辉瑞公司和BioNTech公司开发的新冠病毒疫苗中使用的RNA序列(Ψ是尿苷核苷酸U的改良形式)。资料来源:Nik Spencer/自然
1987年底,罗伯特·马龙(Robert Malone)进行了一项里程碑式的实验。他将信使RNA链与脂肪滴混合,创造出一种分子炖菜。沐浴在这种基因浓汤中的人类细胞吸收了mRNA,并开始从中产生蛋白质1.
马龙是加州拉霍亚市索尔克生物研究所(Salk Institute for Biological Studies)的一名研究生,他意识到这一发现可能在医学上具有深远的潜力,后来他草草记下了一些笔记,并签了名和日期。他在1988年1月11日写道,如果细胞能够从传递到细胞中的mRNA中产生蛋白质,那么就有可能“把RNA当作药物来对待”。索尔克实验室的另一名成员也为后人在笔记上签名。同年晚些时候,马龙的实验表明青蛙胚胎吸收了这种信使rna2.这是第一次有人使用脂肪液滴来减缓mRNA进入活体的过程。
这些实验是历史上最重要、最有利可图的两种疫苗的垫脚石:基于mrna的COVID-19疫苗给全世界数亿人.预计仅2021年,这些产品的全球销售额就将超过500亿美元。
但通往成功的道路并不直接。马龙的实验本身就借鉴了其他研究人员的成果,在他的实验结束多年后,mRNA被认为太不稳定、太昂贵,不能用作药物或疫苗。数十家学术实验室和公司致力于这一想法,努力寻找正确的脂肪和核酸配方——信使rna疫苗的基石。
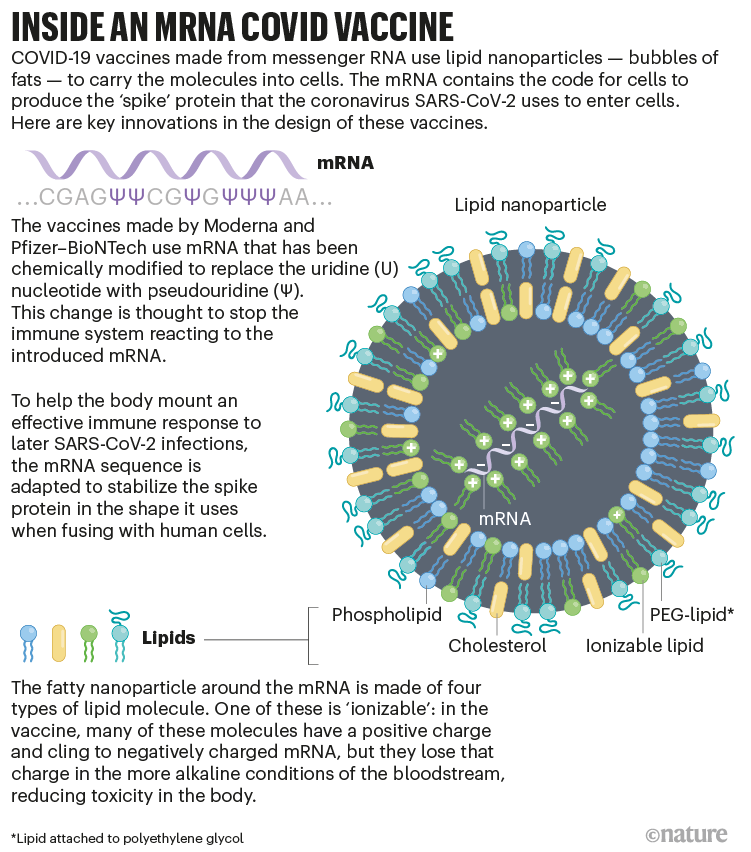
今天的mRNA疫苗是在马龙在实验室工作多年后发明的创新,包括化学修饰的RNA和不同类型的脂肪泡,以将它们运送到细胞中(参见“mRNA COVID疫苗内部”)。尽管如此,自称为“信使rna疫苗发明者”的马龙认为,他的工作没有得到足够的肯定。“我已经从历史中消失了,”他说自然.
尼克·斯宾塞/自然;改编自m.d. Buschmannet al。疫苗965岁(2021年)
随着奖项的陆续颁发,关于谁应该为这项技术的先驱获得荣誉的争论正在升温,而在下个月诺贝尔奖宣布之前,这种猜测会变得更加激烈。但是,仅限于少数科学家的正式奖项将无法认识到信使rna医学发展的众多贡献者。事实上,信使rna疫苗的研发之路凝聚了数百名研究人员30多年的心血。
这个故事讲述了许多科学发现成为改变生活的创新的方式:伴随着数十年的死胡同、拒绝和对潜在利润的争夺,但也有慷慨、好奇心和对怀疑和怀疑的顽强坚持。“这是一系列漫长的步骤,”图森亚利桑那大学(University of Arizona)的发育生物学家保罗•克里格(Paul Krieg)说,他在上世纪80年代中期做出了自己的贡献,“你永远不知道什么会有用。”
信使rna的开始
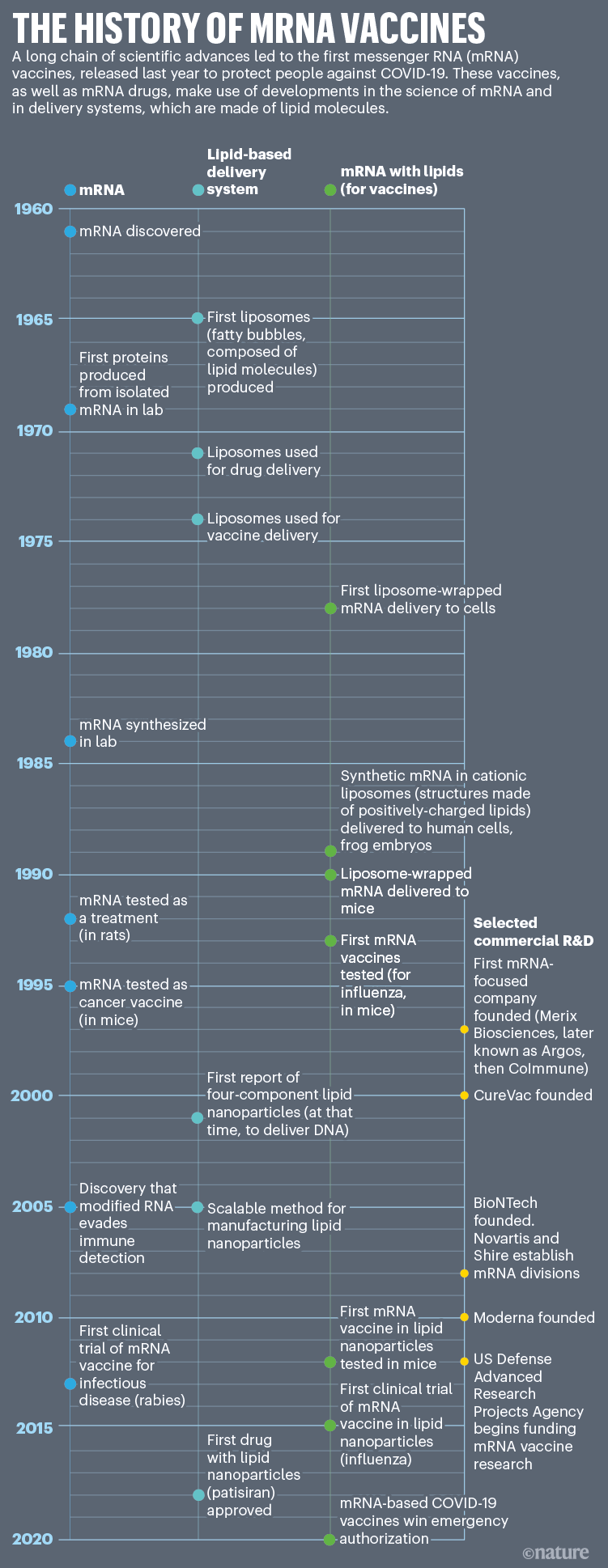
马龙的实验并非凭空而来。早在1978年,科学家们就已经使用称为脂质体的脂肪膜结构将mRNA运输到小鼠体内3.和人类4细胞诱导蛋白表达。脂质体包装并保护mRNA,然后与细胞膜融合,将遗传物质传递到细胞中。这些实验本身是建立在多年对脂质体和信使rna的研究基础上的;这两种疫苗都是在20世纪60年代发现的(见“mRNA疫苗的历史”)。
尼克·斯宾塞/自然;改编自美国Şahinet al。自然Rev.药物发现13, 759-780 (2014)和侯孝贤et al。自然牧师。https://doi.org/gmjsn5(2021)。
然而,当时很少有研究人员将信使rna视为一种医疗产品——尤其是因为当时还没有办法在实验室中制造这种遗传物质。相反,他们希望用它来研究基本的分子过程。大多数科学家重新利用兔子血液、培养的小鼠细胞或其他动物来源的mRNA。
这种情况在1984年发生了改变,当时克里格和马萨诸塞州剑桥市哈佛大学发育生物学家道格拉斯·梅尔顿、分子生物学家汤姆·曼尼提斯和迈克尔·格林领导的团队的其他成员在实验室里使用rna合成酶(取自病毒)和其他工具生产出具有生物活性的mRNA5这种方法的核心至今仍在使用。然后,克里格将实验室制造的信使rna注入青蛙卵中,并证明它的工作原理与真实的东西一样6.
梅尔顿和克里格都表示,他们认为合成信使rna主要是研究基因功能和活性的研究工具。1987年,在梅尔顿发现mRNA既可以用来激活蛋白质,也可以用来阻止蛋白质的产生后,他帮助成立了一家名为Oligogen的公司(后来在加利福尼亚州福斯特市更名为吉利德科学公司),探索使用合成RNA来阻止目标基因表达的方法,目的是治疗疾病。在他的实验室里,没有人想到疫苗,也没有人想到他们的合作者。

保罗·克里格(左)和道格拉斯·梅尔顿(右),他们在实验室里研究合成信使rna的方法。资料来源:亚利桑那大学;凯文·沃尔夫/美联社HHMI图片
“RNA通常以难以置信的不稳定性而闻名,”克里格说。“RNA周围的一切都被小心翼翼地掩盖着。”这或许可以解释为什么哈佛大学的技术开发办公室选择不为该小组的rna合成方法申请专利。相反,哈佛大学的研究人员只是把他们的试剂交给了Promega公司,这是一家位于威斯康星州麦迪逊的实验室用品公司,该公司为研究人员提供了rna合成工具。作为回报,他们获得了不多的版税和一箱凯歌香槟。
专利纠纷
多年后,马龙遵循哈佛团队的策略,为他的实验合成信使rna。但他添加了一种新的脂质体,这种脂质体携带正电荷,增强了这种物质与mRNA的负电荷主干结合的能力。这些脂质体是由生物化学家Philip Felgner开发的,他现在领导着加州大学欧文分校的疫苗研究与开发中心。

菲利普·费尔格纳(左)和罗伯特·马龙。来源:Steve Zylius/UCI;罗伯特·马龙
尽管他成功地利用脂质体将mRNA传递到人类细胞和青蛙胚胎中,但马龙从未获得博士学位。他和他的导师、索尔克基因疗法研究员因德·维尔马(Inder Verma)闹翻了,1989年,他提前放弃了研究生学业,在加利福尼亚州圣地亚哥新成立的Vical公司为费尔格纳工作。在那里,他们和威斯康星大学麦迪逊分校的合作者表明,脂质-信使rna复合物可以刺激小鼠体内蛋白质的产生7.(马龙和他的同事还探索了将mRNA用于疫苗:他们早期的专利申请描述了将编码HIV蛋白的mRNA注射到小鼠体内,并观察到一些对感染的保护,尽管没有产生特定的免疫细胞或分子;这项研究从未在同行评议的期刊上发表过)。

摘自罗伯特·马龙(Robert Malone)的实验室笔记,描述了1989年合成用于注射小鼠的mRNA。资料来源:罗伯特·马龙
然后事情变得一团糟。Vical(威斯康辛大学)和索尔克都在1989年3月开始申请专利。但索尔克很快就放弃了专利要求,1990年,维尔马加入了维卡尔的顾问委员会。
马龙声称维尔马和维卡尔达成了一项秘密协议,相关知识产权归维卡尔所有。马龙被列为几个发明家之一,但他个人不再从随后的许可协议中获利,就像他从索尔克颁发的任何专利中获利一样。马龙的结论是:“他们靠我思想的产物发家致富。”
维尔马和费尔格纳断然否认马龙的指控。“这完全是无稽之谈,”维尔马说自然.他说,放弃专利申请的决定是由索尔克的技术转让办公室做出的。(维尔马于2018年从索尔克辞职此前,他遭到了性骚扰指控,但他仍在否认。)
1989年8月,马龙离开了维卡尔,理由是与费尔格纳在“科学判断”和“对我的智力贡献的赞扬”方面存在分歧。在进入学术界之前,他完成了医学院的学业,并接受了一年的临床培训。在学术界,他试图继续研究mRNA疫苗,但很难获得资金。(例如,1996年,他向加利福尼亚州的一家研究机构申请资金,开发一种对抗季节性冠状病毒感染的mRNA疫苗,但没有成功。)马龙转而专注于DNA疫苗和递送技术。
2001年,他开始从事商业和咨询工作。在过去的几个月里,他开始公开抨击他的研究帮助实现的mRNA疫苗的安全性。例如,Malone说,疫苗产生的蛋白质会破坏人体细胞,而且接种疫苗的风险超过了对儿童和年轻人的好处——其他科学家和卫生官员一再驳斥了这一说法。
制造业的挑战
1991年,Vical与世界上最大的疫苗开发商之一美国默克公司签订了一项价值数百万美元的研究合作和许可协议。默克公司的科学家们在小鼠身上评估了mRNA技术,目的是制造一种流感疫苗,但随后放弃了这种方法。“生产疫苗的成本和可行性让我们踌躇不前,”前默克公司科学家杰弗里·乌尔默说,他现在为疫苗研究公司提供咨询。
法国斯特拉斯堡一家名为Transgène的小型生物技术公司的研究人员也有同样的感觉。1993年,Pierre Meulien领导的一个团队与工业界和学术界合作,首次证明脂质体中的mRNA可以在小鼠体内引发特定的抗病毒免疫反应8.(另一个令人兴奋的进展出现在1992年,当时拉霍亚斯克里普斯研究所的科学家们用mRNA取代了大鼠体内的一种缺乏蛋白质,以治疗一种代谢紊乱9.但独立实验室花了近20年时间才报告了类似的成功。)

皮埃尔Meulien。图片来源:IMI联合承诺
Transgène的研究人员为他们的发明申请了专利,并继续研究mRNA疫苗。但现在担任创新药物计划(一家总部位于布鲁塞尔的公私合营企业)负责人的Meulien估计,他至少需要1亿欧元(1.19亿美元)来优化这个平台——他说,他不会为这样一个“棘手、高风险”的项目向老板索要那么多钱。在Transgène的母公司决定停止支付维持该专利活动所需的费用后,该专利失效了。
与默克公司的团队一样,穆伦的团队也转而专注于DNA疫苗和其他基于载体的输送系统。DNA平台最终产生了一些获得许可的疫苗,用于兽医应用,例如帮助预防养鱼场的感染。就在上个月,印度监管机构紧急批准了世界上第一个用于人类的DNA疫苗以帮助抵御COVID-19。但由于一些尚不完全清楚的原因,DNA疫苗在人类身上取得成功的速度很慢。
Ulmer认为,尽管如此,制药行业对DNA技术的一致推动也为RNA疫苗带来了好处。他说,从制造方面的考虑和监管经验,到序列设计和分子研究,“我们从DNA中学到的许多东西都可以直接应用于RNA”。“这为RNA的成功提供了基础。”
持续的斗争
在20世纪90年代和21世纪的大部分时间里,几乎每一家考虑研究mRNA的疫苗公司都选择将资源投入到其他地方。传统观点认为,信使rna太容易降解,其生产成本太高。斯德哥尔摩卡罗林斯卡研究所的病毒学家Peter Liljeström说:“这是一场持续的斗争。”他在30年前率先研制出了一种“自我放大”的RNA疫苗。
“RNA很难处理,”马特·温克勒(Matt Winkler)说,他于1989年在德克萨斯州奥斯汀创办了第一家专注于RNA的实验室用品公司Ambion。“如果你当时问我,你是否可以把RNA注射到某人体内制成疫苗,我会当面嘲笑你。”
信使rna疫苗的想法在肿瘤学领域更受欢迎,尽管是作为一种治疗剂,而不是预防疾病。从基因治疗师大卫·库列尔(David Curiel)的工作开始,几位学术科学家和初创公司探索了mRNA是否可以用于对抗癌症。这种想法认为,如果mRNA编码的是癌细胞表达的蛋白质,那么将其注入人体可能会训练免疫系统攻击这些细胞。
库列尔目前在密苏里州圣路易斯的华盛顿大学医学院工作,他在老鼠身上取得了一些成功10.但他说,当他与Ambion接洽商业化机会时,公司告诉他:“我们认为这项技术没有任何经济潜力。”
另一位癌症免疫学家取得了更大的成功,这导致了1997年第一家mRNA治疗公司的成立。Eli Gilboa提出从血液中提取免疫细胞,并诱导它们接受合成的编码肿瘤蛋白的信使rna。然后,这些细胞将被注射回体内,在那里它们可以组织免疫系统攻击潜伏的肿瘤。
基利波和他在北卡罗来纳州达勒姆的杜克大学医学中心的同事们在老鼠身上证明了这一点11.到20世纪90年代末,学术合作者已经开始了人体试验,基利波的商业衍生品Merix Bioscience(后来更名为Argos Therapeutics,现在称为CoImmune)很快就开始了自己的临床研究。这种方法看起来很有希望,直到几年前,一种晚期候选疫苗在一次大型试验中失败;如今,它基本上已经过时了。
但是基利波的工作有一个重要的结果。它激发了德国公司CureVac和BioNTech的创始人开始研究信使rna,这两家公司是目前最大的信使rna公司。CureVac的Ingmar Hoerr和BioNTech的u土耳其(Şahin)都告诉记者自然在得知基利波的实验后,他们也想做同样的实验,但是是直接将信使rna注入人体。

Ingmar Hoerr(左)创立了CureVac,癌症免疫学家Eli Gilboa(右)创立了第一家mRNA治疗公司。图片来源:塞巴斯蒂安·戈尔诺/dpa/阿拉米;基利波山伊莱
现在佛罗里达迈阿密大学米勒医学院工作的Gilboa说:“这就像滚雪球一样。”
创业加速器
霍尔是第一个取得成功的人。2000年,他在德国Tübingen大学(University of Tübingen)发表报告称,直接注射可以在小鼠身上引发免疫反应12.同年,他创建了CureVac(也位于Tübingen)。但几乎没有科学家或投资者对此感兴趣。在Hoerr展示早期老鼠数据的一次会议上,他说,“有一位诺贝尔奖得主站在第一排说,‘你在这里告诉我们的完全是狗屎——完全是狗屎’。(霍尔拒绝透露诺贝尔奖得主的名字。)
最终,资金慢慢流入。几年后,人体测试开始了。该公司当时的首席科学官史蒂夫·帕斯科洛(Steve Pascolo)是第一个研究对象:他自己注射13他的腿上仍然有火柴头大小的白色疤痕,这是皮肤科医生做活检分析时留下的。一项更正式的试验,涉及针对皮肤癌患者的肿瘤特异性mRNA,很快就启动了。
Şahin和他的免疫学家妻子Özlem Türeci也在20世纪90年代末开始研究mRNA,但比霍尔创办公司的时间要晚。他们在德国美因茨约翰内斯古登堡大学(Johannes Gutenberg University Mainz)工作多年,研究这项技术,获得专利、论文和研究经费,2007年向亿万富翁投资者提出了一个商业计划。Şahin网站表示:“如果它成功了,那将是突破性的。”他获得了1.5亿欧元的种子资金。

Özlem Türeci(左)和u土耳其Şahin(右)共同创立了mRNA疫苗公司BioNTech。资料来源:BioNTech SE 2021
同年,一家名为RNARx的mRNA初创企业获得了一笔较为温和的资金:来自美国政府的97,396美元小企业赠款。该公司的创始人,生物化学家Katalin Karikó和免疫学家Drew Weissman,当时都在费城的宾夕法尼亚大学(UPenn),做出了现在被一些人称为关键的发现:改变部分mRNA代码可以帮助合成mRNA躲过细胞的先天免疫防御。
基本的见解
Karikó在整个20世纪90年代都在实验室辛勤工作,目标是将mRNA转化为药物平台,尽管拨款机构一直拒绝她的资助申请。1995年,在多次遭到拒绝后,她被给予选择,要么离开宾大,要么接受降职减薪。她选择留下来,继续她的顽强追求,改进马龙的协议14,并设法诱导细胞产生一种具有治疗意义的大型复杂蛋白质15.

Katalin Karikó帮助证明了对RNA进行化学修饰可以使分子通过人体的免疫防御。图源:Hannah Yoon/Bloomberg/Getty
1997年,她开始与韦斯曼合作,后者刚刚在宾夕法尼亚大学建立了一个实验室。他们计划一起开发一种基于rna的艾滋病疫苗。但当Karikó的mrna被注射到小鼠体内时,它们会引发大规模的炎症反应。
她和韦斯曼很快就找出了原因:合成的信使rna激发了兴奋16这是一系列被称为toll样受体的免疫传感器,它们是病原体危险信号的第一反应者。2005年,两人报告说,重新排列mRNA核苷酸之一尿苷上的化学键,产生一种类似物,称为伪尿苷,似乎可以阻止身体将mRNA识别为敌人17.

Drew Weissman与Karikó合作,共同发现了改良mRNA的优势。来源:宾夕法尼亚大学医学院
当时很少有科学家认识到这些修饰过的核苷酸的治疗价值。但科学界很快意识到它们的潜力。2010年9月,德里克·罗西(Derrick Rossi)领导的一个团队描述了如何利用修饰后的mrna将皮肤细胞转化为胚胎样干细胞,然后转化为收缩肌肉组织。德里克·罗西当时是马萨诸塞州波士顿儿童医院的干细胞生物学家18.这一发现引起了轰动。罗西曾在时间杂志评选的2010年度“重要人物”之一。他在剑桥联合创立了一家初创公司Moderna。
Moderna试图授权UPenn在2006年为Karikó和Weissman的发明申请的改良mRNA专利。但是已经太迟了。在未能与RNARx达成许可协议后,宾夕法尼亚大学选择了快速支付。2010年2月,该公司授予麦迪逊一家小型实验室试剂供应商独家专利权。该公司现在被称为Cellscript,在这笔交易中支付了30万美元。它还将从Moderna和BioNTech那里获得数亿美元的转授费,这两家公司是针对COVID-19的第一批mRNA疫苗的鼻祖。这两种产物都含有经过修饰的mRNA。
与此同时,RNARx又用完80万美元的小企业资助资金,并于2013年停止运营,也就是在Karikó加入BioNTech(保留在宾夕法尼亚大学的兼职职位)的时候。
关于假尿嘧啶的争论
研究人员仍在争论Karikó和Weissman的发现是否对成功的mRNA疫苗至关重要。Moderna一直使用经过修饰的mRNA——它的名字是这两个词的合成词。但该行业的其他一些人却没有。
位于马萨诸塞州列克星敦市的Shire制药公司人类基因疗法部门的研究人员推断,如果添加正确的“帽”结构并去除所有杂质,未经修饰的mRNA也可以产生同样有效的产品。“这取决于RNA的质量,”迈克尔·哈特莱因(Michael Heartlein)说,他领导了夏尔的研究工作,并在剑桥的翻译生物公司(Translate Bio)继续推进这项技术,夏尔后来将其mRNA投资组合卖给了该公司。(夏尔现在是日本武田公司的一部分。)
尽管Translate的一些人体数据表明其mRNA不会引发令人担忧的免疫反应,但其平台仍有待临床证明:其COVID-19候选疫苗仍处于早期人体试验阶段。但法国制药巨头赛诺菲(Sanofi)对这项技术的前景深信不疑:2021年8月,该公司宣布计划以32亿美元收购Translate。(去年,哈特莱因离职,在马萨诸塞州沃尔瑟姆(Waltham)创办了另一家名为Maritime Therapeutics的公司。)
与此同时,CureVac有自己的免疫缓解策略,包括改变mRNA的基因序列,以最大限度地减少疫苗中尿苷的含量。20年的努力似乎正在结出硕果,该公司的实验性狂犬病疫苗进行了早期试验19和COVID-1920.两者都取得了成功。但在6月,一项后期试验的数据显示,CureVac的冠状病毒候选疫苗是无效的比Moderna和BioNTech的保护效果差得多.
鉴于这些结果,一些mRNA专家现在认为假尿嘧啶是这项技术的重要组成部分——因此,他们说,Karikó和Weissman的发现是值得认可和奖励的关键促成贡献之一。“真正的赢家是经过改良的RNA,”位于剑桥的合成生物学公司Strand Therapeutics的联合创始人兼首席执行官杰克•克拉夫特说。该公司致力于基于RNA的治疗。
不是每个人都这么肯定。“有多种因素可能会影响mRNA疫苗的安全性和有效性,对mRNA进行化学修饰只是其中之一,”苏州阿博根生物科技有限公司(Suzhou Abogen Biosciences)首席执行官波应(Bo Ying)说。该公司拥有一种针对COVID-19的mRNA疫苗,目前处于后期临床测试阶段。(该产品被称为ARCoV,使用未经修饰的mRNA。)
脂肪的突破
至于关键技术,许多专家强调了另一项对mRNA疫苗至关重要的创新——一项与mRNA无关的创新。正是被称为脂质纳米颗粒(LNPs)的微小脂肪气泡保护了mRNA并将其运送到细胞中。
这项技术来自加拿大温哥华英属哥伦比亚大学的生物化学家彼得·卡利斯的实验室,以及他创立或领导的几家公司。从20世纪90年代末开始,他们开创了LNPs,用于传递抑制基因活动的核酸链。其中一种疗法,patisiran,现在被批准用于治疗一种罕见的遗传性疾病。

Pieter天沟。图源:UBC的Paul Joseph
2012年,在基因沉默疗法开始在临床试验中显示出前景之后,Cullis的两家公司开始探索LNP传递系统在基于mrna的药物中的应用机会。例如,温哥华的Acuitas Therapeutics公司在首席执行官托马斯·马登(Thomas Madden)的领导下,与威斯曼在宾夕法尼亚大学的团队以及几家mRNA公司建立了合作关系,以测试不同的mRNA - lnp配方。现在,在BioNTech和CureVac的COVID-19疫苗中可以找到其中一种。Moderna的LNP混合物也没有太大不同。
纳米颗粒由四种脂肪分子组成:三种有助于结构和稳定性;第四种被称为可电离脂质,是LNP成功的关键。这种物质在实验室条件下带正电荷,这与Felgner开发和Malone在20世纪80年代末测试的脂质体具有类似的优势。但是Cullis和他的商业合作伙伴开发的可电离脂质在生理条件下(如血液中的)转换为中性电荷,这限制了对身体的毒性作用。
此外,在几家与库利斯相关的企业担任高管的伊恩•麦克拉克伦(Ian MacLachlan)说,四种脂质混合物可以让该产品在药店货架上储存更长时间,并在体内保持稳定。他说:“这是我们现在拥有的药理学的全部组成部分。”

Ian MacLachlan(左)和Thomas Madden(右)。资料来源:Ian MacLachlan;Acuitas疗法
到2000年代中期,人们发明了一种混合和制造这些纳米颗粒的新方法。它使用“t -连接器”装置,将脂肪(溶解在酒精中)与核酸(溶解在酸性缓冲液中)结合在一起。当两种溶液融合时,组分自发形成密集的LNPs21.事实证明,这种技术比其他制造基于mrna的药物的方法更可靠。
一旦所有的部件组合在一起,“就像,天啊,我们终于有了一个可以扩展的过程,”现任圣地亚哥复制生物科学公司(Replicate Bioscience)首席开发官安德鲁·吉尔(Andrew Geall)说。Geall领导的第一个团队将LNPs与RNA疫苗结合222012年,他在诺华位于剑桥的美国中心发表演讲。每个mRNA公司现在都在使用这种LNP传递平台和制造系统的一些变体,尽管谁拥有相关专利仍然是法律纠纷的主题。例如,Moderna与cullis的一家附属企业——温哥华的Arbutus Biopharma——陷入了一场战斗,争夺的是Moderna COVID-19疫苗中发现的LNP技术的所有权。
一个行业诞生了
到本世纪末,几家大型制药公司开始进入mRNA领域。例如,2008年,诺华和夏尔都成立了mRNA研究部门——前者(由Geall领导)专注于疫苗,后者(由Heartlein领导)专注于治疗。2012年,美国国防高级研究计划局(Defense Advanced Research Projects Agency)决定开始资助行业研究人员研究RNA疫苗和药物,这推动了BioNTech的成立,其他初创企业很快也加入了竞争。Moderna是其中一家以这项工作为基础的公司,到2015年,它已经筹集了超过10亿美元他们希望利用mRNA诱导体内细胞制造自己的药物,从而治愈由蛋白质缺失或缺陷引起的疾病。当这个计划遭遇挫折时,由首席执行官Stéphane Bancel领导的Moderna选择优先考虑一个不那么雄心勃勃的目标:生产疫苗。

Moderna的Derrick Rossi(左)和Stéphane Bancel(右)。资料来源:德里克·罗西;亚当Glanzman /彭博/盖蒂
最初,这让许多投资者和旁观者感到失望,因为疫苗平台似乎没有那么大的变革性和利润。截至2020年初,Moderna已将9种用于传染病的mRNA候选疫苗送入人体进行测试。没有一个是完全成功的。只有一个人进入了更大阶段的试验。
但当COVID-19爆发时,Moderna迅速做出了原型疫苗病毒的基因组序列在网上公布的几天内.随后,该公司与美国国家过敏和传染病研究所(NIAID)合作,在不到10周的时间内开展了小鼠研究和人体试验。
BioNTech也采取了全员参与的方式。2020年3月,该公司与总部位于纽约的辉瑞制药公司合作,临床试验以创纪录的速度进行,在不到8个月的时间里,从首次人体试验到紧急批准。
两种获批准的疫苗都使用LNPs中合成的修饰mRNA。这两种病毒都含有编码一种SARS-CoV-2刺突蛋白的序列,这种蛋白质的形状更易于诱导保护性免疫。许多专家说,NIAID的疫苗学家巴尼·格雷厄姆和德克萨斯大学奥斯汀分校的结构生物学家杰森·麦克莱伦以及斯克里普斯大学的安德鲁·沃德为冠状病毒量身定制的蛋白质调整也是一项有价值的贡献,尽管不是针对mRNA疫苗的,因为这个概念可以应用于许多病毒疫苗。

对COVID疫苗的闪电般的寻求——以及它对其他疾病的意义
关于信使rna发现的荣誉的讨论中,有些愤怒与谁拥有利润丰厚的专利有关。但大部分基础知识产权可以追溯到1989年费尔格纳、马龙和他们在Vical的同事提出的主张(1990年由Liljeström提出)。这些证书自发布之日起只有17年的有效期,因此现在属于公共领域。
即使是2006年授予Cellscript的Karikó-Weissman专利,也将在未来五年内到期。业内人士表示,这意味着不久将很难为在脂质纳米颗粒中递送信使rna的广泛申请专利,尽管公司可以合理地为信使rna的特定序列(比如一种刺突蛋白)或专有脂质配方申请专利。
公司正在努力。Moderna是mRNA疫苗领域的主要参与者,在流感、巨细胞病毒和甲型h1n1流感疫苗的临床测试中拥有实验性疫苗其他传染病的范围该公司去年获得了两项专利,涉及广泛使用信使rna生产分泌蛋白。但多位业内人士透露自然他们认为这些都是有挑战性的。

COVID如何释放RNA疫苗的力量
加拿大卡尔加里的mRNA疫苗公司普罗维登斯治疗公司的首席科学官埃里克·马库森(Eric Marcusson)说:“我们觉得有很多东西是可申请专利的,当然也不能强制执行。”
诺贝尔的辩论
至于谁配得上诺贝尔奖,人们谈论最多的名字是Karikó和韦斯曼。这两个人已经获得了几个奖项,包括一个突破奖(奖金300万美元,科学界奖金最高的奖项)和西班牙著名的阿斯图里亚斯公主技术和科学研究奖。获得阿斯图里亚斯奖的还有费尔格纳、Şahin、Türeci和罗西,以及英国牛津大学和阿斯利康制药公司开发的COVID-19疫苗的疫苗学家莎拉·吉尔伯特(Sarah Gilbert),该疫苗使用病毒载体而不是mRNA。(卡利斯最近获得的唯一荣誉是受控释放协会(Controlled Release Society)颁发的5000美元创始人奖,该协会是一个由研究缓释药物的科学家组成的专业组织。)
一些人还认为,Karikó对mRNA研究界的贡献应该和她在实验室的发现一样得到承认。英属哥伦比亚大学RNA生物工程师安娜·布莱克尼说:“她不仅是一位令人难以置信的科学家,而且是该领域的一股力量。”Blakney对Karikó表示感谢,因为两年前她在一个重要会议上获得了演讲机会,当时她还只是一个初级博士后职位(在Blakney与人共同创立VaxEquity公司之前,该公司是一家位于英国剑桥的疫苗公司,专注于自我扩增rna技术)。Karikó“在她的整个职业生涯都不被认可的时候,她积极地试图提升别人的地位”。
尽管包括马龙在内的一些参与mRNA发育的人认为它们应该得到更多的认可,但其他人更愿意分享风头。“你真的不能邀功,”卡利斯说。例如,当谈到他的脂质输送系统时,“我们说的是数百人,可能是数千人一直在一起工作,使这些LNP系统实际上已经为黄金时段做好了准备。”
Karikó说:“每个人都在逐渐增加一些东西,包括我。”
回顾过去,许多人说他们很高兴信使rna疫苗对人类产生了影响,他们可能在这条路上做出了有价值的贡献。费尔格纳说:“看到这一切,我很激动。“所有我们当时认为会发生的事情,现在都发生了。”

 COVID如何释放RNA疫苗的力量
COVID如何释放RNA疫苗的力量 对COVID疫苗的闪电般的寻求——以及它对其他疾病的意义
对COVID疫苗的闪电般的寻求——以及它对其他疾病的意义 CureVac COVID疫苗的缺失凸显了mRNA设计的挑战
CureVac COVID疫苗的缺失凸显了mRNA设计的挑战