摘要gydF4y2Ba
在脓毒症期间,tlr4介导的巨噬细胞活化需要EGFR磷酸化。然而,细胞内EGFR是否以及如何在内毒素血症期间运输在很大程度上是未知的。在这里,我们发现LPS通过两种不同的转运机制促进巨噬细胞中EGFR的高水平细胞表面表达。一方面,Rab10在eea1介导的EGFR从高尔基体的膜转运中是必需的。另一方面,EGFR磷酸化以一种依赖于激酶活性的方式阻止其内吞。厄洛替尼是一种EGFR酪氨酸激酶抑制剂,可显著降低lps激活巨噬细胞中细胞膜EGFR的表达。在机制上,LPS诱导TLR4/EGFR磷酸化后,MAPK14磷酸化了Rab7a在S72受损膜受体的晚期内吞作用,通过阻止其溶酶体降解来维持EGFR的膜定位。同时Rab5a也参与了EGFR的早期内吞作用。随后,抑制EGFR磷酸化将M1表型转化为M2表型,缓解脓毒症诱导的急性肺损伤。机制研究表明,Erlotinib通过PKM2/HIF-1ɑ途径抑制糖酵解依赖的M1极化,并通过上调PPARγ诱导的谷氨酰胺代谢促进M2极化。 Collectively, our data elucidated a more in-depth mechanism of macrophages activation, and provided stronger evidence supporting EGFR as a potential therapeutic target for the treatment of sepsis.
简介gydF4y2Ba
败血症是指机体对病原体感染的先天免疫反应失调而引起的组织损伤甚至危及生命的多器官功能障碍综合征[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].就其发病机制而言,中性粒细胞、单核细胞和巨噬细胞的持续激活可能是加速脓毒性反应的原因[gydF4y2Ba3.gydF4y2Ba].gydF4y2Ba
代谢级联越来越被认为是巨噬细胞激活的特征和控制者。M1巨噬细胞(经典激活的巨噬细胞)通过糖酵解获得快速杀伤的能量,而M2巨噬细胞(交替激活的巨噬细胞)依靠线粒体氧化磷酸化(OXPHOS)提供能量[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].M1巨噬细胞是促炎细胞,在宿主防御感染中起核心作用,而M2巨噬细胞则与抗炎反应和组织修复有关[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].巨噬细胞M1/M2表型之间的平衡对于控制过度炎症和触发伤口愈合至关重要。因此,调节巨噬细胞极化是有效治疗脓毒症等炎症性疾病的潜在治疗方法。gydF4y2Ba
EGFR(表皮生长因子受体)是一种跨膜受体酪氨酸激酶,也有报道在调节LPS/TLR4信号通路中发挥重要作用[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].我们和其他研究人员都报道了EGFR抑制剂Erlotinib在体内有效地防止lps诱导的细胞因子表达,并保护小鼠免受lps诱导的致死性,这表明TLR4和EGFR信号通路之间存在交叉作用,这对细菌感染后的宿主预后有重要影响[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].我们的实验室进一步证明,EGFR和TLR4共同调节内毒素血症中的巨噬细胞激活,EGFR磷酸化对于增加TLR4细胞表面表达和信号转导是必要的[gydF4y2Ba13gydF4y2Ba].然而,与TLR4相比,EGFR在巨噬细胞中响应LPS的胞内转运过程及其生理意义尚不清楚。gydF4y2Ba
在本研究中,我们发现LPS增加了巨噬细胞表面EGFR的表达,Rab10有助于EGFR的质膜转运。我们还发现Rab5a介导早期EGFR内吞,而EGFR/MAPK14/Rab7a调控晚期EGFR内吞和溶酶体降解途径。我们进一步证明,抑制细胞表面EGFR表达可以通过激活ppar γ介导的谷氨酰胺代谢来降低糖酵解依赖的M1极化,并促进M2极化。最后,抑制EGFR磷酸化使巨噬细胞从M1表型向M2表型的平衡倾斜,并减弱lps诱导的炎症和组织损伤。总之,我们的数据阐明了更深入的巨噬细胞激活机制,并提供了更有力的证据支持EGFR作为脓毒症治疗的潜在治疗靶点。gydF4y2Ba
结果gydF4y2Ba
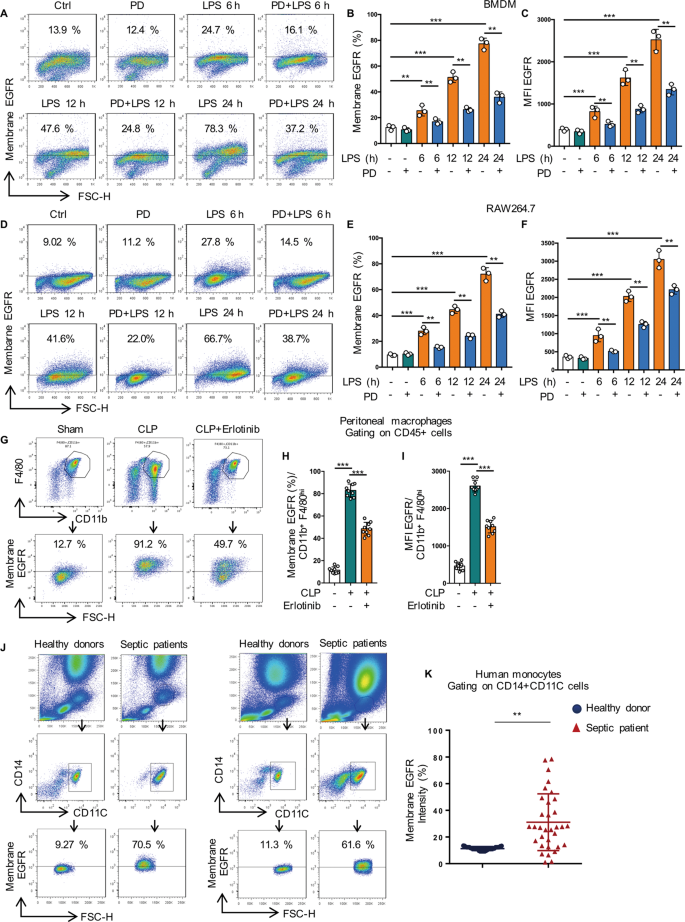
LPS促进巨噬细胞表皮生长因子受体的表面表达gydF4y2Ba
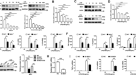
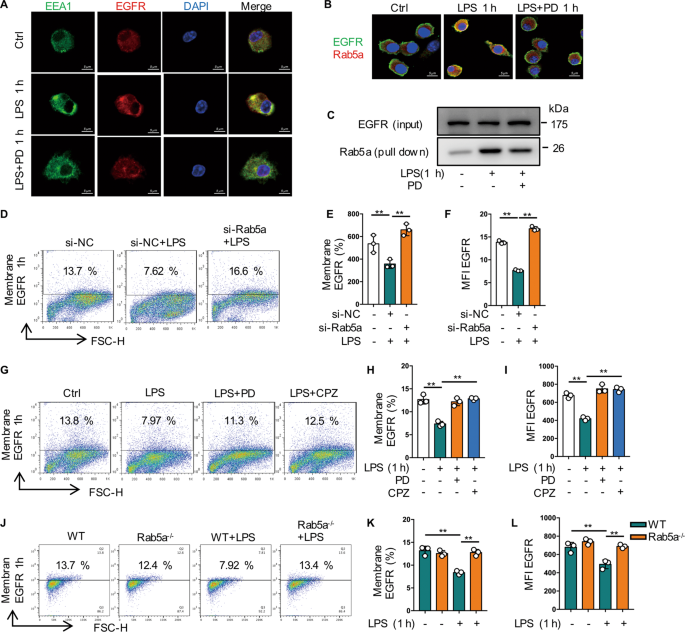
我们报道了LPS增加了TLR4的细胞表面表达,抑制EGFR磷酸化降低了TLR4细胞表面表达,以响应LPS [gydF4y2Ba13gydF4y2Ba].在这里,我们证明了LPS也改善了两种BMDM中EGFR的细胞表面表达(图2)。gydF4y2Ba1得了gydF4y2Ba)和RAW264.7细胞(图;gydF4y2Ba1 d-fgydF4y2Ba),且EGFR抑制剂PD168393在各时间点均能有效抑制这一现象。为了进一步证实EGFR细胞表面表达在炎症巨噬细胞中的作用,如前所述,采用盲肠结扎穿刺(CLP)诱导的脓毒症小鼠模型[gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BaFgydF4y2Ba巨噬细胞用LPS(1µg/mL)处理6、12或24 h,并加或不加PD168393 (PD, 10µM)预处理30 min。gydF4y2Ba一个gydF4y2BaBMDM中EGFR细胞表面表达的流式细胞仪分析。gydF4y2BaBgydF4y2Baegfr阳性巨噬细胞百分比显示。gydF4y2BaCgydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaDgydF4y2Ba流式细胞术分析RAW264.7中EGFR细胞表面表达。gydF4y2BaEgydF4y2Baegfr阳性巨噬细胞百分比显示。gydF4y2BaFgydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaGgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba从CLP小鼠腹腔灌洗中收集巨噬细胞,分为假手术、CLP和CLP +埃洛替尼(100 mg/kg,灌胃)预处理2 h,腹腔巨噬细胞鉴定为CD45 + CD11b + F4/80high。gydF4y2BaGgydF4y2Ba流式细胞术检测腹腔巨噬细胞表面EGFR强度。gydF4y2BaHgydF4y2Baegfr阳性腹腔巨噬细胞百分比显示(gydF4y2BangydF4y2Ba= 9)。gydF4y2Ba我gydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 9)。gydF4y2BaJgydF4y2Ba,gydF4y2BaKgydF4y2Ba从临床败血症患者或健康献血者采集血液,血液单个核细胞被鉴定为CD14和CD11c。gydF4y2BaJgydF4y2Ba采用流式细胞术对20例健康供体和33例脓毒症患者单核细胞表面EGFR强度进行分析。gydF4y2BaKgydF4y2Baegfr阳性CD14 + CD11c +单个核细胞百分比。该图描述了基于三个独立实验的平均值±标准差。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2Ba
然后我们检测了C57BL/6小鼠腹腔巨噬细胞中EGFR的表达,在CLP 24 h后,厄洛替尼(100 mg/kg灌胃)预处理2 h。与Sham组相比,CLP 24 h后腹膜巨噬细胞中EGFR的表达增加到5倍,但Erlotinib预处理抑制了C57BL/6小鼠腹膜巨噬细胞表面EGFR表达的增加。gydF4y2Ba1胃肠道gydF4y2Ba).更重要的是,在大多数临床急性脓毒症患者中(补充表gydF4y2Ba6gydF4y2Ba),单核细胞表面EGFR的表达明显高于健康志愿者(图。gydF4y2Ba1 j, KgydF4y2Ba).鉴于EGFR可以通过配体依赖和不依赖的机制激活,接下来进行了体外研究,以解决EGF在LPS/TLR4/EGFR信号通路中的作用。用中和抗EGF抗体预处理BMDM细胞,以自分泌方式消除任何EGF的影响,然后用lps处理。我们发现中和抗egf抗体预处理并不改变EGFR的总蛋白水平(图SgydF4y2Ba4 fgydF4y2Ba).根据这些数据,我们得出结论,lps诱导的巨噬细胞M1/M2极化与EGFR配体无关。上述结果表明,LPS诱导内毒素血症和脓毒症巨噬细胞表皮生长因子受体(EGFR)的活化,促进细胞表面表皮生长因子受体(EGFR)的表达。gydF4y2Ba
S72位点Rab7a的磷酸化促进晚期EGFR的内吞作用gydF4y2Ba
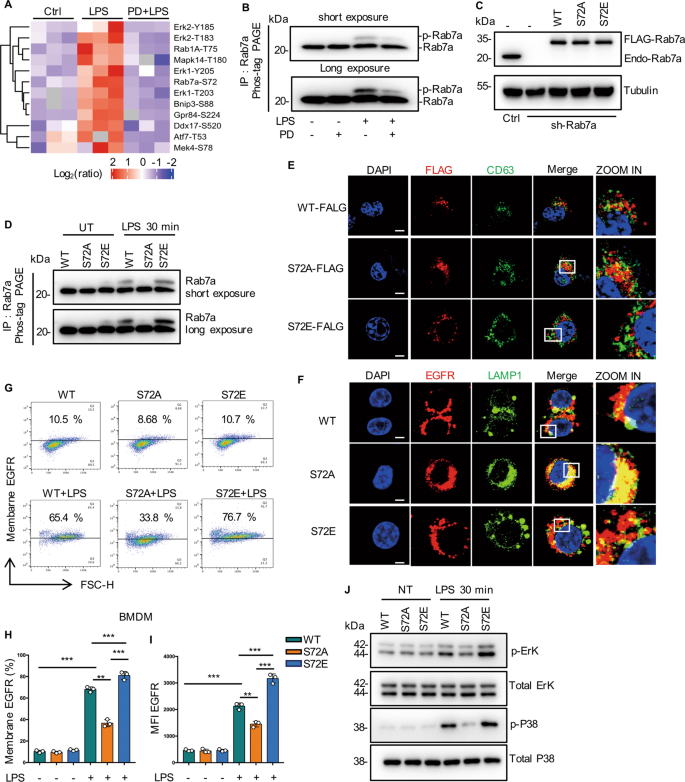
抑制EGFR磷酸化显著降低巨噬细胞膜中EGFR的表达,提示EGFR激酶活性在受体转运中的重要作用。为了揭示EGFR激酶活性的新下游靶点,采用定量无标签LC-MS/MS蛋白质组学方法对RAW264.7细胞的全细胞裂解物进行定量分析。总共分析了8151个肽片段,产生了11772个独特的磷酸化位点,映射到3041个独特的蛋白质(图SgydF4y2Ba1gydF4y2Ba).通过KEGG通路分析,磷酸化肽主要富集在MAPK信号通路、内吞通路和糖酵解通路(图SgydF4y2Ba1 bgydF4y2Ba).在已鉴定的差异表达的磷酸肽中,只有Rab7a被报道参与了内吞作用途径。Rab7a GTPase参与调节内吞作用介导的蛋白质转运[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].特别是Rab7A可促进生长因子受体等膜受体从早期核内体转运至晚期核内体和溶酶体,使其最终降解[gydF4y2Ba17gydF4y2Ba].因此,我们重点研究了RAB7a磷酸化与EGFR转运之间的关系。gydF4y2Ba
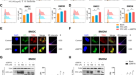
在不同磷酸化位点中,Rab7a只有一个磷酸化位点S72(图7)。gydF4y2Ba2gydF4y2Ba;无花果。gydF4y2Ba1gydF4y2BaC和SgydF4y2Ba1 dgydF4y2Ba).通过磷酸亲和(磷酸标签)聚丙烯酰胺凝胶电泳(PAGE),我们成功地检测到RAW264.7细胞在LPS处理后30分钟内Rab7a的磷酸化(图2)。gydF4y2Ba2 bgydF4y2Ba磷酸化可被PD168393抑制(图3)。gydF4y2Ba2 bgydF4y2Ba为了进一步确认S72是Rab7a的主要磷酸化位点,我们在RAW264.7细胞中敲除Rab7a,并在近内源性水平使用慢病毒重新表达Rab7a- wt、不可磷酸化的S72A突变体和潜在的拟磷突变体S72E(图2)。gydF4y2Ba2摄氏度gydF4y2Ba).与Rab7a-WT相比,Rab7a-S72E在phos-tag PAGE分析中出现了更明显的带移(图7)。gydF4y2Ba二维gydF4y2Ba而Rab7a-S72A则没有(图7)。gydF4y2Ba二维gydF4y2Ba这些结果表明,在lps激活的巨噬细胞中,Rab7a在S72位点被磷酸化。gydF4y2Ba
一个gydF4y2Ba与对照组相比,用LPS(1µg/mL)处理30分钟后,与PD168393 (PD 10µM)预处理30分钟后,测定RAW264.7中差异表达蛋白和磷酸肽的聚类分析。蓝色和红色分别表示下调或上调(gydF4y2BangydF4y2Ba=每个条件3个样本)。gydF4y2BaBgydF4y2BaPD168393 (PD 10µM)抑制Rab7a磷酸化(30 min)。对指示细胞进行去极化处理,用Rab7a抗体免疫印迹法对细胞提取物进行phostagg - page处理。gydF4y2BaCgydF4y2BaRab7a shRNA敲低RAW264.7细胞中Rab7a- wt、Rab7a- s72a或Rab7a- s72e突变体稳定表达。western blot检测Rab7a总蛋白表达。a- tubulin作为加载控件。gydF4y2BaDgydF4y2Ba从指示细胞中分离a-Rab7a免疫沉淀,然后用a-Rab7a抗体免疫印迹。gydF4y2BaEgydF4y2Ba在指示的Rab7a突变RAW264.7细胞中免疫染色Flag-Rab7a和CD63,然后用LPS(1µg/mL)处理30分钟。比例尺,5 μm。gydF4y2BaFgydF4y2Ba对指示的Rab7a突变RAW264.7细胞进行EGFR和LAMP1免疫染色,然后用LPS(1µg/mL)处理24小时。比例尺,5 μm。gydF4y2BaGgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba将指示的Rab7a突变体RAW264.7细胞经LPS处理(1µg/mL) 24 h。gydF4y2BaGgydF4y2Ba流式细胞仪检测RAW264.7细胞表面EGFR的表达。gydF4y2BaHgydF4y2Baegfr阳性RAW264.7的百分比显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2Ba我gydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaJgydF4y2Ba从指示的Rab7a突变体RAW264.7细胞中制备细胞裂解液,LPS处理(1µg/mL) 24 h, western blot检测磷酸化ERK、总ERK、总p38和磷酸化p38蛋白表达。该图描述了基于三个独立实验的平均值±标准差。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2Ba
有研究报道S72的磷酸化导致Rab7a的GTPase活性完全丧失[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba],提示Rab7a磷酸化在EGFR细胞内转运中的关键作用。与Rab7a-WT相比,LPS刺激RAW264.7细胞30 min后,rab7a - s722a和CD63(晚期核内体)之间的共定位增加,但Rab7a-S72E和CD63之间的共定位减少(图2)。gydF4y2Ba2 egydF4y2Ba).与Rab7a-S72E突变体相比,EGFR与LAMP1的共定位增加,细胞表面EGFR表达降低(图7)。gydF4y2Ba2胃肠道gydF4y2Ba),表明LPS处理Rab7a-S72A突变体12 h后,EGFR的晚期内吞降解增强(图7)。gydF4y2Ba2 fgydF4y2Ba).此外,我们观察到Rab7a-S72E突变体促进了ERK1/2和P38的激活,但在Rab7a-S72A突变体中没有。gydF4y2Ba2 jgydF4y2Ba).上述结果表明,Rab7a磷酸化调控了EGFR的晚期内吞降解,从而影响了EGFR的膜表达。gydF4y2Ba
MAPK14在Rab7a的S72位点磷酸化gydF4y2Ba
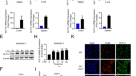
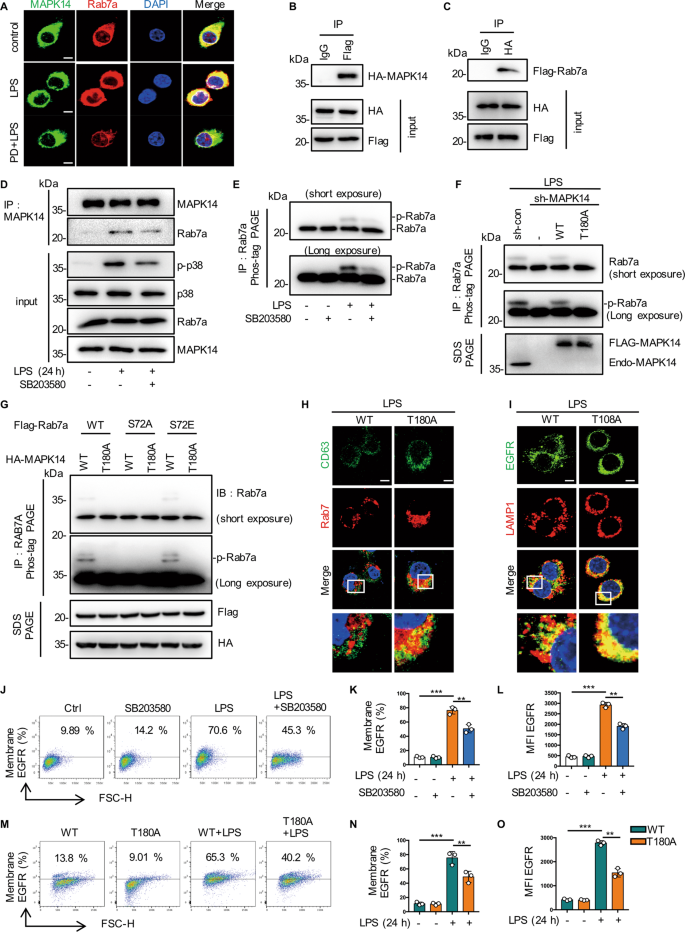
根据磷酸化蛋白质组学数据,我们推测Rab7a在S72位点的磷酸化可能受到EGFR/MAPK14通路的调控。首先,我们发现在LPS处理的RAW264.7细胞中Rab7a与MAPK14的共定位增加,但PD168393预处理降低了Rab7a与MAPK14的共定位。gydF4y2Ba3gydF4y2Ba).然后在共转染的HEK 293 T细胞中,标记的MAPK14与ha标记的Rab7a共沉淀。gydF4y2Ba3 bgydF4y2Ba,gydF4y2BaCgydF4y2Ba).MAPK14抑制剂SB203580可抑制RAW264.7细胞内源性MAPK14与Rab7a的结合(图2)。gydF4y2Ba3 dgydF4y2Ba).此外,SB203580通过对细胞提取物的磷标记PAGE分析,减弱了lps刺激的BMDMs中的内源性Rab7a磷酸化(图2)。gydF4y2Ba3 egydF4y2Ba).此外,与MAPK14-WT相比(图;gydF4y2Ba3 fgydF4y2Ba, lane 1, lane 3),失活突变MAPK14-T180A在lps激活的RAW264.7细胞中没有出现Rab7a蛋白迁移率的变化(图2)。gydF4y2Ba3 fgydF4y2Ba这些结果表明MAPK14可以直接结合并磷酸化Rab7a。为了证实Rab7a S72是MAPK14磷酸化的主要位点,我们在HEK293T细胞中共表达了Rab7a和MAPK14的不同结构。当Rab7a WT或S72E突变体与MAPK14-WT共表达时,我们检测到Rab7a蛋白的迁移带。gydF4y2Ba3 ggydF4y2Ba, lane 1, lane 5),而MAPK14-T180A(图。gydF4y2Ba3 ggydF4y2BaMAPK14-WT和MAPK14-T180A与Rab7a-S72A共表达时无迁移带(图7)。gydF4y2Ba3 ggydF4y2Ba这些结果表明,在lps激活的巨噬细胞中,Rab7a S72是MAPK14磷酸化的主要位点。gydF4y2Ba
一个gydF4y2Ba用1µg/mL LPS处理RAW264.7细胞MAPK14和Rab7a免疫染色30 min,加或不加PD168393 (PD 10 μM)预处理30 min。gydF4y2BaBgydF4y2Ba,gydF4y2BaCgydF4y2Ba在转染了flag -tag Rab7a和ha -tag MAPK14的HEK 293 T细胞中,flag -tag Rab7a和ha -tag MAPK14的共免疫沉淀。gydF4y2BaDgydF4y2Ba用1 μg/mL LPS刺激RAW264.7的裂解物30min,加上或不加PD168393 (PD)预处理30min,免疫印迹分析MAPK14免疫沉淀。gydF4y2BaEgydF4y2Ba用1 μg/mL LPS刺激RAW264.7的Rab7a免疫沉淀30 min,加上或不加p38抑制剂SB-203580 (SB 5 μM)预处理30 min。gydF4y2BaFgydF4y2BaMAPK14突变体RAW264.7细胞用LPS (1 μg/mL)刺激30 min,细胞提取物在phostagg - page前进行a-Rab7a免疫沉淀,免疫印迹分析Rab7a免疫沉淀。gydF4y2BaGgydF4y2BaMAPK14在体内诱导Rab7在S72位点磷酸化。用Flag-Rab7 (WT、S72A或S72E突变体)和HA-MAPK14 (WT或T180A失活突变体)共转染HEK293细胞,用phos-tag SDS-PAGE分析细胞裂解液。总裂解物按指示用抗体进行免疫印迹(IB)。迁移条带分别表示磷酸化的Rab7。gydF4y2BaHgydF4y2BaMAPK14突变RAW264.7细胞Rab7a和CD63免疫染色,LPS (1 μg/mL)处理30 min。比例尺,5 μm。gydF4y2Ba我gydF4y2BaLPS (1 μg/mL)处理24 h后,EGFR和LAMP1对指示的MAPK14突变RAW264.7细胞进行免疫染色。比例尺,5 μm。gydF4y2BaJgydF4y2Ba- - - - - -gydF4y2BalgydF4y2Ba用LPS刺激RAW264.7细胞24 h,加入或不加入p38抑制剂SB203580 (SB 5 μM)。gydF4y2BaJgydF4y2Ba流式细胞仪检测RAW264.7细胞表面EGFR的表达。gydF4y2BaKgydF4y2Baegfr阳性RAW264.7的百分比显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BalgydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2Ba米gydF4y2Ba- - - - - -gydF4y2BaOgydF4y2BaMAPK14突变体RAW264.7细胞用LPS刺激24 h,并加或不加p38抑制剂SB203580 (SB 5 μM)。gydF4y2Ba米gydF4y2Ba流式细胞仪检测RAW264.7细胞表面EGFR的表达(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaNgydF4y2Baegfr阳性RAW264.7的百分比显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaOgydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 3)。该图描述了基于三个独立实验的平均值±标准差。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2Ba
为了了解MAPK14介导的Rab7a磷酸化在EGFR细胞内转运调控中的作用,我们接下来分析了在共转染不同MAPK14结构物的MAPK14敲除RAW264.7细胞中Rab7a和CD63的共定位。MAPK14-T180A突变体转染在LPS刺激后30分钟增强了Rab7a与CD63的共定位,并在LPS处理后24小时减少了EGFR与LAMP1的共定位(图2)。gydF4y2Ba3 hgydF4y2Ba,gydF4y2Ba我gydF4y2Ba).因此,我们推测MAPK14/Rab7a可能通过内体-溶酶体途径调控细胞膜EGFR表达。正如预期的那样,SB203580显著降低了lps诱导的EGFR在细胞膜中的表达(图2)。gydF4y2Ba3 j-lgydF4y2Ba).同时,与MAPK14-WT组相比,MAPK14-T180A突变体的膜EGFR表达明显降低(图14- wt组)。gydF4y2Ba3 m-ogydF4y2Ba).总之,这些结果表明mapk14介导的Rab7a磷酸化控制了lps激活巨噬细胞中EGFR的晚期内吞和降解。gydF4y2Ba
Rab5a在巨噬细胞中介导EGFR早期内化gydF4y2Ba
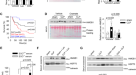
生长因子受体的内吞转运是EGFR信号时空调控的重要细胞机制之一[gydF4y2Ba20.gydF4y2Ba].为了更全面地研究巨噬细胞炎症反应中EGFR转运的机制,我们试图确定其他小g蛋白是否可能参与EGFR转运。在这里,我们发现PD168393预处理减弱了LPS处理后1小时早期核内体(EEA1)和EGFR之间的共定位(图2)。gydF4y2Ba4gydF4y2Ba).由于Rab5a是细胞内吞作用的关键调节因子[gydF4y2Ba21gydF4y2Ba],我们通过共聚焦免疫荧光显微镜和共免疫沉淀发现,在LPS处理后1小时,Rab5a和EGFR在BMDM质膜附近共定位,这可能被PD168393预处理所干扰(图2)。gydF4y2Ba4 bgydF4y2Ba,gydF4y2BaCgydF4y2Ba).敲除Rab5a可在LPS处理后1小时内阻止BMDM细胞表面EGFR表达的下降(图5)。gydF4y2Ba4 d-fgydF4y2Ba).网格蛋白是Rab5a的效应器,参与多种跨膜受体的内化[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].PD168393和网格蛋白抑制剂CPZ(图。gydF4y2Ba4胃肠道gydF4y2Ba),可有效抑制lps诱导的EGFR细胞表面表达降低。此外,在BMDM中来自Rab5agydF4y2Ba−−/gydF4y2Ba在小鼠中,与WT BMDM相比,Rab5a缺陷有效地阻止了LPS处理后1小时EGFR细胞表面表达的下降(图5)。gydF4y2Ba4 j-lgydF4y2Ba).这些结果表明,lps诱导的EGFR内化是由Rab5a介导的。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BaCgydF4y2Ba用LPS(1µg/mL)处理BMDM 1 h,加或不加PD168393 (PD 10 μM)预处理30 min。gydF4y2Ba一个gydF4y2BaBMDM中EGFR和EEA1的免疫染色。gydF4y2BaBgydF4y2BaRab5a对EGFR免疫染色。gydF4y2BaCgydF4y2BaBMDM中EGFR和Rab5a的共免疫沉淀。gydF4y2BaDgydF4y2Ba- - - - - -gydF4y2BaFgydF4y2Ba用si-NC或si-Rab5a转染BMDM 48小时,然后用LPS处理(1µg/mL) 1小时。gydF4y2BaDgydF4y2Ba流式细胞仪检测BMDM表面EGFR的表达。gydF4y2BaEgydF4y2Baegfr阳性BMDM百分比显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaFgydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaGgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba用LPS(1µg/mL)处理BMDM 1 h,加或不加网格蛋白抑制剂氯丙嗪(CPZ 12.5 μM)或PD168393 (PD 10 μM)预处理30 min。gydF4y2BaGgydF4y2Ba流式细胞术检测BMDM表面EGFR的表达(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaHgydF4y2Baegfr阳性BMDM百分比显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2Ba我gydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaJgydF4y2Ba- - - - - -gydF4y2BalgydF4y2BaWT和Rab5agydF4y2Ba−−/gydF4y2Ba用1 μg/mL LPS处理BMDM 1 h。gydF4y2BaJgydF4y2Ba流式细胞术检测BMDM表面EGFR的表达(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaKgydF4y2Baegfr阳性BMDM百分比显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BalgydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 3)。该图描述了基于三个独立实验的平均值±标准差。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2Ba
Rab10有助于巨噬细胞表面EGFR的表达gydF4y2Ba
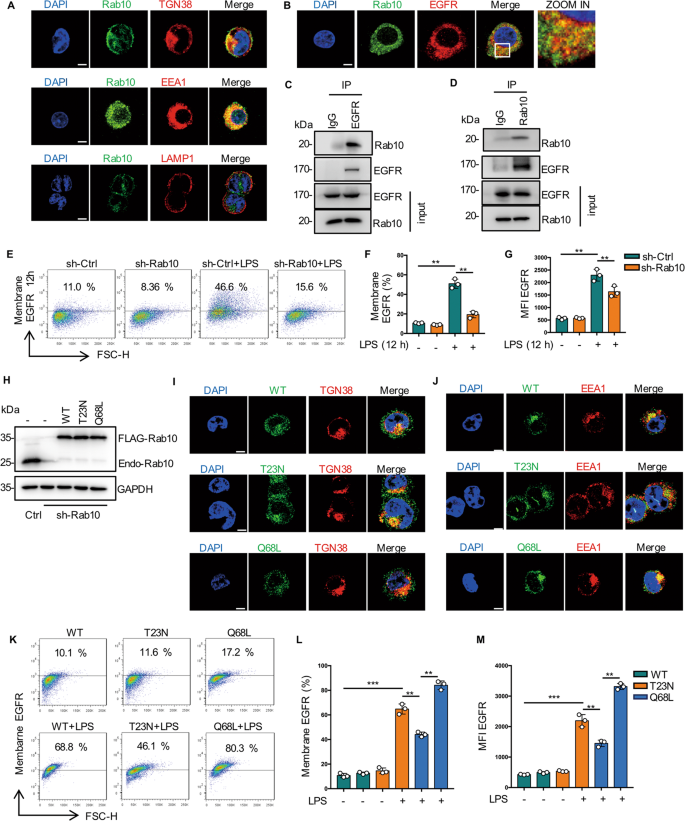
为了寻找上述内毒素血症中EGFR细胞表面表达的细胞调节机制,我们重点研究了Ras家族的小g蛋白。Rab10主要参与蛋白质从高尔基体到质膜的转运[gydF4y2Ba24gydF4y2Ba].在这里,我们发现Rab10定位于高尔基体和EEA1,但不定位于晚期的核内体(图。gydF4y2Ba5gydF4y2Ba).同时,我们通过共聚焦免疫荧光和共免疫沉淀,在RAW264.7细胞中观察到Rab10和EGFR高度共定位(图2)。gydF4y2Ba5罪犯gydF4y2Ba).此外,与打乱shrna处理的细胞相比,Rab10沉默的RAW264.7细胞表面EGFR表达显著降低(图2)。gydF4y2Ba5比gydF4y2Ba).gydF4y2Ba
一个gydF4y2BaEGFR定位于rab10阳性高尔基体和早期核内体区室。用抗TGN38K(红色)、抗EEA1(红色)或抗LAMP1(红色)和抗Rab10(绿色)抗体免疫染色RAW2654.7细胞。代表性的共聚焦图像显示Rab10与TGN38K、EEA1、LAMP1共定位(黄色)。比例尺,5 μm。gydF4y2BaBgydF4y2BaRab10在RAW264.7细胞中与EGFR共定位。比例尺,5 μm。gydF4y2BaCgydF4y2BaRAW264.7细胞裂解物EGFR免疫沉淀的免疫印迹分析gydF4y2BaDgydF4y2BaRAW264.7细胞裂解物Rab10免疫沉淀的免疫印迹分析gydF4y2BaEgydF4y2Ba- - - - - -gydF4y2BaGgydF4y2Ba用LPS (1 μg/mL)处理Sh-ctrl和sh-Rab10 BMDM 12 h。gydF4y2BaEgydF4y2Ba流式细胞仪检测BMDM表面EGFR的表达。gydF4y2BaFgydF4y2Baegfr阳性BMDM百分比显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaGgydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaHgydF4y2BaRab10 shRNA敲低RAW264.7细胞Rab10- wt、Rab10- t23n或Rab10- q68l突变体稳定表达。使用a- rab10或a- gapdh作为负载对照,对指示细胞的全细胞提取物进行免疫印迹。gydF4y2Ba我gydF4y2BaTGN38免疫染色显示RAW264.7中Rab10突变。gydF4y2BaJgydF4y2BaRAW264.7中EEA1免疫染色及Rab10突变。gydF4y2BaKgydF4y2Ba- - - - - -gydF4y2Ba米gydF4y2Ba用LPS刺激指示的Rab10突变体RAW264.7细胞12 h。gydF4y2BaKgydF4y2Ba流式细胞术检测BMDM表面EGFR的表达(gydF4y2BangydF4y2Ba= 3)。gydF4y2BalgydF4y2Baegfr阳性BMDM百分比显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2Ba米gydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 3)。该图描述了基于三个独立实验的平均值±标准差。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2Ba
为了进一步阐明Rab10与EGFR转运之间的联系,有必要验证Rab10的激酶活性是否直接参与EGFR从高尔基体转运到细胞膜的过程。我们首先构建了不同突变位点的Rab10质粒,建立了稳定的细胞系[gydF4y2Ba25gydF4y2Ba].这可以想见,Rab10的非活性突变体(Rab10- t23n)定位于高尔基体并分布在细胞质中,而活性突变体(Rab10- q68l)主要定位于早期的核内体区室(图10- q68l)。gydF4y2Ba5 h-jgydF4y2Ba).Rab10-WT重表达或Rab10-Q68L上调了RAW264.7细胞中EGFR表面表达(图2)。gydF4y2Ba5 kmgydF4y2Ba).综上所述,这些结果表明Rab10促进EGFR从高尔基体运输到细胞表面。gydF4y2Ba
抑制EGFR磷酸化抑制巨噬细胞中糖酵解依赖的M1极化gydF4y2Ba
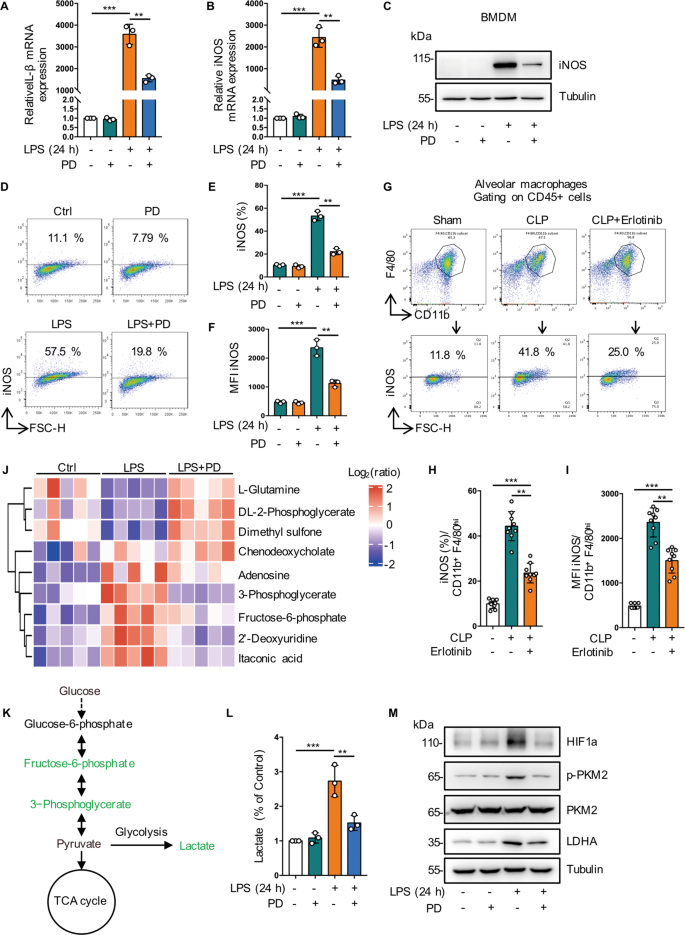
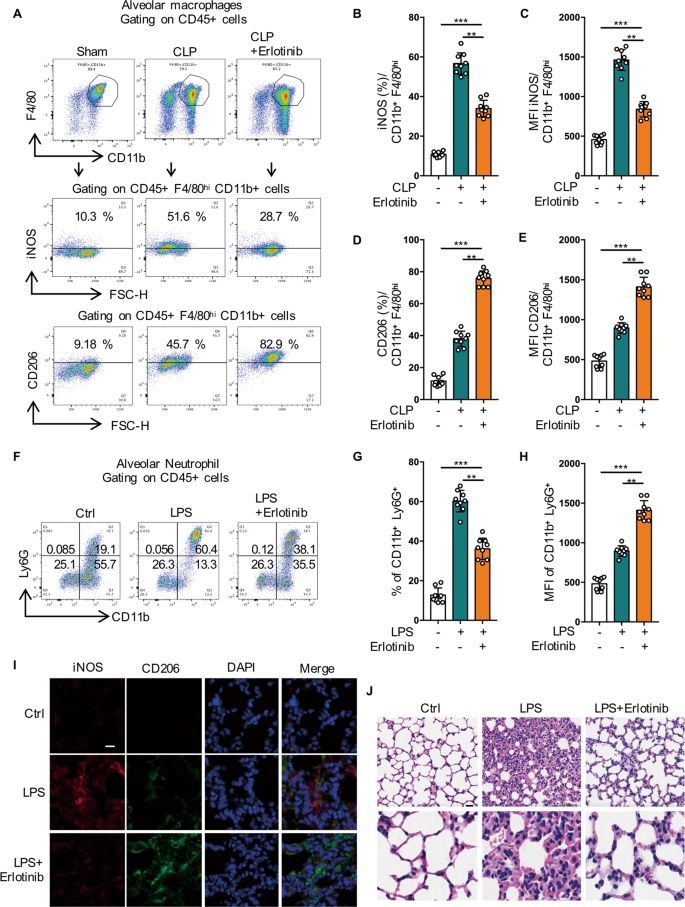
为了评估细胞膜EGFR激活对脓毒症巨噬细胞M1/M2表型平衡的影响,我们使用LPS刺激BMDMs和RAW264.7细胞向M1表型转变。我们发现PD168393在RNA水平上显著降低了M1标记物如iNOS和IL-1β的表达(图2)。gydF4y2Ba6 a、BgydF4y2Ba和SgydF4y2Ba2gydF4y2Ba).此外,与lps处理过的细胞相比,western blot(图2。gydF4y2Ba6摄氏度gydF4y2Ba和SgydF4y2Ba2 bgydF4y2Ba)和流式细胞术分析(图;gydF4y2Ba6 d-fgydF4y2Ba和SgydF4y2Ba2摄氏度gydF4y2Ba- - - - - -gydF4y2BaFgydF4y2Ba)显示,在PD168393预处理细胞中iNOS的表达水平也受到抑制。此外,厄洛替尼(100 mg/kg,灌胃)预处理可有效下调CLP小鼠支气管肺泡灌洗液(BALF)中iNOS的表达水平(图2)。gydF4y2Ba6克gydF4y2Ba- - - - - -gydF4y2BaFgydF4y2Ba).这些结果表明,细胞表面的EGFR磷酸化促进内毒素血症或败血症相关M1巨噬细胞的激活。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BaFgydF4y2Ba用LPS (1 μg/mL)处理BMDMs 24 h,加或不加PD168393 (10 μM)预处理30 min。gydF4y2Ba一个gydF4y2BaRT-qPCR分析IL-1β mRNA表达(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaBgydF4y2BaRT-qPCR分析iNOS mRNA表达(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaCgydF4y2BaWestern blot检测iNOS的表达。gydF4y2BaDgydF4y2Ba流式细胞仪检测BMDM表面iNOS的表达。gydF4y2BaEgydF4y2BaiNOS阳性BMDM百分比示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaFgydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaGgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba从CLP作用的C57BL/6小鼠支气管肺泡灌洗液中收集巨噬细胞,分为假手术、CLP和CLP +埃洛替尼(100 mg/kg,灌胃)预处理2 h,经CD45 + CD11b + F4/80high鉴定肺泡巨噬细胞。gydF4y2BaGgydF4y2Ba流式细胞术检测肺泡巨噬细胞表面iNOS的表达。gydF4y2BaHgydF4y2Bainos阳性的肺泡巨噬细胞百分比显示(gydF4y2BangydF4y2Ba= 9)。gydF4y2Ba我gydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 9)。gydF4y2BaJgydF4y2Ba用LPS (1 μg/mL)处理RAW264.7 30 min,与PD168393 (PD 10 μM)预处理30 min后,对RAW264.7差异表达代谢产物进行聚类分析。蓝色和红色分别表示下调或上调(gydF4y2BangydF4y2Ba=每个条件3个样本)。gydF4y2BaKgydF4y2Ba图示LPS刺激后24小时PD168393 (10 μM) RAW264.7细胞中代谢物减少(蓝色)的示意图。gydF4y2BalgydF4y2BaPD168393 (10 μM)预处理RAW264.7细胞乳酸水平较LPS组降低约2倍(gydF4y2BangydF4y2Ba= 3)。gydF4y2Ba米gydF4y2BaRAW264.7细胞中HIF1-a、p-PKM2、PKM2、LDHA表达的代表性western印迹。该图描述了基于三个独立实验的平均值±标准差。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2Ba
为了进一步阐明EGFR对内毒素血症代谢的影响,我们对不同组进行了整体代谢组学分析。我们观察到LPS组磷酸戊糖通路(PPP)和糖酵解中间产物增加,LPS + PD168393组降低,并验证了乳酸的降低(图。gydF4y2Ba6 j-lgydF4y2Ba).Pyruvate Kinase M2 (PKM2)调节HIF-1ɑ活性和IL-1β诱导,是LPS激活巨噬细胞Warburg效应的关键决定因素[gydF4y2Ba26gydF4y2Ba].我们发现PD168393抑制PKM2磷酸化,降低HIF-1ɑ和乳酸脱氢酶A (LDHA)蛋白表达(图2)。gydF4y2Ba6米gydF4y2Ba).此外,在EGFR敲除BMDM中,巨噬细胞M1极化被抑制(图2)。年代gydF4y2Ba5gydF4y2Ba- - - - - -gydF4y2BaDgydF4y2Ba和SgydF4y2Ba5克gydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba).这些结果有力地表明,抑制EGFR磷酸化可以减少巨噬细胞对LPS的糖酵解反应。gydF4y2Ba
抑制EGFR磷酸化通过激活PPARγ调节谷氨酰胺代谢促进M2极化gydF4y2Ba
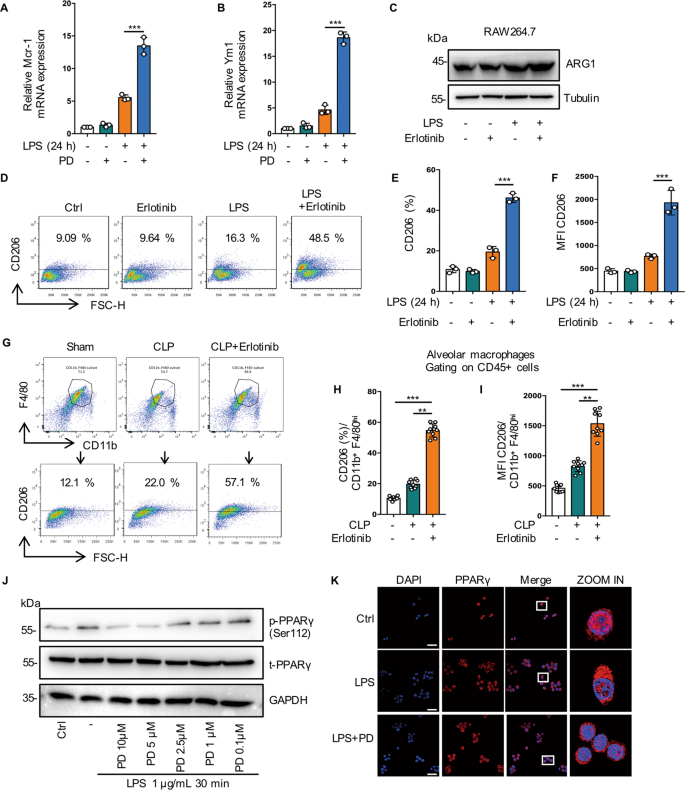
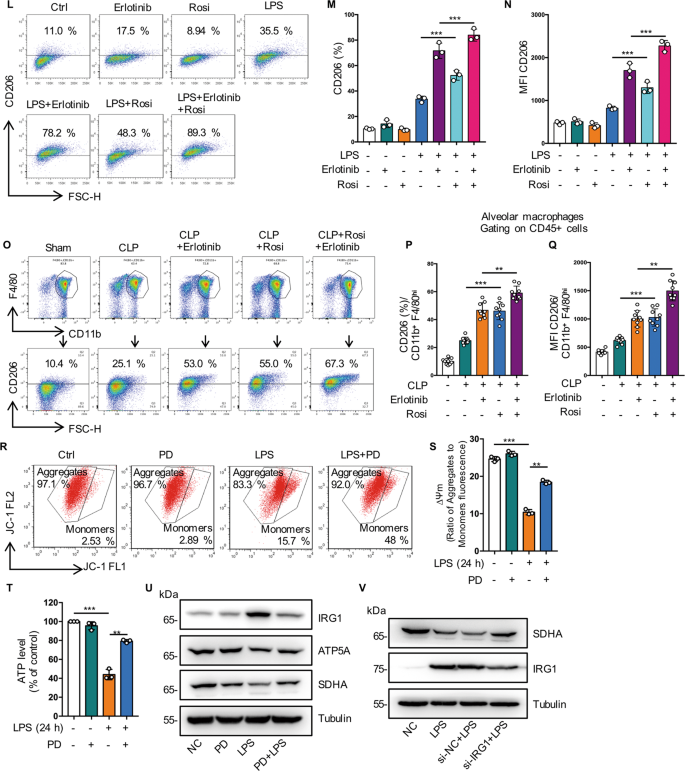
既往报道表明,代谢紊乱诱导M2巨噬细胞,促进M2极化,抑制元炎症[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].接下来,我们研究了EGFR磷酸化在M2表型极化中的作用。我们发现Erlotinib在RNA水平上上调了M2标记物的表达,包括Mrc1(图2)。gydF4y2Ba7一个gydF4y2Ba,gydF4y2BaBgydF4y2Ba和SgydF4y2Ba3gydF4y2Ba).与lps处理的细胞相比,western blot显示Arg1表达增加(图2)。gydF4y2Ba7 cgydF4y2Ba和SgydF4y2Ba3 bgydF4y2Ba流式细胞仪分析显示,厄洛替尼预处理细胞中CD206的表达水平增加了2倍以上(图2)。gydF4y2Ba7 d-fgydF4y2Ba和SgydF4y2Ba3 cgydF4y2Ba,gydF4y2BaDgydF4y2Ba).此外,埃洛替尼(100 mg/kg,灌胃)预处理可有效上调CLP小鼠BALF巨噬细胞CD206的表达水平(图2)。gydF4y2Ba7我gydF4y2Ba,gydF4y2BaJgydF4y2Ba).所有这些结果表明,抑制EGFR磷酸化促进了脓毒症期间M2巨噬细胞的极化。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BaFgydF4y2Ba用LPS (1 μg/mL)处理RAW264.7巨噬细胞24 h,加或不加厄洛替尼(20 μM)预处理30 min。gydF4y2Ba一个gydF4y2BaRT-qPCR分析m2相关基因Mcr1的mRNA表达(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaBgydF4y2BaRT-qPCR分析m2相关基因Ym1的mRNA表达(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaCgydF4y2BaArg1的代表性western blot。gydF4y2BaDgydF4y2Ba流式细胞仪分析显示M2巨噬细胞相关标志物CD206水平。gydF4y2BaEgydF4y2Bacd206阳性RAW264.7的百分比显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2Ba我gydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaGgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba从CLP作用的C57BL/6小鼠支气管肺泡灌洗液中收集巨噬细胞,分为假手术、CLP和CLP +埃洛替尼(100 mg/kg,灌胃)预处理2 h,经CD45 + CD11b + F4/80high鉴定肺泡巨噬细胞。gydF4y2BaGgydF4y2Ba流式细胞术检测肺泡巨噬细胞表面CD206的表达。gydF4y2BaHgydF4y2Bacd206阳性的肺泡巨噬细胞百分比显示(gydF4y2BangydF4y2Ba= 9)。gydF4y2Ba我gydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 9)。gydF4y2BaJgydF4y2Ba免疫印迹法检测LPS (1 μg/mL)处理RAW264.7细胞30 min时p-PPARγ (Ser112)和t-PPARγ (10 μM)的变化。gydF4y2BaKgydF4y2Ba描绘PPARγ易位的荧光图像(左面板,比例尺,50 μm;右侧面板,比例尺,5 μm)。gydF4y2BalgydF4y2Ba- - - - - -gydF4y2BaNgydF4y2Ba用LPS (1 μg/mL)处理RAW264.7细胞,同时加入厄洛替尼(10 μM)和罗格列酮(Rosi (20 μM)预处理或不加预处理24 h。gydF4y2BalgydF4y2Ba流式细胞仪检测细胞表面CD206。gydF4y2Ba米gydF4y2Bacd206阳性RAW264.7的百分比显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaNgydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaOgydF4y2Ba- - - - - -gydF4y2Ba问gydF4y2Ba从CLP作用的C57BL/6小鼠支气管肺泡灌洗液中收集巨噬细胞,分为假手术、CLP和CLP +埃洛替尼(100 mg/kg,灌胃)预处理2 h,经CD45 + CD11b + F4/80high鉴定肺泡巨噬细胞。gydF4y2BaOgydF4y2Ba流式细胞术检测肺泡巨噬细胞表面CD206的表达。gydF4y2BaPgydF4y2Bacd206阳性的肺泡巨噬细胞百分比显示(gydF4y2BangydF4y2Ba= 9)。gydF4y2Ba问gydF4y2Ba平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 9)。gydF4y2BaRgydF4y2Ba- - - - - -gydF4y2BaVgydF4y2Ba用LPS (1 μg/mL)处理RAW264.7细胞30 min,外加或不加PD168393 (10 μM)预处理30 min。gydF4y2BaRgydF4y2Ba流式细胞术分析JC-1检测线粒体膜电位变化(ΔΨm)(左图,JC-1聚集物;右面板,JC-1单体)。gydF4y2Ba年代gydF4y2BaJC-1聚合体/JC-1单体的比值计算为Δψm。gydF4y2BaTgydF4y2Ba检测细胞总ATP水平(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaUgydF4y2Ba免疫印迹分析IRG1、ATP5A、SDHA、Tubulin作为负载对照。gydF4y2BaVgydF4y2Ba免疫印迹分析对照组和IRG1沉默的RAW264.7细胞的SDHA和IRG1, Tubulin作为加载对照。该图描述了基于三个独立实验的平均值±标准差。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2Ba
PPARγ控制巨噬细胞谷氨酰胺代谢,在转录、M2极化和代谢之间提供联系,而谷氨酰胺是M2极化所必需的[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].我们的代谢组学分析表明,PD168393 (PD)治疗组谷氨酰胺水平升高(图。gydF4y2Ba6 jgydF4y2Ba).我们发现PD以浓度依赖的方式抑制PPARγ的磷酸化(图。gydF4y2Ba7 jgydF4y2Ba).此外,与LPS处理组相比,我们观察到PD显著促进PPARγ的激活,表明MH-S细胞PPARγ核转移增加(图2)。gydF4y2Ba7 kgydF4y2Ba).RT-PCR结果显示,ROSI (PPARγ激活剂)激活PPARγ后,Arg1、MRC1和YM1的表达增加(图S .gydF4y2Ba3 egydF4y2Ba- - - - - -gydF4y2BaGgydF4y2Ba).流式细胞仪显示CD206的表达随着PPARγ的激活而增加(图2)。gydF4y2Ba7 l-ngydF4y2Ba)和体内(图;gydF4y2Ba7 o-qgydF4y2Ba).gydF4y2Ba
谷氨酰胺代谢对TCA循环周转和线粒体氧化磷酸化很重要[gydF4y2Ba32gydF4y2Ba].在lps诱导的内毒素血症中,厄洛替尼预处理可维持线粒体膜电位(ΔΨm)水平和ATP含量,表明EGFR参与巨噬细胞激活过程中的能量代谢(图。gydF4y2Ba7 rtgydF4y2Ba).巨噬细胞PPARγ缺失上调免疫应答基因1 (IRG1)表达,随后导致衣康酸积累并阻断线粒体琥珀酸脱氢酶(SDH)活性[gydF4y2Ba29gydF4y2Ba].SDH的A亚单位(SDHA)突变会降低酶活性,从而损害OXPHOS [gydF4y2Ba33gydF4y2Ba].代谢组学数据显示,脂多糖组衣康酸水平升高,而PD168393 +脂多糖组衣康酸水平显著降低(图2)。gydF4y2Ba6 jgydF4y2Ba).同时,我们发现,与lps诱导的RAW264.7细胞相比,PD168393降低了IRG1蛋白表达水平,上调了线粒体呼吸链亚基ATP5A (complex V)和SDHA (complex II)的表达(图2)。gydF4y2Ba7 ugydF4y2Ba).此外,IRG1的敲除恢复了SDHA的表达(图。gydF4y2Ba7 vgydF4y2Ba).这些结果表明,EGFR参与维持OXPHOS活性,抑制EGFR磷酸化通过激活PPARγ调节谷氨酰胺代谢促进M2极化。gydF4y2Ba
抑制EGFR磷酸化将M1表型转化为M2表型,缓解脓毒症引起的急性肺损伤gydF4y2Ba
为了进一步验证EGFR抑制剂在体内对炎症和巨噬细胞极化的影响,应用LPS和clp诱导的急性肺损伤(ALI)小鼠模型[gydF4y2Ba34gydF4y2Ba].我们发现,在厄洛替尼(100 mg/kg)给药小鼠中,小鼠肺泡灌洗液中巨噬细胞中M2标记物CD206的表达增加,而M1标记物iNOS的表达减少(图2)。gydF4y2Ba8 a egydF4y2Ba).我们还通过免疫荧光观察到厄洛替尼增强了CD206的表达,抑制了iNOS的表达(图2)。gydF4y2Ba8我gydF4y2Ba).此外,厄洛替尼明显减少了LPS诱导的肺损伤中BALF中性粒细胞的浸润(图2)。gydF4y2Ba8 f-hgydF4y2Ba).此外,H&E染色显示,注射LPS (20 mg/kg)在治疗后24 h导致炎症细胞浸润、间质水肿和肺泡间隔增厚,而厄洛替尼治疗减弱了肺组织的病理改变(图2)。gydF4y2Ba8 jgydF4y2Ba).总之,这些结果表明,EGFR抑制剂可能通过调节巨噬细胞极化和减轻体内炎症来改善脓毒性ALI。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BaEgydF4y2Ba从CLP作用的C57BL/6小鼠支气管肺泡灌洗液中收集巨噬细胞,分为假手术、CLP和CLP +埃洛替尼(100 mg/kg,灌胃)预处理2 h,经CD45 + CD11b + F4/80high鉴定肺泡巨噬细胞。gydF4y2Ba一个gydF4y2Ba流式细胞术检测肺泡巨噬细胞表面iNOS和CD206的表达。gydF4y2BaBgydF4y2Bainos阳性的肺泡巨噬细胞百分比显示(gydF4y2BangydF4y2Ba= 9)。gydF4y2BaCgydF4y2BaiNOS的平均荧光强度(MFI)显示为(gydF4y2BangydF4y2Ba= 9)。gydF4y2BaDgydF4y2Bacd206阳性的肺泡巨噬细胞百分比显示(gydF4y2BangydF4y2Ba= 9)。gydF4y2BaEgydF4y2BaCD206的平均荧光强度(MFI)显示(gydF4y2BangydF4y2Ba= 9)。gydF4y2BaFgydF4y2Ba- - - - - -gydF4y2BaJgydF4y2Ba小鼠腹腔注射LPS (20 mg/kg)或等量PBS,厄洛替尼(100 mg/kg)预处理2小时。gydF4y2BaFgydF4y2Ba采用流式细胞仪检测BALF中性粒细胞CD11b和Ly6G。gydF4y2BaGgydF4y2BaCD11b + Ly6G+阳性肺泡巨噬细胞百分比显示(gydF4y2BangydF4y2Ba= 9)。gydF4y2BaHgydF4y2BaCD11b + Ly6G+的平均荧光强度(MFI)显示为gydF4y2BangydF4y2Ba= 9)。gydF4y2Ba我gydF4y2Ba肺切片中iNOS和CD206的免疫染色gydF4y2BaJgydF4y2Ba肺切片用苏木精和伊红染色(H&E)。比例尺,上面板为50 μm,下面板为5 μm。该图描述了基于三个独立实验的平均值±标准差。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001。gydF4y2Ba
讨论gydF4y2Ba
我们之前的研究表明,在lps诱导的内毒素血症中,BMDMs中TLR4的细胞表面表达增加[gydF4y2Ba13gydF4y2Ba].有趣的是,我们发现lps诱导的巨噬细胞炎症中细胞表面EGFR的表达也增加,包括小鼠巨噬细胞系、小鼠原代巨噬细胞和临床脓毒症患者的原代单核细胞。然而,EGFR抑制剂(PD168393/Erlotinib)抑制了lps介导的巨噬细胞表面EGFR表达的增加。这至少可以部分解释为什么LPS也可以增加egfr介导的作用,如细胞增殖[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].受体的细胞表面表达由受体从高尔基体转运到细胞膜和从细胞膜内化到内体间室之间的平衡决定[gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba].gydF4y2Ba
小的rabb GTPase Rab10主要参与蛋白质从高尔基体到质膜的运输[gydF4y2Ba24gydF4y2Ba].前期研究表明,TLR4从高尔基体向质膜的持续补充受Rab10的调控[gydF4y2Ba39gydF4y2Ba].我们发现Rab10活性位点突变体在内毒素血症期间改变了RAW264.7巨噬细胞表面EGFR的表达,但不影响EGFR表达的总蛋白水平。同时,Rab10的下调降低了RAW264.7细胞表面EGFR的表达。此外,Rab10在巨噬细胞中与EGFR高度共定位。这些结果表明Rab10通过促进EGFR易位来影响其表面表达。gydF4y2Ba
受体的内吞作用被认为是一种通过受体和配体清除细胞表面的信号衰减机制[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].Rab5a是早期分类核内体的标记物[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].我们的研究表明Rab5a在巨噬细胞中介导EGFR早期内化。当我们抑制EGFR的磷酸化时,Rab5a的激活以及EGFR与Rab5a的共定位被抑制,从而导致EGFR的内吞功能障碍。我们的研究结果显示,PD168393降低了EGFR和Rab5a的共定位,抑制了Rab5a的激活,从而阻断了早期EGFR的内吞转运,从而阻止了LPS处理1 h后BMDM表面EGFR表达的下降。EGFR内化和溶酶体介导的降解是调节EGFR信号振幅和动力学的重要负反馈机制[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].gydF4y2Ba
Rab7a调节早期至晚期核内体的转运,是晚期内吞途径的关键调节因子[gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba].我们发现,Rab7a的磷酸化阻断了晚期EGFR的内吞作用,抑制了EGFR的溶酶体降解途径,最终促进了EGFR的细胞膜转运,提高了细胞膜上EGFR的水平。我们发现LPS诱导Rab7a在S72位点磷酸化,而PD168393抑制这种磷酸化,这使Rab7a失活,并导致Rab7a介导的晚期EGFR内吞作用被破坏。当Rab7a被磷酸化时,CD63与Rab7a的共定位以及EGFR与CD63和LAMP1的共定位降低。由于溶酶体降解是膜受体内吞作用的最终阶段,我们的结果与最近的研究结果一致,表明Rab7a的磷酸化阻碍了EGFR的晚期内吞转运[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].此外,Rab7a的磷酸化促进lps诱导的EGFR膜表达,激活巨噬细胞,并促进内毒素血症小鼠的肺组织损伤。Rab7a磷酸化激活的MAPK信号通路可能是对感染后炎症的反应,Rab7a可能是控制LPS/ egfr介导的炎症和自身免疫性疾病的新靶点。gydF4y2Ba
M1和M2巨噬细胞生物能量需求的差异正在作为调节回路出现,调节巨噬细胞的行为以响应其栖息地和受感染组织中的营养状态[gydF4y2Ba51gydF4y2Ba].M1巨噬细胞依赖有氧糖酵解产生ATP,增加葡萄糖和谷氨酰胺的消耗,但它们抑制氧化代谢[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba].相反,M2巨噬细胞维持完整的TCA循环并促进氧化代谢[gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba].在本研究中,我们发现Erlotinib不仅抑制糖酵解下调lps诱导的M1极化,而且通过PPARγ途径促进M2极化。我们描述了一种新的方法,通过细胞代谢调节巨噬细胞的M1/M2表型转化,EGFR参与内毒素血症。gydF4y2Ba
总之,我们首次证明了LPS对巨噬细胞中EGFR细胞表面表达的增强。然后阐述了EGFR的整个细胞转运过程,包括质膜易位、早期内化和晚期内吞,以及分别调控这些过程的特异性Rab蛋白。此外,我们发现细胞表面EGFR水平调控巨噬细胞M1/M2极化表型转化,并通过代谢重编程影响脓毒症诱导的多器官损伤。gydF4y2Ba
材料与方法gydF4y2Ba
抗体gydF4y2Ba
抗α-Rab5a (#2143), α-Rab7a (#9367), α-Rab10 (#8127), α-EGFR (#4267), α-Phospho-EGF受体(Tyr1068) (#2234 S), α-Phospho-p38 MAPK (Thr180/Tyr182) (#2775 S), α-p38 MAPK (D13E1) XP兔单抗(#8690),α-p44/42 MAPK (Erk1/2) (#695), α-IRG1(#17805)的抗体均购自Cell Signaling Technology。抗α-HIF1-α (sc-53546)、α-EGFR (sc-120)、α-PKM2 (sc-365684)、α-LDHA (sc-133123)、α-MAPK14 (sc-11415)、α-EGFR (sc-120)、α-EEA1 (sc-137130)、α-TGN38 (sc-166594)、α-LAMP1 (sc-20011)、α-PPARγ (sc-7273)、α-SDHA (sc-390381)、α-COX2 (sc-514489)、α-COX4 (sc-517553)、α-ATP5A (sc-136178)的抗体均购自Santa Cruz Biotechnology。抗α-HA抗体(51064-2-AP, proteintech Group)、α-FLAG抗体(20543-1-AP, proteintech Group)、APC抗小鼠CD11b抗体(APC-65055, proteintech Group)购自proteintech Group。APC抗小鼠iNOS抗体(#85-17-5920-82,eBioscience), PE抗小鼠CD206 (MMR)抗体(#85-12-2061-82,eBioscience), α-F4/80 (11-4801-82, FITC, eBioscience), PE抗小鼠Ly6G (#12-9668-82, eBioscience), α-CD14 (25-0149-42, FITC, eBioscience)购自eBioscience。抗α- gapdh (T0004)、α-β-Tubulin (T0023)、α- phospho - ppar γ (Ser112) (AF3284)、α- phospho - pkm2 (AF7231)抗体购自Affinity Biosciences。gydF4y2Ba
动物gydF4y2Ba
C57BL/6 (WT)小鼠来源于江苏吉翠耀康生物科技有限公司。Rab5a基因敲除小鼠,EGFRgydF4y2Ba液氧/液氧gydF4y2Ba小鼠和Lyz2-Cre小鼠来自Cyagen Biosciences(中国广州)。我们实验室之前生成了髓系特异性EGFR条件敲除(CKO)小鼠(EGFR-CKO小鼠),通过与EGFR交叉,在髓系巨噬细胞中特异性地删除EGFRgydF4y2Ba液氧/液氧gydF4y2Ba小鼠Lyz2-Cre小鼠(EGFRgydF4y2Ba/ fgydF4y2Ba;Lyz2-Cre)。实验对象为雄性小鼠(6-8周龄)。给予以下处理:LPS (20 mg/kg, i.p.);厄洛替尼(100 mg/kg溶解于卡皮索,灌胃);罗格列酮(Rosi) (30mg /kg,灌胃)。所有动物实验均由广东医科大学动物伦理委员会审核通过。gydF4y2Ba
盲肠结扎穿刺gydF4y2Ba
CLP的执行如前所述[gydF4y2Ba56gydF4y2Ba].简单地说,6 - 8周大的C57Bl/6小鼠被麻醉,并使用加热垫保持温暖。做一个腹部中线切口,在盲肠从管腔入口到其尖端距离的四分之一处结扎盲肠。用20号针在盲肠中部穿孔一次。少量盲肠内容物被轻轻地从四个开口推入腹膜。随后,缝合腹肌,并用两根钉钉缝合皮肤。肠子被放回腹膜腔。关闭切口后皮下注射生理盐水1ml。在假手术的动物中,盲肠是分离的,但既没有结扎也没有穿孔。gydF4y2Ba
骨髓来源巨噬细胞(BMDM)的分离和细胞培养gydF4y2Ba
如前所述,从C57BL/6小鼠的股骨和胫骨中分离出BMDM [gydF4y2Ba51gydF4y2Ba].小鼠来源的巨噬细胞RAW264.7细胞(C7505)和MH-S细胞购自(Beyotime Biotechnology, Shanghai, China)。细胞在含1% (v/v)青霉素/链霉素的10% FBS DMEM中培养。gydF4y2Ba
腹腔巨噬细胞的制备gydF4y2Ba
腹腔内注射LPS (10mg /kg)加厄洛替尼或不加厄洛替尼(100mg /kg,灌胃)24 h后收集腹腔巨噬细胞。简单地说,将PBS或生理盐水注入腹腔,轻轻摇晃后提取。腹腔灌洗液以400 g离心。离心后,细胞在冷的1% BSA-PBS中重悬,立即用于流式细胞术分析。gydF4y2Ba
人外周血单个核细胞的制备gydF4y2Ba
从健康人类志愿者或符合脓毒症标准的ICU患者的全血中分离出pmcs。采集血液于10ml EDTA血管中,立即分层于Ficoll培养基上,梯度离心分层。PBMC层分离后立即用于流式细胞仪分析。采集的pbmc符合所有相关伦理法规,并获得广东医科大学人类伦理委员会的批准。gydF4y2Ba
流式细胞术分析gydF4y2Ba
从小鼠或人供体中收集的巨噬细胞或pbmc与F4/80或CD14抗体一起在冰上孵育30分钟。用PE-EGFR抗体对巨噬细胞进行冰上30 min染色,以检测EGFR膜。使用FACScalibur细胞仪(BD Biosciences, USA)对至少10,000例F4/80阳性事件进行荧光信号分析,并使用FlowJo 10.0版本软件进行数据处理。gydF4y2Ba
RNA提取和Real-time PCRgydF4y2Ba
从BMDM、MH-S或RAW264.7细胞中制备总RNA。实时PCR采用Light Cycler 480 (Roche)实时PCR系统,Bio-Rad iQ5软件进行分析。基因特异性引物列表如下:Rab5a(正向:GCTAATCGAGGAGCAACAAGAC;反向:CCAGGCTTGATTTGCCAACAG), EGFR(正向:GCCATCTGGGCCAAAGATACC;反向:GTCTTCGCATGAATAGGCCAAT), IL-1β(正向:GCAACTGTTCCTGAACTCAACT;反向:ATCTTTTGGGGTCCGTCAACT), iNOS(正向:GAGACAGGGAAGTCTGAAGCAC;反向:CCAGCAGTAGTTGCTCCTCTTC), Arg1(正向:CATTGGCTTGCGAGACGTAGAC;反向:GCTGAAGGTCTCTTCCATCACC), Ym1(正向:TACTCACTTCCACAGGAGCAGG;反向:CTCCAGTGTAGCCATCCTTAGG), Mcr-1(正向:GTGAGTCTGGTGGAGAATGTGC;反向:gtagtctccagcacgatgcttga), GAPDH(正向:CATCACTGCCACCCAGAAGACTG; reverse: ATGCCAGTGAGCTTCCCGTTCAG).
siRNA可拆卸的gydF4y2Ba
RAW264.7或BMDM细胞(4 × 10gydF4y2Ba5gydF4y2Ba细胞)接种于6孔板。按照制造商的说明,使用lipor - rnaimax试剂(Invitrogen)转染200 pmol /孔的指定特异性siRNA或非特异性siRNA。转染48 h后,用Western blot方法验证相应基因敲低的有效性。这些研究中使用的siRNA由GenePharma(中国上海)合成:非特异性(ns) siRNA (5 ' - cuacguccaggagcgcaac - 3 '), Rab5a (5 ' - acaguuugagguacuguc - 3 '), Rab10 (5 ' -AACGATTTCACACCATCACAA-3 '), IRG1 (5 ' - gaggauauucuagacacutt - 3 ')。gydF4y2Ba
shRNA击倒gydF4y2Ba
靶向Rab10、Rab5a、Rab7a和MAPK14的shRNA和阴性对照shRNA的质粒由GenePharma(中国上海)设计合成。所示shRNA慢病毒包装在293 T细胞中。慢病毒感染细胞,2 μg/mL嘌呤霉素作用72 h。这些研究中使用的shrna购自GenePharma(中国上海)。目的序列:Rab10 shRNA, AACTGGAACAGACAAACTATC;Rab7a shRNA, AAGACCAGACGCCACTCCAAC;MAPK14 shRNA, CTCAGAGTCTGCAAGAAACTA。gydF4y2Ba
免疫沉淀和免疫印迹gydF4y2Ba
细胞悬浮在IP裂解缓冲液(Thermo, CA, USA)中,在冰上持续混合30分钟。离心12000 ×gydF4y2BaggydF4y2Ba最终体积为500 μl上清液(500 μg蛋白质),用20 μl 50% protein a /G磁珠(Merck Millipore, CA, USA)浆液在4℃下预清除1 h。我们使用磁性支架捕获珠子,并将上清液与4 μg抗小鼠EGFR抗体(Santa Cruz Biotechnologies)在4℃下孵育过夜。取50 μl protein - a /G磁珠与蛋白溶液在4℃旋转摇床中孵育2 h。收集珠粒,用1ml PBS洗涤6次,洗脱液SDS-PAGE(6 - 12%凝胶),然后转移到Immobilon-P膜上进行Western blotting。gydF4y2Ba
免疫荧光gydF4y2Ba
细胞方面,将RAW264.7或BMDM细胞接种于35mm玻璃底皿中,4%多聚甲醛固定,0.1% TritonX-100渗透,4℃一抗孵育过夜,5% BSA rt封闭30 min,荧光偶联二抗和DAPI孵育后,用Olympus荧光显微镜(FV10i-DOC, Olympus, Japan)观察荧光信号。gydF4y2Ba
荧光显微镜gydF4y2Ba
对于组织学研究,组织被固定,切片和染色描述。简单地说,组织切片用iNOS抗体(1:50;Santa Cruz)和CD206抗体(1:100;Proteintech Group)在4°C过夜。随后,荧光偶联二抗在室温下使用30分钟。使用共聚焦显微镜(徕卡TCS SP8,西好莱坞,CA)对样品进行成像。gydF4y2Ba
Western blotting和phostagg - pagegydF4y2Ba
对于SDS-PAGE,指示细胞在裂解缓冲液中裂解,如上所示。然后将裂解物(20 μg)(或来自抗rab7a CO-IP裂解物的适当数量的蛋白质)加载到SDS-PAGE上并进行电泳。对于Phostag SDS-PAGE,将100 mM Phostag丙烯酰胺(#F4002, ApexBio Technology)和60 mM MnCl2添加到12%的SDS-PAGE凝胶中。蛋白质洗脱液在12%聚丙烯酰胺凝胶上进行电泳。电泳后,凝胶转移到硝化纤维膜上,用Rab7a抗体进行免疫印迹。gydF4y2Ba
PhosphoproteomicsgydF4y2Ba
磷蛋白组学结果由上海应用蛋白质技术有限公司(中国上海)提供。用LPS (1 mg/mL)处理24 h,外加或不加PD168393 (10 μM)预处理30 min,制备标准培养的RAW264.7细胞。蛋白质裂解物根据已发表的指南被消化成多肽。磷酸化肽富集后进行LC-MS /MS分析,收集数据。以表达倍数变化2倍以上(上调2倍以上或下调0.5倍以下)为标准筛选差异表达的磷酸化肽gydF4y2BaPgydF4y2Ba值< 0.05。在一组样本中有两个或多个null值的差异表达磷酸化肽,而在另一组样本中有所有null值的差异表达磷酸化肽被排除在后续的生物信息学分析中。蛋白质组学实验在2个技术重复中进行3个生物重复。gydF4y2Ba
代谢组学gydF4y2Ba
代谢组学分析和数据分析由上海应用蛋白质科技有限公司(中国上海)完成。用LPS (1 mg/mL)处理24 h,外加或不加PD168393 (10 μM)预处理30 min,制备标准培养的RAW264.7细胞。代谢物定量、数据规范化和质量控制方法的协议在发表的指南中给出。对代谢组学数据进行筛选(相对标准差)并归一化。使用Student 's计算代谢物的统计学意义gydF4y2BatgydF4y2Ba以及。根据OPLS-DA模型获得的投影变量重要性(Variable Importance for the Projection, VIP),测量代谢物表达模式对各组样本分类和鉴别的影响强度和解释能力,挖掘具有生物学意义的差异代谢物。以VIP > 1为标准初步筛选各组间差异。进一步的单变量统计分析验证不同代谢物的显著性。代谢产物与VIP > 1和gydF4y2BaPgydF4y2Ba多元统计分析中值< 0.05为差异有统计学意义的代谢物。代谢组学实验代表了在2个技术重复中进行的5个生物重复。gydF4y2Ba
线粒体膜电位测定gydF4y2Ba
根据制造商推荐,使用JC-1线粒体膜电位测定试剂盒,6孔格式(#C2006, Beyotime)。RAW264.7细胞用LPS处理24小时,加或不加厄洛替尼预处理,按照制造商的说明进行测定。5 × 10gydF4y2Ba4gydF4y2Ba6孔板每孔细胞为一个样本,流式细胞仪检测。gydF4y2Ba
乳酸浓度的测量gydF4y2Ba
RAW264.7细胞在6孔板中以80%至90%的汇合度播种。用LPS (1 μg/mL)处理细胞24 h,加或不加PD168393 (10 μM)预处理30 min,测定培养基上清液中乳酸含量。使用乳酸检测试剂盒(SenBeiJia,南京,中国)根据方案评估乳酸浓度,并将乳酸水平归一化为蛋白质浓度。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
所有数据均可在正文或补充材料中查阅。gydF4y2Ba
参考文献gydF4y2Ba
Angus DC, van der Poll T.严重败血症和感染性休克。中华口腔医学杂志,2013;gydF4y2Ba
Vincent JL, Opal SM, Marshall JC, Tracey KJ。败血症定义:是时候改变了。《柳叶刀》杂志。2013;381:774-5。gydF4y2Ba
stens -Kurosawa DJ, Osuchowski MF, Valentine C, Kurosawa S, Remick DG。脓毒症的发病机制。《病理学年鉴》2011;6:19-48。gydF4y2Ba
Murray PJ, Allen JE, Biswas SK, Fisher EA, Gilroy DW, Goerdt S,等。巨噬细胞活化和极化:命名法和实验指南。免疫力。2014;41:14-20。gydF4y2Ba
巨噬细胞极化和功能的表观遗传调控。免疫学杂志,2013;34:16 - 23。gydF4y2Ba
巨噬细胞的可塑性和极化:在体内的真实性。《中国科学》,2012;gydF4y2Ba
Rodriguez-Prados JC, Traves PG, Cuenca J, Rico D, Aragones J, Martin-Sanz P,等。被激活巨噬细胞中的底物命运:先天激活、经典激活和替代激活之间的比较。中华免疫杂志,2010;gydF4y2Ba
viira AV, Lamaze C, Schmid SL.网格蛋白介导的EGF受体信号通路的控制。科学。1996;274:2086-9。gydF4y2Ba
Chattopadhyay S, Veleeparambil M, Poddar D, Abdulkhalek S, Bandyopadhyay SK, Fensterl V,等。表皮生长因子受体激酶活性是TLR4信号转导和感染性休克反应所必需的。EMBO代表2015;16:1535-47。gydF4y2Ba
DeS, Zhou H, DeSantis D, Croniger CM, Li X, Stark GR. Erlotinib保护lps诱导的内毒素,因为TLR4需要EGFR信号。美国国家科学研究院。2015; 112:9680-5。gydF4y2Ba
陈伟,钟辉,王旭,庞强,庄杰,胡健,等。Mig6在lps诱导的内毒素血症中通过调节EGFR的激活来减少炎症介质的产生。中国生物医学工程学报,2018;gydF4y2Ba
孙旭,梁健,姚旭,卢超,钟涛,洪旭,等。EGFR的激活促进内毒素血症心肌肿瘤坏死因子α的产生和心衰。Oncotarget。2015;6:35478 - 95。gydF4y2Ba
唐杰,周斌,Scott MJ,陈琳,赖东,范克科,等。更正更正:EGFR信号通路通过调节Rab5a激活增强巨噬细胞TLR4细胞表面表达和功能。蛋白质细胞,2020;11:618-9。gydF4y2Ba
Rittirsch D, Huber-Lang MS, Flierl MA, Ward PA。盲肠结扎穿刺实验性败血症的免疫设计。Nat protocol . 2009; 4:31-6。gydF4y2Ba
Wandinger-Ness A, Zerial M. Rab蛋白和内体系统的区室化。中国生物医学工程杂志。2014;6:a022616。gydF4y2Ba
杨晓东,郭勇,李志强,等。PDZD8与prodrudin和Rab7在与线粒体相关的ER-late endosome膜接触位点相互作用。Nat Commun. 2020;11:3645。gydF4y2Ba
Hewawasam NV, Lhaf F, Taylor HA, Viloria K, Austin A, King A,等。调节rab7a介导的生长因子受体运输抑制代谢应激条件下胰岛β细胞凋亡和自噬。科学通报2020;10:15741。gydF4y2Ba
许建明,李志强,李志强,李志强,等。TBK1磷酸化RAB7A通过PINK-PARKIN途径促进有丝分裂。科学通报2018;4:eaav0443。gydF4y2Ba
张志强,张志强,张志强,等。BCR信号体和下游磷酸化和泛素化的全系统分析。生物化学学报。2015;11:10 10。gydF4y2Ba
托马斯A,富特CE,艾登ER。EGF受体运输:信号传导和癌症的后果。细胞生物学,2014;24:26-34。gydF4y2Ba
筛选核内体的生物发生:Rab5的作用。交通。2000;1:695 - 701。gydF4y2Ba
李俊杰,金东东,金德华,辛博里奥,闵伟,李海杰,等。网格蛋白和Rab5之间的相互作用控制了流产布鲁氏菌在HeLa细胞内的早期吞噬运输和细胞内生存。生物化学学报。2013;28:28049 - 57gydF4y2Ba
丁强,王志,陈艳。脂联素受体1通过网格蛋白和rab5依赖通路的内吞作用。Cell Res. 2009; 19:17 - 27。gydF4y2Ba
Chua CEL, Tang BL. Rab 10-一个多细胞路径和位置的交通控制器。中国生物医学工程学报,2018;gydF4y2Ba
施依涛,薛永平。VCP和ATL1调节内质网和蛋白质合成,促进树突棘的形成。Nat Commun. 2016;7:11020。gydF4y2Ba
palson - mcdermott EM, Curtis AM, Goel G, Lauterbach MA, Sheedy FJ, Gleeson LE,等。丙酮酸激酶M2调节hif -1 α活性和il -1 β诱导,是lps激活巨噬细胞warburg效应的关键决定因素。Cell Metab. 2015; 21:65-80。gydF4y2Ba
张华,薛荣,朱松,付松,陈忠,周荣,等。m2特异性CD1d的减少可切换NKT细胞介导的免疫反应,并触发脂肪组织的元炎症。中国生物医学工程杂志,2018;gydF4y2Ba
孙敏,孙琳,黄超,陈建斌,周哲。脂肪组织源性间充质干细胞诱导巨噬细胞M2b/ C极化。中国免疫杂志2019;2019:7059680。gydF4y2Ba
Nelson VL, Nguyen HCB, Garcia-Canaveras JC, Briggs ER, Ho WY, DiSpirito JR,等。PPARgamma是一个通过谷氨酰胺代谢控制巨噬细胞替代激活的连接。基因开发2018;32:1035-44。gydF4y2Ba
张文杰,黄志强,张志强,张志强,等。平行代谢和转录数据的网络集成揭示了调节巨噬细胞极化的代谢模块。免疫力。2015;42:419-30。gydF4y2Ba
O 'Neill LA, Kishton RJ, Rathmell J.免疫学家免疫代谢指南。免疫生物学杂志,2016;16:553-65。gydF4y2Ba
Fendt SM, Bell EL, Keibler MA, Olenchock BA, Mayers JR, Wasylenko TM,等。还原性谷氨酰胺代谢是细胞中α -酮戊二酸与柠檬酸比率的功能。Nat Commun. 2013;4:2236。gydF4y2Ba
Cordes T, Wallace M, Michelucci A, Divakaruni AS, Sapcariu SC, Sousa C,等。免疫应答基因1和衣康酸抑制琥珀酸脱氢酶调节细胞内琥珀酸水平。中国生物化学杂志,2016;291:14274-84。gydF4y2Ba
魏健,陈刚,石霞,周华,刘明,陈勇,等。Nrf2激活通过调节巨噬细胞极化来预防气管内LPS诱导的小鼠/小鼠急性呼吸窘迫综合征。生物化学与生物物理学报,2018;gydF4y2Ba
西班牙语AJ,马达雷诺MO,伦巴第MG,赛拉M,马丁内斯普利多P,销售我。LPS + inf - γ处理诱导毒蕈碱乙酰胆碱受体的表达和功能,调节NIH3T3细胞增殖:NOS和COX的参与。英国制药杂志。2014;171:5154-67。gydF4y2Ba
Takizawa H, Fritsch K, Kovtonyuk LV, Saito Y, Yakkala C, Jacobs K,等。病原体诱导的TLR4-TRIF先天免疫信号在造血干细胞促进增殖,但降低竞争适应度。《细胞干细胞》2017;21:225-40。gydF4y2Ba
王杰,贾瑞华,王志强。心脏病中的g蛋白偶联受体。Circ res 2018; 123:716-35。gydF4y2Ba
Clarke DC, Liu X.解码TGF-beta/Smad信号的定量性质。细胞生物学杂志,2008;18:430-42。gydF4y2Ba
王东,楼杰,欧阳春,陈伟,刘勇,刘旭,等。ras相关蛋白Rab10通过促进TLR4在质膜上的补充而促进TLR4信号通路。美国国家科学研究院。2010; 107:13806-11。gydF4y2Ba
Sigismund S, Argenzio E, Tosoni D, Cavallaro E, Polo S, Di Fiore PP.网格蛋白介导的内化对于持续的EGFR信号传导是必要的,但对于降解是可可可无的。开发单元,2008;15:209-19。gydF4y2Ba
Di Guglielmo GM, Le Roy C, Goodfellow AF, Wrana JL。不同的内吞途径调节tgf - β受体信号转导和周转。中国生物医学工程学报。2003;5:41 - 21。gydF4y2Ba
Langemeyer L, Frohlich F, Ungermann C. Rab GTPase在核内体和溶酶体生物发生中的作用。细胞生物学,2018;28:957-70。gydF4y2Ba
Gorji-Bahri G, Moghimi HR, Hashemi A. RAB5A与外泌体分泌相关基因:生物信息学分析和实验验证的集成。中国生物医学工程学报。2010;gydF4y2Ba
Wells A, Welsh JB, Lazar CS, Wiley HS, Gill GN, Rosenfeld MG。非内化表皮生长因子受体的配体诱导转化。科学。1990;247:962-4。gydF4y2Ba
Grandal MV, Madshus IH。表皮生长因子受体与癌症:通过内吞作用控制致癌信号。中华医学杂志。2008;12:1527-34。gydF4y2Ba
Vanlandingham PA, Ceresa BP。Rab7调节多泡体生物发生下游的晚期内吞转运和货物隔离。中国生物医学工程学报。2009;gydF4y2Ba
Vitelli R, Santillo M, Lattero D, Chiariello M, Bifulco M, Bruni CB,等。小GTPase Rab7在晚期内吞通路中的作用。中国生物化学杂志,1997;gydF4y2Ba
Shinde SR, Maddika S. PTEN通过去磷酸化Rab7调节EGFR晚期内吞转运和降解。Nat Commun. 2016;7:10689。gydF4y2Ba
Ritter JL, Zhu Z, Thai TC, Mahadevan NR, Mertins P, Knelson EH,等。TBK1/IKKepsilon对RAB7的磷酸化调控三阴性乳腺癌中的先天免疫信号。癌症决议2020;80:44-56。gydF4y2Ba
Hanafusa H, Yagi T, Ikeda H, Hisamoto N, Nishioka T, Kaibuchi K,等。LRRK1在Rab7 S72位点的磷酸化将含有egfr的核内体的转运与其效应物RILP联系起来。中国生物医学工程学报,2019;gydF4y2Ba
galvana - pena S, O 'Neill LA。巨噬细胞极化的代谢重编程。前沿免疫。2014;5:20 20。gydF4y2Ba
奥尼尔LA,皮尔斯EJ。免疫代谢控制树突状细胞和巨噬细胞的功能。中华实验医学杂志2016;213:15-23。gydF4y2Ba
刘磊,陆勇,马丁内斯,毕勇,连刚,王涛,等。促炎信号抑制增殖并将巨噬细胞代谢从myc依赖性转变为hif1 α依赖性。美国国家科学研究院。2016; 113:1564-9。gydF4y2Ba
黄雪峰,黄志强,李志强,等。细胞内溶酶体脂解对于巨噬细胞的选择性激活是必不可少的。中华免疫杂志2014;15:846-55。gydF4y2Ba
王志强,王志强,王志强,等。氧化代谢和pgc -1 β减弱巨噬细胞介导的炎症。Cell Metab, 2006; 4:13-24。gydF4y2Ba
李志强,李志强,李志强,等。破坏自我放大的儿茶酚胺环可以减少细胞因子释放综合征。大自然。2018;564:273-7。gydF4y2Ba
确认gydF4y2Ba
我们感谢上海应用蛋白质科技有限公司(中国上海)提供的蛋白质组学和代谢组学数据分析。gydF4y2Ba
资金gydF4y2Ba
国家自然科学基金(81873951 to JT, 82072208 to JT)和国家重点研发计划(2021YFC2701700)资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
XD、CP、ZF和JT四家公司构思和规划了项目,设计了实验,分析和解释了数据。在SH、ZY、XL、CX、PY的辅助下,XD和CP进行了最多的实验。YT, LQ, ZH协助编写报告。XD、CP和JT撰写、编辑并提交了手稿。JT和采埃孚监督了这项研究。所有作者均进行了数据分析和解释。所有作者都对手稿初稿做出了贡献。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
道德gydF4y2Ba
研究批准。所有动物实验均由广东医科大学动物伦理委员会审核通过(批准PJ2020-077)。2020年10月- 2021年9月广东医科大学附属医院ICU收治的脓毒症或脓毒症休克患者(符合广东医科大学附属医院ICU第3号规定)。国际公认的脓毒性休克和败血症定义)和体检中心的健康捐赠者。选择标准为:患者年龄在18岁以上,患者或法定代表人能够签署道德知情同意书。健康或患者的pbmc的收集符合所有相关的伦理法规,并得到广东医科大学人类伦理委员会的批准。本试验已注册为临床试验(clinicaltrials。政府标识符ChiCTR2000039545)。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
弗朗西斯卡·伯纳索拉编辑gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
张X,陈C,凌C。gydF4y2Baet al。gydF4y2BaEGFR酪氨酸激酶活性和Rab GTPases协调EGFR运输,调节脓毒症中的巨噬细胞激活。gydF4y2Ba细胞死亡gydF4y2Ba13gydF4y2Ba, 934(2022)。https://doi.org/10.1038/s41419-022-05370-ygydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
修改后的gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41419-022-05370-ygydF4y2Ba