亲爱的编辑,gydF4y2Ba
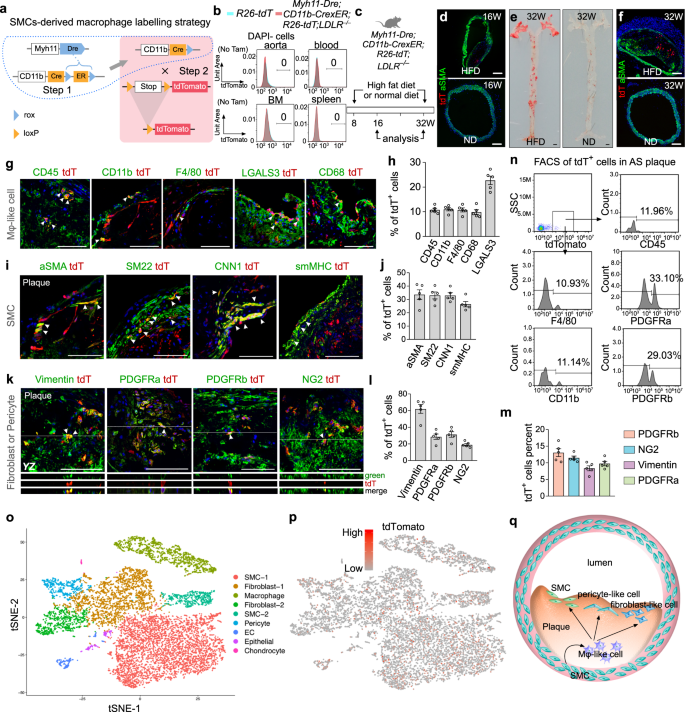
动脉壁上富含脂质的分子形成动脉粥样硬化斑块,随着时间的推移使动脉变窄,导致心肌梗死和中风。阐明各种细胞类型的起源和可塑性,这些细胞类型关键地参与斑块形成和不稳定的所有阶段,对于理解动脉粥样硬化的发病机制至关重要。斑块中的平滑肌细胞(Smooth muscle cell, SMCs)来源于血管内侧已存在的平滑肌细胞,晚期粥样硬化斑块中的部分平滑肌细胞可分化为巨噬细胞样细胞或泡沫细胞gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.遗传谱系追踪研究表明,一些SMC后代可能不再表达SMC标记,并转化为巨噬细胞样细胞gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.然而,这些smc来源的巨噬细胞样细胞在动脉粥样硬化进展过程中是采取稳定的还是短暂的巨噬细胞命运仍存在争议,尚不清楚gydF4y2Ba4gydF4y2Ba.在这里,我们开发了一种双遗传谱系方法,专门追踪SMC衍生的巨噬细胞样细胞的谱系转换,如果有的话,并发现这些细胞的一个子集在纤维帽中重新采用SMC谱系,有助于斑块中的成纤维细胞和周细胞。gydF4y2Ba
为了特异性地追踪smc来源的巨噬细胞样细胞,我们使用了先前报道的Dre-rox和Cre-loxP的双正交重组系统gydF4y2Ba5gydF4y2Ba.我们首先生成一个gydF4y2BaMyh11-DregydF4y2Ba利用CRISPR/Cas9进行同源重组敲入小鼠系,并与rox报告基因进行杂交gydF4y2BaR26-rox-ZsGreengydF4y2Ba(补充图。gydF4y2BaS1a bgydF4y2Ba).ZsGreen和SMC标记如SMA、SM22、CNN1和smMHC免疫染色显示gydF4y2BaMyh11-DregydF4y2Ba有效和特异性靶向主动脉SMCs(补充图;gydF4y2Ba就是S1c dgydF4y2Ba).接下来我们生成一个gydF4y2BaCD11b-CrexERgydF4y2Ba通过将CrexER -rox- er -rox (CrexER)靶向到CD11b基因位点敲入小鼠系(补充图。gydF4y2BaS1egydF4y2Ba),并与loxP报告程序交叉gydF4y2BaR26-loxP-tdTomatogydF4y2Ba线(gydF4y2BaR26-tdTgydF4y2Ba,补充图。gydF4y2BaS1fgydF4y2Ba).没有他莫西芬治疗,我们没有检测到任何tdTomatogydF4y2Ba+gydF4y2Ba血液、脾脏或骨髓中的细胞,表明没有渗漏gydF4y2BaCD11b-CrexERgydF4y2Ba;而他莫西芬治疗导致CD11b特异性标记gydF4y2Ba+gydF4y2Ba细胞(补充图。gydF4y2BaS1g hgydF4y2Ba),表示特异性。成功生成gydF4y2BaMyh11-DregydF4y2Ba而且gydF4y2BaCD11b-CrexERgydF4y2Ba我们对老鼠的基因进行了交叉,形成了一种连续的交叉遗传策略gydF4y2BaMyh11-DregydF4y2Ba-介导的Dre-rox重组首先从CrexER盒中去除ER,从而切换gydF4y2BaCD11b-CrexERgydF4y2Ba到gydF4y2BaCD11b-CregydF4y2BasmMHC基因型gydF4y2Ba+gydF4y2Basmc(步骤1,图;gydF4y2Ba1gydF4y2Ba).表达cd11b的巨噬细胞来源于smMHCgydF4y2Ba+gydF4y2Ba因此,SMCs被基因标记gydF4y2BaR26-tdTgydF4y2Ba使用tdTomato可以追踪和分析其在动脉粥样硬化斑块中的后续细胞命运(步骤2,图。gydF4y2Ba1gydF4y2Ba).通过与gydF4y2BaLDLRgydF4y2Ba−−/gydF4y2Ba,我们生成了gydF4y2BaMyh11-Dre; CD11b-CrexER R26-tdT; LDLRgydF4y2Ba−−/gydF4y2Ba线。首先,我们分析了tdTomato信号gydF4y2BaMyh11-Dre; CD11b-CrexER R26-tdT; LDLRgydF4y2Ba−−/gydF4y2Ba老鼠保持体内平衡。我们没有检测到任何tdTomatogydF4y2Ba+gydF4y2Ba主动脉、血液、脾脏或骨髓中的细胞。gydF4y2Ba1 bgydF4y2Ba).然后,我们从8周龄开始用高脂肪饮食(HFD)或正常饮食(ND)喂养小鼠,并在16或32周龄时分析组织(图2)。gydF4y2Ba1 cgydF4y2Ba).HFD治疗导致16周龄动脉粥样硬化斑块巨噬细胞积聚,少量tdTomatogydF4y2Ba+gydF4y2Ba检测细胞数量(图;gydF4y2Ba1 dgydF4y2Ba).我们用巨噬细胞标记CD45、CD11b、F4/80和CD68抗体对组织进行染色;或有平滑肌细胞标记aSMA。免疫染色结果显示tdTomatogydF4y2Ba+gydF4y2Ba细胞表达这些巨噬细胞标记物,但不表达aSMA(补充图。gydF4y2BaS2a bgydF4y2Ba).此外,我们用多色流式细胞仪证实了这一结果。的tdTomatogydF4y2Ba+gydF4y2Ba早期细胞大多为CD45gydF4y2Ba+gydF4y2BaCD11bgydF4y2Ba+gydF4y2BaF4/80gydF4y2Ba+gydF4y2Ba巨噬样细胞(补充图。gydF4y2BaS2c dgydF4y2Ba).此外,tdTomatogydF4y2Ba+gydF4y2Ba细胞仅占巨噬细胞总数的0.146%(补充图。gydF4y2BaS2c egydF4y2Ba),较先前报道的其他模型低gydF4y2Ba3.gydF4y2Ba.这可能是由于这里分析的时间点和使用的标记不同造成的。值得注意的是,我们没有检测到任何tdTomatogydF4y2Ba+gydF4y2Ba血液、脾脏或骨髓中的细胞(补充图。gydF4y2BaS2fgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba显示双重组酶介导的序列交叉遗传策略的示意图。步骤1:Dre-rox复合开关gydF4y2BaCD11b-CrexERgydF4y2Ba到gydF4y2BaCD11b-CregydF4y2BasmMHC基因型gydF4y2Ba+gydF4y2Ba细胞;第二步:当CD11b被激活时,Cre-loxP重组从基因上标记CD11b表达细胞。gydF4y2BabgydF4y2BatdTomato的流式细胞分析gydF4y2Ba+gydF4y2Ba血液、脾脏和骨髓中的细胞gydF4y2BaMyh11-Dre; CD11b-CrexER R26-tdT; LDLRgydF4y2Ba−−/gydF4y2Ba老鼠。gydF4y2BacgydF4y2Ba实验策略示意图。小鼠分别给予高脂肪饮食(HFD)或正常的实验室饮食。gydF4y2BadgydF4y2Ba用HFD或正常饮食治疗的16周龄小鼠主动脉切片进行tdT和aSMA免疫染色。gydF4y2BaegydF4y2Ba苏丹IV染色后的主动脉全贴装图像。gydF4y2BafgydF4y2BaHFD和正常饮食治疗小鼠主动脉切片tdTomato (tdT)和aSMA的免疫染色gydF4y2BaggydF4y2Ba在斑块切片上进行tdT、CD45、CD11b、F4/80、LGALS3或CD68免疫染色。箭头,负gydF4y2Ba+gydF4y2Ba巨噬细胞。gydF4y2BahgydF4y2BatdT %的定量gydF4y2Ba+gydF4y2Ba斑块中表达不同巨噬细胞标记的细胞。数据以均值±SEM表示;gydF4y2BangydF4y2Ba= 5。gydF4y2Ba我gydF4y2BatdT和SMC标记免疫染色。箭头,负gydF4y2Ba+gydF4y2Basmc。gydF4y2BajgydF4y2BatdT %的定量gydF4y2Ba+gydF4y2Ba斑块中表达不同SMC标记的细胞。数据以均值±SEM表示;gydF4y2BangydF4y2Ba= 5。gydF4y2BakgydF4y2BatdT和成纤维细胞或周细胞标记物的免疫染色。箭头,负gydF4y2Ba+gydF4y2Ba成纤维细胞或周细胞。gydF4y2BalgydF4y2BatdT %的定量gydF4y2Ba+gydF4y2Ba斑块中表达成纤维细胞或周细胞标记的细胞。数据以均值±SEM表示;gydF4y2BangydF4y2Ba= 5。gydF4y2Ba米gydF4y2Ba斑块中表达tdT的成纤维细胞或周细胞百分比的定量。数据以均值±SEM表示;gydF4y2BangydF4y2Ba= 5。gydF4y2BangydF4y2Ba流式细胞术分析tdT表达的不同谱系标记gydF4y2Ba+gydF4y2Ba从斑块中分离出的细胞。gydF4y2BaogydF4y2Ba来自10618个斑块细胞的scRNA-seq数据的tSNE分析gydF4y2BaMyh11-Dre; CD11b-CrexER R26-tdT; LDLRgydF4y2Ba−−/gydF4y2Ba喂食24周高热量食物的小鼠gydF4y2BapgydF4y2BatdTomato在不同聚类中的特征图。1946年的负gydF4y2Ba+gydF4y2Ba细胞呈簇状。gydF4y2Ba问gydF4y2Ba卡通图像显示smc衍生的巨噬细胞样细胞子集采用短暂的细胞命运,并促进纤维帽和动脉粥样硬化斑块中的smc,周细胞样细胞和成纤维细胞样细胞。比例尺:黑色,1毫米;白色,100 μ m。每张图像代表了五个单独的生物样本。gydF4y2Ba
而tdTomatogydF4y2Ba+gydF4y2Ba在16周龄时,细胞完全是巨噬细胞,我们接下来询问smcs来源的巨噬细胞是否最终分化或处于间歇状态,在32周龄时,它们可以在晚期动脉粥样硬化斑块中进一步采用其他细胞命运。治疗HFD而非ND导致32周大时主动脉形成晚期动脉粥样硬化病变(图。gydF4y2Ba1 egydF4y2Ba),其中包括易于检测的tdTomatogydF4y2Ba+gydF4y2Ba细胞(图。gydF4y2Ba1 fgydF4y2Ba).为了确定它们的细胞命运,我们对晚期斑块的冷冻切片进行了tdTomato和多种细胞谱系标记的免疫染色。我们发现只有tdTomato的一个子集gydF4y2Ba+gydF4y2Ba细胞(~10%)仍保持CD45、CD11b、F4/80或CD68等巨噬细胞标志物的表达(图5)。gydF4y2Ba1 g hgydF4y2Ba),表明大量的tdTomato .gydF4y2Ba+gydF4y2Ba细胞可能不再维持巨噬细胞的命运。很大比例的tdTomatogydF4y2Ba+gydF4y2Ba动脉粥样硬化斑块纤维化帽细胞(~25% ~ 35%)表达aSMA、SM22、CNN1、smMHC等SMC标志物(图2)。gydF4y2Ba1 i, jgydF4y2Ba),表明这些巨噬细胞可能在动脉粥样硬化进展过程中恢复SMC的命运。此外,tdTomato和成纤维细胞或周细胞标记物的免疫染色显示tdTomato的一个子集gydF4y2Ba+gydF4y2Ba在动脉粥样硬化斑块中表达Vimentin(~60%)、PDGFRa(~25%)、PDGFRb(~30%)或NG2(~18%)的细胞。gydF4y2Ba1 k, lgydF4y2Ba),表明在晚期动脉粥样硬化病变中,smc来源的巨噬细胞有助于成纤维细胞和周细胞样细胞。斑块中表达成纤维细胞或周细胞标记的巨噬细胞样细胞占总成纤维细胞和周细胞样细胞的10%左右(图2)。gydF4y2Ba1米gydF4y2Ba).其他一些成纤维细胞和周细胞可能来自其他来源,而不是smc来源的巨噬细胞样细胞。tdTomato的流式细胞分析gydF4y2Ba+gydF4y2Ba从动脉粥样硬化斑块中纯化的细胞显示~10% tdTomatogydF4y2Ba+gydF4y2Ba细胞表达巨噬细胞标记物,约30% tdTomatogydF4y2Ba+gydF4y2Ba细胞表达PDGFRa或PDGFRb(图;gydF4y2Ba1 ngydF4y2Ba).进一步验证tdTomato的细胞谱系gydF4y2Ba+gydF4y2Ba我们对10,618个晚期斑块细胞进行了scRNA-seq检测。gydF4y2Ba1阿gydF4y2Ba,补充图。gydF4y2BaS3gydF4y2Ba).1946年tdTomatogydF4y2Ba+gydF4y2Ba在巨噬细胞、平滑肌细胞、成纤维细胞和周细胞富集特征的细胞簇中检测到细胞。gydF4y2Ba1便士gydF4y2Ba),表明smc来源的巨噬细胞样细胞有助于细胞表达这些多种细胞谱系标记。在三组不同的技术控制中,gydF4y2BaMyh11-Dre; CD11b-CrexER R26-tdT; LDLRgydF4y2Ba- / +gydF4y2Ba,gydF4y2BaMyh11-Dre; R26-tdT LDLRgydF4y2Ba−−/gydF4y2Ba,gydF4y2BaCD11b-CrexER; R26-tdT LDLRgydF4y2Ba−−/gydF4y2Ba老鼠,我们没有检测到任何tdTomatogydF4y2Ba+gydF4y2Ba在主动脉瓣或血管壁的细胞(补充图。gydF4y2BaS2ggydF4y2Ba),证明smc来源的巨噬细胞只能通过双基因示踪系统在动脉粥样硬化进展过程中被检测到。gydF4y2Ba
最近的研究使用双重组系统,gydF4y2BaMyh11-DreER; Lgals3-RSR-CregydF4y2Ba,揭示了smc衍生的LGALS3的细胞命运转变gydF4y2Ba+gydF4y2Ba细胞gydF4y2Ba6gydF4y2Ba.他们还观察到表达CD11b和F4/80的smc来源的巨噬细胞。在我们的研究中,smc来源的巨噬细胞样细胞(tdTomatogydF4y2Ba+gydF4y2Ba细胞)表达CD45, CD11b, F4/80和CD68(补充图。gydF4y2BaS2a-dgydF4y2Ba)为早期病变。我们还对从动脉粥样硬化斑块中分离的细胞进行了scRNA-seq分析,发现CD11b在巨噬细胞群中富集(补充图。gydF4y2BaS3egydF4y2Ba),提示CD11b反映了动脉粥样硬化过程中smc的巨噬细胞或巨噬细胞样状态。在Wirka等人的研究中。gydF4y2Ba7gydF4y2Ba,他们报道了SMCs转化为成纤维细胞样细胞而不是经典的巨噬细胞表型。我们的谱系追踪增加了新的信息,SMCs对成纤维细胞样细胞的贡献在动脉粥样硬化期间瞬时表达巨噬细胞标记物。最近的研究报道,在动脉粥样硬化过程中,SMCs也转变为中间细胞状态,分化为巨噬细胞样细胞和纤维软骨细胞样细胞,并回归到SMC表型gydF4y2Ba8gydF4y2Ba.我们的研究提供了smc衍生的巨噬细胞样细胞转化为斑块中表达其他细胞系标记的细胞的直接遗传证据。此外,我们推测我们的观察结果也可能在ApoE中守恒gydF4y2Ba−−/gydF4y2Ba最近的研究报告了smc衍生的LGALS3的细胞命运转变gydF4y2Ba+gydF4y2Ba载脂蛋白e细胞gydF4y2Ba−−/gydF4y2Ba老鼠gydF4y2Ba6gydF4y2Ba和smcs衍生的中间细胞状态gydF4y2Ba−−/gydF4y2Ba和LDLRgydF4y2Ba−−/gydF4y2Ba老鼠gydF4y2Ba8gydF4y2Ba.gydF4y2Ba
在这项研究中,我们使用gydF4y2BaMyh11-Dre; CD11b-CrexERgydF4y2Ba在动脉粥样硬化中追踪smc来源的巨噬细胞样细胞。我们的研究结果表明,虽然一小部分smc来源的巨噬细胞样细胞在晚期斑块中仍然是巨噬细胞样细胞,但大多数在晚期不再继续表达巨噬细胞标志物。相反,这些smc来源的巨噬细胞样细胞有助于在动脉粥样硬化斑块中表达成纤维细胞或周细胞标记物(图。gydF4y2Ba1问gydF4y2Ba).这项研究还表明,斑块中来自SMCs的巨噬细胞样细胞可以表现出短暂的细胞命运,并有可能在动脉粥样硬化进展过程中表达多种细胞谱系的标记物。我们的数据显示,smcs来源的巨噬细胞样细胞具有独特的细胞可塑性,这与已知的最终分化的单核细胞不同。通常,巨噬细胞被认为促进动脉粥样硬化的进展,扩大病变大小,并有助于斑块破裂。平滑肌细胞来源的巨噬样细胞在动脉粥样硬化中的作用一直存在争议。在本研究中,我们发现smc来源的巨噬细胞样细胞可以在晚期斑块纤维帽中恢复为平滑肌细胞,提示这些细胞可能通过稳定动脉粥样硬化斑块发挥保护作用,并在动脉粥样硬化中发挥修复机制。进一步阐明斑块中多种细胞系的起源和可塑性,以及它们未来的潜在功能,可能有助于开发辅助动脉粥样硬化治疗的潜在治疗靶点。smc衍生的巨噬样细胞命运调节机制以及这种命运转变如何影响斑块稳定性值得进一步研究。gydF4y2Ba
数据可用性gydF4y2Ba
支持本研究结果的数据和研究材料,以及实验程序和协议,可根据要求从通讯作者处获得。gydF4y2Ba
参考文献gydF4y2Ba
Allahverdian, S., Chehroudi, a.c., McManus, b.m., Abraham, T. & Francis, g.a.人类动脉粥样硬化中内膜平滑肌细胞对胆固醇积累和巨噬细胞样细胞的贡献。gydF4y2Ba循环gydF4y2Ba129gydF4y2Ba, 1551-1559(2014)。gydF4y2Ba
费尔,S.等人。动脉粥样硬化发生过程中血管平滑肌细胞向巨噬细胞样细胞的转分化。gydF4y2Ba中国保监会,Res。gydF4y2Ba115gydF4y2Ba, 662-667 .(2014)。gydF4y2Ba
尚克曼,L. S.等。klf4依赖的平滑肌细胞表型调节在动脉粥样硬化斑块发病机制中起关键作用。gydF4y2BaNat,地中海。gydF4y2Ba21gydF4y2Ba, 628-637(2015)。gydF4y2Ba
Bentzon, J. F. & majesty, M. W.动脉粥样硬化中平滑肌细胞起源和命运的谱系跟踪。gydF4y2BaCardiovasc。Res。gydF4y2Ba114gydF4y2Ba, 492-500(2018)。gydF4y2Ba
他,L.等人。利用双重组酶提高遗传谱系追踪的精确度。gydF4y2BaNat,地中海。gydF4y2Ba23gydF4y2Ba, 1488-1498(2017)。gydF4y2Ba
Alencar, g.f.等。干细胞多能性基因Klf4和Oct4调节复杂的SMC表型变化,在晚期动脉粥样硬化病变发病机制中至关重要。gydF4y2Ba循环gydF4y2Ba142gydF4y2Ba, 2045-2059(2020)。gydF4y2Ba
Wirka, R. C.等。单细胞分析显示平滑肌细胞表型调节和TCF21疾病基因的动脉粥样硬化保护作用。gydF4y2BaNat,地中海。gydF4y2Ba25gydF4y2Ba, 1280-1289(2019)。gydF4y2Ba
潘,H.等。单细胞基因组学揭示了平滑肌细胞表型转换过程中的一种新的细胞状态,以及小鼠和人类动脉粥样硬化的潜在治疗靶点。gydF4y2Ba循环gydF4y2Ba142gydF4y2Ba, 2060-2075(2020)。gydF4y2Ba
确认gydF4y2Ba
国家重点研究发展计划项目(2019YFA0110403, 2018YFA0107900, 2019YFA0802000, 2018YFA0108100),国家自然科学基金项目(8208810001,31730112,32050087,31625019,91849202,81830010),国家创新人才博士后计划项目(BX20200211), XPLORE PRIZE资助。我们感谢上海模式生物中心(SMOC)对小鼠的生成,以及国家蛋白质科学上海中心对共聚焦成像的帮助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
Y.L.和H.Z.在这项工作中贡献相同。Y.L.进行了实验。H.Z.进行scRNA-seq数据收集和分析。Y. L.、B.H.和B.Z.撰写了手稿。洪志、高志、薛宏、张志、李世民、李伟文、K.L.参与了本文的撰写和资料讨论。B.H.和B.Z.构想并监督了这项研究。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
利益冲突gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
李勇,朱宏,张Q。gydF4y2Baet al。gydF4y2Ba平滑肌来源的巨噬细胞样细胞有助于动脉粥样硬化斑块的多种细胞系。gydF4y2Ba细胞越是加大gydF4y2Ba7gydF4y2Ba, 111(2021)。https://doi.org/10.1038/s41421-021-00328-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41421-021-00328-4gydF4y2Ba