摘要gydF4y2Ba
在成人中,慢性肝损伤期间,肝细胞主要由现有的肝细胞和胆管细胞祖细胞库补充。然而,目前尚不清楚除了经典肝细胞和胆管细胞外,其他类型的细胞是否有助于慢性肝损伤后的肝细胞再生。在这里,我们发现了一种新的双表型细胞群,有助于慢性肝损伤期间的肝细胞再生。我们发现一个细胞群表达Gli1和EpCAM (EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba),通过单细胞RNA测序进一步表征了上皮细胞和间充质细胞的特征。使用双重组酶进行遗传谱系追踪发现Gli1gydF4y2Ba+gydF4y2Ba慢性肝损伤后非肝细胞群可生成肝细胞。EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞在体外表现出更强的类器官形成能力,并在体内移植后表现出更强的肝再生能力。总的来说,这些发现证明了EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞可作为肝祖细胞的新来源,促进肝脏修复和再生。gydF4y2Ba
简介gydF4y2Ba
功能性组织再生需要不同类型细胞的协调作用。此外,在许多严重损伤模型和许多疾病进展的再生背景下,细胞谱系转换和细胞可塑性已被确定gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba.肝脏是一个复杂的器官,由上皮和间质血统的异质混合物组成gydF4y2Ba5gydF4y2Ba.肝脏中不同类型的细胞可以在稳态期间和损伤后合作执行基本功能gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba.因此,识别肝脏中的新细胞类型及其在肝脏再生中的功能将为肝脏再生和治疗应用的谱系可塑性提供巨大的见解。gydF4y2Ba
肝细胞和胆管细胞是仅有的两种上皮细胞系,使肝脏表现出较高的再生能力gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.不同类型肝细胞的谱系追踪表明,肝细胞可转化为成熟的胆管细胞,形成功能稳定的胆道系统gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.另一方面,只有肝细胞增殖被完全抑制,或在小鼠长期严重损伤的情况下,胆管细胞才能转分化为肝细胞gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.此外,Sox9gydF4y2Ba+gydF4y2Ba肝细胞是一种双效祖细胞,既能产生肝细胞,也能产生导管细胞,用于肝脏修复和再生gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.此外,肝细胞在损伤后的肝脏修复和再生过程中表现出广泛的原位再生能力,而不是依赖罕见的特化肝干细胞gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba.相反,当肝细胞和胆管细胞增殖在严重或慢性肝损伤中受损时,有报道称兼性肝祖细胞(LPCs)有助于再生。之前的研究表明Foxl1gydF4y2Ba+gydF4y2Ba肝损伤后可产生肝细胞的细胞可被认为是兼性祖细胞gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.最近,单细胞RNA测序(scRNA-seq)被用于鉴定EpCAMgydF4y2Ba+gydF4y2BaTROP2gydF4y2BaintgydF4y2Ba在成人肝脏中,细胞群作为假定的祖细胞群可能参与肝脏再生gydF4y2Ba8gydF4y2Ba.这些证据主要集中在上皮细胞谱系在肝脏再生中的可塑性和贡献。然而,非上皮细胞群的作用在很大程度上仍然未知。gydF4y2Ba
先前的研究表明,非上皮细胞群,如间充质细胞和免疫细胞,存在于门静脉周围区域的胆道附近,并在肝脏再生过程中为LPCs形成一个生态位gydF4y2Ba9gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.间充质细胞与向远处器官的迁移和保持干性的能力有关,这可以在发育和迁移的初始阶段促进向多个细胞谱系的分化gydF4y2Ba20.gydF4y2Ba.间充质细胞是居住在肝脏的间充质干细胞(MSCs),因为它们有分化成脂肪细胞或骨细胞的潜力gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba.此外,肝星状细胞(hsc)已被确定为LPCs的来源,并可在成人肝脏中产生肝细胞gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba.不同组织中的间充质细胞已通过多种标记物进行鉴定,包括胶质瘤相关癌基因同源物1 (Gli1)、gre1和血小板衍生生长因子受体α (PDGFRα)。gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.Gli1在多个组织中识别msc样种群,而Gli1gydF4y2Ba+gydF4y2Ba细胞在组织纤维化过程中产生肌成纤维细胞gydF4y2Ba27gydF4y2Ba.在成人肝脏中,Gli1gydF4y2Ba+gydF4y2Ba细胞位于胆道周围,损伤后发生广泛扩张gydF4y2Ba27gydF4y2Ba.因此,我们选择Gli1作为间充质细胞标志物,研究非上皮细胞在肝脏再生中的作用。gydF4y2Ba
为了确定非上皮细胞群在肝脏再生中的作用,我们使用遗传示踪、scRNA-seq和类器官培养来表征Gli1标记的成人肝细胞群。我们发现Gli1gydF4y2Ba+gydF4y2Ba慢性损伤后肝细胞生成新生肝细胞。遗传谱系追踪显示Gli1gydF4y2Ba+gydF4y2Ba非肝细胞群体在慢性肝损伤后可通过双重组酶生成肝细胞。进一步的检查发现Gli1gydF4y2Ba+gydF4y2Ba肝脏中的细胞是由PDGFRα组成的异质群体gydF4y2Ba+gydF4y2Ba基质细胞和EpCAMgydF4y2Ba+gydF4y2BaPDGFRαgydF4y2Ba+gydF4y2Babiphenotypic细胞。我们演示了EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞可作为肝祖细胞的新来源,促进肝脏修复和再生。gydF4y2Ba
结果gydF4y2Ba
Gli1gydF4y2Ba+gydF4y2Ba细胞参与慢性肝损伤后的肝细胞再生gydF4y2Ba
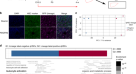
在肝脏中,Gli1gydF4y2Ba+gydF4y2Ba细胞分布在胆道周围和门静脉周围的周细胞生态位gydF4y2Ba27gydF4y2Ba.描述Gli1gydF4y2Ba+gydF4y2Ba我们首先检测了gli1表达细胞及其在成年小鼠肝脏中的位置。与之前的研究一致,在成年小鼠肝脏的肝小叶门周区存在gli1表达细胞(补充图)。gydF4y2BaS1agydF4y2Ba).然后,我们对Gli1-LacZ小鼠的肝脏切片进行免疫染色,检测β-半乳糖苷酶(β-gal)和胆道上皮细胞标记物细胞角蛋白19 (KRT19)、上皮细胞粘附分子(EpCAM)和骨桥蛋白(OPN)、肝细胞标记物肝细胞核因子4α (HNF4α)、白蛋白和谷氨酰胺合成酶(GS)、MSC标记物PDGFRα、激活的HSC标记物α-平滑肌动蛋白(α-SMA)、内皮细胞标记物ve -钙粘蛋白(VE-CAD)和巨噬细胞标记物F4/80(补充图)。gydF4y2Ba印地cgydF4y2Ba).结果表明,Gli1gydF4y2Ba+gydF4y2Ba成年Gli1-lacZ小鼠肝脏中的胆道上皮细胞标志物KRT19和OPN、肝细胞标志物HNF4α、Alb和GS、内皮细胞标志物VE-CAD和巨噬细胞标志物F4/80均呈阴性(补充图4)。gydF4y2Ba印地gydF4y2Ba).引人注目的是,Gli1的一个子集gydF4y2Ba+gydF4y2BaMSC标记物PDGFRα阳性(78.01%),活化HSC标记物α-SMA阳性(11.19%)(补充图)。gydF4y2Ba就是S1cgydF4y2Ba).有趣的是,Gli1还专门标记了EpCAM的一个小子集gydF4y2Ba+gydF4y2Ba细胞(补充图。gydF4y2Ba印地gydF4y2Ba).定量上,免疫染色显示~0.1% Gli1gydF4y2Ba+gydF4y2Ba细胞表达EpCAM。gydF4y2Ba
探讨Gli1的作用gydF4y2Ba+gydF4y2Ba我们在Gli1-LacZ小鼠中使用了不同的肝损伤模型。首先,我们研究了Gli1的变化gydF4y2Ba+gydF4y2Ba这是一种与肝细胞损伤无关的肝细胞再生模型gydF4y2Ba29gydF4y2Ba.我们在术后24和48小时采集肝脏样本,检测Gli1gydF4y2Ba+gydF4y2BaX-gal染色。值得注意的是,Gli1无明显升高gydF4y2Ba+gydF4y2BaPH后24和48小时,肝脏中的细胞数量增加。gydF4y2BaS1dgydF4y2Ba).接下来,我们检查了单次高剂量的氯化碳是否gydF4y2Ba4 gydF4y2Ba(1 mL/kg,急性损伤)导致Gli1扩增gydF4y2Ba+gydF4y2Ba细胞。X-gal染色结果也显示Gli1gydF4y2Ba+gydF4y2Ba细胞在CCl后2天没有增加gydF4y2Ba4 gydF4y2Ba注射(补充图gydF4y2BaS1egydF4y2Ba).然而,Gli1显著增加gydF4y2Ba+gydF4y2Ba在注射低剂量CCl的慢性肝损伤小鼠模型中观察到细胞的变化gydF4y2Ba4 gydF4y2Ba每周3次,共10次。gydF4y2BaS1fgydF4y2Ba).另外,我们使用3,5-二氧羰基-1,4-二氢collidine (DDC)、缺乏甲硫氨酸/胆碱(MCD)或缺乏胆碱,补充乙硫氨酸(CDE)饮食诱导的胆道损伤模型来研究Gli1的细胞动力学gydF4y2Ba+gydF4y2Ba细胞在胆汁淤积损伤(图;gydF4y2Ba1 a, bgydF4y2Ba;补充图。gydF4y2BaS1g hgydF4y2Ba).在这些条件下,Gli1增加gydF4y2Ba+gydF4y2Ba与正常饮食喂养的小鼠相比,细胞凋亡明显增加。gydF4y2Ba1 bgydF4y2Ba;补充图。gydF4y2BaS1g hgydF4y2Ba).与X-gal染色结果一致,β-gal组织切片免疫染色也显示DDC、MCD或CDE饮食诱导损伤并刺激Gli1显著扩增gydF4y2Ba+gydF4y2Ba细胞(补充图。gydF4y2BaS1igydF4y2Ba).用细胞系标记(如胆道上皮细胞标记KRT19、肝细胞标记HNF4α或MSC标记PDGFRα)对β-gal进行切片染色,结果显示Gli1的表达为0%、0%或97.24%gydF4y2Ba+gydF4y2Ba细胞为KRT19gydF4y2Ba+gydF4y2Ba, HNF4αgydF4y2Ba+gydF4y2Ba,和PDGFRαgydF4y2Ba+gydF4y2Ba,分别(图;gydF4y2Ba1 cgydF4y2Ba).这些结果表明Gli1gydF4y2Ba+gydF4y2Ba细胞积极参与慢性肝损伤。gydF4y2Ba
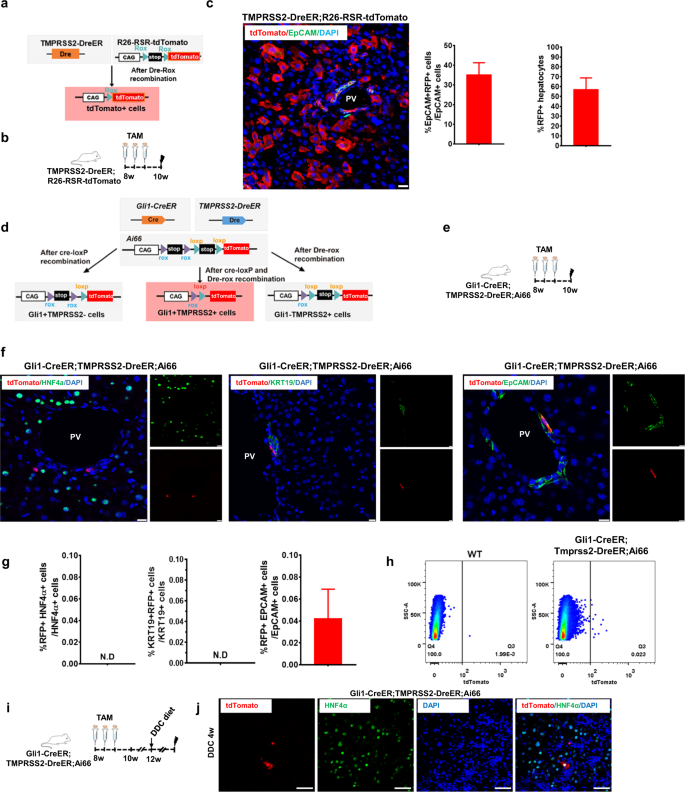
一个gydF4y2Ba实验设计示意图。gydF4y2BabgydF4y2Ba正常饮食或DDC饮食4周后Gli1-LacZ小鼠x -gal染色肝脏切片的代表性组织学图像(左图)。X-gal数的量化gydF4y2Ba+gydF4y2Ba损伤后的细胞(右图)。数据以均值±SEM (gydF4y2BangydF4y2Ba= 3)。**gydF4y2BaPgydF4y2Ba< 0.01。gydF4y2BacgydF4y2Ba使用抗β-gal(绿色)、PDGFRα(红色)、HNF4α(红色)或KRT19(红色)的抗体,对接受正常或DDC饮食的小鼠的肝脏切片进行代表性免疫荧光染色。PV门静脉。比例尺,50 μm。右图:β-gal百分比的定量gydF4y2Ba+gydF4y2Ba表达HNF4α、KRT19和PDGFRα的细胞。数据表示为均值±SEM (gydF4y2BangydF4y2Ba= 5)。未检测到N.D。gydF4y2BadgydF4y2Ba使用Gli1-Cre的谱系跟踪示意图gydF4y2BaERt2gydF4y2Baddc致肝损伤后Ai9报告小鼠。gydF4y2BaegydF4y2Ba实验设计示意图。gydF4y2BafgydF4y2Ba从Gli1-Cre清除肝脏的方案示意图gydF4y2BaERt2gydF4y2BaAi9小鼠在正常饮食或含CUBIC的DDC饮食后4周。gydF4y2BaggydF4y2Ba重建Gli1-Cre肝脏的三维图像gydF4y2BaERt2gydF4y2BaAi9小鼠在正常饮食或DDC饮食4周后。图像由光片荧光显微镜(LSFM)获得(gydF4y2BazgydF4y2Ba-stack: 5 μm/slice)。白色箭头表示肝细胞形态。比例尺,200 μm。gydF4y2BahgydF4y2BaGli1-Cre后肝脏组织切片中tdTomato(红色)、KRT19(绿色)、EpCAM(绿色)或HNF4α(绿色)的免疫染色gydF4y2BaERt2gydF4y2BaAi9小鼠接受DDC饮食4周。比例尺,50 μm。白色箭头表示肝细胞形态。白色箭头表示EpCAMgydF4y2Ba+gydF4y2BatdtomatogydF4y2Ba+gydF4y2Ba细胞。右面板:tdTomato百分比的量化gydF4y2Ba+gydF4y2Ba表达HNF4α、KRT19和EpCAM的细胞。数据以均值±SEM (gydF4y2BangydF4y2Ba= 5)。未检测到N.D。*gydF4y2BaPgydF4y2Ba< 0.05。gydF4y2Ba我gydF4y2BaGli1-Cre后肝脏组织切片tdTomato(红色)和HNF4α(绿色)免疫染色gydF4y2BaERt2gydF4y2BaAi9小鼠接受为期4周的MCD饮食。白色箭头表示肝细胞形态。比例尺,50 μm。gydF4y2BajgydF4y2BaGli1-Cre后肝脏组织切片tdTomato(红色)和HNF4α(绿色)免疫染色gydF4y2BaERt2gydF4y2BaAi9小鼠接受为期4周的CDE饮食。白色箭头表示肝细胞形态。比例尺,10 μm。gydF4y2BakgydF4y2Baddc诱导损伤后4周代表性肝切片内tdTomato(红色)、Ki67(白色)、KRT19(绿色)、EpCAM(绿色)、HNF4α(绿色)或PDGFRα(绿色)的免疫染色。白色箭头表示肝细胞形态。白色箭头表示EpCAMgydF4y2Ba+gydF4y2BatdtomatogydF4y2Ba+gydF4y2Ba细胞。比例尺,50 μm。右面板:tdTomato百分比的量化gydF4y2Ba+gydF4y2Ba, KRT19gydF4y2Ba+gydF4y2Ba, EpCAMgydF4y2Ba+gydF4y2Ba, HNF4αgydF4y2Ba+gydF4y2Ba,或PDGFRαgydF4y2Ba+gydF4y2Ba表达Ki67的细胞。N.D,未检测到。数据以均值±SEM (gydF4y2BangydF4y2Ba= 5)。gydF4y2Ba
为了进一步研究表达gli1的细胞在肝脏修复和再生中的作用,我们使用Gli1-Cre进行了遗传谱系追踪实验gydF4y2BaERt2gydF4y2BaAi9小鼠给予他莫西芬(TAM)治疗8周(图;gydF4y2Ba1 dgydF4y2Ba).在一项谱系追踪研究中,检测了由Cre“渗漏”表达引起的背景重组水平gydF4y2Ba30.gydF4y2Ba.在这里,我们没有观察到在没有TAM注射的情况下,Gli1-Cre损伤后出现任何“渗漏”标记细胞gydF4y2BaERt2gydF4y2BaAi9小鼠(补充图;gydF4y2BaS2a bgydF4y2Ba).有血统标记的tdTomato的身份gydF4y2Ba+gydF4y2BaGli1-Cre表达gydF4y2BaERt2gydF4y2BaTAM注射1周、4周、8周或24周后Ai9成年小鼠肝脏(补充图。gydF4y2BaS3agydF4y2Ba).Gli1-marked tdTomatogydF4y2Ba+gydF4y2Ba肝胆管周围也有细胞分布,不同时期无明显差异(补充图)。gydF4y2BaS3b-fgydF4y2Ba).TAM给药后至少14天(洗脱期)诱导损伤,以消除损伤后重组的可能性(补充图)。gydF4y2BaS3ggydF4y2Ba).与Gli1-LacZ小鼠的发现一致,我们还观察到tdTomato显著增加gydF4y2Ba+gydF4y2BaGli1-Cre肝脏中的细胞gydF4y2BaERt2gydF4y2BaAi9小鼠ddc损伤后4周或12周(补充图;gydF4y2BaS3h-jgydF4y2Ba).然后,我们应用了一种清晰、通畅的脑成像鸡尾酒和计算分析(CUBIC)方法,这是一种组织清理和三维(3D)成像技术,进行了实验研究(图2)。gydF4y2Ba1 e, fgydF4y2Ba).通过光片显微镜收集全肝3D图像,并用于正常和ddc诱导的Gli1-Cre肝脏的全肝比较gydF4y2BaERt2gydF4y2Ba; Ai9老鼠。在损伤组,tdTomatogydF4y2Ba+gydF4y2Ba细胞呈典型的肝细胞形态,细胞呈簇状或单分布(图2)。gydF4y2Ba1克gydF4y2Ba).为了检查Gli1在肝脏中标记的详细细胞类型,我们在ddc诱导的损伤后对肝脏进行切片,并进行tdTomato和细胞谱系标记的免疫染色。我们发现tdTomato的一个子集gydF4y2Ba+gydF4y2Ba肝脏中HNF4α或EpCAM共定位的细胞。定量分析显示tdTomato为0.032%、0%和0.72%gydF4y2Ba+gydF4y2Ba细胞分别表达HNF4α、KRT19或EpCAM(图;gydF4y2Ba1 hgydF4y2Ba;补充图。gydF4y2BaS3kgydF4y2Ba).为了准确检测肝脏中的这些事件,我们获得了50 μm冷冻切片,并按照标准的免疫荧光染色程序进行染色。最后,通过共聚焦显微镜获得免疫染色图像(补充图。gydF4y2BaS3lgydF4y2Ba).我们发现tdTomato的> 85%gydF4y2Ba+gydF4y2Ba门静脉附近的肝细胞(PV)(补充图。gydF4y2BaS3mgydF4y2Ba).此外,我们还使用CDE或MCD饮食诱导胆汁淤积损伤模型(图2)。gydF4y2Ba1 i, jgydF4y2Ba).与ddc诱导损伤的结果一致,我们发现tdTomato的一个子集gydF4y2Ba+gydF4y2Ba肝脏细胞与HNF4α共定位(图;gydF4y2Ba1 i, jgydF4y2Ba).然而,在低剂量CCl的肝脏中,没有检测到具有相同基因型的追踪事件gydF4y2Ba4 gydF4y2Ba-诱发慢性损伤。我们假设CClgydF4y2Ba4 gydF4y2Ba但DDC、CDE或MCD可引起lpc的发生gydF4y2Ba21gydF4y2Ba.接下来,检查tdTomatogydF4y2Ba+gydF4y2Ba我们对Ki67/tdTomato进行了免疫染色,并对各种标志物(包括胆管细胞标志物KRT19和EpCAM,肝细胞标志物HNF4α和MSC标志物PDGFRα)进行了三染色。定量上,免疫染色显示Ki67阳性率为18.2%、63.5%、77.3%、5.5%、18.6%gydF4y2Ba+gydF4y2Ba细胞分别表达tdTomato、EpCAM、KRT19、HNF4α和PDGFRα。Ki67增殖率较高gydF4y2Ba+gydF4y2Ba在EpCAM中观察细胞gydF4y2Ba+gydF4y2Ba, KRT19gydF4y2Ba+gydF4y2Ba,和PDGFRαgydF4y2Ba+gydF4y2Ba用DDC处理的细胞(图;gydF4y2Ba1 kgydF4y2Ba).这些数据表明,gli1来源的细胞有助于慢性损伤后的肝脏再生。gydF4y2Ba
来源于Gli1的肝细胞gydF4y2Ba+gydF4y2Ba慢性损伤后非肝细胞gydF4y2Ba
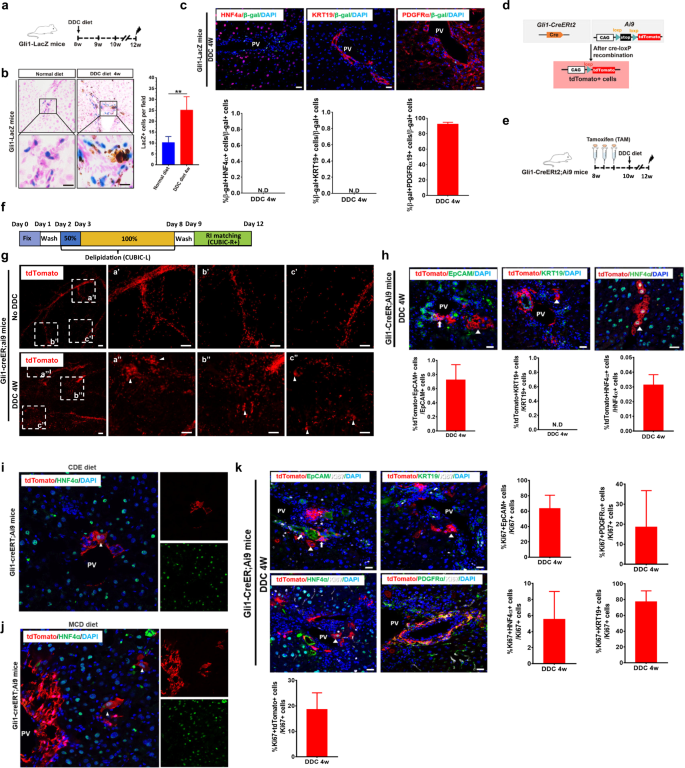
识别Gli1gydF4y2Ba+gydF4y2Ba我们在HNF4α-Dre中进行了杂交gydF4y2BaERt2gydF4y2Ba和Gli1-CregydF4y2BaERt2gydF4y2Ba用双重组酶介导的tdTomato报告株(Ai66)诱导小鼠产生Gli1-CregydF4y2BaERt2gydF4y2Ba; HNF4α衣服gydF4y2BaERt2gydF4y2BaAi66小鼠系(图;gydF4y2Ba2gydF4y2Ba).在本报告系中,tdTomato的激活需要Dre-rox和Cre-loxP的重组,而只需要Gli1gydF4y2Ba+gydF4y2BaHNF4αgydF4y2Ba+gydF4y2Ba细胞,可以被基因标记(图;gydF4y2Ba2 a, bgydF4y2Ba)gydF4y2Ba14gydF4y2Ba.我们没有检测到任何tdTomatogydF4y2Ba+gydF4y2BaGli1-Cre中的肝细胞gydF4y2BaERt2gydF4y2Ba; HNF4α衣服gydF4y2BaERt2gydF4y2BaAi66小鼠损伤或未损伤,表明无Gli1gydF4y2Ba+gydF4y2BaHNF4αgydF4y2Ba+gydF4y2Ba肝细胞被标记(图;gydF4y2Ba2摄氏度gydF4y2Ba).为了避免TAM注射带来的潜在偏倚,我们接下来用AAV8-TBG-GFP标记肝细胞,已知AAV8-TBG-GFP强标记肝细胞。我们将GFP插入AAV8载体的下游agydF4y2Bathyroxine-binding球蛋白gydF4y2Ba(gydF4y2Ba英特百奇gydF4y2Ba)启动子在肝细胞中过表达GFP。在TAM治疗和2周洗脱期后,Gli1-CregydF4y2BaERt2gydF4y2BaAi9小鼠注射AAV8-TBG-GFP病毒颗粒(2 × 10gydF4y2Ba11gydF4y2Ba)通过尾静脉注射BD超细胰岛素注射器(图;gydF4y2Ba二维gydF4y2Ba).肝切片免疫染色tdTomato、GFP、HNF4α、EpCAM或KRT19显示,GFP标记99%的肝细胞;然而,没有tdTomatogydF4y2Ba+gydF4y2Ba在这些实验中观察到肝细胞(图;gydF4y2Ba2 egydF4y2Ba).接下来,我们使用Gli1-Cre进行了遗传谱系追踪实验gydF4y2BaERt2gydF4y2BaAi9小鼠慢性损伤后给予TAM和AAV8-TBG-GFP病毒颗粒。我们观察到tdTomato的存在gydF4y2Ba+gydF4y2Ba绿色荧光蛋白gydF4y2Ba+gydF4y2BaGli1-Cre肝脏中的细胞gydF4y2BaERt2gydF4y2BaAi9小鼠ddc损伤后4周(图;gydF4y2Ba2 fgydF4y2Ba).综上所述,这些数据表明Gli1gydF4y2Ba+gydF4y2Ba非肝细胞促进慢性损伤后肝细胞再生。gydF4y2Ba
一个gydF4y2Ba显示标记Gli1策略的示意图gydF4y2Ba+gydF4y2BaHNF4αgydF4y2Ba+gydF4y2Ba细胞通过双重组酶介导的交叉遗传方法。gydF4y2BabgydF4y2Ba实验设计示意图。gydF4y2BacgydF4y2Baddc损伤后代表性肝脏切片tdTomato(红色)和HNF4α(绿色)免疫染色。比例尺,50 μm。gydF4y2BadgydF4y2Ba实验设计示意图。gydF4y2BaegydF4y2BaGli1-Cre肝切片中GFP(绿色)、tdTomato(红色)、EpCAM(白色)、HNF4α(白色)或KRT19(白色)的免疫染色gydF4y2BaERt2gydF4y2Ba; Ai9老鼠。PV门静脉。比例尺,50 μm。gydF4y2BafgydF4y2BaGli1-Cre肝切片GFP(绿色)和tdTomato(红色)免疫染色gydF4y2BaERt2gydF4y2BaAAV8-TBG-GFP病毒颗粒注射致Ai9小鼠ddc损伤。白色箭头表示肝细胞形态。比例尺,50 μm。gydF4y2Ba
Gli1标记EpCAM的一个小子集gydF4y2Ba+gydF4y2Ba肝脏中的细胞gydF4y2Ba
为了进一步描述Gli1gydF4y2Ba+gydF4y2Ba单元格,我们执行gydF4y2BaGli1gydF4y2Ba8周龄野生型(WT)小鼠的FISH和EpCAM或KRT19共染色。我们观察到,在成人肝脏中,Gli1表达细胞位于PV附近,Gli1与EpCAM共定位,而不是KRT19(图2)。gydF4y2Ba3gydF4y2Ba;补充图。gydF4y2BaS4agydF4y2Ba).接下来,我们还检查了gli1表达细胞的详细细胞类型及其在肝脏中的位置(图2)。gydF4y2Ba3 bgydF4y2Ba).肝切片免疫染色显示tdTomato、PDGFRα和α-SMA分别为77.8%和25.18%gydF4y2Ba+gydF4y2Ba细胞为PDGFRαgydF4y2Ba+gydF4y2Ba和αsmagydF4y2Ba+gydF4y2Ba细胞,分别(图;gydF4y2Ba3 cgydF4y2Ba).值得注意的是,Gli1还专门标记了EpCAM的一个非常小的子集gydF4y2Ba+gydF4y2Ba(0.26%)细胞(图;gydF4y2Ba3 cgydF4y2Ba),这与Gli1-LacZ小鼠的研究结果一致。我们还用tdTomato在肝脏切片中检测了其他细胞系标记,包括KRT19、Sox9、F4/80、Alb、HNF4α和VE-CAD,我们没有发现任何tdTomatogydF4y2Ba+gydF4y2Ba这些细胞系标记阳性的细胞(补充图。gydF4y2BaS4b cgydF4y2Ba).流式细胞术分析从肝脏分离的细胞也显示~0.037%的tdTomatogydF4y2Ba+gydF4y2Ba肝脏中的细胞为EpCAMgydF4y2Ba+gydF4y2Ba(补充图。gydF4y2BaS4dgydF4y2Ba).此外,我们进行了Gli1/EpCAM/PDGFRα或Gli1/EpCAM/α-SMA三染色来表征EpCAM的谱系gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2BaGli1-Cre中的细胞gydF4y2BaERt2gydF4y2Ba; Ai9老鼠。结果显示,80.25%的EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞为PDGFRαgydF4y2Ba+gydF4y2Ba而不是α-SMAgydF4y2Ba+gydF4y2Ba(无花果。gydF4y2Ba3 dgydF4y2Ba).综合来看,这些数据表明EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞是PDGFRα的一个子集gydF4y2Ba+gydF4y2Ba间充质细胞。值得注意的是,EpCAMgydF4y2Ba+gydF4y2Ba细胞通常被认为是潜在的肝干细胞群gydF4y2Ba5gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,暗示EpCAMgydF4y2Ba+gydF4y2Ba肝损伤细胞可能具有不同的性质和功能异质性。gydF4y2Ba
一个gydF4y2BaRNAscope分析8周龄WT小鼠Gli1(红色)、EpCAM(绿色)或CK19(绿色)的肝脏表达。比例尺,200 μm。gydF4y2BabgydF4y2BaGli1谱系追踪的实验设计gydF4y2Ba+gydF4y2Ba细胞使用Gli1-CregydF4y2BaERt2gydF4y2Ba; Ai9老鼠。gydF4y2BacgydF4y2Ba免疫染色tdTomato(红色)和EpCAM(绿色),PDGFRα(绿色)或α-SMA(绿色)肝脏切片(左图)。白色箭头表示共染细胞。比例尺,50 μm。tdTomato百分比的量化gydF4y2Ba+gydF4y2Ba表达PDGFRα、EpCAM和α-SMA的细胞(右图)。数据以均值±SEM (gydF4y2BangydF4y2Ba= 3)。gydF4y2BadgydF4y2Ba肝切片tdTomato(红色)、EpCAM(白色)、PDGFRα(绿色)或α-SMA(绿色)免疫染色。PV门静脉。白色箭头表示共染细胞。比例尺,50 μm。gydF4y2Ba
EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞呈现双表型状态,并共同表达上皮和间充质标记物gydF4y2Ba
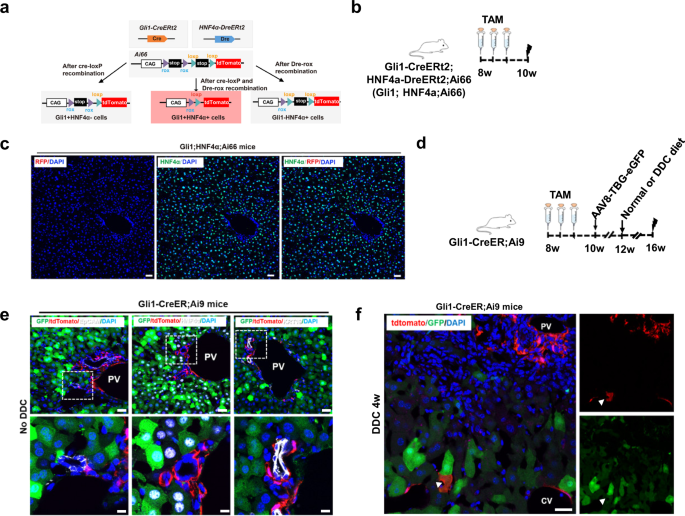
EpCAMgydF4y2Ba+gydF4y2Ba细胞由ASGR1组成gydF4y2Ba+gydF4y2Ba成人肝脏中的肝细胞群、胆管细胞群和推定的祖细胞群gydF4y2Ba8gydF4y2Ba.确定EpCAM的身份gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba我们对从Gli1-Cre中分离出来的单个细胞进行了scRNA-seqgydF4y2BaERt2gydF4y2BaAi9小鼠肝脏。EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞,EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba细胞和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba从Gli1-Cre中分离细胞gydF4y2BaERt2gydF4y2BaAi9小鼠肝脏(图;gydF4y2Ba4gydF4y2Ba).HNF4α-Dre肝细胞gydF4y2BaERt2gydF4y2BaR26-RSR-tdTomato小鼠为阴性对照。我们分析了527个细胞的scRNA-seq谱gydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞,gydF4y2BangydF4y2Ba= 144;EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba细胞,gydF4y2BangydF4y2Ba= 148;EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞,gydF4y2BangydF4y2Ba= 202;肝细胞,gydF4y2BangydF4y2Ba= 33)使用Smart-seq2方法。利用DoubletDecon和DoubletFinder(补充图。gydF4y2BaS5agydF4y2Ba).无监督聚类和主成分分析(PCA)产生了4个聚类(聚类1-4)(图。gydF4y2Ba4 bgydF4y2Ba;补充图。gydF4y2BaS5bgydF4y2Ba).这四个集群被清楚地识别为EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba, EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba, EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba和肝细胞,表明这些细胞的不同生物学特征(图。gydF4y2Ba4摄氏度gydF4y2Ba).我们注意到EpCAM主要由EpCAM表达gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba细胞和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba而tdTomato主要由EpCAM表达gydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞(图。gydF4y2Ba4 dgydF4y2Ba).此外,肝细胞也表达tdTomato,作为对照(图2)。gydF4y2Ba4 dgydF4y2Ba).这些结果与荧光激活细胞分选(FACS)结果一致,并为我们高质量的测序数据提供了证据。然后,我们通过聚类分析检查每个细胞群富集的标记基因,并通过热图检查每个细胞群的代表性差异表达基因(DEGs)(图2)。gydF4y2Ba4 egydF4y2Ba).肝细胞特异性表达的肝细胞标记基因,如gydF4y2Ba铝青铜gydF4y2Ba而且gydF4y2BaCyp7a1gydF4y2Ba(补充图。gydF4y2BaS5cgydF4y2Ba).EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞外基质(ECM)高表达基因(gydF4y2BaCol1a1gydF4y2Ba,gydF4y2BaCol1a2gydF4y2Ba,gydF4y2BaCol3a1gydF4y2Ba,gydF4y2Ba宽带运gydF4y2Ba)和与间充质细胞标记相关的基因(gydF4y2BaPdgfrαgydF4y2Ba而且gydF4y2BaPdgfrβgydF4y2Ba),这是成纤维细胞样细胞和间充质细胞的特征(图。gydF4y2Ba4 e, fgydF4y2Ba).有趣的是,我们发现EpCAM中标记基因的表达gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba在EpCAM细胞之间gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba和EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞。EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞同时表达上皮和间充质标记基因,表明EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞可能会执行这两种细胞的功能(图。gydF4y2Ba4 e, fgydF4y2Ba;补充图。gydF4y2BaS5d-fgydF4y2Ba).目的:探讨EpCAM的生物学功能gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞中,我们在EpCAM中对DEGs进行了基因本体(GO)分析gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞。结果显示,与组织形态发生、损伤反应和干细胞分化相关的几个显著丰富的生物过程(图2)。gydF4y2Ba4 ggydF4y2Ba).通过基因集富集分析(GSEA)对EpCAM的功能进行表征gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba在细胞亚群中,我们还发现组织形态发生、损伤反应和干细胞分化途径在EpCAM中富集gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba与其他三种类型的细胞相比(图;gydF4y2Ba4 hgydF4y2Ba;补充图。gydF4y2BaS5ggydF4y2Ba).上皮标志物的共表达(gydF4y2BaEpCAMgydF4y2Ba而且gydF4y2BaKrt7gydF4y2Ba)和间充质标记(gydF4y2BaPdgfrαgydF4y2Ba而且gydF4y2BaPdgfrβgydF4y2Ba)支持EpCAM的祖先特性gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞群,表明EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞可能是Gli1的来源gydF4y2Ba+gydF4y2Ba肝损伤后的肝细胞。gydF4y2Ba
一个gydF4y2Bafacs排序EpCAM的代表性概况gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba, EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2BaGli1-Cre的细胞群gydF4y2BaERt2gydF4y2BaAi9小鼠scRNA-seq。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Bat-随机邻居包埋(tSNE)图的527个单个细胞分离gydF4y2Ba一个gydF4y2Ba(点)。gydF4y2BadgydF4y2Ba通过scRNA-seq测定显示EpCAM和tdTomato表达的小提琴图。E + G−EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba, E−G+ EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba, E+G+ EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba, H1肝细胞。gydF4y2BaegydF4y2BascRNA-seq数据的热图显示了4个不同簇的富集基因。gydF4y2BafgydF4y2Ba小提琴图显示了通过scRNA-seq确定的特定谱系相关基因的表达。gydF4y2BaggydF4y2BaEpCAM GO注释gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞。gydF4y2BahgydF4y2BaEpCAM中显著富集的信号通路gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba使用BioCarta GSEA基因集对细胞进行鉴定。gydF4y2BaPgydF4y2Ba< 0.05。E + G−EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba, E−G+ EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba, E+G+ EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba, H1肝细胞。gydF4y2Ba
Gli1gydF4y2Ba+gydF4y2Ba双表型细胞在慢性肝损伤后产生新生肝细胞gydF4y2Ba
实现EpCAM的具体标注gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba在细胞中,我们生成了两个不同的小鼠品系:EpCAM-CregydF4y2BaERt2gydF4y2Ba和Gli1-DregydF4y2BaERt2gydF4y2Ba老鼠。的EpCAM-CregydF4y2BaERt2gydF4y2Ba将小鼠与Ai9报告鼠交叉,生成EpCAM-CregydF4y2BaERt2gydF4y2BaAi9鼠标(补充图;gydF4y2BaS6agydF4y2Ba).TAM诱导导致Cre-loxP重组,从而导致EpCAM的永久标记gydF4y2Ba+gydF4y2Ba细胞和它们的后代。为了检测tdTomato在成人组织中的表达,我们对8周大的EpCAM-Cre进行了处理gydF4y2BaERt2gydF4y2BaAi9小鼠TAM, 7天后采集组织样本进行分析(补充图;gydF4y2BaS6bgydF4y2Ba).EpCAM的大部分gydF4y2Ba+gydF4y2Ba细胞为tdTomatogydF4y2Ba+gydF4y2Ba和tdTomato的百分比gydF4y2Ba+gydF4y2BaEpCAMgydF4y2Ba+gydF4y2Ba为95.26%(补充图;gydF4y2BaS6cgydF4y2Ba).相反,免疫染色显示21.96%的EpCAMgydF4y2Ba+gydF4y2Ba在肝脏中表达tdTomato的细胞(补充图。gydF4y2BaS6dgydF4y2Ba).双重组酶介导的遗传方法显著提高了体内谱系追踪的精度,以及基因操作。然而,这种方法受到Cre和Dre重组酶标记效率的限制。由于EpCAM-Cre的标记效率gydF4y2BaERt2gydF4y2Ba在肝脏中不高,我们没有尝试构建EpCAM-DregydF4y2BaERt2gydF4y2Ba老鼠。我们需要找到一个与EpCAM具有相同表达模式的基因,并可以取代EpCAM在双重组酶系统中使用。跨膜蛋白酶丝氨酸2 (Tmprss2)是一个70 kda的丝氨酸蛋白酶家族成员,与消化、组织重塑、凝血、生育、炎症反应、肿瘤细胞侵袭和凋亡等生理和病理过程相关gydF4y2Ba32gydF4y2Ba.gydF4y2BaTmprss2gydF4y2BamRNA在很多组织中都有表达,包括前列腺、乳房、肝脏和肺。Tmprss2蛋白和mRNA主要表达于上皮细胞gydF4y2Ba32gydF4y2Ba.在肝脏中,使用Tmprss2-Cre进行谱系追踪研究gydF4y2BaERt2gydF4y2BaR26-YFP小鼠显示Tmprss2蛋白定位于两种主要的上皮细胞类型:肝细胞和导管细胞(补充图。gydF4y2BaS6egydF4y2Ba).最近的研究表明Tmprss2在TROP2中特异共表达gydF4y2Ba+gydF4y2Ba使用scRNA-seq和FISH检测人肝组织中的肝祖细胞gydF4y2Ba33gydF4y2Ba.结果表明,Tmprss2特异性存在于具有胆管细胞命运偏倚的肝祖细胞中。基于这些数据gydF4y2BaTmprss2gydF4y2Ba可以利用该基因来解决Gli1的标记问题gydF4y2Ba+gydF4y2Babiphenotypic细胞。用于Tmprss2的沿袭跟踪gydF4y2Ba+gydF4y2Ba细胞时,我们生成了一个新的小鼠系(Tmprss2-DregydF4y2BaERt2gydF4y2Ba),以编码Dre蛋白的cDNA为靶标gydF4y2BaTmprss2gydF4y2Ba基因位点取代了内源性翻译起始密码子ATG,随后是土拨鼠转录后调控元件(WPRE)和polyA序列。的Tmprss2-DregydF4y2BaERt2gydF4y2Ba将小鼠与R26-RSR-tdTomato报告小鼠杂交,生成Tmprss2-DregydF4y2BaERt2gydF4y2BaR26-RSR-tdTomato小鼠(图;gydF4y2Ba5gydF4y2Ba).TAM诱导导致Dre-loxP重组,从而导致Tmprss2的永久标记gydF4y2Ba+gydF4y2Ba细胞及其所有后代(图;gydF4y2Ba5 bgydF4y2Ba).Tmprss2-Dre免疫染色gydF4y2BaERt2gydF4y2Bar26 - rsr -td番茄肝脏切片EpCAM表达63.08%gydF4y2Ba+gydF4y2Ba细胞为tdTomatogydF4y2Ba+gydF4y2Ba(无花果。gydF4y2Ba5度gydF4y2Ba).tdTomato染色是特异性的,因为我们没有在油处理的Tmprss2-Dre收集的组织中检测到它gydF4y2Ba呃gydF4y2BaR26-RSR-tdTomato小鼠(补充图;gydF4y2BaS6fgydF4y2Ba).实现Gli1的特异性标记gydF4y2Ba+gydF4y2BaTmprss2gydF4y2Ba+gydF4y2Ba细胞中,我们杂交了Tmprss2-DregydF4y2BaERt2gydF4y2Ba和Gli1-CregydF4y2BaERt2gydF4y2Ba用双重组酶介导的tdTomato报告基因(Ai66)转染小鼠,生成Gli1-CregydF4y2BaERt2gydF4y2Ba; Tmprss2-DregydF4y2BaERt2gydF4y2BaAi66小鼠系(图;gydF4y2Ba5 dgydF4y2Ba).TAM诱导两周后,从Gli1-Cre中收集肝脏gydF4y2BaERt2gydF4y2Ba; Tmprss2-DregydF4y2BaERt2gydF4y2BaAi66小鼠分析(图;gydF4y2Ba5 egydF4y2Ba).肝切片HNF4α、KRT19或EpCAM免疫染色显示0.042%的EpCAM阳性gydF4y2Ba+gydF4y2Ba细胞为tdTomatogydF4y2Ba+gydF4y2Ba而HNF4α肝细胞和KRT19gydF4y2Ba+gydF4y2Ba细胞为tdTomatogydF4y2Ba−gydF4y2Ba(无花果。gydF4y2Ba5 f, ggydF4y2Ba),显示EpCAM+细胞的选择性标记。流式细胞术分析显示~0.023%的EpCAMgydF4y2Ba+gydF4y2Ba用tdTomato标记细胞(图;gydF4y2Ba5 hgydF4y2Ba).我们还检查了窝友对照(Gli1-Cre)gydF4y2BaERt2gydF4y2BaAi66或Tmprss2-DregydF4y2BaERt2gydF4y2Ba;Ai66),并进行相同的TAM诱导策略和免疫染色进行后续分析。两组都没有tdTomatogydF4y2Ba+gydF4y2Ba结果表明,tdTomato的表达需要Cre和Dre的双重重组。综上所述,这些数据证明了成功生成了靶向Gli1的遗传工具gydF4y2Ba+gydF4y2BaTmprss2gydF4y2Ba+gydF4y2Ba肝脏中的细胞。研究Gli1的动力学gydF4y2Ba+gydF4y2BaTmprss2gydF4y2Ba+gydF4y2Ba肝脏损伤后,我们给Gli1-Cre喂食gydF4y2BaERt2gydF4y2Ba; Tmprss2-DregydF4y2BaERt2gydF4y2Ba用DDC饮食诱导Ai66小鼠TAM诱导后肝损伤。4周后,收集肝组织进行分析(图2)。gydF4y2Ba5我gydF4y2Ba).我们观察到tdTomato的特异性标注gydF4y2Ba+gydF4y2BaHNF4αgydF4y2Ba+gydF4y2Ba损伤肝脏内的肝细胞(图;gydF4y2Ba5 jgydF4y2Ba).此外,我们还利用EpCAM-Cre进行了遗传谱系追踪实验gydF4y2BaERt2gydF4y2BaAi9或PDGFRα-CregydF4y2BaERt2gydF4y2BaAi9小鼠给予TAM。14 d后采用DDC诱导肝损伤。与Gli1-Cre的发现一致gydF4y2BaERt2gydF4y2BaAi9小鼠,我们也观察到tdTomato的一个子集gydF4y2Ba+gydF4y2Ba肝脏中HNF4α共染色的细胞(补充图。gydF4y2BaS6igydF4y2Ba).定量分析显示~0.059%或~0.075%的tdTomatogydF4y2Ba+gydF4y2Ba细胞分别表达HNF4α(补充图;gydF4y2BaS6h jgydF4y2Ba).综上所述,这些数据表明Gli1gydF4y2Ba+gydF4y2BaTmprss2gydF4y2Ba+gydF4y2Ba有助于ddc诱导损伤后新生肝细胞的产生。gydF4y2Ba
一个gydF4y2Ba使用Tmprss2-Dre进行Dre-rox重组的谱系跟踪策略示意图gydF4y2BaERt2gydF4y2Ba; R26-RSR-tdTomato老鼠。gydF4y2BabgydF4y2Ba实验设计示意图。gydF4y2BacgydF4y2BaTmprss2-Dre肝切片tdTomato(红色)和EpCAM(绿色)免疫染色gydF4y2Ba呃gydF4y2BaR26-tdTomato小鼠及tdTomato百分比的定量gydF4y2Ba+gydF4y2BaEpCAM中的细胞gydF4y2Ba+gydF4y2Ba细胞。PV门静脉。比例尺,50 μm。数据以均值±SEM (gydF4y2BangydF4y2Ba= 5)。gydF4y2BadgydF4y2Ba使用Gli1-Cre进行Dre-rox和Cre-loxP重组的谱系追踪策略示意图gydF4y2BaERt2gydF4y2Ba; Tmprss2-DregydF4y2BaERt2gydF4y2Ba; Ai66老鼠。gydF4y2BaegydF4y2Ba实验设计示意图。gydF4y2BafgydF4y2BaGli1-Cre肝切片中tdTomato(红色)和HNF4α(绿色)、KRT19(绿色)或EpCAM(绿色)的免疫染色gydF4y2BaERt2gydF4y2Ba; Tmprss2-DregydF4y2BaERt2gydF4y2Ba; Ai66老鼠。比例尺,50 μm。gydF4y2BaggydF4y2BatdTomato百分比的量化gydF4y2Ba+gydF4y2BaEpCAM中的细胞gydF4y2Ba+gydF4y2Ba, KRT19gydF4y2Ba+gydF4y2Ba或HNF4αgydF4y2Ba+gydF4y2Ba细胞。数据以均值±SEM (gydF4y2BangydF4y2Ba= 5)。gydF4y2BahgydF4y2Ba流式细胞术分析tdTomato百分比gydF4y2Ba+gydF4y2Ba细胞。gydF4y2Ba我gydF4y2Ba实验设计示意图。gydF4y2BajgydF4y2BaGli1-Cre肝切片tdTomato(红色)和HNF4α(绿色)免疫染色gydF4y2BaERt2gydF4y2Ba; Tmprss2-DregydF4y2BaERt2gydF4y2BaAi66小鼠ddc损伤后。比例尺,50 μm。gydF4y2Ba
EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞在体外可形成肝类器官并分化为功能性肝细胞gydF4y2Ba
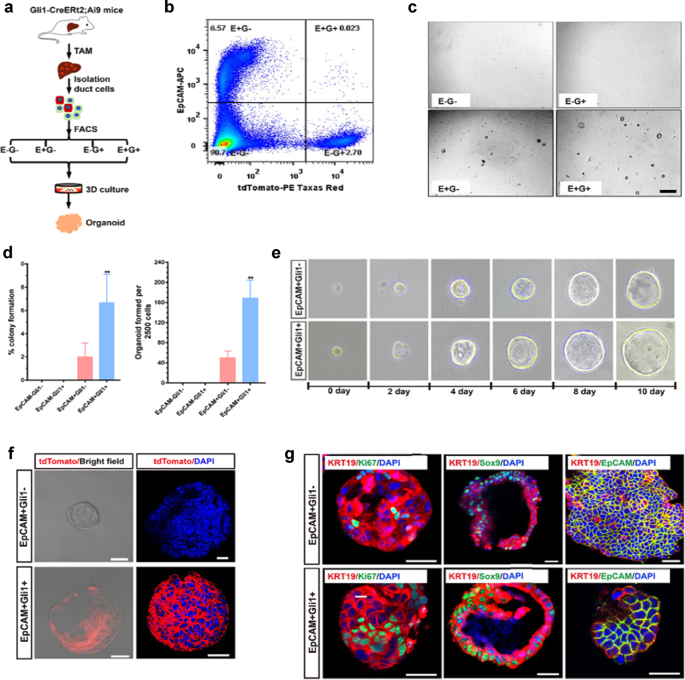
接下来我们对EpCAM进行功能分析gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba肝类器官形成中的细胞群。我们分离了EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba, EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba, EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba和EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba−gydF4y2BaGli1-Cre细胞gydF4y2BaERt2gydF4y2Ba注射TAM 2周后Ai9小鼠肝脏,评估其类器官形成效率(图;gydF4y2Ba6 a、bgydF4y2Ba;补充图。gydF4y2BaS7agydF4y2Ba).我们找到了EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba与EpCAM相比,细胞表现出三倍的肝脏类器官形成效率gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba细胞,而EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba和EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞没有形成类器官(图;gydF4y2Ba6 c, dgydF4y2Ba).培养第10天,EpCAM的类器官形成效率gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba分别为2%±0.98%和6.67%±1.99%(图;gydF4y2Ba6 dgydF4y2Ba;补充图。gydF4y2BaS7bgydF4y2Ba).为了确定培养的类器官的细胞来源,我们对tdTomato进行了免疫荧光染色。我们很容易在EpCAM培养的全装类器官中检测到tdTomato荧光gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞(图。gydF4y2Ba6 fgydF4y2Ba).来自EpCAM的类器官gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞在形态上类似于以前来源于胆管细胞的肝类器官gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba并允许串行传输(图。gydF4y2Ba6 egydF4y2Ba).传代后,两组间类器官形成效率无明显差异。免疫荧光染色显示EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba- - - - - -gydF4y2Ba和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba类器官表达导管细胞标记如KRT19,祖细胞标记如Sox9(图2)。gydF4y2Ba6克gydF4y2Ba).此外,类器官中Ki67的免疫组化分析显示许多Ki67阳性细胞(图。gydF4y2Ba6克gydF4y2Ba),而类器官未表达成熟的肝细胞标志物,如Alb或HNF4α。为了进一步验证这些结果,我们对EpCAM进行了排序gydF4y2Ba−gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba, EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba, EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba,以及EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba从Gli1-LacZ小鼠肝脏中提取细胞群,并在体外培养5天后评估类器官形成(补充图。gydF4y2BaS7c dgydF4y2Ba).一致地,我们观察到只有EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞可以形成类器官和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞表现出最高的类器官形成效率(补充图。gydF4y2BaS7e-ggydF4y2Ba).这些结果表明,EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞群是一种新型的LPC,在体外表现出双细胞系特征。gydF4y2Ba
一个gydF4y2Ba来自EpCAM的类器官发育示意图gydF4y2Ba−gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba, EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba, EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba采用流式细胞仪对单细胞进行分类。gydF4y2BabgydF4y2Ba来自Gli1- cre的EpCAM和Gli1在肝脏中的表达的FACS图gydF4y2BaERt2gydF4y2BaTAM诱导后Ai9小鼠。gydF4y2BacgydF4y2BaEpCAM的代表性亮场图像gydF4y2Ba−gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba, EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba, EpCAMgydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞作为肝类器官培养3天。原始放大倍数:10倍。gydF4y2BadgydF4y2Ba集落形成效率的百分比(左)和每2500个单细胞形成的类器官的数量(右)。数据以均值±SEM (gydF4y2BangydF4y2Ba= 3)。**gydF4y2BaPgydF4y2Ba< 0.01。gydF4y2BaegydF4y2Ba初始单种子EpCAM的代表图像gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞在3D培养中维持10天。原始放大倍数分别为40×(天0-4)、20×(天6-8)、10×(天10)。gydF4y2BafgydF4y2Ba在EpCAM生成的类器官中,tdTomato(红色)的全贴装类器官免疫荧光染色gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞gydF4y2Ba.gydF4y2Ba比例尺,50 μm。gydF4y2BaggydF4y2Ba免疫荧光染色KRT19(红色)和Sox9(绿色),EpCAM(绿色)或Ki67(绿色)在EpCAM产生的类器官中gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞。比例尺,50 μm。gydF4y2Ba
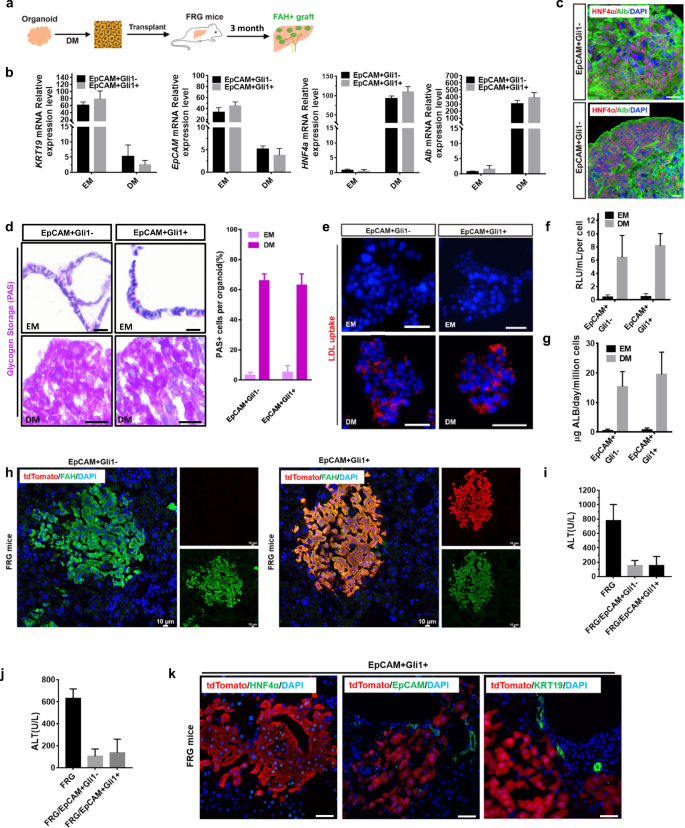
确定类器官分化为成熟肝细胞的能力,EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞来源的类器官在分化培养基中培养(图;gydF4y2Ba7一个gydF4y2Ba).类器官对肝细胞标记物Alb和HNF4α呈阳性,但对胆管细胞标记物KRT19和EpCAM呈阴性。gydF4y2Ba7 b, cgydF4y2Ba).此外,从EpCAM分化的类器官gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞有能力积累糖原和摄取低密度脂蛋白在体外(图。gydF4y2Ba7 d, egydF4y2Ba).肝细胞的肝功能,如白蛋白分泌和CYP3A4激活,在分化培养基中显著增加(图。gydF4y2Ba7 f, ggydF4y2Ba).这些结果表明,EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞有向肝细胞谱系分化的潜力。gydF4y2Ba
一个gydF4y2Ba实验设计示意图。gydF4y2BabgydF4y2BaRT-qPCR分析gydF4y2BaKrt19gydF4y2Ba,gydF4y2BaEpCAMgydF4y2Ba,gydF4y2Ba铝青铜gydF4y2Ba,gydF4y2BaHNF4αgydF4y2Ba在膨胀介质(EM)或分化介质(DM)中进行。数据表示为均值±SEM (gydF4y2BangydF4y2Ba= 3)。gydF4y2BacgydF4y2Ba肝细胞标记基因的免疫荧光分析gydF4y2Ba铝青铜gydF4y2Ba(绿色)或gydF4y2BaHNF4αgydF4y2Ba(红色)DM。比例尺,50 μm。gydF4y2BadgydF4y2Ba在EM或DM中生长12天的类器官中,糖原积累通过周期性酸-希夫(PAS)染色测定。比例尺,50 μm。gydF4y2BaegydF4y2Ba在EM或DM中维持12天的类器官中,使用LDL荧光底物(红色)分析LDL摄取。比例尺,50 μm。gydF4y2BafgydF4y2Ba白蛋白分泌在EM或DM持续12天。数据以均值±SEM (gydF4y2BangydF4y2Ba= 3)。gydF4y2BaggydF4y2Ba在EM或DM中测量CYP3A4细胞色素活性12天。相对光单位(RLUs)每毫升每百万细胞显示。数据以均值±SEM (gydF4y2BangydF4y2Ba= 3)。gydF4y2BahgydF4y2BaFAH(绿色)和tdTomato(红色)的免疫荧光染色显示FAH的植入gydF4y2Ba+gydF4y2Ba移植后3个月FRG受体肝脏的肝细胞。比例尺,10 μm。gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba移植后3个月测定血清ALT和AST水平。数据以均值±SEM (gydF4y2BangydF4y2Ba= 3)。gydF4y2BakgydF4y2Ba移植后3个月tdTomato(红色)和HNF4α(绿色)、KRT19(绿色)、EpCAM(绿色)的免疫荧光染色。比例尺,50 μm。gydF4y2Ba
肝细胞由EpCAM分化gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba移植后,类器官能有效地重新填充FRG肝脏gydF4y2Ba
为了评估分化的类器官细胞能否在体内移植和修复损伤的肝组织,我们使用了FRG (FahgydF4y2Ba−−/gydF4y2BaRag2gydF4y2Ba−−/gydF4y2BaIL2rggydF4y2Ba−−/gydF4y2Ba老鼠)gydF4y2Ba36gydF4y2Ba.肝细胞由EpCAM分化gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba或EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba类器官经酶消化成单细胞后,经脾注射移植到FRG小鼠体内。随后,我们在移植后3个月用FAH染色分析了移植。3个月时,FAH和tdTomato的免疫染色显示有明显的移植物(图。gydF4y2Ba7小时gydF4y2Ba).移植后两组患者血清谷草转氨酶(ALT)、谷丙转氨酶(AST)水平显著降低(EpCAM之间差异无统计学意义)gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba和EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba),进一步证实了这些小鼠肝功能的改善(图。gydF4y2Ba7 i, jgydF4y2Ba).接下来,我们对EpCAM是否gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞在体内进一步成熟。免疫荧光染色显示tdTomatogydF4y2Ba+gydF4y2Ba维持HNF4α的表达,KRT19和EpCAM的表达减少(图2)。gydF4y2Ba7 kgydF4y2Ba).这些数据表明,肝细胞由EpCAM分化而来gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba类器官有效地重新填充了FRG小鼠的肝脏。gydF4y2Ba
讨论gydF4y2Ba
肝脏是最大和最重要的代谢器官之一,在损伤后表现出非常高的再生潜力gydF4y2Ba5gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.肝细胞是肝脏生理功能的主要功能细胞类型。因此,新肝细胞的细胞来源一直是损伤后肝再生研究的重点。肝脏再生能力主要基于两种主要上皮细胞类型:肝细胞和胆管细胞的自我复制能力gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.在急性和慢性损伤模型中,这两种细胞群停止静止并复制以补偿失去的功能性实质。谱系追踪研究表明,肝细胞通过转分化促进胆道上皮再生gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.同样,当肝细胞严重损伤时,胆道上皮细胞也可转化为肝细胞gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.这些数据表明,肝细胞和胆管细胞的可塑性有助于损伤后的肝脏再生。然而,非上皮细胞,包括间充质细胞和免疫细胞,在肝脏再生中的作用仍不完全清楚。导管周围的间充质细胞不仅影响祖细胞的分化,而且有助于祖细胞的居群gydF4y2Ba40gydF4y2Ba.造血干细胞是肝脏特异性间充质细胞,在肝脏生理和纤维化过程中发挥作用gydF4y2Ba41gydF4y2Ba.以往对造血干细胞的研究主要集中在与肝纤维化的关系上;近年来,有研究表明,造血干细胞在肝再生过程中对肝细胞的增殖、分化和成熟具有重要作用gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba.尽管体外培养实验和移植提供了造血干细胞具有双性的证据,但其在体内的谱系潜力需要进一步评估。在这项研究中,我们发现了一个新的Gli1gydF4y2Ba+gydF4y2Ba在慢性损伤期间,间充质样细胞群有助于新肝细胞的生成。我们发现Gli1gydF4y2Ba+gydF4y2Ba肝脏中的细胞是由PDGFRα组成的异质群体gydF4y2Ba+gydF4y2Ba基质细胞和EpCAM的一小部分gydF4y2Ba+gydF4y2Ba细胞。scRNA-seq显示EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞呈现双表型状态,共同表达上皮标记和间充质标记。这一发现与之前的一项工作一致,该工作表明Gli1的一小部分gydF4y2Ba+gydF4y2Ba胆道上皮细胞标志物EpCAM阳性gydF4y2Ba43gydF4y2Ba.值得注意的是,EpCAMgydF4y2Ba+gydF4y2Ba细胞通常被认为是潜在的肝干细胞gydF4y2Ba5gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,表示EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞可能是Gli1的来源gydF4y2Ba+gydF4y2Ba肝损伤后的肝细胞。gydF4y2Ba
当肝细胞和胆管细胞严重受损时,LPCs可能通过产生新的肝细胞来促进肝再生gydF4y2Ba5gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.然而,由于不同谱系追踪研究得到的结果不一,LPCs的存在、起源、命运、激活以及对肝脏再生的贡献存在争议gydF4y2Ba15gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba.毫无疑问,lpc特异性标记的鉴定将极大地推进这一领域。既往研究表明间充质标记物Foxl1可能是兼性LPCs的标记物,兼性LPCs在肝损伤后可产生肝细胞和胆道细胞gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba50gydF4y2Ba.然而,应该强调的是gydF4y2BaFoxl1gydF4y2Ba基因在损伤之前没有表达,因此不能用来预标记肝脏再生过程中出现的细胞。此外,Foxl1的克隆性和分化潜力gydF4y2Ba+gydF4y2Ba细胞尚未在体外得到验证。scRNA-seq最近证明了EpCAMgydF4y2Ba+gydF4y2BaTROP2gydF4y2BaintgydF4y2Ba种群是成年人肝脏中的一个假定的祖种群,可能参与肝脏再生gydF4y2Ba8gydF4y2Ba.然而,直接证据表明,TROP2gydF4y2Ba+gydF4y2Ba在体内,肝再生过程中产生新的肝细胞的细胞仍然缺乏。我们的数据表明,Gli1和EpCAM识别了存在于健康肝脏中的特定细胞群,可以在体外扩增为上皮类器官,并在体内和体外都分化为功能性肝细胞。EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞是潜在的LPC,有助于肝脏修复和再生。因此,Gli1和EpCAM可以作为筛选lpc的标志物。gydF4y2Ba
上皮-间充质转化(epithelial-mesenchymal transition, EMT)在多种组织器官的分化过程中起着至关重要的作用gydF4y2Ba51gydF4y2Ba.EMT也有助于组织修复,但会导致器官纤维化。初级EMT之后是分化事件,产生不同的细胞类型。间充质状态与细胞迁移到损伤部位并保持干性的能力有关,允许它们在发育和转移开始期间分化为多种细胞类型gydF4y2Ba52gydF4y2Ba.在肝脏中,LPCs在慢性肝损伤时能够进行EMT,增加了EMT参与肝脏再生的可能性gydF4y2Ba53gydF4y2Ba.先前的研究也表明LPCs表现出上皮-间充质谱系的特征,通过上皮-间充质谱系可以修复受损的肝脏gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba54gydF4y2Ba.我们还发现了EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞表现出双表型状态,共同表达上皮和间充质标记,与EMT相关。Gli1在LPCs中的表达可能对获得间充质特征很重要,如增强的运动能力和侵袭性,促进祖细胞迁移到肝损伤部位。gydF4y2Ba
血管周的Gli1gydF4y2Ba+gydF4y2Bamsc样细胞可能起源于肌成纤维细胞,并在损伤后实体器官(包括肝脏)的纤维化中发挥核心作用;消融这些细胞可以缓解纤维化并恢复器官功能gydF4y2Ba27gydF4y2Ba.尽管Gli1的功能在成人组织中并非不可或缺,但Gli1gydF4y2Ba+gydF4y2Ba细胞表现出MSC特性并形成周细胞生态位gydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba.基因命运追踪实验揭示Gli1gydF4y2Ba+gydF4y2Ba细胞是器官损伤后肌成纤维细胞的主要来源gydF4y2Ba27gydF4y2Ba.Gli1基因消融gydF4y2Ba+gydF4y2Ba细胞改善纤维化并挽救器官功能gydF4y2Ba27gydF4y2Ba,gydF4y2Ba57gydF4y2Ba.此外,Gli1gydF4y2Ba+gydF4y2Ba细胞被认为是支持颅骨骨转换和颅骨缝合损伤的干细胞gydF4y2Ba58gydF4y2Ba.Gli1gydF4y2Ba+gydF4y2Ba细胞是产生wnt的干细胞生态位的组成部分,也在结肠上皮干细胞的自我更新中发挥重要作用gydF4y2Ba59gydF4y2Ba.此外,其他证据表明Gli1gydF4y2Ba+gydF4y2Ba在不同年龄的肾上腺皮质中,囊状干细胞能够向类固醇源性谱系转化gydF4y2Ba60gydF4y2Ba.在我们的研究中,我们发现了一种罕见的表达Gli1的细胞亚群,这些Gli1gydF4y2Ba+gydF4y2Ba细胞在肝损伤后可产生肝细胞并参与肝再生过程。总的来说,我们的结果为Gli1的异质性提供了证据gydF4y2Ba+gydF4y2Ba这些细胞在肝损伤后同时发挥不利和有利的作用。gydF4y2Ba
在本研究中,我们发现了一种新的罕见的既表达Gli1又表达EpCAM的祖细胞群,这些细胞可以在慢性肝病发生后立即参与肝脏修复过程。因此,探索这些细胞调控肝脏修复过程的机制至关重要。由于gli1特异性抗体尚不存在,因此探索肝脏中的细胞表面蛋白,将有助于我们新发现的细胞的容易鉴定,有助于人类肝脏再生的研究。总的来说,EpCAM的基因证据gydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba肝脏修复中的细胞为肝脏疾病和再生的细胞和分子机制提供了新的见解。gydF4y2Ba
材料与方法gydF4y2Ba
老鼠实验gydF4y2Ba
所有动物实验均按照中国科学院上海生物化学与细胞生物学研究所分子细胞科学卓越中心机构动物护理与使用委员会的指导方针进行。动物被安置在生物化学和细胞生物学研究所的特定无病原体设施中,并在标准条件下饲养,昼夜周期为12小时,可自由获得食物和水。使用以下基因型和品系的雌性和雄性(8-10周龄)小鼠:Gli1-LacZ(杰克逊实验室,库存# 008211,以C57BL/6为背景),Gli1-CregydF4y2BaERt2gydF4y2Ba(杰克逊实验室,库存编号007913,在C57BL/6背景上维护),B6。Cg -gydF4y2BaGt (ROSA) 26琼gydF4y2Batm9 Hze (CAG-tdTomato)gydF4y2Ba/J (Ai9)(杰克逊实验室,库存# 007909,维持在C57BL/6背景上),R26-YFP(杰克逊实验室,库存# 006148,维持在C57BL/6背景上),HNF4α-DregydF4y2BaERt2gydF4y2Ba、R26-RSR-tdTomato和Ai66报告小鼠(在129×1/SvJ后台维护)gydF4y2Ba14gydF4y2Ba,gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba, Tmprss2-CregydF4y2BaERt2gydF4y2Ba(在129×1/SvJ后台维护)gydF4y2Ba63gydF4y2Ba.FRG小鼠(来源于王鑫博士,维持在混合C57BL/6 J和129S6/SvEvTac背景下)gydF4y2Ba36gydF4y2Ba.EpCAM-CregydF4y2BaERt2gydF4y2Ba小鼠系由上海模式生物中心采用CRISPR/Cas9方法生成。简而言之,一个编码Cre重组酶的cDNA与雌激素受体激素结合域(Cre)的突变形式融合gydF4y2BaERt2gydF4y2Ba的翻译起始密码子ATGgydF4y2BaEpCAMgydF4y2Ba基因通过同源重组。的Tmprss2-DregydF4y2BaERt2gydF4y2Ba使用类似的方法生成小鼠,并引入2A-CregydF4y2BaERt2gydF4y2Ba导入卡带的转译起始密码子ATGgydF4y2BaTmprss2gydF4y2Ba基因。为了诱导所有Cre-和dre -重组酶模型,将TAM (Sigma)与玉米油(Sigma)稀释,以产生TAM:玉米油的混合物,浓度为20 mg/mL。8 ~ 10周龄小鼠连续3天腹腔注射200 μg/g体重诱导重组。所有谱系追踪实验都代表最小值gydF4y2BangydF4y2Ba= 5只老鼠。gydF4y2Ba
损伤模型gydF4y2Ba
为了诱导肝损伤,小鼠分别饲喂添加0.1% (w/w) DDC的饲粮4 ~ 12周或CDE和MCD 3 ~ 4周。CCl的gydF4y2Ba4 gydF4y2Ba小鼠腹腔注射单剂量1 mL/kg体重的CClgydF4y2Ba4 gydF4y2Ba.对于CClgydF4y2Ba4 gydF4y2Ba慢性损伤模型,CClgydF4y2Ba4 gydF4y2Ba以玉米油1:3溶解,每3天腹腔注射1 mL/g体重,连续注射10次。2 / 3的PH在2%异氟醚麻醉下进行,如前所述,中位剖腹探查后切除左外侧和中位叶gydF4y2Ba64gydF4y2Ba.术后24、48 h对小鼠实施安乐死。gydF4y2Ba
免疫荧光和β-gal染色gydF4y2Ba
新鲜解剖的小鼠肝脏在4%多聚甲醛中4°C固定1小时。固定后,PBS洗涤3次,4℃30%蔗糖脱水过夜,10月包埋,取冷冻切片(10 μm),室温风干。为了染色,干燥切片在PBS中洗涤,然后在室温下用1% BSA和0.05% Triton X-100在PBS中阻塞30分钟。切片在4°C下与补充表中所列的一抗孵育过夜gydF4y2BaS1gydF4y2Ba.使用荧光染料偶联二抗(Alexa Fluor 488, Alexa Fluor 555和Alexa Fluor 657;英杰公司)。切片用DAPI(4 ',6-二氨基-2-苯基吲哚)染色,用Aqua-Ploy/mount (Polysciences)安装。免疫染色图像采用Olympus荧光显微镜(BX53)和Leica TCS SP8共聚焦显微镜。使用ImageJ软件对采集的图像进行分析。gydF4y2Ba
为了检测β-gal活性,切片在含有2 mM MgCl的0.1 M PBS溶液中漂洗gydF4y2Ba2gydF4y2Ba, 0.02% NP-40, 0.01% na -脱氧胆酸盐,pH 7.4),三次,在预热过滤的X-gal染色液中孵育(洗涤液中添加5 mM KgydF4y2Ba3.gydF4y2Ba铁(CN)gydF4y2Ba6克ydF4y2Ba, 5 mM KgydF4y2Ba4 gydF4y2Ba铁(CN)gydF4y2Ba6克ydF4y2Ba,和1 mg/mL X-gal)在37°C的黑暗中过夜。在光镜组织学检查之前,按照标准方案用核快速红染色液对部分玻片进行反染色。gydF4y2Ba
立方清理gydF4y2Ba
CUBIC按先前报道的方法进行gydF4y2Ba65gydF4y2Ba,gydF4y2Ba66gydF4y2Ba.简单地说,将甲醛固定的肝脏切除成组织块(3-5 mm × 3-5 mm),然后用PBS冲洗。将这些肝块浸泡在5ml 50% (v/v) CUBIC-L试剂中(1:1的水:CUBIC-L混合物)1天,并进一步浸泡在5ml CUBIC-L试剂中5天。接下来,这些肝脏用PBS冲洗1天,并浸泡在5ml CUBIC-R+试剂中4天。肝脏荧光图像由LiTone XL光片显微镜(LiT)获取。gydF4y2Ba
肝脏瀑样gydF4y2Ba
Gli1-cre的肝脏gydF4y2BaERt2gydF4y2BaAi9和Gli1-LacZ小鼠在8-10周龄时收集,如前所述,使用disase II、胶原酶IV和Dnase I加工成单细胞悬液gydF4y2Ba67gydF4y2Ba.EpCAMgydF4y2Ba+gydF4y2Ba和Gli1gydF4y2Ba+gydF4y2Ba(tdTomatogydF4y2Ba+gydF4y2Ba或CUGgydF4y2Ba+gydF4y2Ba)细胞经FACS分选鉴定。为了分选和定量,使用以下抗体:EpCAM-APC (eBioscience,克隆G8.8, 1:500)。分离的阳性细胞与Matrigel (BD Bioscience)混合,按照前面所述进行种子和培养gydF4y2Ba21gydF4y2Ba.膨胀培养基以Advanced DMEM/F12培养基为基础,添加10 mM HEPES (Gibco)、2 nM GlutaMAX-1 (Gibco)、500× primocin (InvivoGen)、1× B27 (Gibco)、1.56 mMgydF4y2BaNgydF4y2Ba-乙酰半胱氨酸(Sigma), 10 mM烟酰胺(Sigma), 0.5 μM A83-01 (Tocris), 10 μM Y27632 (Selleck), 50 ng/mL EGF (PeproTech), 10 ng/mL FGF10 (PeproTech), 1 ng/mL FGF2 (PeproTech),自制R-Spondin(10%)和Noggin(10%)条件培养基。为了增强肝细胞的细胞命运,单细胞来源的肝类器官被播种并在肝扩张培养基中保存2-4天。然后将培养基改为分化培养基:高级DMEM/F12培养基中添加50 ng/mL EGF、10 mM HEPES、2 mM GlutaMAX-1、500× primocin、1× B27、10 μM Y27632、10 μM DAPT (Selleck)、25 ng/mL BMP7 (PeproTech)、25 ng/mL HGF (PeproTech)和20 ng/mL Oncostatin M (R&D)。对于移植和体外功能研究,分化的最后3天还补充地塞米松(30 mM)。培养基每隔一天更换一次,为期9-14天。gydF4y2Ba
类器官功能分析gydF4y2Ba
为了获得糖原的存储,分化培养基中的类器官被石蜡包埋。切片(4 μm)按照生产厂家说明书使用PAS染色试剂盒(Solarbio)进行切割和染色。使用低密度脂蛋白摄取细胞基础检测试剂盒(开曼)根据制造商的说明检测低密度脂蛋白摄取。收集培养基,用小鼠白蛋白ELISA试剂盒(Bethyl)检测白蛋白分泌情况。分化培养基中的类器官与3mm的荧光素- ipa孵育过夜,使用P450-Glo测量CYP3A11活性gydF4y2BaTMgydF4y2BaCYP3A4检测系统(Promega)。gydF4y2Ba
RNA分离、逆转录和实时PCRgydF4y2Ba
按照制造商的说明,使用TRIZOl (Invitrogen)从类器官和肝脏中提取总RNA。RNA浓度和纯度通过使用NanoDrop测量260 nm和280 nm波长的光密度(OD)来确定。的ODgydF4y2Ba260/280gydF4y2Ba所有样本的比值为> 1.8和< 2.1。根据制造商的说明,使用ReverTra Ace qPCR RT master Mix with gDNA Remover kit (TOYOBO)将来自类器官和肝脏的总rna (500 ng)转化为cdna。gydF4y2Ba
在含有SYBR Green (Takara) 12.5 μL、模板cDNA 2 μL、引物1 μM(补充表)的25 μL反应体积中进行实时PCRgydF4y2BaS2gydF4y2Ba),使用的是ABI Fast 7500。热循环条件为95°C持续10分钟,然后在94°C持续15秒,60°C持续30秒,72°C持续30秒,循环40次。gydF4y2BaGAPDHgydF4y2Ba用于标准化。每个实验独立重复至少3次,通过2分析每个基因表达的倍数变化gydF4y2Ba−ΔΔCtgydF4y2Ba方法gydF4y2Ba68gydF4y2Ba.gydF4y2Ba
移植试验gydF4y2Ba
FRG小鼠饮用含7.5 mg/L 2-(2-硝基-4-三氟甲基苯甲酰)-1,3环己二酮(NTBC)的饮用水。将8 - 12周龄的雄性和雌性小鼠混合用于移植,未检测到性别偏见差异。用于移植的三个克隆来自三个不同的Gli1-cregydF4y2BaERt2gydF4y2BaAi9小鼠培养至少2个月。培养物在肝扩张培养基中保存,移植前9天转移到分化培养基中。悬挂1 × 10gydF4y2Ba6克ydF4y2BaFRG小鼠脾内注射类器官细胞。移植后小鼠在饮用水中给予NTBC药物4天。然后去除NTBC,每隔一天监测小鼠健康状况和体重。移植后3个月采集移植小鼠肝脏,用FAH抗体染色进行评价。移植后3个月测定移植小鼠肝脏血清AST和ALT。处死小鼠,采血,在12000 rpm下离心10 min,从凝固的血液中分离血清。ALT和AST检测采用Abcam的ALT和AST检测试剂盒。gydF4y2Ba
scRNA-seq文库的制备和测序gydF4y2Ba
如前所述,scRNA-seq库是使用Smart-seq2构造的gydF4y2Ba69gydF4y2Ba.将单细胞分选在96孔板中,其中含有2µL细胞裂解缓冲液(0.2% Triton X-100和RNase抑制剂),1µL oligo-dT引物和1µL dNTP混合物。接下来,我们使用SuperScript II逆转录酶在模板开关寡核苷酸引物(TSO)存在下对多腺苷酸化转录物进行逆转录。双链rt -产物用Kapa Ready Mix (Kapa Biosystems)进行21次PCR扩增,得到完整的转录组扩增产物。扩增产物用VAHTS DNA Clean Beads清洗,QIxcel QC(确认正确的产物大小)和Qubit QC(确定数量)。接下来,使用来自Vazyme的TruePrep DNA library Prep Kit V2 for Illumina生成单细胞文库。每个单细胞文库分别用引物进行PCR编码。用Illumina NextSeq测序仪对条形码单细胞进行汇总和测序。gydF4y2Ba
scRNA-seq数据的处理gydF4y2Ba
首先用trim_galore (TrimGalore-0.5.0)修整原始测序读数,以去除适配器和TSO序列。然后通过STAR (STAR -2.7)将干净的reads映射到小鼠基因组(mus_muscle . grcm38.84)gydF4y2Ba70gydF4y2Ba.featurets (subread-1.6.0-source)gydF4y2Ba71gydF4y2Ba用于生成原始计数。在原始计数的基础上,对各基因的表达水平进行log归一化gydF4y2Ba2gydF4y2Ba(TPM/10 + 1),如前所述gydF4y2Ba72gydF4y2Ba.gydF4y2Ba
scRNA-seq进一步分析gydF4y2Ba
使用R包Seurat (version 3.1.1)进行下游分析和可视化gydF4y2Ba73gydF4y2Ba,gydF4y2Ba74gydF4y2Ba.仅保留> 10细胞表达的基因,保留> 1000基因表达的细胞进行下游分析。执行“FindVariableFeatures”来检测单个细胞中的可变基因(selection.method = " vst ")。FindClusters的关键参数设置为分辨率= 0.05。为了进一步比较EpCAM之间的生物学功能gydF4y2Ba−gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞,EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba−gydF4y2Ba细胞,EpCAMgydF4y2Ba+gydF4y2BaGli1gydF4y2Ba+gydF4y2Ba细胞和肝细胞,metscape (gydF4y2Bahttp://metascape.org/gp/index.htmlgydF4y2Ba)gydF4y2Ba75gydF4y2Ba和GSEAgydF4y2Ba76gydF4y2Ba被执行。DoubletDecon对DoubletDecon进行识别和过滤gydF4y2Ba77gydF4y2Ba和DoubletFindergydF4y2Ba78gydF4y2Ba.gydF4y2Ba
统计分析gydF4y2Ba
所有数据均以均数±SEM表示。结果分析使用单或双向方差分析,其次是最不显著差异tukey检验,和gydF4y2BaPgydF4y2Ba< 0.05为有统计学意义。所有统计分析均采用SPSS 17.0进行。“gydF4y2BangydF4y2Ba”代表了生物学重复的数量,并指出。gydF4y2Ba
参考文献gydF4y2Ba
唐,J.等。动脉Sca1(+)血管干细胞产生新生平滑肌用于动脉修复和再生。gydF4y2Ba细胞干细胞gydF4y2Ba26gydF4y2Ba, 81 - 96。e4(2020).
Joshi, p.a.等人。在小鼠乳腺小叶-肺泡发生过程中,pdgfrα(+)基质脂肪细胞祖细胞转变为上皮细胞。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 1760(2019)。gydF4y2Ba
邓,等。慢性肝损伤诱导胆道上皮细胞转化为肝细胞。gydF4y2Ba细胞干细胞gydF4y2Ba23gydF4y2Ba, 114 - 122。e3(2018)。gydF4y2Ba
瓦尔加,J. & Greten, F. R.细胞可塑性在上皮内稳态和肿瘤发生中的作用。gydF4y2Ba细胞生物学。gydF4y2Ba19gydF4y2Ba, 1133-1141(2017)。gydF4y2Ba
Miyajima, A. Tanaka, M. & Itoh, T.肝发育、稳态、再生和重编程中的干/祖细胞。gydF4y2Ba细胞干细胞gydF4y2Ba14gydF4y2Ba, 561-574(2014)。gydF4y2Ba
多比,R.等人。单细胞转录组学揭示肝纤维化期间间质功能分区。gydF4y2Ba细胞的代表。gydF4y2Ba29gydF4y2Ba, 1832 - 1847。e8(2019)。gydF4y2Ba
麦克帕兰,s.a.等。人类肝脏单细胞RNA测序显示不同的肝内巨噬细胞群。gydF4y2BaCommun Nat。gydF4y2Ba9gydF4y2Ba, 4383(2018)。gydF4y2Ba
Aizarani, N.等。人肝细胞图谱揭示了异质性和上皮祖细胞。gydF4y2Ba自然gydF4y2Ba572gydF4y2Ba, 199-204(2019)。gydF4y2Ba
Takase, h.m.等。FGF7是一种功能性小位信号,用于刺激支持肝脏再生的成人肝祖细胞。gydF4y2BaDev的基因。gydF4y2Ba27gydF4y2Ba, 169-181(2013)。gydF4y2Ba
肝纤维化的发展挑战。gydF4y2Ba胃肠醇。乙醇。gydF4y2Ba7gydF4y2Ba, 425-436(2010)。gydF4y2Ba
Schaub, J. R.等。经由tgf -介导的肝细胞转分化而形成的胆道系统。gydF4y2Ba自然gydF4y2Ba557gydF4y2Ba, 247-251(2018)。gydF4y2Ba
杨格,K.等。健壮的细胞重编程在肝脏再生过程中自发发生。gydF4y2BaDev的基因。gydF4y2Ba27gydF4y2Ba, 719-724(2013)。gydF4y2Ba
Raven, A.等人。在受损的肝细胞再生过程中,胆管细胞充当兼性肝干细胞。gydF4y2Ba自然gydF4y2Ba547gydF4y2Ba, 350-354(2017)。gydF4y2Ba
韩,x等。谱系追踪揭示了SOX9(+)肝细胞在肝再生过程中的双重性。gydF4y2Ba干细胞代表gydF4y2Ba12gydF4y2Ba, 624-638(2019)。gydF4y2Ba
Font-Burgada, J.等。混合门静脉周围肝细胞再生受损肝脏而不引起癌症。gydF4y2Ba细胞gydF4y2Ba162gydF4y2Ba, 766-779(2015)。gydF4y2Ba
陈,F.等。肝细胞增殖在肝脏稳态和再生中的广泛分布。gydF4y2Ba细胞干细胞gydF4y2Ba26gydF4y2Ba,即。e4(2020).
Matsumoto, T., Wakefield, L., Tarlow, B. D. & Grompe, M.多倍体肝细胞体内谱系追踪显示肝再生过程中广泛增殖。gydF4y2Ba细胞干细胞gydF4y2Ba26gydF4y2Ba, 34-47。e3.(2020).
孙,T.等。中心周肝细胞AXIN2(+)对肝脏稳态和再生的贡献有限。gydF4y2Ba细胞干细胞gydF4y2Ba26gydF4y2Ba, 97 - 107。e6(2020).
他,L.等人。增殖示踪显示肝细胞在肝脏内稳态和修复中的局部生成。gydF4y2Ba科学gydF4y2Ba371gydF4y2Ba, eabc4346(2021)。gydF4y2Ba
萨克特,s.d.等人。Foxl1是小鼠双潜能肝祖细胞的标记物。gydF4y2Ba肝脏病学gydF4y2Ba49gydF4y2Ba, 920-929(2009)。gydF4y2Ba
等等。wnt驱动再生诱导Lgr5+肝干细胞体外扩增。gydF4y2Ba自然gydF4y2Ba494gydF4y2Ba, 247-250(2013)。gydF4y2Ba
杨,L.等。肝脏星状细胞是成年小鼠肝脏上皮祖细胞的命运图谱证据。gydF4y2Ba干细胞gydF4y2Ba26gydF4y2Ba, 2104-2113(2008)。gydF4y2Ba
Kordes, C., Sawitza, I., Gotze, S., Herebian, D. & Haussinger, D.肝星状细胞有助于祖细胞和肝脏再生。gydF4y2Baj .中国。投资。gydF4y2Ba124gydF4y2Ba, 5503-5515(2014)。gydF4y2Ba
科德斯,C.等人。CD133+肝星状细胞为祖细胞。gydF4y2Ba物化学。Biophys。Commun >,gydF4y2Ba352gydF4y2Ba, 410-417(2007)。gydF4y2Ba
Kordes, C., Sawitza, I., Gotze, S. & Haussinger, D.肝星状细胞支持造血,是肝脏间充质干细胞。gydF4y2Ba细胞。杂志。物化学。gydF4y2Ba31gydF4y2Ba, 290-304(2013)。gydF4y2Ba
Mendez-Ferrer, S.等人。间充质干细胞和造血干细胞形成了一个独特的骨髓生态位。gydF4y2Ba自然gydF4y2Ba466gydF4y2Ba, 829-834(2010)。gydF4y2Ba
克拉曼,R.等人。血管周围Gli1+祖细胞是损伤性器官纤维化的关键因素。gydF4y2Ba细胞干细胞gydF4y2Ba16gydF4y2Ba, 51-66(2015)。gydF4y2Ba
沃斯利,D. L.等。Gremlin 1鉴定出具有骨、软骨和网状基质潜能的骨骼干细胞。gydF4y2Ba细胞gydF4y2Ba160gydF4y2Ba, 269-284(2015)。gydF4y2Ba
肝再生中的干/祖细胞。gydF4y2Ba肝脏病学gydF4y2Ba64gydF4y2Ba, 663-668(2016)。gydF4y2Ba
毛X, Fujiwara, Y. & Orkin, s.h.改进报告菌株监测Cre重组酶介导的小鼠DNA切除。gydF4y2BaProc。国家的。学会科学。美国gydF4y2Ba96gydF4y2Ba, 5037-5042(1999)。gydF4y2Ba
Okabe, M.等。潜在的肝干细胞存在于正常和损伤小鼠肝脏的EpCAM+细胞中。gydF4y2Ba发展gydF4y2Ba136gydF4y2Ba, 1951-1960(2009)。gydF4y2Ba
安塔利,吴志强,吴志强。膜锚定丝氨酸蛋白酶在健康与疾病中的作用。gydF4y2Ba掠夺。摩尔。杂志。Transl。科学。gydF4y2Ba99gydF4y2Ba, 1-50(2011)。gydF4y2Ba
萧,j.j.w,等。单细胞RNA-seq揭示了TROP2(+)肝祖细胞中血管紧张素转换酶2和跨膜丝氨酸蛋白酶2的表达:在2019年冠状病毒疾病相关肝功能障碍中的意义。gydF4y2Ba前面。地中海。gydF4y2Ba8gydF4y2Ba, 603374(2021)。gydF4y2Ba
等等。成人肝脏基因组稳定双能干细胞的长期培养。gydF4y2Ba细胞gydF4y2Ba160gydF4y2Ba, 299-312(2015)。gydF4y2Ba
Aloia, L.等。表观遗传重塑许可成年胆管细胞的类器官形成和肝脏再生。gydF4y2Ba细胞生物学。gydF4y2Ba21gydF4y2Ba, 1321-1333(2019)。gydF4y2Ba
高丽丽,张震,张鹏,于敏,杨涛。典型刺猬信号通路在肝脏中的作用。gydF4y2BaInt。生物。科学。gydF4y2Ba14gydF4y2Ba, 1636-1644(2018)。gydF4y2Ba
李伟,李丽丽,惠琳。细胞可塑性在肝再生中的作用。gydF4y2Ba细胞生物学趋势。gydF4y2Ba30.gydF4y2Ba, 329-338(2020)。gydF4y2Ba
Ko, S., Russell, J. O., Molina, L. M. & Monga, s.p.肝损伤和修复中的肝祖细胞和成体细胞可塑性:已知和未知。gydF4y2Ba为基础。启分册。gydF4y2Ba15gydF4y2Ba, 23-50(2020)。gydF4y2Ba
土屋,A. & Lu W. Y.肝干细胞:肝上皮的可塑性。gydF4y2Ba世界J.胃肠醇。gydF4y2Ba25gydF4y2Ba, 1037-1049(2019)。gydF4y2Ba
Boulter, L.等人。巨噬细胞来源的Wnt在慢性肝病中反对Notch信号来指定肝祖细胞命运。gydF4y2BaNat,地中海。gydF4y2Ba18gydF4y2Ba, 572-579(2012)。gydF4y2Ba
尹,C, Evason, K. J., Asahina, K. & Stainier, D. Y.肝星状细胞在肝脏发育,再生和癌症中的作用。gydF4y2Baj .中国。投资。gydF4y2Ba123gydF4y2Ba, 1902-1910(2013)。gydF4y2Ba
米凯罗蒂,G. A.等。Smoothened是成人肝脏修复的主要调节剂。gydF4y2Baj .中国。投资。gydF4y2Ba123gydF4y2Ba, 2380-2394(2013)。gydF4y2Ba
Chong Y. C.等。印度刺猬认为肥胖与肝细胞癌的发展有关。gydF4y2Ba致癌基因gydF4y2Ba38gydF4y2Ba, 2206-2222(2019)。gydF4y2Ba
Malato, Y.等人。成熟肝细胞在小鼠肝脏稳态和再生中的命运追踪。gydF4y2Baj .中国。投资。gydF4y2Ba121gydF4y2Ba, 4850-4860(2011)。gydF4y2Ba
Espanol-Suner, R.等。肝祖细胞在小鼠慢性肝损伤中产生功能性肝细胞。gydF4y2Ba胃肠病学gydF4y2Ba143gydF4y2Ba, 1564 - 1575。e7(2012)。gydF4y2Ba
Schaub, J. R., Malato, Y., Gormond, C. & Willenbring, H.慢性肝损伤普通小鼠模型中新肝细胞干细胞来源的证据。gydF4y2Ba细胞的代表。gydF4y2Ba8gydF4y2Ba, 933-939(2014)。gydF4y2Ba
塔洛,B. D.等人。双潜能成人肝祖细胞来源于慢性损伤的成熟肝细胞。gydF4y2Ba细胞干细胞gydF4y2Ba15gydF4y2Ba, 605-618(2014)。gydF4y2Ba
杨格,K.等。成人肝细胞是通过自我复制而不是干细胞分化产生的。gydF4y2Ba细胞干细胞gydF4y2Ba15gydF4y2Ba, 340-349(2014)。gydF4y2Ba
Jors, S.等人。肝损伤和癌变中导管反应的谱系命运。gydF4y2Baj .中国。投资。gydF4y2Ba125gydF4y2Ba, 2445-2457(2015)。gydF4y2Ba
Shin, S.等。foxl1 - cre标记的成年肝祖细胞具有克隆性和双肾分化潜力。gydF4y2BaDev的基因。gydF4y2Ba25gydF4y2Ba, 1185-1192(2011)。gydF4y2Ba
黄瑞玉,黄瑞玉,黄瑞玉,聂托。上皮-间充质细胞在发育和疾病中的转变。gydF4y2Ba细胞gydF4y2Ba139gydF4y2Ba, 871-890(2009)。gydF4y2Ba
姚东,戴超,彭森。间充质-上皮细胞转化机制及其与转移瘤形成的关系。gydF4y2BaMol. Cancer Res。gydF4y2Ba9gydF4y2Ba, 1608-1620(2011)。gydF4y2Ba
崔,S. S. & Diehl。上皮细胞到间充质细胞在肝脏的转变。gydF4y2Ba肝脏病学gydF4y2Ba50gydF4y2Ba, 2007-2013(2009)。gydF4y2Ba
Yovchev, m.i.等人。成年肝祖细胞在损伤大鼠肝脏再生能力的鉴定。gydF4y2Ba肝脏病学gydF4y2Ba47gydF4y2Ba, 636-647(2008)。gydF4y2Ba
克拉曼,R.等人。外基质间充质干细胞样细胞是血管平滑肌细胞的祖细胞,并在慢性肾病中驱动血管钙化。gydF4y2Ba细胞干细胞gydF4y2Ba19gydF4y2Ba, 628-642(2016)。gydF4y2Ba
施耐德,R. K.等。Gli1(+)间充质间质细胞是骨髓纤维化的关键驱动因素,也是重要的细胞治疗靶点。gydF4y2Ba细胞干细胞gydF4y2Ba20.gydF4y2Ba, 785 - 800。e8(2017)。gydF4y2Ba
Kramann, R., Wongboonsin, J., Chang-Panesso, M., Machado, F. G. & Humphreys, B. D. Gli1(+)周细胞丢失诱导毛细血管稀疏和近端小管损伤。gydF4y2Baj。Soc。Nephrol。gydF4y2Ba28gydF4y2Ba, 776-784(2017)。gydF4y2Ba
赵,H.等。缝线为颅面骨间充质干细胞提供了一个小生境。gydF4y2Ba细胞生物学。gydF4y2Ba17gydF4y2Ba, 386-396(2015)。gydF4y2Ba
Degirmenci, B., Valenta, T., Dimitrieva, S., Hausmann, G. & Basler, K.表达gli1的间充质细胞形成了结肠干细胞必需的wnt分泌生态位。gydF4y2Ba自然gydF4y2Ba558gydF4y2Ba, 449-453(2018)。gydF4y2Ba
格拉贝克,A.等。成人肾上腺皮质以性别特异性的方式经历快速的组织更新。gydF4y2Ba细胞干细胞gydF4y2Ba25gydF4y2Ba, 290 - 296。e2(2019)。gydF4y2Ba
他,L.等人。利用双重组酶提高遗传谱系追踪的精确度。gydF4y2BaNat,地中海。gydF4y2Ba23gydF4y2Ba, 1488-1498(2017)。gydF4y2Ba
韩,x等。一套新的Dre重组酶驱动程序显着扩展了执行交叉基因靶向的能力。gydF4y2Ba细胞干细胞gydF4y2Ba28gydF4y2Ba, 1160 - 1176。e7(2021)。gydF4y2Ba
高,D.等。Tmprss2-CreERT2敲入小鼠模型用于前列腺和结肠癌症遗传研究。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba11gydF4y2Ba, e0161084(2016)。gydF4y2Ba
Mitchell, C. & Willenbring, H.小鼠2/3部分肝切除术可重复且耐受性良好的方法。gydF4y2BaProtoc Nat。gydF4y2Ba3.gydF4y2Ba, 1167-1170(2008)。gydF4y2Ba
Susaki, E. A.等。使用化学鸡尾酒和计算分析的单细胞分辨率全脑成像。gydF4y2Ba细胞gydF4y2Ba157gydF4y2Ba, 726-739(2014)。gydF4y2Ba
Tainaka, K.等。组织脱色的单细胞分辨率全身成像。gydF4y2Ba细胞gydF4y2Ba159gydF4y2Ba, 911-924(2014)。gydF4y2Ba
Broutier, L.等人。自我更新的人与小鼠成人肝脏和胰腺三维类器官的培养与建立及其遗传操作。gydF4y2BaProtoc Nat。gydF4y2Ba11gydF4y2Ba, 1724-1743(2016)。gydF4y2Ba
Schmittgen, t.d., liak, K. J.用比较C(T)方法分析实时PCR数据。gydF4y2BaProtoc Nat。gydF4y2Ba3.gydF4y2Ba, 1101-1108(2008)。gydF4y2Ba
皮切利等人。使用Smart-seq2从单细胞获得全长RNA-seq。gydF4y2BaProtoc Nat。gydF4y2Ba9gydF4y2Ba, 171-181(2014)。gydF4y2Ba
Dobin, A.等人。STAR:超快通用RNA-seq对准器。gydF4y2Ba生物信息学gydF4y2Ba29gydF4y2Ba, 15-21(2013)。gydF4y2Ba
Liao, Y., Smyth, G. K. & Shi, W. featuremets:一种高效的通用程序,用于分配序列读取基因组特征。gydF4y2Ba生物信息学gydF4y2Ba30.gydF4y2Ba, 923-930(2014)。gydF4y2Ba
李,L.等。单细胞RNA-seq分析绘制了人类生殖细胞和性腺生态位相互作用的发展。gydF4y2Ba细胞干细胞gydF4y2Ba20.gydF4y2Ba, 891-892(2017)。gydF4y2Ba
斯图尔特,T.等人。单细胞数据的全面集成gydF4y2Ba.细胞gydF4y2Ba177gydF4y2Ba, 1888 - 1902。e21(2019)。gydF4y2Ba
Butler, A, Hoffman, P, Smibert, P, Papalexi, E. & Satija, R.整合不同条件、技术和物种的单细胞转录组数据。gydF4y2Ba生物科技Nat。》。gydF4y2Ba36gydF4y2Ba, 411-420(2018)。gydF4y2Ba
周,Y.等。metscape为分析系统级数据集提供了面向生物学家的资源。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 1523(2019)。gydF4y2Ba
萨勃拉曼尼亚,A.等。基因集富集分析:解释全基因组表达谱的一种基于知识的方法。gydF4y2BaProc。国家的。学会科学。美国gydF4y2Ba102gydF4y2Ba, 15545-15550(2005)。gydF4y2Ba
德帕斯夸莱,e.a.k.等人。DoubletDecon:从单细胞rna测序数据中反褶积双序列。gydF4y2Ba细胞的代表。gydF4y2Ba29gydF4y2Ba, 1718 - 1727。e8(2019)。gydF4y2Ba
McGinnis, C. S., Murrow, L. M. & Gartner, Z. J. DoubletFinder:使用人工最近邻的单细胞RNA测序数据中的DoubletFinder。gydF4y2Ba细胞系统。gydF4y2Ba8gydF4y2Ba, 329 - 337。e4(2019)。gydF4y2Ba
确认gydF4y2Ba
我们要感谢博士。吴保晋和陈国元负责畜牧业,边伟博士负责SIBCB核心设施的技术帮助。感谢中国科学院上海生物化学与细胞生物学研究所基因组标记工程(GTP)中心的技术支持。国家自然科学基金项目(32130025,81830054,81874201,32125013,32000539),国家重点研发计划项目(2020YFA0509000),中国科学院基础前沿科学研究计划项目(ZDBS-LY-SM015),上海市科委项目(21XD1424200, 21ZR1470100),中国科学院项目(JCTD-2020-17)资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
Y.Z.构想并设计了实验。j·p进行了大部分实验。F.L.对计算分析和统计分析做出了贡献。j.h.、j.w.、c.w.、y.j.、k.y.、b.l.、c.p.、b.z.、l.c.、M.L.协助实验并提供技术支持。j。p。d。g。和y。z。写了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
利益冲突gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
彭俊,李峰,王俊。gydF4y2Baet al。gydF4y2Ba罕见Gli1的鉴定gydF4y2Ba+gydF4y2Ba慢性损伤时祖细胞群对肝脏再生的影响。gydF4y2Ba细胞越是加大gydF4y2Ba8gydF4y2Ba, 118(2022)。https://doi.org/10.1038/s41421-022-00474-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41421-022-00474-3gydF4y2Ba