亲爱的编辑,gydF4y2Ba
甲状腺激素释放激素受体(TRHR)是一种a类G蛋白偶联受体(GPCR),是下丘脑-垂体-甲状腺轴的关键信号传感器gydF4y2Ba1gydF4y2Ba.TRHR主要表达在垂体前叶,通过介导促甲状腺激素释放激素(pGlu-His-Pro-NH)的作用,调节促甲状腺激素和催乳素的合成和释放gydF4y2Ba2gydF4y2Ba(皇室))。激活后,TRHR主要与GgydF4y2Baq / 11gydF4y2Ba蛋白质发挥其调节作用gydF4y2Ba2gydF4y2Ba.在这里,我们报道了trh结合TRHR-G的高分辨率冷冻电子显微镜(cryo-EM)结构gydF4y2Ba问gydF4y2Ba信号复杂。结合细胞信号分析、三维变异性分析和分子动力学(MD)模拟,我们的结果揭示了配体识别和TRHR激活的分子基础。gydF4y2Ba
提高TRHR-G的表达,稳定TRHR-G的表达gydF4y2Ba问gydF4y2Ba复合物,我们结合了几种策略来组装复合物,包括一个工程构建的人类TRHR,其中BRIL融合到n端,c端截断Y348,广泛使用的主导阴性GαgydF4y2Ba问gydF4y2Ba嵌合体(GαgydF4y2Ba平方gydF4y2BaiN,以下简称GαgydF4y2Ba问gydF4y2Ba为简洁起见)和NanoBiT系留策略gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba.TRHR-G的结构gydF4y2Ba问gydF4y2Ba通过单粒子冷冻电镜,该复合物的标称全局分辨率为2.7 Å,可以准确地模拟TRH、受体残基E13到N336,细胞内环3 (ICL3)和G的大多数残基gydF4y2Ba问gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Ba;补充无花果。gydF4y2BaS1gydF4y2Ba- - - - - -gydF4y2BaS3gydF4y2Ba和表gydF4y2BaS1gydF4y2Ba).gydF4y2Ba
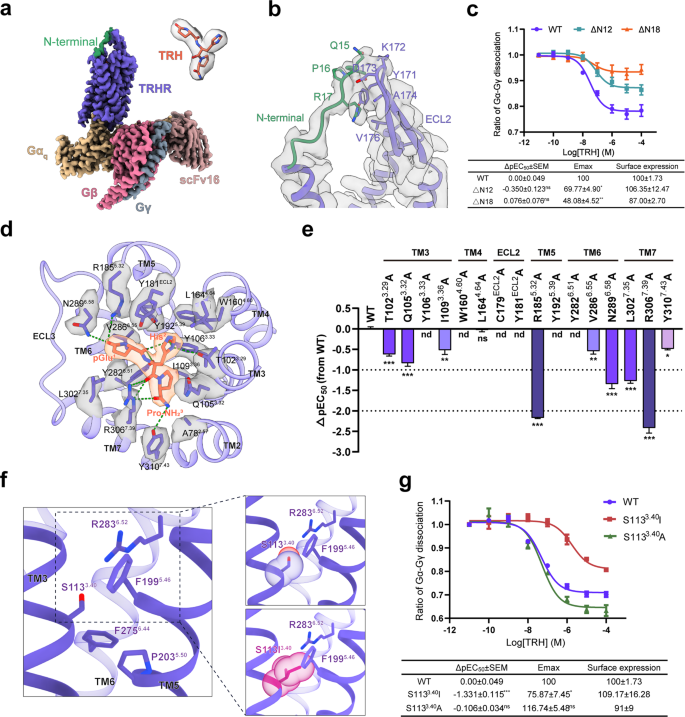
一个gydF4y2Batrh结合TRHR-G的冷冻电镜结构gydF4y2Ba问gydF4y2Ba复杂。TRH的密度如图所示。TRHR,石板蓝;GαgydF4y2Ba问gydF4y2Ba,粗壮的木头;Gβ,淡紫红色;Gγ,浅石板灰色;scFv16,红褐色。TRHR的解析n端以海绿色突出显示。gydF4y2BabgydF4y2BaTRHR扩展n端与ECL2的相互作用。gydF4y2BacgydF4y2Ban端截断(ΔN12和ΔN18)对trh诱导受体激活的影响。GgydF4y2Ba问gydF4y2Ba采用NanoBiT法检测游离信号。gydF4y2BadgydF4y2BaTRH(橙色)与TRHR(石板蓝)的详细相互作用。氢键用绿色虚线表示。gydF4y2BaegydF4y2Batrh结合袋突变对trh诱导GgydF4y2Ba问gydF4y2Ba通过NanoBiT分析显示解离信号。柱形表示计算TRH效力[pEC .]的差异gydF4y2Ba50gydF4y2Ba]用于相对于野生型受体(WT)的代表性突变体。数据根据影响程度进行着色。gydF4y2BafgydF4y2Ba非保守S113的严密结构检查gydF4y2Ba3.40gydF4y2BaTRHR的“PIF”主题。更换S113gydF4y2Ba3.40gydF4y2Ba和我gydF4y2Ba3.40gydF4y2Ba与相邻残基R283gydF4y2Ba6.52gydF4y2Ba或F199gydF4y2Ba5.46gydF4y2Ba.gydF4y2BaggydF4y2BaS113的效果gydF4y2Ba3.40gydF4y2Batrh诱导的GgydF4y2Ba问gydF4y2Ba分离信号。数据显示为均值±SEM,来自至少三个独立的技术重复实验。细胞表面表达和gydF4y2BaEgydF4y2Ba马克斯gydF4y2Ba值归一化为WT TRHR。不确定,不重要。gydF4y2BaPgydF4y2Ba> 0.05;*gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0。01;***gydF4y2BaPgydF4y2Ba经单因素方差分析(one-way ANOVA)和Dunnett多重比较检验(multiple comparison test)与WT比较< 0.001。gydF4y2Ba
与最近报道的两种trh结合TRHR-G结构进行了比较gydF4y2Ba问gydF4y2Ba复合物gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,我们的高分辨率重建提供了一个更准确的模板来描述TRHR的肽识别和激活。值得注意的是,我们的结构分解了受体的一个延伸的n端区域(残基13-21),这在之前的两种结构中都没有观察到gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba(无花果。gydF4y2Ba1 a, bgydF4y2Ba).n端部分指向受体的细胞外环2 (ECL2),并与保守β-发夹尖端的残基171-176广泛接触(图2)。gydF4y2Ba1 bgydF4y2Ba).TRHR的极端n端(残基1-12)在我们的低温em图中没有被解析,可能是由于其固有的灵活性。然而,截断n端12个残基(残基1-12;ΔN12)似乎损害了TRHR的激活(图。gydF4y2Ba1 cgydF4y2Ba;补充表gydF4y2BaS2gydF4y2Ba而且gydF4y2BaS3gydF4y2Ba).进一步删除与ECL2相连的n端残基(残基1-18;ΔN18)导致最大反应大幅减少50% (gydF4y2BaEgydF4y2Ba马克斯gydF4y2Ba)的TRH(图;gydF4y2Ba1 cgydF4y2Ba;补充表gydF4y2BaS2gydF4y2Ba而且gydF4y2BaS3gydF4y2Ba).然而,我们的MD模拟分析表明,ΔN12和ΔN18突变体都没有危及激动剂的结合,对TRH表现出相似的边际均方根偏差(RMSD)值~0.9 Å(补充图)。gydF4y2BaS4gydF4y2Ba).这些结果表明TRHR的n端部分可能变构调控TRHR的激活。gydF4y2Ba
TRH在七跨膜(7TM)束中占据一个典型配体口袋,其c端Pro-NHgydF4y2Ba2gydF4y2Ba位于受体核心,n端pGlu指向ECL3(图。gydF4y2Ba1 dgydF4y2Ba).与迄今为止解决的其他A类肽GPCR复合物相比,TRH与大多数A类肽激动剂一样深入7TM核心,除了神经紧张素和甘丙肽与配体口袋表面结合外gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba(补充图。gydF4y2BaS5gydF4y2Ba).然而,三肽TRH与7TM和ecl的胞外端形成的相互作用要少得多,显示出更小的界面(522 ÅgydF4y2Ba2gydF4y2Ba)与其他肽激动剂的受体相比(图。gydF4y2Ba1 dgydF4y2Ba;补充图。gydF4y2BaS5gydF4y2Ba).详细的相互作用分析表明,TRH与TRHR形成广泛的氢键或极性相互作用,涉及TM3/5/6/7和ECL2 (T102gydF4y2Ba3.29gydF4y2Ba, Y106gydF4y2Ba3.33gydF4y2Ba, Y181gydF4y2BaECL2gydF4y2Ba, R185gydF4y2Ba5.32gydF4y2Ba, Y192gydF4y2Ba5.39gydF4y2Ba, Y282gydF4y2Ba6.51gydF4y2Ba, N289gydF4y2Ba6.58gydF4y2Ba, R306gydF4y2Ba7.39gydF4y2Ba, Y310gydF4y2Ba7.43gydF4y2Ba,上标指的是巴列斯特罗斯-温斯坦编号gydF4y2Ba9gydF4y2Ba)(图。gydF4y2Ba1 dgydF4y2Ba;补充表gydF4y2BaS4gydF4y2Ba).我们的细胞信号分析显示,大多数丙氨酸突变严重损害TRH活性(图。gydF4y2Ba1 egydF4y2Ba;补充图。gydF4y2BaS6gydF4y2Ba和表gydF4y2BaS2gydF4y2Ba而且gydF4y2BaS3gydF4y2Ba).最引人注目的是一系列酪氨酸残基的突变(Y106gydF4y2Ba3.33gydF4y2Ba, Y181gydF4y2BaECL2gydF4y2Ba, Y192gydF4y2Ba5.39gydF4y2Ba, Y282gydF4y2Ba6.51gydF4y2Ba)消除了下游信号,突出了它们在TRH结合和受体激活中的重要作用(图。gydF4y2Ba1 egydF4y2Ba;补充图。gydF4y2BaS6b-dgydF4y2Ba和表gydF4y2BaS2gydF4y2Ba而且gydF4y2BaS3gydF4y2Ba).此外,我们的功能试验也表明,W160残留gydF4y2Ba4.60gydF4y2Ba,这与他的强烈对抗gydF4y2Ba2gydF4y2BaTRH和酪氨酸贴片(Y106gydF4y2Ba3.33gydF4y2Ba, Y181gydF4y2BaECL2gydF4y2Ba和Y192gydF4y2Ba5.39gydF4y2Ba),对TRH活性非常重要(图;gydF4y2Ba1 d, egydF4y2Ba;补充图。gydF4y2BaS6cgydF4y2Ba和表gydF4y2BaS2gydF4y2Ba而且gydF4y2BaS3gydF4y2Ba).与最近解决的结构相比gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,我们的结构定义了更精确的配体结合姿态和详细的相互作用(图。gydF4y2Ba1 dgydF4y2Ba;补充表gydF4y2BaS4gydF4y2Ba).具体来说,由于分辨率有限,TRH的羧胺基团的密度在其他报道的图中没有观察到,并且在相应的结构中建模不同gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.我们的高质量低温电镜图足够清晰,可以在“向上”配置中对羧胺基团进行建模,为进一步的药物发现提供了更精确的模板(图2)。gydF4y2Ba1 dgydF4y2Ba;补充图。gydF4y2BaS5agydF4y2Ba).gydF4y2Ba
解析的TRHR结构采用了a类肽GPCRs的经典活性态构象,与报道的胆囊收缩素a受体(CCK)高度相似gydF4y2Ba一个gydF4y2BaR)对于7TM bundle,其Cα RMSD值< 1 ÅgydF4y2Ba10gydF4y2Ba(补充图。gydF4y2BaS7agydF4y2Ba).与此同时,保守的“微开关”(Toggle switch, DRY, NPxxY, PIF motif)对A类GPCRs的激活至关重要,它们在TRHR和CCK之间表现出几乎相同的构象gydF4y2Ba一个gydF4y2BaR,提示TRHR存在保守激活机制gydF4y2Ba11gydF4y2Ba(补充图。gydF4y2BaS7bgydF4y2Ba).有趣的是,保守的IgydF4y2Ba3.40gydF4y2Ba在P中gydF4y2Ba5.50gydF4y2Ba我gydF4y2Ba3.40gydF4y2BaFgydF4y2Ba6.44gydF4y2BaA类GPCRs基序被罕见的S113取代gydF4y2Ba3.40gydF4y2BaTRHR和TgydF4y2Ba3.40gydF4y2Ba在CCKgydF4y2Ba一个gydF4y2BaR,分别为图;gydF4y2Ba1 fgydF4y2Ba;补充图。gydF4y2BaS7cgydF4y2Ba).结构分析表明S113被取代gydF4y2Ba3.40gydF4y2Ba典型的IgydF4y2Ba3.40gydF4y2Ba会与相邻残基R283产生空间位阻gydF4y2Ba6.52gydF4y2Ba或F199gydF4y2Ba5.46gydF4y2BaTRHR,这可能损害受体的激活(图。gydF4y2Ba1 fgydF4y2Ba).不出所料,更换S113gydF4y2Ba3.40gydF4y2Ba和我gydF4y2Ba3.40gydF4y2Ba显著降低trh诱导的受体激活,而S113gydF4y2Ba3.40gydF4y2Ba没有破坏局部残基构象的突变保留了与野生型受体相似的信号传导(图。gydF4y2Ba1 f, ggydF4y2Ba;补充表gydF4y2BaS2gydF4y2Ba而且gydF4y2BaS3gydF4y2Ba).对不同种TRHR的序列比对表明,其功能残基为SgydF4y2Ba3.40gydF4y2Ba和一个gydF4y2Ba3.40gydF4y2Ba但我不是gydF4y2Ba3.40gydF4y2Ba高度保存在TRHR直系线中(补充图。gydF4y2BaS8gydF4y2Ba).与TRHR不同,T129的取代gydF4y2Ba3.40gydF4y2Ba和我gydF4y2Ba3.40gydF4y2Ba在CCKgydF4y2Ba一个gydF4y2BaR似乎增强了与V125的疏水相互作用gydF4y2Ba3.36gydF4y2Ba, L217gydF4y2Ba5.46gydF4y2Ba和F330gydF4y2Ba6.52gydF4y2Ba(补充图。gydF4y2BaS7cgydF4y2Ba).事实上,我们的细胞信号分析显示了T129的突变gydF4y2Ba3.40gydF4y2Ba和我gydF4y2Ba3.40gydF4y2Ba在CCKgydF4y2Ba一个gydF4y2BaR明显增加了激动剂的效力(补充图。gydF4y2BaS7dgydF4y2Ba).这些结果强调了A类GPCRs激活机制的共同性和多样性。gydF4y2Ba
的TRHR-GgydF4y2Ba问gydF4y2Ba受体的TM2/3/5/6/7、ICL1/2、8号螺旋和G的α5-螺旋、β1、α n -螺旋、GβgydF4y2Ba问gydF4y2Ba,总界面面积1483 ÅgydF4y2Ba2gydF4y2Ba(补充图。gydF4y2BaS9a bgydF4y2Ba).报告的GPCR-G的结构比较gydF4y2Ba问gydF4y2Ba复合物显示GgydF4y2Ba问gydF4y2Ba插入到由TMs和ICLs的细胞内末端形成的类似腔中,但旋转范围为15°(补充图。gydF4y2BaS9c-egydF4y2Ba).为了深入了解TRHR与GgydF4y2Ba问gydF4y2Ba,我们进一步利用最终粒子进行三维重建进行三维变异性分析。三维变异性分析显示TRHR-G的整体构象gydF4y2Ba问gydF4y2Ba复合物是稳定的,仅在受体的n端(~2.5 Å), ECL2 (~3.0 Å)和螺旋8 (2.7 Å)中观察到轻微的运动,TRH激动剂(~0.8 Å)和耦合GgydF4y2Ba问gydF4y2Ba(~1.2 Å)对于这两个组件(补充图。gydF4y2BaS10gydF4y2Ba).gydF4y2Ba
总之,我们报道了trh结合的TRHR-G的高分辨率低温电镜结构gydF4y2Ba问gydF4y2Ba复合物,这为TRHR激活提供了分子上的见解。与最近两项相关研究进行了比较gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,我们的工作提供了额外的结构和功能细节。首先,我们的结构分解了TRHR的一个延伸的n端区域(残基13-21),这可能通过变构调节受体的激活(图。gydF4y2Ba1得了gydF4y2Ba).其次,我们的高分辨率结构定义了更精确的配体结合姿态和相互作用,为药物发现提供了精确的平台(图2)。gydF4y2Ba1 d, egydF4y2Ba;补充表gydF4y2BaS4gydF4y2Ba).第三,我们的结果揭示了非守恒SgydF4y2Ba3.40gydF4y2Ba或者一个gydF4y2Ba3.40gydF4y2BaPIF基序对TRHR的激活至关重要,并且在TRHR直方图中高度保留(图2)。gydF4y2Ba1 f, ggydF4y2Ba;补充图。gydF4y2BaS8gydF4y2Ba).总的来说,这些发现,加上最近的研究gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,揭示TRH结合和TRHR活化的分子机制。gydF4y2Ba
数据可用性gydF4y2Ba
trh结合TRHR-G的原子坐标和电子显微镜图gydF4y2Ba问gydF4y2Ba复合物已分别存入蛋白质数据库(PDB),登录号7XW9,电子显微镜数据库(EMDB),登录号EMD-33494。gydF4y2Ba
参考文献gydF4y2Ba
Joseph-Bravo, P., jaime - hoy, L., Uribe, R. M. & Charli, J. L.神经内分泌学60年:TRH,第一个分离的促垂体释放激素:垂体-甲状腺轴的控制。gydF4y2Baj .性。gydF4y2Ba227gydF4y2Ba, x3(2015)。gydF4y2Ba
Hinkle, P. M. Gehret, A. U. & Jones, B. W.垂体促甲状腺激素释放激素受体的脱敏、贩卖和再敏。gydF4y2Ba前面。>。gydF4y2Ba6gydF4y2Ba, 180(2012)。gydF4y2Ba
Mobbs, J. I.等人。人胆囊收缩素1 (CCK1)受体结合Gs和Gq模拟蛋白的结构提供了对G蛋白选择性机制的深入了解。gydF4y2Ba公共科学图书馆杂志。gydF4y2Ba19gydF4y2Ba, e3001295(2021)。gydF4y2Ba
段,J.等。通过NanoBiT栓系策略揭示激活的VIP1受体- g蛋白复合物的冷冻电镜结构。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba, 4121(2020)。gydF4y2Ba
徐毅,等。配体结合和人类促甲状腺激素释放激素受体激活的结构洞见。gydF4y2Ba细胞Res。gydF4y2Ba32gydF4y2Ba, 855-857(2022)。gydF4y2Ba
杨,F.等。内源性肽激动剂或口服类似物对促甲状腺激素释放激素受体激活的结构洞察。gydF4y2Ba细胞Res。gydF4y2Ba32gydF4y2Ba, 858-861(2022)。gydF4y2Ba
张,M.等。脂质纳米圆盘中活化的GPCR-G蛋白复合物的冷冻电镜结构。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba28gydF4y2Ba, 258-267(2021)。gydF4y2Ba
段,J.等。甘丙肽受体变构激动作用和G蛋白亚型选择性的分子基础。gydF4y2BaCommun Nat。gydF4y2Ba13gydF4y2Ba, 1364(2022)。gydF4y2Ba
Ballesteros, J. A. & Weinstein, H.构建三维模型的集成方法和G蛋白偶联受体结构-功能关系的计算探测。在gydF4y2Ba神经科学方法gydF4y2Ba.第25卷(希尔丰主编,s.c.) 366-428(学术出版社,1995年)。gydF4y2Ba
刘,Q.等。胆囊收缩素A受体的配体识别及g蛋白偶联选择性。gydF4y2BaNat,化学。医学杂志。gydF4y2Ba17gydF4y2Ba, 1238-1244(2021)。gydF4y2Ba
周,Q.等。A类GPCRs的常见激活机制。gydF4y2BaElifegydF4y2Ba8gydF4y2Ba, e50279(2019)。gydF4y2Ba
确认gydF4y2Ba
低温电镜数据采集于浙江大学低温电镜中心。国家自然科学基金(81922071资助Y.Z., 32100959资助C.M.)、浙江省自然科学基金(LR19H31000资助Y.Z., LR22C050002资助C.M.)、浙江省重点研发项目(2021C03039资助Y.Z.)、浙江省创新创业领军团队引进计划(2020R01006资助Y.Z.)、中央高校基本科研业务费基金(Y.Z.)部分资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
Y.Z.和C.M.构想并监督整个项目;C.M.和s.y.j提纯了TRHR-GgydF4y2Ba问gydF4y2Ba复杂并进行了低温电磁图计算和模型构建;用阴性染色EM对样品进行d - d -s评价;J.G.和J.Q.收集了低温电子显微镜数据;s.y j ., y.j d ., l.n c .和J.W.进行细胞功能测定;C.M.和s.k.z进行了MD模拟;s.k z、H.Z、w.w w、Q.S、z.s参与数据分析;c.m.、y.z.和Z.S.根据所有作者的意见撰写了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
利益冲突gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
霁,SY。,Dong, YJ., Chen, LN.et al。gydF4y2Ba促甲状腺素释放激素受体激活的分子基础。gydF4y2Ba细胞越是加大gydF4y2Ba8gydF4y2Ba, 116(2022)。https://doi.org/10.1038/s41421-022-00477-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41421-022-00477-0gydF4y2Ba