摘要gydF4y2Ba
生发中心(GC) B细胞在病毒复制位点获得特异性低免疫原性但保守的流感血凝素(HA)表位。在这里,高通量的表位定位本地GC B细胞被用来识别保守的HA表位,选择交叉反应抗体介导异亚型保护。该表位的一个显著特征是原始三聚体HA结构的闭塞,这种闭塞暴露在融合后HA结构中,发生在病毒复制期间的低pH条件下。重要的是,融合后HA抗原的全身免疫导致GC B细胞靶向闭塞的表位,并诱导一类具有跨组特异性的保护性抗体,并提供独立于病毒中和活性的保护。此外,这类具有广泛保护作用的抗体在较晚的时间点产生并持续存在。我们的结果确定了一类在病毒复制位点被选择的交叉保护抗体,并为使用闭塞表位的疫苗策略提供了见解。gydF4y2Ba
简介gydF4y2Ba
由于宿主/病原体共同进化,病毒获得了几种逃避抗体监测的机制,其中之一是获得逃逸突变。体液反应对抗逃逸突变的方法是获得足够广泛的抗体特异性,以包括逃逸变异,并在长寿命记忆区(记忆B细胞和长寿命浆细胞)中保持交叉反应性抗体的产生gydF4y2Ba1克ydF4y2Ba.抗体宽度或交叉反应通过两种不同的途径实现:种系编码的针对可变病毒表位的交叉反应或生发中心(GCs)中针对保守病毒表位的体细胞进化gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
先前对一种早期的、不依赖gc的途径进行观察,该途径将种系编码的抗体招募到记忆区,从而提出低亲和力/交叉反应性B细胞可以增加体液保护的广度gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba.这种早期的种系交叉反应与B细胞抗原受体(BCR)介导的低亲和力可变表位的识别有关,并得到McGargill小组的有趣发现的支持,该发现表明,通过雷帕霉素治疗限制高特异性IgG B细胞的产生,增强了对流感的保护性抗体反应的广度gydF4y2Ba6gydF4y2Ba.gydF4y2Ba
保护性交叉反应也可以通过靶向保守的病毒表位获得,这些病毒表位通常是免疫亚显性的,免疫原性较差。这一过程需要通过V(D)J突变和GCs内的选择来提高BCR的亲和力和特异性gydF4y2Ba7gydF4y2Ba.对HIV广泛中和抗体(bNAbs)的广泛分析强调了需要异常频率的V(D)J突变和反复的选择,以获得保守的免疫亚显性中和表位所需的亲和力/特异性gydF4y2Ba8gydF4y2Ba.同样,针对血凝素(HA)保守表位的流感bNAbs通过累积V(D)J突变获得亲和力/特异性gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,尽管其程度小于HIV bNAbs。因此,GC途径中的V(D)J突变和选择微调了抗体对保守流感表位的特异性和亲和力。然而,GC对保守表位的选择似乎不如免疫显性表位和可变表位的选择强大或具有竞争力。这种二分法的机制仍然难以捉摸,并构成了开发针对快速突变病毒的交叉保护疫苗的关键问题。gydF4y2Ba
通过监测小鼠中靶向保守HA表位的B细胞反应,我们先前证明流感病毒感染会在病毒复制位点诱导肺GCs异位形成,其中交叉反应性B细胞以更高的频率被选择gydF4y2Ba12gydF4y2Ba.这一结果促使我们确定了用于选择抗原的保守表位及其增强免疫原性的机制。在这里,我们应用单细胞培养方法,允许高通量分析人类和小鼠的B细胞表位gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.我们在HA2茎区鉴定了长α螺旋(LAH)表位,这些表位通常以原生HA形式闭塞,作为局部GCs中交叉反应B细胞的选择表位。此外,我们证明融合后HA抗原暴露LAH表位以增加其抗原性,并作为LAH结合B细胞的选择抗原;这些事件的后果是强大和持久的交叉保护拉IgG诱导。因此,病毒复制位点上的GC B细胞利用抗原可塑性来引导特异性到可能包括病毒脆弱位点的封闭表位。gydF4y2Ba
结果gydF4y2Ba
单B细胞培养验证GC B细胞的特异性gydF4y2Ba
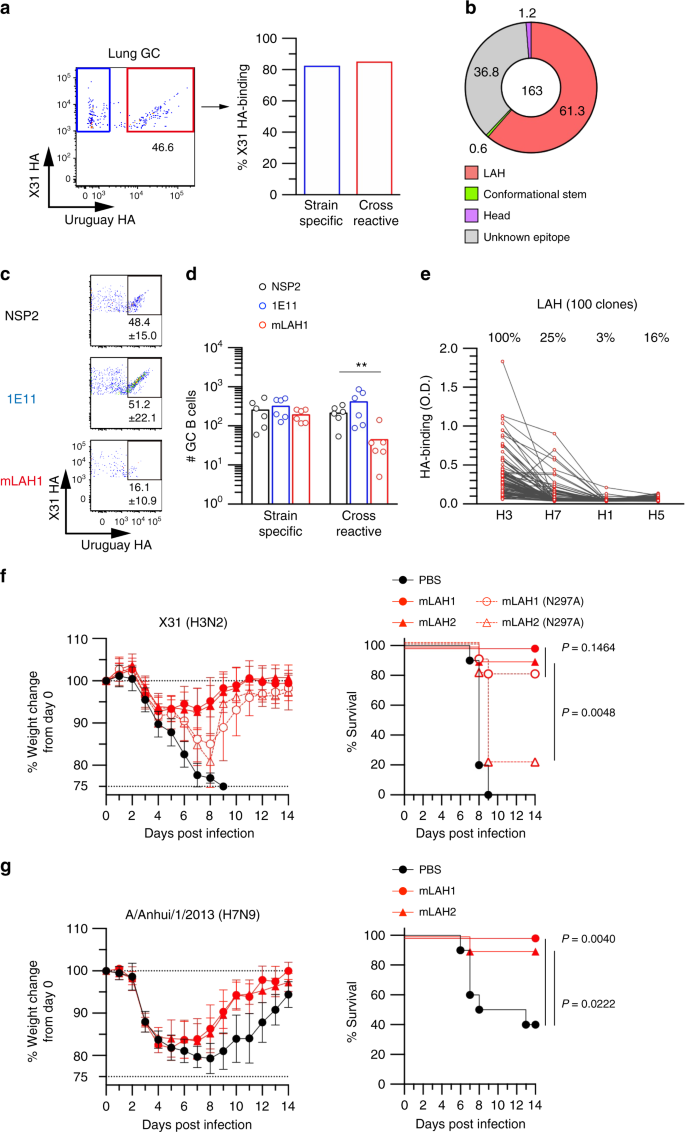
使用两个相同H3亚型的rHA探针(X31和A/乌拉圭/716/07),我们从X31感染小鼠的肺部检测到菌株特异性(X31单阳性)和交叉反应性(X31/Urg双阳性)GC B细胞,如先前所述(图2)。gydF4y2Ba1gydF4y2Ba)gydF4y2Ba12gydF4y2Ba.我们的染色程序的特异性是通过使用来自naive小鼠的小鼠B细胞和来自BCR-knock-in小鼠的小鼠B细胞对不相关的半抗原进行彻底验证的gydF4y2Ba12gydF4y2Ba.此外,我们用单细胞Nojima培养证实了鉴定的GC B细胞的抗原特异性gydF4y2Ba13gydF4y2Ba.gydF4y2Ba
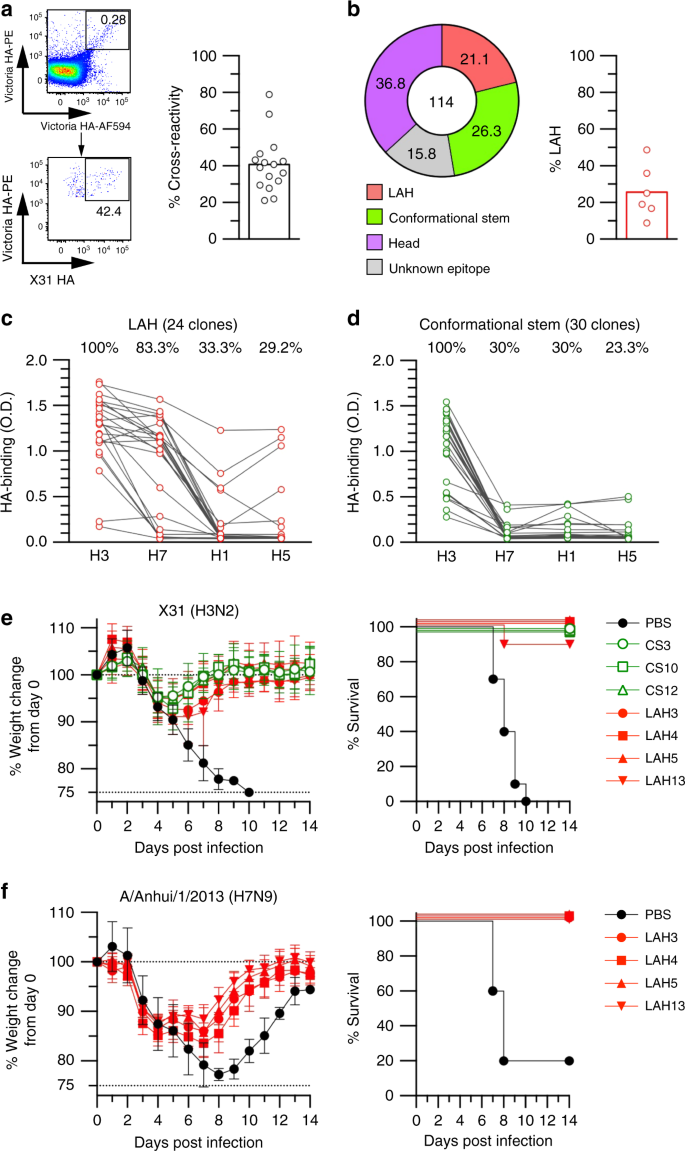
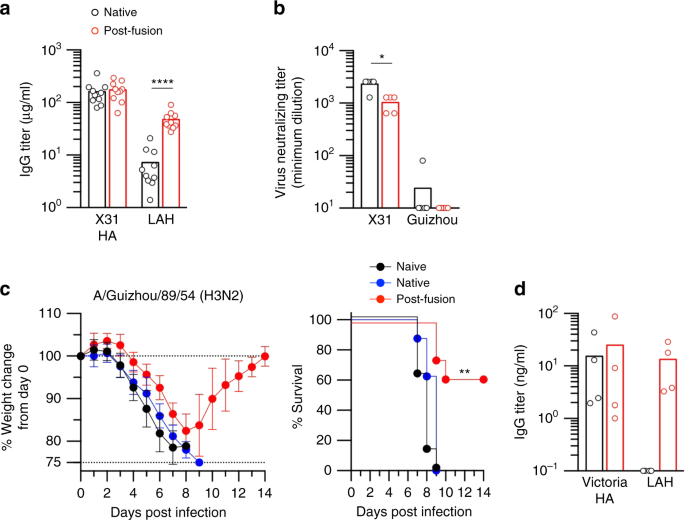
LAH是在病毒复制位点交叉反应的GC B细胞的选择表位。gydF4y2Ba一个gydF4y2Ba在感染X31的BALB/c小鼠肺部恢复X31 ha结合GC B细胞,并在感染后第20天分离成菌株特异性(蓝色)和交叉反应性(红色)细胞。用单细胞培养上清中的单克隆抗体来评估两个群体的抗原特异性。gydF4y2BabgydF4y2Ba高通量表位定位分析应用于肺中的交叉反应性GC B细胞(X31/Urg HA结合物)。36只小鼠的数据如图所示。gydF4y2BacgydF4y2Ba在注射lah结合IgG1 (mLAH1)、头部结合IgG1 (1E11)和非结合IgG1 (NSP2)后5天,在肺中发现交叉反应的GC B细胞。gydF4y2BadgydF4y2Ba抗体处理后5 d,采用流式细胞术检测菌株特异性和交叉反应性GC B细胞数量。每个圆圈代表单个鼠标的结果。显示了两个独立实验的组合数据。gydF4y2BaegydF4y2Ba以rHA作为包被抗原,用ELISA法评价H3 hla结合克隆的异亚型反应性。H3;X31 H7;H1 /安徽/ 1/2013;成田机场/ 1/2009,H5;NIBRG-14(原产于A/Vietnam/1194/2004)。gydF4y2BafgydF4y2Ba用X31 (5 × LD50)致死攻毒后,检测hla结合IgG2a和N297A突变体(100 μg /只小鼠)的保护功能。gydF4y2BaggydF4y2Ba在感染H7N9病毒后(A/Anhui/1/2013, 1 × LD50)评估了lah结合IgG2a的异亚型保护作用(100 μg /只小鼠)。来自两个独立实验的综合数据(gydF4y2BangydF4y2Ba=每组10个)。离开;体重减轻。对的;生存曲线。数值代表平均值±s.d。**gydF4y2BaPgydF4y2Ba< 0.01。的gydF4y2BaPgydF4y2Ba-值通过双尾Mann-Whitney检验确定gydF4y2BadgydF4y2Ba还有对数秩检验gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba.源数据作为源数据文件提供gydF4y2Ba
在Nojima培养中,肺GC B细胞的克隆效率低于表型相似的次级淋巴组织GC B细胞gydF4y2Ba13gydF4y2Ba(补充表gydF4y2Ba1克ydF4y2Ba),这可能是由于从肺组织中提取B细胞所需的条件更苛刻所致。我们分析了菌株特异性(69个克隆)和交叉反应性(191个克隆)GC B细胞分泌的克隆IgGs的ha结合频率(图2)。gydF4y2Ba1gydF4y2Ba).流式细胞术与IgG结合的特异性一致性较高;83%(57/69)株特异性GC克隆只分泌X31 HA, 85%(163/191)株交叉反应克隆表现出适当的双反应性。我们推测,这些特异性ha结合比率低估了实际比率,因为低亲和力的可溶性抗体可能无法被ELISA检测到,即使膜结合形式可以通过使用抗原探针的流式细胞术检测到gydF4y2Ba15gydF4y2Ba.因此,我们之前的数据和本研究中的Nojima培养数据验证了我们的HA探针在识别菌株特异性和交叉反应性GC B细胞方面的特异性。gydF4y2Ba
LAH是交叉反应性GC B细胞的选择性表位gydF4y2Ba
接下来,我们通过两种独立的方法进行了研究,这些保守的表位用于选择交叉反应的GC B细胞。首先,我们使用来自单细胞Nojima培养上清的克隆IgGs进行表位定位,这种方法可以高通量分析B细胞的特异性和亲和性gydF4y2Ba13gydF4y2Ba.其次,我们通过向小鼠注射特定的单抗来掩盖已识别的表位gydF4y2Ba16gydF4y2Ba并评估了表位在体内对选择的影响程度。gydF4y2Ba
我们筛选了交叉反应肺GC B细胞分泌的克隆IgGs,发现61%(100/163)在HA2中结合了一个合成的包含长α螺旋(LAH)的肽(图2)。gydF4y2Ba1 bgydF4y2Ba)gydF4y2Ba17gydF4y2Ba.相比之下,只有两个GC B细胞克隆(1.2%,2/163)结合了头部HA蛋白gydF4y2Ba14gydF4y2Ba.其余交叉反应性GC b细胞克隆(36.8%,60/163)识别的表位仍有待更详细的鉴定和鉴定。gydF4y2Ba
一类重要的广泛中和HA抗体识别构象茎表位,以下称为“构象茎(CS)”抗体。我们选择了5种特征良好的CS单抗(FI6, MEDI8852, 16.a。26日,31.。83.,而且56.一个.09)18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,并评估它们与全长rHA的结合。在这5种CS单抗中,我们发现MEDI8852与其他CS单抗最有效、特异性地竞争结合。gydF4y2Ba1克ydF4y2Ba).因此,我们选择通过与MEDI8852竞争,在交叉反应性克隆igg中识别潜在的CS抗体。只有一个(1/163;0.6%)克隆IgG被MEDI8852有效竞争,不与LAH肽和HA头蛋白结合(补充图;gydF4y2Ba1克ydF4y2Ba).总结从交叉反应的GC B细胞中获得的HA结合IgG抗体的表位分析,我们发现61%是LAH结合物,1.2%与HA头结合,0.6%与CS表位反应;在我们的筛选中,37%的GC克隆IgGs没有映射到已知的表位,并且对测试的三个参数均为阴性。gydF4y2Ba
为了确认LAH表位在交叉反应性GC B细胞中的优势,我们通过将小鼠LAH单抗(克隆mLAH1)注射到x31感染小鼠中来掩盖LAH表位。我们使用具有低唾液化Fc的单抗来避免先前描述的Fc介导的免疫调节(补充图)。gydF4y2Ba2gydF4y2Ba)gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba.小鼠在感染后第20天用mLAH1单抗治疗,这是GC B细胞数量趋于稳定的时间点gydF4y2Ba12gydF4y2Ba.为了支持表位映射数据,mLAH1选择性地减少了交叉反应性GC B细胞的数量,但不影响菌株特异性GC B细胞的数量(图2)。gydF4y2Ba1 c, dgydF4y2Ba).相比之下,被动给药X31菌株特异性单抗1E11对任何一个GC B细胞亚群的影响都可以忽略不计,这表明1E11表位在菌株特异性GC B细胞的高变表位中是次要的。因此,在体内通过抗体输注掩盖表位,证实了LAH是在病毒复制位点选择交叉反应GC B细胞的主要表位。gydF4y2Ba
LAH抗体提供异亚型保护gydF4y2Ba
第2组HA亚型H3和H7之间的LAH氨基酸序列同源性约为60%,但H3和第1组HA亚型(H1和H5)之间的相似性略有降低,约为50%。为了研究H3 hla结合抗体的异亚型反应性,我们检测了来自个体野岛培养物的克隆IgGs对H7(组内)和H1和H5(组间)HA蛋白的反应性(图5)。gydF4y2Ba1 egydF4y2Ba).大约四分之一的H3 lah结合IgGs也结合H7亚型,但较少识别H5(16%)和H1(3%)蛋白。gydF4y2Ba
LAH最初被鉴定为小鼠交叉反应单抗的表位,该单抗对漂移的H3反应,但对H1 HAs不反应gydF4y2Ba23gydF4y2Ba.我们随机选取5个与LAH结合的B细胞克隆,以同源X31作为攻击病毒,制备重组LAH IgG,体外检测病毒中和活性。作为参考,我们以MEDI8852和FI6为代表的CS抗体,这两种抗体具有强效和广泛的中和活性gydF4y2Ba18gydF4y2Ba.事实上,两种CS单克隆抗体对H3病毒的中和活性分别为1.6 μg / mL (MEDI8852)和3.1 μg / mL (FI6),而5种LAH单克隆抗体在达到50 μg / mL时没有表现出任何中和活性(补充图)。gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
尽管在体外缺乏病毒中和活性,但越来越多的证据表明,非中和性HA单克隆抗体在体内提供了保护gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba.因此,我们在x31感染小鼠中评估了IgG2a亚类代表性LAH单克隆抗体(mLAH1和mLAH2)的保护能力。基于体重下降和存活,使用LAH单克隆抗体进行预防性治疗提供了对X31致命感染的显著保护(图。gydF4y2Ba1 fgydF4y2Ba);然而,同样的LAH IgG2a,携带N297A突变,在相同的攻毒实验中,保护功能部分降低。由于N297A突变减少了IgG与FcγR的结合gydF4y2Ba26gydF4y2Ba,非中和的LAH IgGs似乎通过fc介导的效应功能提供保护,类似于CS IgGs提供的保护gydF4y2Ba27gydF4y2Ba尽管Fc依赖水平在不同的LAH mAb克隆中是可变的。通过预防治疗LAH单克隆抗体,也观察到对H7N9感染的异亚型保护(图。gydF4y2Ba1克gydF4y2Ba).总之,h3lah结合igg是非中和性但具有广泛保护作用的抗体,其活性部分依赖于fc介导的效应功能。gydF4y2Ba
人体中存在与lah结合的记忆B细胞gydF4y2Ba
由于过去的感染和/或疫苗接种史,几乎所有健康成年人都存在针对流感HA的记忆B细胞,这显著影响了对未来感染和疫苗接种的回忆抗体反应gydF4y2Ba28gydF4y2Ba.因此,了解人类记忆区中lah结合B细胞的频率是很重要的。从血清阴性供者的外周血单个核细胞(血凝抑制滴度< 40)中,我们使用与小鼠B细胞相似但略有不同的策略从人外周血单个核细胞中鉴定出交叉反应性B细胞。首先,我们使用了来自最近的H3N2疫苗株a/ Victoria/361/2011的HA探针,因为Vic HA结合记忆B细胞被认为比对抗X31(1968株重组病毒携带HA)和Urg(2007株分离)HAs的B细胞更丰富。其次,我们收集了Vic HA结合的B细胞作为双阳性细胞用于Vic HA探针,这些细胞被不同的荧光染料标记,以减少非特异性结合剂的污染。类似的方法已被证明可以减少与荧光色素结合的B细胞的污染,这是人类的一个重大问题gydF4y2Ba29gydF4y2Ba.gydF4y2Ba
我们观察到大约40%的维多利亚ha结合IgGgydF4y2Ba+gydF4y2Ba记忆B细胞对X31 HA有交叉反应(图;gydF4y2Ba2gydF4y2Ba).单细胞培养证实75%的igg分泌克隆与ha结合(补充表gydF4y2Ba2gydF4y2Ba).交叉反应IgG的表位gydF4y2Ba+gydF4y2Ba记忆B细胞用培养上清进行定位gydF4y2Ba14gydF4y2Ba从21%的克隆中鉴定出了LAH结合物(图;gydF4y2Ba2 bgydF4y2Ba).所有6个供体均存在LAH结合物(8.8 - 48.6%),显示该人群存在多供体(图。gydF4y2Ba2 bgydF4y2Ba及补充表gydF4y2Ba3.gydF4y2Ba).LAH结合物的频率低于小鼠GC B细胞的频率(61%),至少部分原因是MEDI8852竞争者(CS结合物)在人类记忆B细胞中丰富(26%)。gydF4y2Ba2 bgydF4y2Ba及补充表gydF4y2Ba2gydF4y2Ba).我们还注意到,37%的交叉反应克隆只识别头部HA蛋白,这与最近的出版物一致,即大量交叉反应性记忆B细胞/抗体在人类中是头部反应性的gydF4y2Ba14gydF4y2Ba,gydF4y2Ba24gydF4y2Ba.gydF4y2Ba
人类lah结合B细胞存在于交叉反应性记忆部分。gydF4y2Ba一个gydF4y2Ba维多利亚ha结合IgGgydF4y2Ba+gydF4y2Ba记忆B细胞(CD19gydF4y2Ba+gydF4y2BaCD27gydF4y2Ba+gydF4y2Ba)在人pbmc中被鉴定为双阳性细胞(Victoria HAs被AlexaFluor594和PE标记),并且对X31 HA的交叉反应被列为门控。交叉反应性以X31 ha结合细胞与维多利亚ha结合细胞的百分比表示。每个圆圈代表一个个体供体的结果。gydF4y2BabgydF4y2Ba高通量表位作图分析发现了人类交叉反应性记忆B细胞的多种保守表位。所示的数据来自汇集的捐赠者。LAH比值由个体供体显示。gydF4y2BacgydF4y2Ba使用与图相同的rHAs,用ELISA检测hla结合克隆的异亚型HA反应性。gydF4y2Ba1克ydF4y2Ba,除了图2中H3的Victoria HA。每个点代表单个克隆的结果。gydF4y2BadgydF4y2Ba用ELISA法检测cs结合克隆在相同条件下的HA异亚型反应性gydF4y2BacgydF4y2Ba.每个点代表单个克隆的结果。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba在致死剂量的同源H3N2 (X31;5 x LD50)感染gydF4y2BaegydF4y2BaH7N9异亚型(A/安徽/1/2013;1 x LD50)感染gydF4y2BafgydF4y2Ba.每天监测感染小鼠的体重(左)和存活率(右)。来自两个独立实验的综合数据(gydF4y2BangydF4y2Ba= 9-10每组)。数值代表平均值±s.d。源数据作为源数据文件提供gydF4y2Ba
与广泛中和HA单克隆聚合的cs结合克隆并行的H3 la结合克隆对异亚型HAs的特异性广度进行了检查(图。gydF4y2Ba2 c, dgydF4y2Ba).值得注意的是,大多数(83%)人类hla结合克隆对H7广泛反应,约三分之一的克隆甚至与H1和H5 HAs结合(图5)。gydF4y2Ba2摄氏度gydF4y2Ba).cs结合克隆如预期的那样包括对H7、H1和H5反应广泛的克隆,但平均结合频率和水平低于ah结合克隆(图2)。gydF4y2Ba二维gydF4y2Ba).gydF4y2Ba
通过体外病毒中和试验和使用X31病毒的体内保护试验,评估了源自人记忆B细胞的LAH-和cs -结合单抗的功能特性。与之前小鼠LAH单克隆抗体的研究结果一致,人类LAH结合单克隆抗体(gydF4y2BangydF4y2Ba= 4),无论广泛反应水平如何,体外对X31病毒均无可检测的中和活性(> 50 μg / mL),而cs结合单抗以可检测的中和浓度(7.2±5.1 μg / mL),gydF4y2BangydF4y2Ba= 5)(补充图gydF4y2Ba3.gydF4y2Ba).尽管在体外缺乏中和活性,但在体内< 5 mg / kg时,lah结合单抗提供的保护水平与对照cs结合单抗提供的保护水平相似(图2)。gydF4y2Ba2 egydF4y2Ba).此外,结合lah的单克隆抗体对禽流感H7N9病毒株的致命感染具有异亚型保护作用(图2)。gydF4y2Ba2 fgydF4y2Ba).综上所述,这些观察结果表明,人体中结合lah的IgG抗体在体内具有广泛的保护作用,独立于体外病毒中和活性。gydF4y2Ba
保守的表位在原生三聚体HA中被阻断gydF4y2Ba
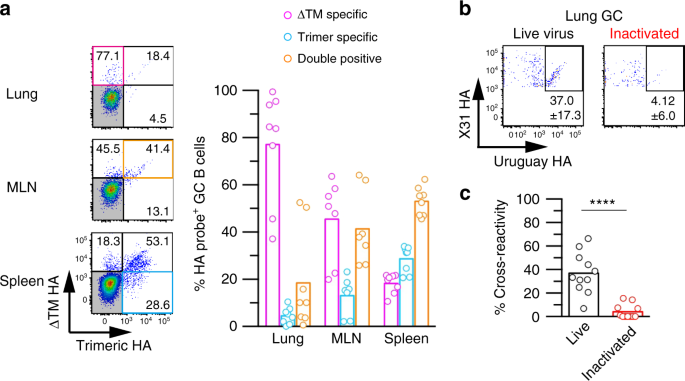
缺乏跨膜结构域的HA蛋白(ΔTM HA)产生多种HA形式,包括单体形式gydF4y2Ba30.gydF4y2Ba.由于我们使用ΔTM HA作为探针检测HA结合的B细胞,使用非原生HA作为探针可能是成功分离ah结合B细胞的技术原因之一。因此,我们比较了B细胞对ΔTM HA和三聚体HA表位的访问。为此,我们从病毒感染的小鼠中恢复了GC B细胞,并分析了BCRs与两种HAs的结合能力(图2)。gydF4y2Ba3gydF4y2Ba和补充图。gydF4y2Ba4gydF4y2Ba).超过一半的脾GC B细胞被归类为双结合剂,其结合能力与两种HA抗原相当。相反,纵隔淋巴结和肺GC B细胞中双结合剂的比例显著降低;相反,ΔTM ha特异性种群在发生病毒复制的肺部增加了80%。总之,这些结果表明肺GC B细胞主要是由表位选择的,表位在原生三聚体HA中被阻断,但在包括单体形式的非原生HA中被暴露。gydF4y2Ba
保守的表位在原生三聚体HA中被阻断。gydF4y2Ba一个gydF4y2Ba在x31感染小鼠(第20天)的指示组织上对GC B细胞进行门控,并用于ΔTM HA和三聚体HA的结合试验。定量并绘制了三种组分(ΔTM-specific、三聚体特异性和双阳性)的GC B细胞百分比。每个圆圈代表单个鼠标的结果。显示了两个独立实验的组合数据。gydF4y2BabgydF4y2Ba用X31活病毒和灭活X31病毒分别接种小鼠肺GC - B细胞,观察其交叉反应性。gydF4y2BacgydF4y2Ba从每组小鼠中绘制交叉反应。每个圆圈代表单个鼠标的结果。显示了三个独立实验的综合数据。的gydF4y2BaPgydF4y2Ba-value通过双尾Mann-Whitney检验确定。****gydF4y2BaPgydF4y2Ba< 0.0001。源数据作为源数据文件提供gydF4y2Ba
为了评估病毒复制对暴露闭塞表位的要求,我们将活病毒或灭活病毒鼻内接种到小鼠体内,并用有或没有复制的病毒诱导肺GC B细胞。LAH抗体与灭活病毒结合,但LAH表位暴露的有效密度明显低于株特异性抗体和cs结合抗体的表位(补充图)。gydF4y2Ba5gydF4y2Ba).在鼻内注射灭活X31病毒后,我们检测到ha结合的肺GC B细胞,尽管频率低于活病毒感染后(活病毒感染每个肺525.5±512.0个,而灭活病毒感染每个肺96.3±74.2个)。gydF4y2BangydF4y2Ba> 10)。在X31 ha结合的GC B细胞门控中,平均37%的GC B细胞在活病毒接种后具有交叉反应性,但在接受灭活病毒的小鼠中,只有4%的GC B细胞是双结合体(图2)。gydF4y2Ba3 b, cgydF4y2Ba).这些结果表明,闭塞表位的暴露依赖于病毒复制。gydF4y2Ba
LAH表位在融合后HA中暴露gydF4y2Ba
在病毒复制过程中,流感病毒在核内体的酸性条件下将原生HA转化为融合后的HA形式gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba.重要的是,融合后HA抗原的结构将LAH表位暴露在膜的远端区域,可能减少了发生在原生融合前HA中抗体接触的空间位阻gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba.因此,我们通过三种方法检测融合后HA抗原是否是病毒复制部位的选择抗原。gydF4y2Ba
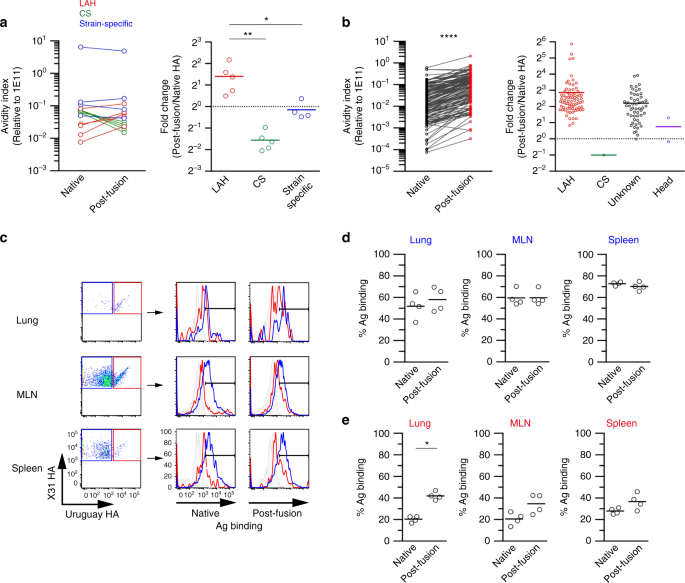
首先,我们通过ELISA评估了mAb面板与原生和融合后HA抗原的结合,并计算了亲和度指数,如前所述(图2)。gydF4y2Ba4gydF4y2Ba)gydF4y2Ba13gydF4y2Ba.菌株特异性单克隆抗体与两种形式的HA抗原平等结合,这一观察结果支持低pH值处理产生的融合后HA中菌株特异性表位的保存。正如预期的那样,融合后HA抗原修饰了CS表位的原生构象,并减少了CS单抗的结合。相反,结合lah的单克隆抗体与融合后HA抗原的结合明显优于与原生HA的结合。gydF4y2Ba
LAH表位在融合后的HA抗原中暴露。gydF4y2Ba一个gydF4y2Baha分裂抗原(X31)经pH 5.0处理后转化为融合后形态。从纯化的单抗(LAH;5个克隆,CS;5个克隆,菌株特异性;4个克隆),以菌株特异性1E11克隆为参考。用亲和度指数计算三组间的折叠变化,并进行比较。每个点代表单克隆单克隆的结果。gydF4y2BabgydF4y2Ba使用来自肺中交叉反应的GC B细胞的相同上清液绘制对原生和融合后HA抗原的亲和度指数和折叠变化。gydF4y2BacgydF4y2Ba对交叉反应和菌株特异性GC B细胞进行门控,并通过流式细胞术评估与原生和融合后HA抗原结合的细胞百分比,这些抗原用荧光染色标记。对照直方图(灰色填充);成田病毒感染小鼠成田ha结合GC B细胞。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba菌株特异性的百分比gydF4y2BadgydF4y2Ba交叉反应细胞gydF4y2BaegydF4y2Ba标记与原生和融合后HA抗原的结合。每个圆圈代表单个鼠标的结果。给出了两个独立实验的代表性数据。的gydF4y2BaPgydF4y2Ba-值由双尾Mann-Whitney检验确定(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaegydF4y2Ba)和Wilcoxon配对符号秩检验gydF4y2BabgydF4y2Ba.*gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0.01;****gydF4y2BaPgydF4y2Ba< 0.0001。源数据作为源数据文件提供gydF4y2Ba
其次,我们从小鼠Nojima培养物中检测了大量交叉反应单克隆抗体的亲和性指数(图2)。gydF4y2Ba4 bgydF4y2Ba).对原生HA抗原和融合后HA抗原亲和度指数的比较分析表明,大多数交叉反应抗体,无论是否与LAH结合,与融合后HA抗原结合的亲和度高于与原生HA抗原的亲和度。这些使用可溶性单克隆抗体的结合数据表明,LAH表位与其他闭塞的表位一起暴露在融合后的HA抗原中。gydF4y2Ba
由于HA结合方向受限,B细胞表面的膜结合BCRs比可溶性抗体更容易受到HA结构约束。作为第三种方法,我们评估了膜结合BCRs在GC B细胞上的结合能力(分别为菌株特异性和交叉反应性)gydF4y2Ba与gydF4y2Ba流式细胞术检测原生融合前HA抗原(图;gydF4y2Ba4摄氏度gydF4y2Ba).来自所有器官的株特异性GC B细胞与两种形式的HA抗原平等结合(图。gydF4y2Ba4 dgydF4y2Ba),再次支持在我们的条件下产生的融合后HA抗原中,菌株特异性表位相对保守。相反,相对于原生HA抗原,交叉反应的GC B细胞与融合后HA抗原结合更好,并且这种差异结合在肺GC B细胞中最为明显(图2)。gydF4y2Ba4 egydF4y2Ba).交叉反应的GC B细胞对融合后HA抗原的更多接触进一步加强了我们的观点,即肺GC B细胞的选择是由融合后HA抗原介导的,该抗原暴露了LAH表位和菌株特异性表位。这也解释了肺中菌株特异性和交叉反应性GC B细胞的等效选择。gydF4y2Ba
融合后HA抗原诱导hla结合GC B细胞gydF4y2Ba
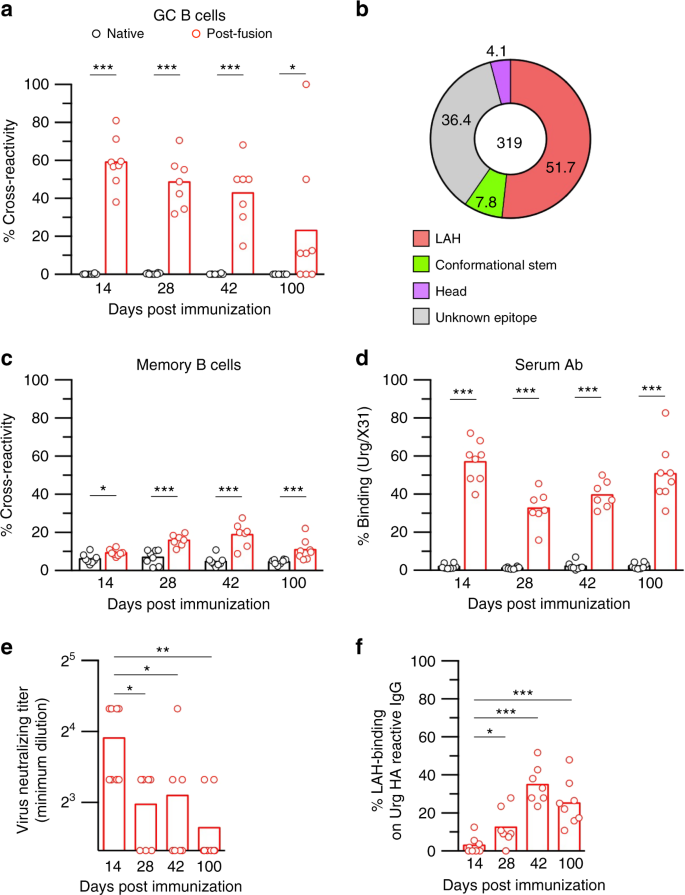
从局部GCs中分离选择抗原并与融合后HA抗原的抗原结构进行比较在技术上具有挑战性;因此,我们决定比较两种抗原选择的抗体表位谱。我们已经完成了图中局部GC B细胞的表位分析。gydF4y2Ba1 bgydF4y2Ba,因此我们确定了接受融合后HA抗原作为免疫原的小鼠的抗体表位谱。融合后的HA免疫原诱导的HA结合的脾GC B细胞在数量上与免疫后14天以后的原生HA免疫原相当(补充图)。gydF4y2Ba6gydF4y2Ba),证实融合后HA抗原具有等效的免疫原性。相反,两种免疫原诱导的GC - B细胞的交叉反应率完全不同;正如我们之前在局部GC B细胞中观察到的那样,融合后HA抗原诱导的大约一半GC B细胞是双结合剂(图2)。gydF4y2Ba1克ydF4y2Ba)gydF4y2Ba12gydF4y2Ba,而这种交叉反应的GC B细胞在用原生的、融合前的HA抗原免疫后低于检测限(图。gydF4y2Ba5gydF4y2Ba).然后,将交叉反应的GC B细胞应用于Nojima培养,以确定LAH表位作为选择表位的贡献(图。gydF4y2Ba5 bgydF4y2Ba及补充表gydF4y2Ba4gydF4y2Ba).通过对319个交叉反应性GC B细胞克隆的分析,la结合抗体占主导地位(52%),cs结合抗体和头部结合抗体占次要地位(8%和4%),这在感染诱导的肺GC B细胞中再现了表位谱(图。gydF4y2Ba1 bgydF4y2Ba).因此,相似的抗原特性以及交叉反应性B细胞/抗体的改善通路支持融合后HA抗原是局部GCs中的选择抗原,并在病毒复制位点诱导lah结合GC B细胞。gydF4y2Ba
融合后HA抗原诱导hla结合GC - B细胞反应。gydF4y2Ba一个gydF4y2Ba原生抗原(黑色)和融合后的HA抗原(红色)与AddaVax佐剂被ip注射到小鼠体内。在指定的时间点,流式细胞术计数ha结合GC B细胞在脾脏的交叉反应性。gydF4y2BabgydF4y2Ba在融合后HA免疫小鼠后第14天,高通量表位作图分析发现了交叉反应性GC B细胞的多种保守表位。9只小鼠的数据如图所示。gydF4y2BacgydF4y2Ba流式细胞术检测同一小鼠ha结合记忆B细胞的交叉反应性。gydF4y2BadgydF4y2BaELISA法测定抗X31 HA和Urg HA的IgG效价,并绘制结合比。gydF4y2BaegydF4y2Ba以Urg株作为攻毒病毒,对连续稀释的免疫血清进行微量中和试验。gydF4y2BafgydF4y2Ba采用竞争性ELISA法检测hla结合IgG与Urg ha结合IgG的比值。每个点代表单个鼠标的结果。显示了两个独立实验的组合数据。的gydF4y2BaPgydF4y2Ba-值通过双尾Mann-Whitney检验确定。*gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0.01;***gydF4y2BaPgydF4y2Ba< 0.001。源数据作为源数据文件提供gydF4y2Ba
GC反应产生至少两种类型的长寿B细胞:记忆B细胞和长寿浆细胞。与GC反应类似,HA结合记忆B细胞的数量在接受融合后和原生HA抗原的小鼠中是相当的。然而,令人惊讶的是,在免疫后第100天,交叉反应性记忆B细胞的频率低于GC B细胞(图2)。gydF4y2Ba5度gydF4y2Ba).当我们将分析扩展到长寿浆细胞产生的持久血清IgG效价时,我们注意到融合后HA免疫原强烈诱导的IgG抗体对漂移的Urg HA和LAH肽具有交叉反应(补充图。gydF4y2Ba6gydF4y2Ba).这导致血清中Urg ha结合IgG抗体的频率增加,达到与GC B细胞相当的水平(图。gydF4y2Ba5 dgydF4y2Ba).这些数据表明,融合后HA抗原抗原性的改变促使交叉反应性B细胞招募到浆细胞而不是记忆B细胞。此外,我们在第14天的血清中检测到低水平的对漂移Urg病毒的中和活性(图2)。gydF4y2Ba5 egydF4y2Ba),但在免疫后的第28天,即使Urg ha结合抗体滴度在第14天至28天保持稳定或增强,其活性也显著降低(补充图。gydF4y2Ba6gydF4y2Ba).这些数据表明,中和漂移病毒的抗体在早期时间点迅速出现,但随着时间的推移逐渐下降。与交叉中和抗体的短暂升高形成鲜明对比的是,在早期时间点,LAH抗体在漂移的ha结合IgG部分中有少量代表,但其比例在第42天增加,并保持到第100天(图)。gydF4y2Ba5 fgydF4y2Ba).因此,融合后接种引发了两波交叉反应性抗体反应,这在以前是不被重视的;在第一波中迅速和短暂地诱导中和性抗体,在第二波中逐渐和持续地诱导非中和性LAH抗体。gydF4y2Ba
融合后HA抗原诱导交叉保护抗体gydF4y2Ba
在增强后,融合后HA抗原诱导的lah结合IgG比原生HA抗原高7倍,而不考虑两种HA抗原之间HA结合IgG滴度的可比性(图。gydF4y2Ba6gydF4y2Ba).利用免疫血清,我们评估了融合后HA抗原诱导的多克隆抗体的功能。首先,检测免疫血清对同源(X31)和异源(贵州)H3N2病毒的中和活性(图3)。gydF4y2Ba6 bgydF4y2Ba),两者都对BALB/c小鼠具有致病性,与体外试验相比,适用于体内攻毒实验。两种HA抗原诱导的免疫血清均表现出对同源病毒的中和活性,这再次与融合后HA抗原中菌株特异性表位相对保守的观点相一致。相反,两种血清均未表现出对异种病毒的中和活性。因此,融合后HA抗原增强后,交叉中和抗体既没有增强,也没有维持。我们还进行了被动转移实验,以评估同一免疫血清的体内保护功能。值得一提的是,免疫血清中的ha结合抗体主要是IgG1亚类,由于与激活FcγRs的低亲和力结合,其保护作用不如IgG2亚类gydF4y2Ba27gydF4y2Ba.此外,我们注入含有ha结合IgG抗体的免疫血清,每公斤体重< 1毫克。即使在这种次优条件下,来自融合后免疫小鼠的免疫血清对外来菌株的致命感染提供了部分但显著的保护(图2)。gydF4y2Ba6摄氏度gydF4y2Ba),而天然ha免疫小鼠的免疫血清根本没有提供任何保护。因此,融合后HA抗原可诱导免疫小鼠血清中交叉保护的IgG抗体。gydF4y2Ba
融合后的血凝素抗原可诱导抗漂移病毒的保护性血清抗体。gydF4y2Ba一个gydF4y2Ba原生和融合后的HA抗原每隔4周注射两次。于增强后第14天采集血清,ELISA检测X31 HA-和lah结合IgG。每个圆圈代表单个鼠标的结果。显示了两个独立实验的组合数据。gydF4y2BabgydF4y2Ba采用H3N2病毒株(X31和贵州)作为挑战病毒,对免疫血清进行微中和试验。每个圆圈代表汇集的血清的结果(gydF4y2BangydF4y2Ba= 5)。gydF4y2BacgydF4y2Ba免疫血清的保护功能(蓝色,原生;将红色,融合后HA)和非免疫血清(黑色,幼稚)作为对照,ip转移到小鼠体内,然后用致死剂量(5 × LD50)的异质H3N2(贵州)感染攻击小鼠。来自两个独立实验的综合数据(gydF4y2BangydF4y2Ba= 8每组)。数值代表平均值±s.d。gydF4y2BadgydF4y2Ba用人pbmc重组NOJ小鼠,然后用原生和融合后的HA抗原(Victoria株)增强。接种后第10天采集血清,ELISA检测人抗ha和抗lah IgG效价。每个圆圈代表携带单个供体PBMC的单个小鼠的结果。的gydF4y2BaPgydF4y2Ba-值由双尾Mann-Whitney检验确定(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)和对数秩检验(gydF4y2BacgydF4y2Ba).*gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0.01;****gydF4y2BaPgydF4y2Ba< 0.0001。源数据作为源数据文件提供gydF4y2Ba
为了阐明融合后HA抗原在人记忆B细胞上的抗原特性,我们使用了人pbmc移植的免疫受损NOD/SCID/Jak3gydF4y2Ba-/-gydF4y2Ba(NOJ)小鼠在人记忆B细胞可被流感疫苗重新刺激的条件下gydF4y2Ba33gydF4y2Ba.用两种形式的HA抗原免疫后,NOJ小鼠产生了相当数量的HA结合人IgG反应。gydF4y2Ba6 dgydF4y2Ba);然而,大多数人IgG反应仅在融合后HA抗原免疫后识别LAH表位,而不识别本地HA抗原。因此,融合后HA抗原能够有效地促进来自人类记忆淋巴细胞的lah结合IgG抗体,这意味着这种免疫原有可能应用于人类使用的疫苗。gydF4y2Ba
讨论gydF4y2Ba
自然流感病毒感染扩大了抗体特异性,并在局部感染部位对突变病毒提供交叉保护gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba.我们发现在病毒复制位点异位形成的局部GCs是靶向保守表位的交叉反应抗体的关键诱导位点gydF4y2Ba12gydF4y2Ba.随着高通量单细胞培养的引入,我们确定了LAH表位作为主要的选择决定因素,它在原生HA三聚体中被阻断,但在融合后的HA抗原中作为免疫原性表位暴露。融合后HA抗原的抗原性和交叉反应性B细胞/抗体的高可及性支持融合后HA抗原作为局部GCs的主要选择抗原。我们已经证明了GC在感染部位选择的独特性质,这对于诱导交叉保护抗体具有重要的功能相关性。gydF4y2Ba
最近的研究揭示了GC选择的异质性,至少部分是由体内选择抗原的表位修饰引起的gydF4y2Ba13gydF4y2Ba,gydF4y2Ba36gydF4y2Ba.融合后HA抗原提供了一个非原生抗原的例子,它促进B细胞选择保守的表位,这些表位在原生抗原中被阻塞,免疫原性差。在病毒复制过程中,在酸性条件(pH 5.0)内核内体中出现融合后的HA形式。这个位置提出了一个问题,即内体HA抗原如何作为GC B细胞的选择抗原并在滤泡树突状细胞(FDCs)中显示。在这方面,至少可以设想两种可能性。首先,许多流感感染细胞死亡;死亡过程可释放细胞内病毒抗原,供FDCs捕获。其次,针对病原体的广泛炎症反应可能会产生细胞外酸化,在细胞外产生融合后的HA蛋白gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba.在这两种情况下,我们认为重要的是注意到一些保护性的人HA单克隆抗体可以识别暴露在低pH值HA构象中的闭塞表位gydF4y2Ba25gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.这些观察结果有力地支持,融合后HA抗原的选择并不是我们的实验条件所独有的,而是在人和小鼠中普遍观察到的事件。gydF4y2Ba
我们用融合后HA抗原免疫的小鼠在时间分离阶段解剖了两种交叉反应抗体。交叉中和抗体在较早的时间点出现,非中和但交叉保护抗体在较晚的时间点开始在循环中出现,与中和抗体的下降相一致(图。gydF4y2Ba5gydF4y2Ba).我们推测,本研究中显示的中和抗体发展的早期波代表了种系编码的通过GC独立途径的交叉反应性,这种交叉反应性可以通过雷帕霉素介导的mTOR抑制和GC抑制而增强gydF4y2Ba6gydF4y2Ba.与之前gc抑制条件下的发现相反gydF4y2Ba6gydF4y2Ba,早期中和抗体反应随着时间的推移而下降,这表明后期时间点的gc衍生抗体通过竞争取代了先前存在的中和抗体。与此一致,H5N1疫苗接种者产生了针对茎结构域的交叉反应性(H5/H1)记忆B细胞,但在临床研究中发现,记忆B细胞的持久性不如针对头部结构域的记忆B细胞gydF4y2Ba40gydF4y2Ba.因此,在动物模型中检测中和CS抗体是否与其他HA抗体竞争较弱将是很有趣的。gydF4y2Ba
一个重要的问题仍然难以捉摸,非中和的LAH抗体如何在体内提供广泛的保护。利用图中IgG突变体(N297A)进行研究。gydF4y2Ba1 fgydF4y2Ba支持Fc介导的保护的参与,尽管Fc依赖的水平在LAH单抗克隆中是可变的。值得注意的是,类似的Fc依赖性异质性先前已在低ph诱导的HA构象中暴露的人类保护性IgGs中显示出来gydF4y2Ba25gydF4y2Ba,gydF4y2Ba39gydF4y2Ba;其中一些需要fc介导的机制来最大限度地提高保护能力,但其他则不需要。这些数据,包括我们在本研究中的数据表明,fc介导的途径有助于在有限的抗体剂量和/或它们的结合特性(如亲和力和表位)范围内的保护。一旦这些参数在适当的条件下,fc介导的效应功能,如抗体依赖的细胞细胞毒性,抗体依赖的细胞吞噬作用,和/或补体依赖的细胞毒性可以操作和清除受感染的细胞以清除病毒gydF4y2Ba39gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba.激活单个fc介导机制需要什么样的条件仍有待解决。gydF4y2Ba
以前的工作,包括我们自己的工作,已经利用小鼠感染模型来证明fc依赖通路的体液保护gydF4y2Ba25gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba.尽管与人类相比,流感感染的病理生理学存在差异,但使用小鼠是至关重要的,因为在更典型的动物模型中,关于IgG亚类和FcγR活性、分布和信号的信息很少(gydF4y2Ba如gydF4y2Ba雪貂)。事实上,如果没有这些信息,被动转移的IgGs所产生的任何fc介导的保护作用(或缺乏这种保护作用)都很难解释。在这种情况下,我们注意到最近的一项临床研究观察到保护与几种预先存在的抗体有显著相关性gydF4y2Ba47gydF4y2Ba不仅可以中和HA抗体,还可以很差地中和需要fc介导机制来最大限度地保护小鼠的HA和NA抗体gydF4y2Ba27gydF4y2Ba,gydF4y2Ba46gydF4y2Ba.因此,有限的临床数据表明fc介导的保护可能与人类自然流感感染有关。gydF4y2Ba
融合后HA抗原诱导短暂中和性抗体和持久性非中和性抗体为未来通用流感疫苗的策略提供了一些重要的意义。交叉中和抗体是重要的和有希望的靶点,需要通过接种强有力和持久地诱导。然而,阻碍持久诱导的因素,如CS抗体的多反应性gydF4y2Ba28gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,需要进一步评估。未来在中和CS抗体和非中和LAH抗体之间的比较研究可能揭示这两类交叉保护抗体的功能分区,这将是合理设计通用流感疫苗所必需的,这种疫苗可以通过多个作用点增强广泛保护。gydF4y2Ba
方法gydF4y2Ba
病毒和疫苗gydF4y2Ba
维多利亚ivr - 165 (A / / 361/2011;H3N2)由英联邦血清实验室提供。A/Anhui/1/2013 (H7N9)病毒由中国疾控中心提供。所有病毒包括X31 (H3N2)、A/乌拉圭/716/07 (H3N2)、A/成田/1/09 (H1N1)和A/贵州/54/89 (H3N2)菌株在鸡胚中繁殖,用蔗糖梯度(10-50%)超离心纯化。为了灭活,纯化的病毒用0.05%的福尔马林在4°C下处理一周。为了生产ha分离疫苗,纯化的活病毒悬浮在0.1%的Tween80中,并与等量的乙醚混合。搅拌后,将混合物离心以分离水相和醚相,并丢弃醚相。经过几轮提取,收集剩余的水相作为ha分裂疫苗。对于融合后ha -分裂疫苗,将ha -分裂疫苗与0.15 M柠檬酸缓冲液混合,用酸性缓冲液(pH 5.0)处理30 min,使其不可逆地转变为融合后形态gydF4y2Ba32gydF4y2Ba,再加入1 M pH 8.0的Tris-HCl缓冲液中和。ha分裂疫苗用超滤(Sartorius)富集,然后在4°C下用福尔马林处理一周后使用。gydF4y2Ba
老鼠gydF4y2Ba
BALB/c小鼠购自日本SLC。NOD / SCID / JAK3gydF4y2Ba-/-gydF4y2Ba老鼠由熊本大学冈田博士提供。所有小鼠在SPF条件下饲养,在7-12周龄时使用。gydF4y2Ba
病毒感染和挑战实验gydF4y2Ba
用戊巴比妥钠腹腔注射麻醉BALB/c小鼠,然后鼻内注射X31病毒或成田病毒,剂量为0.2 × LD50,体积为20 μL。部分组小鼠分别用100 μg mAb或200 μl免疫血清免疫处理3 h以上后,分别用X31 (5 × LD50)、A/贵州/54/89 (5 × LD50)和A/安徽/1/2013 (1 × LD50)攻击。所有小鼠在感染后14天内每天监测生存和体重减轻情况。人道终点设定为相对于感染时的初始体重减轻25%的体重。gydF4y2Ba
免疫接种gydF4y2Ba
BALB/c小鼠分别用原生或融合后的ha分裂抗原(10 μg)和辅助剂AddaVax (InvivoGen)进行免疫,并在免疫后第28天用相同剂量的不含AddaVax的抗原进行免疫增强。注射后第14天收集血清。在一些实验中,小鼠每隔28天接受两次灭活病毒的静脉注射,肺在流式细胞术分析后的第7天恢复。gydF4y2Ba
人性化小鼠试验gydF4y2Ba
肝素化外周血取自健康献血者。采用淋巴细胞分离介质1077 (PromoCell)进行密度离心法分离pmcs。2只小鼠静脉注射2 × 10gydF4y2Ba7gydF4y2Ba24 h后,用50 μg ha分裂抗原进行免疫。免疫后第10天采集免疫血清,ELISA检测。gydF4y2Ba
小鼠细胞制备gydF4y2Ba
在小鼠右心室灌注PBS以清除肺部的血液。将肺切碎,在含5%胎牛血清、2 mM l -谷氨酰胺、100 IU / mL青霉素、100 μg / mL链霉素、2 mg / mL胶原酶D (Roche)和10 μg / mL脱氧核糖核酸酶I (Roche)的DMEM中37℃孵育45-60分钟,然后在磨砂的玻片两端之间破坏。在以70%/44%/30% Percoll梯度离心后,在70% - 44%界面的细胞被回收为肺细胞。在含2%胎牛血清、2 mM l -谷氨酰胺、100 IU / mL青霉素、100 μg / mL链霉素、55 μM -巯基乙醇的DMEM中,机械破坏载片磨砂端间的MLN或脾脏。脾用氯化铵-钾缓冲液(0.16 M NH)裂解红细胞gydF4y2Ba4gydF4y2BaCL, 10毫米KHCOgydF4y2Ba3.gydF4y2Ba, 0.1 mM EDTA)孵育1 min,并清洗细胞。gydF4y2Ba
流式细胞分析gydF4y2Ba
用抗fc γ rii /III单抗预处理小鼠细胞,然后与生物素化单抗混合物孵育,进行倾倒门;抗igm (eBioscience, Cat#: 13-5790- 85,1:1000), IgD (eBioscience, Cat#: 13-5931- 85,1:1000), Gr-1 (eBioscience, Cat#: 13-5931- 85,1:2000), CD3 (BioLegend, Cat#: 100304, 1:1000), CD5 (eBioscience, Cat#: 13-0051- 85,1:5000), CD11b (BioLegend, Cat#: 101204, 1:2000), CD43 (BD生物科学,Cat#: 117304, 1:1000), CD90 (eBioscience, Cat#: 13-0903- 85,1:3000), CD93 (eBioscience, Cat#: 13-5892- 85,1:1000), TER-119 (BioLegend, Cat#: 100304, 1:1000),116204, 1:2000), F4/80 (BioLegend, Cat#: 123106, 1:2000), CD117 (BioLegend, Cat#: 105804, 1:5000),和CD138 (BD生物科学,Cat#: 553713, 1:1000)。二次染色由荧光染色偶联抗体[抗cd38 (BioLegend, Cat#: 102720, 1:500), B220 (BioLegend, Cat#: 103232, 1:100)], HA探针,HA分裂抗原,链霉亲和素(BioLegend, Cat#: 405233, 1:200,或BD Biosciences, Cat#: 562284, 1:3000)和碘化丙啶(PI)或活/死固定水(Life Technologies)的混合进行。以ha分裂抗原为探针,用15 mU神经氨酸酶(Roche)在37°C处理细胞10分钟。在使用三聚体HAs作为探针的实验中,用fitc偶联单抗对细胞进行染色,进行倾斜门[抗igm (BioLegend, Cat#: 406506, 1:200,和eBioscience, Cat#: 11-5790- 85,1:20 0), IgD (BioLegend, Cat#: 405704, 1:500), CD5 (BioLegend, Cat#: 100606, 1:500), CD11b (BioLegend, Cat#: 101206, 1:500)和CD43 (BioLegend, Cat#: 143203, 1:500)]。gydF4y2Ba
为了对人PBMCs进行染色,将细胞与生物素化单克隆抗体[抗igd (BD Biosciences, Cat#: 555777, 1:40 00)、CD2 (BioLegend, Cat#: 300204,1:40 00)和CD4 (BioLegend, Cat#: 300504, 1:40 00)混合孵育,然后用抗cd19 (BioLegend, Cat#: 302240, 1:100)、CD27 (BioLegend, Cat#: 302814, 1:100)、IgG (BD Biosciences, Cat#: 555786, 1:50)、HA探针、链霉亲和素(BioLegend, Cat#: 405233, 1:200)和活/死固定水进行染色。使用链霉亲和素微珠从macs富集的群体中筛选B细胞(Miltenyi Biotech)。使用FACS Canto II或FACS Aria III (BD Bioscience)对染色细胞进行分析或单细胞分类。流式细胞术数据采用FlowJo软件(TreeStar)进行分析。ΔTM重组HA (rHA)gydF4y2Ba12gydF4y2Ba在实验室中与荧光色素[APC和PE (Dojindo)或Alexafluor594 (Invitrogen)]偶联。三聚物的哈gydF4y2Ba49gydF4y2Ba用链霉亲和素pe (Invitrogen)逐次添加标记。我们实验室用AlexaFluor488 (Invitrogen)标记X31原生和融合后ha分裂抗原。gydF4y2Ba
小鼠/人B细胞单细胞培养gydF4y2Ba
供线细胞(NB21.2D9细胞为小鼠细胞gydF4y2Ba13gydF4y2BaMS40L-low细胞用于人类细胞gydF4y2Ba14gydF4y2Ba)分别以每孔1000个NB21.2D9细胞或每孔3000个MS40L-low细胞(BCM;rmi -1640含有10% Hyclone FBS, 1mm丙酮酸钠,10mm HEPES, MEM非必需氨基酸,100iu / mL青霉素,100 μg / mL链霉素,55 μM 2-巯基乙醇)在单个b细胞分选前1天。第二天,在BCM中加入重组细胞因子[小鼠B细胞的小鼠IL-4 (Peprotech: 2ng / mL),或人B细胞的IL-2 (Peprotech: 50ng / mL),人IL-4 (Peprotech: 10ng / mL),人IL-21 (Peprotech: 10ng / mL)和人BAFF (Peprotech: 10ng / mL)],以每孔1个细胞的速度将小鼠/人B细胞直接分选到96孔板中,然后与饲养系细胞共培养。培养后,收获培养上清,ELISA检测分泌单克隆抗体的表位。将培养的克隆B细胞冷冻,进行V(D)J序列分析和V(D)J基因回收,制备重组单克隆抗体。gydF4y2Ba
ELISA和表位定位gydF4y2Ba
对于单细胞培养上清的表位定位,我们进行了ELISA。ELISA板涂布抗小鼠/人IgG (Fab特异性)Ab (Sigma-Aldrich, Cat#: M6898或I2136, 5 μg / mL), X31三聚体全长/头用rHAgydF4y2Ba14gydF4y2Ba、成田rHA、维多利亚rHA、NIBRG-14 rHA、安徽rHA、LAH肽或灭活的X31病毒。在一些实验中,rHA被ELISA板通过板结合的anti-His-tag Ab (MBL Life Science, Cat#: PM032, 2.5 μg / mL)捕获。为确定其与ha -分裂疫苗的结合,将非固定ha -分裂疫苗包被在ELISA板上,然后加/不加酸性缓冲液(pH 5.0)处理30 min。用含1% BSA的PBS阻断后,以1:10、1:50、1:150、1:450、1:500或1:1500稀释的比例将培养上清应用于培养皿,然后用山羊抗小鼠IgG-HRP (SouthernBiotech, Cat#: 1030- 05,1:5000)或山羊抗人IgG-HRP (SouthernBiotech, Cat#: 204 - 05,1:5000)孵育。为了检测CS抗体,在上清前加入MEDI8852 (20 μg / mL),孵育2 h。用OPD底物(Sigma)和OD观察酶活性gydF4y2Ba490gydF4y2Ba使用iMark Microplate Reader (Bio-Rad)进行测量。gydF4y2Ba
为了确定总IgG和抗原特异性IgG的结合,将阈值OD设置为来自阴性对照组无分选B细胞的平均加6个SDs的点。medi8852竞争性ELISA的阈值OD设置为从lah阳性孔的值中平均减去3个SDs。为获得亲和度指数,参照标准单抗(克隆1E11)测定总IgG和ha分裂结合IgG浓度。通过计算各样本抗原特异性IgG/总IgG的比值,得到ha分裂疫苗的亲和度指数。以rHA和LAH肽为包被抗原,采用ELISA法检测血清中抗原特异性IgG的浓度。为了测定LAH-结合IgG与Urg - ra -结合IgG的比例,将血清与10 μg / mL的LAH肽预孵育,然后加载到Urg - ra -包膜板上。gydF4y2Ba
IgG Fc的Western和凝集素印迹gydF4y2Ba
ac4杂交瘤分泌小鼠抗瓜氨酸蛋白抗体(ACPA)由R. Holmdahl(隆德大学)提供。唾液化ACPA (ACC4 SiagydF4y2Ba+gydF4y2Ba)通过转染两者构建gydF4y2BamSt6gal1gydF4y2Ba而且gydF4y2BamB4galt1gydF4y2Bacdna转化为ACC4杂交瘤gydF4y2Ba22gydF4y2Ba.纯化后的IgG在消化缓冲液[10 mM EDTA, 10 mM半胱氨酸在PBS (pH 7.4)]中与木瓜蛋白酶(Sigma-Aldrich, 0.05 μg / 1 μg IgG.)在37℃下孵育2小时。用SDS-PAGE分离消化后的IgGs(每巷1 μg用于凝集素印迹;western blotting每车道100 ng),并转移到Immobilon上gydF4y2Ba®gydF4y2Ba-P转移膜(默克Millipore)。对于western或凝集素印迹,膜与山羊抗小鼠IgG-HRP(日本细胞信号技术,1:1000)或生物素偶联凝集素(Vector Laboratories, Inc.)孵育。末端α2,6唾液酸(Sia)、β1,4半乳糖(Gal)和n -乙酰葡萄糖胺(GlcNAc)分别用凝集素SNA (Cat#: B-1305, 1:40 00)、ECL (Cat#: B-1145, 1:1000)和GSL II (Cat#: B-1215, 1:40 00)检测。生物素偶联凝集素印迹用ABC试剂盒(Vector Laboratories)培养。用增强化学发光法观察膜上的结合缀合物gydF4y2BaTMgydF4y2Ba检测系统(PerkinElmer Life Sciences)。化学发光由Amersham Imager 680 (GE Healthcare)检测。gydF4y2Ba
体外中和试验gydF4y2Ba
病毒中和抗体滴度采用MDCK细胞系(日本国立传染病研究所流感病毒研究中心)微量中和法测定。将连续稀释的血清或单抗与X31、A/乌拉圭/716/07或A/贵州/54/89 (100 TCID50)预孵育,然后在5 μg / mL乙酰胰蛋白酶(Sigma)存在下加入MDCK细胞。3天孵育后,确定病毒中和抗体滴度,并表示为抑制病毒复制的最小Ab浓度。gydF4y2Ba
BCR序列分析gydF4y2Ba
单细胞培养小鼠/人B细胞重排V(D)J序列分析如下:用RNeasy Plus Micro Kit (Qiagen)从单细胞培养后的冷冻细胞中提取总RNA,用SuperScript III CellsDirect cDNA Synthesis Kit (Invitrogen)和random hexamer进行反转录,合成cDNA。VgydF4y2BaHgydF4y2Ba和VgydF4y2BalgydF4y2Ba用建立的引物和方法进行两轮嵌套PCR扩增gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba.用IgBlast IMGT检测V(D)J重排和体细胞高突变数。gydF4y2Ba
单克隆抗体的生成gydF4y2Ba
嵌合单抗作为人/小鼠V(D)J的形式,具有小鼠IgG2a野生型或n297a突变体的恒定区域,生成如下。VgydF4y2BaHgydF4y2Ba/ VgydF4y2BalgydF4y2Ba从单细胞培养或发表的Ab中选择B细胞样本(FI6, MEDI8852, 16.a.)。26日,31.。83.,而且56.一个.09) were cloned into mouse IgG2a wild-type or N297A-mutant expression vectors and then subsequently produced by transfection of Expi293F cells (Thermofisher, Cat#: A14527)50gydF4y2Ba.使用protein G柱(Thermofisher)从培养上清中纯化单克隆抗体,并用于进一步分析。gydF4y2Ba
统计数据gydF4y2Ba
统计分析采用双尾Mann-Whitney检验或Wilcoxon配对符号秩检验。生存率采用Kaplan-Meier生存曲线和log-rank检验,差异有统计学意义。所有统计分析均使用Prism (GraphPad)进行。gydF4y2BaPgydF4y2Ba-值< 0.05被认为显著,用星号*表示gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0.01;***gydF4y2BaPgydF4y2Ba< 0.001;****gydF4y2BaPgydF4y2Ba< 0.0001。gydF4y2Ba
研究批准gydF4y2Ba
使用人体样本的研究得到了人体实验机构伦理委员会的批准,并按照日本《涉及人体受试者的医学和健康研究伦理准则》进行。所有参与者都按照《赫尔辛基宣言》提供了书面知情同意。动物程序经日本国家传染病研究所动物伦理委员会批准,并按照机构动物护理和使用委员会的准则执行。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
支持本研究结果的完整序列数据已存入日本DNA数据库(DDBJ)、EMBL核苷酸序列数据库和GenBank,登录号如下(LC457978-LC457997)。支持本研究结果的其他数据可根据合理要求从通讯作者处获得。图中的源数据。gydF4y2Ba1克ydF4y2Ba- - - - - -gydF4y2Ba6gydF4y2Ba,补充图。gydF4y2Ba1克ydF4y2Ba- - - - - -gydF4y2Ba3.gydF4y2Ba、及补充表格gydF4y2Ba1克ydF4y2Ba- - - - - -gydF4y2Ba4gydF4y2Ba,作为源数据文件提供。gydF4y2Ba
参考文献gydF4y2Ba
Inoue, T., Moran, I., Shinnakasu, R., Phan, T. G. & Kurosaki, T.记忆B细胞的生成及其再激活。gydF4y2BaImmunol。牧师。gydF4y2Ba283gydF4y2Ba, 138-149(2018)。gydF4y2Ba
高桥,Y. & Kelsoe, G.生发中心对广泛反应性记忆B细胞的诱导作用。gydF4y2Ba咕咕叫。当今。Immunol。gydF4y2Ba45gydF4y2Ba, 119-125(2017)。gydF4y2Ba
泰勒,J. J.,佩普,K. A.和詹金斯,M. K.生发中心独立通路在主要反应早期产生非开关记忆B细胞。gydF4y2Ba实验,医学。gydF4y2Ba209gydF4y2Ba, 597-606(2012)。gydF4y2Ba
Kaji, T.等人。不同的细胞通路选择种系编码和身体突变的抗体进入免疫记忆。gydF4y2Ba实验,医学。gydF4y2Ba209gydF4y2Ba, 2079-2097(2012)。gydF4y2Ba
Weisel, f.j., Zuccarino-Catania, g.v., Chikina, M. & Shlomchik, m.j.生发中心的时间开关决定记忆B和浆细胞的差异输出。gydF4y2Ba免疫力gydF4y2Ba44gydF4y2Ba, 116-130(2016)。gydF4y2Ba
基廷,R.等。激酶mTOR调节抗体反应,为流感病毒致命感染提供交叉保护免疫。gydF4y2BaImmunol Nat。gydF4y2Ba14gydF4y2Ba, 1266-1276(2013)。gydF4y2Ba
维多利亚,g.d. &努森茨威格,m.c.生发中心。gydF4y2Ba为基础。启Immunol。gydF4y2Ba30.gydF4y2Ba, 429-457(2012)。gydF4y2Ba
沙伊德,J. F.等。从hiv感染者的记忆B细胞中分离出的广泛多样性的中和抗体。gydF4y2Ba自然gydF4y2Ba458gydF4y2Ba, 636-640(2009)。gydF4y2Ba
帕帕斯,L.等人。通过重复突变,广泛发展流感中和抗体。gydF4y2Ba自然gydF4y2Ba516gydF4y2Ba, 418-422(2014)。gydF4y2Ba
廖,洪旭等。广泛中和HIV-1抗体和创始人病毒的共同进化。gydF4y2Ba自然gydF4y2Ba496gydF4y2Ba, 469-476(2013)。gydF4y2Ba
Bonsignori, M.等。从种系到CD4-mimic抗体的广泛HIV-1中和剂的成熟途径。gydF4y2Ba细胞gydF4y2Ba165gydF4y2Ba, 449-463(2016)。gydF4y2Ba
Adachi, Y.等。不同的生发中心选择在局部部位形成记忆B细胞反应的病毒逃逸。gydF4y2Ba实验,医学。gydF4y2Ba212gydF4y2Ba, 1709-1723(2015)。gydF4y2Ba
Kuraoka, M.等。复合抗原驱动生发中心的允许性克隆选择。gydF4y2Ba免疫力gydF4y2Ba44gydF4y2Ba, 542-552(2016)。gydF4y2Ba
麦卡锡,K. R.等。与1组和2组A型流感病毒交叉反应的记忆B细胞在成人剧目中大量存在。gydF4y2Ba免疫力gydF4y2Ba48gydF4y2Ba, 174 - 184。e179(2018).
林伍德,D.等。广泛中和流感抗体发展的结构和遗传基础。gydF4y2Ba自然gydF4y2Ba489gydF4y2Ba, 566-570(2012)。gydF4y2Ba
张杨,等。生发中心B细胞通过抗体反馈控制自己的命运。gydF4y2Ba实验,医学。gydF4y2Ba210gydF4y2Ba, 457-464(2013)。gydF4y2Ba
王婷婷等。用流感病毒血凝素合成肽接种疫苗可预防不同的病毒亚型。gydF4y2Ba国家科学院学报美国gydF4y2Ba107gydF4y2Ba, 1897 - 18984(2010)。gydF4y2Ba
Corti, D.等人。一种从浆细胞中选择的中和抗体,与A型流感1组和2组血凝素结合。gydF4y2Ba科学gydF4y2Ba333gydF4y2Ba, 850-856(2011)。gydF4y2Ba
kalleward, N. L.等。一种能识别所有甲型流感亚型的抗体的结构和功能分析。gydF4y2Ba细胞gydF4y2Ba166gydF4y2Ba, 596-608(2016)。gydF4y2Ba
乔伊斯,M. G.等。疫苗诱导的抗体,中和组1和组2甲型流感病毒。gydF4y2Ba细胞gydF4y2Ba166gydF4y2Ba, 609-623(2016)。gydF4y2Ba
王婷婷等。抗ha糖型驱动B细胞亲和选择并决定流感疫苗的效力。gydF4y2Ba细胞gydF4y2Ba162gydF4y2Ba, 160-169(2015)。gydF4y2Ba
Ohmi, Y.等。唾液化将促关节炎IgG转化为胶原诱导关节炎的抑制剂。gydF4y2BaCommun Nat。gydF4y2Ba7gydF4y2Ba, 11205(2016)。gydF4y2Ba
王婷婷等。经不同血凝素序贯免疫获得抗H3流感病毒广泛保护性单克隆抗体。gydF4y2Ba公共科学图书馆Pathog。gydF4y2Ba6gydF4y2Ba, e1000796(2010)。gydF4y2Ba
李,J.等。青年人季节性流感疫苗接种前后血清抗体库的分子水平分析gydF4y2BaNat,地中海。gydF4y2Ba22gydF4y2Ba, 1456-1464(2016)。gydF4y2Ba
亨利·杜南,C. J.等。中和性和非中和性人H7N9流感疫苗诱导的单克隆抗体均具有保护作用。gydF4y2Ba细胞宿主微生物gydF4y2Ba19gydF4y2Ba, 800-813(2016)。gydF4y2Ba
Arduin, E.等。通过将L234A/L235A和N297A Fc突变工程到小鼠IgG2a中,高度减少与高和低亲和力小鼠Fc γ受体的结合。gydF4y2Ba摩尔。Immunol。gydF4y2Ba63gydF4y2Ba, 456-463(2015)。gydF4y2Ba
DiLillo, D. J., Tan, G. S, Palese, P. & Ravetch, J. V.广泛中和的血凝素茎特异性抗体需要fcgamma相互作用来保护体内对抗流感病毒。gydF4y2BaNat,地中海。gydF4y2Ba20.gydF4y2Ba, 143-151(2014)。gydF4y2Ba
安德鲁斯,S. F.等。免疫史深刻影响广泛的保护性B细胞对流感的反应。gydF4y2Ba科学。Transl。地中海。gydF4y2Ba7gydF4y2Ba, 316ra192(2015)。gydF4y2Ba
Amanna I. J. & Slifka . M. K.用两种独立和互补的方法定量稀有记忆B细胞群。gydF4y2Baj . Immunol。方法gydF4y2Ba317gydF4y2Ba, 175-185(2006)。gydF4y2Ba
韦尔登,W. C.等人。稳定的三聚体可溶性流感血凝素的免疫原性增强。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba5gydF4y2Ba, e12466(2010)。gydF4y2Ba
Garcia, N. K., Guttman, M., Ebner, J. L. & Lee, K. K.在酸诱导的流感血凝素激活期间的动态变化。gydF4y2Ba结构gydF4y2Ba23gydF4y2Ba, 665-676(2015)。gydF4y2Ba
Das, D. K.等。单一流感血凝素三聚体构象动力学的直接可视化。gydF4y2Ba细胞gydF4y2Ba174gydF4y2Ba, 926 - 937。e912(2018).
和田,Y.等。人源化小鼠模型鉴定H7N9疫苗低免疫原性的关键氨基酸。gydF4y2Ba科学。代表。gydF4y2Ba7gydF4y2Ba, 1283(2017)。gydF4y2Ba
穆迪,m.a.等。与流感疫苗相比,H3N2流感感染引起更多的交叉反应和较少的克隆扩增抗血凝素抗体。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba6gydF4y2Ba, e25797(2011)。gydF4y2Ba
玛吉恩,等等。H3N2流感病毒感染在人和小鼠中诱导广泛反应性的血凝素柄抗体。gydF4y2Baj .性研究。gydF4y2Ba87gydF4y2Ba, 4728-4737(2013)。gydF4y2Ba
塔斯,J. M.等。生发中心抗体亲和成熟的可视化。gydF4y2Ba科学gydF4y2Ba351gydF4y2Ba, 1048-1054(2016)。gydF4y2Ba
van Zwieten, R., Wever, R., Hamers, M. N., Weening, R. S. & Roos, D.受刺激中性粒细胞的细胞外质子释放。gydF4y2Baj .中国。投资。gydF4y2Ba68gydF4y2Ba, 310-313(1981)。gydF4y2Ba
Simmen, H. P. & Blaser, J.腹部手术中和术后存在或不存在细菌感染时脓肿、腹膜液和引流液中pH和pO2的分析。gydF4y2Ba点。j .杂志。gydF4y2Ba166gydF4y2Ba, 24-27(1993)。gydF4y2Ba
于,F.等。一种有效的种系样人单克隆抗体靶向H7N9流感血凝素ph敏感表位。gydF4y2Ba细胞宿主微生物gydF4y2Ba22gydF4y2Ba, 471 - 483。e5(2017)。gydF4y2Ba
惠特利,a.k.等人。H5N1疫苗诱导的记忆B细胞在识别血凝素茎中的中和表位时受到IGHV位点的遗传限制。gydF4y2Baj . Immunol。gydF4y2Ba195gydF4y2Ba, 602-610(2015)。gydF4y2Ba
寺岛,等人。广泛交叉反应的人单克隆抗体对甲型流感病毒感染细胞的补体依赖性裂解。gydF4y2Baj .性研究。gydF4y2Ba85gydF4y2Ba, 13463-13467(2011)。gydF4y2Ba
他,W.等人。肺泡巨噬细胞对小鼠广泛反应性抗体介导的甲型流感病毒保护至关重要。gydF4y2BaCommun Nat。gydF4y2Ba8gydF4y2Ba, 846(2017)。gydF4y2Ba
Mullarkey, c.e.,等。广泛中和的血凝素柄特异性抗体诱导嗜中性粒细胞以fc依赖的方式对免疫复合物进行强有力的吞噬。gydF4y2BamBiogydF4y2Ba7gydF4y2Ba(2016)。gydF4y2Ba
Watanebe, A.等。保守型流感头部界面表位的抗体受IgG亚型依赖机制保护。gydF4y2Ba细胞gydF4y2Ba177gydF4y2Ba, 1124-1135(2019)。gydF4y2Ba
Bajic, G.等人。流感抗原工程将免疫反应集中在亚显性但具有广泛保护作用的病毒表位上。gydF4y2Ba细胞宿主微生物gydF4y2Ba25gydF4y2Ba, 827-835(2019)。gydF4y2Ba
DiLillo, D. J., Palese, P., Wilson, P. C. & Ravetch, J. V.广泛中和抗流感抗体需要Fc受体参与体内保护。gydF4y2Baj .中国。投资。gydF4y2Ba126gydF4y2Ba, 605-610(2016)。gydF4y2Ba
Ng, S.等。预防甲型H1N1流感病毒感染的新关联物。gydF4y2BaNat,地中海。gydF4y2Ba25gydF4y2Ba, 962-967(2019)。gydF4y2Ba
Bajic, G.等人。流感血凝素广泛中和抗体的自身反应谱。gydF4y2Ba科学。代表。gydF4y2Ba9gydF4y2Ba, 3492(2019)。gydF4y2Ba
惠特尔,J. R.等。流式细胞术显示H5N1疫苗接种可诱导来自多个Ig重链谱系的交叉反应性茎定向抗体。gydF4y2Baj .性研究。gydF4y2Ba88gydF4y2Ba, 4047-4057(2014)。gydF4y2Ba
蒂勒,T.等。通过单细胞RT-PCR和表达载体克隆从单个人B细胞高效生成单克隆抗体。gydF4y2Baj . Immunol。方法gydF4y2Ba329gydF4y2Ba, 112-124(2008)。gydF4y2Ba
丁磊,张志刚,张志刚,张志刚。小鼠Ig基因的克隆与表达。gydF4y2Baj . Immunol。方法gydF4y2Ba350gydF4y2Ba, 183-193(2009)。gydF4y2Ba
确认gydF4y2Ba
我们感谢博士。Stephen C. Harrison和Aaron G. Schmidt(哈佛医学院)提供血凝素蛋白,舒玉龙博士(中国疾控中心世卫组织主任)提供H7N9病毒毒株,日本红十字会根据“关于在研发中使用捐献血液的指南等”提供献血。我们还要感谢出山女士提供的技术援助。本研究由日本教育、文化、体育、科学和技术部资助,资助项目为JP16K19167(给Y.A.)和JP16K15296(给Y.T.),资助项目为AMED,资助项目为JP18fk0108051(给Y.T.)。以及孔敬大学研究事务和研究生院的博士后项目(59260)(到A.N.)。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
Y.A.设计、执行、分析和解释实验。A.N.和G.L.设计、执行、分析和解释人性化的小鼠实验。M.K.和A.W.搭建单细胞培养平台并提供关键试剂。K.T.和H.T.进行单细胞培养。Y.O.分析了Fc唾液化。h.a.、a.a.、H.H.进行H7N9感染实验。t.y., r.s., k.j.i.和T.K.提供了关键试剂和解释分析。M.A.解释了分析结果。G.K.搭建单细胞培养平台,提供关键试剂,解释分析,撰写论文。Y.T.负责监督项目,设计和解释所有实验,并撰写论文。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
y.a.、m.a.和Y.T.声明已使用本文中提供的数据提交了一项知识产权申请。其余作者声明没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
同行评审信息:gydF4y2Ba自然通讯gydF4y2Ba感谢Michelle Linterman和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba
出版商的注意:gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
足立,Y., Tonouchi, K., Nithichanon, A.。gydF4y2Baet al。gydF4y2Ba暴露一个闭塞的血凝素表位驱动一类交叉保护性流感抗体的选择。gydF4y2BaNat CommungydF4y2Ba10gydF4y2Ba, 3883(2019)。https://doi.org/10.1038/s41467-019-11821-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-019-11821-6gydF4y2Ba
这篇文章被引用gydF4y2Ba
流感病毒感染通过B细胞中的IL-4信号转导扩大了抗体反应的广度gydF4y2Ba
自然通讯gydF4y2Ba(2021)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba