摘要gydF4y2Ba
血浆多聚体糖蛋白血管性血友病因子(VWF)通过将血小板固定在血管损伤部位暴露的胶原蛋白上,在初级止血中起着至关重要的作用。最近的研究已经确认了VWF的其他生物学作用,特别是表明VWF可能在调节炎症反应中发挥重要作用。然而,VWF发挥其免疫调节作用的分子机制仍然知之甚少。在本研究中,我们报道了VWF与巨噬细胞结合可触发下游MAP激酶信号、NF-κB激活以及促炎细胞因子和趋化因子的产生。此外,VWF结合还驱动巨噬细胞M1极化,使巨噬细胞代谢以p38依赖的方式转向糖酵解。总之,我们的研究结果确定了VWF在调节巨噬细胞功能方面的重要生物学作用,从而建立了原发性止血和先天免疫之间的新联系。gydF4y2Ba
简介gydF4y2Ba
血管性血友病因子(VWF)是一种大型唾液糖蛋白,作为一系列异质多聚体在正常血浆中循环gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2gydF4y2Ba.多年来,人们已经认识到血浆VWF在维持正常止血中的重要性gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba.VWF与血管损伤部位暴露的内皮下胶原蛋白结合gydF4y2Ba5克ydF4y2Ba.随后,剪切应力诱导的球状VWF的展开导致血小板糖蛋白bα (GPIbα) A1结构域结合位点的暴露gydF4y2Ba5克ydF4y2Ba,gydF4y2Ba6gydF4y2Ba.因此,系住和解开的VWF可以将血小板招募到损伤部位,导致原发性血小板堵塞的形成。此外,VWF还与促凝因子VIII具有高亲和力结合,从而保护其不受蛋白水解和过早清除的影响gydF4y2Ba7gydF4y2Ba.gydF4y2Ba
除了止血功能,最近的研究发现VWF还有其他的生物学作用,包括抑制血管生成和促进肿瘤细胞凋亡gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.此外,越来越多的证据表明VWF在增强炎症反应中发挥重要作用gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba.内皮细胞(EC)的急性激活触发高分子量多聚体(HMWM) VWF的分泌,储存在Weibel Palade体(WPB)中。gydF4y2Ba1克ydF4y2Ba.因此,血浆VWF水平升高已被报道与不同类型的败血症以及许多其他血管病理有关,这也许并不令人惊讶gydF4y2Ba10gydF4y2Ba.事实上,血浆VWF:Ag和VWF前肽(VWFpp)水平都被认为是在许多不同疾病环境中与严重程度和/或临床结果相关的有用生物标志物,包括COVID-19、脑型疟疾、镰状细胞病、全身炎症反应综合征和各种不同的癌症gydF4y2Ba9gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.gydF4y2Ba
重要的是,在许多不同动物炎症疾病模型中进行的研究数据表明,VWF不仅作为急性EC激活的标记物,而且在介导潜在的病理生理过程中发挥积极作用gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba.例如,在盲肠穿刺脓毒症模型中,与野生型对照相比,vwf缺陷小鼠的总生存率显著提高gydF4y2Ba14gydF4y2Ba.此外,Petri等人发现,vwf阻断抗体显著减弱了中性粒细胞向巯基乙酸酯炎症的腹膜和角化细胞衍生趋化因子(KC)刺激的暴露睾肌的募集gydF4y2Ba13gydF4y2Ba.在这两种炎症小鼠模型中,vwf调节的中性粒细胞外渗依赖于血小板的存在。同样,在免疫复合物介导的血管炎和刺激性接触性皮炎小鼠模型中,vwf阻断抗体再次被证明显著减少中性粒细胞的募集gydF4y2Ba12gydF4y2Ba.有趣的是,在这些小鼠皮肤炎症模型中,vwf调节的中性粒细胞招募是通过血小板独立途径介导的gydF4y2Ba12gydF4y2Ba.gydF4y2Ba
总之,这些发现表明VWF影响炎症的多个不同方面。然而,VWF发挥促炎作用的分子机制仍然知之甚少。最近的研究报道VWF可以与巨噬细胞结合,然后迅速内吞gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba.此外,肝脏库普弗细胞已被证明在调节血浆VWF的循环半衰期中发挥作用gydF4y2Ba24gydF4y2Ba,gydF4y2Ba26gydF4y2Ba.许多特定的巨噬细胞受体也参与调节VWF结合,包括低密度脂蛋白受体相关蛋白-1 (LRP1),清道夫受体A类成员1 (SR-A1),巨噬细胞半乳糖型凝集素(MGL)和siglec5gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba.在这篇论文中,我们研究了多细胞VWF与巨噬细胞的结合可能影响先天炎症反应的假设。我们证明,VWF结合在巨噬细胞中触发了显著的胞内信号,导致p-38和随后的HIF-1α激活,以及糖酵解增强。这种VWF相互作用部分通过巨噬细胞LRP1介导,并导致促炎细胞因子和趋化因子的分泌。总的来说,这些数据确定了VWF在血管损伤部位的原发性止血与先天免疫之间的联系的生物学作用。gydF4y2Ba
结果gydF4y2Ba
VWF结合巨噬细胞触发促炎症信号gydF4y2Ba
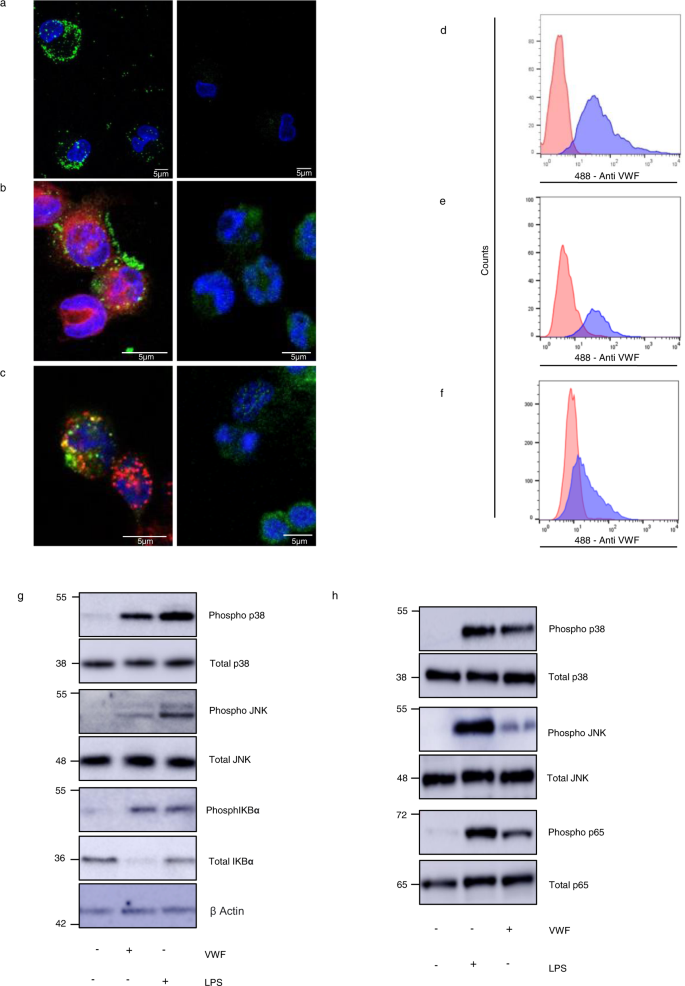
最近的研究报道了VWF与巨噬细胞的剪切依赖性结合gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba.在初步研究中,我们观察到纯化的血浆来源(pd)-VWF也可以在静态条件下与原发性人类巨噬细胞和thp -1来源的巨噬细胞结合(图1)。gydF4y2Ba1 a, bgydF4y2Ba).此外,这种静态结合之后是VWF的内吞作用。gydF4y2Ba1 cgydF4y2Ba).流式细胞术研究证实pd-VWF和重组VWF都能与人巨噬细胞结合(图1)。gydF4y2Ba1 d, fgydF4y2Ba).相比之下,未观察到VWF与未被PMA预激活的原代人单核细胞或THP1细胞的结合(补充图。gydF4y2Ba1gydF4y2Ba)gydF4y2Ba31gydF4y2Ba.重要的是,我们进一步观察到pd-VWF结合与两种原代人巨噬细胞中的促炎细胞内信号有关(图1)。gydF4y2Ba1克gydF4y2Ba)和小鼠骨髓来源的巨噬细胞(BMDMs)中gydF4y2Ba1 hgydF4y2Ba).VWF结合巨噬细胞和促炎作用本质上都是剂量依赖性的(补充图。gydF4y2Ba2gydF4y2Ba).特别是,VWF通过磷酸化p38和JNK诱导MAPKinase促炎信号通路的激活。此外,VWF结合也激活NF-κB,使其调控亚基IKBα磷酸化(图5)。gydF4y2Ba1 g hgydF4y2Ba和补充图gydF4y2Ba1 bgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba血浆源性VWF (pd-VWF)与原发性人巨噬细胞的结合gydF4y2BabgydF4y2Ba体外使用共聚焦显微镜对THP1巨噬细胞进行评估,详见材料和方法(绿色的VWF染色;核DAPI染色为蓝色;细胞膜染色为红色)。gydF4y2BacgydF4y2Ba绿色为THP1巨噬细胞和抗VWF抗体染色,红色为DAPI和抗eea1(早期核内体抗原1)抗体染色,黄色为共定位。pd-VWF或重组VWF (300-600 nM)与巨噬细胞在37°C孵育30 min,用流式细胞仪分析细胞。有代表性的直方图中,红色代表未接受VWF处理的对照细胞,蓝色代表接受VWF处理的细胞。gydF4y2BadgydF4y2Bapd-VWF和gydF4y2BaegydF4y2Ba重组VWF结合人原代巨噬细胞;gydF4y2BafgydF4y2Ba重组VWF与THP1巨噬细胞结合。流量门控策略在补充图中给出。gydF4y2Ba14gydF4y2Ba.Western blot检测血清中p38、JNK、IKBα和p65的磷酸化情况gydF4y2BaggydF4y2Ba主要人类和gydF4y2BahgydF4y2Ba原代小鼠巨噬细胞用VWF(10µg/ml)或LPS (100 ng/ml)孵育30 min。比例尺均为5 μM。所有的实验都是重复进行的,该图的源数据作为源数据文件提供。gydF4y2Ba
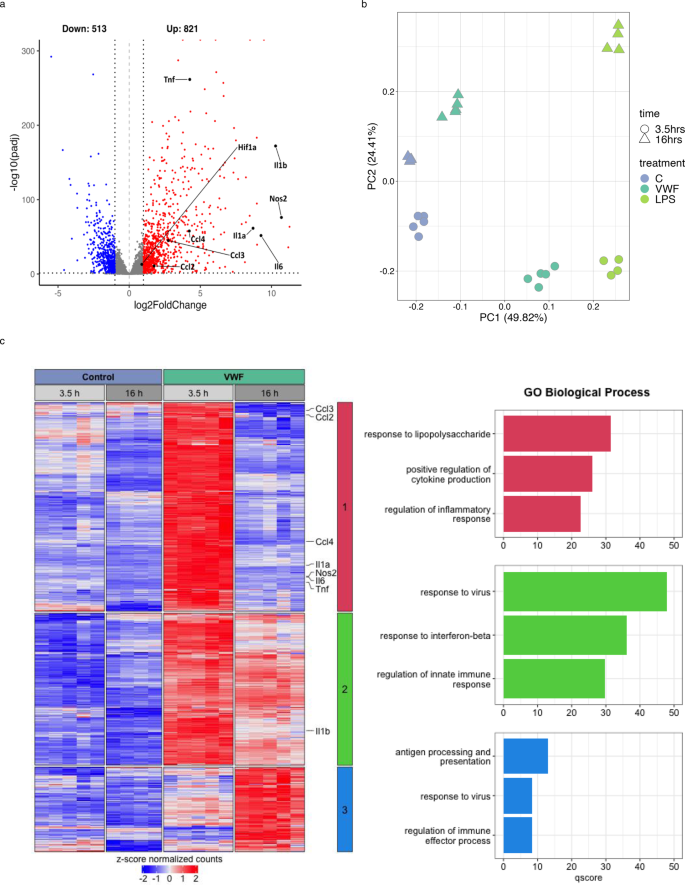
为了进一步研究VWF信号的作用,对BMDMs分别与pd-VWF (10 μg/ml)、LPS (100 ng/ml)或PBS对照孵育3.5 h (T1)或16 h (T2)后进行RNAseq研究。在3.5 h时,我们观察到1334个基因的差异表达(gydF4y2BapgydF4y2Ba-调整值< 0.05,绝对倍数变化> 2;与未处理的对照细胞相比,VWF处理的巨噬细胞中有821个表达上调,513个表达下调。gydF4y2Ba2gydF4y2Ba).相关的,促炎细胞因子(TNF, IL-6和IL-1β)和趋化因子(CCL2, CCL3和CCL4)的表达在VWF暴露后均显著增加。RNAseq数据使用qPCR对选定的促炎基因进行确认(补充图。gydF4y2Ba3 fgydF4y2Ba).总之,转录组学分析证实,VWF治疗巨噬细胞与显著的早期促炎作用相关。然而,重要的是,与LPS处理后的相同时间段相比,这种反应在定性和定量上都有所不同(VWF与LPS处理3.5 h−1005个差异表达基因;上调441个,下调564个;补充图。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
一个gydF4y2BaRNAseq在vwf处理的巨噬细胞与pbs对照中检测到显著差异表达基因的火山图(FDR < 0.05) (gydF4y2BangydF4y2Ba=每人5个)。红点和蓝点分别表示统计上显著的上调和下调基因。关键的促炎基因用黑色标记。gydF4y2BabgydF4y2Ba对照组(蓝色)、VWF-(深绿色)和lps处理的巨噬细胞(浅绿色)在不同时间点的RNA-seq数据PCA图的第一(PC1)和第二(PC2)主成分。gydF4y2BacgydF4y2Bavwf处理的巨噬细胞诱导的基因与对照的热图。采用皮尔逊相关相似度的分层聚类和z分数转换后的基因表达值的完全连锁聚类方法对基因进行聚类。关键的促炎基因被列在热图上。使用k-means聚类(中心,彩色条)识别前三个聚类。右边的柱状图显示了这些聚类中相应的基因本体富集结果。q-score表示负对数gydF4y2Ba10gydF4y2Ba的gydF4y2BapgydF4y2Ba调整值。此图的源数据作为Source data文件提供。gydF4y2Ba
虽然VWF和LPS在3.5小时时对巨噬细胞都有促炎作用,但主成分分析(PCA)显示,在16小时时VWF或LPS处理诱导的转录组重编程有显著差异(图1)。gydF4y2Ba2 bgydF4y2Ba).在这个较晚的时间点,LPS治疗巨噬细胞仍与促炎基因表达相关(补充图。gydF4y2Ba4 bgydF4y2Ba),而VWF处理的巨噬细胞恢复到与对照组相似的表达谱(图。gydF4y2Ba2 bgydF4y2Ba).对两个时间点上VWF诱导的基因进行分析,发现了转录表达的三个主要波动:(簇1)短暂的早期反应基因,在3.5小时表达,但在16小时关闭;(簇2)早期反应基因,在之后的时间点持续表达,尽管水平降低;(簇3)晚期反应基因,在16小时启动。对这些诱导基因簇的基因本体论富集分析显示,促炎过程相关基因的富集程度较高。gydF4y2Ba2摄氏度gydF4y2Ba).许多关键的促炎基因(包括TNF、IL-6、IL-1β、CCL2、CCL3和CCL4)位于簇1和簇2中,在VWF治疗16小时后表达减弱,而VWF治疗仅3.5小时(图1)。gydF4y2Ba2摄氏度gydF4y2Ba和补充图gydF4y2Ba5 a、BgydF4y2Ba).总的来说,我们观察到2249个基因(998个基因上调,1251个基因下调)在VWF与LPS处理巨噬细胞16小时后存在差异表达(补充图。gydF4y2Ba4 c, DgydF4y2Ba).总的来说,这些发现证明了VWF对巨噬细胞的促炎作用与LPS诱导的促炎作用在性质上是不同的,并进一步强调了VWF诱导的巨噬细胞转录组重编程受时间调控。gydF4y2Ba
VWF诱导细胞因子和趋化因子表达,促进单核细胞趋化gydF4y2Ba
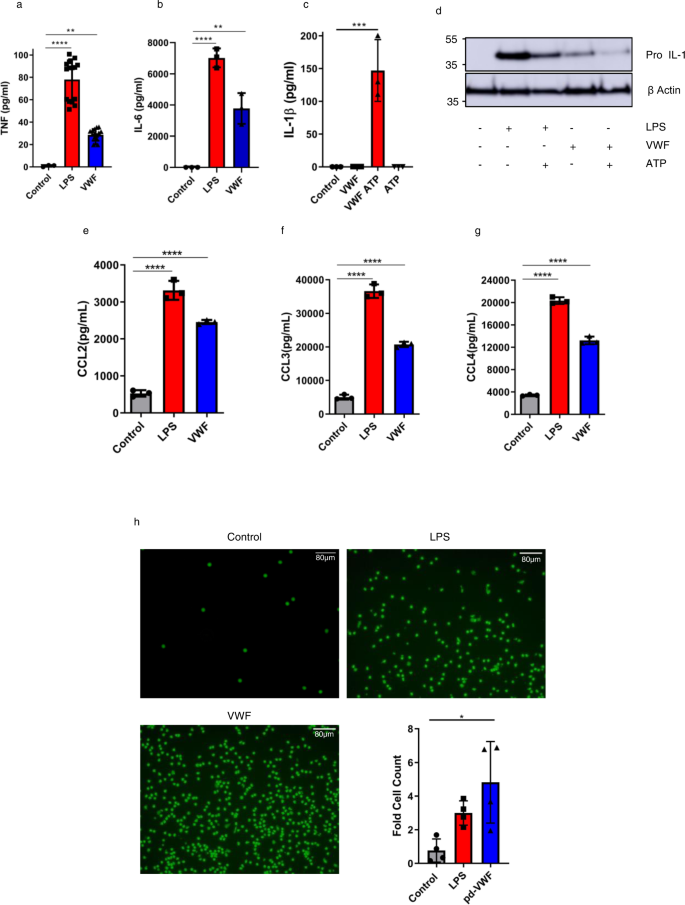
与观察到的信号作用一致,VWF与巨噬细胞结合与促炎细胞因子表达(包括TNF和IL-6)的显著增加相关(图1)。gydF4y2Ba3 a, bgydF4y2Ba).IL-1β蛋白的分泌依赖于NLRP3炎症小体的激活,这需要双重信号触发gydF4y2Ba32gydF4y2Ba.尽管VWF与巨噬细胞结合与IL-1β mRNA的增加相关(补充图。gydF4y2Ba3 cgydF4y2Ba), IL-1β分泌显著增加(图。gydF4y2Ba3 cgydF4y2Ba)和细胞内pro-IL-1β浓度平行下降(图。gydF4y2Ba3 dgydF4y2Ba)仅当VWF处理的巨噬细胞随后也暴露于ATP作为第二刺激,显示VWF激活炎症小体时才观察到。对照研究排除了pd-VWF产品的内毒素污染(补充图。gydF4y2Ba6gydF4y2Ba).此外,最近获得许可的临床级重组VWF (Vonvendi®,Takeda)与巨噬细胞的结合也与促炎信号有关(补充图。gydF4y2Ba7gydF4y2Ba).有趣的是,与pd-VWF相比,临床级裂谷wf的促炎作用减弱,这可能反映了裂谷wf与pd-VWF在翻译后修饰(特别是糖基化)方面的差异。值得注意的是,rVWF在中国仓鼠卵巢(CHO-rVWF)细胞中表达,该细胞不具有产生α2-6唾液化的能力。总之,这些发现表明VWF与巨噬细胞结合直接启动促炎信号,导致下游促炎细胞因子的产生。gydF4y2Ba
一个gydF4y2Bapd-VWF(10µg/ml)或LPS (100 ng/ml)与原代人巨噬细胞孵育4 h后,其分泌明显增加gydF4y2Ba一个gydF4y2BaTNF(对照vs LPS ****gydF4y2BaPgydF4y2Ba< 0.0001,控制vs VWF **gydF4y2BaPgydF4y2Ba= 0.0052)和gydF4y2BabgydF4y2BaIL-6促炎细胞因子类似于LPS(对照vs LPS ****gydF4y2BaPgydF4y2Ba< 0.0001,控制vs VWF **gydF4y2BaPgydF4y2Ba= 0.0011)。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba虽然VWF与巨噬细胞结合与IL-1β mRNA和细胞内pro-IL-1β水平的增加有关,但只有当VWF处理的巨噬细胞随后再次暴露于ATP中时,才观察到IL-1β分泌显著增加(同时细胞内pro-IL-1β水平下降)(***)gydF4y2BaPgydF4y2Ba= 0.0003)。同样,pd-VWF (10 μg/ml)或LPS (100 ng/ml)刺激原代人巨噬细胞24小时后,趋化因子的分泌显著增加,包括(gydF4y2BaegydF4y2Ba) CCL2,gydF4y2BafgydF4y2BaCCL3和gydF4y2BaggydF4y2BaCCL4与****gydF4y2BaPgydF4y2Ba所有趋化因子均< 0.0001对照vs LPS,对照vs VWF。所有实验均为3个重复,结果为平均值±标准差(SD),对对照采用方差分析(ANOVA)确定显著性。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba分别< 0.001。gydF4y2BahgydF4y2Ba原代人巨噬细胞用pd-VWF (10 μg/ml)或LPS (100 ng/ml)孵育24 h。然后收集细胞上清,并放置在一个迁移孔的下腔。Naïve人单核细胞置于上腔,并允许其迁移2.5 h。用钙钙素- am染色迁移的细胞数量,并使用Image J软件评估。pd-VWF (10 μg/ml)孵育的巨噬细胞上清诱导单核细胞迁移(*gydF4y2BaPgydF4y2Ba< 0.0207), LPS (100 ng/ml) (gydF4y2BaPgydF4y2Ba= 0.213)或介质表示为四个独立实验的平均折叠细胞计数增加,并表示为平均值±SD。pd-VWF (10 μg/ml)单独对naïve人单核细胞的迁移无显著影响(ns =不显著)。所有比例尺均为80 μM。此图的源数据作为Source data文件提供。gydF4y2Ba
鉴于VWF结合能够上调促炎细胞因子分泌,我们研究了它对巨噬细胞趋化因子表达的影响。VWF与原发性人类巨噬细胞结合与趋化因子表达(包括CCL2、CCL3和CCL4)的显著增加相关,这与lps处理阳性对照观察到的情况相似(图。gydF4y2Ba3比gydF4y2Ba).利用从分别用pd-VWF、临床级重组VWF或LPS刺激的原代人巨噬细胞中收集的上清液,通过转运趋化试验进一步研究了这种VWF诱导的趋化因子表达的潜在功能意义。与lps处理的阳性对照细胞相似,从pd-VWF或重组VWF刺激的巨噬细胞中收集的上清均能有效促进单核细胞的增强转运(图。gydF4y2Ba3 hgydF4y2Ba和补充图gydF4y2Ba7 bgydF4y2Ba).然而,有趣的是,pd-和重组vwf处理的巨噬细胞上清在招募单核细胞方面明显比LPS更有效。gydF4y2Ba3 hgydF4y2Ba和补充图gydF4y2Ba7 bgydF4y2Ba).最后,我们评估了VWF孵育是否影响人巨噬细胞吞噬活性。vwf治疗显著(gydF4y2BapgydF4y2Ba< 0.05) gfp标记的巨噬细胞吞噬减弱gydF4y2Ba大肠杆菌gydF4y2Ba与LPS阳性对照的观察结果相似。综上所述,这些发现表明VWF结合在调节巨噬细胞细胞因子和趋化因子的表达中发挥作用,因此有可能直接影响体内巨噬细胞的生物学。gydF4y2Ba
VWF触发巨噬细胞向M1表型极化gydF4y2Ba
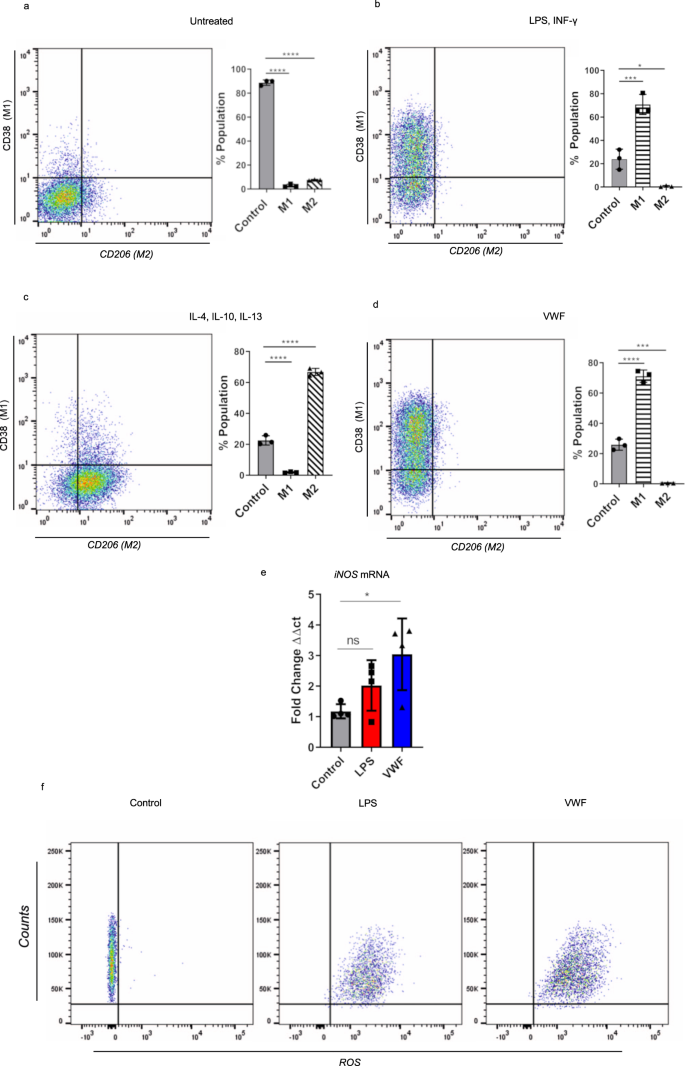
鉴于pd-和重组VWF与巨噬细胞结合的促炎作用,我们研究了VWF的相互作用是否可能影响巨噬细胞极化为M1(经典激活或“促炎”)或M2(交替激活或“抗炎”)表型。小鼠BMDMs与LPS和IFN-γ孵育后,约75%的细胞采用M1表型(C11b和CD38表达阳性)(图1)。gydF4y2Ba4 a、bgydF4y2Ba).相比之下,IL-4、IL-10和IL-13治疗导致大多数巨噬细胞采用M2表型(CD11b和CD206阳性)(图。gydF4y2Ba4摄氏度gydF4y2Ba).有趣的是,单独使用VWF治疗足以导致超过70%的BMDM采用M1表型(图1)。gydF4y2Ba4 dgydF4y2Ba).先前的研究表明,产生活性氧(ROS)和诱导一氧化氮合成酶(iNOS)是M1巨噬细胞的一个显著特征gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba.我们观察到,VWF治疗BMDM与两种iNOS表达的显著增加相关(图。gydF4y2Ba4 egydF4y2Ba)和ROS的产生(图。gydF4y2Ba4 fgydF4y2Ba).总之,这些发现进一步支持了VWF结合在巨噬细胞中诱导显著的促炎作用的假设。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba小鼠BMDMs在不同激动剂组合(LPS 100 ng/ml和IFN-γ 20 ng/ml)、(IL-4 40 ng/ml、IL-10 10 ng/ml和IL-13 20 ng/ml)或pd-VWF(10µg/ml)中孵育24 h,然后用流式细胞术检测细胞表面标记物的表达。流量门控策略在补充图中给出。gydF4y2Ba15gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba对照组BMDMs未表达CD38或CD206。gydF4y2BabgydF4y2Ba大多数经LPS和INF-γ处理的BMDMS为CD38阳性,与M1表型一致(*gydF4y2BaPgydF4y2Ba= 0.0004)。gydF4y2BacgydF4y2Ba相比之下,大多数与IL-4、IL-10和IL-13孵育的BMDMs为CD206阳性,与M2表型一致(*gydF4y2BaPgydF4y2Ba< 0.0001)。gydF4y2BadgydF4y2Bapd-VWF (10 μg/ml)刺激BMDM导致CD38表达显著增加,与促炎性M1巨噬细胞表型一致(*gydF4y2BaPgydF4y2Ba< 0.0001)。与M1表现型一致,gydF4y2BaegydF4y2BaVWF治疗还导致BMDMs中iNOS表达显著增加(*gydF4y2BaPgydF4y2Ba= 0.0287),gydF4y2BafgydF4y2Ba同时产生的活性氧(ROS)也显著增加。三个独立实验的数据以平均值±标准差表示。用方差分析计算显著性,其中*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001 ****gydF4y2BaPgydF4y2Ba< 0.0001;Ns =不显著。此图的源数据作为Source data文件提供。gydF4y2Ba
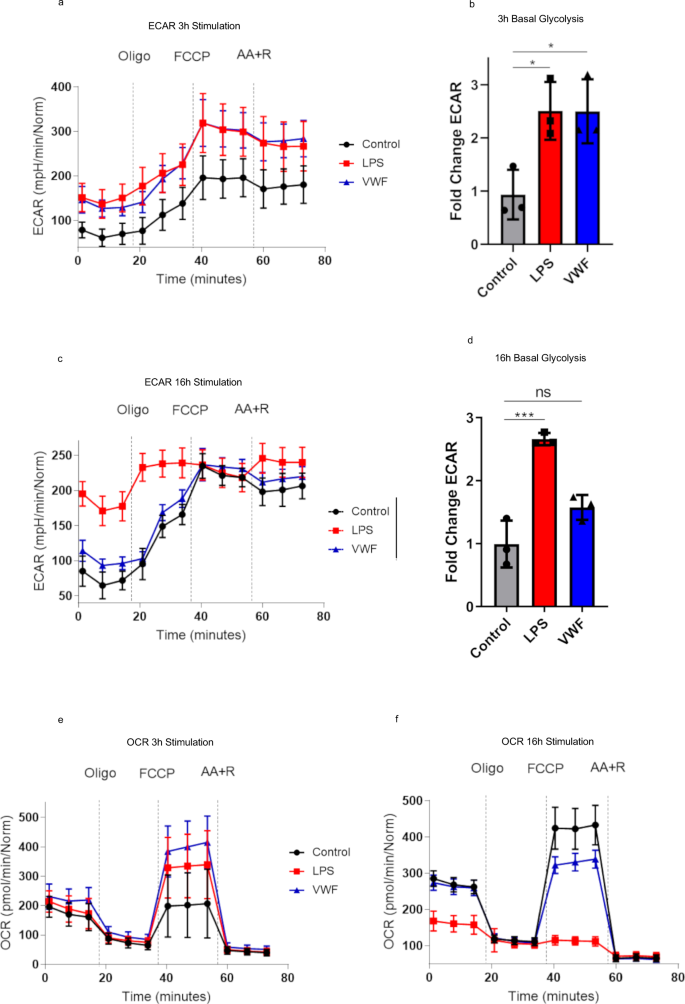
VWF调节巨噬细胞代谢,驱动糖酵解gydF4y2Ba
代谢途径的改变,特别是糖酵解的增加,构成了炎症巨噬细胞的一个标志,通过模式识别受体信号,由病原体相关信号和损伤相关信号激活gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba.为了进一步研究VWF调节巨噬细胞功能的假说,利用细胞外通量分析评估了VWF结合对巨噬细胞代谢的影响。使用Seahorse XF分析仪评估糖酵解和氧化磷酸化的基础率,该分析仪分别测量细胞外酸化(ECAR)和细胞耗氧率(OCR)作为糖酵解和线粒体呼吸的读出值。如前所述,在加入线粒体抑制剂(包括寡霉素、FCCP或抗霉素A和鱼藤酮(AA + R))前后评估ECAR和OCR的基础发生率gydF4y2Ba37gydF4y2Ba.pd-VWF刺激3小时后,在基础糖酵解(添加Oligo前的ECAR读数)中观察到ECAR显著增加(与糖酵解显著增加一致),其幅度与LPS暴露时观察到的相似(图1)。gydF4y2Ba5 a、bgydF4y2Ba).有趣的是,与观察到的VWF对巨噬细胞转录组学的时间效应一致,在延长的16小时孵育后,pd-VWF诱导的BMDM糖酵解增加已经解决,而在同一时间内LPS处理的巨噬细胞中ECAR仍然显著升高(图1)。gydF4y2Ba5 c, dgydF4y2Ba).gydF4y2Ba
采用细胞外通量分析(Seahorse XF Cell Mito Stress kit)评估vwf结合对巨噬细胞代谢的影响。测定细胞外酸化(ECAR)以研究VWF (10 μg/ml)(蓝色)、LPS (100 ng/ml)(红色)或未处理对照(黑色)刺激3 h后对糖酵解的影响(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)及16小时(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba分别)。同样,在3 h和16 h后,通过测定细胞耗氧率(OCR)来研究BMDM氧化磷酸化的影响(gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba孵化项目。VWF和LPS对BMDM糖酵解的影响(*gydF4y2BaPgydF4y2Ba= 0.0272和***gydF4y2BaPgydF4y2Ba对照组与LPS组= 0.0004;*gydF4y2BaPgydF4y2Ba= 0.0279和gydF4y2BaPgydF4y2Ba= 0.0646(对照vs VWF,分别在3和16 h后)和氧化磷酸化在存在或不存在特异性线粒体抑制剂的情况下进行研究。图是从三个独立的分析中收集的代表性图像。数据以三个独立实验的平均值±SD表示。方差分析确定显著性,其中**gydF4y2BapgydF4y2Ba< 0.01和****gydF4y2BapgydF4y2Ba< 0.0001。此图的源数据作为Source data文件提供。gydF4y2Ba
OCR用于评估与LPS或pd-VWF孵育3和16 h后的线粒体氧化磷酸化(OXPHOS)。与促进糖酵解的作用相比,LPS或pd-VWF不影响线粒体氧化磷酸化的基础水平(图。gydF4y2Ba5 egydF4y2Ba).但是,与以前的报告一致gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba我们观察到,暴露于LPS 16小时后,线粒体OCR显著降低(图。gydF4y2Ba5克gydF4y2Ba).在用pd-VWF培养的细胞中未观察到这种作用。重要的是,当巨噬细胞用临床级重组VWF代替pd-VWF治疗时,也观察到类似的巨噬细胞代谢作用(补充图。gydF4y2Ba7 cgydF4y2Ba).此外,VWF对巨噬细胞代谢的影响不能归因于刺激后BMDM细胞活力的改变(补充图。gydF4y2Ba8gydF4y2Ba).gydF4y2Ba
对VWF或lps处理的巨噬细胞的转录组学分析为这些细胞外通量发现的机制提供了进一步的认识。特别地,我们观察到VWF和LPS处理在3和16小时的时间点诱导了代谢途径基因的明显转录变化(补充图。gydF4y2Ba9gydF4y2Ba).重要的是,巨噬细胞中关键糖酵解和TCA周期相关基因的转录受激动剂(VWF或LPS)以及暴露时间的影响而特异修饰。虽然VWF和LPS在3 h时均诱导糖酵解增加,但我们观察到,这些影响是由两种激动剂之间糖酵解相关基因表达的明显变化所驱动的。例如,单独VWF可在3小时诱导Slc2a1(一种限速葡萄糖转运蛋白)。相反,在3 h时,LPS导致糖酵解途径的第一个酶己糖激酶II和III的表达增加。同样,参与TCA循环的基因(包括异柠檬酸脱氢酶同工酶Idh1和Idh2)也根据激动剂和治疗时间的不同而有差异表达。gydF4y2Ba
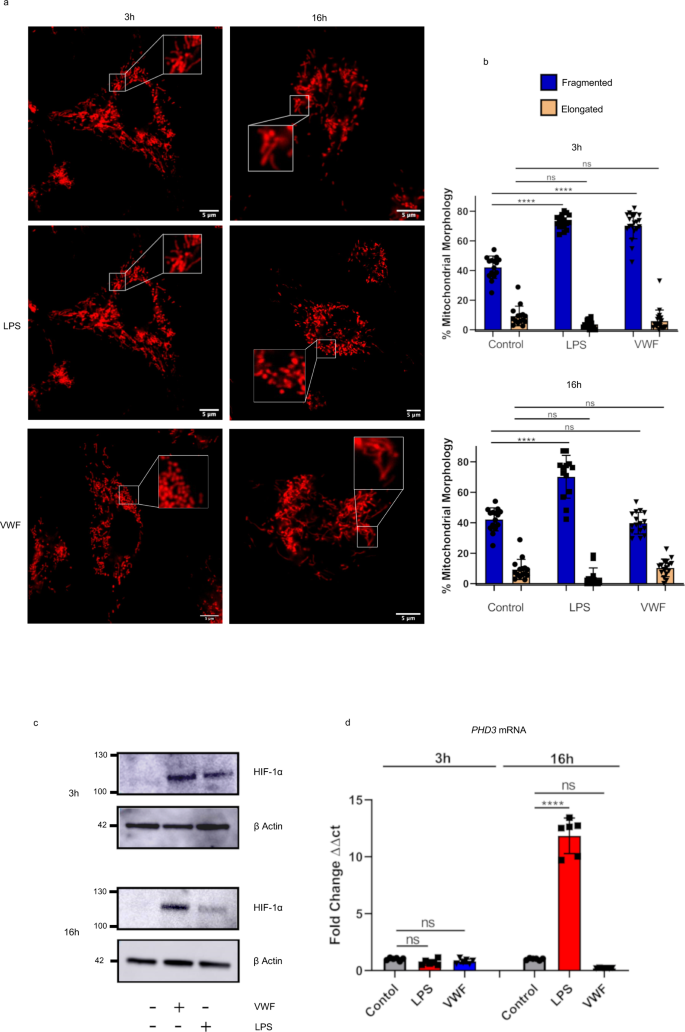
VWF影响线粒体形态,上调HIF-1α的表达gydF4y2Ba
先前的研究报道了线粒体形态的改变伴随巨噬细胞代谢状态的改变gydF4y2Ba38gydF4y2Ba.特别是,当糖酵解活性高时,线粒体呈碎片状,而在氧化磷酸化增强时,线粒体呈拉长状gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba.根据这一假设,我们观察到LPS刺激巨噬细胞3或16小时会导致线粒体形态碎片化(图1)。gydF4y2Ba6 a、bgydF4y2Ba).有趣的是,VWF治疗3小时也与线粒体碎裂水平显著升高相关。然而,与LPS相比,线粒体形态在暴露于VWF 16小时后恢复正常。这些发现进一步支持了VWF结合对巨噬细胞线粒体形态有显著的调节作用的假设,这将影响线粒体代谢,特别是证明了VWF促进巨噬细胞糖酵解的短期显著增加。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba小鼠BMDMs在存在或不存在pd-VWF (10 μg/ml)或LPS (100 ng/ml)的情况下孵育3或16小时,使用Mitotracker和扫描共聚焦活细胞成像评估线粒体形态,详见材料和方法。每次处理至少分析20个图像,包括每个细胞≥60个线粒体。在VWF或LPS刺激3小时后,观察到线粒体碎裂明显增加,与糖酵解增加一致(gydF4y2BapgydF4y2Ba< 0.01,gydF4y2BapgydF4y2Ba分别< 0.001)。尽管在LPS孵育16小时后仍观察到线粒体碎片明显增加(****gydF4y2BaPgydF4y2Ba< 0.0001),在VWF治疗的BMDMs中不再观察到(gydF4y2BaPgydF4y2Ba= 0.958, ns =不显著)。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2BaVWF (10 μg/ml)或LPS (100 ng/ml)处理BMDMs 3或16 h (****gydF4y2BaPgydF4y2Ba对照组vs LPS和< 0.0001gydF4y2BaPgydF4y2Ba对照组与VWF在16 h时= 0.3065),然后分别用Western blotting法或qRT-PCR法检测HIF-1α或PHD3的表达。三个独立实验的数据以平均值±标准差表示。用方差分析计算显著性,其中*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001, ****gydF4y2BaPgydF4y2Ba分别< 0.0001。此图的源数据作为Source data文件提供。gydF4y2Ba
LPS促进巨噬细胞糖酵解的能力,即使长时间暴露,至少部分归因于HIF-1α表达的上调gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba.为了研究VWF促进巨噬细胞糖酵解的时间依赖性机制,分别对VWF和LPS孵育3和16小时后HIF-1α的表达进行了评估。在VWF或LPS孵育3小时后,巨噬细胞HIF-1α蛋白表达水平显著增加(图1)。gydF4y2Ba6摄氏度gydF4y2Ba).有趣的是,尽管在LPS孵育16小时后,BMDMs中HIF-1α的表达仍然升高,但在vwf处理的细胞中,HIF-1α的表达在延长处理后降低(图1)。gydF4y2Ba6摄氏度gydF4y2Ba).此外,我们观察到LPS和VWF对巨噬细胞PHD3的表达具有类似的时间依赖性作用,PHD3是HIF-1α表达的关键负调控因子(图1)。gydF4y2Ba6 dgydF4y2Ba)gydF4y2Ba43gydF4y2Ba.gydF4y2Ba
巨噬细胞LRP1在调节VWF炎症信号传导中起着关键作用gydF4y2Ba
最近有研究报道,人和小鼠巨噬细胞上的LRP1受体都能与VWF结合,并在体内调节VWF清除gydF4y2Ba25gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba.根据这些数据,我们证实,在抗lrp1抗体的存在下,VWF与原发性人巨噬细胞的结合被减弱(图1)。gydF4y2Ba7一个gydF4y2Ba).据报道,许多其他LRP1配体的结合可启动巨噬细胞内的信号传导gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba.为了研究VWF- lrp1的结合是否参与触发VWF促炎症信号,在RAP存在或不存在(200 nM)的情况下,用pd-VWF (10 μg/ml)培养原代巨噬细胞。在RAP存在的情况下,观察到vwf诱导的MAPKinase p38磷酸化显著降低(图。gydF4y2Ba7 b, cgydF4y2Ba).与之前的研究一致,LPS结合TLR4导致JNK、p-38和NF-κB激活gydF4y2Ba49gydF4y2Ba, RAP没有抑制lps诱导的p38磷酸化(补充图。gydF4y2Ba8 cgydF4y2Ba).此外,RAP没有减弱vwf诱导的JNK或NF-κB激活(图。gydF4y2Ba7 b, cgydF4y2Ba).与RAP数据一致,抗lrp1抑制抗体也显著降低了vwf诱导的p38信号,但不改变p65检测的NF-κB信号(图5)。gydF4y2Ba7 d, egydF4y2Ba).总之,这些发现表明VWF与巨噬细胞的相互作用驱动了p38 MAPKinase通路的激活,该通路至少部分通过LRP1受体进行调节。gydF4y2Ba
一个gydF4y2Ba采用流式细胞术检测pd-VWF在存在LRP1阻断抗体的情况下与人原代巨噬细胞的结合。流量门控策略在补充图中给出。gydF4y2Ba14gydF4y2Ba.抗lrp1抗体作用下VWF与巨噬细胞结合的代表性直方图(蓝色)和pd-VWF与巨噬细胞结合的代表性直方图(黑色)。gydF4y2BabgydF4y2Ba抑制人巨噬细胞LRP1结合受体相关蛋白(RAP)使p38磷酸化降低50% (*gydF4y2BaPgydF4y2Ba= 0.013), JNK和NF-κB活化无变化(ns =不显著,gydF4y2BaPgydF4y2Ba= 0.642和gydF4y2BaPgydF4y2Ba= 0.374)。gydF4y2BacgydF4y2Bawestern blots的密度测定由3个独立实验确定。gydF4y2BadgydF4y2Ba使用单克隆抗LRP1抗体抑制LRP1的效果与RAP抑制p38信号降低50%的效果相似(*gydF4y2BaPgydF4y2Ba= 0.0394), NK-κB活化无变化(gydF4y2BaPgydF4y2Ba= 0.953)。gydF4y2BaegydF4y2Bawestern blots的密度测定来自三个独立实验(平均值±SD)。显著性由Mann Whitney或t检验确定,其中*gydF4y2BaPgydF4y2Ba< 0.05。此图的源数据作为Source data文件提供。gydF4y2Ba
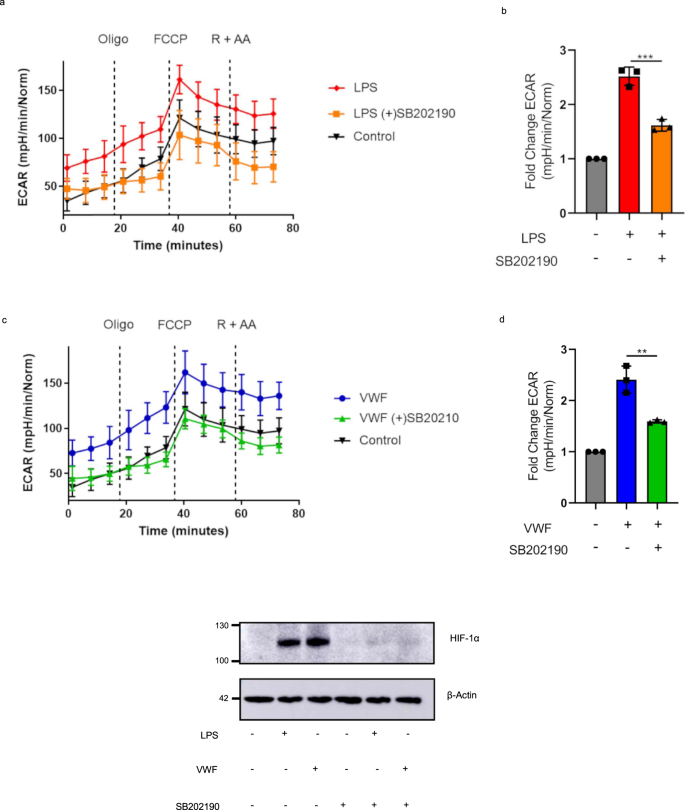
我们进一步研究了MAPKinase p38是否可能在调节巨噬细胞糖酵解过程中vwf依赖性的作用中发挥作用。重要的是,p38 MAPKinase抑制剂SB202190显著降低了LPS的能力(图。gydF4y2Ba8 a、bgydF4y2Ba)或VWF(图。gydF4y2Ba8 c, dgydF4y2Ba)促进巨噬细胞糖酵解,但不影响细胞活力(补充图。gydF4y2Ba8 bgydF4y2Ba).此外,这被证实依赖于HIF-1α,因为p38抑制也阻止了vwf诱导的下游HIF-1α激活(图1)。gydF4y2Ba8 egydF4y2Ba).综上所述,这些研究结果表明,VWF与LRP1相互作用引发的巨噬细胞促炎作用是通过p38激活介导的,这反过来又导致HIF-1α的早期稳定和糖酵解的增强。gydF4y2Ba
BMDMs细胞外酸化率(ECAR)的代表图和基础ECAR在处理3 h后的折叠变化柱状图gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2BaLPS (100 ng/ml)或gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2BaVWF (10 μg/ml)加或不加p38抑制剂SB202190 (50 μM)预处理1 h。折叠变化ECAR由三个独立实验±SEM测定。显著性用方差分析(**gydF4y2BapgydF4y2Ba< 0.01)。gydF4y2BaegydF4y2Ba分别用pd-VWF (10 μg/ml)或LPS (100 ng/ml)加SB202190 (50 μM)预处理BMDMs 3 h。Western blot检测HIF-1α水平,β-肌动蛋白检测总蛋白水平。所有的实验都是重复进行的,该图的源数据作为源数据文件提供。gydF4y2Ba
与之前的研究一致gydF4y2Ba25gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,我们观察到VWF中的多个结构域有助于巨噬细胞的结合(补充图。gydF4y2Ba10 a egydF4y2Ba).初步实验表明,n端VWF-D 'A3和c端VWF-A3CK截断体均可与巨噬细胞结合(补充图。gydF4y2Ba10 cgydF4y2Ba).全长VWF和VWF截断(VWF- a1a2a3和VWF- d 'A3)与巨噬细胞的结合在利豆素的存在下显著增强,这导致了A1结构域的展开,类似于剪切应力诱导的展开(补充图)。gydF4y2Ba10 b、DgydF4y2Ba).最后,我们分别评估了单个A1、A2和A3结构域的巨噬细胞结合。在A1结构域观察到显著的结合,但在A2或A3结构域都没有(补充图。gydF4y2Ba10 egydF4y2Ba).类似地,我们观察到多个VWF结构域(包括VWF- d 'A3, VWF- a1a2a3和VWF- a1)可以与固定化LRP1结合,并且在利斯托丁存在时,这种结合增强。总的来说,这些发现突出了A1结构域在调节巨噬细胞和LRP1相互作用中的关键作用,但进一步证实了VWF的其他N端和c端结构域也可以与巨噬细胞相互作用。在剪切应力条件下,针对A1结构域的抗VWF抗体可以减弱但不能完全抑制VWF与巨噬细胞的结合,这一观察结果支持了这一假设(补充图。gydF4y2Ba11gydF4y2Ba).gydF4y2Ba
VWF在体内具有促炎和化学吸引作用gydF4y2Ba
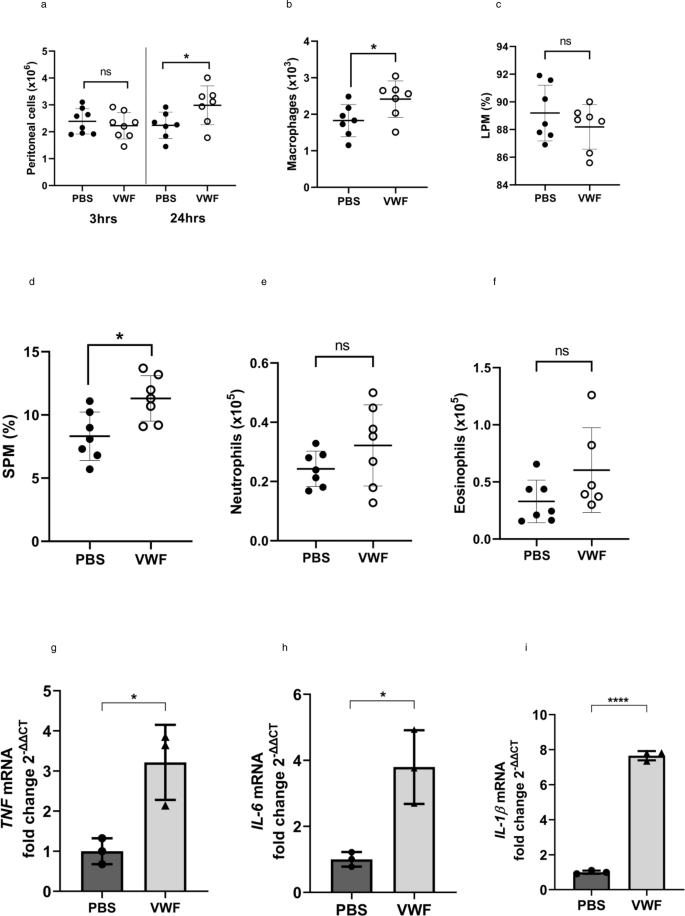
体外VWF与巨噬细胞的结合与M1促炎表型的极化、代谢变化以及促炎细胞因子和趋化因子的产生有关。为了进一步研究这些观察结果在体内的潜在意义,我们利用先前描述的趋化性模型,将临床级rVWF或生理盐水对照注射到野生型小鼠的腹膜中gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba.然后进行腹腔灌洗,回收腹膜渗出细胞(PEC)进行流式细胞术分析。gydF4y2Ba12gydF4y2Ba).临床级VWF腹腔注射小鼠3小时后,与pbs注射的对照组小鼠相比,从腹膜中恢复的细胞总数没有显著减少,PEC的细胞组成没有变化(图1)。gydF4y2Ba9gydF4y2Ba).相比之下,24小时后显著(gydF4y2BaPgydF4y2Ba与pbs注射小鼠相比,注射vwf的小鼠恢复的PEC数量增加< 0.05。gydF4y2Ba9gydF4y2Ba).PEC细胞的流式细胞术表型分析表明,临床级VWF可引起显著的(gydF4y2BaPgydF4y2Ba< 0.05)腹腔巨噬细胞(CD45 + CD11b + siglecl - ly6g -)增加(图。gydF4y2Ba9 bgydF4y2Ba).小鼠腹膜中存在CD45 + CD11b + siglecl - ly6g -两个巨噬细胞亚群。大的腹膜常驻巨噬细胞(LPM)群体(F4/80hiMHCIIlo)构成了稳定状态下幼稚小鼠腹膜巨噬细胞的主要群体(~ 80-90%)。相反,小的腹膜巨噬细胞(SPM;F4/80lowMHCIIhi)是对炎症刺激产生反应的少数(~10%)人群。注射VWF没有显著改变常住LPM的数量,但导致显著增加(gydF4y2BaPgydF4y2BaSPM < 0.05)。gydF4y2Ba9 c, dgydF4y2Ba).相比之下,临床级VWF没有引起腹膜内嗜中性粒细胞或嗜酸性粒细胞的任何显著变化(图。gydF4y2Ba9 e, fgydF4y2Ba).为了进一步验证VWF处理后腹腔巨噬细胞在体内流式细胞仪检测到的变化,分别从PEC中分离VWF和PBS处理前后的RNA。与我们之前的RNAseq数据和体外研究一致,vwf治疗与PEC中TNF、IL-6和IL-1β表达显著增加相关(图1)。gydF4y2Ba9胃肠道gydF4y2Ba).总的来说,这些体内数据支持巨噬细胞是VWF诱导的促炎反应的主要靶点的假设。gydF4y2Ba
小鼠腹腔注射VWF (2 mg/kg)或PBS(对照组)。注射3或24 h后,处死小鼠,进行腹腔灌洗,回收腹腔渗出细胞(PEC),用流式细胞术分析(见补充图)。gydF4y2Ba10gydF4y2Ba)和基因表达的qPCR分析。gydF4y2Ba一个gydF4y2Ba从小鼠身上回收的PEC细胞总数(gydF4y2BaPgydF4y2Ba= 0.508和*gydF4y2BaPgydF4y2Ba= 0.0428,分别为3和24 h)。gydF4y2BabgydF4y2Ba小鼠PEC中巨噬细胞数量(*gydF4y2BaPgydF4y2Ba= 0.0383)和相对频率(%)gydF4y2BacgydF4y2Ba大腹膜巨噬细胞(LPM) (gydF4y2BaPgydF4y2Ba= 0.320和gydF4y2BadgydF4y2Ba腹膜小巨噬细胞(SPM) (*gydF4y2BaPgydF4y2Ba= 0.0108)。的数量gydF4y2BaegydF4y2Ba中性粒细胞(gydF4y2BaPgydF4y2Ba= 0.187)和gydF4y2BafgydF4y2BaPEC中的嗜酸性粒细胞(gydF4y2BaPgydF4y2Ba= 0.112)。数据以每组7 - 8只小鼠和两个生物重复的平均值±SD表示。gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba为了验证VWF处理后腹腔巨噬细胞在体内流式细胞仪检测到的变化,分别从PEC中分离VWF和PBS处理前后的RNA。与我们的RNAseq数据和体外研究一致,vwf治疗与显著增加gydF4y2BaggydF4y2Ba肿瘤坏死因子(* * *gydF4y2BaPgydF4y2Ba= 0.0004),gydF4y2BahgydF4y2Bail - 6 (* *gydF4y2BaPgydF4y2Ba= 0.0061),和gydF4y2Ba我gydF4y2Bail - 1β(* * * *gydF4y2BaPgydF4y2Ba3 h时PEC中< 0.0001)的表达。统计学意义测定使用gydF4y2BatgydF4y2Ba-test in which *gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001。此图的源数据作为Source data文件提供。gydF4y2Ba
讨论gydF4y2Ba
近年来越来越多的资料表明,VWF不仅调节初级止血,而且对炎症反应有直接影响gydF4y2Ba10gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba.VWF的这些促炎特性已在各种不同的小鼠炎症疾病模型中被观察到,并已在使用VWF阻断抗体或VWF的实验中得到独立验证gydF4y2Ba−−/gydF4y2Ba老鼠gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.然而,VWF的免疫调节作用的生物学机制仍然知之甚少。体外研究证实,固定化VWF可直接与白细胞结合gydF4y2Ba31gydF4y2Ba,gydF4y2Ba53gydF4y2Ba.在流动条件下,VWF-白细胞相互作用由最初的短暂滚动(通过VWF与白细胞PSGL-1结合介导)和随后的稳定粘附(通过VWF与白细胞β2-整合素结合介导)组成。gydF4y2Ba31gydF4y2Ba.与先前的研究一致,表明肝脏库普弗细胞在调节VWF清除方面的作用gydF4y2Ba24gydF4y2Ba,gydF4y2Ba26gydF4y2Ba我们观察到pd-VWF和重组VWF分别与原发性人类巨噬细胞、THP-1巨噬细胞和小鼠BMDMs结合。然而,正如之前报道的,未见明显的VWF与未分化的原代单核细胞结合gydF4y2Ba31gydF4y2Ba.基于这些发现,我们认为VWF和单核细胞在正常血液中一起循环,相互作用极小。然而,在血管损伤部位,VWF与组织内巨噬细胞接触。VWF会与这些巨噬细胞结合因为它们表达了不同的表面受体。重要的是,我们的数据进一步强调了VWF不是简单地与巨噬细胞结合。相反,VWF结合还启动了重要的下游信号通路效应,包括MAPKinase促炎通路p38和JNK的磷酸化,以及NF-κB的激活。虽然以前没有描述过VWF诱导巨噬细胞中的信号,但我们的研究结果与之前的研究一致,表明VWF与血小板上的糖蛋白(GP) b- ix - v受体结合会导致复杂的胞内信号,涉及许多不同的胞内分子,包括Src家族、Rac1、pi3 -激酶/Akt和MAP激酶gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba.gydF4y2Ba
为了保持与VWF与原发性人类巨噬细胞或小鼠BMDMs结合相关的促炎信号,我们观察到(i)促炎细胞因子表达(ii)趋化因子表达(iii) iNOS表达和ROS产生的显著增加。此外,VWF结合诱导大多数巨噬细胞采用M1炎症表型。不出所料,考虑到这些对巨噬细胞生物学的主要影响,利用细胞外通量分析,我们观察到VWF对巨噬细胞代谢,特别是糖酵解也有显著影响。与pd-或重组VWF短时间孵育后,巨噬细胞糖酵解的初始显著增加,与LPS观察到的相似。糖酵解仍随着LPS暴露时间的延长而升高,但在VWF暴露时间较长时,糖酵解并没有持续升高。有趣的是,观察到长时间LPS刺激对氧化磷酸化的抑制,VWF没有发生。与其他报告一致gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2BaLPS刺激导致线粒体裂变增加,在VWF短时间孵育时也观察到类似的裂变增加。通过VWF观察到的增强裂变可能有助于这些细胞中较高的线粒体ROS和促炎表型的促进。同样,巨噬细胞HIF-1α的表达水平显著增加(已知在促进巨噬细胞糖酵解中发挥重要作用)gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba)在VWF孵育3小时后观察到,但在16小时后恢复正常。我们的数据进一步证明MAPKinase p38参与了VWF处理后HIF-1α依赖性的快速糖酵解的激活。总的来说,这些数据支持VWF结合对巨噬细胞生物学有显著但短期的促炎作用的假设。gydF4y2Ba
以前的研究强调了VWF与巨噬细胞接触时的一些重要临床情况。特别是,在组织损伤和血管损伤后,VWF从血浆逃逸到内皮下,在那里与组织内的巨噬细胞接触。根据我们的研究结果,很明显,vwf结合将触发这些巨噬细胞采用M1表型,导致血管损伤部位分泌促炎细胞因子和趋化因子,并进一步将巨噬细胞招募到损伤部位。因此,我们的数据强调,VWF不仅在血管损伤部位的原发性止血和血小板堵塞形成中起关键作用,而且它还可以通过启动附近的巨噬细胞来促进促炎症反应,在先天免疫中发挥作用。gydF4y2Ba
本文所述的vwf结合对巨噬细胞生物学的促炎作用在血管损伤部位之外还有其他重要的意义。先前的meta分析和系统综述报道了VWF水平升高与缺血性心脏病(IHD)风险增加有关。gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba.相反,血管性血友病患者似乎相对免受IHD的发展gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba.此外,ABO血型也被证明是心血管疾病的一个危险因素,与非O血型(a、B或AB)个体相比,O血型的心血管风险显著降低。值得注意的是,O型血受试者的血浆VWF水平比非O型血受试者低20-30%gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba.有趣的是,研究在VWF中进行gydF4y2Ba−−/gydF4y2BaLDLRgydF4y2Ba−−/gydF4y2Ba与VWF相比,双敲除小鼠的动脉粥样硬化斑块形成明显减少gydF4y2Ba+/+gydF4y2BaLDLRgydF4y2Ba−−/gydF4y2Ba控制gydF4y2Ba65gydF4y2Ba.重要的是,在VWF中也观察到动脉粥样硬化斑块内巨噬细胞聚集的显著减少gydF4y2Ba−−/gydF4y2Ba老鼠gydF4y2Ba65gydF4y2Ba.此外,最近的研究使用ADAMTS13进行gydF4y2Ba−−/gydF4y2Ba小鼠进一步支持VWF在IHD发病机制中起重要作用的假说。ApoE中巨噬细胞再次聚集到动脉粥样斑块病变中显著增加gydF4y2Ba−−/gydF4y2Ba/ ADAMTS13gydF4y2Ba−−/gydF4y2Ba与ApoE相比gydF4y2Ba−−/gydF4y2Ba/ ADAMTS13gydF4y2Ba+/+gydF4y2Ba控制gydF4y2Ba66gydF4y2Ba.综上所述,这些发现支持了VWF在调节巨噬细胞向动脉粥样硬化斑块募集中发挥作用的假设。gydF4y2Ba
最近的研究报道了许多巨噬细胞受体可以调节VWF的结合gydF4y2Ba26gydF4y2Ba.我们的数据表明,VWF与LRP1结合在巨噬细胞中触发促炎症信号中起着特定的作用。因此,使用RAP或抗lrp1抗体抑制lrp1结合显著减弱了VWF驱动MAPKinase p38磷酸化和随后HIF-1α激活的能力(补充图)。gydF4y2Ba13gydF4y2Ba-图形摘要)。相比之下,LRP1的抑制不能减弱vwf诱导的JNK或NF-κB的激活。总之,这些数据证明了LRP1在驱动vwf依赖性巨噬细胞激活方面的作用,但进一步表明其他巨噬细胞受体也参与其中。有趣的是,与LRP1结合的组织型纤溶酶原激活物(tPA)在调节巨噬细胞激活中的作用也被提出gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba.而正常血药浓度VWF为~10µg/ml,而tPA为<20 ng/ml。从VWF的角度来看,VWF的几个不同结构域参与了LRP1结合的调节gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba.特别是,我们最近描述了VWF A1域在这方面的关键作用gydF4y2Ba25gydF4y2Ba.由于VWF作为一系列异质多聚体循环,巨噬细胞表面复杂相互作用的潜力很明显。进一步研究参与调节VWF促炎信号作用的其他巨噬细胞受体的特性,以及研究不同受体之间潜在的协同结合作用,将具有重要意义。gydF4y2Ba
综上所述,近年来的研究描述了止血与炎症之间存在于体内的复杂的相互作用,并提出了免疫血栓形成的概念gydF4y2Ba67gydF4y2Ba,gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba.我们的数据确定了VWF在驱动炎症反应中的生物学作用和机制,从而建立了原发性止血和先天免疫之间的另一种联系。因此,VWF不仅在血管损伤部位的止血启动中起关键作用,而且还能启动局部巨噬细胞启动促炎症反应。在这种局部环境下,我们认为VWF作为一种损伤信号,可通过特定的巨噬细胞模式识别受体识别。此外,我们的研究结果还为VWF结合对巨噬细胞生物学的影响提供了见解,这可能有助于解释越来越多的证据表明,VWF参与了许多不同小鼠炎症疾病模型的发病机制。考虑到与炎症病理相关的显著发病率和死亡率,确定VWF在这方面的作用可能提供令人兴奋的机会,开发针对这些途径的新疗法,解决一个重要的未满足的临床需求。gydF4y2Ba
方法gydF4y2Ba
该研究获得了圣詹姆斯医院研究伦理委员会(2017/01/6)和爱尔兰输血协会(IBTS-004-03-18)的批准。所有健康献血者均提供书面知情同意。所有小鼠实验均得到爱尔兰皇家外科医生学院伦理委员会(REC1315)的批准,并完全按照爱尔兰卫生产品监管局(AE19136/P040)的要求,在6-8周大的小鼠上进行。gydF4y2Ba
试剂gydF4y2Ba
人血浆源性血管性血友病因子-游离因子VIII (VWF)(血液学技术公司),重组血管性血友病因子,VonVendi®(r-VWF) (Takeda),超纯脂多糖(LPS) (Sigma), INFγ (Life Technologies, Gibco), IL-4 (Life Technologies, Gibco), IL-10 (Life Technologies, Gibco), IL-13 (Life Technologies, Gibco)。重组小鼠M-CSF (rm M-CSF) (R&D系统),细胞追踪器绿色CMFDA染料(Thermofisher),海马XF细胞Mito应激细胞试剂盒(Agilent),人抗p38, P-p38, JNK, P-JNK, IKBα, P-IKBα, p65, P-p65, HIF-1α, β-actin(细胞信号技术公司),Alexa Fluor 488偶联物(分子探针,Thermofisher Scientific)。gydF4y2Ba
细胞培养gydF4y2Ba
外周血单个核细胞(PBMC)经组织法(Sigma)梯度分离后从健康供体棕黄皮中分离。使用抗cd14珠(Miltenyi Biotec)分离单核细胞。分离的单核细胞在添加10%人血清(Sigma)、青霉素-链霉素100µg/ml (Life Technologies, Gibco)的RPMI培养基中分化为巨噬细胞7-10天。小鼠PBMC从8 ~ 12周龄C57/B6JB小鼠骨髓中分离得到。PBMC在添加10%胎牛血清(Life Technologies, Gibco)、25 ng/ml rmM-CSF和100ug/ml青霉素-链霉素的RPMI中孵育7天,以产生骨髓来源的巨噬细胞(BMDM)。THP1单核细胞在100 nM PMA (Sigma)存在下分化为巨噬细胞3天。gydF4y2Ba
西方墨点法gydF4y2Ba
细胞在添加蛋白酶(默克)和磷酸酶(西格玛)抑制剂的RIPA缓冲液中裂解,并使用BCA蛋白检测试剂盒(Pierce, ThermoFisher)进行归一化处理。采用SDS-PAGE对样品进行解析。一抗在4°C孵育过夜,随后与IgG-HRP抗体孵育。用化学发光染色(ECL, Pierce, Thermofisher)培养印迹。gydF4y2Ba
mRNA分离和qRT-PCRgydF4y2Ba
用Trizol (Sigma)法分离总mRNA。利用RevertAid逆转录酶(ThermoFisher)合成cDNA,利用Life Technologies 7500 Real-Time PCR系统用Go Taq qPCR master mix (Promega)进行RT-qPCR。mRNA水平归一化为β-actin。为了测定PHD3和iNOS的激活,从人原代巨噬细胞中分离出VWF或LPS处理24 h后的细胞裂解物和RNA。引物序列见补充表gydF4y2Ba1克ydF4y2Ba.gydF4y2Ba
细胞因子分析gydF4y2Ba
人原发性巨噬细胞IL-1β、TNFα和IL-6细胞因子在添加1 mM CaCl的RPMI中以10µg/ml的VWF或100 ng/ml的LPS处理4小时或24小时后,用ELISA (Invitrogen)量化gydF4y2Ba2gydF4y2Ba.用VWF或LPS孵育24小时后,检测到人原发性巨噬细胞炎症小体激活。随后,在血清游离RPMI中用5 mM ATP孵育细胞1小时,用western blot(山羊抗-pro- il -1β CST)测定pro- il -1β。gydF4y2Ba
RNA序列gydF4y2Ba
BMDM在添加10%胎牛血清、青霉素(100 IU/ml)、链霉素(100ug/ml)和重组小鼠(M-CSF, 25 μg/ml)的RPMI GlutMax中孵育过夜。洗净细胞后,用pd-VWF (10 μg/ml)或LPS (100 ng/ml)分别孵育3.5 h (T1)和16 h (T2)。除去上清,用PBS冲洗BMDM。RNA用RNeasy Kit (QIAGEN)提取,样品在−80°C冷冻。RNA测序分析由NovaSeq 6000 S4平台使用NovaSeq 6000 S4进行。将接受治疗的BMDM与未受刺激的BMDM对照进行比较。gydF4y2Ba
RNAseq数据分析gydF4y2Ba
长度为150 bp的配对端reads被映射到小鼠组件GRC38 (mm10)上,并使用短读取映射器STAR进行量化gydF4y2Ba70gydF4y2Ba.低表达基因的去除基于TPM值(转录本每百万)。在所有用于比较的样本中,保持在10tpm以下的基因被排除在外。用DESeq2进行差异表达分析gydF4y2Ba71gydF4y2Ba.对于主成分分析,数据转换使用正则化对数转换与DESeq2。使用R中的prcomp函数和所有通过TPM截止的基因(gydF4y2BangydF4y2Ba= 8737)。采用Benjamini-Hochberg法对p值进行多次检验校正。差异表达基因采用FDR < 0.05和|log2 foldchange| > 1进行鉴定。热图和火山图是在R中使用软件包ComplexHeatmap(2.12.0版本)和ggplot2(3.3.6版本)生成的。gydF4y2Ba
VWF与人和小鼠巨噬细胞结合gydF4y2Ba
为了通过流式细胞术评估VWF与巨噬细胞的结合,将人单核细胞来源的巨噬细胞与pd-或重组VWF在RPMI + 1 mM CaCl中孵育gydF4y2Ba2gydF4y2Ba在冰上放置30分钟。使用Fc- γ受体抑制剂(Thermofisher)阻断Fc受体。使用多克隆兔抗人VWF (Dako, Agilent)检测结合VWF 30分钟,然后使用抗兔Alexa-488 (Thermofisher)检测结合VWF 30分钟。结合重组VWF用pe标记的Anti-His Tag抗体(BioLegand)检测。gydF4y2Ba
在共聚焦显微镜下,单核细胞在玻璃盖玻片上分化(Nunc, Lab-Tek)。巨噬细胞用10µg/ml的VWF在添加CaCl的RPMI中室温培养gydF4y2Ba2gydF4y2Ba1毫米,30分钟。用fc - γ受体抑制剂(ThermoFisher)和3% BSA阻断细胞,并用抗vwf和抗兔Alexa 488培养细胞。将THP1细胞分化并用抗vwf抗体和抗早期内体抗原1 (EEA1)抗体(Santa-Cruz)孵育。细胞膜用深红色细胞掩膜标记(分子探针,Thermofisher Scientific),细胞用固定介质和原位DAPI染色(Sigma)安装。gydF4y2Ba
为了进一步描述特异性VWF结构域在调节与巨噬细胞和LRP1受体相互作用中的作用,我们像之前一样表达和纯化了一系列重组VWF截断gydF4y2Ba25gydF4y2Ba.简单地说,表达载体pcDNA-VWF编码全长rVWF之前已经被描述过gydF4y2Ba25gydF4y2Ba.一个含有VWFA1A2A3(残基1260 ~ 1874)的DNA片段通过NheI和PmeI限制位点插入表达载体pepr -IBA 42 (IBA, Germany)。同样的方法用于表达VWFA1(残基1239-1472)、VWFA2(残基1473-1668)和VWFA3(残基1671-1878)。人全长重组VWF (rVWF)、VWF- d 'A3、VWF- a3ck、VWF- a1a2a3、VWF- a1、VWF- a2和VWF- a3均在HEK293T细胞中瞬时表达。收集条件血清游离培养基,浓缩,并通过镍亲和层析进一步纯化gydF4y2Ba25gydF4y2Ba.随后,使用流式细胞术评估VWF截断与BMDM和THP-1巨噬细胞的结合。在存在或不存在利豆素(1.5 mg/ml)的情况下进行结合研究。gydF4y2Ba
为了研究剪切作用下VWF与巨噬细胞的相互作用,将THP-1细胞重悬于分化培养基(无血清RPMI培养基,0.1% BSA, 1mm MnCl)中gydF4y2Ba2gydF4y2Ba和100 nM PMA)在37°C下放置15分钟。将分化的THP-1细胞用cmfda -细胞追踪器绿色(Invitrogen)在2.5 μ M下在37°C下荧光标记30 min。在无蛋白阻断溶液(PFBS) (Thermo Fisher)中,将pd-VWF涂在μ-玻片VI 0.4(德国Ibidi GmbH)上过夜。未涂覆的对照通道用PFBS堵塞。采用注射泵(Nemesys S, Cetoni GmbH, Germany)诱导层流剪切流动。将滑梯的每个通道连接到泵上,分化的THP-1细胞以0.25 ml/min的速度在通道间灌注,对应的静脉壁剪切速率为0.31 dyn cmgydF4y2Ba−2gydF4y2Ba.利用meamorph v7.8.2软件控制的Zeiss Axiovert显微镜上的EM-CCD相机(Andor iXon 888)实时观察vwf粘附的THP-1细胞。使用10x Plan Neofluar (NA 0.3)物镜以每秒17帧的速度获取延时图像序列。随后,对延时图像序列进行分析。简单地说,在每一帧中都检测到荧光标记的THP-1细胞。细胞的xy位置和面积被传递到粒子跟踪软件uTrack,长度小于3帧的轨迹被丢弃。随着时间的推移,对累计音轨数同时进行全局拟合,以获得绑定率(细胞数mm)gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)和脱离率(sgydF4y2Ba−1gydF4y2Ba).用结合率除以分离率计算平衡表面覆盖率。剪切灌注实验在多克隆抗vwf或抗a1区域抗体(20µg/ml)的存在下进行。gydF4y2Ba
VWF在巨噬细胞极化中的作用gydF4y2Ba
小鼠骨髓源性巨噬细胞(BMDM)与rmM-CSF (25 ng/ml)培养24 h。此外,添加LPS (100 ng/ml)和IFNγ (20 ng/ml)可生成M1极化表型。加入IL-4 (40 ng/ml)、IL-13 (20 ng/ml)和IL-10 (10 ng/ml)生成M2极化巨噬细胞。或者,VWF (10 μg/ml)在RPMI与1 mM CaClgydF4y2Ba2gydF4y2Ba是使用。用流式细胞仪检测细胞表面标记物的表达。M1巨噬细胞CD11b (BioLegend)和CD38 (BioLegend)双阳性。M2双阳性CD11b和CD206 (BioLegend)。使用CellROX DeepRed染色(ThermoFisher)检测细胞活性氧香料(ROS)的生成。BMDM与VWF或LPS孵育3 h,用Live-Dead FITC (ThermoFisher)排除死亡细胞后,流式细胞术分析。gydF4y2Ba
vwf介导的单核细胞趋化和迁移的测定gydF4y2Ba
用VWF (10 μg/ml)或LPS (100 ng/ml)刺激含CaCl的RPMI BMDMgydF4y2Ba2gydF4y2Ba(1 mM)和M-CSF (25 ng/ml) 24小时。收集上清并放置在较低的腔室,分离的人类幼稚单核细胞放置在顶部腔室。单核细胞迁移至下腔2.5 h。使用细胞追踪器绿色(ThermoFisher)染色30分钟。使用ImageJ软件量化细胞计数,并表示为与对照的倍数变化。gydF4y2Ba
VWF对巨噬细胞代谢的影响gydF4y2Ba
BMDM分化后,细胞以5 × 10的密度接种到海马XF96培养板(Agilent)中gydF4y2Ba5克ydF4y2BaLPS (100 ng/ml)或VWF (10 μg/ml)刺激RPMI 3 h或16 h,添加1 mM CaClgydF4y2Ba2gydF4y2Ba.处理后,BMDM在CO中与海马酚红无碱培养基孵育gydF4y2Ba2gydF4y2Ba免费孵化器按照制造商的说明(安捷伦)。为了测定细胞外酸化和耗氧率(ECAR和OCR),根据制造商的说明使用海马水户应激试剂盒(Agilent)。BMDMs分别用线粒体复合物V抑制剂寡霉素(Oligio)、线粒体膜解偶联剂羰基氰化物对三氟甲氧氧苯腙(FCCP)和复合物I和III抑制剂鱼藤酮和抗霉素A (R + AA)处理。gydF4y2Ba37gydF4y2Ba,gydF4y2Ba72gydF4y2Ba.此外,在与VWF或LPS孵育之前,使用p38 atp酶抑制剂SB202190 (50 μM)进行1小时的预处理。使用Leica SP8扫描共聚焦显微镜在活细胞成像下测定线粒体形态。将BMDM以1 × 10的速度接种于4个Ibidi培养皿中gydF4y2Ba5克ydF4y2Ba细胞/。细胞用MitoTracker™Red(分子探针,Thermo fisher)染色,每次处理20张图像。使用Fiji ImageJ软件对图像进行线粒体形态分析。平均每个细胞有60个线粒体。线粒体碎裂<1 μm,延长>3 μmgydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba.gydF4y2Ba
VWF在腹膜免疫细胞募集中的作用gydF4y2Ba
所有动物实验都得到了都柏林三一学院动物研究伦理委员会的批准,并符合爱尔兰健康产品监管局的规定。总之,所有实验均采用8-12周龄成年雌性C57BL/6J株小鼠。动物被安置在特定的无病原体设施中,在正压下单独通风和过滤的笼子中。小鼠腹腔注射临床级rVWF (2 mg/kg)或PBS。3 h和24 h后扑杀小鼠,腹腔注射灌洗液(PBS),细胞恢复。含腹膜渗出细胞(PECs)的灌洗液在400 ×离心gydF4y2BaggydF4y2Ba4℃孵育10 min,计数细胞进行流式细胞仪和qPCR检测。gydF4y2Ba
用流式细胞仪检测腹膜细胞表面标记物的表达。gydF4y2Ba10gydF4y2Ba)gydF4y2Ba73gydF4y2Ba,gydF4y2Ba74gydF4y2Ba.PECs用Fc-block抗小鼠CD16/CD32单抗(Invitrogen, Waltham, USA)重悬。细胞被抗f4 /80- fitc (Biolegend, San Diego, USA)、抗siglec F-APC (Invitrogen)、抗cd11b - apc - cy7 (Biolegend)、抗ly6g - bv650 (Biolegend)、抗cd45 - bv711 (Biolegend)、抗mhc - ii - pe (Biolegend)染色。一个活/死标记(Life/ dead Aqua;包括Thermo Scientific, Waltham, USA),以确保仅对活细胞进行分析。PEC细胞被门控为嗜酸性粒细胞(CD45gydF4y2Ba+gydF4y2BaCD11bgydF4y2Ba-gydF4y2BaSiglecFgydF4y2Ba+gydF4y2Ba)、中性粒细胞(CD45gydF4y2Ba+gydF4y2BaCD11bgydF4y2Ba+gydF4y2BaSiglecFgydF4y2Ba-gydF4y2BaLy6GgydF4y2Ba+gydF4y2Ba)、巨噬细胞(CD45gydF4y2Ba+gydF4y2BaCD11bgydF4y2Ba+gydF4y2BaSiglecFgydF4y2Ba-gydF4y2BaLy6GgydF4y2Ba-gydF4y2BaF4/80gydF4y2Ba+gydF4y2Ba),腹膜小巨噬细胞(SPM;CD45gydF4y2Ba+gydF4y2BaCD11bgydF4y2Ba+gydF4y2BaSiglecFgydF4y2Ba-gydF4y2BaLy6GgydF4y2Ba-gydF4y2BaF4/80gydF4y2Ba低gydF4y2BaMHCIIgydF4y2Ba嗨gydF4y2Ba)和大量腹膜巨噬细胞群(LPM;CD45gydF4y2Ba+gydF4y2BaCD11bgydF4y2Ba+gydF4y2BaSiglecFgydF4y2Ba-gydF4y2BaLy6GgydF4y2Ba-gydF4y2BaF4/80gydF4y2Ba嗨gydF4y2BaMHCIIgydF4y2Ba罗gydF4y2Ba使用BD LSR Fortessa流式细胞仪(BD Biosciences, Franklin Lakes, USA)获取细胞,然后用FlowJo软件(Tree Star, OR USA)进行分析。gydF4y2Ba
数据展示和统计分析gydF4y2Ba
所有实验数据和统计分析均使用GraphPad Prism程序(GraphPad Prism 5.0版本用于Windows;GraphPad软件公司圣地亚哥,加州)。数据以平均值±标准差(SD)表示。为了评估统计差异,数据分析使用学生的未配对双尾gydF4y2BatgydF4y2Ba或用方差分析比较三个或三个以上组在Kolmogorov-Smirnov或Shapiro-Wilk检验后的正态性。对于所有的统计检验,gydF4y2BaPgydF4y2Ba< 0.05为显著值。gydF4y2Ba
报告总结gydF4y2Ba
关于研究设计的进一步信息可在gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到本文。gydF4y2Ba
数据可用性gydF4y2Ba
本研究产生的数据在补充信息/源数据文件中提供。RNA-Seq数据文件已提交到NCBI的基因表达集合,并存储在登录号下gydF4y2BaGSE205365gydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
l婷,P. J, Christophe, O. D. & Denis, C. V. von Willebrand因子的生物合成、分泌和清除:连接远端。gydF4y2Ba血gydF4y2Ba125gydF4y2Ba, 2019-2028(2015)。gydF4y2Ba
李贝克,F. W. G. &艾肯布姆,J. C. J.冯·维勒布兰德病。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba376gydF4y2Ba, 701-702(2017)。gydF4y2Ba
福格蒂,H, Doherty, D. & O 'Donnell, J. s。血管性血友病的新进展。gydF4y2BaBr。j . HaematolgydF4y2Ba.gydF4y2Ba191gydF4y2Ba, 329-339(2020)。gydF4y2Ba
低VWF:对发病机制、诊断和临床管理的见解。gydF4y2Ba血供订购。gydF4y2Ba4gydF4y2Ba, 3191-3199(2020)。gydF4y2Ba
Bockenstedt, P, Greenberg, J. M. & Handin, R. I.血管性血友病因子与血小板糖蛋白Ib和胶原蛋白结合的结构基础。聚合冯·维勒布兰德因子二硫还原和有限蛋白水解的影响。gydF4y2Baj .中国。投资。gydF4y2Ba77gydF4y2Ba, 743-749(1986)。gydF4y2Ba
Moake, J. L., Turner, n.a, Stathopoulos, n.a, Nolasco, L. H. & Hellums, J. D.血浆血管性血友病因子(vWF)多聚物和内皮细胞衍生的异常大的vWF形式在剪切应力诱导血小板聚集中的作用。gydF4y2Baj .中国。投资。gydF4y2Ba78gydF4y2Ba, 1456-1461(1986)。gydF4y2Ba
图雷切克,P. L.,约翰森,J. M., Pipe, S. W. & O 'Donnell, J. S. i Psg。血友病中ⅷ因子清除率个体间差异的生物学机制。gydF4y2Ba血友病gydF4y2Ba26gydF4y2Ba, 575-583(2020)。gydF4y2Ba
斯塔克,R. D.等人。内皮血管性血友病因子调节血管生成。gydF4y2Ba血gydF4y2Ba117gydF4y2Ba, 1071-1080(2011)。gydF4y2Ba
O’sullivan, J. M., Preston, R. J. S., Robson, T. & O’donnell, J. von Willebrand因子在癌细胞生物学中的新作用。gydF4y2BaSemin。Thromb。Hemost。gydF4y2Ba44gydF4y2Ba, 159-166(2018)。gydF4y2Ba
卡维奇,C,兰婷,P. J.和丹尼斯,C. V.冯·维勒布兰德因子与炎症。gydF4y2Baj . Thromb。Haemost。gydF4y2Ba15gydF4y2Ba, 1285-1294(2017)。gydF4y2Ba
等。血管性血友病因子在血管炎症中的作用:从发病机制到靶向治疗。gydF4y2Ba介质Inflamm。gydF4y2Ba2017gydF4y2Ba, 5620314(2017)。gydF4y2Ba
Hillgruber, C.等人。阻断血管性血友病因子治疗皮肤炎症。gydF4y2Baj .投资。北京医学。gydF4y2Ba134gydF4y2Ba, 77-86(2014)。gydF4y2Ba
Petri, B. et al. von Willebrand因子促进白细胞外渗。gydF4y2Ba血gydF4y2Ba116gydF4y2Ba, 4712-4719(2010)。gydF4y2Ba
von Willebrand因子是盲肠结扎和穿刺诱导的小鼠败血症中ADAMTS-13下降的主要决定因素。gydF4y2Baj . Thromb。Haemost。gydF4y2Ba7gydF4y2Ba, 843-850(2009)。gydF4y2Ba
亚当,F.等人。基因工程的血管性血友病2B型小鼠模型显示止血和炎症缺陷。gydF4y2Ba科学。代表。gydF4y2Ba6gydF4y2Ba, 26306(2016)。gydF4y2Ba
Ayme, G.等人。一种新的抗血管性血友病因子A1结构域的单结构域抗体可解决炎症过程中白细胞募集和血管渗漏的问题——简要报告。gydF4y2BaArterioscler。Thromb。Vasc。医学杂志。gydF4y2Ba37gydF4y2Ba, 1736-1740(2017)。gydF4y2Ba
Kasuda, S.等。盲肠结扎穿刺小鼠败血症模型中血管性血友病因子在中性粒细胞招募中的相关作用。gydF4y2BaHaematologicagydF4y2Ba101gydF4y2Ba, e52-e54(2016)。gydF4y2Ba
O 'Regan等人。冯·维勒布兰德因子在实验性脑性疟疾发病机制中的新作用。gydF4y2Ba血gydF4y2Ba127gydF4y2Ba, 1192-1201(2016)。gydF4y2Ba
O’sullivan, J. M., Preston, R. J., O’regan, N. & O’donnell, J. S.疟疾发病机制中止血功能障碍的新角色。gydF4y2Ba血gydF4y2Ba127gydF4y2Ba, 2281-2288(2016)。gydF4y2Ba
Reinhart, K, Bayer, O, Brunkhorst, F. & Meisner, M.器官功能障碍和败血症中内皮损伤的标记物。gydF4y2Ba暴击。保健医疗。gydF4y2Ba30.gydF4y2Ba, s302-s312(2002)。gydF4y2Ba
Hyseni, A.等。活动性冯·维勒布兰德因子预测系统性炎症反应综合征患者28天死亡率。gydF4y2Ba血gydF4y2Ba123gydF4y2Ba, 2153-2156(2014)。gydF4y2Ba
沃德,S. E.等。重症冠状病毒病2019 (COVID-19)中的血管性血友病因子前肽:急性和持续内皮细胞激活的证据。gydF4y2BaBr。j . Haematol。gydF4y2Ba192gydF4y2Ba, 714-719(2021)。gydF4y2Ba
福格蒂,H.等。长冠综合征发病机制中的持续性内皮病变-回复von Meijenfeldt等人的评论gydF4y2Baj . Thromb。Haemost。gydF4y2Ba20.gydF4y2Ba, 270-271(2022)。gydF4y2Ba
van schoten, C. J.等。巨噬细胞在体内有助于细胞吸收血管性血友病因子和因子VIII。gydF4y2Ba血gydF4y2Ba112gydF4y2Ba1704-1712(2008)。gydF4y2Ba
Chion, a。血管性血友病因子A2结构域内的n链聚糖可调节巨噬细胞介导的清除。gydF4y2Ba血gydF4y2Ba128gydF4y2Ba, 1959-1968(2016)。gydF4y2Ba
O 'Sullivan, J. M., Ward, S., Lavin, M.和O 'Donnell, J. S. von Willebrand因子清除的生物学机制和临床意义。gydF4y2BaBr。j . Haematol。gydF4y2Ba183gydF4y2Ba, 185-195(2018)。gydF4y2Ba
沃德,S. E.等。巨噬细胞半乳糖型凝集素受体在介导血管性血友病因子清除中的新作用。gydF4y2Ba血gydF4y2Ba131gydF4y2Ba, 911-916(2018)。gydF4y2Ba
Pegon, J. N.等。因子VIII和血管性血友病因子是碳水化合物受体siglec5的配体。gydF4y2BaHaematologicagydF4y2Ba97gydF4y2Ba, 1855-1863(2012)。gydF4y2Ba
Wohner, N.等。巨噬细胞清道夫受体SR-AI有助于清除血管性血友病因子。gydF4y2BaHaematologicagydF4y2Ba103gydF4y2Ba, 728-737(2018)。gydF4y2Ba
Castro-Nunez, L., Dienava-Verdoold, I., Herczenik, E., Mertens, K. & Meijer, A. B.巨噬细胞内吞吸收因子VIII-von Willebrand因子复合体需要剪应力。gydF4y2Baj . Thromb。Haemost。gydF4y2Ba10gydF4y2Ba, 1929-1937(2012)。gydF4y2Ba
Pendu, R.等。p -选择素糖蛋白配体1和- a2-整合素在白细胞与血管性血友病因子的粘附中协同作用。gydF4y2Ba血gydF4y2Ba108gydF4y2Ba, 3746-3752(2006)。gydF4y2Ba
何玉林,王晓燕,王晓燕,王晓燕。NLRP3炎性小体活化的机制与调控。gydF4y2Ba学生物化学的发展趋势。科学。gydF4y2Ba41gydF4y2Ba, 1012-1021(2016)。gydF4y2Ba
Weisser, S. B., mclaren, K. W, Kuroda, E. & Sly, L. M.小鼠交替激活巨噬细胞的生成和表征。gydF4y2Ba方法分子生物学;gydF4y2Ba946gydF4y2Ba, 225-239(2013)。gydF4y2Ba
韦斯特,A. P.等。TLR信号通过线粒体ROS增强巨噬细胞的杀菌活性。gydF4y2Ba自然gydF4y2Ba472gydF4y2Ba, 476-480(2011)。gydF4y2Ba
O 'Neill, l.a, Kishton, R. J. & Rathmell, J.免疫学家的免疫代谢指南。gydF4y2Ba免疫1;gydF4y2Ba16gydF4y2Ba, 553-565(2016)。gydF4y2Ba
时间和需求是免疫代谢的两个关键维度:巨噬细胞激活过程和戊糖磷酸途径。gydF4y2Ba前面。Immunol。gydF4y2Ba6gydF4y2Ba, 164(2015)。gydF4y2Ba
Shirai, T.等。糖酵解酶PKM2在冠状动脉疾病的代谢和炎症功能障碍中起桥梁作用。gydF4y2BaJ.经验医学。gydF4y2Ba213gydF4y2Ba, 337-354(2016)。gydF4y2Ba
Park, J.等。线粒体动态调节小胶质细胞中促炎介质的表达。gydF4y2Baj . Neurochem。gydF4y2Ba127gydF4y2Ba, 221-232(2013)。gydF4y2Ba
高铮等。线粒体动力学通过调节CHIP-IRF1轴稳定性控制抗肿瘤先天免疫。gydF4y2BaCommun Nat。gydF4y2Ba8gydF4y2Ba, 1805(2017)。gydF4y2Ba
Escoll, P.等。嗜肺军团菌调节线粒体动力学触发受感染巨噬细胞的代谢再利用。gydF4y2Ba细胞宿主微生物gydF4y2Ba22gydF4y2Ba, 302 - 316。e30.7(2017).
唐纳希尔,g.m.等。琥珀酸是一种炎症信号,通过hif -1诱导il -1。gydF4y2Ba自然gydF4y2Ba496gydF4y2Ba, 238-242(2013)。gydF4y2Ba
palson - mcdermott, e.m.等人。丙酮酸激酶M2调节hif -1 α活性和il -1 β诱导,是lps激活巨噬细胞Warburg效应的关键决定因素。gydF4y2Ba细胞金属底座。gydF4y2Ba21gydF4y2Ba, 347(2015)。gydF4y2Ba
沃姆斯利,s.r.等。脯氨酰羟化酶3 (PHD3)对人类和小鼠中性粒细胞炎症的缺氧调节至关重要。gydF4y2Baj .中国。投资。gydF4y2Ba121gydF4y2Ba, 1053-1063(2011)。gydF4y2Ba
Rastegarlari, G.等。巨噬细胞LRP1有助于清除血管性血友病因子。gydF4y2Ba血gydF4y2Ba119gydF4y2Ba, 2126-2134(2012)。gydF4y2Ba
Rawley, O. et al. von Willebrand因子精氨酸1205替代导致体内巨噬细胞依赖性清除加速。gydF4y2Baj . Thromb。Haemost。gydF4y2Ba13gydF4y2Ba, 821-826(2015)。gydF4y2Ba
Wohner, N.等。von Willebrand因子型2B突变体p.R1306Q和p.V1316M与LRP1的非剪切应力结合解释了它们间隙增加的原因。gydF4y2Baj . Thromb。Haemost。gydF4y2Ba13gydF4y2Ba, 815-820(2015)。gydF4y2Ba
Mantuano, E.等人。组织型纤溶酶原激活物调节巨噬细胞激活和先天免疫。gydF4y2Ba血gydF4y2Ba130gydF4y2Ba, 1364-1374(2017)。gydF4y2Ba
Mantuano, E.等人。LDL受体相关蛋白-1调节巨噬细胞中的NFkappaB和microRNA-155以控制炎症反应。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba113gydF4y2Ba, 1369-1374(2016)。gydF4y2Ba
李,q等人。toll样受体4介导的信号通路调节il -7驱动的b细胞前体的增殖和分化。gydF4y2Ba细胞Mol.免疫;gydF4y2Ba11gydF4y2Ba, 132-140(2014)。gydF4y2Ba
Miyazaki, S., Ishikawa, F., Fujikawa, T., Nagata, S. & Yamaguchi, K.腹腔内注射脂多糖诱导小鼠腹腔内gr -1高多形核中性粒细胞动态迁移。gydF4y2Ba中国。成岩作用。实验室Immunol。gydF4y2Ba11gydF4y2Ba, 452-457(2004)。gydF4y2Ba
隆德,m.e.等人。从寄生虫肝片吸虫中分泌的蛋白质可以抑制NOD小鼠自反应性T细胞反应的启动和预防糖尿病。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba9gydF4y2Ba, e86289(2014)。gydF4y2Ba
Jenkins, S. J.等。IL-4直接向组织内巨噬细胞发出信号,使其增殖超过CSF-1控制的内稳态水平。gydF4y2BaJ.经验医学。gydF4y2Ba210gydF4y2Ba, 2477-2491(2013)。gydF4y2Ba
Koivunen, E.等。含亮氨酸-亮氨酸-甘氨酸基序肽抑制β(2)整合素介导的白细胞粘附。gydF4y2Ba细胞生物学。gydF4y2Ba153gydF4y2Ba, 905-916(2001)。gydF4y2Ba
Canobbio, I., Reineri, S., Sinigaglia, F., Balduini, C. & Torti, M. p38 MAP激酶在冯·维勒布兰德因子激活血小板中的作用。gydF4y2BaThromb。Haemost。gydF4y2Ba91gydF4y2Ba, 102-110(2004)。gydF4y2Ba
Delaney, M. K., Liu, J., Zheng, Y., Berndt, M. C., Du, X. Rac1在糖蛋白b- ix介导的信号转导和整合素激活中的作用。gydF4y2BaArterioscler。Thromb。Vasc。医学杂志。gydF4y2Ba32gydF4y2Ba, 2761-2768(2012)。gydF4y2Ba
殷,H.等。Src家族酪氨酸激酶Lyn通过cGMP信号通路介导VWF/ gpib - ix诱导的血小板激活。gydF4y2Ba血gydF4y2Ba112gydF4y2Ba, 1139-1146(2008)。gydF4y2Ba
冯氏血友病因子与冠心病:前瞻性研究和meta分析。gydF4y2Ba欧元。心J。gydF4y2Ba23gydF4y2Ba, 1764-1770(2002)。gydF4y2Ba
Sonneveld, m.a., de Maat, m.p. & Leebeek, F. W. Von Willebrand因子和ADAMTS13在动脉血栓形成中的作用:一项系统综述和meta分析。gydF4y2Ba血液牧师。gydF4y2Ba28gydF4y2Ba, 167-178(2014)。gydF4y2Ba
Sonneveld, m.a.等。血管性血友病因子与冠状动脉斑块特征和心血管结局的关系。动脉粥样硬化- ivus研究结果。gydF4y2BaThromb。Haemost。gydF4y2Ba113gydF4y2Ba, 577-584(2015)。gydF4y2Ba
van Galen, K. P, Tuinenburg, A. Smeets, E. M. & Schutgens, R. E. Von Willebrand因子缺乏与动脉粥样硬化。gydF4y2Ba血液牧师。gydF4y2Ba26gydF4y2Ba, 189-196(2012)。gydF4y2Ba
Seaman, c.d, George, K. M, Ragni, M. & Folsom, A. R.血管性血友病因子缺乏与流行心血管疾病和无症状颈动脉粥样硬化的关系:社区动脉粥样硬化风险研究。gydF4y2BaThromb。Res。gydF4y2Ba144gydF4y2Ba, 236-238(2016)。gydF4y2Ba
Preston, R. J., Rawley, O., Gleeson, E. M.和O 'Donnell, J. S.阐明碳水化合物决定因素在调节止血中的作用:见解和机会。gydF4y2Ba血gydF4y2Ba121gydF4y2Ba, 3801-3810(2013)。gydF4y2Ba
吉尔,J. C.,恩德斯-布鲁克斯,J.,鲍尔,P. J.,马克斯,W. J. Jr.和蒙哥马利,R.。ABO血型对血管性血友病诊断的影响。gydF4y2Ba血gydF4y2Ba69gydF4y2Ba, 1691-1695(1987)。gydF4y2Ba
沃德,奥沙利文,j.m.,奥唐耐,j.s. ABO血型、冯·维勒布兰德因子与原发性止血的关系。gydF4y2Ba血gydF4y2Ba136gydF4y2Ba, 2864-2874(2020)。gydF4y2Ba
Methia, N., Andre, P., Denis, c.v, Economopoulos, M. & Wagner, D. von Willebrand因子缺陷小鼠动脉粥样硬化的局部减少。gydF4y2Ba血gydF4y2Ba98gydF4y2Ba, 1424-1428(2001)。gydF4y2Ba
Gandhi, C, Ahmad, A, Wilson, K. M. & Chauhan, A. K. ADAMTS13通过vwf依赖机制调节小鼠动脉粥样硬化斑块进展。gydF4y2Baj . Thromb。Haemost。gydF4y2Ba12gydF4y2Ba, 255-260(2014)。gydF4y2Ba
李维,M. &范德波尔,T.炎症和凝血。gydF4y2Ba暴击。保健医疗。gydF4y2Ba38gydF4y2Ba, s26-s34(2010)。gydF4y2Ba
Gleeson, E. M, O 'Donnell, J. S. & Preston, R. J.内皮细胞蛋白C受体:细胞保护凝血因子信号传导的细胞表面导体。gydF4y2Ba细胞分子,生命科学。gydF4y2Ba69gydF4y2Ba, 717-726(2012)。gydF4y2Ba
炎症和凝血的相互作用。gydF4y2BaBr。j . Haematol。gydF4y2Ba131gydF4y2Ba, 417-430(2005)。gydF4y2Ba
Dobin, A.等。STAR:超快通用RNA-seq对准器。gydF4y2Ba生物信息学gydF4y2Ba29gydF4y2Ba, 15-21(2013)。gydF4y2Ba
Love, M. I., Huber, W. & Anders, S.用DESeq2调节RNA-seq数据的折叠变化和色散估计。gydF4y2Ba基因组医学杂志。gydF4y2Ba15gydF4y2Ba, 550(2014)。gydF4y2Ba
Capaldi, R. A., Aggeler, R., Turina, P. & Wilkens, S. f1f0型atp酶中催化位点和质子通道的偶联。gydF4y2Ba学生物化学的发展趋势。科学。gydF4y2Ba19gydF4y2Ba, 284-289(1994)。gydF4y2Ba
Hams, E., Roberts, J. Bermingham, R. & Fallon, P. G.维甲酸相关孤儿受体α (rorα)在脂多糖诱导的脓毒性休克中巨噬细胞激活中的作用。gydF4y2Ba前面。Immunol。gydF4y2Ba12gydF4y2Ba, 647329(2021)。gydF4y2Ba
火腿,e等。维甲酸相关孤儿受体α (rorα)表达巨噬细胞在饮食诱导肥胖中的作用。gydF4y2Ba前面。Immunol。gydF4y2Ba11gydF4y2Ba, 1966(2020)。gydF4y2Ba
确认gydF4y2Ba
这项工作得到都柏林皇家城医院信托基金的资金支持(项目赠款181;R.M.和J.S.O.D.);NIH的齐默尔曼项目(HL081588;J.S.O.D.);卫生研究委员会研究员领导项目奖(ilp - pol -2017-008;J.S.O.D.);和科学基金会爱尔兰未来前沿奖(20/FFP- a /8952;J.S.O.D.)。gydF4y2Ba
作者信息gydF4y2Ba
作者和隶属关系gydF4y2Ba
贡献gydF4y2Ba
跨距,s.a.。目前,K.H, J.F。M.P.C, H.C.H, S.P.S.D H.CM。白雪,E.H交流。,同上,后代e.b., i, J.M.O。进行实验;跨距,s.a.。目前,K.H, A.M.C, j.k., i, J.M.O R.M。R.J.S.P, P.F, F.J.S, J.S.O。设计研究并分析数据。所有作者都参与了论文的撰写和评审。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
J.S.O。曾在百特、拜耳、诺和诺德、勃林格殷格翰、利奥制药、武田和八达制药的发言人局任职。他还曾担任Baxter, Bayer, Octapharma CSL Behring, Daiichi Sankyo, Boehringer Ingelheim, Takeda和Pfizer的顾问委员会。J.S.O。还获得了3m、百特、拜耳、辉瑞、夏尔、武田和诺和诺德的研究资助。其余作者声明无竞争利益gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然通讯gydF4y2Ba感谢匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
源数据gydF4y2Ba
权利与权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的使用范围,您将需要直接从版权所有者那里获得许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
德拉克福德,C州,阿奎拉,S州,罗奇,F州。gydF4y2Baet al。gydF4y2Ba血管性血友病因子将初级止血与先天免疫联系起来。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba, 6320(2022)。https://doi.org/10.1038/s41467-022-33796-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-33796-7gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba