摘要gydF4y2Ba
1型糖尿病(T1D)是一种自身免疫性疾病,导致产生胰岛素的胰腺β细胞被破坏。其中一个与T1D相关的基因是gydF4y2BaTYK2gydF4y2Ba它编码一种Janus激酶,在-Ι型干扰素(IFN-Ι)介导的细胞内信号传导中起关键作用。为了研究TYK2在β细胞发育和对IFNα反应中的作用,我们生成了gydF4y2BaTYK2gydF4y2Ba敲除人类的iPSCs,并引导它们进入胰腺内分泌谱系。在这里,我们发现TYK2的缺失通过调节KRAS的表达而影响内分泌前体的出现,而成熟的干细胞胰岛(SC-islets)功能不受影响。在sc -胰岛中,TYK2的丢失或抑制阻止了ifn α诱导的抗原加工和呈递,包括MHC Ι类和ΙΙ类的表达,增强了它们对CD8的生存能力gydF4y2Ba+gydF4y2Bat细胞的细胞毒性。这些结果确定了TYK2在β细胞发育中的未知作用,并支持在成年β细胞中抑制TYK2作为阻止T1D进展的有效治疗靶点。gydF4y2Ba
简介gydF4y2Ba
1型糖尿病(T1D)是一种慢性自身免疫性疾病,以胰岛炎症为特征,最终导致分泌胰岛素的β细胞特异性损失gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba.全基因组关联和其他遗传学研究已经确定了超过120个与T1D风险相关的非hla区域gydF4y2Ba3 gydF4y2Ba.其中一个易感基因是酪氨酸激酶2 (gydF4y2BaTYK2gydF4y2Ba),是JAK (Janus激酶)家族的成员,在细胞因子(包括-Ι型干扰素(IFN-Ι))刺激的细胞内信号换能器和转录激活因子(STAT)信号传导中起着关键作用。gydF4y2Ba4 gydF4y2Ba.IFN-Ι信号通路通过上调MHC类Ι的表达和抗原提呈参与T1D的病因学,从而导致针对β细胞的细胞毒性自身免疫gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.最近的一份报告显示,罕见的功能丧失gydF4y2BaTYK2gydF4y2Ba启动子突变与日本人群糖尿病易感性增加有关gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba.有趣的是,一些非同义单核苷酸多态性(SNPs)gydF4y2BaTYK2gydF4y2Ba(rs34536443和rs2304256)诱导部分抑制gydF4y2BaTYK2gydF4y2Ba表达与预防几种自身免疫性疾病有关,包括T1D和类风湿性关节炎gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.因为大多数T1D候选基因在人类胰岛中表达,并调节其功能gydF4y2Ba2gydF4y2Ba重要的是要破译它们在胰腺发育、功能和对免疫挑战的反应中的作用,以便有效地制定特定阶段的治疗干预措施。人多能干细胞(Human pluripotent stem cells, hPSCs)及其向胰腺干细胞-胰岛(pancreatic stem - cell-islets, SC-islets)的高效分化为研究人类胰腺发育和β细胞水平候选基因的作用提供了卓越的工具gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.gydF4y2Ba
我们目前研究了T1D候选基因在发育中的内分泌胰腺中的表达并进行了鉴定gydF4y2BaTYK2gydF4y2Ba作为上调基因之一。在sc -胰岛发育过程中,通过单细胞转录组学研究TYK2扰动的影响。令人惊讶的是,特定的gydF4y2BaTYK2gydF4y2Ba敲除(KO)干细胞系显示内分泌前体形成受损,而TYK2抑制分化胰岛细胞完全阻断IFNα反应。基于我们的研究结果,成熟胰岛细胞TYK2抑制是一种潜在的T1D预防疗法。gydF4y2Ba
结果gydF4y2Ba
T1D候选基因在胰腺分化过程中的表达gydF4y2Ba
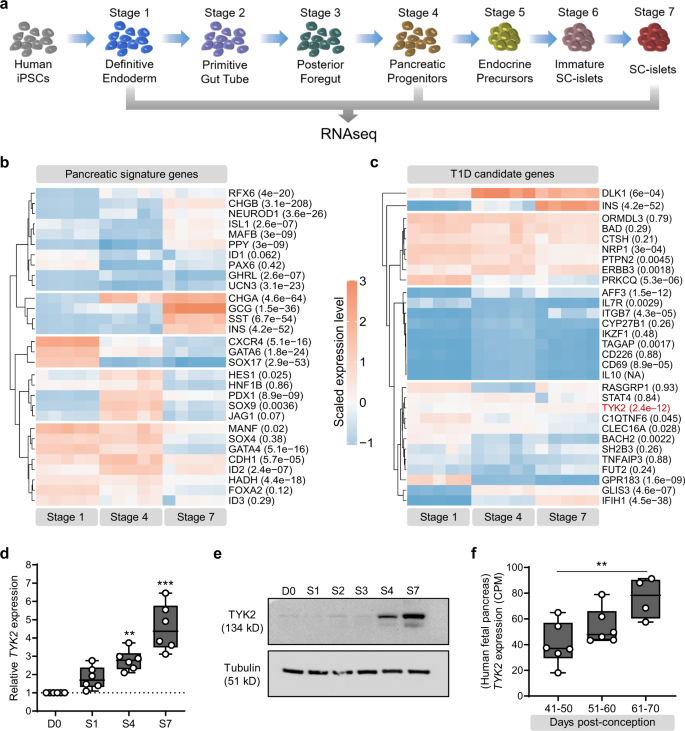
为了确定胰腺发育的候选基因,这些基因也与人类T1D的发展有关,我们进行了深度RNA测序(gydF4y2Ba∼gydF4y2Ba在人诱导多能干细胞(hiPSCs)胰腺分化的特定阶段(图2)。gydF4y2Ba1gydF4y2Ba).我们的分化策略通过胰腺发育层次关键基因的表达模式显示,稳健地表型复制了人类胰腺发育(图2)。gydF4y2Ba1 bgydF4y2Ba).特异性转录组的筛选揭示了几种T1D候选基因的差异表达,例如:gydF4y2BaTYK2gydF4y2Ba,gydF4y2BaDLK1gydF4y2Ba,gydF4y2BaIFIH1gydF4y2Ba被强烈上调,而gydF4y2BaPRKCQgydF4y2Ba,gydF4y2BaBACH2gydF4y2Ba,gydF4y2BaGPR183gydF4y2Ba随着分化向内分泌谱系发展而下调(图;gydF4y2Ba1 cgydF4y2Ba).TYK2表达显著增加(gydF4y2BapgydF4y2Baadj = 2.4E-12)在独立实验中在转录物和蛋白质水平上得到进一步证实(图。gydF4y2Ba1 d, egydF4y2Ba).与这一观察结果相一致的是,人类第1个月中期至晚期胎儿胰腺RNAseq数据(gydF4y2BangydF4y2Ba的强烈上调gydF4y2BaTYK2gydF4y2Ba转录随胎龄增加而增加(图;gydF4y2Ba1 fgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba胰腺分化方案的示意图。这个数字部分是使用施维耶医学艺术生成的。gydF4y2BabgydF4y2Ba来自阶段(S) 1(最终内胚层)、S4(胰腺祖细胞)和S7 (sc -胰岛)的深层RNAseq分析的胰腺谱系基因热图。gydF4y2BacgydF4y2Ba已知T1D候选基因的类似热图。每个基因都经过多次校正gydF4y2BapgydF4y2Ba基因在分化过程中纵向差异表达所产生的值(gydF4y2BangydF4y2Ba= 5)。gydF4y2BadgydF4y2Ba相对表达式gydF4y2BaTYK2gydF4y2BaqRT-PCR显示胰腺分化期间(gydF4y2BangydF4y2Ba= 6)和gydF4y2BaegydF4y2Ba免疫印迹法检测TYK2蛋白。微管蛋白被用作负荷控制(gydF4y2BangydF4y2Ba= 3)。gydF4y2BafgydF4y2Ba表达模式gydF4y2BaTYK2gydF4y2Ba在怀孕后40至70天的人类胎儿胰腺样本中(gydF4y2BangydF4y2Ba= 16)。为gydF4y2BadgydF4y2Ba和gydF4y2BafgydF4y2Ba,采用单因素方差分析(one-way ANOVA)和Tukey的多重比较检验(multiple comparison test)来确定显著性,盒形和胡须图显示中位数,胡须从最小值延伸到最大值。*gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;***gydF4y2BapgydF4y2Ba< 0.001。源数据作为源数据文件提供。gydF4y2Ba
TYK2的丢失或抑制导致有缺陷的EP形成gydF4y2Ba
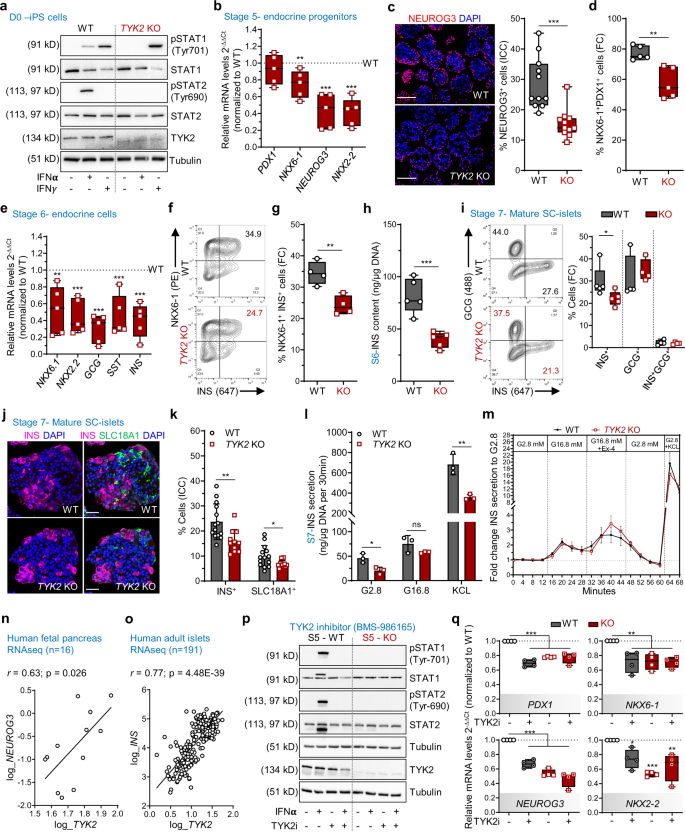
接下来,我们使用CRISPR-Cas9来生成gydF4y2BaTYK2gydF4y2BaKO hiPSC系列(HEL46.11)gydF4y2Ba12gydF4y2Ba.通过TYK2蛋白表达缺失选择的两个KO克隆用于本研究,一个未编辑的阴性克隆作为野生型(WT)对照(补充图)。gydF4y2Ba1得了gydF4y2Ba).Sanger测序证实,精确删除了含有atg起始密码子的外显子3的277 bp目标序列。gydF4y2Ba1 dgydF4y2Ba),没有证据表明crispr诱导脱靶indel。基于批量RNAseq的e-核型分析gydF4y2Ba16gydF4y2BaWT和免疫细胞化学分析gydF4y2BaTYK2gydF4y2BaKO hiPSC系证实不存在基因组畸变,并显示关键增殖和多能性标记的表达水平相似(补充图。gydF4y2Ba1的情况gydF4y2Ba).gydF4y2Ba
已知TYK2与IFN-Ι受体(IFNAR1)相关,但不与IFN-ΙΙ受体相关,并激活下游STAT信号通路gydF4y2Ba17gydF4y2Ba.IFNα刺激在WT中激活STAT1和STAT2,但在KO中不激活(图2)。gydF4y2Ba2gydF4y2Ba).相比之下,IFNγ处理在WT和gydF4y2BaTYK2gydF4y2Ba进一步证实了IFNAR1信号通路在KO细胞中的特异性抑制作用gydF4y2BaTYK2gydF4y2BaKO细胞。gydF4y2Ba
一个gydF4y2Ba免疫印迹IFNα或IFNγ处理WT和gydF4y2BaTYK2gydF4y2BaKO hipsc (gydF4y2BangydF4y2Ba= 3)。gydF4y2BabgydF4y2Ba阶段(S) 5相对转录水平gydF4y2BaPDX1gydF4y2Ba,gydF4y2BaNKX6-1gydF4y2Ba,gydF4y2BaNEUROG3gydF4y2Ba,gydF4y2BaNKX2-2gydF4y2Ba(gydF4y2BangydF4y2Ba= 5)。gydF4y2BacgydF4y2BaNEUROG3的免疫组化(比例尺= 150 μm)和3个实验的11张图像的定量(gydF4y2BangydF4y2Ba= 11)。gydF4y2BadgydF4y2BaS5流式细胞仪检测PDX1gydF4y2Ba+gydF4y2BaNKX6-1gydF4y2Ba+gydF4y2Ba细胞(gydF4y2BangydF4y2Ba= 5)。gydF4y2BaegydF4y2BaS6的相对转录水平gydF4y2BaNKX6-1gydF4y2Ba,gydF4y2BaNKX2-2gydF4y2Ba,gydF4y2BaGCGgydF4y2Ba,gydF4y2Ba风场gydF4y2Ba,gydF4y2BaINSgydF4y2Ba(gydF4y2BangydF4y2Ba= 5)。gydF4y2BafgydF4y2BaS6流式细胞术检测NKX6-1gydF4y2Ba+gydF4y2Ba和INSgydF4y2Ba+gydF4y2Ba细胞。gydF4y2BaggydF4y2Ba量化(gydF4y2BangydF4y2Ba= 4)。gydF4y2BahgydF4y2BaS6总胰岛素含量归一化至DNA含量(gydF4y2BangydF4y2Ba= 5)。gydF4y2Ba我gydF4y2BaS7流式细胞术检测INSgydF4y2Ba+gydF4y2Ba和GCGgydF4y2Ba+gydF4y2Ba细胞(gydF4y2BangydF4y2Ba= 4 - 5)。gydF4y2BajgydF4y2BaS7 sc -胰岛中INS和SLC18A1的免疫组化(比例尺= 50 μm)gydF4y2BakgydF4y2Ba量化来自2个实验,每个实验5-7张图像(gydF4y2BangydF4y2Ba11 - 14 =)。WT和KO定量的细胞数量分别为10516和11990个。gydF4y2BalgydF4y2BaS7静态胰岛素分泌,低(2.8 mM),高(16.8 mM)葡萄糖和30 mM KCl,归一化到DNA含量(gydF4y2BangydF4y2Ba= 3)。柱状图gydF4y2BakgydF4y2Ba和gydF4y2BalgydF4y2Ba均值±标准差gydF4y2Ba米gydF4y2BaS7动态胰岛素分泌,16.8 mM葡萄糖,50 ng/ml exendin-4 (Ex4), 30 mM KCl,正常化为基础分泌。未配对gydF4y2BatgydF4y2Ba-test with Holm-Šídák多重比较,数据为均值±SEM (gydF4y2BangydF4y2Ba= 5)。gydF4y2BangydF4y2Ba的相关性gydF4y2BaTYK2gydF4y2Ba和gydF4y2BaNEUROG3gydF4y2Ba人胎儿胰腺的表达(gydF4y2BangydF4y2Ba= 16)。gydF4y2BaogydF4y2Ba的相关性gydF4y2BaTYK2gydF4y2Ba和gydF4y2BaINSgydF4y2Ba在成人胰岛的表达(gydF4y2BangydF4y2Ba= 191)。皮尔森的gydF4y2BargydF4y2Ba计数对数归一化后的相关性检验。gydF4y2BapgydF4y2Ba在S3-S5期间,用TYK2i处理WT和KO的免疫印迹分析了IFNα存在下的STATs磷酸化情况(gydF4y2BangydF4y2Ba3)和gydF4y2Ba问gydF4y2Ba相对转录水平gydF4y2BaPDX1gydF4y2Ba,gydF4y2BaNKX6-1gydF4y2Ba,gydF4y2BaNEUROG3gydF4y2Ba,gydF4y2BaNKX2-2gydF4y2Ba.普通单因素方差分析与Tukey多元比较(gydF4y2BangydF4y2Ba= 4)。双尾未配对gydF4y2BatgydF4y2Ba以及(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,gydF4y2BakgydF4y2Ba,gydF4y2BalgydF4y2Ba).盒和须图显示中位数与最小到最大须。*gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;***gydF4y2BapgydF4y2Ba< 0.001;ns-non-significant。源数据作为源数据文件提供。gydF4y2Ba
为了研究TYK2在胰腺发育中的作用,我们采用七阶段方案进行了胰腺分化gydF4y2Ba12gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.WT和gydF4y2BaTYK2gydF4y2BaKO细胞系在胰腺祖细胞(PP)阶段(S) 4之前表现出相当的分化能力,这可以通过相似比例的细胞在S1(最终内胚层)表达CXCR4,在S4共同表达PDX1和NKX6-1来证明(补充图)。gydF4y2Ba2 a, bgydF4y2Ba).此外,表达水平gydF4y2BaSOX9gydF4y2Ba,gydF4y2BaFOXA2gydF4y2Ba,gydF4y2BaPTF1AgydF4y2Ba,gydF4y2BaPDX1gydF4y2Ba在S4相似。然而,与WT相比,KO中NKX6-1的表达显著降低(补充图。gydF4y2Ba2摄氏度gydF4y2Ba).gydF4y2Ba
内分泌前体(EP)在分化方案的S5诱导。EP的形成在gydF4y2BaTYK2gydF4y2BaKO,如转录本表达降低所示gydF4y2BaNKX6-1gydF4y2Ba(减少25±7%),gydF4y2BaNEUROG3gydF4y2Ba(56±9%)gydF4y2BaNKX2-2gydF4y2Ba(58±7%;无花果。gydF4y2Ba2 bgydF4y2Ba).NEUROG3的数目gydF4y2Ba+gydF4y2Ba细胞数量也显著减少(减少46.3%,gydF4y2BapgydF4y2Ba= 0.0002)。gydF4y2Ba2摄氏度gydF4y2Ba).PDX1的比例gydF4y2Ba+gydF4y2BaNKX6-1gydF4y2Ba+gydF4y2Ba流式细胞术显示细胞数量显著减少(减少19±4%,gydF4y2BapgydF4y2Ba= 0.004)(图gydF4y2Ba二维gydF4y2Ba).gydF4y2Ba
S6以未成熟内分泌细胞数量显著增加为标志。作为EP形成受损的结果,我们还观察到胰岛激素转录物表达的整体下降gydF4y2BaINSgydF4y2Ba(减少59±8%),gydF4y2BaGCGgydF4y2Ba(70±7%)gydF4y2Ba风场gydF4y2Ba(54±10%)。gydF4y2Ba2 egydF4y2Ba).INS的流式细胞术进一步证实了这一观察结果gydF4y2Ba+gydF4y2BaNKX6-1gydF4y2Ba+gydF4y2Ba细胞(减少29.8±2%)和归一化总胰岛素含量(减少51.4±8%)(图。gydF4y2Ba2 f-hgydF4y2Ba).在S7的进一步表征证实,单激素INS数量减少了约32%gydF4y2Ba+gydF4y2Ba细胞gydF4y2BaTYK2gydF4y2BaKO sc -胰岛(图;gydF4y2Ba2 i, jgydF4y2Ba),而GCG单阳性的数量gydF4y2Ba+gydF4y2Ba,风场gydF4y2Ba+gydF4y2Ba,和Ki-67gydF4y2Ba+gydF4y2Ba细胞与WT相当(补充图;gydF4y2Ba3模拟gydF4y2Ba).据报道,sc -胰岛分化产生非胰腺肠染色质样细胞(SC-EC),它遵循β细胞的发育谱系gydF4y2Ba18gydF4y2Ba.有趣的是,我们还检测到SC-EC (SLC18A1)显著降低≈31%gydF4y2Ba+gydF4y2Ba)细胞gydF4y2BaTYK2gydF4y2Ba-KO S7 sc -胰岛(图;gydF4y2Ba2 j, kgydF4y2Ba).gydF4y2Ba
研究S7成熟3周后的静态和动态胰岛素分泌。与减少的单激素INS数量一致gydF4y2Ba+gydF4y2Ba细胞中,我们检测到较低的胰岛素分泌gydF4y2BaTYK2gydF4y2BaKO sc -胰岛(图;gydF4y2Ba2 lgydF4y2Ba).然而,KO β细胞的功能是正常的,对高糖、胰高血糖素样肽-1 (GLP1)类似物exendin-4和K的完整胰岛素刺激指数证明了这一点gydF4y2Ba+gydF4y2Ba-诱导膜去极化(图;gydF4y2Ba2米gydF4y2Ba).为了进一步研究S7成熟sc -胰岛的体内功能潜能,我们植入了等量的WT和gydF4y2BaTYK2gydF4y2Ba非糖尿病NOD-SCID-Gamma小鼠肾包膜下的KO S7 sc -胰岛(补充图)gydF4y2Ba4gydF4y2Ba).WT组和对照组的血糖和循环人c肽水平相当gydF4y2BaTYK2gydF4y2BaKO S7植入小鼠直到植入后2个月(补充图。gydF4y2Ba4 b, cgydF4y2Ba).INS比例gydF4y2Ba+gydF4y2Ba和GCGgydF4y2Ba+gydF4y2Ba细胞群以单激素INS的比例测量gydF4y2Ba+gydF4y2Ba或GCGgydF4y2Ba+gydF4y2Ba细胞与总INS之比gydF4y2Ba+gydF4y2Ba和GCGgydF4y2Ba+gydF4y2BaWT和gydF4y2BaTYK2gydF4y2Ba移植2个月的KO组织切片没有变化(补充图。gydF4y2Ba4 d, egydF4y2Ba).这些结果表明,TYK2的完全缺失损害了S5 EP的形成,从而减少了内分泌β细胞的数量,但不影响随后的体外或体内成熟和β细胞的功能。gydF4y2Ba
值得注意的是,来自16个人胎儿胰腺的RNA-seq数据也显示了显著的正相关gydF4y2BaTYK2gydF4y2Ba和gydF4y2BaNEUROG3gydF4y2Ba(gydF4y2BargydF4y2Ba= 0.63;gydF4y2BapgydF4y2Ba= 0.026;无花果。gydF4y2Ba2 ngydF4y2Ba).同样,成人胰岛RNA-seq数据集gydF4y2Ba19gydF4y2Ba(gydF4y2BangydF4y2Ba= 191)之间呈较强的正相关gydF4y2BaTYK2gydF4y2Ba和gydF4y2BaINSgydF4y2Ba表达式(gydF4y2BargydF4y2Ba= 0.77;gydF4y2BapgydF4y2Ba= 4.4 e-39;无花果。gydF4y2Ba2 ogydF4y2Ba),提示TYK2在胰腺内分泌谱系中的调节作用。gydF4y2Ba
接下来,我们使用选择性强效变构TYK2抑制剂(TYK2i) BMS-986165验证了这些发现gydF4y2Ba20.gydF4y2Ba在S3向S5分化期间。在IFNα刺激S5 WT细胞后,TYK2i可以消除STAT1和STAT2的激活(图2)。gydF4y2Ba2 pgydF4y2Ba).然后我们调查了TYK2i是否可以概括gydF4y2BaTYK2gydF4y2BaKO可减少EP形成表型。在S5结束时进行TYK2i处理后,我们也观察到转录本的表达类似地降低gydF4y2BaPDX1gydF4y2Ba(30±3%),gydF4y2BaNEUROG3gydF4y2Ba(33±4%),gydF4y2BaNKX6-1gydF4y2Ba(28±6%)gydF4y2BaNKX2-2gydF4y2Ba(降低26±8%),TYK2i处理KO样品无变化(图2)。gydF4y2Ba2问gydF4y2Ba).类似地,我们在H1人类胚胎干细胞(hESCs)上复制了TYK2抑制的上述发现(补充图。gydF4y2Ba5 a egydF4y2Ba).总的来说,这些数据证实TYK2调节胰腺EP的形成。gydF4y2Ba
TYK2负向调控KRAS表达gydF4y2Ba
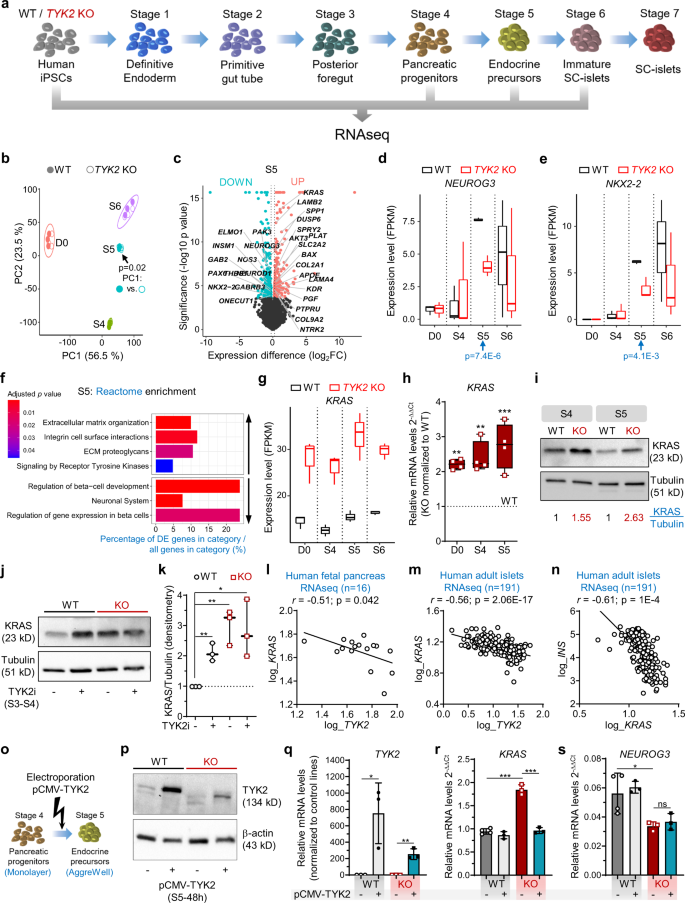
为了了解TYK2的丢失或抑制在胰腺谱系分化过程中损害EP形成的机制,我们在干细胞水平(hiPSCs)、S4 (PP)、S5 (EP)和S6(未成熟的sc -胰岛;无花果。gydF4y2Ba3gydF4y2Ba).WT和KO基因型各自转录组的主成分分析(PCA)按照发育阶段的顺序聚在一起,但在S5观察到显著差异(图5)。gydF4y2Ba3 bgydF4y2Ba),其中上调基因319个,下调基因412个(图;gydF4y2Ba3 cgydF4y2Ba).与上述研究结果一致,关键胰腺转录因子(tf)gydF4y2BaNEUROG3gydF4y2Ba(gydF4y2BapgydF4y2Baadj = 7.4E-6)和gydF4y2BaNKX2-2gydF4y2Ba(gydF4y2BapgydF4y2Baadj = 4.1E-3)在S5显著下调(图。gydF4y2Ba3 d, egydF4y2Ba).反应组富集分析证实了与“调控β细胞发育”相关的基因集的下调(如:gydF4y2BaINSM1gydF4y2Ba,gydF4y2BaNEUROD1gydF4y2Ba,gydF4y2BaONECUT1gydF4y2Ba,gydF4y2BaPAX4gydF4y2Ba,gydF4y2BaPAX6gydF4y2Ba)和“β细胞中的基因表达”,以及“受体酪氨酸激酶的信号传导(例如,gydF4y2BaDUSP6 shpgydF4y2Ba,gydF4y2Ba喀斯特gydF4y2Ba, SPPgydF4y2Ba1gydF4y2Ba,gydF4y2BaLAMB2gydF4y2Ba,gydF4y2BaCOL2A1gydF4y2Ba)被意外地上调(图;gydF4y2Ba3 fgydF4y2Ba).gydF4y2Ba
一个gydF4y2BaWT和的批量RNAseq实验示意图gydF4y2BaTYK2gydF4y2BaKO细胞(gydF4y2BangydF4y2Ba= 3)。这个数字是用Servier Medical Art生成的。gydF4y2BabgydF4y2Ba大量RNA-seq样品的主成分分析。填充圆圈,WT单元格;空圆,KO单元格。gydF4y2BapgydF4y2Ba-value(线性回归比较)表明PC1~基因型为(S) 5期。gydF4y2BacgydF4y2Ba火山图显示WT和KO的S5差异表达基因。基因显著下调,虹膜呈蓝色;上调基因,软红色。所选感兴趣的基因被突出显示。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2BaFPKM值gydF4y2BaNEUROG3gydF4y2Ba和gydF4y2BaNKX2-2gydF4y2Ba不同分化阶段的表达。gydF4y2BapgydF4y2Ba-value (DESeq2)用于S5。gydF4y2BafgydF4y2Ba与WT相比,S5 KO细胞中选择上调和下调的反应组富集途径。gydF4y2BaggydF4y2BaFPKM值gydF4y2Ba喀斯特gydF4y2Ba表达式。gydF4y2BahgydF4y2Ba相对转录水平gydF4y2Ba喀斯特gydF4y2BaqRT-PCR检测hiPSCs、S4和S5细胞。gydF4y2Ba我gydF4y2BaKRAS在S4和S5的免疫印迹。与微管蛋白密度值的归一化显示在面板上(gydF4y2BangydF4y2Ba= 3)。gydF4y2BajgydF4y2BaWT和KO细胞经TYK2i处理后S4段KRAS的免疫印迹。gydF4y2BakgydF4y2Ba面板的密度分析gydF4y2BajgydF4y2Ba(gydF4y2BangydF4y2Ba= 3)。gydF4y2BalgydF4y2Ba的相关性gydF4y2BaTYK2gydF4y2Ba和gydF4y2BaNEUROG3gydF4y2Ba人胎儿胰腺的表达(gydF4y2BangydF4y2Ba= 16)。计数对数归一化后的Pearson相关性。gydF4y2Ba米gydF4y2Ba的相关性gydF4y2Ba喀斯特gydF4y2Ba和gydF4y2BaTYK2gydF4y2Ba的表情;和gydF4y2BangydF4y2Ba喀斯特gydF4y2Ba和gydF4y2BaINSgydF4y2Ba人类胰岛的表达(gydF4y2BangydF4y2Ba= 191)。皮尔森的相关性gydF4y2BargydF4y2Ba以及显著性水平gydF4y2BapgydF4y2Ba在面板中显示。gydF4y2BaogydF4y2BaTYK2过表达实验示意图。gydF4y2BapgydF4y2BaS5期间pCMV-TYK2电穿孔后48 h的免疫印迹。β-肌动蛋白作为负荷控制(gydF4y2BangydF4y2Ba= 2)。在S5期间pCMV-TYK2过表达24 h后的qRT-PCR相对转录水平gydF4y2Ba问gydF4y2BaTYK2gydF4y2Ba,gydF4y2BargydF4y2Ba喀斯特gydF4y2Ba,gydF4y2Ba年代gydF4y2BaNEUROG3gydF4y2Ba(gydF4y2BangydF4y2Ba= 3)。双尾未配对gydF4y2BatgydF4y2Ba-测试已应用。*gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;***gydF4y2BapgydF4y2Ba< 0.001;ns-non-significant。箱线图gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba和gydF4y2BakgydF4y2Ba显示具有上下铰链的中位数,对应于第一和第三四分位数(第25和第75百分位数),并具有最小到最大胡须(gydF4y2BangydF4y2Ba= 3),除gydF4y2BahgydF4y2Ba, (gydF4y2BangydF4y2Ba= 4)。源数据作为源数据文件提供。gydF4y2Ba
在整个分化过程中,只有16个基因持续上调,3个基因持续下调。引人注目的是,我们观察到在所有阶段上调最显著的基因是gydF4y2Ba喀斯特gydF4y2Ba(无花果。gydF4y2Ba3 ggydF4y2Ba).这一观察结果在基因(qRT-PCR)和蛋白质(WB)水平上得到了证实。gydF4y2Ba3 h,我gydF4y2Ba).同样,我们在WT细胞中观察到TYK2i处理后KRAS蛋白显著增加,但KO细胞没有,表明TYK2和KRAS之间呈负相关(图2)。gydF4y2Ba3 j, kgydF4y2Ba).人胎儿胰腺RNAseq数据(gydF4y2BargydF4y2Ba=−0.51;gydF4y2BapgydF4y2Ba= 0.042)和成年胰岛(gydF4y2BargydF4y2Ba=−0.56;gydF4y2BapgydF4y2Ba= 2.06E-17)之间呈显著负相关gydF4y2BaTYK2gydF4y2Ba和gydF4y2Ba喀斯特gydF4y2Ba表达水平(图;gydF4y2Ba3 l, mgydF4y2Ba).而且,两者之间呈较强的负相关gydF4y2Ba喀斯特gydF4y2Ba和gydF4y2BaINSgydF4y2Ba(gydF4y2BargydF4y2Ba=−0.61;gydF4y2BapgydF4y2Ba= 1E-4)在islet数据集中也被发现(图。gydF4y2Ba3 ngydF4y2Ba).接下来,我们在WT和TYK2 KO细胞中在S5期间短暂过表达TYK2 (pCMV-TYK2)(图2)。gydF4y2Ba3 ogydF4y2Ba),并确认上调gydF4y2BaTYK2gydF4y2Ba转录本和蛋白质(图;gydF4y2Ba3 p, qgydF4y2Ba).重要的是,TYK2蛋白在KO细胞中的恢复挽救了gydF4y2Ba喀斯特gydF4y2Ba而在WT细胞中,其水平没有变化(图2)。gydF4y2Ba3 rgydF4y2Ba).然而,对gydF4y2BaNEUROG3gydF4y2Ba表达不显著(图;gydF4y2Ba3 sgydF4y2Ba).gydF4y2Ba
总的来说,这些发现与早期的研究一致,这些研究表明,高KRAS通过抑制NEUROG3的表达来拮抗发育中的胰腺内分泌新生gydF4y2Ba21gydF4y2Ba并提示TYK2的丢失或抑制通过上调KRAS来抑制EP的形成。gydF4y2Ba
增加gydF4y2Ba喀斯特gydF4y2Ba扰乱gydF4y2BaNEUROG3gydF4y2Ba感应gydF4y2Ba
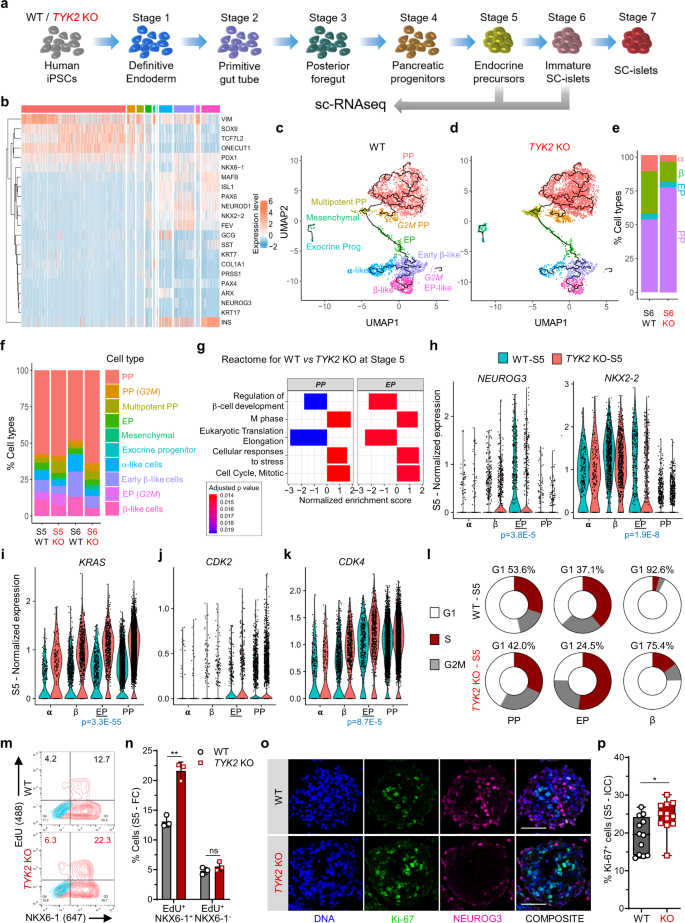
要了解的影响gydF4y2BaTYK2gydF4y2Ba在特定胰腺细胞亚型水平上的KO,我们研究了gydF4y2BaTYK2gydF4y2BaKO表型通过单细胞(sc) RNA-seq(图;gydF4y2Ba4gydF4y2Ba).我们为EP (S5)和sc -胰岛(S6)生成了12545 WT和13856 KO细胞的数据集,并使用Seurat管道进行分析gydF4y2Ba22gydF4y2Ba.经过质量筛选后,我们根据已知细胞类型特异性胰腺标记物的表达对聚类进行标注(图2)。gydF4y2Ba4 bgydF4y2Ba和补充图。gydF4y2Ba6gydF4y2Ba).接下来,我们将集群大致分为四组:PP (gydF4y2BaSOX9gydF4y2Ba++gydF4y2BaONECUT1gydF4y2Ba++gydF4y2BaTCF7L2gydF4y2Ba++gydF4y2Ba), ep (gydF4y2BaNEUROG3gydF4y2Ba++gydF4y2Ba)、α样细胞(gydF4y2BaGCGgydF4y2Ba++gydF4y2BaARXgydF4y2Ba++gydF4y2Ba)和β样细胞(gydF4y2BaINSgydF4y2Ba++gydF4y2BaNKX6-1gydF4y2Ba++gydF4y2Ba).我们观察到来自S5和S6 WT和TYK2 KO细胞的不同簇的细胞归一化分布有显著差异(补充图。gydF4y2Ba6中gydF4y2Ba).WT S6含有31.1%的β样细胞,而KO为15%,而S6 KO仍含有76.4%的pp样细胞,而WT为53.1%(图2)。gydF4y2Ba四氟gydF4y2Ba).对S5位点PP和EP簇的GSEA(反应组)分析证实,“调控β细胞发育”的基因组下调,而KO中“M期”和“细胞周期”的基因组上调(图5)。gydF4y2Ba4 ggydF4y2Ba).进一步,我们证实了gydF4y2BaNEUROG3gydF4y2Ba以及下游目标gydF4y2BaNKX2-2gydF4y2Ba在KO EP细胞中,与我们之前的观察结果一致(图。gydF4y2Ba4 hgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba在阶段(S) 5 (3995 WT和5025 KO细胞)和S6 (3348 WT和4550 KO细胞)样本中执行的scRNA-seq示意图。该数字部分是使用Servier提供的Servier Medical Art生成的。gydF4y2BabgydF4y2Ba选定的与胰腺分化相关基因的热图。gydF4y2BacgydF4y2Ba各种注意到的星团以不同的颜色代码表示,并表示为带有S6 WT伪时间轨迹的UMAP,gydF4y2BadgydF4y2BaTYK2gydF4y2BaKO和gydF4y2BaegydF4y2Ba胰腺祖细胞(PP)、内分泌前体(EP)、β样细胞(β)和α样细胞(α)的相对丰度百分比。gydF4y2BafgydF4y2Ba在S5和S6中,WT和gydF4y2BaTYK2gydF4y2Ba不同颜色编码的KO样品。gydF4y2BaggydF4y2Ba使用基因集富集分析(GSEA, Reactome)选择S5 PP和EP类簇中的富集通路。gydF4y2BahgydF4y2Ba小提琴情节的相对表达gydF4y2BaNEUROG3gydF4y2Ba和gydF4y2BaNKX2-2gydF4y2Ba;gydF4y2Ba我gydF4y2Ba喀斯特gydF4y2Ba,gydF4y2BajgydF4y2BaCDK2gydF4y2Ba,gydF4y2BakgydF4y2Ba到gydF4y2Baα, β, EP和PP类簇。gydF4y2BalgydF4y2Ba在PP、EP和β样细胞簇中,通过Seurat (CellCycleScoring)管道显示处于不同细胞周期阶段的细胞百分比的甜甜圈图。gydF4y2Ba米gydF4y2Ba流式细胞仪检测NKX6-1gydF4y2Ba+gydF4y2BaEdUgydF4y2Ba+gydF4y2Ba细胞在S5和gydF4y2BangydF4y2Ba它们的量化(gydF4y2BangydF4y2Ba= 3)。数据为平均值±标准差gydF4y2BaogydF4y2BaS5神经g3和Ki-67的免疫细胞化学表达。比例尺= 100 μm。gydF4y2BapgydF4y2Ba面板中数据的量化gydF4y2BaogydF4y2Ba来自两个实验,每个实验有六幅图像(gydF4y2BangydF4y2Ba= 12)。盒须图显示最小到最大须的中位数。双尾未配对gydF4y2BatgydF4y2Ba-测试以确定的显著性水平gydF4y2BangydF4y2Ba和gydF4y2BapgydF4y2Ba.*gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;ns-non-significant。源数据作为源数据文件提供。gydF4y2Ba
scRNA-seq显示gydF4y2Ba喀斯特gydF4y2BaPP-和ep -样蛋白最高gydF4y2BaTYK2gydF4y2BaKO簇(图;gydF4y2Ba4我gydF4y2Ba).gydF4y2Ba喀斯特gydF4y2Ba已经被证明可以加速GgydF4y2Ba1gydF4y2Ba细胞周期的/S转变,导致G . S缩短gydF4y2Ba1gydF4y2Ba长度gydF4y2Ba23gydF4y2Ba.G的加长gydF4y2Ba1gydF4y2Ba在PP细胞的阶段是适当增强的关键gydF4y2BaNEUROG3gydF4y2Ba及其下游目标gydF4y2Ba24gydF4y2Ba.我们观察到细胞分裂蛋白激酶2 (gydF4y2BaCDK2)gydF4y2Ba和gydF4y2Ba到gydF4y2Ba在gydF4y2BaTYK2gydF4y2BaKO S5 EP细胞(图;gydF4y2Ba4 j, kgydF4y2Ba).然后,我们使用细胞周期标记物的表达水平,用Seurat (CellCycleScoring)估计每个簇中分裂细胞的比例。gydF4y2Ba22gydF4y2Ba.值得注意的是,在WT样品中,53.6% (S5 PP)和37.1% (S5 EP)的细胞位于GgydF4y2Ba1gydF4y2Ba相比较,KO分别为42%和24.5%(图;gydF4y2Ba4 lgydF4y2Ba).gydF4y2Ba
总的来说,这些数据表明KRAS的升高驱动GgydF4y2Ba1gydF4y2Ba/S的转换速度更快gydF4y2BaTYK2gydF4y2BaKO PP和EP细胞,导致GgydF4y2Ba1gydF4y2Ba干扰正常感应的相gydF4y2BaNEUROG3gydF4y2Ba表达式。因此,我们观察到NKX6-1增加了39%gydF4y2Ba+gydF4y2BaEdUgydF4y2Ba+gydF4y2Ba流式细胞仪检测双阳性细胞,KO S5聚类中Ki-67核染色显著升高(图2)。gydF4y2Ba4大学出版社gydF4y2Ba).gydF4y2Ba
TYK2调节sc -胰岛中的IFNα反应gydF4y2Ba
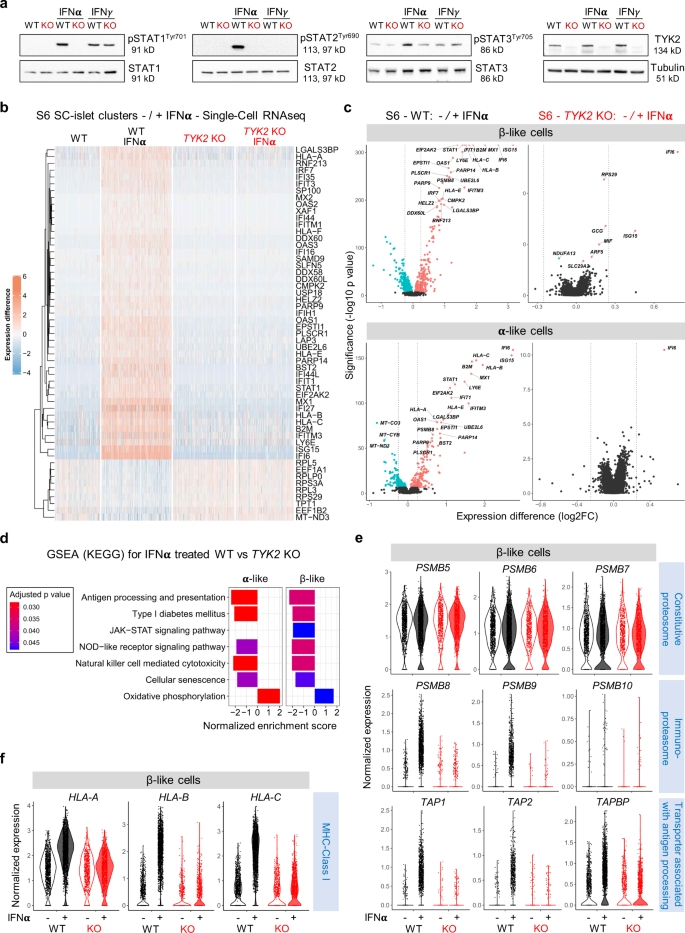
几项研究报告了IFNα在T1D自身免疫诱导中的突出作用gydF4y2Ba25gydF4y2Ba.由于TYK2对于通过IFNAR1介导的IFN-I信号传导很重要,我们利用了我们的研究gydF4y2BaTYK2gydF4y2Ba以了解其在IFNα与发育中的胰岛细胞对话中的作用。在S6 KO sc -胰岛中,STAT1/2的磷酸化在IFNα的响应下完全消失,而IFNγ则没有,而STAT3的响应仅部分受到影响(图2)。gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba免疫印迹分析IFNα或IFNγ处理对(S) 6期sc -胰岛中STAT1、STAT2和STAT3磷酸化的影响(gydF4y2BangydF4y2Ba= 3)。gydF4y2BabgydF4y2Ba热图显示WT(3348个细胞)、WT + IFNα(5202个细胞)、KO(4550个细胞)和KO + IFNα(4281个细胞)样品中的差异表达基因。在WT和小鼠上处理24 h IFNα (100 ng/ml)后进行单细胞转录组学gydF4y2BaTYK2gydF4y2BaKO S6 sc -胰岛。gydF4y2BacgydF4y2Ba火山图显示IFNα在β样细胞和α样细胞中的显著上调基因(软红色)、下调基因(虹膜蓝色)和不显著基因(黑色)。gydF4y2BadgydF4y2BaGSEA (KEGG)用于α-和β-样细胞中显示的精选富集基因集,以响应IFNα处理。gydF4y2BaegydF4y2Ba小提琴图显示了组成性蛋白酶体基因,免疫蛋白酶体基因,与抗原处理基因相关的转运蛋白和正常表达gydF4y2BafgydF4y2BaS6 β样细胞中的MHC类Ι基因对IFNα的反应。源数据作为源数据文件提供。gydF4y2Ba
接下来,我们对干扰素α处理的S6 WT(5202个细胞)和KO(4281个细胞)胰岛细胞进行scRNA-seq。值得注意的是,IFNα处理后WT个体胰岛细胞的整体转录组变化与我们之前报道的类似处理下的人类胰岛数据集一致gydF4y2Ba5gydF4y2Ba(补充图。gydF4y2Ba7一个gydF4y2Ba).IFNα在WT细胞中诱导了先前描述的ifn刺激基因(ISGs)的上调。然而,这种反应在gydF4y2BaTYK2gydF4y2BaKO细胞,由所有簇中前55个(向上46个,向下9个)差异表达基因的热图显示。gydF4y2Ba5 bgydF4y2Ba和补充图。gydF4y2Ba7 bgydF4y2Ba).在β-和α样细胞中,IFNα反应同样完全被抑制。gydF4y2Ba5度gydF4y2Ba).此外,基因对干扰素的抗病毒反应很重要gydF4y2BaSTAT1gydF4y2Ba和抗病毒MX动力样GTPase 1 (gydF4y2Bamx₁gydF4y2Ba)在WT中强烈诱导,但在gydF4y2BaTYK2gydF4y2BaKO细胞(补充图。gydF4y2Ba8gydF4y2Ba).鉴于MHC类Ι上调是糖尿病β细胞中最重要的标志之一gydF4y2Ba26gydF4y2Ba,我们观察到IFNα处理后,gydF4y2Ba抗原gydF4y2Ba,gydF4y2BaHLA-BgydF4y2Ba,gydF4y2BaHLA-CgydF4y2Ba,gydF4y2BaHLA-EgydF4y2Ba基因在WT细胞中表达明显上调,而在gydF4y2BaTYK2gydF4y2BaKO细胞(补充图。gydF4y2Ba8 bgydF4y2Ba).与实验数据一致,两者之间存在较强的正相关关系gydF4y2BaTYK2gydF4y2Ba和gydF4y2Ba抗原gydF4y2Ba(gydF4y2BargydF4y2Ba= 0.52;gydF4y2BapgydF4y2Ba= 6.53 e15汽油);gydF4y2BaHLA-BgydF4y2Ba(gydF4y2BargydF4y2Ba= 0.42;gydF4y2BapgydF4y2Ba= 1.06 e-9);gydF4y2BaHLA-CgydF4y2Ba(gydF4y2BargydF4y2Ba= 0.60;gydF4y2BapgydF4y2Ba= 1.55 e-20);和gydF4y2BaHLA-EgydF4y2Ba(gydF4y2BargydF4y2Ba= 0.51;gydF4y2BapgydF4y2Ba= 3.65E-14)在人类胰岛RNA-seq数据集(gydF4y2BangydF4y2Ba= 191)gydF4y2Ba19gydF4y2Ba(补充图。gydF4y2Ba8 cgydF4y2Ba).gydF4y2Ba
与上述其他研究结果一致,GSEA (KEGG)分析强调了抗原加工和呈递基因集的低表达gydF4y2BaTYK2gydF4y2Ba与WT相比,IFNα后KO β-和α样细胞(图2)gydF4y2Ba5 dgydF4y2Ba).然后,我们分析了IFNα处理后与抗原处理相关的基因的表达。首先,我们观察到组成性蛋白酶体基因(gydF4y2BaPSMB5gydF4y2Ba,gydF4y2BaPSMB6gydF4y2Ba,gydF4y2BaPSMB7gydF4y2Ba)在WT和KO中保持不变,而IFNα上调编码免疫蛋白酶体的基因(gydF4y2BaPSMB8, PSMB9gydF4y2Ba,gydF4y2BaPSMB10gydF4y2Ba)。其次,与抗原加工相关的转运蛋白(gydF4y2BaTAP1, TAP2gydF4y2Ba,gydF4y2BaTAPBPgydF4y2Ba)及MHC类别Ι (gydF4y2Ba抗原,HLA-BgydF4y2Ba,gydF4y2Ba和HLA-CgydF4y2Ba)在WT β样细胞中显著增加,但在KO中保持不变gydF4y2Ba27gydF4y2Ba(无花果。gydF4y2Ba5 e, fgydF4y2Ba).gydF4y2Ba
总的来说,这些数据表明,抑制β-和α样细胞中的TYK2信号可以抑制IFNα处理后的抗原加工和呈递。因为内分泌分化部分受损gydF4y2BaTYK2gydF4y2Ba这些发现也可能与T1D相关β细胞自身抗原(尤其是胰岛素)的低表达有关。因此,我们比较了先前描述的T1D自身抗原在WT和gydF4y2BaTYK2gydF4y2BaKO β样细胞gydF4y2Ba28gydF4y2Ba.只有在gydF4y2BaGAD1gydF4y2Ba(在IFNα存在时)和gydF4y2BaGAD2gydF4y2Ba在gydF4y2BaTYK2gydF4y2BaKO β样细胞(补充图;gydF4y2Ba8 d, egydF4y2Ba).接下来,我们研究了MHC类ΙΙ基因的表达,这些基因具有t1d相关多态性gydF4y2Ba29gydF4y2Ba在T1D供体胰岛β细胞中过表达gydF4y2Ba30.gydF4y2Ba.重要的是,我们观察到MHC类ΙΙ基因的TYK2依赖性上调gydF4y2BaHLA-DQB1gydF4y2Ba和gydF4y2BaHLA-DRB1gydF4y2Ba但不是gydF4y2BaHLA-DPB1gydF4y2BaIFNα在S7- sc -胰岛中的作用(补充图gydF4y2Ba9 a -gydF4y2Ba).gydF4y2Ba
TYK2调节t细胞介导的sc -胰岛细胞毒性gydF4y2Ba
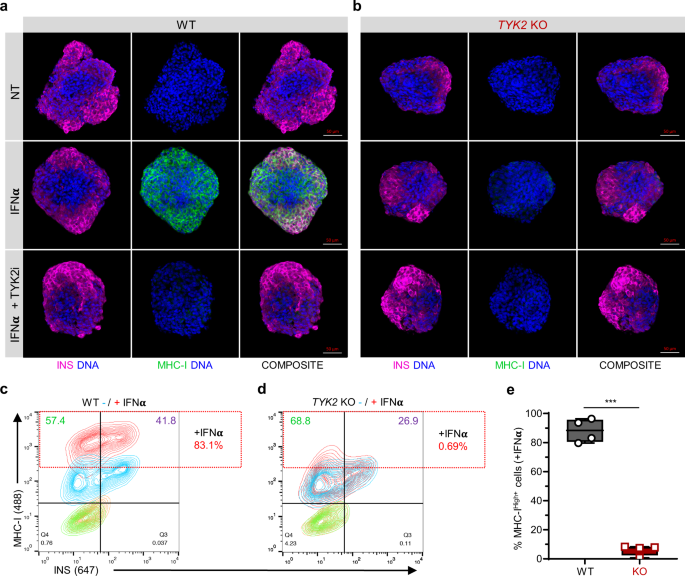
接下来,我们检测了IFNα处理后成熟sc -胰岛表面MHC类Ι蛋白的表达。我们观察到在WT sc -胰岛上有强烈的上调,而在gydF4y2BaTYK2gydF4y2BaKO或TYK2i联合治疗(图。gydF4y2Ba6 a、bgydF4y2Ba).同样,流式细胞术证实,WT sc -胰岛中MHC类Ι总体增加83.1%,而在gydF4y2BaTYK2gydF4y2BaKO(无花果。gydF4y2Ba6汉英gydF4y2Ba).值得注意的是,gydF4y2BaTYK2gydF4y2BaKO sc -胰岛也有26.9%的INSgydF4y2Ba+gydF4y2Ba相比WT sc -胰岛的41.8%。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba7期sc -胰岛的代表性图像显示,单独使用IFNα或联合TYK2i治疗24小时后,胰岛素(红色)和MHC类Ι(绿色)的免疫细胞化学表达(gydF4y2BangydF4y2Ba= 3)。面板gydF4y2Ba一个gydF4y2Ba, WT细胞;面板gydF4y2BabgydF4y2Ba,gydF4y2BaTYK2gydF4y2BaKO细胞。比例尺= 50 μm。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba有代表性的流式细胞仪等高线图显示IFNα处理24 h后胰岛素和MHC类Ι的表达。面板gydF4y2BacgydF4y2Ba, WT细胞;面板gydF4y2BadgydF4y2Ba,gydF4y2BaTYK2gydF4y2BaKO细胞。gydF4y2BaegydF4y2Ba数据的量化gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba(gydF4y2BangydF4y2Ba= 4)。双尾未配对gydF4y2BatgydF4y2Ba-检验以确定显著性水平。盒和胡须图显示中位数与最小到最大胡须。***gydF4y2BapgydF4y2Ba< 0.001。源数据作为源数据文件提供。gydF4y2Ba
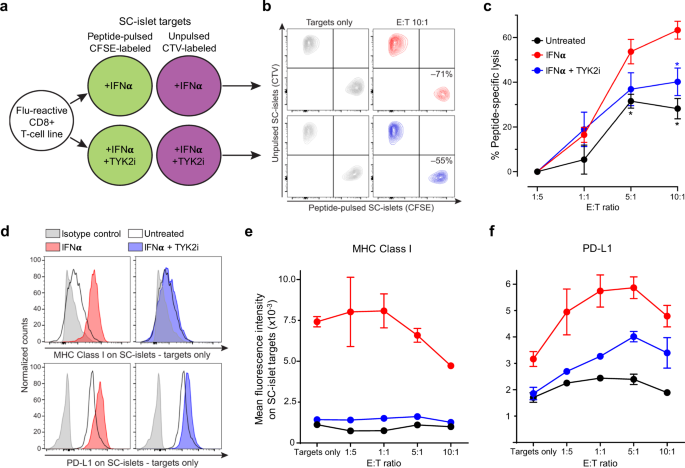
为了研究TYK2i抑制ifn α诱导的MHC Class Ι上调是否可以降低WT sc -胰岛对t细胞介导的细胞毒性的脆弱性,我们设计了一个t细胞共培养实验(图2)。gydF4y2Ba7一个gydF4y2Ba).为了排除TYK2丢失时β细胞抗原下调的潜在混淆效应,我们使用了一种流感肽反应性CD8gydF4y2Ba+gydF4y2Bat细胞线。将不同数量的t细胞与肽脉冲、cfse标记的sc -胰岛和非脉冲、ccv标记的sc -胰岛的固定混合物一起培养6小时,这些细胞分别用IFNα单独处理或与TYK2i联合处理或不处理。存活的sc -胰岛的比例因此提供了肽特异性裂解的读数(图。gydF4y2Ba7 bgydF4y2Ba).IFNα处理导致sc -胰岛裂解显著增加,但在TYK2i存在时被抑制(图。gydF4y2Ba7 cgydF4y2Ba).这些细胞毒性结果与MHC类Ι表达平行(图。gydF4y2Ba7 d, egydF4y2Ba).随着t细胞数量的增加,细胞毒性存活下来的sc -胰岛是那些MHC类Ι表达较低的细胞(图。gydF4y2Ba7 egydF4y2Ba).虽然TYK2i完全抑制了MHC类Ι的上调,但细胞毒性仅被部分抑制。与已知的IFNα对程序性死亡配体-1 (PD-L1)上调的作用一致gydF4y2Ba31gydF4y2Ba, TYK2i治疗也部分抑制了PD-L1的上调(图。gydF4y2Ba7 d, fgydF4y2Ba).PD-L1gydF4y2Ba高gydF4y2Ba当t细胞数量增加至5:1效应靶比时,sc -胰岛细胞毒性存活(图。gydF4y2Ba7 fgydF4y2Ba).TYK2i对MHC类Ι的抑制作用和PD-L1的上调可能解释了不完全抑制t细胞介导的细胞毒性。gydF4y2Ba
一个gydF4y2Bat细胞/ sc -胰岛共培养实验示意图。不断增加的流感肽反应性CD8gydF4y2Ba+gydF4y2BaT细胞与肽脉冲、cfse标记的sc -胰岛和未脉冲、CellTrace Violet (CTV)标记的sc -胰岛的固定混合物一起孵卵6小时,这些细胞先用IFNα单独或联合TYK2i处理24小时,或不处理。存活比率(活/死阴性)脉冲CFSEgydF4y2Ba+gydF4y2Bavs.无脉冲CTVgydF4y2Ba+gydF4y2Basc -胰岛因此提供了肽特异性裂解的读数。gydF4y2BabgydF4y2BaIFNα处理(上)和IFNα/ tyk2i处理的sc -胰岛(下)的典型流式细胞术等高线图,单独培养(左)或与T细胞以效靶比(E:T)为10:1(右)。每个群体都对活/死负面事件进行了控制。T细胞存在时肽特异性裂解的百分比(即CFSE的比例)gydF4y2Ba+gydF4y2Ba/ CTVgydF4y2Ba+gydF4y2Ba活细胞归一化到没有T细胞的比例)。gydF4y2BacgydF4y2Ba在不同的E:T比条件下的肽特异性裂解。数据为三次实验的归一化均值±SEM: *gydF4y2BapgydF4y2Ba双尾Mann-Whitney检验< 0.05gydF4y2BaUgydF4y2Ba测试vs IFNα。gydF4y2BadgydF4y2Ba在IFNα(左)或IFNα/TYK2i(右)处理的sc -胰岛靶标中,MHC类Ι(上)和PD-L1表达的代表性流式细胞仪直方图(下)。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba平均荧光强度gydF4y2BaegydF4y2BaMHC类Ι和gydF4y2BafgydF4y2Ba不同E:T比值下PD-L1在sc -胰岛中的表达。数据为重复井的均值±SEM,所示为两次实验中的一次代表性实验。源数据作为源数据文件提供。gydF4y2Ba
综上所述,这些结果表明TYK2抑制抑制ifn α诱导的sc -胰岛MHC类Ι的上调,并且,尽管同时抑制了PD-L1的上调,但显著降低了随之而来的t细胞介导的细胞毒性。gydF4y2Ba
分析gydF4y2BaTYK2gydF4y2Bafingen队列中的snp (rs34536443和rs2304256)gydF4y2Ba
的功能丧失SNPsgydF4y2BaTYK2gydF4y2Ba(例如,rs34536443, rs2304256)已被报道对包括T1D在内的几种自身免疫性疾病具有保护作用gydF4y2Ba9gydF4y2Ba,gydF4y2Ba32gydF4y2Ba.本研究中使用的TYK2i BMS-986165模拟了rs34536443 (TYK2gydF4y2BaP1104AgydF4y2Ba)编码变体gydF4y2Ba20.gydF4y2Ba.我们在FinnGen项目(R7 . FinnGen .fi)的R7数据集中复制了这些SNP的全现象关联分析,该数据集汇编了3095个临床终点,这些临床终点来自309,154名芬兰人的电子健康记录数据(补充表)gydF4y2Ba1gydF4y2Ba).我们发现rs34536443和rs2304256在芬兰人群中提供了对几种自身免疫/自身炎症性疾病的保护,包括T1D(8671例和255,466例对照;补充图。gydF4y2Ba10 a, bgydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
在这里,我们展示了T1D候选基因以前未知的作用gydF4y2BaTYK2gydF4y2Ba在胰腺内分泌细胞发育中。在TYK2缺失的情况下,KRAS表达上调,导致促内分泌转录因子NEUROG3的不恰当诱导。虽然成熟gydF4y2BaTYK2gydF4y2Ba正常胰岛素刺激指数反应显示,KO sc -胰岛β细胞数量较低,胰岛素分泌机制完整(图2)。gydF4y2Ba2我gydF4y2Ba和补充图。gydF4y2Ba4 b, cgydF4y2Ba).重要的是,TYK2被发现对sc -胰岛的IFN-Ι反应性至关重要,这支持了抑制TYK2以阻止T1D进展的治疗原理。gydF4y2Ba
hPSCs定向分化为胰岛细胞提供了一个可控的实验系统,以研究糖尿病相关基因在胰腺发育中的作用gydF4y2Ba11gydF4y2Ba,gydF4y2Ba33gydF4y2Ba.我们和其他研究人员此前已经证明,STAT3激活可调节NEUROG3介导的胰腺β细胞分化gydF4y2Ba12gydF4y2Ba,gydF4y2Ba34gydF4y2Ba.在本研究中,我们发现TYK2是一种主要的STAT激活剂,在胰腺祖细胞中对NEUROG3的表达也有调节作用。有趣的是,促炎细胞因子(IL1β, TNFα和IFNγ)通过STAT3依赖的NEUROG3表达诱导胰腺导管细胞的内分泌分化gydF4y2Ba35gydF4y2Ba.gydF4y2Ba
我们的结果揭示了一种意想不到的和以前未知的负调控gydF4y2BaTYK2gydF4y2Ba和gydF4y2Ba喀斯特gydF4y2Ba(无花果。gydF4y2Ba3 gydF4y2Ba).TYK2对KO细胞中KRAS表达的调控是值得注意的,因为已知JAK/STAT信号通路对于受体酪氨酸激酶(RTK)和丝裂原活化蛋白激酶(MAPK)信号通路非常重要gydF4y2Ba36gydF4y2Ba.与此一致的是,Reactome对S5体RNA-seq的富集分析显示RTK通路在小鼠中显著上调gydF4y2BaTYK2gydF4y2BaKO细胞。已有研究表明,KRAS可加速GgydF4y2Ba1gydF4y2Ba/S的进阶和G . S的延长gydF4y2Ba1gydF4y2Ba期是在内分泌祖细胞周期退出之前完全诱导NEUROG3表达的先决条件gydF4y2Ba24gydF4y2Ba.因此,KRAS水平的升高gydF4y2BaTYK2gydF4y2BaKO、PP和EP细胞加速细胞周期,导致神经g3增强受损(图。gydF4y2Ba4 l-ngydF4y2Ba).重要的是,KRAS已被证明在胰腺内分泌细胞中不具有致癌功能,并且从未在胰岛细胞肿瘤中发现激活KRAS突变(补充图)。gydF4y2Ba3 c, dgydF4y2Ba)gydF4y2Ba21gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.与此一致,我们没有观察到细胞周期动力学的差异gydF4y2BaTYK2gydF4y2BaS5分化后KO β样细胞。综上所述,我们发现TYK2对胰腺祖细胞中JAK/STAT通路的调控对于内分泌分化进程所需的细胞周期控制至关重要,但TYK2不参与成熟内分泌细胞的增殖调控。gydF4y2Ba
明显的是,罕见的功能丧失gydF4y2BaTYK2gydF4y2Ba在日本人群中,启动子突变(Clin Var, 440728)易患自身抗体阴性的T1D和T2DgydF4y2Ba8gydF4y2Ba.这种关联被认为与病毒感染易感性增加有关gydF4y2Ba38gydF4y2Ba.然而,基于我们的研究结果,TYK2表达的部分缺失可能导致β细胞质量降低,这是导致糖尿病风险增加的一个因素。gydF4y2Ba
值得注意的是,生殖细胞功能丧失gydF4y2BaTYK2gydF4y2Ba突变(rs34536443;TYK2gydF4y2BaP1104AgydF4y2Ba)已被报道并在此证实,在芬兰人群中对几种自身免疫性疾病包括T1D具有保护作用gydF4y2Ba9gydF4y2Ba,gydF4y2Ba32gydF4y2Ba(补充图。gydF4y2Ba10gydF4y2Ba).这种对自身免疫的高度保护作用与抑制IFN-Ι、IL12和IL23信号有关gydF4y2Ba32gydF4y2Ba.值得注意的是,IFN-Ι反应是T1D病因学的重要贡献者,在早期疾病中抑制这些反应被认为是一种潜在的干预措施gydF4y2Ba6gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.gydF4y2BaTYK2gydF4y2Ba-沉默的成年β细胞(即siRNA或TYK2i诱导的50%抑制)显示有限的IFNα通路激活,但保留了抗病毒反应和β细胞功能gydF4y2Ba10gydF4y2Ba.我们的实验表明,TYK2的缺失消除了包括MHC类Ι在内的ISGs的上调,相当于在β细胞、α细胞及其EPs中(图2)。gydF4y2Ba5度gydF4y2Ba).此外,ifn α诱导抗原处理基因上调,即免疫蛋白酶体(gydF4y2BaPSMB8gydF4y2Ba,gydF4y2BaPSMB9gydF4y2Ba)和肽转运蛋白(gydF4y2BaTAP1gydF4y2Ba,gydF4y2BaTAP2gydF4y2Ba,gydF4y2BaTAPBPgydF4y2Ba)缺失,提示免疫原肽的加工和呈现受损gydF4y2BaTYK2gydF4y2BaKO细胞gydF4y2Ba27gydF4y2Ba.因此,与我们在体外使用肽反应性CD8观察到的效果相比,这些作用可能协同抑制体内的自身免疫反应gydF4y2Ba+gydF4y2BaT细胞对抗肽脉冲sc -胰岛(图。gydF4y2Ba7gydF4y2Ba).尽管这些肽驱动的反应与对抗自然处理和呈现的β细胞肽的自身免疫反应相比具有更高的细胞毒性,并且伴随抑制ifn α诱导的PD-L1上调,TYK2i仍然有效地限制了sc -胰岛对t细胞的脆弱性。仔细的TYK2i滴定,或同时靶向IFNα信号传导的其他下游介质,可能允许解离其对MHC类Ι和PD-L1的抑制作用。此外,IFNα诱导MHC类ΙΙ基因的上调(gydF4y2BaHLA-DQB1gydF4y2Ba,gydF4y2BaHLA-DRB1gydF4y2Ba在sc -胰岛模型中,TYK2的抑制也拯救了细胞,这表明下游的糖尿病性CD4激活减少gydF4y2Ba+gydF4y2Bat细胞也可以获得。gydF4y2Ba
最近的一份报告表明,与自体pbmc共培养后的iPSC-β细胞相比,iPSC-α细胞可选择性地免受t细胞介导的破坏,尽管它们在异基因环境中具有免疫原性gydF4y2Ba40gydF4y2Ba.重要的是,我们的scRNA-seq数据集揭示了类似的情况gydF4y2BaTYK2gydF4y2Baα细胞样和β细胞样群体中ISGs的依赖性上调,表明其调控机制相似。因此,本模型可能有助于理解α细胞在具有相似的IFNα反应的情况下,如何选择性地免受t细胞介导的自身免疫的影响。gydF4y2Ba
总之,使用gydF4y2BaTYK2gydF4y2BaKO sc -胰岛模型,我们破译了双重作用的候选基因gydF4y2BaTYK2gydF4y2Ba在胰腺β细胞中。首先,在胰岛发育早期,TYK2的缺失会影响内分泌功能,但不会影响成熟β细胞的功能。其次,成熟胰岛细胞中TYK2的抑制有效地抑制了IFNα诱导的抗原加工和递呈机制的上调,从而降低了对t细胞毒性的脆弱性。抑制TYK2信号足以保护sc -胰岛免受IFNα反应和t细胞毒性的影响。重要的是,本研究中使用的TYK2i BMS-986165已经进入治疗银屑病的2期和3期试验gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba41gydF4y2Ba因此可能为T1D干预提供了一个有吸引力的候选者。gydF4y2Ba
方法gydF4y2Ba
hPSCs细胞系和基因组编辑gydF4y2Ba
hiPSCs系HEL46.11(来源于人类新生儿包皮成纤维细胞)gydF4y2Ba42gydF4y2Ba和人胚胎干细胞株H1 (WA01, WiCell)用于研究。HEL46.11 hiPSCs用于生成gydF4y2BaTYK2gydF4y2Ba本研究中使用的敲除系。根据赫尔辛基和Uusimaa医院区协调伦理委员会的批准,hiPSCs是生成和使用的。423/13/03/00/08)。hiPSCs在Essential 8 (E8)培养基(Thermo Fisher, A1517001)的Matrigel (Corning, #354277)涂层板上培养,并在PBS中用5 mM EDTA (Thermo Fisher, #15575-038)传代。细胞系常规检测支原体污染。gydF4y2Ba
因为你把我击倒了gydF4y2BaTYK2gydF4y2Ba在HEL46.11 iPSCs中,使用使用Benchling设计的两个CRISPR/Cas9指南(G1 AAGAGCTAACAGGGGTCTCT和G2 GTCTGGGGCGTTGGCACCAT)删除了含有ATG起始密码子的第三个外显子。用6 μg cag - cas9 - t2a - egfp - res- puro (Addgene,质粒号)电穿孔200万个iPSCs。78311,连同其使用的详细协议),500ng gRNA1-PCRgydF4y2BaTYK2gydF4y2BagRNA2-PCR 500 nggydF4y2BaTYK2gydF4y2Ba产品,采用Neon转染系统(赛默飞世尔科学;1100 V;20 ms;两个脉冲)。对单细胞进行分类、扩增,筛选3号外显子缺失约300 bp。阳性克隆经Sanger测序验证。前三名的CRISPR脱靶命中是测序的,没有任何索引。研究中用于基因组编辑的引物序列在补充表中描述gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
体外hPSCs培养及其胰腺谱系分化gydF4y2Ba
使用我们最近发表的详细方案,hPSCs分化为胰腺谱系,生成sc -胰岛gydF4y2Ba15gydF4y2Ba稍加修改。简单地说,用EDTA分离近80%的融合板干细胞,并在添加了10 μM Rho-Associated kinase inhibitor (ROCKi, Y-27632, Selleckchem S1049)的E8培养基中以约22万细胞/cm的密度将其接种到新的Matrigel涂层板上gydF4y2Ba2gydF4y2Ba.在播种24小时后开始分化,并进行7期分化方案(1-4期贴壁培养,5期AggreWell (Stemcell Technologies, #34421), 6期和7期悬浮培养)。gydF4y2Ba
详细的鉴别方案和特定阶段的完整介质配方如下所述。在补充表中描述的鉴别方案中使用的试剂的细节gydF4y2Ba3 gydF4y2Ba和gydF4y2Ba4 gydF4y2Ba.gydF4y2Ba
人胰岛RNAseq的相关性研究gydF4y2Ba
来自人类胰岛的数据按照描述进行处理gydF4y2Ba19gydF4y2Ba.简单地说,人类胰岛(gydF4y2BangydF4y2Ba= 191)通过北欧临床胰岛移植网络的EXODIAB网络获得。28名T2D捐赠者临床诊断为T2D。RNA提取使用miRNeasy (Qiagen)或AllPrep DNA/RNA (Qiagen)迷你试剂盒miRNeasy (Qiagen)或AllPrep DNA/RNA (Qiagen)迷你试剂盒使用TruSeq RNA样品制备试剂盒(Illumina)制备高质量RNA (RIN > 8)文库。隆德的伦理委员会(Dnr)已经批准从器官捐赠者那里收集人类胰岛。陆2011/263)。人类胰岛的所有手术均经乌普萨拉大学和隆德大学伦理委员会批准,并通过适当措施获得捐赠者或其亲属的知情同意。该研究的设计和实施符合所有关于使用人体研究参与者的相关规定,并根据《赫尔辛基宣言》制定的标准进行。gydF4y2Ba
人胎儿胰腺gydF4y2Ba
RNA采用TRIZOL方法从终止妊娠(7-14孕周)的胎儿组织活检中提取(gydF4y2BangydF4y2Ba= 16)。然后使用TruSeq RNA文库制备试剂盒(Illumina)构建RNA文库。RNA测序在HiSeq 2000 / Nextseq (Illumina)上进行。配对端长101 bp的reads使用STAR与参考人类基因组Build 37进行比对,并按照描述生成计数gydF4y2Ba43gydF4y2Ba.使用COMBAT函数R包v3.32.1执行批量更正。在EdgeR v3.26.8中比较胎儿和成人(来自GTEX)胰腺的表达水平。通过Pearson相关分析,基因表达与受孕后天数相关。计数对数归一化后,使用Pearson相关性进行基因-基因相关性。收集胎儿胰腺组织已从隆德的伦理委员会获得伦理许可(Dnr2012/593, Dnr 2015/241和2018/579)。所有涉及人类胎儿胰腺的手术均经隆德大学伦理委员会批准,并通过适当措施获得亲属的知情同意。该研究的设计和实施符合所有关于使用人体研究参与者的相关规定,并根据《赫尔辛基宣言》制定的标准进行。gydF4y2Ba
超深体RNAseq分析gydF4y2Ba
我们对HEL46.11衍生的1期(DE)、4期(PP)和7期(sc -胰岛)样本进行了超深度RNAseq分析,如图所示。gydF4y2Ba1 b, cgydF4y2Ba.如前所述,进行分化,RNA分离和文库制备gydF4y2Ba12gydF4y2Ba.简单地说,使用NucleoSpin Plus RNA试剂盒(machery - nagel)从hipsc来源的细胞中分离总RNA,用DNase I (NEB)处理,并使用RNA HS Assay kit (Qubit)定量。使用TruSeq搁浅mRNA文库准备试剂盒(Illumina)制备定向RNA-seq文库。文库在Eurofins Genomics使用Illumina HiSeq 2500(化学v4)进行测序。gydF4y2Ba
利用STAR比对仪将读对定位到人类参考基因组(GRCh38)gydF4y2Ba44gydF4y2Ba.在Rsubread v2.4.3中使用featurets从映射到外显子的读对计数基因表达gydF4y2Ba45gydF4y2Ba.排除重复、嵌合和multimapping reads,以及低映射评分(MAPQ < 10)的reads。读取计数数据用DESeq2 v1.30.1进行分析gydF4y2Ba46gydF4y2Ba.我们分析了分化作为时间函数的影响,以及不同发育阶段(de - pp - sc -胰岛)之间的两两比较。我们从分析中删除了低表达水平的基因(所有样本均<50 reads)。用prcomp计算PCA,使用归一化计数,使用来自limma的音量函数进行缩放gydF4y2Ba47gydF4y2Ba.gydF4y2Ba
对于WT和gydF4y2BaTYK2gydF4y2BaKO基因型样品,RNAseq (Illumina HiSeq 2500;4)如上所述制备,并在图所示的0期(iPSCs)、4期(PP)、5期(EP)和6期(EC)进行。gydF4y2Ba3 gydF4y2Ba.使用Cutadapt v2.6对原始数据进行过滤,去除适配器序列,歧义(N)和低质量碱基(Phred评分<25)。我们还排除了修剪后太短(<25 bp)的读对。利用STAR aligner v2.5.4b将筛选后的reads对定位到人类参考基因组(GRCh38)gydF4y2Ba44gydF4y2Ba并进行如上所述的处理。我们分析了…的影响gydF4y2BaTYK2gydF4y2Ba针对每个发育阶段(iPSCs、4期、5期和6期)分别进行敲除。对于错误发现率(FDR)估计,我们使用Fdrtool v1.2.17gydF4y2Ba48gydF4y2Ba.使用ClusterProfiler v3.18.1分别对差异表达基因(FDR<0.01)进行富集分析gydF4y2Ba49gydF4y2Ba对抗Reactome通路gydF4y2Ba50gydF4y2Ba.gydF4y2Ba
单细胞RNA测序样品制备及分析gydF4y2Ba
WT和gydF4y2BaTYK2gydF4y2Ba如前所述,准备KO基因型5期和6期(未处理或100 ng/ml处理24 h IFNα)样本进行单细胞RNAseq分析gydF4y2Ba15gydF4y2Ba.简单地说,细胞用2毫升1:1的TrypLE Select (Thermo目录编号:;12563-029)和Trypsin-EDTA (Sigma目录号:12563-029)。T4174, 10×原液用PBS 1:10稀释)在37°C下浸泡10分钟。加入12 ml冷的5% FBS-PBS中和解离剂。细胞通过30 μm过滤器(BD)去除细胞团块,200 rcf离心5 min,在包封缓冲液(1× PBS, 0.04% BSA)中洗涤2次,计数并调整至1× 10gydF4y2Ba6gydF4y2Ba/ml细胞悬液包封。gydF4y2Ba
单细胞基因表达谱由10x Genomics Chromium Single cell 3’rnaseq平台使用Chromium Next GEM Single cell 3’基因表达(3.1化学版)生成。原始数据(fastq)处理使用10x Genomics Cell Ranger (v3.1)管道进行。这些reads被映射到人类参考基因组(GRCh38.98)。用Seurat v3.2.3分析过滤后的计数gydF4y2Ba22gydF4y2Ba.使用默认方法对计数进行归一化、缩放和分析。每个样本分别鉴定出前1000个可变基因,并在分析过程中进行组合(共1199个可变基因)。为了减少数据集之间的偏差,我们使用了Harmony v1.0gydF4y2Ba51gydF4y2Ba在前50个pc上,以样本为协变量(theta = 2, nclust = 50, max.iter。Cluster = 40, max.iter.harmony = 10)。集成的(协调的)pc被用于构建统一流形近似和投影(UMAP),找到相邻的细胞(使用共享最近邻),并使用默认的Seurat方法识别细胞集群。为了减少来自被破坏细胞的背景RNA污染,我们使用SoupX v1.4.8gydF4y2Ba52gydF4y2Ba与Seurat鉴定的簇,以及已知的细胞类型特异性标记基因(gydF4y2BaGCGgydF4y2Ba,gydF4y2Ba竞技场队伍gydF4y2Ba,gydF4y2BaINSgydF4y2Ba,gydF4y2BaIAPPgydF4y2Ba,gydF4y2Ba风场gydF4y2Ba,gydF4y2BaGHRLgydF4y2Ba,gydF4y2BaPPYgydF4y2Ba,gydF4y2BaCOL3A1gydF4y2Ba,gydF4y2BaCPA1gydF4y2Ba,gydF4y2BaCLPS后续gydF4y2Ba,gydF4y2BaREG1AgydF4y2Ba,gydF4y2BaCELA3AgydF4y2Ba,gydF4y2BaCTRB1gydF4y2Ba,gydF4y2BaCTRB2gydF4y2Ba,gydF4y2BaPRSS2gydF4y2Ba,gydF4y2BaCPA2gydF4y2Ba,gydF4y2BaKRT19gydF4y2Ba,gydF4y2BaVTCN1gydF4y2Ba),以估计污染程度。然后对调整后的计数进行Seurat分析,并进行如下修改。UMI计数少于5000或表达基因少于1700的细胞被排除。我们还去除了线粒体reads异常高的细胞(>占20%)。我们使用CellCycleScoring-function中的默认设置为所有细胞分配了一个细胞周期阶段,并使用它来消除在缩放数据时由于细胞周期异质性造成的偏差。在聚类过程中,分辨率设置为0.2。用Seurat Wilcox-test检测聚类和样本类型之间的差异表达基因。这些聚类根据相似度重新排序,并通过与已知标记基因相对应的差异表达基因识别为细胞类型。使用ClusterProfiler v3.18.1分别对差异表达基因(FDR < 0.01)进行富集分析gydF4y2Ba49gydF4y2Ba反对KEGG。ClusterProfiler还用于同一数据库的基因集富集分析(GSEA),使用折叠变化对基因进行排序。gydF4y2Ba
活体动物移植研究gydF4y2Ba
动物护理和实验由芬兰国家动物实验委员会批准(ESAVI/14852/2018)。NOD-SCID-Gamma (NSG, 005557, Jackson实验室)小鼠从SCANBUR获得,并安置在赫尔辛基生物医学动物设施中,进行12小时的光/暗循环,并自由喂食标准饲料,2016 Teklad全球16%蛋白啮齿类动物饲料(ENVIGO)。温度保持在23℃,相对湿度为24 RH。如前所述,在3至8个月大的小鼠上进行植入gydF4y2Ba15gydF4y2Ba.简单地说,阶段7- WT和gydF4y2BaTYK2gydF4y2Ba将相当于约200万个细胞的KO sc -胰岛装载在PE-50管中,并植入肾包膜下。每月从大隐静脉收集小鼠血清样本,并在−80°C保存,用于人C肽分析。使用超灵敏c肽ELISA试剂盒(Mercodia, Uppsala, Sweden)从血浆样本中检测人特异性c肽。gydF4y2Ba
TYK2 WT蛋白在内分泌前体细胞中的过表达gydF4y2Ba
WT- tyk2在WT和KO分化细胞S5期间短暂过表达。pRC/CMV-TYK2-VSV质粒来自Sandra Pellegrini博士(Addgene #139344)gydF4y2Ba53gydF4y2Ba.S4末,用TrypLE (Thermo Fisher Scientific)在37℃、5 × 10条件下将细胞分离成单细胞悬液10 mingydF4y2Ba6gydF4y2Ba细胞用2µg质粒使用Neon转染系统(Thermo Fisher Scientific;1100 V;20 ms;两个脉冲)。然后将细胞在AggreWell板中镀以形成3D聚集物24-48小时。gydF4y2Ba
免疫印迹gydF4y2Ba
为了提取蛋白质,用冰冷的PBS清洗细胞,用细胞裂解缓冲液(Cell Signaling Technologies #9803)在冰上溶解10分钟。细胞在冰上超声3 × 5秒,离心(1000 rcf, 4℃下10分钟),上清液保存在−80℃。样品在Any kD Mini-PROTEAN TGX凝胶(Bio-Rad Laboratories)上运行,然后按照制造商的说明使用ilot系统(Invitrogen)干燥转移到硝化纤维膜上。在4℃下用一抗检测过夜,用含0.05% Tween的tris缓冲生理盐水冲洗两次2 × 10 min,并与相应的二抗在室温下孵育30 min。采用Amersham ECL (RPN2235;Cytiva)和Bio-RAD Chemidoc XRS1成像系统;Image Lab软件v6.0.0。在WB研究中使用的抗体及其稀释剂的细节见补充表gydF4y2Ba5gydF4y2Ba.gydF4y2Ba
流式细胞术gydF4y2Ba
为了定量第1期的最终内胚层阳性细胞,如前所述,对CXCR4进行细胞计数gydF4y2Ba12gydF4y2Ba.简单地说,细胞在室温下用1:10 PE小鼠抗人CXCR4抗体(BD Biosciences)或PE小鼠IgG2a, kappa同型孵卵30分钟,然后用FACSCalibur (BD Biosciences)分析。在细胞内抗原细胞术中,细胞用TrypLE(赛默飞世尔科学公司)在37℃分离6分钟,然后在冷的5%含fbs的PBS中重悬。按照制造商的说明,使用Cytofix/Cytoperm (554714, BD Biosciences)对细胞进行固定和渗透。一抗或偶联抗体与细胞在4°C的Perm/Wash缓冲液(554714,BD Biosciences)中孵育过夜,其中含有4% FBS和二抗,在rt中孵育45分钟。然后使用FACSCalibur细胞仪(BD Biosciences)与BD Cellquest Pro v4.0.2 (BD Biosciences)和FlowJo (Tree Star Inc.)软件分析细胞。EdU和NKX6-1双染色使用Click-iT EdU流式细胞仪检测试剂盒(Thermo Fisher Scientific, #C10419)。S5细胞用5 μM EdU标记18小时,然后按照制造商的说明收集细胞并对EdU和细胞内NKX6-1进行染色。对于所有流式细胞仪样品,用FSC和SSC对细胞进行门控以去除细胞碎片。通过同一人群中阴性染色的细胞和/或未染色的偶联IgG同型对照来确定阳性和阴性门控。对于t细胞毒性测定,在排除CFSEnegCTVneg CD8后gydF4y2Ba+gydF4y2BaT细胞,sc -胰岛细胞被门控在活单线上,然后被门控在CFSE上gydF4y2Ba+gydF4y2Ba和CTVgydF4y2Ba+gydF4y2Ba计算它们的相对比例。在流式细胞仪研究中使用的抗体及其稀释剂的细节见补充表gydF4y2Ba6gydF4y2Ba.gydF4y2Ba
mRNA提取和qRT-PCRgydF4y2Ba
使用NucleoSpin Plus RNA试剂盒(machery - nagel)从hipsc来源的细胞中分离总RNA。用Moloney小鼠白血病病毒逆转录酶(M1701, Promega)在37°C下逆转录90 min,得到1.5 μg RNA。用5x HOT FIREPol EvaGreen qPCR Mix Plus no ROX (Solisbiodyne)在20 μl的反应中扩增出50 ng cDNA。用QIAgility (Qiagen)机器人将反应移液到转子-基因q的100孔圆盘上,以亲环蛋白G (PPIG)为内参基因,用ΔΔCt方法分析基因表达的相对定量。采用无模板逆转录作为阴性对照,外源阳性对照作为校准器。qRT-PCR引物序列将根据要求从铅接触处提供。gydF4y2Ba
免疫细胞化学和免疫组织化学gydF4y2Ba
对于石蜡包埋,将团聚体用4% PFA在4℃下固定24小时,伊红染色后,将团聚体包埋在2%低熔点琼脂糖(Fisher生物反应器)PBS中,并转移到石蜡块中。WT或gydF4y2BaTYK2gydF4y2Ba2个月时回收KO植入移植物,解剖,在RT下用4% PFA固定48小时,石蜡包埋,用徕卡切片机切成5 μm切片。对于免疫组化,将载玻片脱蜡,抗原通过载玻片在0.1 M柠檬酸缓冲液(pH值6)中使用Decloaking chamber (Biocare Medical)在95°C下煮沸12分钟。对于整个贴壁或贴壁培养染色,细胞在4% PFA中RT固定15分钟,在PBS中用0.5% Triton X-100渗透15分钟,然后用Ultra-V (Thermo Fisher Scientific)封闭10分钟,在4℃下用一抗过夜,在PBS中稀释0.1% Tween的RT中用二抗体培养1小时。使用Invitrogen™EVOS™FL数字倒置荧光显微镜或Zeiss Axio Observer Z1带apoome对细胞进行成像,并用ZEN-2软件进行进一步处理。所有染色样品均经过同等处理,并在相同的显微镜参数下成像。使用CellProfiler软件进行图像量化gydF4y2Ba54gydF4y2Ba和斐济软件gydF4y2Ba55gydF4y2Ba.在免疫细胞化学研究中使用的抗体及其稀释剂的细节见补充表gydF4y2Ba6gydF4y2Ba.gydF4y2Ba
静态和动态葡萄糖刺激胰岛素分泌gydF4y2Ba
对于静态测定,人工采摘50个聚合体,并在2.8 mmol/L葡萄糖克雷布斯缓冲液中预孵育在12孔板中,放置在95转/分的旋转平台上,在37℃下孵育90分钟。然后用Krebs缓冲液清洗聚集物,并依次在含有2.8 mmol/L葡萄糖、16.6 mmol/L葡萄糖和2.8 mmol/L葡萄糖+ 30 mmol/L KCL的Krebs缓冲液中孵育30分钟。各处理各取200 μL样品,保存于- 80°C,用于胰岛素ELISA检测。使用灌注仪(Brandel Suprafusion SF-06, MD, USA)进行胰岛素分泌动态测试,流速为0.25 ml/min,每4分钟采样一次。使用胰岛素酶联免疫吸附法(Mercodia,瑞典)分析采集的每个馏分的样品。在胰岛素分泌静态和动态试验后,收集sc -胰岛,并分析总胰岛素和DNA含量。刺激胰岛素分泌结果用总DNA含量归一化。gydF4y2Ba
细胞毒性检测gydF4y2Ba
一个CD8gydF4y2Ba+gydF4y2Ba对hla - a2限制性肽流感病毒基质蛋白MP反应的t细胞系gydF4y2Ba58 - 66gydF4y2Ba(四聚体染色32%肽特异性)解冻静置3小时后使用。同时,用TrypLE分离胰岛簇,用1 μM CFSE或CellTrace Violet (CTV)染色,0.1 μM Influenza MP孵育2 hgydF4y2Ba58 - 66gydF4y2Ba或肽稀释剂,分别。洗涤后,将CFSE和ctv标记的sc -胰岛等量混合,在1 × 10的条件下培养6 hgydF4y2Ba5gydF4y2Ba在96孔平板中,单独或增加T细胞数量(0.2 × 10gydF4y2Ba5gydF4y2Ba, 1 × 10gydF4y2Ba5gydF4y2Ba, 5 × 10gydF4y2Ba5gydF4y2Ba,和10 × 10gydF4y2Ba5gydF4y2Ba),分别对应效靶比(E:T)为1:5、1:1、5:1和10:1。清洗后,细胞用活/死固定远红(Thermo Fisher)、抗HLA-A、B、C抗体(RRID: AB_2566151)和PD-L1抗体(RRID: AB_940368)染色,并在BD LSRFortessa流式细胞仪上采集。通过FlowJo对活/死¯事件和CFSE分离后,对sc -胰岛进行分析gydF4y2Ba+gydF4y2Ba(肽脉冲)和CTVgydF4y2Ba+gydF4y2Ba(unpulsed)的人口。不同E:T比下的肽特异性裂解百分比表示为活CFSE的比例gydF4y2Ba+gydF4y2Ba/ CTVgydF4y2Ba+gydF4y2Ba在单独含有sc -胰岛靶的孔中归一化到相同比例的细胞。gydF4y2Ba
量化和统计分析gydF4y2Ba
数据收集自至少3个独立的2个独立的分化实验gydF4y2BaTYK2gydF4y2BaKO hiPSCs克隆(C10和C12)。采用免疫组化盲法定量。形态数据代表了独立分化实验对整个种群的观察结果。图中的所有代表性图像在所有实验中都是可重复的,并随后进行了量化面板。盒状和须状图以最小到最大的形式显示所有的点。所使用的统计方法在每个图例和单独的方法部分中描述。简而言之,学生的未配对双尾gydF4y2BatgydF4y2Ba使用Welch校正检验来比较两组之间的差异,对于超过两组的单因素方差分析,然后使用Prism 8软件(GraphPad software, La Jolla, CA)进行Tukey 's检验。结果以均数±S表示。D除非另有说明。盒须图显示了中位数,其上下铰链对应于第一和第三四分位数(第25和第75百分位数),最小到最大胡须的范围在最小值到最大值之间。gydF4y2BaPgydF4y2Ba-value < 0.05为有统计学意义(*gydF4y2BaPgydF4y2Ba< 0.05;**gydF4y2BaPgydF4y2Ba< 0.01;***gydF4y2BaPgydF4y2Ba< 0.001)。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
HEL46.11的胰腺分化阶段−1、−4和−7,以及WT和的胰腺分化阶段−0、−4、−5和6的超深度批量RNAseq数据gydF4y2BaTYK2gydF4y2BaKO基因型保存在基因表达综合数据库中,并附有登录代码gydF4y2BaGSE190727gydF4y2Ba和gydF4y2BaGSE190725gydF4y2Ba.WT和单细胞RNA-seq数据gydF4y2BaTYK2gydF4y2BaKO基因型胰腺分化期- 5、- 6和治疗±IFNα的6期)保存在基因表达综合数据库中,并带有登录代码gydF4y2BaGSE190726gydF4y2Ba.本文提供了原始数据。原始western blot图像在Mendeley (gydF4y2Bahttps://data.mendeley.com/datasets/8n9nytgy57/1gydF4y2Ba)和源数据文件。显微镜图像采集数据报告在源数据文件。重新分析本文报告的数据所需的任何其他信息可从源数据文件和应要求的主要联系人Vikash Chandra (vikash.chandra@helsinki.fi)和Timo Otonkoski (timo.otonkoski@helsinki.fi)中获得。gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
参考文献gydF4y2Ba
Mallone, R. & Eizirik, D. L. 1型糖尿病的无罪推定:为什么β细胞是如此脆弱的自身免疫目标?gydF4y2BaDiabetologiagydF4y2Ba63gydF4y2Ba, 1999-2006(2020)。gydF4y2Ba
Eizirik, D. L., Pasquali, L. & Cnop, M. 1型和2型糖尿病中的胰腺β细胞:不同的失败途径。gydF4y2Ba内分泌。gydF4y2Ba16gydF4y2Ba, 349-362(2020)。gydF4y2Ba
1型糖尿病全基因组关联研究:不要在翻译中迷失。gydF4y2Ba中国。Transl。Immunol。gydF4y2Ba6gydF4y2Ba, e162-e167(2017)。gydF4y2Ba
Marroqui, L.等。TYK2是1型糖尿病的候选基因,在人胰腺β细胞中调节凋亡和先天免疫反应。gydF4y2Ba糖尿病gydF4y2Ba64gydF4y2Ba, 3808-3817(2015)。gydF4y2Ba
科利,M. L.等。一种综合的多组学方法确定了干扰素-α介导的人类胰腺β细胞反应的景观。gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba, 2584(2020)。gydF4y2Ba
apolaza, P. S.等。I型干扰素反应传感器的胰岛表达与1型糖尿病的免疫浸润和病毒感染相关。gydF4y2BaSci副词gydF4y2Ba7gydF4y2Ba, eabd6527(2021)。gydF4y2Ba
Izumi, K.等。由于自然突变,β细胞中Tyk2基因表达的降低决定了病毒诱发糖尿病的易感性。gydF4y2BaCommun Nat。gydF4y2Ba6gydF4y2Ba, 1-10(2015)。gydF4y2Ba
Nagafuchi, S.等。TYK2启动子变体与日本糖尿病的关系。gydF4y2BaEBioMedicinegydF4y2Ba2gydF4y2Ba, 744-749(2015)。gydF4y2Ba
韦斯特拉,H. J.等。精细定位和功能研究强调了类风湿性关节炎和1型糖尿病的潜在因果变异。gydF4y2BaNat,麝猫。gydF4y2Ba50gydF4y2Ba, 1366-1374(2018)。gydF4y2Ba
Marroqui, L.等。干扰素-α介导人类β细胞HLA I类过表达,内质网应激和凋亡,早期人类1型糖尿病的三个特征。gydF4y2BaDiabetologiagydF4y2Ba60gydF4y2Ba, 656-667(2017)。gydF4y2Ba
Balboa, D, Saarimäki-Vire, J. & Otonkoski, T.简明综述:用于胰腺β细胞病理建模的人类多能干细胞。gydF4y2Ba干细胞gydF4y2Ba37gydF4y2Ba, 33-41(2019)。gydF4y2Ba
Saarimäki-Vire, J.等。激活的STAT3突变通过过早诱导胰腺分化导致新生儿糖尿病。gydF4y2Ba细胞的代表。gydF4y2Ba19gydF4y2Ba, 281-294(2017)。gydF4y2Ba
de Franco, E.等人。YIPF5突变通过内质网应激引起新生儿糖尿病和小头畸形。gydF4y2Baj .中国。Investig。gydF4y2Ba130gydF4y2Ba, 6338-6353(2020)。gydF4y2Ba
蒙塔瑟,H.等人。MANF的缺失由于内质网应激的增加导致儿童期发病综合征性糖尿病。gydF4y2Ba糖尿病gydF4y2Ba70gydF4y2Ba, 1006-1018(2021)。gydF4y2Ba
Balboa, D.等人。来自干细胞的人胰岛的功能、代谢和转录成熟。gydF4y2Ba生物科技Nat。》。gydF4y2Ba40gydF4y2Ba, 1042-1055(2022)。gydF4y2Ba
Ben-David, U., Mayshar, Y. & Benvenisty, N.多能干细胞基于其全局基因表达谱的虚拟核型分析。gydF4y2BaProtoc Nat。gydF4y2Ba8gydF4y2Ba, 989-997(2013)。gydF4y2Ba
Mazewski, C., Perez, R. E., Fish, E. N. & Platanias, L. C. I型干扰素(IFN)调控的典型和非典型信号通路的激活。gydF4y2Ba前面。Immunol。gydF4y2Ba11gydF4y2Ba, 1-13(2020)。gydF4y2Ba
维尔斯等人。绘制人体外β细胞分化过程中的细胞特性。gydF4y2Ba自然gydF4y2Ba569gydF4y2Ba, 368-373(2019)。gydF4y2Ba
阿斯普朗德,O.等。胰岛基因视图-促进胰岛研究的工具。生命科学。联盟5(2022)。gydF4y2Bahttps://www.life-science-alliance.org/content/5/12/e202201376gydF4y2Ba.gydF4y2Ba
伯克,J. R.等。小鼠和人类的自身免疫途径被TYK2假激酶结构域的药理稳定所阻断。gydF4y2Ba科学。Transl。地中海。gydF4y2Ba11gydF4y2Ba, eaaw1736(2019)。gydF4y2Ba
张伯伦,c.e.等。Menin决定K-RAS在内分泌细胞中的增殖输出。gydF4y2Baj .中国。Investig。gydF4y2Ba124gydF4y2Ba, 4093-4101(2014)。gydF4y2Ba
Butler, A, Hoffman, P, Smibert, P, Papalexi, E. & Satija, R.整合不同条件、技术和物种的单细胞转录组数据。gydF4y2Ba生物科技Nat。》。gydF4y2Ba36gydF4y2Ba, 411-420(2018)。gydF4y2Ba
温纳伯格,K,罗斯曼,K. L. & Der, C. J. Ras超家族一瞥。gydF4y2Ba细胞科学。gydF4y2Ba118gydF4y2Ba, 843-846(2005)。gydF4y2Ba
克伦兹,n.a.j等。在胰腺祖细胞中,NEUROG3的磷酸化将内分泌分化与细胞周期联系起来。gydF4y2BaDev细胞。gydF4y2Ba41gydF4y2Ba, 129-142(2017)。gydF4y2Ba
Eizirik, D. L., Szymczak, F., Alvelos, M. I. & Martin, F.从胰腺β细胞基因网络到1型糖尿病的新疗法。gydF4y2Ba糖尿病gydF4y2Ba70gydF4y2Ba, 1915-1925(2021)。gydF4y2Ba
理查森,S. J.等。HLA I类抗原的胰岛细胞高表达:1型糖尿病的一个决定性特征。gydF4y2BaDiabetologiagydF4y2Ba59gydF4y2Ba, 2448-2458(2016)。gydF4y2Ba
Carré, A. & Mallone, R.制造胰岛素并远离自身免疫问题:β细胞难题。gydF4y2Ba前面。Immunol。gydF4y2Ba12gydF4y2Ba, 1-8(2021)。gydF4y2Ba
James, E. A., Mallone, R., Kent, S. C. & Dilorenzo, T. P. 1型糖尿病中的t细胞表位和新表位:全面更新和重新评估。gydF4y2Ba糖尿病gydF4y2Ba69gydF4y2Ba, 1311-1335(2020)。gydF4y2Ba
Nejentsev, S.等人。MHC类I基因HLA-B和HLA-A对1型糖尿病易感性的定位。gydF4y2Ba自然gydF4y2Ba450gydF4y2Ba, 887-892(2007)。gydF4y2Ba
Quesada-Masachs, E.等人。1型糖尿病器官供体胰腺β细胞HLA II类的上调gydF4y2BaDiabetologiagydF4y2Ba65gydF4y2Ba, 387-401(2022)。gydF4y2Ba
科利,M. L.等。PDL1在1型糖尿病患者的胰岛中表达,并通过IRF1诱导被干扰素-α和-γ上调。gydF4y2BaEBioMedicinegydF4y2Ba36gydF4y2Ba, 367-375(2018)。gydF4y2Ba
Dendrou, C. A.等。解决TYK2位点自身免疫的基因型-表型差异。gydF4y2Ba科学。Transl。地中海。gydF4y2Ba8gydF4y2Ba, 363ra149(2016)。gydF4y2Ba
Siehler, J., Blöchinger, a.k, Meier, M. & Lickert, H.从干细胞中提取胰岛用于糖尿病的高级治疗。gydF4y2BaNat. Rev. Drug。越是加大。gydF4y2Ba20.gydF4y2Ba, 920-940(2021)。gydF4y2Ba
Baeyens, L.等。Ngn3在JAK/STAT途径诱导的体外β细胞新生过程中的表达。gydF4y2Ba细胞死亡不同。gydF4y2Ba13gydF4y2Ba, 1892-1899(2006)。gydF4y2Ba
瓦尔迪兹,i.a.等人。促炎细胞因子通过stat3依赖的NGN3激活诱导胰腺导管细胞的内分泌分化。gydF4y2Ba细胞的代表。gydF4y2Ba15gydF4y2Ba, 460-470(2016)。gydF4y2Ba
罗林斯,J. S.,罗斯勒,K. M. &哈里森,D. A. JAK/STAT信号通路。gydF4y2Ba细胞科学。gydF4y2Ba117gydF4y2Ba, 1281-1283(2004)。gydF4y2Ba
吉德克尔·弗里德兰德,s.y.等人。肿瘤基因K-Ras对成人胰腺细胞的环境依赖性转化。gydF4y2Ba癌症细胞gydF4y2Ba16gydF4y2Ba, 379-389(2009)。gydF4y2Ba
我的,k等人。病毒诱发糖尿病的宿主遗传易感性。gydF4y2Ba微生物gydF4y2Ba8gydF4y2Ba, 1-20(2020)。gydF4y2Ba
库曼斯Brachène, A.等。酪氨酸激酶2抑制剂对1型糖尿病人β细胞保护的临床前评估gydF4y2Ba糖尿病ob。金属底座。gydF4y2Ba22gydF4y2Ba, 1827-1836(2020)。gydF4y2Ba
Leite, N. C.等。体外利用人多能干细胞建立1型糖尿病模型。gydF4y2Ba细胞的代表。gydF4y2Ba32gydF4y2Ba, 107894(2020)。gydF4y2Ba
帕普,K.等人。选择性酪氨酸激酶2抑制银屑病2期临床研究gydF4y2Ba心血管病。j .地中海。gydF4y2Ba379gydF4y2Ba, 1313-1321(2018)。gydF4y2Ba
Trokovic, R., Weltner, J. & Otonkoski, T.从人新生儿包皮成纤维细胞生成iPSC系HEL24.3。gydF4y2Ba干细胞研究。gydF4y2Ba15gydF4y2Ba, 266-268(2015)。gydF4y2Ba
阿德利,K. G.等。基因型-组织表达(GTEx)先导分析:人类多组织基因调控。gydF4y2Ba科学gydF4y2Ba348gydF4y2Ba, 648-660(2015)。gydF4y2Ba
Dobin, A.等人。STAR:超快通用RNA-seq校准器。gydF4y2Ba生物信息学gydF4y2Ba29gydF4y2Ba, 15-21(2013)。gydF4y2Ba
Liao, Y., Smyth, G. K. & Shi, W. R包Rsubread更容易,更快,更便宜,更适合RNA测序reads的校准和定量。gydF4y2Ba核酸测定。gydF4y2Ba47gydF4y2Ba, e47(2019)。gydF4y2Ba
Love, m.i, Huber, W. & Anders, S.使用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。gydF4y2Ba基因组医学杂志。gydF4y2Ba15gydF4y2Ba, 1-21(2014)。gydF4y2Ba
里奇,m.e.等人。Limma为rna测序和微阵列研究提供差分表达分析。gydF4y2Ba核酸测定。gydF4y2Ba43gydF4y2Ba, e47(2015)。gydF4y2Ba
Strimmer, K. fdrtool:一个多功能R包,用于估计基于局部和尾部区域的错误发现率。gydF4y2Ba生物信息学gydF4y2Ba24gydF4y2Ba, 1461-1462(2008)。gydF4y2Ba
于刚,王丽光,韩艳,何庆云。ClusterProfiler:一个R包,用于比较基因簇之间的生物学主题。gydF4y2Ba组学gydF4y2Ba16gydF4y2Ba, 284-287(2012)。gydF4y2Ba
贾萨尔,B.等。反应组途径知识库。gydF4y2Ba核酸测定。gydF4y2Ba48gydF4y2Ba, d498-d503(2020)。gydF4y2Ba
科尔森斯基等人。与Harmony快速、灵敏、准确地集成单细胞数据。gydF4y2BaNat方法。gydF4y2Ba16gydF4y2Ba, 1289-1296(2019)。gydF4y2Ba
Young, m.d. & Behjati, S. SoupX从基于液滴的单细胞RNA测序数据中去除环境RNA污染。gydF4y2BaGigasciencegydF4y2Ba9gydF4y2Ba, 1-10(2020)。gydF4y2Ba
Li, Z, Rotival, M, Patin, E, Michel, F. & Pellegrini, S.两种常见疾病相关TYK2变异影响外显子剪接和TYK2剂量。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba15gydF4y2Ba, e0225289(2020)。gydF4y2Ba
McQuin, C.等。CellProfiler 3.0:生物学的下一代图像处理。gydF4y2Ba公共科学图书馆杂志。gydF4y2Ba16gydF4y2Ba, 1-17(2018)。gydF4y2Ba
Schindelin, J.等。斐济:生物图像分析的开源平台。gydF4y2BaNat方法。gydF4y2Ba9gydF4y2Ba, 676-682(2009)。gydF4y2Ba
确认gydF4y2Ba
我们感谢Fatoumata Samassa博士在细胞毒性检测方面的帮助。我们感谢Jarkko Ustinov的胰岛素和c肽ELISA检测。感谢S. Eurola、H. Grym和A. Laitinen提供的专业技术支持。我们感谢FIMM单细胞分析单元(由HiLIFE和芬兰生物中心支持)的单细胞RNA测序服务。我们要感谢fingen研究的参与者和研究人员。T.O.感谢芬兰科学院(MetaStem卓越中心资助312437)、诺和诺德基金会和Sigrid Juselius基金会提供的资金。R.M.承认gydF4y2Ba国家研究机构gydF4y2Ba(ANR-19-CE15-0014-01)和gydF4y2Ba医学研究基金会gydF4y2Ba(EQU20193007831)。ch是由一个gydF4y2BaAnnee矫揉造作的gydF4y2Ba巴黎萨克雷大学奖学金。F.V.由IdEx Université de Paris的国际博士奖学金资助。R.B.P.感谢Hjelt基金会、Crafoord基金会(2020089)和瑞典研究委员会(2021-02623)的资助。D.L.E.感谢Welbio-FNRS(国家科学研究基金会;welbio - cr - 2019 c - 04),比利时;荷兰innovate2curetype1型糖尿病研究基金会(DDRF);青少年糖尿病基金会(JDRF;2 - sra - 2019 - 834 - s - b);NIH (HIRN-CBDS)批准U01 DK127786,美国。D.L.E、T.O和R.M.感谢欧盟Horizon 2020研究和创新计划资助协议No 115797 (INNODIA)和945268 (INNODIA HARVEST)下的创新药物倡议2联合项目的支持。 These Joint Undertakings receive support from the Union’s Horizon 2020 research and innovation programme and “EFPIA”, “JDRF” and “The Leona M. and Harry B. Helmsley Charitable Trust”.
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
V.C.构思并概念化了这项研究,进行了实验,分析了数据,并撰写了第一稿。H.I.负责实验、标准化鉴别、数据分析、参与稿件撰写。C.H.和F.V.进行了t细胞毒性试验并分析了数据。R.B.P、O.P.D和L.G.对胎儿胰腺和成人胰岛RNAseq数据集进行基因表达相关性分析,并对数据进行分析。c.h., f.v.和R.B.P.作为第二作者,j.k执行和分析了所有的大容量和单细胞RNAseq数据集。D.B.帮助了一代gydF4y2BaTYK2gydF4y2BaKO hiPSCs系。J.S.V.和H.M.进行了动物和分化实验并进行了分析。T.B.和V.L.参与了分化实验和分析。I.A.提供并分析了人类胎儿RNAseq的衍生数据。S.G.参与显微镜检查和手稿写作。R.M.概念化并监督了t细胞的细胞毒性实验,分析了数据,参与了手稿写作,并获得了资金。d.l.e构想并监督了这项研究,获得了资金,并参与了手稿的撰写。T.O.构思并监督了这项研究,提供了资源,获得了资金,并撰写了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
D.L.E.获得了来自礼来公司(Eli Lilly and Company, Indianapolis)的资助,用于研究保护T1D胰腺β细胞的新方法。其余作者声明没有竞争利益。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然通讯gydF4y2Ba感谢Matthias von Herrath, Saiyong Zhu和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
钱德拉,V,易卜拉欣,H,哈利兹,C。gydF4y2Baet al。gydF4y2Ba1型糖尿病基因gydF4y2BaTYK2gydF4y2Ba调节β细胞发育及其对干扰素-α的反应。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba, 6363(2022)。https://doi.org/10.1038/s41467-022-34069-zgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-34069-zgydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba