文摘
水生生态系统是全球重要来源的温室气体甲烷到大气中。直到最近,甲烷生产被认为是一个严格的厌氧过程主要局限于缺氧沉积物。然而,过度饱和的甲烷在含氧水域一直观察到湖泊和海洋(称为“甲烷悖论”),这表明甲烷可以通过不含氧的条件下产生机制。这里显示有氧来自多个来源的甲烷生产淡水孵化实验在不同治疗和生物地球化学的基础上,宏基因组,和metatranscriptomic数据。我们发现有氧甲烷生产似乎与(bacterio)叶绿素代谢和光合作用,以及Proteobacterial methylphosphonate退化。基因编码通路为假定的光合和methylphosphonate-based甲烷生产也共现Proteobacterial metagenome-assembled基因组。我们的研究结果提供了洞察有氧甲烷生产机制,并提出一个潜在的共病机制与水生生态系统中细菌光合作用有关。
介绍
大气温室气体甲烷的浓度(CH4由于人为活动)显著增加,代表了气候变化的一个重要组成部分1。然而,这些叠加在巨大的时空变异性增加CH的天然来源4到大气中。所有自然的CH4来源、淡水湖泊尤其重要,但知之甚少,他们估计的贡献从6到16%的自然CH4emissions-despite占地球表面积的~只有0.9%2。CH4排放的湖泊被传统认为是受CH4主要生产发生在缺氧沉积物,紧随其后的是随后的CH4氧化表面沉积物和水体3。然而,过度饱和的CH4一直观察到含氧水域水生系统4。这个观察可能表明CH4产生氧化的条件下,好氧的CH的速度4生产超过CH4氧化。古以来甲烷生成是一个专性厌氧过程5,CH的积累4含氧的条件下通常称为“甲烷悖论”,一直在观察到海洋6,7、湖泊8,9,10,有氧湿地土壤11。值得注意的是,有氧CH4生产发生在地表附近,所以任何CH4可以随时通量的气氛。识别机制产生CH4因此在含氧水域是必不可少的我们对CH的理解4通量及其对气候变化的贡献。
尽管多个矛盾的机制(即。有氧)CH4生产已经提出,这些活跃在淡水湖的程度仍是未知的。初步研究表明,CH4生产含氧的条件下可能发生在水中缺氧的微型网站出现在列如粪球,碎石,和更大的胃肠道生物如鱼类和浮游动物12,13,14。几项研究也证明了浮游植物的初级生产和CH之间的相关性4生产8,9,10。然而,这种关系的根本原因(s)尚不清楚。一种可能性是,产甲烷菌驻留在浮游植物细胞表面的和生产CH4在缺氧的微型网站8。伯加德et al。9和多尼et al。15还猜测,几组的产甲烷菌oxygen-tolerant或排毒途径可以帮助CH4生产氧气的存在。
相比之下,当前海洋生态系统的普遍观点是,methylphosphonate(或然数)的主要前体CH4生产在氧化conditions-particularly磷(P)强调生态系统如大海6,16。或然数是最简单形式的有机碳(C) - p键化合物在水生生态系统;微生物利用或然数的P c P键的分解,释放CH4作为一个副产品6,16,17,18。广泛的海洋和淡水细菌基因组可能代谢或然数和生产CH4基于多基因的存在c p基因组裂合酶途径。这包括多个组的变形菌门,厚壁菌门,拟杆菌门,Chloroflexi和蓝藻17,18,19。而表达的途径被认为是由P的可用性17,18,19,如何广泛发生在淡水生态系统并不是众所周知的20.,21,22。最近的工作23也表明,CH4可以通过甲胺生产耗氧(MeA)代谢在淡水,这CH4生产可以切换从与MeA或然数代谢与一周time-highlighting矛盾CH检查机制的重要性4生产。
最后,文化的海洋和淡水蓝藻可以直接产生CH424。然而,外面的一个实验25,这已经不是在水生生态系统检查。更重要的是,这发生的确切机制仍不清楚,尽管它发生在光照24。鉴于广泛分布在海洋和淡水蓝藻,识别潜在的机制(s)的蓝藻产生CH4——此功能是否可能存在其他光合生物的广泛的相关性。
这些提议CH的机制4生产——(i)甲烷生成的协助下解毒基因或缺氧的微型网站,(ii) CH4生产甲基化合物的分解,CH (iii)4CH Cyanobacteria-point生产的多种机制4在含氧条件下可以产生。矛盾的CH4生产还在数周内尤其是variable-ranging几个数量级26这可能反映了个体的相对活动CH4生产机制。然而,许多这些机制是最近发现的,因此了解甚少,所以他们出现在不同的水生生态系统的程度在很大程度上是未知的。
这里我们使用一个跨学科的方法来解开这些机制和确定哪些可能产生CH4在淡水湖泊。为了排除物理运输和专注于好氧的CH的潜在的生物机制4生产,我们进行孵化实验使用地表水从山湖位于海拔梯度在加州约塞米蒂国家公园(图S1、表S1)。我们调查的具体机制使用CH的组合4测量随着时间的推移,实验治疗和抑制剂,16 s rRNA基因和转录测序,同时应用稳定同位素分析和metagenome metatranscriptome排序选择实验。矛盾的CH4生产是在多个实验和实验治疗,明显是或然数通过煤炭价格的崩溃Comamonadaceae家庭。然而,实验治疗,稳定同位素δ13C CH的签名4和metatranscriptomic数据也指向一个新的矛盾CH的潜在机制4生产由光合细菌。
结果
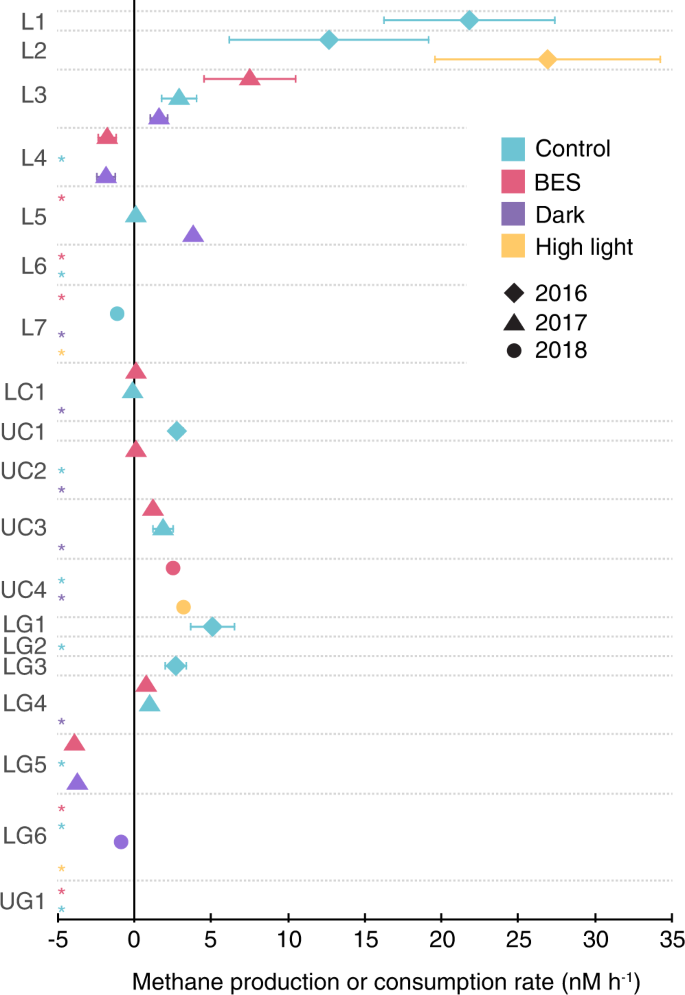
我们的实验提供多个证据自相矛盾的CH4生产淡水湖泊。19总实验在五湖,63%显示CH4也许生产控制和/或至少一个实验处理(见下文;根据CH4浓度测量在复制瓶孵化至少24小时;无花果。1)。我们观察到最高的CH4生产速度在luken湖(例如,L1和L2实验),以及一致的生产低Gaylor湖(LG1 LG3, LG4)和上大教堂湖(所有加州大学实验)。净CH4生产速度范围从0.086到26.9 nM h−1,大部分的< 4海里h值−1。这些利率符合有限的实验在其他淡水lakes-e.g之前进行。,0.1 - -10.8 nM h−1德国Stechlin湖8,10,26——高端,我们的价值观是类似于伯加德报道范围等。9Lac克伦威尔的实验操作(2.08 - -8.33海里h−1)。CH4流动率也范围从5到146天(原位浓度从309 - 2839 nM),符合流动率Stechlin湖(CH ~ 18天4浓度~ 430海里;ref。8)~ 2.2天Lac克伦威尔(CH4浓度~ 200海里;ref。9在黄石湖(CH)和67天4浓度为46.3 nM;ref。21)。
不同的颜色代表不同的治疗或控制孵化项目。不同的符号表示的实验。缩写左边表示湖(luken = L,降低大教堂= LC,上教堂= UC,降低Gaylor = LG,和上Gaylor = UG)和实验数量在每个湖(例如,UC4是第四次实验在湖上大教堂)。从斜坡上重要的利率计算(P时间和一式三份CH < 0.05)之间的相关性4浓度测量实验孵化项目在多个时间点进行。没有显示符号,星号表明没有发生重大的生产或消费。标准误差表示错误CH之间的斜率值显著相关性4和时间;在某些情况下,这些都是比点和不可见。BES表明2-bromoethanesulphonate甲烷生成抑制剂的加入。源数据作为源数据文件提供。
ca的实验。24小时长常常表现出矛盾的CH4生产(图。1、表S2)。(唯一的例外是LG2实验,由于复制之间的差异不显著)。我们后来增加了长度和数量的实验治疗的意图捕捉共病的CH之间的平衡的变化4生产和消费。例如,初始CH4生产可以氧化一旦CH紧随其后4浓度达到某一阈值所需的氧化8。相反,最初的减少由于氧化可能是紧随其后的是最终生产的例子通过P限制触发CH的发展4生产通过或然数新陈代谢6。我们测试了非线性模式使用分段回归,发现两个实验初始CH4生产紧随其后的是氧化(LG1和UC3控制),以及两个表现出氧化生产紧随其后(LC1 UC2;补充说明1)。也有可能生产和氧化与出口增速,导致没有净浓度的变化,尽管CH4是积极地骑车。16种和UG1实验的几个实验中没有检测到CH的变化4这可能反映了平衡生产和氧化(或缺乏CH4自行车完全)。在这种情况下,分子数据提供深入了解底层动力学是有用的。我们因此检查颗粒甲烷单氧酶基因的表达(pmoA),发现pmoA表达在大多数受访孵化项目(补充注1)。最后,我们发现,时间越长,96小时,2018年地级和LG6实验表明甲烷氧化。
观察CH的减少4浓度在某些实验中,以及使数据,表明积极的CH4氧化,可能掩盖矛盾的生产。换句话说,CH4显然是在63%的生产实验基于CH4单独测量,但也可能出现在实验显示无显著变化(甚至净消费)。因此,我们评估潜在的矛盾的CH4生产机制在实验中使用多个实验治疗(甲烷生成抑制剂,黑暗条件下,高光照强度)和分析。
甲烷生成
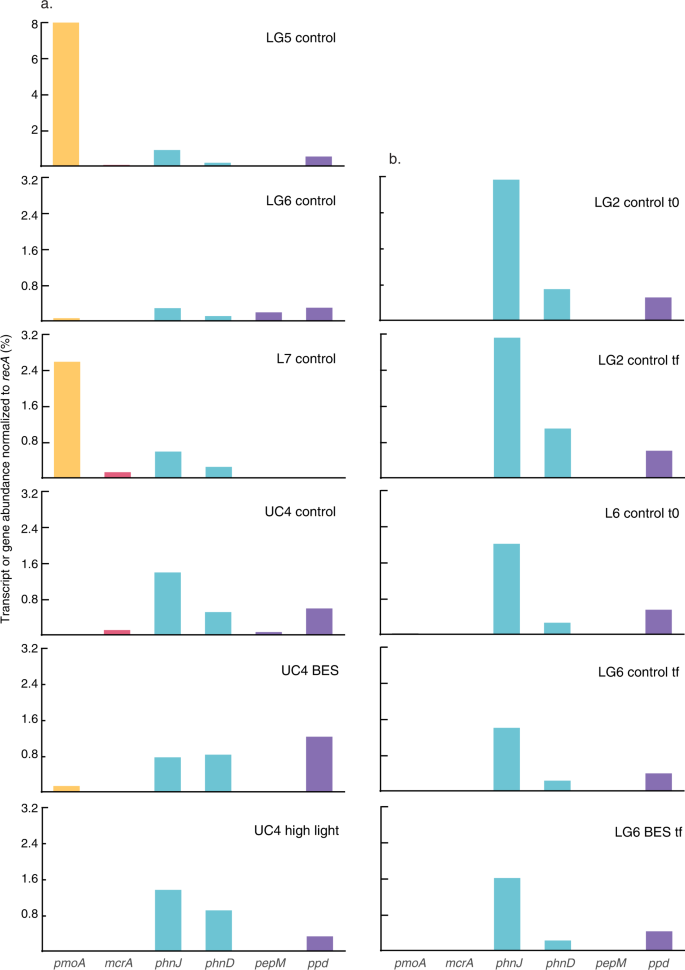
我们使用这些方法来测试浮游植物或particle-based甲烷生成,作为初始观测显示,产甲烷菌与浮游植物在淡水湖泊8,而其他的工作建议CH4生产可以在粒子发生在缺氧的微型网站12,13,14。从2017年至2018年期间,在所有的实验中,我们包含了治疗,包括附加的甲烷生成抑制剂BES (2-bromoethanesulphonate)。虽然有一些与它的使用说明27早些时候,BES广泛应用,包括测试的CH4悖论8,10。尽管已知的甲烷生成抑制剂,自相矛盾的CH4生产速度在四喜神贝斯治疗(L3、LG4 UC3 UC4)明显高于CH4生产控制(图。1和S2)。另外两个BES治疗显示CH4其次是重要的生产消费(LC1和UC2),而两个显示显著降低CH4随着时间的推移(L4和LG5)。剩下的五个BES治疗显示没有明显的趋势(图。S2)。同时,16 s rRNA的DNA测序实验L1-6 LG1-4恢复没有产烷生物16 s序列(540万总序列;表1)。测序16 s rRNA转录的RNA样本实验L5-6 LG5-6, UC3-4恢复产烷生物序列中只有两个样品(深色治疗L5和LG5)在非常低的水平(表1)。metatranscriptomes分析同样表明,甲基辅酶还原酶(mcrA;负责甲烷生成的最后一步)成绩单缺席LG6 UC4 (tf)孵化项目,和现在在LG5低水平,抑制和UC4 (t0)(无花果。2)。mcrA基因缺失以外所有基因组的16种(tf)孵化(无花果。2 b)。在早些时候的工作8,28、16 s rRNAmcrA是隶属于序列Methanosaeta和Methanospirillum属,表明潜在的hydrogenotrophic和acetoclastic(但不是methylotrophic)甲烷生成28。(孵化项目也监控确认他们是含氧的条件下在任何时候;表S1)。集体这些数据为水提供有限的证据基于列的甲烷生成CH的来源4LG5实验,BES减少CH4生产(图。1),产烷生物16 s rRNA(表1),mcrA基因(图。2)在低水平表达。然而,在其他的实验中,CH4是在产甲烷菌几乎完全没有和不活跃的基于16 s rRNA和mcrA基因和成绩单(表1;无花果。2)。
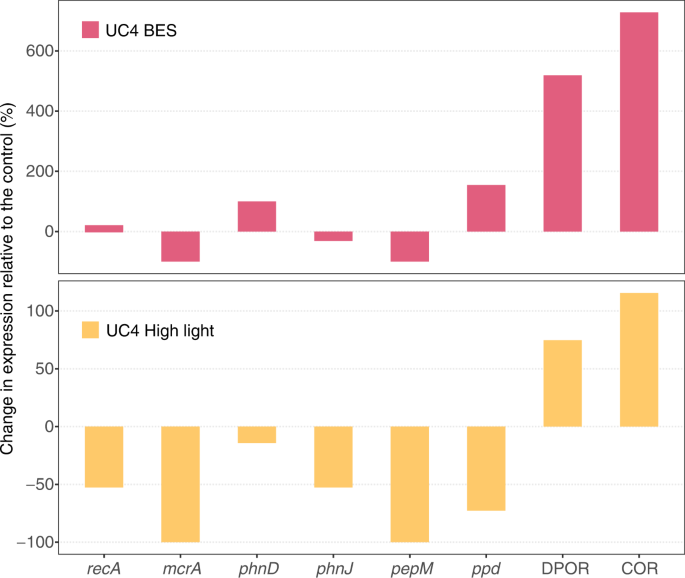
变化在实验和治疗(a)转录丰度(规范化%的DNA重组蛋白(recA)在metatranscriptomes成绩单)和(b)基因丰度(规范化的%recA关键功能基因的基因在基因组中)。功能基因量化包括那些参与:甲烷氧化(微粒甲烷单氧酶;pmoA),甲烷生成(甲基辅酶还原酶;mcrA)、膦酸酯同化(c p裂合酶和phosphonate-binding蛋白质;phnJ和phnD)和膦酸酯合成(磷酸烯醇丙酮酸变位酶和phosphonopyruvate脱羧酶;pepM和产后抑郁症)。缩写表示实验(如UC4)治疗(控制,增加甲烷生成抑制剂2-bromoethanesulphonate (BES),或高光照强度),和采样时间点(t0表明最初的采样时间点和tf表示端点样本)。注意区别在纵轴LG5实验相比,其他实验。源数据作为源数据文件提供。
有氧methylphosphonate和甲胺代谢的甲烷来源
相反,metatranscriptomes分析和基因组显示潜在的多个额外的CH4生产机制。特别是,我们发现的证据或然数基于微生物代谢的普遍表达式alpha-D-ribose 1-methylphosphonate 5-phosphate c p裂合酶(phnJ)在metatranscriptomes成绩单(无花果。2)。phnJ负责c p键,结果在CH的乳沟吗4生产从或然数;这种机制被认为是主要矛盾的CH4在海洋的生产机制16,但已经被记载在只有数量有限的淡水湖泊20.,21,22。随着phnJ,phosphonate-binding周质蛋白(phnD)基因(参与膦酸酯吸收的绑定组件18)也表示在所有metatranscriptomes(无花果。2)。phnJ和phnD基因也在所有基因组(图中恢复过来。2 b)。最后,我们研究了基因是否生产或然数也呈现和表达。成绩单的磷酸烯醇丙酮酸变位酶(pepM)和phosphonopyruvate脱羧酶(产后抑郁症膦酸酯生物合成)网络版29日都是出现在一些metatranscriptomes(无花果。2),这表明为原料可以合成原位。
总的来说,超过40个不同细菌属表达或拥有phnJ的基因,这表明P同化或然数是地表水微生物中广泛分布。然而,phnJ成绩单和基因生物在betaproteobacterial中最为常见Comamonadaceae家庭,与多个Comamonadaceae属占20.9%phnJ在metatranscriptomes和27.4%的记录phnJ基因在基因组(表S3)。phnJ成绩单和基因Sphingobacteriales丰富的在几个样品(LG5和LG6 metatranscriptomes, 16种基因组),Comamonadaceae phnJ成绩单和基因最丰富的在其他样本。Comamonadaceae phnJ成绩单和数据库显示,尤其是高身份的基因序列,序列的多数显示> 92%和100%氨基酸身份Acidovorax, Hydrogenophaga,Limnohabitans, Polaromonas,Rhodoferax,Variovorax phnJ数据库序列(表S3)。
与矛盾的CH4从或然数生产,最近的工作在黄石湖也牵涉其中Acidovorax在CH4通过吡哆醛生产从MeA 5′phosphate-dependent天冬氨酸转氨酶(aat;ref。23)。包括额外的隔离能力假单胞菌、茎菌属、Mesorhizobium,Dietzia仕达屋优先计划23,但这个矛盾的CH4生产机制只有在单一位置检查。我们发现aat从四个五组序列(假单胞菌,Acidovorax茎菌属,Mesorhizobium)出现在metatranscriptomes和基因组约塞米蒂(表S4)。虽然一些aat序列是隶属于Acidovorax,茎菌属aat序列(表中较为常见S4)。我们也对aat序列从黄石公园Acidovorax隔离与我们metatranscriptomes和基因组;王与et al。23,我们发现相似aat在约塞米蒂隶属于序列Polaromonas和Limnohabitans。总的来说,aat从这些群体中基因和转录相似的比例phnJ。
16 s rRNA基因和转录数据与功能基因来自metatranscriptomes和基因组的数据保持一致。Comamonadaceae(其中包括Acidovorax, Polaromonas,Limnohabitans)是普遍存在和丰富的实验茎菌属都出现在较低的比例。在16 s rRNA基因序列库从L1-6 LG1-4, UC1实验,Comamonadaceae所有序列的范围从2.04%到11.6%(表1),在几个孵化项目重大CH丰富4生产(L1, L2, UC1)。测序16 s rRNA转录的RNA样本实验L5-6 LG5-6, UC3-4显示出类似的值(表1),Comamonadaceae达到15%的16 s rRNA成绩单和UC3 UC4实验(CH4明显在几个治疗)。类似于phnJ结果,16 s rRNA序列的主导Comamonadaceaeasv显示高(98.8 -100%)16 s rRNA基因的核苷酸序列的身份在基因组测序(表S5)。在比较Comamonadaceae,茎菌属范围从0%到3.18%的16 s rRNA基因和转录,少通常是丰富的16 s rRNA基因库(除了LG3样本;表1)。茎菌属达到> 2%的16 s rRNA LG5成绩单在一些治疗,LG6,和UC3实验,后者显示明显的自相矛盾的CH4生产。
最后,我们组装和注释metatranscriptomes和基因组研究是否特定团体拥有和表达多个phn和并行相关基因的基因参与收购膦酸酯和利用经常聚集在基因组18。我们发现phnJ基因通常与其他集群phn基因在同一叠连群,尤其是那些从Comamonadaceae(表S6)。例如,叠连群> 50 kb包含phnC,phnD,phnE,phnI,phnJ,phnK,phnL,phnM在场的基因组LG2, 16种孵化项目,是隶属于丰富的淡水细菌群Limnohabitans30.,31日,32,以及其他的成员Comamonadaceae,如Hydrogenophaga和Acidovorax。几个再叠连群也包含了太平洋标准时间或越南河粉P吸收和代谢基因(表S6)。
内华达山脉的海拔湖泊通常缺乏营养33,34,35,溶解无机磷(DIP)附近的湖泊采样是一贯浓度检测的局限性(100海里)通过比色技术,与绝大多数测量< 200海里(参考文献。36,37、表S1)。然而,内华达山脉湖泊还可以展示N-limitation33浓度、溶解无机氮(DIN)在这里的湖泊采样通常< 2μM(表S1)。在这些低溶解无机养分浓度作为P和或然数和MeA N-organic化合物可以作为基本营养素的重要来源。与此一致的是,的存在和表达phnJ基因表明几个微生物能够释放CH组4通过c p的乳沟债券或然数(无花果。2)。特别是,我们的数据表明,多个属内的丰富和煤炭价格Comamonadaceae30.,31日,32利用或然数,考虑到高phnJ和16 s身份在其他地方(表收集的序列S3和S5),以及叠连群包含的复苏phn和其他基因P收购和新陈代谢(表S6)。
光合细菌对甲烷生产的证据
蓝藻光合作用最近被确定为一个可能的额外的矛盾来源CH4生产蓝藻的途径最终产生CH4是未知的24。基于16 s rRNA基因和转录,基因组和metatranscriptomes,蓝藻在我们的样品(表是很常见的1)。我们使用了两个额外的治疗分区CH的相对影响4生产与氧化和评估CH的蓝藻作为一个潜在来源4。首先,我们在一些实验,包括黑暗治疗(i)光抑制CH4氧化38,39,40,(2)CH4蓝藻生产文化呈正相关,光24。因此,黑暗的治疗将有更高的CH4氧化率,降低蓝藻CH4生产,因此降低CH4浓度与控制。此外,我们光强度增加四个实验,这可能有双重影响:(i)更大的抑制CH4氧化,(2)增加了CH4生产从蓝藻或其他浮游植物8,9,24。出于这两个原因,我们将观察到更高的CH4生产速度下更高的光。
黑暗的瓶装水混合的结果,CH 4例4消费,生产在两种情况下,四个实验(图中无显著差异。1和S2)。在四个实验的两个光强度高的治疗,我们观察了CH4生产(L2和UC4;这两个p< 0.05)。UC4实验特别照明,因为更高的光强度大大提高了CH4生产速度62倍与控制(3.2海里h−1;P< 0.0005)。这是最强的治疗效果观察中所有实验(图。S2)。喜神贝斯也增加了CH4产量UC4 49-fold而控制的实验(2.5海里h−1;P < 0.0005,无花果。S2)。这个违反直觉的影响增加CH4production-despite添加一个已知的甲烷生成inhibitor-suggests CH的另一个来源4。
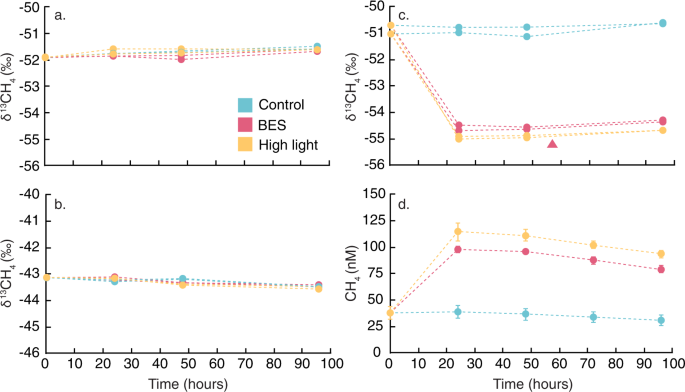
在更详细地检查这些反应,我们分析了δ13C CH的稳定同位素组成4UC4实验中产生的,以及基因表达的变化在metatranscriptomes响应实验治疗。我们直接将这些结果与前面UC3实验还显示CH4生产BES治疗(没有高光治疗)——LG6和抑制实验(没有显示CH4生产BES或高光治疗。符合缺乏显著的CH4生产LG6和抑制实验,δ13CH4从多个采样时间点没有显著差异治疗LG6和抑制实验(无花果。3 a, b)。
UC4实验数据给出了一个清晰的对比,为δ13CH4值显著降低了BES和高亮度治疗与控制(图。3 c)。δ13CH4UC3 BES治疗中的值显示相似的价值观,也不同于控制(图。3 c)。随着增加CH4浓度(无花果。3 d),这些数据表明一个isotopically耗尽CH4喜神贝斯和高的光源疗法,必须<−55‰基于同位素质量平衡。这个值取决于CH的速度4是氧化,徒isotopically丰富其余CH4池15。因此,更高的CH4氧化率意味着一个更13c缺失的CH来源4。然而,CH4氧化可能是最小的鉴于δ13CH4和CH4浓度控制孵化项目,基本没有变化,以及高光照强度可以抑制CH的事实4氧化38,39,40。
Isotopically耗尽δ13CH4值<−55‰与CH4生产大大低于大气CH4同时收集样本(−45.2−47.4‰),和反映的同位素分馏过程产生CH4(ref。41)。甲烷生成并导致强烈的分离,但是我们的测量值δ的上端13CH4甲烷生成的值(110−−50‰),只有acetoclastic产甲烷相一致41。然而,mcrA(图中无法表达。2)这些,治疗包括喜神贝斯,一个已知的甲烷生成inhibitor-suggesting另一个来源。为了使或然数代谢生成δ13CH4ca的价值观。−55‰,或然数需要类似的同位素组成,为CH平均同位素分馏4来自或然数仅为1.3‰(ref。42)。或然数可以移置(陆地)或原地(基于pepM结果;无花果。2),但在这两种情况下,似乎不太可能是足够的13c缺失。C原子或然数来自磷酸烯醇丙酮酸的分子内重排(PEP;参考文献。17,18)、PEP经历连续的细胞再生;在生物生产或然数、PEP需要13C缺失至少20 - 30‰与总体相比细胞C以收益率δ13C值的ca。−55‰或然数。相反,δ13CH4数据显示另一个矛盾的CH4生产机制,类似的δ13CH4值解释为CH的证据4生产光合生物43。
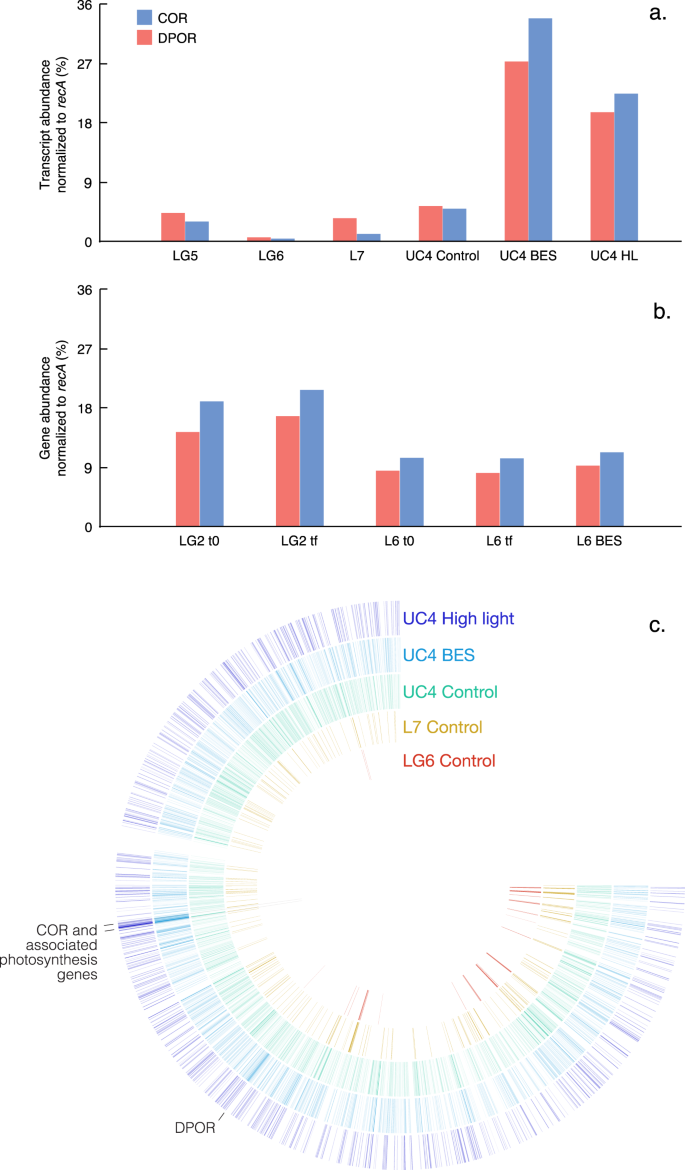
尽管蓝藻产生的途径CH4依然不明,Bižićet al。24假设CH4在光合作用中产生由于光线和CH之间正相关4。我们用metatranscriptomic数据识别特定功能明显不同的治疗与控制,这也许可以解释CH的差异4浓度和同位素组成。通过比较所有功能的家庭在metatranscriptomes UC4实验44,我们发现两个函数之间的强烈和明显不同的控制和喜神贝斯(P< 0.0005)和高光照强度(P< 0.005)治疗(图。4;补充说明2)。有趣的是,两人都是叶绿素生物合成有关;铁氧还蛋白:原叶绿素酸脂还原酶(DPOR)和脱植基叶绿素还原酶(软木)参与卟啉和叶绿素代谢。DPOR在光合细菌、蓝藻和绿藻和参与不依赖光减少原叶绿素酸脂45,46。软木催化氯转换的第一步在细菌叶绿素生物合成细菌叶绿素戒指47,48,49。值得注意的是,DPOR和心脏都nitrogenase-like酶,在所有metatranscriptomes丰富和基因组(无花果。5)。蓝藻DPOR被发现在几个集团Pseudanabaena,Dolichospermum,Snowella和颤藻-metatranscriptome数据(表S3)。然而,DPOR和软木中最常见Limnohabitans和Polynucleobacter属(36.3 -54.5%的DPOR和软木成绩单;表S3),这些丰富的淡水细菌菌株的有氧存在光合作用的能力32,50。
原叶绿素酸脂还原酶(DPOR)和脱植基叶绿素还原酶(软木)读入一个metatranscriptomes (b)基因组,c映射到Limnohabitansmetagenome-assembled基因组(MAG) 5。在一个,bDPOR(红色)和软木(蓝色)成绩单(一个)和基因(b)显示在不同的实验和实验治疗。缩写表示实验(如UC4),采样时间点和治疗(控制,增加甲烷生成抑制剂2-bromoethanesulphonate (BES),或高光照强度)。在c,Limnohabitans杂志5所示循环形式,读取映射杂志内基因的数量由颜色强度表示。不同的实验和治疗不同的颜色所示,LG6实验用红色,地级的橙色,aqua UC4控制,UC4 BES治疗浅蓝色,UC4高在深蓝色的光治疗。DPOR和心脏的位置(和光合作用相关基因)杂志表示。源数据作为源数据文件提供。
为了进一步验证这些发现,我们从UC4映射读取实验,以及LG6和抑制实验(没有显示CH4生产),metagenome-assembled基因组(杂志)。27个杂志是由两个约塞米蒂样品作为全球范围内分析的一部分51这些杂志,五是betaproteobacterial。这包括一个Rubrivivax杂志,一Polynucleobacter杂志,三Limnohabitans杂志。所有这五个betaproteobacterial杂志包含光合作用的基因,包括软木(表S7)。三种杂志包含心脏和DPOR以及多种基因参与了膦酸酯代谢。剩下的两个杂志,一个缺乏DPOR而另一个没有phn基因(表S7),但这些杂志估计为55 - 58%完成。有趣的是,约塞米蒂Limnohabitans杂志5共享95%的平均核苷酸身份(ANI)几个杂志加拿大湖泊中矛盾的CH组装4生产以前观察到的9,43。
基于阅读映射到这些杂志,我们检查模式记录显示差异的BES和高亮度治疗UC4实验与控制。我们还研究了差异UC4实验与LG6和抑制实验。我们发现多个光合作用基因相似度高Limnohabitans杂志5 UC4中高度表达,而没有发现LG6和抑制实验(图。5度)。此外,> 12000个基因出现在五杂志,几个显示最高的整体映射读取次数UC4 BES和高光治疗。其中主要是心脏的两个子单元,以及相关光合反应中心基因位于同一镁支架(图。5度)。与高相似记录Limnohabitans杂志5 DPOR基因也高度表达。相比之下,膦酸酯代谢基因表达在较低水平,在所有metatranscriptomes相似的水平。
DPOR软木是表达和出现在所有metatranscriptomes基因组——然而DPOR的整体表现和软木高出一个数量级的UC4实验相比LG6和抑制实验(无花果。5)。DPOR和心脏的表达的差异Limnohabitans杂志5甚至更明显。这些模式是一致的CH的生产4变化δ13CH4UC4实验中观察到的治疗,并没有观察到LG6和抑制实验(图。3)。基于喜神贝斯的积极作用和CH的光强度高4生产UC4实验中观察到,这种机制也可能是活跃在L2, L3, LG4,和UC3实验,BES或高光照强度也显著增加CH4生产(图。S2)。减少CH4在黑暗的治疗在一些实验中也反映了降低光合作用(与增加CH4氧化;无花果。S2)。实验数据进一步表明,该机制是环境变量,给出明确的实验之间的差异(无花果。3和5)。然而,这些变化与光合作用的事实相一致Limnohabitans是可变的,光合作用是用于补充营养异常50。
基于这些发现,我们提出两个潜在机制可能参与矛盾的CH4生产氧化的淡水湖泊的表层水:(i) CH4可能产生的甲氧基组出现在(bacterio)叶绿素前兆,或(ii) CH4生产可能会被DPOR和心脏酶催化。在陆生植物,CH4被认为是产生耗氧从结构组件(果胶、木质素和纤维素52,53,54——特别是在压力下的植物(如增加温度、紫外线辐射或物理伤害55)。原叶绿素酸脂、脱植基叶绿素和其他(bacterio)叶绿素前体含有甲氧基组,已经被证明可以作为CH的前身4在植物中56,一个类似的机制可能是活跃在蓝细菌和/或压力下的变形菌门(可能是由于BES增加和高光照强度在我们的实验)。另外,CH4生产可能会被DPOR和心脏酶催化。固氮酶减少一系列multi-bond化合物57,58,59,60,61年在不同的固氮酶,这质量是共享的62年。类似的发现郑et al。60nitrogenase-like酶DPOR和软木可以促进减少二氧化碳(有限公司2)CH4。重要的是,DPOR和心脏中心(bacterio)叶绿素代谢和光合作用,所以DPOR存在于蓝藻,发现在丰富和无处不在的淡水细菌组Limnohabitans和Polynucleobacter30.,31日,32,50。
讨论
我们的结果表明,结合小说矛盾CH4生产机制与光合作用与其他机制共存水生生态系统,对我们理解和几个影响水生CH4生产。首先,确认的CH4悖论在淡水中仍在最近的范围和相对有限8,9,15,24,25,但淡水湖泊是CH的大来源4到大气中2。我们进行了多个湖泊中的多个实验,测量重大CH4生产控制和/或治疗63%的实验(图。1)。在许多的实验,CH的变化4浓度随着时间的推移,在实验治疗,pmoA基因表达模式表明,CH4氧化反应发生在与CH4生产(图。2,如果文本)。CH的变化4相对于生产氧化可能是一个源在实验中我们观察到的变化。CH4氧化还复杂矛盾的CH的分析4生产,因为它可能掩盖CH4生产。因此,使用不同的实验治疗结合的数据,使或其他方法,需要识别和检查矛盾CH4在更详细的生产。
考虑到无处不在的phnJ基因和记录在我们的数据(无花果。2),他们在重叠群的存在丰富的生物(表S6),他们收集到其他地方(表相似序列S3和S5),以及潜在的P限制在淡水生态系统中,微生物代谢或然数可能代表一个重要的基准CH4生产机制在淡水湖泊。这符合当前对海洋生态系统的理解6,16。我们的数据进一步证明或然数本身可能是在湖泊的基础上产后抑郁症和pepM表达式(无花果。2)。量化的相对贡献移置与原地或然数生产以及更广泛的理解CH P收购力学是必要的4生产在淡水中。在这里的湖泊研究,或然数可能更广泛使用,溶解有机碳(DOC) luken湖(表中浓度较高S1)。然而,进一步的有机质特征16需要确定相对或然数浓度在淡水通过空间和时间。膦酸酯化合物曾经被认为是耐击穿,及其形成仍然了解甚少;17,63年变化在他们的生产和可用性相比,其他形式的P和N可能驱动CH的变化4在我们的数据生产诸如明显。
无机磷,特别是氮(N)可能会通过大气沉积和融雪(特别是在高海拔地区)33,64年例如,影响整体下降和DIN可用性和N和P的程度限制33。我们metatranscriptomic数据表明或然数和MeA代谢可能发生在高海拔低营养条件下普遍湖泊。这是符合这一事实或然数和MeA都用于黄石湖23,并提供了证据表明,代谢和相关矛盾的CH4生产发生在额外的淡水水体。然而,茎菌属aat序列在Yosemite-suggesting更普遍,不同细菌群体可能意味着相关代谢在不同地区或不同环境条件下。最后,我们的数据与王等。23提高的可能性Polaromonas和Limnohabitans代谢是。
光合作用是一个额外的、新发现和潜在的广泛的CH4源,通过一个未知的途径24。因此,我们使用方法的组合来确定光合CH4生产发生在淡水,意味着什么。虽然独立的数据类型(CH4浓度、治疗效果、同位素数据,使数据)可能以多种方式解释,与光合CH合并后的数据是一致的4生产(无花果。3和4)。例如,光强度高,BES治疗提高了CH4浓度(无花果。S2),但这CH4不太可能从甲烷生成给定的结果吗mcrA表达式(无花果。4)和一个已知的甲烷生成抑制剂的使用。相反,DPOR和软木成绩单在场和响应治疗通过宏基因组和metatranscriptomic数据如图所示。δ13CH4数据进一步表明CH4源,落在最可能的值(acetoclastic)甲烷生成41,或者需要大幅13c缺失的PEP /或然数17,18,42,但最符合光合CH的解释4生产43。从UC4实验中,光合CH4生产可能发生在至少四个实验,喜神贝斯和高光照强度也显著增加CH4(L2, L3, LG4 UC3;无花果。S2)。虽然喜神贝斯和高产生的光强度在CH惊人的相似4生产、δ13CH4值,以及基因表达(无花果。3- - - - - -5),有几种可能的解释为什么可能会诱发响应谱仪(补充注3)。最后,无处不在的DPOR和心脏基因和记录表明,潜在的光合CH4生产普遍存在(图。5;表S3和S7),但明显的变化在实验符合已知的可变性在有氧存在光合作用Limnohabitans50,65年。特别是,有氧存在光合活动依赖于浓度和形式的有机物质,光水平,特殊细菌的传播集团,以及这些因素之间的相互作用66年,67年,68年,69年——可以解释观察到的一些变化在我们的实验。高亮度治疗特别是表明光合CH4生产是可变的,光水平升高在一些实验和强大的效果没有影响别人。最终,周期性脉冲光合CH4生产可能叠加上一致的生产从或然数或意味着(nutrient-limiting条件下),基于列的甲烷生成水的罕见的贡献。CH4浓度和通量可能随后受到CH4氧化,导致额外的变化和在其他研究。额外的湖泊研究应该检查这是否CH的总体模式4源和汇拥有其他地方。
光合CH4生产最明显的体现在实验治疗,强调不同治疗方法的疗效包括检查矛盾CH4生产。我们从这些疗法利用数据来识别潜在的CH4生产mechanisms-providing实验方法、同位素签名数据和两个潜在基因目标检查其他水生生态系统。我们发现这种机制并不局限于蓝藻,大多数DPOR和软木成绩单和基因来自betaproteobacteria。这有几个潜在的影响。首先,Limnohabitans和Polynucleobacter淡水生态系统中无处不在的30.,31日。这两个组织的杂志包含DPOR和心脏基因,以及膦酸酯代谢基因。Limnohabitans也表达了phnJ基因,这表明它们可以在矛盾的CH扮演双重角色4生产。这些发现表明,两种可能的CH4生产机制(光合和phosphonate-based)同时出现在多个血统的丰富和广泛的细菌存在于淡水。额外的工作隔离和环境样品应该确定这些机制是活动的程度,以及不同的环境因素(如光,不同的溶解的化合物,和其他相关因素)影响CH4生产。第二,我们的数据表明额外的矛盾的CH4生产mechanism-CH4生产由有氧存在光合细菌(AAnP)也可能是相关的海洋中。AAnP细菌占10%的海洋细菌社区和海洋碳循环中扮演重要角色65年。鉴于其重要性,潜在的CH4生产船用AAnP值得检验。最后,多个其他nitrogenase-like酶产生CH4(参考文献。60,62年),我们的研究结果表明nitrogenase-like酶DPOR和软木。无论这些支撑CH4生产其他光合生物还有待确定。我们的数据表明,这种机制相结合可能产生CH4矛盾的是,存在与其他机制(甚至在同一个有机体),并可能在水生ecosystems-representing煤炭价格另一个潜在的CH的重要来源4到大气中。
方法
场网站,样本收集和试验装置
水样收集2016 - 2018年在5个海拔的湖泊在约塞米蒂国家公园,和用于孵化实验。样本中收集luken (L),降低大教堂(LC),上教堂(加州大学),降低Gaylor (LG),和上Gaylor (UG)湖泊。实验是用湖缩写为每个湖(表和顺序编号S2)。水样收集在沿海和湖沼地区湖泊在0.1米深度的酸洗方容器,然后继续维持湖冰或制冷温度直到实验室孵化项目建立了24小时内样本集合。温度和溶解氧测量样本集合的时候使用ProODO YSI探针(YSI Inc .,黄色的弹簧,哦,美国)。
水收集在湖泊被转移到170或300毫升惠顿瓶,限制和卷曲,已知体积的空气被介绍给生成一个顶部空间抽样。最初的CH4样本收集,和瓶子是孵化温度的水浴锅水样本收集。所有控件和实验治疗进行了一式三份,三瓶采样牺牲地在每个实验中测量的计算。实验中使用的不同的治疗方法是:
控制:也许湖水自然昼夜后设置(水浴盖子打开7点h和关闭在18:00 h)。
黑:也许湖水;瓶子被蒙在鼓里在整个孵化时间。
喜神贝斯:湖水与2-bromoethanesulphonate修改(BES)最后5×10的浓度−4建立了m .这个浓度抑制甲烷生成27并已用于甲烷悖论实验8。这种治疗都遵循着相同的自然日光设置控件。
高亮度:500年也许湖水受到µmol m−2年代−1在生长室,都遵循着相同的自然日光设置控制(光将在18:00关闭在晚上7 h和h)。
无菌治疗:0.22μm-filtered湖水CH不显著4生产或氧化随着时间的推移,表明观察CH4生产和消费可能是生物。
这些,三瓶取样牺牲地每6日到24日h 96 h通过收集气体样品用注射器从顶部空间,和直接转移到Exetainers (Labco有限公司兰彼得、Ceredigion、英国)供以后分析。并不是所有的治疗进行了测试在每个孵化实验。温度和氧气浓度在每个采样点监控。光学传感器位置(Fibox、枪乌贼系统、Viborg、丹麦)被用来测量氧气浓度在孵化项目(100海里)的检测极限,确保水不会缺氧。所有测量值超过5.2毫克−1(表S1)。Fibox温度传感器的温度测量和在孵化期间保持不变。开始和结束的水样本过滤DNA或RNA抽样的孵化。
甲烷测量
甲烷浓度测量通过顶空平衡,气相色谱法。孵化项目的顶空气样本收集与气密注射器到12毫升Labco Exetainer瓶(Labco有限公司兰彼得、Ceredigion、英国)孵化瓶都摇动了2分钟后达到平衡。样本随后分析了用日本岛津公司gc - 2014气相色谱仪(日本岛津公司,日本京都)和火焰离子化检测(FID) CH4(ref。70年)。顶部空间CH4浓度测量被用来计算CH4浓度在湖水亨利定律的基础上平衡71年。
DNA和RNA提取
水样过滤0.22μm过滤器(微孔,达姆施塔特,德国)和DNA筛选样本保存在Sucrose-Tris-EDTA (STE)缓冲区在幼儿学前裂解矩阵E管(MP生物,Eschwege、德国)和冻结在−直到提取80°C。RNA样本保存在RNA晚些时候®(Ambion™, AM7021)幼儿学前赖氨酸矩阵E管和冻结在−直到提取80°C。DNA提取使用试剂盒DNeasy血液和组织装备与修改的协议从碧曼等。72年。简单地说,与100年样本细胞溶解µL 10%十二烷基硫酸钠(SDS)和DNA分离蛋白质和细胞碎片使用蛋白酶K(20毫克毫升−1;美国试剂盒,Inc .,瓦伦西亚,CA);然后DNA与乙醇沉淀和净化后,制造商的指示。提取后,样品被保存在−80°C,直到进一步的分析。RNA提取使用米尔AM1560 Vana microrna的隔离设备(Ambion™),修改后的协议从Huber和走73年。短暂,样本细胞溶解工具包的赖氨酸矩阵,然后用phenol-chloroform受到有机萃取,后跟一个洗获得RNA。后立即RNA提取,我们使用上标三世第一链合成系统(美国生命技术公司,卡尔斯巴德,CA)合成第一链cDNA、和样本保存−80°C,直到进一步的分析。从DNA、RNA、cDNA纯度测定使用生物光谱计(股份公司、德国汉堡)和量化使用浓度PicoGreen Quant-iT dsDNA定量分析(美国ThermoFisher科学)DNA样本和MaestroNano Pro (Maestrogen Inc .、台湾)RNA和互补DNA样本。
16 s测序
DNA和过滤水的互补脱氧核糖核酸提取样本稀释至浓度(1 ngμl−1)和发送16 s rRNA扩增子测序的Illumina公司MiSeq(美国Illumina公司,圣地亚哥,CA)根据地球微生物协议。我们使用通用引物515 f-y (5 ' r -GTGYCAGCMGCCGCGGTAA)和926 (5 ' -CCGYCAATTYMTTTRAGTTT)。DNA样本测序联合基因组研究所(美国伯克利,CA)和互补脱氧核糖核酸样品在阿贡国家实验室(美国IL Lemont)。
asv生成从16 s rDNA使用分裂和核糖体rna序列数据
扩增子去噪算法(DADA2) v1.12 (ref。74年)作为实现QIIME 2 v2019.7.0 (ref。75年),然后用于后续分析。导入和多路分解后,阅读质量可视化使用“qiime工具视图”命令。读取被加工使用的qiime dada2 denoise-paired”命令,有13 bp削减从正向和反向读取,截断的反向读取169个基点(由于众所周知的下降序列质量观察MiSeq反向读取),和培训的去噪算法在100万年写道。分类进行了asv的mothur v1.42.2 (ref。76年使用席尔瓦(128年版)数据库)。
Metatranscriptomics和宏基因组
Metatranscriptomes和基因组产生个人的治疗选择实验为了检查潜在的生产机制和耦合甲烷氧化。提取后,DNA和RNA样本被送往文森特·j·科茨测序的基因组测序实验室(GSL)加州大学伯克利分校(https://genomics.qb3.berkeley.edu/),这是由国家卫生研究院S10 OD018174仪表格兰特。对于每个DNA样本,250 ng的基因组DNA是剪切和图书馆准备使用KAPA HyperPrep工具包(KAPA生物系统,威尔明顿,美国)。对于每个RNA样本,~ 800 ng的总RNA耗尽rRNA使用Ribo-Zero rRNA去除工具包(Illumina公司,Inc .,圣地亚哥,美国),剪切,图书馆是准备使用KAPA RNA HyperPrep工具包(KAPA生物系统公司,马威尔明顿,美国)。12个样本汇集成一个车道,通过150 -循环测序paired-end测序4000年Illumina公司HiSeq平台(Illumina公司,Inc .)、圣地亚哥、钙、美国)。
GSL和读取都去复用的数据过滤和减少使用BBDuk v38.23 (https://jgi.doe.gov/data-and-tools/software-tools/bbtools/bb-tools-user-guide/bbduk-guide/)使用以下参数:maq = 8, maxns = 1, minlen = 40, minlenfraction = 0.6, k = 23日hdist = 1, trimq = 12, qtrim rl =。正向和反向读取然后合并使用PANDASeq v2.11 (https://github.com/neufeld/pandaseq;ref。77年)使用默认参数。合并读取随后针对NCBI NR数据库查询(2月11日访问th,2020年,包括主题分类id)使用钻石v0.9.30 BLASTX函数(http://diamondsearch.org/;ref。78年)以下搜索条件:目标序列的最大数量= 1,bit-score > 40岁。为了量化功能基因的丰度,我们过滤BLASTX匹配功能基因感兴趣的基础上为每个metagenome或metatrascriptome DIAMOND-generated文本注释,丢弃那些相似度低于60%。我们归一化大量的DNA重组蛋白(recA在每个metagenome或metatranscriptome)基因/成绩单。宏基因组重叠群装配通过热卖v1.1.3 (ref。79年23)使用一个初始k-mer大小,带注释的如上所述,但“长读”选项在钻石。
额外的分析,UC4 metatranscriptomes被上传到联合基因组研究所(变得更;https://img.jgi.doe.gov/)综合微生物与微生物基因组平台(IMG / M)。我们使用IMG / M的比较分析工具比较metatranscriptomes UC4之间的功能实验44。丰富配置文件查看器的工具是用来提供的相对丰度功能的概述整个家庭UC4 metatranscriptomes控制与治疗,和比较丰富的工具是用来测试是否充足的特定功能的差异(在UC4控制与治疗metatranscriptomes)是重要的。我们也使用的系统发育分布工具量化潜在重要性的大量不同的系统组在甲烷悖论。
Metatranscriptome读取也映射到杂志使用bowtie2 v2.3.4.3 (ref。80年传闻(ref)并使用Anvi可视化。81年)。覆盖文件中生成samtools v1.11 (http://www.htslib.org/),随后在r .杂志进行统计比较被Nayfach组装在全球分析等。51。总之,组装基因组在IMG / M他们使用MetaBAT杂志82年tetranucleotide频率的基础上使用v0.32.4和0.32.5选项”——superspecific。杂志是精制使用RefineM v0.0.20 (ref。83年GC)去除重叠群异常的深度阅读,内容,和/或tetranucleotide频率,并通过消除叠连群冲突phylum-level分类法(基于蛋白质水平对使用去年v876 IMG / M数据库比对;ref。84年)。最后,CheckM v1.0.11 (ref。85年)是用于选择杂志至少50%完成,污染不到5%,质量分数> 50。
稳定同位素测量
顶部空间孵化瓶被转移到疏散exetainers和发送到加州大学戴维斯分校稳定同位素设施(戴维斯,CA)进行分析。测量稳定碳同位素比值(δ13C)在CH4进行了使用ThermoScientific Precon浓度单位界面的ThermoScientificδV +同位素比率质谱计(ThermoScientific、不来梅、德国)。总之,气体样品通过H2O /公司2洗涤器和一个冷阱和CH4然后分开其他气体和氧化有限公司2。纯有限公司2参考气体用来计算临时δ值,和最后的δ值计算校正后的变化线性和仪器零点漂移,并表示相对于维也纳PeeDee箭石(V-PDB)标准。
统计分析
所有统计分析进行了R统计环境(RStudioVersion 1.2.5001)。皮尔逊相关性是用来评估时间和CH之间的关系4在所有孵化项目和所有复制治疗浓度。我们使用了lm R的函数,和先验显著性水平定义为α< 0.05。时间和CH之间显著正相关关系4被认为是净CH4生产的孵化,而显著负相关关系被认为是净CH4消费。这些关系的斜率和无花果的标准报告错误。1。
我们随后使用“分割”包v1.3-4 R执行分段回归测试CH的情况4生产或氧化在采样时间点之间存在着显著的差异,导致在CH非线性模式4浓度的实验。例如,初始CH4生产可能是紧随其后的是随后的氧化,从而导致重大的CH4增加随后显著减少。
表达方面的不同反应CH4浓度随时间在不同的实验治疗我们首先计算响应率(lnRR)由以下方程:
此外,我们计算的治疗有显著不同,控制使用方差分析(自动阀的功能)和图基诚实的显著差异(HSD)事后测试(HSD。测试的功能agricolae包v1.3.3)。
报告总结
进一步研究信息设计是可用的自然研究报告摘要与这篇文章有关。
数据可用性
DNA和RNA序列数据从这项研究中可用的序列读取存档BioProject之下PRJNA656136。CH4浓度数据(https://doi.org/10.6071/M3J67R)和δ13CH4数据(https://doi.org/10.6071/M3NX08)在森林女神是可用的。源数据本文提供的。
引用
联合国政府间气候变化专门委员会。2014年气候变化:综合报告。工作组的贡献I, II, III的第五次评估报告政府间气候变化专门委员会”(2014年日内瓦联合国政府间气候变化专门委员会)
戴维,D。,科尔,J。,P一个ce, M. & Tranvik, L. Methane emissions from lakes: dependence of lake characteristics, two regional assessments, and a global estimate.全球Biogeochem。周期18,(2004)。
戴维,d .百科全书的内陆水域(ed,把大肠)783 - 805(学术出版社,2009年)。https://doi.org/10.1016/b978 - 012370626 - 3.00117 - 4所示。
唐,k W。,McGinnis, D. F., Ionescu, D. & Grossart, H.-P. Methane production in oxic lake waters potentially increases aquatic methane flux to air.环绕。科学。抛光工艺。列托人。3,227 - 233 (2016)。
Hoehler, T。,Losey, N. A., Gunsalus, R. P. & McInerney, M. J.环境约束限制甲烷生成(参考工作一章)。https://www.osti.gov/biblio/1604967https://doi.org/10.1007/978 - 3 - 319 - 53114 - 4 _17 - 1(2018)。
卡尔·d·m . et al .有氧生产甲烷在海里。Geosci Nat。1,473 - 478 (2008)。
达姆、大肠等。甲烷生产有氧贫瘠地表水在中央北冰洋。Biogeosciences7,1099 - 1108 (2010)。
Grossart H.-P。Frindte, K。,Dziallas, C., Eckert, W. & Tang, K. W. Microbial methane production in oxygenated water column of an oligotrophic lake.Proc。《科学。108年,19657 - 19661 (2011)。
伯加德,m . j . et al .好氧的水柱水生CH的甲烷生成作为主要组成部分4通量。Commun Nat。55350 (2014)。
唐,k W。,McGinnis, D. F., Frindte, K., Brüchert, V. & Grossart, H.-P. Paradox reconsidered: Methane oversaturation in well-oxygenated lake waters.Limnol。Oceanogr。59,275 - 284 (2014)。
角,j . c . et al .甲烷生成的含氧土壤是湿地甲烷排放的很大一部分。Commun Nat。81567 (2017)。
Oremland声称,r s浮游生物样品和鱼类肠道产甲烷活动在海洋表面水域原位甲烷生成的机制。Limnol。Oceanogr。24,1136 - 1141 (1979)。
旧金山,c . m .正面& Lee甲烷生产期间浮游动物放牧对海洋浮游植物。Limnol。Oceanogr。39,1298 - 1308 (1994)。
卡尔,d . m . & Tilbrook b d生产和运输的甲烷海洋有机粉尘。自然368年,732 - 734 (1994)。
东,d . et al。甲烷氧化的条件下生产的全面评价中滋育的湖。Commun Nat。81 - 12 (2017)。
Repeta, d . j . et al .海洋甲烷悖论解释为细菌溶解有机物的降解。Geosci Nat。9,884 - 887 (2016)。
Horsman, g p & Zechel d l .膦酸酯生物化学。化学。牧师。117年,5704 - 5783 (2017)。
麦格拉思,j·W。,Chin, J. P. & Quinn, J. P. Organophosphonates revealed: new insights into the microbial metabolism of ancient molecules.启Microbiol Nat。11,412 - 419 (2013)。
索萨,o . A。,Repeta, D. J., DeLong, E. F., Ashkezari, M. D. & Karl, D. M. Phosphate-limited ocean regions select for bacterial populations enriched in the carbon–phosphorus lyase pathway for phosphonate degradation.环绕。Microbiol。21,2402 - 2414 (2019)。
姚明,M。,Henny, C. & Maresca, J. A. Freshwater bacteria release methane as a by-product of phosphorus acquisition.达成。环绕。Microbiol。82年,6994 - 7003 (2016)。
王,问。,Dore, J. E. & McDermott, T. R. Methylphosphonate metabolism by Pseudomonas sp. populations contributes to the methane oversaturation paradox in an oxic freshwater lake.环绕。Microbiol。19,2366 - 2378 (2017)。
李,w . et al .甲烷生产的含氧水柱常年冰雪覆盖的南极湖泊。Limnol。Oceanogr。65年,143 - 156 (2020)。
王,问:et al .有氧细菌甲烷合成。Proc。《科学。118年e2019229118 (2021)。
Bižić,m . et al .水生和陆生蓝藻产生甲烷。科学。睡觉。6eaax5343 (2020)。
Gunthel, m . et al . Photosynthesis-driven甲烷氧化的湖水中生产甲烷排放作为一个重要的因素。Limnol。Oceanogr。65年,2853 - 2865 (2020)。
Gunthel, m . et al .表面氧化的甲烷生产甲烷排放的贡献在湖泊和其全球的重要性。Commun Nat。10,1 - 10 (2019)。
Oremland声称,r s &卡彭,d . g .微生物生态学的发展(ed。马歇尔,k . c) 285 - 383 (Springer, 1988)。https://doi.org/10.1007/978 - 1 - 4684 - 5409 - 3 - _8。
李,et al。全球有限公司发生的产甲烷古菌和methanotrophic微胞藻属的细菌总量。环绕。Microbiol。23,6503 - 6519 (2021)。
Yu x et al .多样性和丰富的膦酸酯生物合成的基因。Proc。《科学。美国110年,20759 - 20764 (2013)。
牛顿,r . J。,Jones, S. E., Eiler, A., McMahon, K. D. & Bertilsson, S. A guide to the natural history of freshwater lake bacteria.Microbiol。摩尔。杂志。牧师。75年14-49 (2011)。
Kasalicky, V。Jezbera, J。,Hahn, M. W. & Šimek, K. The Diversity of the Limnohabitans Genus, an important group of freshwater bacterioplankton, by characterization of 35 isolated strains.《公共科学图书馆•综合》8e58209 (2013)。
英霍夫,j·F。Rahn, T。,Künzel, S. & Neulinger, S. C. Phylogeny of anoxygenic photosynthesis based on sequences of photosynthetic reaction center proteins and a key enzyme in bacteriochlorophyll biosynthesis, the chlorophyllide reductase.微生物7576 (2019)。
Sickman, j . O。,Melack, J. M. & Clow, D. W. Evidence for nutrient enrichment of high-elevation lakes in the Sierra Nevada, California.Limnol。Oceanogr。48,1885 - 1892 (2003)。
Elser, j。j。湖N的变化:P化学计量学和营养限制由大气氮沉降。科学326年,835 - 837 (2009)。
莫泽k . et al .高山湖泊:对全球环境变化的眼睛。全球地球。改变https://doi.org/10.1016/j.gloplacha.2019.04.001(2019)。
海登,c . j .碧曼& j . m .微生物多样性和群落结构在约塞米蒂国家公园沿着湖海拔梯度,加州,美国。环绕。Microbiol。18,1782 - 1791 (2016)。
Perez-Coronel E。,Hart, S. C. & Beman, J. M. Methane dynamics of high-elevation lakes in the Sierra Nevada California: the role of elevation, temperature, and inorganic nutrients.内陆水域11,267 - 277 (2021)。
Dumestre j . f . et al .光强度对methanotrophic细菌活动小跳跃水库,法属圭亚那。达成。环绕。Microbiol。65年,534 - 539 (1999)。
Murase j . &杉本a对甲烷氧化的抑制作用远洋的水柱中滋育的湖(日本琵琶湖,日本)。Limnol。Oceanogr。50,1339 - 1343 (2005)。
Thottathil, s D。,Reis, P. C. J. & Prairie, Y. T. Methane oxidation kinetics in northern freshwater lakes.生物地球化学143年,105 - 116 (2019)。
Whiticar, m . j .碳氢化合物、油和脂质:多样性、起源、化学和命运(ed。威尔克斯,h), 669 - 746 (Springer, 2020)。
Taenzer, l . et al .微生物甲烷从methylphosphonate isotopically记录来源。地球物理学。卷。47e2019GL085872 (2020)。
Thottathil, s D。,Reis, P. C. & Prairie, Y. T. Magnitude and drivers of oxic methane production in small temperate lakes.环绕。科学。抛光工艺。56,11041 - 11050 (2022)。
马科维茨,v . M . et al . IMG / M:基因组的数据管理和分析系统。核酸Res。36D534-D538 (2008)。
藤田,Y。,Matsumoto, H., Takahashi, Y. & Matsubara, H. Identification of a nifDK-like gene (ORF467) involved in the biosynthesis of chlorophyll in the Cyanobacterium Plectonema boryanum.植物细胞杂志。34,305 - 314 (1993)。
Nomata, J。,Ogawa, T., Kitashima, M., Inoue, K. & Fujita, Y. NB-protein (BchN-BchB) of dark-operative protochlorophyllide reductase is the catalytic component containing oxygen-tolerant Fe-S clusters.2月。582年,1346 - 1350 (2008)。
Nomata, J。,Mizoguchi, T., Tamiaki, H. & Fujita, Y. A second nitrogenase-like enzyme for bacteriochlorophyll biosynthesis reconstitution of chlorophyllide a reductase with purified x-protein (bchx) and yz-protein (bchy-bchz) from rhodobacter capsulatus.生物。化学。281年,15021 - 15028 (2006)。
咀嚼,a·g·m . &科比,d . a .细菌叶绿素生物合成:结构和功能多样性的起源。为基础。启Microbiol。61年,113 - 129 (2007)。
Tsukatani, y . et al .意外分支为细菌叶绿素生物合成途径能够吸收近红外光。科学。代表。31217 (2013)。
Kasalicky, v . et al .有氧存在光合作用属Limnohabitans中普遍存在。达成。环绕。Microbiol。84年e02116-17 (2018)。
Nayfach, s . et al。地球的微生物的基因组目录。生物科技Nat。》。1 - 11。https://doi.org/10.1038/s41587 - 020 - 0718 - 6。(2020)。
开普勒,:F。,Hamilton, J. T. G., Braß, M. & Röckmann, T. Methane emissions from terrestrial plants under aerobic conditions.自然439年,187 - 191 (2006)。
信使,d J。,Mcleod, A. R. & Fry, S. C. The role of ultraviolet radiation, photosensitizers, reactive oxygen species and ester groups in mechanisms of methane formation from pectin.植物,细胞包围。321 - 9 (2009)。
乌拉•威佳诺,等。紫外线辐射和温度对甲烷的排放从植物生物量和结构组件。Biogeosciences5,937 - 947 (2008)。
Bruhn D。,Møller, I. M., Mikkelsen, T. N. & Ambus, P. Terrestrial plant methane production and emission.Physiologia植物。144年,201 - 209 (2012)。
开普勒,:f . et al .甲氧基组植物果胶大气甲烷的先驱:证据从氘标记研究。n .植物学家178年,808 - 814 (2008)。
胡,Y。,李,C . C。&Ribbe, M. W. Extending the carbon chain: hydrocarbon formation catalyzed by vanadium/molybdenum nitrogenases.科学333年,753 - 755 (2011)。
杨,Z.-Y。,Dean, D. R. & Seefeldt, L. C. Molybdenum nitrogenase catalyzes the reduction and coupling of CO to form hydrocarbons.生物。化学。286年,19417 - 19421 (2011)。
李,C . C。,胡,Y。&Ribbe, M. W. Vanadium nitrogenase reduces CO.科学329年,642 - 642 (2010)。
郑,y . et al。使用细菌生物甲烷途径生产铁片固氮酶。Microbiol Nat。3,281 - 286 (2018)。
北,j . A . et al . nitrogenase-like酶体系催化蛋氨酸、乙烯和甲烷生物起源。科学369年,1094 - 1098 (2020)。
Seefeldt, l . c . et al .减少固氮酶的基质。化学。牧师。120年,5082 - 5106 (2020)。
Kafarski p为:自然发生和生理作用。当代对磷在生物学和材料主题https://doi.org/10.5772/intechopen.87155(2019)。
小丑,d . W。,Nanus, L. & Huggett, B. Use of regression-based models to map sensitivity of aquatic resources to atmospheric deposition in Yosemite National Park, USA.水资源Res。46,(2010)。
Kobližek、m .生态学的有氧存在光在水生环境中。《。牧师。39,854 - 870 (2015)。
Hauruseu, d . & Kobližek m .影响光的碳利用率在有氧存在光。:环境。Microbiol78年,7414 - 7419 (2012)。
Čuperova, Z。霍尔泽E。索尔卡,我。,Sommaruga, R. & Koblížek, M. Temporal changes and altitudinal distribution of aerobic anoxygenic phototrophs in Mountain Lakes.达成。环绕。Microbiol。79年,6439 - 6446 (2013)。
Piwosz, K。,Kaftan, D., Dean, J., Šetlík, J. & Koblížek, M. Nonlinear effect of irradiance on photoheterotrophic activity and growth of the aerobic anoxygenic phototrophic bacterium Dinoroseobacter shibae.环绕。Microbiol。20.,724 - 733 (2018)。
Horňak, K。,Kasalicky, V。,Šimek, K. & Grossart, H.-P. Strain-specific consumption and transformation of alga-derived dissolved organic matter by members of the Limnohabitans-C and Polynucleobacter-B clusters of Betaproteobacteria.环绕。Microbiol。19,4519 - 4535 (2017)。
Weiss, r . f .决定二氧化碳和甲烷的双催化剂火焰电离电子俘获色谱层析和一氧化二氮。j . Chromatogr。科学。19,611 - 616 (1981)。
山本,S。,Alcauskas, J. B. & Crozier, T. E. Solubility of methane in distilled water and seawater.j .化学。Eng。数据21,78 - 80 (1976)。
碧曼,j . M。,Popp, B. N. & Alford, S. E. Quantification of ammonia oxidation rates and ammonia-oxidizing archaea and bacteria at high resolution in the Gulf of California and eastern tropical North Pacific Ocean.Limnol。Oceanogr。57,711 - 726 (2012)。
Huber J & Fortunato c RNA提取协议从RNA-SIP实验。https://doi.org/10.17504/protocols.io.iuycexw(2017)。
卡拉汉,b . j . et al . DADA2:高分辨率从Illumina公司扩增子数据样本推断。Nat方法。13,581 - 583 (2016)。
Bolyen、大肠等。可再生的、互动的、可伸缩、可扩展的微生物数据科学使用QIIME 2。生物科技Nat。》。37,852 - 857 (2019)。
城堡,p . d . et al .引入mothur:开源,独立于平台的,支持的软件描述和比较微生物群落。达成。环绕。Microbiol。75年,7537 - 7541 (2009)。
Masella, a P。,Bartram, A. K., Truszkowski, J. M., Brown, D. G. & Neufeld, J. D. PANDAseq: paired-end assembler for illumina sequences.BMC Bioinform。1331 (2012)。
Buchfink B。,Xie, C. & Huson, D. H. Fast and sensitive protein alignment using DIAMOND.Nat方法。1259-60 (2015)。
李,d . et al .热卖v1.0:快速和可伸缩metagenome汇编由先进的方法论和社会实践。方法102年3-11 (2016)。
Langmead, b &扎尔茨贝格,s . l .快gapped-read符合领结2。Nat方法。9,357 - 359 (2012)。
、a . m . et al . Anvi传闻:一种先进的组学数据分析和可视化平台。PeerJ3e1319 (2015)。
康,d . d . et al . MetaBAT准确重建的一个有效工具单一基因组从复杂的微生物群落。PeerJ3e1165 (2015)。
公园,d . h . et al .恢复近8000 metagenome-assembled基因组大大扩展了生命之树。Microbiol Nat。2,1533 - 1542 (2017)。
波兰熏肠,s m . et al .自适应抑制种子基因组序列的比较。基因组Res。21,487 - 493 (2011)。
公园,d . h . et al . CheckM:评估质量的微生物基因组从孤立中恢复过来,单个细胞和基因组。基因组Res。25,1043 - 1055 (2015)。
确认
这项工作是由加州大学通过情人节山脉东部的储备研究生科研补助金(EPC),研究所生态和进化气候影响的研究奖学金(EPC),加州大学默塞德环境系统夏季赠款(EPC),和加州大学MEXUS-CONACYT博士奖学金(EPC)。Metagenome测序部分由美国能源部联合基因组研究所社区测序计划JMB 1839 (CSP)。我们感谢美国国家公园管理局协助样品收集在约塞米蒂国家公园允许yose - 2016 sci - 0118, yose - 2017 sci - 0104和yose - 2018 sci - 0091。我们感谢史蒂夫·哈特帮助处理甲烷样品;杰伊·塞克斯顿他的帮助孵化室;杰昆·弗拉加,安琪拉于索尼娅•巴尔加斯Ariadna开罗,萨曼莎·巴斯克斯,豪尔赫·蒙特埃尔和丹妮拉阿隆索协助现场和实验室工作。
作者信息
作者和联系
贡献
概念化:E.P.C.J.M.B.;方法:E.P.C.J.M.B.;调查:E.P.C.J.M.B.;可视化:E.P.C.J.M.B.;监督:J.M.B.;原创作品草案:E.P.C.;Writing-review &编辑:J.M.B.,E.P.C.
相应的作者
道德声明
相互竞争的利益
作者宣称没有利益冲突。
同行评审
同行审查的信息
自然通讯感谢匿名评论者对他们的贡献的同行评审工作。同行审查报告是可用的。
额外的信息
出版商的注意施普林格自然保持中立在发表关于司法主权地图和所属机构。
源数据
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到Creative Commons许可,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问http://creativecommons.org/licenses/by/4.0/。
关于这篇文章
引用这篇文章
Perez-Coronel E。,Michael Beman, J. Multiple sources of aerobic methane production in aquatic ecosystems include bacterial photosynthesis.Nat Commun136454 (2022)。https://doi.org/10.1038/s41467 - 022 - 34105 - y
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41467 - 022 - 34105 - y