文摘gydF4y2Ba
摘要generalisable方法校正荧光读数在微型板块的读者,为了任意荧光单位转换成绝对单位。FPCountR依靠定制荧光蛋白的生成(FP) calibrants,化验以确定蛋白质浓度和活动,和相应的分析工作流程。我们系统地描述分析协议的准确性、敏感性和简单性和描述一个“ECmax”试验,优于其他人,甚至使精确校准无需FPs的净化。获得细胞蛋白的浓度,我们考虑方法转换的光密度细胞计数或者细胞数量,以及检查细胞如何通过荧光猝灭可以干扰蛋白质计数,我们量化和正确的第一次。校准在不同的仪器,不同的滤波器组和不匹配的收益是产生等效的结果了。它还显示,mCherry吸收在600海里不会混淆细胞密度测量,除非表示超过100000每细胞蛋白质。FPCountR提出了对开放存取工具(协议和R包)让社区使用这种方法,并最终促进合成微生物的定量描述电路。gydF4y2Ba
介绍gydF4y2Ba
人们越来越意识到应对的挑战合成电路设计需要的合成经验描述遗传数据部分数学建模方法预测和实现所期望的行为gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3gydF4y2Ba。然而,有许多挑战与定量框架集成实验数据,实验数据通常是在相对或任意单位(特定于工具和各自设置),不能转化为有用的单位,因此限制了我们能力对比实验和模型。gydF4y2Ba
荧光蛋白(FPs)是我们最多才多艺的合成基因元件性能的评估工具。自发现以来,FPs正确被认定为唯一有价值的记者蛋白质定量描述gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,因为他们不需要添加外源性组件能发出荧光。这使得其使用简单和成本效益。各种实验室仪器允许的描述荧光系统在各种尺寸和scales-through直接可视化(使用荧光显微法),通过单细胞荧光分析(使用流式细胞仪),或通过timecourse动力学数据采集(使用微型板块的读者)。gydF4y2Ba
的蛋白质量化问题报告GFP水平获得此类仪器的相对荧光单位”(RFU)在合成生物学广泛认可gydF4y2Ba6gydF4y2Ba。这种认识导致校准标准的采用荧光素等小分子荧光团与GFP激发和发射特征相似。荧光素可用于给定的仪器校准仪器的任意RFU输出转化为单位的“等效荧光素分子”(MEFL)。这种技术已被证实能使GFP表达数据聚集的比较从不同的仪器以及在实验室gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba。gydF4y2Ba
虽然现在接近主流用法在合成生物学,绿色荧光值的转换成MEFL可以说是不是最重要类型的量化要求构建合成电路。三个方面的蛋白质定量问题仍然是难以捉摸的。首先,荧光素只是好calibrant绿色荧光蛋白质,离开蓝色、黄色、橙色和红色FPs未校准。第二,只能提供一个转换单位的荧光素荧光素,而真正需要的是一个转换单位的蛋白质。目前,大多数实验甚至不能揭示FPs的数量级是表示(例如10 vs 100000分子/细胞)与RNA序列——相对于什么是可能的gydF4y2Ba8gydF4y2Ba。第三,尽管荧光素可以让GFP水平仪器和实验室之间的比较,它不能解决比较两种不同的FPs在同一电路。这仅仅是可能的如果RFUs FPs都可以分别转化为单位的蛋白质分子。有些人试图解决这个问题,试图预测FPs使用理论的相对亮度值gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,但这种校准做出一些假设,例如关于翻译率等效跨结构,需要验证才能被采纳。gydF4y2Ba
幸运的是,有一种相当简单的解决方案。理想的分子生物学calibrant被认为是纯化样品的分子在这种情况下,荧光蛋白本身。虽然纯化FPs不一般商用,它们可以产生“内部”,从而提供至关重要的直接相对荧光单位和分子的蛋白质之间的联系。事实上,FP校准提出了过去,尽管它的使用是有限的显微镜gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba并为微型板块分析仍然是罕见的gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba。我们怀疑这是由于(a)一个underappreciation绝对量化是不可能“组学”,(b)一个沉默不熟悉生化协议通常不合成生物学或微生物学的一部分,和(c)怀疑,这样的协议可能不够准确或敏感用于一般用途。这些促使我们开发一个通用,但简单易用标定协议这种性质的。gydF4y2Ba
接下来,我们轮廓优化标定方法和现在这是一双资源:一个湿实验室协议,称为FPCount(可用protocols.io)和一篇分析方案,称为FPCountR (GitHub上可用)。我们目前的数据显示这个协议的发展,和生化系统地描述和分析需求的准确和敏感的校准。我们还展示了一个absorbance-based荧光蛋白分析,行为既简化方法去除蛋白质纯化的要求,并使其更敏感和健壮。使用FPCountR,我们表明,分子单位转换为可用于校准不同仪器,不同过滤集和不匹配的收益产生等效的结果。我们证明转换绝对单位允许用户我们的方法来比较不同荧光蛋白表达的蛋白质生产效率从一台相同的向量在分子/细胞,或者作为摩尔浓度。最后,我们表明,该方法可用于定量评估实验协议本身,如红色荧光蛋白的程度让光密度读数timecourse化验。gydF4y2Ba
结果gydF4y2Ba
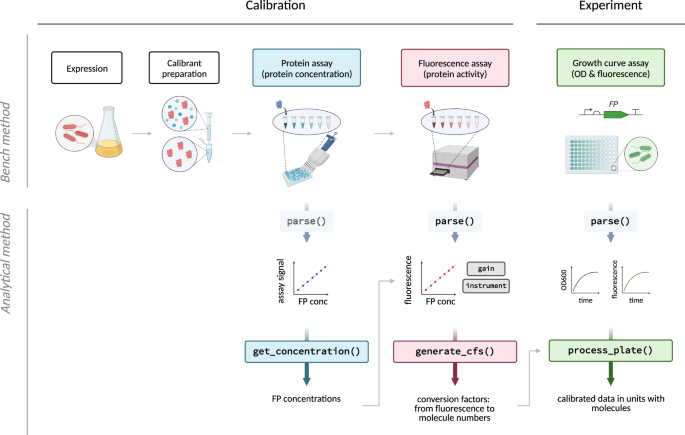
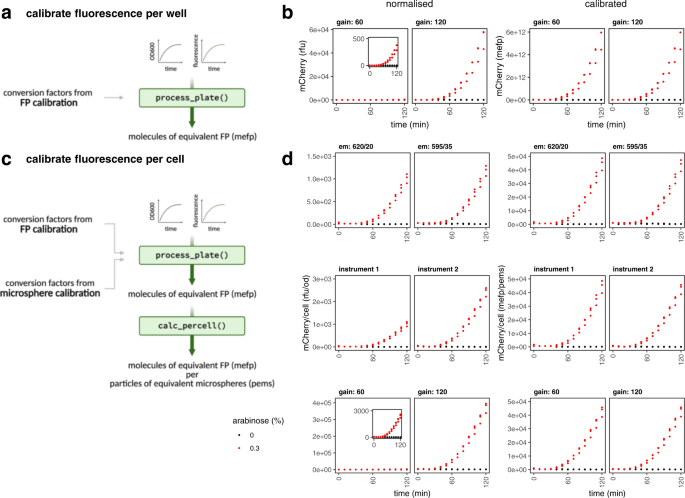
为这项工作我们的目标是开发一个generalisable FP校准方法,可以使用任何集团希望校正荧光读数在微型板块读者分子单位。为此,我们定义了一个数量的我们的方法的关键目标。首先,它应该是精确的和敏感的,因为我们需要正确的方法估计细胞内的分子数,和蛋白质产量小规模的方法进行了净化通常是温和的。第二,标定协议应该尽可能简单,适应各自理想情况下,每个实验可能在96 - microwell使用相同的板板格式读者被校准。这样,多个荧光蛋白可能校准一次,最终用户不需要任何额外的仪器。第三,方法应适合荧光蛋白的特定特性。这些蛋白质更小和结构不同于典型的蛋白质calibrants如牛血清白蛋白(BSA)和已知某些挑战量化由于光吸收发色团。因此,任何试验为荧光蛋白质需要单独开发验证FPs证明他们也适合这类蛋白质。最后,我们想使数据的简单分析,(我)允许方便地转换的原始校准数据链接任意荧光输出的转换因子的蛋白质分子单位的数量,和(2)以允许简单的数据转换技术,未来所有timecourse的工具产生输出数据(如GFP)分子,而不是相对(如绿色)荧光单位。概述FPCount荧光蛋白校准协议见图。gydF4y2Ba1gydF4y2Ba。gydF4y2Ba
校准工作流描述(左),紧随其后的是一个演示如何使用这个校准实验数据转换从任意荧光单位每光密度成分子细胞(右)。校准工作流程由湿实验室协议(顶部,可用protocols.io)和分析包(底部,GitHub上可用)。总之,协议描述了如何准备荧光蛋白表达和纯化calibrants,尽管后者步骤是可选的溶解产物允许精确校准不需要净化。协议还描述了如何收集数据校准的蛋白质测定来确定蛋白质浓度,以及荧光测定来确定蛋白质的活动。分析工作流作为一个开源R包,提供完整的功能,使提取的蛋白质浓度的测定数据,转换因子(任意荧光单位每个分子)结合的蛋白质和荧光测定数据,和功能,允许用户将实验数据转换成绝对单位。图创建Biorender.com。gydF4y2Ba
calibrants净化协议获取蛋白质gydF4y2Ba
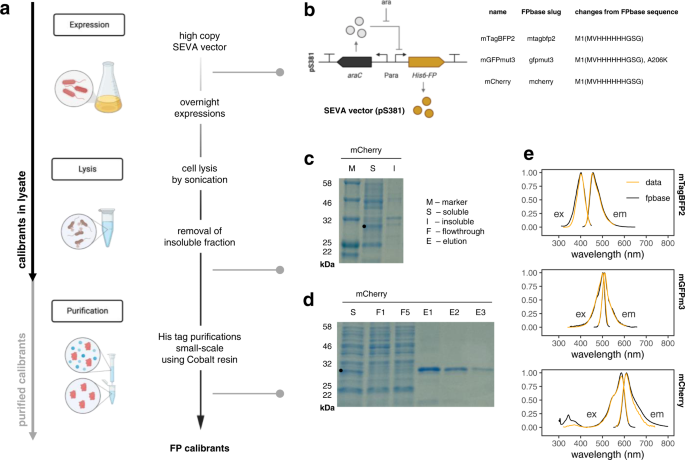
为了获得我们的荧光蛋白calibrants,他们必须先由超表达,纯化。蛋白质纯化方法往往是高度复杂的,需要专家经验和仪器。要实现这一点,我们的协议是明确设计得尽可能的简单,只涉及到所需的最小数量的步骤,并使用常用试剂。也设计成适合小规模的校准方法进行了净化,使并行多个蛋白质。协议总结在无花果。gydF4y2Ba2gydF4y2Ba。标准化FP表达载体构建从arabinose-inducible His-tagged FP构建在一个高仿欧洲向量标准化体系结构(歌曲)向量(图。gydF4y2Ba2 bgydF4y2Ba)。高仿的使用向量和一夜之间表达旨在最大化蛋白的生产,和温度降至30°C到最小化错误折叠。细胞细胞溶解使用声波降解法避免下游需求添加化学成分,可能会干扰过程,如EDTA(他净化)、洗涤剂(蛋白量化),或未知组件的商业裂解试剂。通过离心分离不溶性蛋白质被移除和钠十二烷基硫酸聚丙烯酰胺凝胶电泳(sds - page)被用来确认FP是可溶性表达的大部分分数(无花果。gydF4y2Ba2摄氏度gydF4y2Ba)。蛋白质纯化使用他亲和纯化,因为他的标签是规模较小,使它们不可能妥协融合蛋白的功能。树脂被用作钴的关联矩阵,因为它具有较高的特异性标记比树脂、镍,因此预计co-isolate杂质少。净化质量的FP calibrants验证了通过sds - page和荧光激发和发射扫描(图。gydF4y2Ba2gydF4y2Bad、e、补充图。gydF4y2Ba1gydF4y2Ba)。纯化calibrants一贯良好的纯度和产量。gydF4y2Ba
一个gydF4y2Ba协议总结。高仿的使用向量和一夜之间表达旨在最大化生产蛋白质。细胞细胞溶解使用声波降解法,避免了需要添加化学成分,可能会干扰下游流程。通过离心去除不溶性蛋白质。蛋白质纯化使用他的亲和力与钴树脂净化将co-isolate杂质少。左边的箭头代表所需的步骤准备净化calibrants(灰色)和calibrants溶解产物(黑色)。gydF4y2BabgydF4y2Ba向量和FP的设计。标准化FP表达载体构建从arabinose-inducible His-tagged FP构建在一个高仿SEVA向量。三个常用的FPs从整个光谱范围选择测试这个协议:mTagBFP2 mGFPmut3, mCherry。表的三种蛋白质说明任何蛋白质序列的变化与FPbase同行相比,显示相同的比赛除了亲和标签和GFPmut3 monomerising突变。gydF4y2BacgydF4y2Ba表达和溶解性验证。sds - page分析溶菌产物分离后的不溶性部分被用来确保大多数荧光蛋白的可溶性。sds - page显示来自一个mCherry净化,显示可溶性(S)和不可溶性的分离(I)分数,旁边的蛋白质标记(M) 12%的凝胶。gydF4y2BadgydF4y2Ba净化验证。sds - page分析纯化后用来证实成功的方法进行了净化。sds - page显示来自一个mCherry净化,显示可溶性(S)分数的分离,两个flowthrough (F)分数从绑定步骤显示有效的FP绑定到树脂、钴和三个洗脱(E)分数。gydF4y2BaegydF4y2Ba荧光光谱。荧光光谱扫描(特异,激发;em,发射)被用来确认纯化FP按预期的行为。光谱获得的图中显示(正常化,最高的价值= 1)安装在黄土模型和95%置信区间(橙色)覆盖每个FP FPbase光谱(黑)。显示光谱代表一个样本以重复,这是代表至少2纯化批calibrant独立。图面板gydF4y2Ba一个gydF4y2Ba和gydF4y2BabgydF4y2Ba创建Biorender.com。源数据作为源数据文件提供。gydF4y2Ba
进行校准板读者gydF4y2Ba
萤光素的标定板读者历来使用稀释进行一系列已知浓度的荧光素,受到读者的荧光测定板的校准需要(相对荧光的测量单位,RFU)。结果被用来与荧光素分子数量RFU获得转换因子,这反过来又可以用来RFU读数从实验数据转换成MEFL单位gydF4y2Ba6gydF4y2Ba。对蛋白质calibrants,需要一个额外步骤:蛋白质浓度测定。gydF4y2Ba
在我们最初的协议,我们选择了bicinchoninic酸(BCA)试验由于其灵敏度,易用性和低protein-to-protein可变性gydF4y2Ba16gydF4y2Ba。此外,microplate-optimised试剂“microBCA”是从ThermoFisher可用,有优秀的敏感性(2 ng /µl)。试验测试表明的抑制作用三羟甲基氨基甲烷和氯化钠在洗脱缓冲液(补充图。gydF4y2Ba2gydF4y2Ba)表明缓冲交换将是必要的检测灵敏度高。正常使用BSA标准测量获得的装备被安装在一个多项式方程获得一个标准曲线(补充图。gydF4y2Ba2 d,二世gydF4y2Ba)。这被用来预测系列稀释的浓度的FPs准备第一次删除值报告阈值下的敏感性和拟合线性模型通过其余的值(补充图。gydF4y2Ba2 d,第二和第三gydF4y2Ba)。添加一个额外的步骤是为了推荐协议(补充图。gydF4y2Ba2,二世gydF4y2Ba和补充图。gydF4y2Ba2摄氏度gydF4y2Ba),占红FPs的基线吸光度A562范围。这些计算处理由get_conc_bca FPCountR包中()函数。使用合成预测蛋白质浓度和荧光分析数据在同一FP系列稀释,的改编版本generate_cfs flopR()函数gydF4y2Ba7gydF4y2Ba用于生成转换因素(RFU /分子)为mCherry Tecan火花板读者红FP-typical滤波器组(前560/20,em 620/20;补充图。gydF4y2Ba3gydF4y2Ba)。gydF4y2Ba
开发FP A280测定的浓度gydF4y2Ba
我们试图验证BCA测定的准确性通过re-quantifying FPs的第二种方法很可能给予可靠浓度估计。虽然有各种各样的蛋白质化验,唯一广泛使用“绝对”分析,不需要calibrant A280化验。顾名思义,它量化蛋白质浓度通过光吸光度在280海里,我们知道三个氨基酸残基的地方吸收光线的方式已被证明是大约添加剂gydF4y2Ba17gydF4y2Ba。这意味着一个合理的预测在280纳米光的吸光度可以为任何纯蛋白质序列已知的主要通过消光系数(EC;预期给定浓度的光吸收的蛋白质)。作为样品吸光度与分子浓度根据比尔定律,即gydF4y2Ba\ (C = {EC} * * L \)gydF4y2Ba(gydF4y2Ba\ \ ()gydF4y2Ba吸光度,gydF4y2Ba\ ({EC} \)gydF4y2Ba消光系数(MgydF4y2Ba−1gydF4y2Ba厘米gydF4y2Ba−1gydF4y2Ba),gydF4y2Ba\ (C \)gydF4y2Ba浓度(M),gydF4y2Ba\ (L \)gydF4y2Ba路径长度(厘米)),蛋白质浓度可以从吸光度计算只使用消光系数和路径长度。最常见的格式A280测量是非常艰苦的,single-throughput试管或Nanodrop-type测量,需要适应的标准A280协议用于96 -微型板块。我们总结的要求在补充报告中这样一个适应gydF4y2Ba1gydF4y2Ba(连同补充无花果。gydF4y2Ba4gydF4y2Ba- - - - - -gydF4y2Ba8gydF4y2Ba和补充表gydF4y2Ba3gydF4y2Ba)。简而言之,最好的A280化验结果获得通过UV-clear塑料、删除添加剂,纠正对路径长度变化,光散射和纠正。这需要收集的吸光度光谱从200到1000纳米,而不仅仅是一个阅读在280海里,是由两个连续的FPCountR处理功能,plot_absorbance_spectrum()和get_conc_a280()(补充无花果。gydF4y2Ba6gydF4y2Ba- - - - - -gydF4y2Ba7gydF4y2Ba)。gydF4y2Ba
系统的协议测试允许方法验证gydF4y2Ba
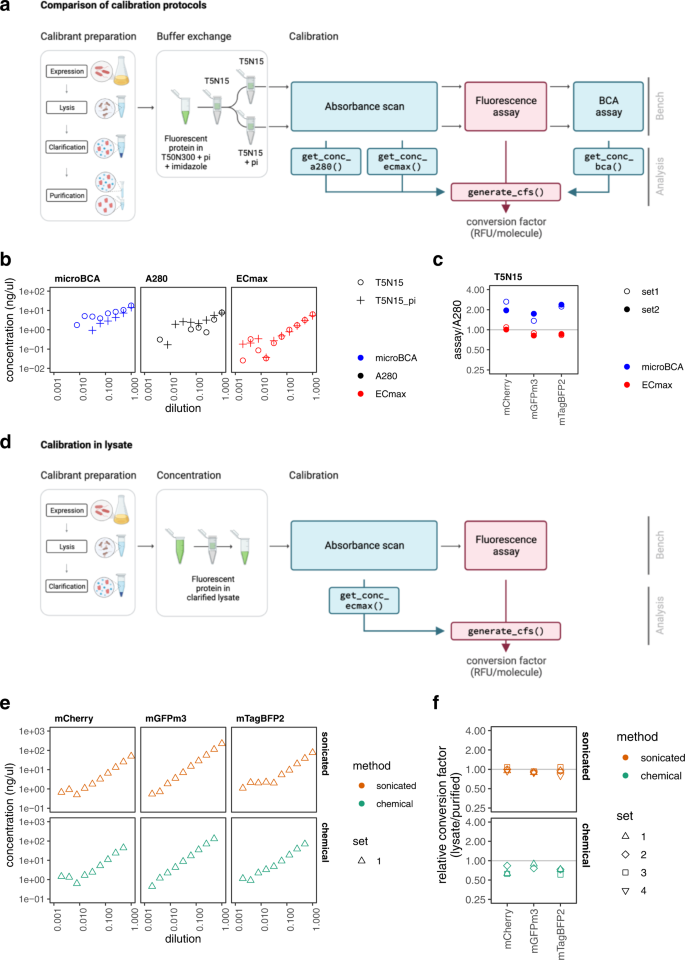
我们试图进行一个系统的评估BCA和A280方法通过测试三个幽灵似地不同的FPs两个缓冲区,评估与分析并行(无花果。gydF4y2Ba3gydF4y2Ba)。选择FPs (mTagBFP2 mGFPmut3和mCherry)被广泛使用,单体的,合理fast-maturing和明亮。所有三个几乎相同的蛋白质水平FPbase条目(图。gydF4y2Ba2 bgydF4y2Ba;“方法”;补充数据),除了,他们都有一个他gydF4y2Ba6gydF4y2Ba标签氨基端扩展和mGFPmut3包含一个定义良好的单体的A206K突变gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba。选择缓冲区(T5N15(5毫米Tris-HCl pH值7.5,15毫米氯化钠)和T5N15蛋白酶抑制剂)都兼容microBCA试验(补充图。gydF4y2Ba2 bgydF4y2Ba),然而,试点研究表明他们可能有不同的对A280测定的影响。净化后,FPs最初透析除去添加剂,然后re-dialysed到各自的分析缓冲区(无花果。gydF4y2Ba3gydF4y2Ba)。每个FP:缓冲组合连续稀释,并受一个吸光度扫描(200 - 1000纳米测量、A280),荧光分析(荧光测量与适当的过滤器为每个FP)和microBCA化验(试剂,孵化和A562测量)。比较测试结果图所示。gydF4y2Ba3 b, cgydF4y2Ba补充图。gydF4y2Ba9gydF4y2Ba和补充表gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba3gydF4y2Ba。广泛,从每个试验结果验证的其他试验:每个FP的浓度测量中使用microBCA和A280化验彼此对于大多数样本的2倍(无花果。gydF4y2Ba3 cgydF4y2Ba)和明显的线性范围达到1 ng /µl对于大多数稀释系列(图。gydF4y2Ba3 bgydF4y2Ba)。相比较而言,报道Nanodrop 100 ng /µl敏感性gydF4y2Ba20.gydF4y2Ba。我们观察到一些缓冲灵敏度为assays-the microBCA产生更多的线性结果包含蛋白酶抑制剂在缓冲,而A280更好的缓冲。总的来说,A280试验产生的数据更适合比microBCA线性回归分析,表明它可能是更可靠的浓度相对较低,用于这些化验(补充表gydF4y2Ba2gydF4y2Ba)。缓冲效果也明显的荧光分析(补充注gydF4y2Ba2gydF4y2Ba补充图。gydF4y2Ba10gydF4y2Ba)。转换因素从不同的净化批次给类似的估计,获得浓度估计是使用最优试验:缓冲区配对(补充图。gydF4y2Ba9 bgydF4y2Ba)。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2BaFP校准使用纯化的蛋白质。gydF4y2Ba一个gydF4y2BaCalibrant准备和分析工作流。在洗脱纯化FPs缓冲区(蛋白酶抑制剂,π)透析T5N15,然后再到T5N15±π。每个FP系列稀释缓冲都准备好了,并受三个蛋白质化验(microBCA, A280和ECmax试验)以及荧光测定。gydF4y2BabgydF4y2Ba使用不同的方法测定蛋白质浓度和缓冲。一个例子使用mTagBFP2(全部结果参见补充图。gydF4y2Ba9gydF4y2Ba)。点代表重复的值的均值。任何遗漏的数据点浓度记录是低于0.01 ng /µl。gydF4y2BacgydF4y2Ba化验A280相比。每个系列稀释的原始数据,显示在(gydF4y2BabgydF4y2Ba),是安装在一个线性模型,并用于估算中的第一个样品的浓度系列(稀释系数= 1),根据每个试验方法。对于一个给定的FP批(集),microBCA和ECmax测定误差计算通过折叠不同浓度预测的试验,与A280预测的试验使用T5N15缓冲区。因此每一个点代表一个值为每个FP批。完整的数据集,看到补充表gydF4y2Ba1gydF4y2Ba。gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba在原油溶解产物FP校准。gydF4y2BadgydF4y2BaCalibrant准备和分析工作流。校准在溶菌产物需要更少的步骤:省略亲和纯化,缓冲交换不是必需的,和稀释系列主题只有两个化验不需要商业试剂或孵化的步骤。gydF4y2BaegydF4y2Ba测量与ECmax测定蛋白质浓度。稀释系列使用溶解产物通过声波降解法(橙色)或化学溶解(绿色),测定吸光度扫描。每个系列的最高稀释使用化学溶解被由于过度样品散射。完整的数据集,看到补充图。gydF4y2Ba11个gydF4y2Ba。gydF4y2BafgydF4y2Ba转换因子比较比较溶菌产物和纯化蛋白质。褶皱的区别(溶菌产物/纯化蛋白)转换因子计算在每一个收获。情节显示意味着折叠差异在收益和误差代表标准差。完整的数据集,看到补充图。gydF4y2Ba11 bgydF4y2Ba。图面板gydF4y2Ba一个gydF4y2Ba和gydF4y2BadgydF4y2Ba创建Biorender.com。源数据作为源数据文件提供。gydF4y2Ba
ECmax试验执行比常规化验gydF4y2Ba
我们试用过第三个蛋白测定在这个实验中,指定在这里“ECmax”方法。这个分析背后的主要思想是,A280消光系数并不是唯一已知的FPs的消光系数。FPs还拥有一个消光系数(EC)对应于他们的光吸收峰值(max)激发波长。“ECmax”大多数FPbase FPs是可用的,我们可以自动检索使用FPbase APIgydF4y2Ba21gydF4y2Ba。(FPbase (gydF4y2Bawww.fpbase.org/gydF4y2Ba)是一个开源,community-editable荧光蛋白及其属性数据库。每个数据库中的FP包含自己的页面结构的属性,如它的主要蛋白质序列、消光系数和荧光光谱。基本上所有常用的FPs条目在这个数据库中,很少使用变体,这些都是通过它的API)。的分析处理步骤ECmax试验(get_conc_ecmax())类似于A280试验(补充图。gydF4y2Ba8gydF4y2Ba),不需要进一步的阅读材料。的最大吸收峰FPs测试都高于280 nm(补充图。gydF4y2Ba1 bgydF4y2Ba补充表gydF4y2Ba4gydF4y2Ba),我们预期ECmax试验更敏感。进一步,蛋白酶抑制剂吸收波长在300海里,我们提出这个实验可能buffer-sensitive少。咄咄逼人地,似乎是正确的:我们一贯发现ECmax分析产生较大的检测的线性范围和下限比其他化验(接近0.1 ng /µl, 10倍比A280试验和1000倍比Nanodrop),而且它产生了几乎相同的结果是否缓冲含有蛋白酶抑制剂(图。gydF4y2Ba3 b, cgydF4y2Ba补充图。gydF4y2Ba9gydF4y2Ba补充表gydF4y2Ba1gydF4y2Ba)。此外,从ECmax预测分析从A280密切匹配,通常在80 - 100%的浓度预测匹配预期的结果(而不是microBCA 170 - 220%;无花果。gydF4y2Ba3 cgydF4y2Ba补充表gydF4y2Ba1gydF4y2Ba),显示一个错误率< 20% A280试验的参考价值。由于这些原因,我们建议ECmax试验是最健壮的试验包括在一个简单的标定协议,并将继续在接下来的使用浓度计算从ECmax化验。gydF4y2Ba
使用纯化FPs标定协议的健壮性gydF4y2Ba
进一步调查这个校准方法的再现性,我们完成了两个独立的重复校准的所有三个FPs使用T5N15pi缓冲区和ECmax化验。从这些数据,我们发现我们的一个校准与mTagBFP2跑了我们最初的实验(补充图。gydF4y2Ba9gydF4y2Ba,mTagBFP2 set2)中的mTagBFP2转换因素,产生了异常值的1.67倍高于其他复制。结果,我们提出一个比较转换的再现性因素与转换因素从原始数据集2(补充图。gydF4y2Ba9 cgydF4y2Ba)。补充表中提供了完整的数据gydF4y2Ba5gydF4y2Ba。我们的数据表明,一般来说,使用上述方法获得的转换因子值是高度可再生的(他们相差不到20%在所有情况下除了异常mTagBFP2价值,与合成变异系数在0.06和0.09之间)。因此,我们建议用户为每个FP进行两个独立的校准,谨慎和锻炼,如果复制相差超过20%。gydF4y2Ba
没有蛋白质纯化ECmax试验使校准gydF4y2Ba
建立ECmax测定,蛋白质定量测定,只有依赖每个FP的峰值光吸光度,非常准确和敏感的纯化蛋白质测量使用受信任的方法,我们问这个方法是否能使我们放弃完全净化步骤。放弃其他化验的纯化步骤是不可能的,因为他们是为了量化总蛋白浓度,但ECmax原则上应具体考虑FP和因此可能被用来量化FPs原油溶解产物。研究这个问题,我们收获和细胞溶解细胞表达我们三个FPs,分离可溶性分数和集中。把这些通过ECmax测定和荧光测定,我们观察到可以量化FPs原油溶解产物与高灵敏度(1 ng /µl;补充图。gydF4y2Ba11个gydF4y2Ba),获得几乎相同的转换因子值作为纯化FPs,使用转换因子的均值(non-anomalous)方法进行了净化用作比较器(图。gydF4y2Ba3 e, fgydF4y2Ba补充图。gydF4y2Ba11 bgydF4y2Ba补充表gydF4y2Ba5gydF4y2Ba)。两tested-sonication溶解方法和化学lysis-the前产生更精确的结果(转换因素从纯化蛋白质接近预期的转换因子- 90 - 99%的预期值),他们也有精度高(低变异性,变异系数在0.02和0.12之间,类似于CVs观察纯化calibrants)。重复测试calibrants由声波降解法表明,FPs保持稳定在溶菌产物储存在4°C的周(补充图。gydF4y2Ba11 cgydF4y2Ba)。使用ECmax FP量化分析,因此可以消除净化步骤完全不影响标定精度和精度。gydF4y2Ba
对商业calibrants FPCountR结果比较积极gydF4y2Ba
我们有兴趣测试是否纯化FPs给类似RFU分子转换因素作为商用FPs。很少FPs商业上可用,多数是绿色的FPs,所以我们关注这些。我们编译可用gfp的表来确定最佳候选人顺序(补充数据文件gydF4y2Ba1gydF4y2Ba)。令人惊讶的是,许多是基于第一代gfp优先激发紫外线范围(与GFPmut3或sfGFP),不完全缺乏蛋白质序列数据,亮度或光谱信息,或没有受到明确的质量控制(补充注gydF4y2Ba3gydF4y2Ba)。这暗示他们严格的生产可能会小于本文中描述的方法,使他们难以推荐calibrants(补充注gydF4y2Ba3gydF4y2Ba)。尽管如此,使用商业TurboGFP,我们获得一个相对95.0%价值的转换因子获得使用我们纯化mGFPmut3(补充表gydF4y2Ba5gydF4y2Ba),这表明FPs内部和(精选)商业来源可以交替使用。进一步,校准使用转换因素产生的小分子荧光素mGFPmut3相比,只有33%的错误提供mGFPmut3之间的光谱差异和荧光素占(补充图。gydF4y2Ba12gydF4y2Ba补充表gydF4y2Ba5gydF4y2Ba),显示出像样的蛋白质和小分子calibrant之间的可比性。据我们所知,这也是第一次实验验证,荧光素可能在一定条件下允许的转换不仅RFU荧光素分子也近似的蛋白质分子。gydF4y2Ba
比较在仪器FPs GFPgydF4y2Ba
虽然荧光素可使整个实验室和实验结果的比较工具通过将任意单位转换为等效荧光素的分子(MEFL)单位,原则上FP校准提供了相同的功能,将任意单位转化为单位的“等效FP分子”(MEFP),这是使用FPCountR process_plate()函数(图。gydF4y2Ba4 a、bgydF4y2Ba)。这使我们能够量化FP分子的数量在每一个我们的微型板块。计算未校准的每个细胞的价值观,典型的研究将RFU值除以光密度(OD600或OD700)的文化,从而量化细胞密度。光密度的校准粒子数量可以通过一个类似的校准过程使用类似大小的微球gydF4y2Ba大肠杆菌gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba。使用校准,可以量化分子/细胞数量的分子与FP /粒子等效微球的(MEFP /到聚合物,无花果。gydF4y2Ba4摄氏度gydF4y2Ba),单位,应该允许交叉对比不同的乐器,收益和过滤集。为了验证这一点,隔夜的文化gydF4y2Ba大肠杆菌gydF4y2Ba包含mCherry表达向量被分为单独但相同的微型板块含有阿拉伯糖,和生长在两板读者使用一系列设置。结果表明,正常价值的相对荧光相差1.5 ~ ~ 3 ~ 130倍没有校准,而这样的价值观成为可靠的可比校准后,即使是使用仪器设置实验产生的值不能明了地绘制在同一轴(图。gydF4y2Ba4 dgydF4y2Ba)。gydF4y2Ba
一个gydF4y2Ba校准的荧光在MEFP的单位。Timecourse实验数据的gydF4y2Ba大肠杆菌gydF4y2Ba蛋白表达可能是加工使用process_plate()函数使用转换因素来自FP校准。这允许正常数据的转换(相对荧光单位,rfu)转化为校准单位,“等效荧光蛋白分子”或“MEFP”。gydF4y2BabgydF4y2Ba在MEFP的比较正常和校准数据。发酵剂的gydF4y2Ba大肠杆菌gydF4y2BaDH10B包含pS381_ara_mCherry被转移到一个96孔板。mCherry表达uninduced(灰色)或(黑)阿拉伯糖诱导0.1% 0分钟。在OD700吸光度和荧光监控每十分钟。数据收集从三个生物复制,每个策划。左面板:正常化mCherry RFU的单位。右面板:校准mCherry MEFP的单位。插图图显示相同的数据作为父情节放大轴。gydF4y2BacgydF4y2Ba校准每个细胞的荧光MEFP单位/到聚合物。结合微球体的FP转换因素与转换因素校准可以进一步处理的数据使用calc_fppercell()函数为每个细胞的数据与MEFP每单位“等效微球粒子”(到聚合物)。gydF4y2BadgydF4y2Ba比较正常和校准数据MEFP /到聚合物。表达式进行了如(gydF4y2BabgydF4y2Ba)。正常化和校准值显示在不同的滤波器组相比(顶部,符号:发射波长/带宽),仪器(中间)和收益(底部)。数据过滤和增益比较被使用相同的工具。图面板gydF4y2Ba一个gydF4y2Ba和gydF4y2BacgydF4y2Ba创建Biorender.com。源数据作为源数据文件提供。gydF4y2Ba
估计绝对细胞蛋白质的浓度gydF4y2Ba
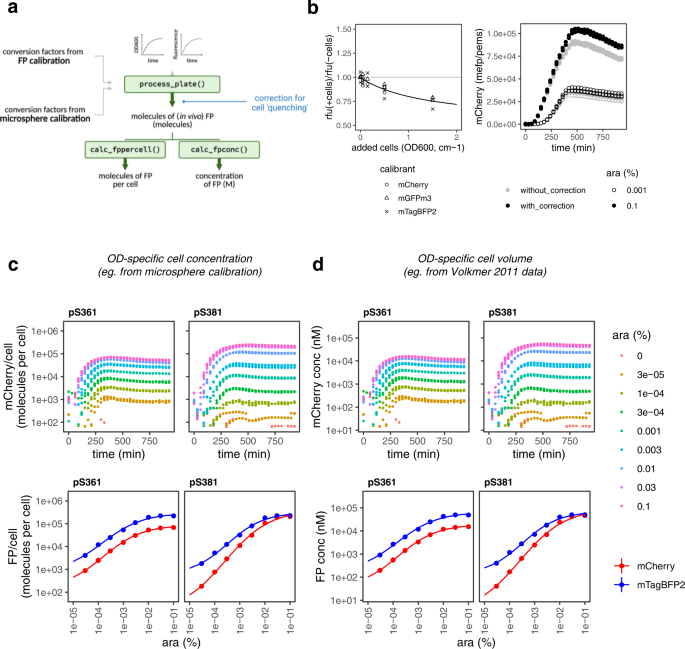
我们接下来问校准单位MEFP /到聚合物是一种合理的近似分子的数量每细胞(图。gydF4y2Ba5gydF4y2Ba)。我们进行微球校准使用1厘米比色皿和标准分光光度计和获得转换因素(补充表gydF4y2Ba6gydF4y2Ba)范围内的,量化的实证OD600-specific细胞计数gydF4y2Ba24gydF4y2Ba。此外,其他作者已经证实的值每细胞使用荧光素和荧光蛋白微球calibrants (MEFL /到聚合物)约等于那些获得使用fluorescein-calibrated单细胞数据流式细胞分析仪gydF4y2Ba7gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,表明粒子计数可能近似实际的细胞数量。然而,我们观察到的一个主要使用微球作为calibrants警告,那就是他们的吸光度概要文件不同的细胞。这可以阻挠他们的能力提供准确的每个细胞数据之间的转换计算使用OD700与OD600测量(补充图。gydF4y2Ba13gydF4y2Ba和补充表gydF4y2Ba4gydF4y2Ba- - - - - -gydF4y2Ba5gydF4y2Ba)我们在补充报告中讨论解决方案gydF4y2Ba4gydF4y2Ba(补充数据文件gydF4y2Ba2gydF4y2Ba)。gydF4y2Ba
一个gydF4y2Ba函数来将实验数据转换成绝对单位。图修改process_plate()函数(i)将补偿步骤基于定量的理解细胞密度对明显的荧光的影响(这允许单位被记录为分子/细胞),和(2)计算分子浓度的FP相反,在摩尔的单位。gydF4y2BabgydF4y2Ba量化淬火效果的荧光三FPs。纯化FPs与荧光涨跌互现gydF4y2Ba大肠杆菌gydF4y2Ba在一系列浓度,OD600和荧光强度都被记录下来。正常化后细胞自体荧光,折叠之间的差异相对荧光强度(rfu)和(+)没有(−)细胞是量化(左)。重复的数据收集,这两个点绘制。通过这个数据,使预测模型是合适的预期荧光猝灭实验数据对于一个给定的细胞密度。校正的影响的一个例子(右面板)。一个mCherry表达载体诱导低(圆圈)和高(封闭的圆圈)浓度树胶醛醣提出了没有(灰色)和(黑)校正。数据收集从三个生物复制和所有的点都绘制。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba绝对量化蛋白质分子/细胞(gydF4y2BacgydF4y2Ba)和摩尔浓度(gydF4y2BadgydF4y2Ba)。mCherry表达式从介质(上)(pS361 p15A)和高(pS381 colE1)复制向量在一系列阿拉伯糖诱导浓度和量化timecourse试验在校准板读者。数据处理中描述(gydF4y2Ba一个gydF4y2Ba)和细胞估计基于微球校准是用来计算每个细胞值(gydF4y2BacgydF4y2Ba),或者OD-specific细胞体积的数据Volkmer et al ., 2011年是用来计算摩尔浓度(gydF4y2BadgydF4y2Ba)。数据收集从三个生物复制,每个策划。(底部)mCherry表达式从顶部面板与mTagBFP2表达式从相同的分析,策划反对阿拉伯糖浓度在420分钟后归纳。点显示的平均值显示两个独立的实验中,每个测试三个生物复制。误差棒表示标准偏差。图面板gydF4y2Ba一个gydF4y2Ba创建Biorender.com。源数据作为源数据文件提供。gydF4y2Ba
是否FPs的测量荧光测量荧光的细胞相当于相同数量的FPs体外尚不明朗。一些作者发现细胞荧光减弱(或“淬火”)gydF4y2Ba15gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,但影响的强度还没有系统的研究,特别是对温和的发现在一个典型的细胞浓度gydF4y2Ba大肠杆菌gydF4y2Ba增长分析。我们量化淬火的属性gydF4y2Ba大肠杆菌gydF4y2Ba细胞在我们三FPs混合越来越浓度的荧光细胞纯化FPs,和量化的差异明显与增加细胞荧光(图gydF4y2Ba5 bgydF4y2Ba和补充图。gydF4y2Ba14gydF4y2Ba)。我们的研究结果表明,这种“淬火”效应达到< 20%的中度细胞的荧光信号密度(OD600 / 0.5厘米以下),但增加约30%的细胞密度最高通常观察到microplate-scale文化(OD600 /厘米2)。这些信息是用来校正步骤添加到process_plate()计算,以弥补荧光的预期损失百分比增加细胞密度(图。gydF4y2Ba5 bgydF4y2Ba右面板)。完整的从校准实验数据处理分析工作流程见附加图。gydF4y2Ba15gydF4y2Ba。gydF4y2Ba
使用这些修改,可以响应曲线试验数据转化为分子/细胞。图gydF4y2Ba5度gydF4y2Ba显示一个实验中使用mCherry表达式构造两个向量不同起源的复制。使用这些向量,我们获得的数据mCherry丰富,大约900到70000之间不同分子p15A每个细胞,并为colE1 200年到200000年。核糖体蛋白质丰度信息,可以从蛋白质组学和分析研究,表明典型的gydF4y2Ba大肠杆菌gydF4y2Ba蛋白质存在于10的顺序gydF4y2Ba2gydF4y2Ba−10gydF4y2Ba3gydF4y2Ba每细胞复制,最丰富的顺序出现在10gydF4y2Ba5gydF4y2Ba副本每个细胞或更高gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba。Over-induction使用高仿(colE1)向量因此似乎允许合成蛋白表达水平达到最丰富的蛋白质在细胞中。这是支持的事实,这些向量可靠FPs过表达水平可观测的sds - page unpurified溶解产物(无花果。gydF4y2Ba1gydF4y2Ba补充图。gydF4y2Ba1gydF4y2Ba)。适度的表达式(10gydF4y2Ba2gydF4y2Ba−10gydF4y2Ba3gydF4y2Ba每个细胞)可以通过结合低阿拉伯糖浓度与向量。换句话说,colE1向量允许我们利用蛋白质丰度的全谱适度表达酶如RecBCD解旋酶(~ 100册/细胞)到最丰富的核糖体蛋白(~ 100000册/细胞,裁判。gydF4y2Ba28gydF4y2Ba)。我们也可以用这个比较分子的数目由相同的向量,但两个不同的FPs。有趣的是,从相同的歌曲向量测量显示,而FP丰度都在同一数量级,mTagBFP2积累到每个细胞水平高于mCherry平均3.8倍,尽管分享相同的启动子,5 '非翻译区,核糖体结合位点和氨基蛋白序列(图。gydF4y2Ba5 c, dgydF4y2Ba)。这可能是由于翻译率效应从编码序列的RNA水平影响超出了前11标准化的密码子,否则由于两种蛋白质降解动力学差异。gydF4y2Ba
2011年,Volkmer和他的同事指出,虽然OD-specificgydF4y2Ba大肠杆菌gydF4y2Ba细胞计数随生长速率、OD-specific细胞总量是每OD600 /厘米~ 3.6µl,不管应变或增长的条件gydF4y2Ba24gydF4y2Ba。使用OD作为测量累积细胞体积的一种文化可以被用于荧光和OD测量转换成在摩尔浓度单位,而不是每个细胞的价值观,这样的转换可能更适合比较实验结果和定量模型的细胞反应网络,因为它们影响增长率的差异。使用这种方法,我们发现FP丰度使用相同的向量之间填充浓度范围的0.01和100年µM(无花果。gydF4y2Ba5 dgydF4y2Ba)。gydF4y2Ba
揭示了隐藏的荧光蛋白的性质gydF4y2Ba
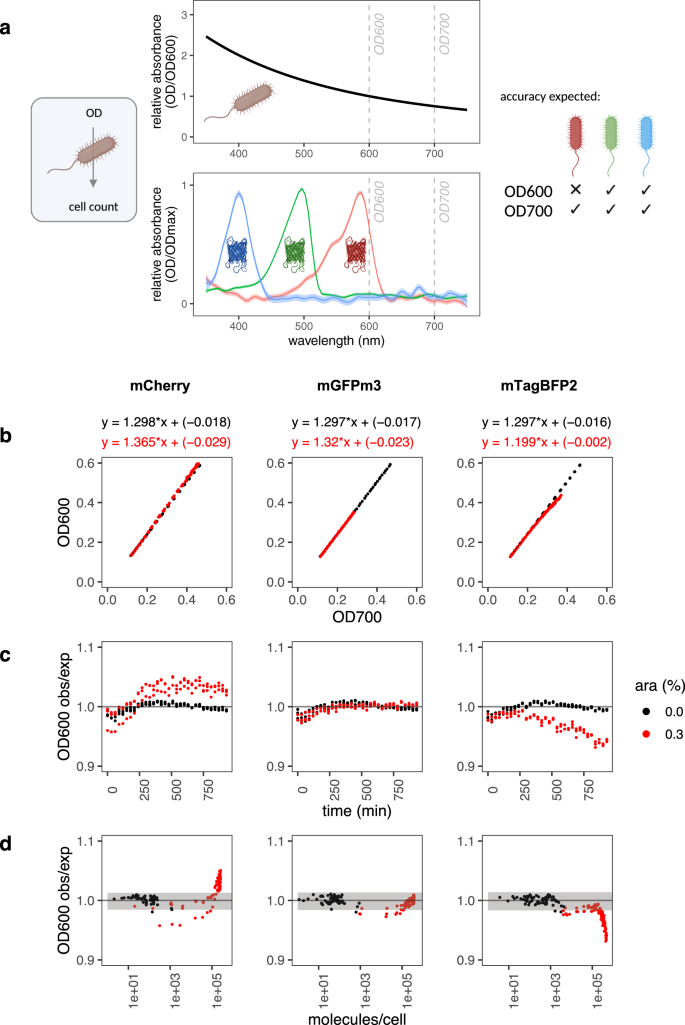
最后,我们有兴趣测试绝对量化能否照亮一个著名的细菌化验误差来源。红色FPs的存在已经建议干扰细菌细胞密度估计在600 nm自红FPs通常在这个波长吸收好gydF4y2Ba29日gydF4y2Ba和导致的结论是,电路使用红色FPs必须量化在700海里,这是影响他们的存在。然而,红色FPs的分子数,这种效应可能需要发生从未被量化。gydF4y2Ba
校准timecourse数据mCherry超表达gydF4y2Ba大肠杆菌gydF4y2Ba(无花果。gydF4y2Ba6gydF4y2Ba)检查量化这些影响,与mGFPmut3 mTagBFP2作为消极的控制。OD600和OD700测量之间的比率是用来识别错误引起的红FP吸光度。线性模型拟合测量OD600之间的关系和OD700值证实这种关系对所有uninduced细胞(图非常相似。gydF4y2Ba6 bgydF4y2Ba;OD600 = 1.30 * OD700 - 0.02),但是mCherry感应导致测量偏差(OD600 = 1.37 * OD700 - 0.03,无花果。gydF4y2Ba6 b, cgydF4y2Ba)。看着这一转变之间的关系,细胞蛋白质拷贝数(图。gydF4y2Ba6 dgydF4y2Ba),我们的研究结果表明,OD600 mCherry只是误差明显mCherry每个细胞水平高时每细胞(超过100000),而且这个错误的大小仅为5%。相比之下,mGFPmut3表达式没有影响使用OD600细胞密度估计,如预期。mTagBFP2令人惊讶的是,我们观察到相反的趋势,其中OD600测量似乎低估了细胞密度mTagBFP2每细胞表达高水平的地方。原因目前还不清楚,超出了本文的范围,但我们的研究结果表明,这可能是未来工作的一个有趣的方法。一般来说,这个实验证实,低到中度FP水平的每个细胞(低于100000)不扰乱细胞密度估计,和错误的大小在所有情况下低于细胞荧光猝灭。gydF4y2Ba
一个gydF4y2Ba细胞计数准确性FPs。在细菌检测,细胞计数得到校准OD600或OD700测量假设的唯一贡献者在600或700纳米细胞吸光度。细胞OD600: OD700比率(情节,补充的数据图。gydF4y2Ba11gydF4y2Ba1.3)近似。红色的FPs像mCherry吸收波长的光用于细胞密度评估(底部情节,补充的数据图。gydF4y2Ba1 bgydF4y2Ba),可能导致细胞计数的误差估计。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2BaTimecourse pS381矢量的表达式分析三个FPs OD600监控,OD700每个30分钟的荧光强度,没有(黑)和(红色)。数据收集从三个生物复制,所有点是策划。这是一个代表性的实验为每个FP至少两个独立的实验。1.3注意OD600: OD700比率再次近似。gydF4y2BabgydF4y2BaOD700和OD600值之间的关系。线性模型的数据拟合三FPs,和每个图如上所示。gydF4y2BacgydF4y2BaOD600误差与时间绘制。OD600误差得到观测值除以预期的值。从OD700期望值计算值和测量OD600 ~ OD700关系0%的阿拉伯糖(见样例gydF4y2BabgydF4y2Ba)。gydF4y2BadgydF4y2BaFP丰富对OD600误差的影响。OD600错误中每个FP策划反对大量的分子/细胞。灰色阴影表示样品没有阿拉伯糖的均值±2 *标准差。图面板创建Biorender.com。源数据作为源数据文件提供。gydF4y2Ba
讨论gydF4y2Ba
为这项工作我们的目标是开发一个generalisable方法,使荧光读数微型板块读者荧光蛋白的分子单元校准。方法应该是(1)准确和敏感,(2)尽可能简单,(3)适合任何荧光蛋白,(4)容易分析。发展的方法,我们采用了冗余的实验设计的原则,包括多个试验的验证类型,描述方法的一致性和通用性的评估为三个不同的FPsgydF4y2Ba30.gydF4y2Ba。gydF4y2Ba
我们最初的方法使用一个简单的净化协议(无花果。gydF4y2Ba2gydF4y2Ba)和一个商业蛋白质测定允许我们开发一个分析管道从纯化FP calibrants获取转换因素。为了展示我们校准的准确性和有效性,我们验证的吸光度和荧光光谱calibrants匹配FPbase同行(无花果。gydF4y2Ba1gydF4y2Ba补充图。gydF4y2Ba2gydF4y2Ba;参考文献。gydF4y2Ba21gydF4y2Ba,gydF4y2Ba31日gydF4y2Ba),并验证我们最初的蛋白质分析测量的交叉与另外两个方法进行比较。要做到这一点,我们采用低吞吐量A280测定准确,高通量分析格式,显示,这些都是适合使用FPs尽管一些近紫外线吸收的范围。这种类型的分析对FP量化,据我们所知,在文献中被证实之前,我们认为它可能是特别感兴趣的,因为它不需要calibrant或商业试剂,没有昂贵的quartz-based耗材和展品敏感性超过Nanodrop等商业系统。gydF4y2Ba
我们还发现了一个方法论的捷径获取FP浓度使用消光系数在最大激发波长,ECmax试验,这是最简单和最健壮的化验测试。特别是ECmax试验被缓冲的条件下,影响最小的和最大的线性范围(几乎0.1 ng /µl;无花果。gydF4y2Ba3gydF4y2Ba)。我们注意分析是有限的,它需要用FP FPbase被记录下来,并假定记录ECmax其他实验室的测量是准确的。幸运的是,我们的研究结果表明,这些测量好inter-lab协议(比较A280和ECmax估计,无花果。gydF4y2Ba3 cgydF4y2Ba)。此外,所有FPbase FPs的分析,比较蛋白质的消光系数在280 nm和最大激发波长,支持ECmax是更敏感的检测对于大多数FPs(补充图。gydF4y2Ba16gydF4y2Ba补充表gydF4y2Ba4gydF4y2Ba)。虽然欧盟(280)值是高度统一的(中位数:27400米gydF4y2Ba−1gydF4y2Ba厘米gydF4y2Ba−1gydF4y2Ba),可能是因为大多数FPs规模非常相似,ECmax值大多相当大(中位数:64200米gydF4y2Ba−1gydF4y2Ba厘米gydF4y2Ba−1gydF4y2Ba)。令人印象深刻的是,随着ECmax分析具体量化FP浓度而不是总蛋白浓度,我们也能够证明可以做这些校准精度前提下原油溶解产物,证明calibrants可能产生不亲和纯化(无花果。gydF4y2Ba3gydF4y2Bad-f)。总的来说,我们希望使用ECmax方法进行校准,使用纯化calibrants或(用)细胞溶解产物,同样准确。我们提供严格的和有利的协议protocols.io潜在用户。gydF4y2Ba
虽然荧光蛋白是生物分子的荧光活动是依赖于他们的生产和测试条件(如pH值和氧气)的可用性,使用一些成熟的技术与标准细菌蛋白质过度协议可以避免这些问题。例如,表达协议我们描述的目的是产生高水平的蛋白质:我们使用高拷贝向量和长时间的表达式。然而,我们培养细胞在低温下25 - 30°C的表达,它的机会减少到最低限度,过表达蛋白质错误折叠或聚合gydF4y2Ba32gydF4y2Ba。聚合物的存在可以通过sds - page检查澄清步骤,分离后的可溶性和不可溶性分数gydF4y2Ba32gydF4y2Ba。我们很少看到重要的聚合(无花果。gydF4y2Ba2摄氏度gydF4y2Ba)。发色团所需氧气也成熟gydF4y2Ba19gydF4y2Ba然而,摇动烧瓶文化将充气,溶解和/或净化过程给任何剩余的时间不成熟的蛋白质成熟期间协议本身。(简单地将细胞暴露在空气中允许在缺氧条件下成熟的FPs表示gydF4y2Ba33gydF4y2Ba)。此外,缓冲区用于校准分析应与细胞pH值(我们使用pH值7.5)。我们也进行校准检测温度匹配我们的细菌检测(尽管我们不希望小FP亮度温度的变化将产生重大影响或行为)。gydF4y2Ba
当前用户的荧光素校准可能感兴趣这个方法如何使用荧光素系列稀释与校准。荧光素校准的协议肯定是便宜(£0.23 /校准使用ref细节。gydF4y2Ba6gydF4y2Ba)由于荧光素是一种低成本的荧光团,和简单的使用商业calibrants不再需要calibrant制备或浓度的决心。FP校准的关键优势在于它能够被用来直接转换任意单位直接向分子所需的FP,加上自由定制生产从任意FP calibrants,或者多个FPs,从光谱,荧光素的特性是否匹配。而商业FPs成本平均£39.05校准(假设使用10µg FP /校准,补充数据文件gydF4y2Ba1gydF4y2Ba),估计成本生产一批FP calibrants在溶菌产物只有£10.18,标准的产量大约100µg FP(只使用文化的一小部分)。虽然FPs可以显示condition-dependent荧光,正如上面所讨论的,这些影响可以最小化:事实上,它们可以用来测试用户的温度或pH敏感性的FP受控条件下。此外,荧光素和其他小分子也显示condition-specific荧光,虽然这一点很少考虑gydF4y2Ba34gydF4y2Ba。虽然很难直接比较该方法的精度和荧光素发表数据,FPCountR协议显然是高度可再生的。计算转换因素通常在±10%的期望值和变异系数之间的独立复制通常低于0.1(补充表gydF4y2Ba5gydF4y2Ba)。以下从模范荧光素gydF4y2Ba6gydF4y2Ba,有明显的潜在未来inter-lab研究延长我们的理解的可访问性和再现性FPCountR协议。gydF4y2Ba
这样可以使用校准,首先从不同的板块,使实验结果的比较读者或在不同的设置,在分子的荧光蛋白粒子等效微球(MEFP /到聚合物;无花果。gydF4y2Ba4 bgydF4y2Ba)。这类似于使用荧光素但有更广泛的应用范围,因为对每个FP允许我们使用定制calibrants校准仪器FP无论其光谱特性。如果仅仅是用作比较单元,每个校准的精度(重复性)是很重要的,但是他们的准确性(无论是转换预测分子数字尽可能)不是。其次,他们可以用来表达蛋白质丰富的分子/细胞(图gydF4y2Ba5度gydF4y2Ba)。精度是一个重要的考虑因素,并将不仅取决于FP校准的准确性(如上所述),但也在微球校准,移除任何吸光度和荧光特性之间的相互作用的细胞表达FPs。微球校准,cross-comparison与流式细胞术微球校准数据显示细胞计数估计是合理的gydF4y2Ba7gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,尽管比尔和他的同事使用0.961µm微球的大小接近gydF4y2Ba大肠杆菌gydF4y2Ba比用于这项研究(0.890µm;更大的类型现在不可用)。我们的蛋白质丰度估计(10gydF4y2Ba2gydF4y2Ba−10gydF4y2Ba5gydF4y2Ba每细胞蛋白质;无花果。gydF4y2Ba5 bgydF4y2Ba)也在合理的范围内gydF4y2Ba26gydF4y2Ba,gydF4y2Ba28gydF4y2Ba确凿的使用,表明FP校准可以使蛋白质丰度比较微型板块分析和蛋白质组学实验。gydF4y2Ba
考虑是否存在干扰细胞荧光定量(反之亦然)是多方面的。众所周知,细胞通过自发荧光干扰荧光测量。细胞自体荧光已知GFP量化精度很大程度上的影响gydF4y2Ba35gydF4y2Ba,并纠正在FPCountR正常化的背景荧光控制细胞在一个类似的OD(参与。gydF4y2Ba7gydF4y2Ba,gydF4y2Ba15gydF4y2Ba)。的“淬火”明显FP荧光的细胞更很少考虑gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba。我们发现的效应大小相当不同的FPs(补充图。gydF4y2Ba14gydF4y2Ba),与自体荧光,支持以前的观测gydF4y2Ba25gydF4y2Ba。这个衰减修正根据预期的比例FPCountR补偿荧光猝灭测量OD(无花果。gydF4y2Ba5 bgydF4y2Ba)。这些修正都是包含在process_plate()函数。gydF4y2Ba
某些错误的来源仅靠校准不能充分解决。虽然一些人指出,pH值会影响分子的某些FPs的亮度gydF4y2Ba15gydF4y2Ba无法弥补,这分析无需用户输入详细的pH值响应的状况包括FPs和pH值的细胞。幸运的是,自细胞pH值gydF4y2Ba大肠杆菌gydF4y2BapH值7.2 - -7.8之间是有限的gydF4y2Ba36gydF4y2Ba,甚至pH-sensitive FPs展览只有轻微的(< 10%)分子亮度的变化之间的pH值7和8gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,pH-dependent分子亮度的变化不太可能对量化有很大影响。gydF4y2Ba
蛋白/细胞的整体精度误差量化利用FP -和microsphere-calibrated微型板块读者可以估计的总和组件:20%(从蛋白质量化误差,无花果。gydF4y2Ba3 cgydF4y2Ba补充表gydF4y2Ba1gydF4y2Ba和gydF4y2Ba2gydF4y2Ba)和33%(从细胞计数错误推断流式细胞分析仪计数,Fedorec et al ., 2020),导致约50%的误差。这应该是足够准确的,允许蛋白/细胞不仅量化到正确的数量级(即。估计每细胞或蛋白质丰度是否在数百数千每个细胞),但也表明,量化可能是准确的在双重的真实值。这应该是最适合大多数应用程序,包括估计的两个或两个以上的FPs的相对大小,以及基因电路模型。额外的错误,比如从细胞淬火或OD600 - vs OD700-quantified细胞数量的比较,可以避免通过使用FPCountR分析R包。其他人,比如从pH-sensitive FPs,可以避免使用pH-insensitive FPs。gydF4y2Ba
总的来说,似乎校准分子每细胞计数的准确性可能会受到细胞计数的准确性校准,因为众所周知,OD-specific细胞计数与增长率变化,这是由于积极的增长速度和细胞大小之间的关系gydF4y2Ba大肠杆菌gydF4y2Ba24gydF4y2Ba。因此我们预计这些计算蛋白质的数量每细胞将更准确,细胞大小和微球大小尽可能相似,和不准确的地方会出现如果成为重要的差异。因此,这些值可能是大约准确只要以下假设是真实的:gydF4y2Ba大肠杆菌gydF4y2Ba吸光度(散射)是由微球特性,随着时间的推移,它不会改变显著或样品之间。这些可能是真实的gydF4y2Ba大肠杆菌gydF4y2Ba实验细胞收缩以来发生几个小时后才在静止的文化,和只有大型的增长率差异保持长时间观察做出显著差异在指数增长的细胞单元尺寸gydF4y2Ba24gydF4y2Ba,但可能会失败如果电路影响很大的负担强加于宿主细胞资源增长率或细胞的大小gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba。相比之下,使用转换从OD细胞总量在给定的文化让我们删除计数细胞(图要求。gydF4y2Ba5 dgydF4y2Ba),并允许蛋白质浓度为0.01 -100µM的表达。大约这些数据应该是准确的假设下OD-specific细胞体积样品或之间不发生显著的变化。这是强烈支持Volkmer和同事的结果gydF4y2Ba24gydF4y2Ba的数据显示这种变化在2倍大范围的增长条件,但也被人表明,随着细胞数量的增加,其OD-specific细胞计数减少大约相同的大小吗gydF4y2Ba39gydF4y2Ba,gydF4y2Ba42gydF4y2Ba。单位的浓度也可能反应造型更有意义,因为最终是分子浓度绑定和动力学的关键gydF4y2Ba9gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba。gydF4y2Ba
我们使用绝对蛋白质定量调查问题第一次被赫克特和他的同事们gydF4y2Ba29日gydF4y2Ba之间的关联mCherry超表达和细胞密度的测量偏差。重复这些化验表明一个明确的影响,但这种影响是中等大小的(< 5%),只是明显每细胞mCherry水平很高(超过10gydF4y2Ba5gydF4y2Ba分子/细胞;无花果。gydF4y2Ba6gydF4y2Ba)。这表明对于大多数电路,使用温和的表达水平来减少细胞的负担,OD600值将保持一个精确的量化细胞密度的方法。我们在mTagBFP2表达式也出人意料地观察到相反的效果。作为量化分析在技术上是否OD600和OD700测量偏离彼此在不同的帧,这些结果可能并不表明OD600-based细胞密度读数存在高mTagBFP2是不准确的。相反,它可能表明,mTagBFP2相反,OD700读数不准。我们目前没有一个解释这一发现。一个可能的因素可能是虽然它通常被描述为一个最好的蓝色FPs, mTagBFP2总倾向高于mCherry最gfpgydF4y2Ba45gydF4y2Ba。细胞应激诱导gydF4y2Ba大肠杆菌gydF4y2Ba延长gydF4y2Ba39gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,这可能会影响其散射特性。可能非常高水平的FP频繁导致细胞密度小而重要的误差估计的组合效应影响,光吸收和散射,权证更多的研究,以使我们能够进一步提高FPs在这些条件下的分子量化。gydF4y2Ba
而流式细胞仪和质谱测量允许我们探测单细胞或整个细胞的蛋白质补充,分别微型板块读者仍在Design-Build-Test-Learn周期的一个重要的筛选平台由于使用方便,低成本和高迭代功能。这需要开发的方法从这些数据中提取信息的数据。提取的能力绝对蛋白质丰度信息工程微生物细胞的分析必须启用描述,优化和调优的基因电路以严格的和定量的方式,并将允许一个更深层次的了解蛋白质丰度如何影响基因构建行为,细胞负担和增长率。重要的是,我们的方法可以准确、无损、甚至简单蛋白质丰度比较,不同样本之间的增长率或细胞的大小。gydF4y2Ba
进一步,这样绝对量化不必局限于荧光蛋白。过去几年已经看到一个奇妙的扩张fluorogenic分子,工具,允许局部的具体量化蛋白质gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba厌氧环境中,蛋白质gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba荧光定量的rnagydF4y2Ba44gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba。校准这些分子会更复杂的实现但同样有价值。同样,校准的替代工具,如流血细胞计数器也感兴趣的,但需要一个非常不同的方法,要求calibrants被附加到的颗粒细胞样的尺寸。我们希望我们的演示如何实现绝对FP量化使用FPCountR有助于从标化验的努力开发更多定量的方法分析电路行为合成生物学。gydF4y2Ba
方法gydF4y2Ba
材料gydF4y2Ba
引物和gblocks获得踊跃参与gydF4y2Ba大肠杆菌gydF4y2Ba应变DH5-alpha(表达载体,18265 - 017)是用于分子克隆。化学物质和蛋白质试剂从默克公司购买,σ,ThermoFisher科学、Bio-Rad,分子生物学试剂从内和生活技术和通用实验室试剂从康宁,他一一Bio-One、流动和VWR。gydF4y2Ba
荧光蛋白gydF4y2Ba
的mCherrygydF4y2Ba54gydF4y2Ba蛋白质序列是基于mcherry FPbase条目(gydF4y2Bahttps://www.fpbase.org/protein/mcherry/gydF4y2Ba)以下变化:M1 (MVHHHHHHGSG)。的mGFPmut3gydF4y2Ba55gydF4y2Ba蛋白质序列是基于gfpmut3 FPbase条目(gydF4y2Bahttps://www.fpbase.org/protein/gfpmut3/gydF4y2Ba)以下变化:M1 (MVHHHHHHGSG) A206K(一个替换,使蛋白质单体的;参考文献。gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba)。的mTagBFP2gydF4y2Ba56gydF4y2Ba蛋白质序列是基于mtagbfp2 FPbase条目(gydF4y2Bahttps://www.fpbase.org/protein/mtagbfp2/gydF4y2Ba)以下变化:M1 (MVHHHHHHGSG)。完整的蛋白质序列提供了补充数据文件gydF4y2Ba3gydF4y2Ba。gydF4y2Ba
DNA组装gydF4y2Ba
向量对荧光蛋白纯化和生长曲线分析了根据标准协议,通过金门和吉布森组装技术使用gydF4y2Ba大肠杆菌gydF4y2Ba应变DH5α(表达载体,18265 - 017)。结构组装成标准化的欧洲向量架构(歌曲)骨干gydF4y2Ba57gydF4y2Ba:pS381生成与氯霉素pS181替换;从pS161 pS361生成类似。为了大约使蛋白质表达水平不同,5’翻译区(包括核糖体结合位点)和5 '每个地区构造将是相同的残渣11(编码区开始:gydF4y2BaDNAgydF4y2Ba:ATGGTTCACCATCATCATCACcacGGTtcgggc,gydF4y2Ba蛋白质gydF4y2Ba:MVHHHHHHGSG)。第二个残渣将缬氨酸减少N-end介导的降解的影响gydF4y2Ba58gydF4y2Ba。亲和标记为净化选择他gydF4y2Ba6gydF4y2Ba标签,紧随其后的是一个简短的非结构化链接器(GSG)。提供了完整的DNA序列向量的补充数据文件gydF4y2Ba3gydF4y2Ba。所有三个pS381质粒中使用方法进行了净化可从下Addgene id 186733 - 186735。gydF4y2Ba
FPCount(湿实验室)协议gydF4y2Ba
FPCount协议由calibrant准备了蛋白质化验(蛋白质浓度)和荧光测定蛋白质(活动)。下面在以下部分中描述的每一步。此外,我们提供了分步指导推荐FPCount协议的补充说明gydF4y2Ba5gydF4y2Ba。这个协议由calibrants制备的荧光蛋白在细胞溶解产物由声波降解法和使用ECmax测定蛋白质的分析。这个协议也可以在协议。io,gydF4y2Bahttps://www.protocols.io/view/fpcount-protocol-in-lysate-purification-free-proto-bzudp6s6gydF4y2Ba59gydF4y2Ba。我们还另外两个标定协议对协议细节。io:无花果的完整协议进行。gydF4y2Ba3gydF4y2Ba,利用FP净化和三个蛋白质分析交叉验证,可用gydF4y2Bahttps://www.protocols.io/view/fpcount-protocol-full-protocol-bztsp6negydF4y2Ba60gydF4y2Ba和更短的协议需要净化,但使用ECmax试验,可用gydF4y2Bahttps://www.protocols.io/view/fpcount-protocol-short-protocol-bzt6p6regydF4y2Ba61年gydF4y2Ba。gydF4y2Ba
蛋白表达和收获gydF4y2Ba
荧光蛋白是利用pS381向量(歌曲)表达式gydF4y2Ba大肠杆菌gydF4y2BaBL21 (DE3)菌株。甘油股票被接种到50毫升Luria肉汤(米勒)补充50µg /毫升0.02%氯霉素和阿拉伯糖,一夜之间长大30°C 250 rpm。细胞被转移后~ 16 h prechilled容器在冰上。进一步的步骤都是在冰上进行。OD600读数,和40 OD的细胞被转移到新鲜的猎鹰管,洗一次T50N300(50毫米Tris-HCl pH值7.5,300毫米氯化钠)和resuspended裂解缓冲(T50N300 1 x蛋白酶抑制剂(EDTA-free,皮尔斯A32955),过滤消毒,补充了溶菌酶100µg /毫升)。细胞被分为20 OD(2毫升)分数,用(QSonica Q125超声发生器,幅度50%,10 s, 10 s, 2分钟)。溶菌产物与5毫米CaCl补充gydF4y2Ba2gydF4y2Ba,50 mM MgClgydF4y2Ba2gydF4y2BaDNase对待我(50 U /毫升,牛胰腺MP生物医学,219006210)在4°C 30分钟。可溶性分数被隔离后上层清液离心分离(16000×gydF4y2BaggydF4y2Ba30分钟4°C),分数都是检查通过sds - page其次是染色Coomassie-based染料根据制造商的指示(即时蓝蛋白染色,σISB1L-1L)。gydF4y2Ba
蛋白质纯化gydF4y2Ba
荧光蛋白纯化在批量使用他亲和色谱法在室温下根据树脂制造商的指令(热费希尔)。溶菌产物与10毫米补充咪唑和600年µl应用于HisPur钴树脂(300µl ThermoFisher)平衡在绑定缓冲(咪唑T50N300 +π,10毫米),在室温下混合并孵化~ 15分钟前删除(1000×gydF4y2BaggydF4y2Ba,1分钟)。这是重复四次,前10列卷的树脂被绑定缓冲。蛋白质在洗脱筛选了缓冲区(咪唑T50N300 +π,150毫米)。所有蛋白质分数校准存储受光照在4°C。gydF4y2Ba
准备校准化验gydF4y2Ba
洗脱分数相结合,集中大约10倍使用Amicon离心过滤列(默克,UFC5010),紧随其后的是缓冲区交换(1000 x) T5N15(5毫米Tris-HCl pH值7.5,15毫米氯化钠)或T5N15 +π(T5N15 1 x蛋白酶抑制剂,过滤消毒)。gydF4y2Ba
标仪检测gydF4y2Ba
所有化验进行使用Tecan火花标(使用SparkControl麦哲伦V 3.1软件)除了荧光光谱化验,也进行了使用BMG Clariostar加标(使用Clariostar v5.60和火星v3.40软件)。gydF4y2Ba
校准化验gydF4y2Ba
对于每个FP校准,浓度和荧光检测进行了在同一稀释系列的蛋白质。集中,缓冲交换FP(100µl)在900年被稀释µl缓冲区,然后稀释1:2 500年1.5毫升埃普多夫µl缓冲区。总共有11个稀释准备这样,分成将微型板块(格林尼655801)副本(225µl)。牛血清白蛋白(BSA)标准(从微观BCA蛋白质化验设备,ThermoFisher, 23235)准备在与同一个缓冲区(年代)。这个稀释集当时受到蛋白质浓度和荧光化验。gydF4y2Ba
蛋白质浓度测定:A280化验和ECmax试验gydF4y2Ba
吸光度测定进行了在225年将盘子µl蛋白质,使用火花吸光度扫描方法(见补充方法)。gydF4y2Ba
荧光分析gydF4y2Ba
吸光度扫描后,200年µl从每个原板是转移到清晰的聚苯乙烯板(康宁,3370)。这个盘子是密封(埃普多夫Masterclear实时PCR胶膜,30132947),用于运行引发荧光方法(见补充方法)在所有相关仪器,渠道和收益。gydF4y2Ba
蛋白质浓度测定:microBCA化验gydF4y2Ba
BCA化验使用微BCA蛋白质进行分析工具包(ThermoFisher, 23235)根据制造商的指示(微型板块协议)。短暂,150µl试剂被分配到一个干净的微型板块工作,和150年µl从每个荧光试验板的混合试剂与多通道吸量器。反应是覆盖着一盘密封(BreatheEasy密封膜,σ,Z380059),并受火花microBCA方法(见补充方法)。gydF4y2Ba
荧光素校准gydF4y2Ba
荧光素(热费舍尔R14782, 1毫米在DMSO)稀释至100µM股票的解决方案在100毫米氢氧化钠对荧光素(适当的缓冲)。这只股票(100µl)在900年被稀释µl缓冲区,然后稀释1:2 500年1.5毫升埃普多夫µl缓冲区。总共有11个稀释准备这样,分成明显的聚苯乙烯板(康宁,3370)副本(200µl)。这个盘子是密封(埃普多夫Masterclear实时PCR胶膜,30132947),用于运行引发荧光方法(见补充方法)在适当的滤波器组(例:485/20,em: 535/35)在Tecan火花板读者。使用FPCountR-type函数数据处理有或没有正常化的相对亮度。gydF4y2Ba
相对亮度正常化gydF4y2Ba
比较从不同的FPs或小分子转换因素,我们计算每个分子的相对亮度相比。这个计算尝试正常化calibrants之间不同的荧光特性,即亮度(i),和(2)如何激发和发射光谱重叠与相关仪器滤波器组。励磁的励磁过滤器的效率与20 nm带宽(480海里)的令人兴奋的荧光团拍摄的gydF4y2Ba\({{}交货。{eff}} _ {480/20} = \ mathop{总和\}\ nolimits_{我= 470}^{490}{一}_{\λ=我}\ \)gydF4y2Ba吸光度(gydF4y2Ba\ \ ()gydF4y2Ba)的值,在每一个波长(gydF4y2Ba\λ(\ \)gydF4y2Ba)激发滤光片的带宽(1纳米步骤)总结,使用正常吸光度光谱的最大吸光度被设置为1。排放过滤器的效率与35 nm带宽(325海里)在检测荧光团的荧光被定义为:gydF4y2Ba\ ({{em}。{eff}} _{535/25} = \压裂{\ mathop{总和\}\ nolimits_{我= 522.5}^ {547.5}{{em}} _{\λ=我}}{\总和{{em}} _{\λ=我}}\)gydF4y2Ba,发射荧光的和相关的波长拍摄和正常化的总和总荧光在整个发射光谱。再次,光谱是正常光谱最大的值被设置为1。最后,相对亮度为:gydF4y2Ba相对\ \ ({{;亮度}= {EC} *{}交货。{eff}} _ {480/20} * {{QY} * {em}, {eff}} _ {535/25} \)gydF4y2Ba在哪里gydF4y2Ba\ ({EC} \)gydF4y2Ba消光系数(MgydF4y2Ba−1gydF4y2Ba厘米gydF4y2Ba−1gydF4y2Ba),gydF4y2Ba\ ({QY} \)gydF4y2Ba量子产率。转换因素(gydF4y2Ba\ ({CF} \)gydF4y2Ba在RFU /分子)被转换为正常转换因素(gydF4y2Ba\ ({CFnorm} \)gydF4y2Ba):gydF4y2Ba\ ({CFnorm} = {CF} * \压裂{{{相对\;亮度}}_ {{mGFPmut} 3}}{{{相对\;亮度}}_ {{calibrant}}} \)gydF4y2Ba。gydF4y2Ba
校准OD600和OD700值使用微球gydF4y2Ba
校准光学密度读数用来量化细胞数量(OD600和OD700)是根据出版协议gydF4y2Ba7gydF4y2Ba。所使用的微球单分散二氧化硅微球(Cospheric sio2ms - 2.0、2.0 g / cc, d50 = 0.890µm,简历= 3.2%,双打< 1%)。gydF4y2Ba
细菌timecourse化验gydF4y2Ba
DH10BgydF4y2Ba大肠杆菌gydF4y2Ba转化株种植在M9培养基(M9盐(1 x,σM6030) casamino酸(0.2%)、果糖(0.8%)、盐酸硫胺素(0.25毫克/毫升),MgSOgydF4y2Ba4gydF4y2Ba(2毫米),CaClgydF4y2Ba2gydF4y2Ba(0.1毫米))补充50µg / ml氯霉素,在深井板(30°C, 700 rpm),第二天早晨,稀释到新鲜M9与抗生素(深井板,30°C, 700 rpm) OD600(厘米gydF4y2Ba−1gydF4y2Ba0.05)。1 h后,文化被转移到清晰的96孔酶标(康宁,3370)预装树胶醛醣(5µl)。板密封(BreatheEasy密封膜,σ,Z380059),生长在Tecan火花板读者在动态模式下(见补充方法,引发生长曲线方法)。gydF4y2Ba
统计和再现性gydF4y2Ba
所有sds - page结果提出了手稿是代表的典型实验,至少有两个,但通常更加独立重复显示了类似的结果。gydF4y2Ba
分析方法gydF4y2Ba
使用R版本4.0.3所有数据进行分析gydF4y2Ba62年gydF4y2Ba。FPCountR包开发的FP校准可在GitHub上gydF4y2Bahttps://github.com/ec363/fpcountrgydF4y2Ba63年gydF4y2Ba。补充说明gydF4y2Ba6gydF4y2Ba包括一个关键功能的分析步骤的描述。汇总的功能,见图。gydF4y2Ba1gydF4y2Ba和补充图。gydF4y2Ba15gydF4y2Ba。gydF4y2Ba
荧光扫描gydF4y2Ba
蛋白质的荧光激发和发射光谱进行了使用BMG Clariostar +标在密封板(康宁,3370;埃普多夫Masterclear实时PCR胶膜,30132947)在适当波长FP(见补充方法)。gydF4y2Ba
数据gydF4y2Ba
数据使用RStudio创建和Biorender.com。gydF4y2Ba
报告总结gydF4y2Ba
进一步研究信息设计是可用的gydF4y2Ba自然研究报告摘要gydF4y2Ba与这篇文章有关。gydF4y2Ba
数据可用性gydF4y2Ba
这项研究没有包括数据存放在外部仓库。关键数据集提供了补充表。进一步的数据集提供了本文提供的源数据文件。从FPbase来源于外部数据gydF4y2Bahttps://www.fpbase.org/gydF4y2Ba。质粒生成Addgene FP净化是可用的。摘要生成其他质粒可从作者请求没有限制。gydF4y2Ba源数据gydF4y2Ba本文提供的。gydF4y2Ba
代码的可用性gydF4y2Ba
本研究生产的计算机代码可以在GitHub (gydF4y2Bahttps://github.com/ec363/fpcountrgydF4y2Ba)。gydF4y2Ba
引用gydF4y2Ba
Delvigne, f . et al .改善控制微生物细胞工厂:从单细胞到大规模bioproduction。gydF4y2Ba《。列托语gydF4y2Ba。gydF4y2Ba365年gydF4y2Ba1 - 11 (2018)。gydF4y2Ba
比尔,j . et al .长途旅行对标准工程生物系统:是分子生物学和生物技术的社区准备标准化?gydF4y2BaEMBO代表gydF4y2Ba。gydF4y2Ba21gydF4y2Bae50521 (2020)。gydF4y2Ba
Perrino G。,Hadjimitsis, A., Ledesma-Amaro, R. & Stan, G.-B. Control engineering and synthetic biology: working in synergy for the analysis and control of microbial systems.咕咕叫。当今。Microbiol。gydF4y2Ba62年gydF4y2Ba,68 - 75 (2021)。gydF4y2Ba
Chalfie, M。你,Y。,Euskirchen, G., Ward, W. W. & Prasher, D. C. Green fluorescent protein as a marker for gene expression.科学gydF4y2Ba263年gydF4y2Ba,802 - 805 (1994)。gydF4y2Ba
罗德里格斯,e·a . et al。生长和发光的荧光和光敏蛋白的工具箱。gydF4y2Ba学生物化学的发展趋势。科学。gydF4y2Ba42gydF4y2Ba,111 - 129 (2017)。gydF4y2Ba
比尔,j . et al .量化使用独立calibrants细菌荧光。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba13gydF4y2Bae0199432 (2018)。gydF4y2Ba
Fedorec, a . j . H。罗宾逊,c . M。,Wen, K. Y. & Barnes, C. P. FlopR: an open source software package for calibration and normalization of plate reader and flow cytometry data.ACS合成器。医学杂志。gydF4y2Ba9gydF4y2Ba,2258 - 2266 (2020)。gydF4y2Ba
Gorochowski, t . e . et al .平移的绝对量化监管和负担使用结合测序方法。gydF4y2Ba摩尔。系统。医学杂志。gydF4y2Ba15gydF4y2Bae8719 (2019)。gydF4y2Ba
Boada, y . et al .表征基因电路部分基于多目标优化的使用标准校准测量。gydF4y2BaChemBioChemgydF4y2Ba20.gydF4y2Ba,2653 - 2665 (2019)。gydF4y2Ba
Vignoni, a . et al .荧光标定和颜色等效为定量合成生物学。gydF4y2BaIFAC-Pap。gydF4y2Ba52gydF4y2Ba,129 - 134 (2019)。gydF4y2Ba
谷口,y . et al .量化gydF4y2Ba大肠杆菌gydF4y2Ba蛋白质组和转录组与单分子敏感性单身。gydF4y2Ba细胞gydF4y2Ba329年gydF4y2Ba8 (2010)。gydF4y2Ba
菲南,K。,Raulf, A. & Heilemann, M. A set of homo-oligomeric standards allows accurate protein counting.Angew。化学。Int。。gydF4y2Ba54gydF4y2Ba,12049 - 12052 (2015)。gydF4y2Ba
领带,h . C。,Madugula, V. & Lu, L. The development of a single molecule fluorescence standard and its application in estimating the stoichiometry of the nuclear pore complex.物化学。Biophys。Commun >,gydF4y2Ba478年gydF4y2Ba,1694 - 1699 (2016)。gydF4y2Ba
广州,B。,Labno, A. & Endy, D. Refinement and standardization of synthetic biological parts and devices.生物科技Nat。》。gydF4y2Ba26gydF4y2Ba,787 - 793 (2008)。gydF4y2Ba
赫斯特,c, D。,Ainsworth, C., Baldwin, G., Kitney, R. I. & Freemont, P. S. In碳氢化合物和油脂微生物学协议gydF4y2Ba(eds。McGenity, t·J。,Timmis, K. N. & Nogales, B.) 9–26 (Springer Berlin Heidelberg, 2015).
高贵的,j·E。,Knight, A. E., Reason, A. J., Di Matola, A. & Bailey, M. J. A. A comparison of protein quantitation assays for biopharmaceutical applications.生物科技摩尔。》。gydF4y2Ba37gydF4y2Ba,99 - 111 (2007)。gydF4y2Ba
速度,c . N。,Vajdos, F., Fee, L., Grimsley, G. & Gray, T. How to measure and predict the molar absorption coefficient of a protein.蛋白质科学。gydF4y2Ba4gydF4y2Ba,2411 - 2423 (1995)。gydF4y2Ba
撒迦利亚,d . A。,小提琴,j . D。,Newton, A. C. & Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells.科学gydF4y2Ba296年gydF4y2Ba,913 - 916 (2002)。gydF4y2Ba
沙:C。,Steinbach, P. A. & Tsien, R. Y. A guide to choosing fluorescent proteins.Nat方法。gydF4y2Ba2gydF4y2Ba,905 - 909 (2005)。gydF4y2Ba
热费希尔科学。NanoDrop 1000分光光度计,V3.8用户手册。gydF4y2Bahttps://tools.thermofisher.com/content/sfs/manuals/nd - 1000 v3.8 -用户- 205 x11.pdf手册- 8%gydF4y2Ba(2010)。gydF4y2Ba
兰伯特,t . j . FPbase: community-editable荧光蛋白数据库。gydF4y2BaNat方法。gydF4y2Ba16gydF4y2Ba,277 - 278 (2019)。gydF4y2Ba
史蒂文森K。,McVey, A. F., Clark, I. B. N., Swain, P. S. & Pilizota, T. General calibration of microbial growth in microplate readers.科学。代表。gydF4y2Ba6gydF4y2Ba38828 (2016)。gydF4y2Ba
比尔,j . et al .稳健估计光密度的细菌细胞计数。gydF4y2BaCommun。医学杂志。gydF4y2Ba3gydF4y2Ba512 (2020)。gydF4y2Ba
Volkmer, b & Heinemann, m . Condition-dependent细胞体积和浓度gydF4y2Ba大肠杆菌gydF4y2Ba为了方便数据转换为系统生物学建模。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba6gydF4y2Bae23126 (2011)。gydF4y2Ba
张,C。,Liu, M.-S., Han, B. & Xing, X.-H. Correcting for the inner filter effect in measurements of fluorescent proteins in high-cell-density cultures.肛交。物化学。gydF4y2Ba390年gydF4y2Ba,197 - 202 (2009)。gydF4y2Ba
Ishihama, y . et al。蛋白质的丰度分析gydF4y2Ba大肠杆菌gydF4y2Ba胞质。gydF4y2BaBMC基因组学gydF4y2Ba9gydF4y2Ba102 (2008)。gydF4y2Ba
Arike, l . et al . label-free绝对蛋白质组的比较和应用量化方法gydF4y2Ba大肠杆菌gydF4y2Ba。gydF4y2Baj . Proteom。gydF4y2Ba75年gydF4y2Ba,5437 - 5448 (2012)。gydF4y2Ba
李,G.-W。,Burkhardt, D., Gross, C. & Weissman, J. S. Quantifying absolute protein synthesis rates reveals principles underlying allocation of cellular resources.细胞gydF4y2Ba157年gydF4y2Ba,624 - 635 (2014)。gydF4y2Ba
赫克特,一个。,Endy, D., Salit, M. & Munson, M. S. When wavelengths collide: bias in cell abundance measurements due to expressed fluorescent proteins.ACS合成器。医学杂志。gydF4y2Ba5gydF4y2Ba,1024 - 1027 (2016)。gydF4y2Ba
卡萨德沃尔,a &方,f . c .严格的科学:驾车指南。gydF4y2BamBiogydF4y2Ba7gydF4y2Bae01902-16 (2016)。gydF4y2Ba
Raynal B。,Lenormand, P., Baron, B., Hoos, S. & England, P. Quality assessment and optimization of purified protein samples: why and how?活细胞。细胞工厂gydF4y2Ba13gydF4y2Ba180 (2014)。gydF4y2Ba
绿色,m . r . & Sambrook J。gydF4y2Ba分子克隆:实验室手册gydF4y2Ba(冷泉港实验室出版社,2012年)。gydF4y2Ba
张,C。,Xing, X.-H. & Lou, K. Rapid detection of a GFP-marked Enterobacter aerogenes under anaerobic conditions by aerobic fluorescence recovery.《。列托人。gydF4y2Ba249年gydF4y2Ba,211 - 218 (2005)。gydF4y2Ba
Le Guern F。,Mussard, V., Gaucher, A., Rottman, M. & Prim, D. Fluorescein derivatives as fluorescent probes for pH monitoring along recent biological applications.Int。j .摩尔。科学。gydF4y2Ba21gydF4y2BaE9217 (2020)。gydF4y2Ba
Lichten, c。,白色,R。,Clark, I. B. & Swain, P. S. Unmixing of fluorescence spectra to resolve quantitative time-series measurements of gene expression in plate readers.生物科技BMC》。gydF4y2Ba14gydF4y2Ba11 (2014)。gydF4y2Ba
威尔,j·l . j . c . & Slonczewski pH值的细胞质和周质gydF4y2Ba大肠杆菌gydF4y2Ba:绿色荧光蛋白荧光法快速测量。gydF4y2Baj . Bacteriol。gydF4y2Ba189年gydF4y2Ba,5601 - 5607 (2007)。gydF4y2Ba
模特全,M。,Farinas, J., Li, Y. & Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator.Biophys。J。gydF4y2Ba74年gydF4y2Ba,1591 - 1599 (1998)。gydF4y2Ba
罗伯茨,t . m . et al . pH-stable GFP的识别和描述。gydF4y2Ba科学。代表。gydF4y2Ba6gydF4y2Ba28166 (2016)。gydF4y2Ba
书面羊皮,m . et al .膨胀细菌细胞的蛋白质合成增加。gydF4y2Ba摩尔。系统。医学杂志。gydF4y2Ba11gydF4y2Ba836 (2015)。gydF4y2Ba
Ceroni F。,Algar, R., Stan, G.-B. & Ellis, T. Quantifying cellular capacity identifies gene expression designs with reduced burden.Nat方法。gydF4y2Ba12gydF4y2Ba,415 - 418 (2015)。gydF4y2Ba
嘘,一个。,Ellis, T. & Stan, G.-B. Host-aware synthetic biology.咕咕叫。当今。系统。医学杂志。gydF4y2Ba14gydF4y2Ba,66 - 72 (2019)。gydF4y2Ba
Schaechter, M。,MaalØe, O. & Kjeldgaard, N. O. Y. Dependency on medium and temperature of cell size and chemical composition during balanced growth of Salmonella typhimurium.微生物学gydF4y2Ba19gydF4y2Ba,592 - 606 (1958)。gydF4y2Ba
布鲁姆,r . J。,Winkler, S. M. & Smolke, C. D. A quantitative framework for the forward design of synthetic miRNA circuits.Nat方法。gydF4y2Ba11gydF4y2Ba,1147 - 1153 (2014)。gydF4y2Ba
Siegal-Gaskins D。Tuza z, A。金,J。,Noireaux, V. & Murray, R. M. Gene circuit performance characterization and resource usage in a cell-free “breadboard”.ACS合成器。医学杂志。gydF4y2Ba3gydF4y2Ba,416 - 425 (2014)。gydF4y2Ba
Cranfill, p . j . et al .荧光蛋白的定量评估。gydF4y2BaNat方法。gydF4y2Ba13gydF4y2Ba,557 - 562 (2016)。gydF4y2Ba
正义,S。,Hunstad, D. A., Cegelski, L. & Hultgren, S. J. Morphological plasticity as a bacterial survival strategy.启Microbiol Nat。gydF4y2Ba6gydF4y2Ba,162 - 168 (2008)。gydF4y2Ba
斯文森主持,S。,Zimprich, C., McDougall, M. G., Klaubert, D. H. & Los, G. V. Spatial separation and bidirectional trafficking of proteins using a multi-functional reporter.BMC细胞杂志。gydF4y2Ba9gydF4y2Ba,17 (2008)。gydF4y2Ba
李,c . et al . Fluorogenic探索膜蛋白贩运。gydF4y2BaBioconjug。化学。gydF4y2Ba29日gydF4y2Ba,1823 - 1828 (2018)。gydF4y2Ba
Csibra如是说。,Renders, M. & Pinheiro, V. Bacterial cell display as a robust and versatile platform for the engineering of low affinity ligands and enzymes.ChemBioChemgydF4y2Ba。gydF4y2Ba21gydF4y2Ba,2844 - 2853 (2020)。gydF4y2Ba
Streett h·E。,Kalis, K. M. & Papoutsakis, E. T. A strongly fluorescing anaerobic reporter and protein-tagging system for梭状芽胞杆菌gydF4y2Ba基于fluorescence-activating生物和absorption-shifting标记蛋白质(快)。gydF4y2Ba达成。环绕。MicrobiolgydF4y2Ba。gydF4y2Ba85年gydF4y2Bae00622-19 (2019)。gydF4y2Ba
Charubin, K。,Streett, H. & Papoutsakis, E. T. Development of strong anaerobic fluorescent reporters for Clostridium acetobutylicum and Clostridium ljungdahlii using HaloTag and SNAP-tag proteins.达成。环绕。MicrobiolgydF4y2Ba。gydF4y2Ba86年gydF4y2Bae01271-20 (2020)。gydF4y2Ba
Pothoulakis G。Ceroni F。,Reeve, B. & Ellis, T. The spinach RNA aptamer as a characterization tool for synthetic biology.ACS合成器。医学杂志。gydF4y2Ba3gydF4y2Ba,182 - 187 (2014)。gydF4y2Ba
Yerramilli v . s . &金,k h .标签使用孔雀石绿在活细胞中rna适配子支架作为荧光探针。gydF4y2BaACS合成器。医学杂志。gydF4y2Ba7gydF4y2Ba,758 - 766 (2018)。gydF4y2Ba
沙:c . et al .改进单体的红色,橙色和黄色荧光蛋白来源于Discosoma sp.红色荧光蛋白。gydF4y2Ba生物科技Nat。》。gydF4y2Ba22gydF4y2Ba,1567 - 1572 (2004)。gydF4y2Ba
Cormack, b P。,Valdivia, R. H. & Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP).基因gydF4y2Ba173年gydF4y2Ba33-38 (1996)。gydF4y2Ba
Subach, o . M。,Cranfill, P. J., Davidson, M. W. & Verkhusha, V. V. An enhanced monomeric blue fluorescent protein with the high chemical stability of the chromophore.《公共科学图书馆•综合》gydF4y2Ba6gydF4y2Bae28674 (2011)。gydF4y2Ba
Silva-Rocha, r . et al .欧洲标准向量架构(歌曲):一个连贯的平台的分析和部署复杂的原核生物的表型。gydF4y2Ba核酸Res。gydF4y2Ba41gydF4y2BaD666-D675 (2013)。gydF4y2Ba
Mogk,。,Schmidt, R. & Bukau, B. The N-end rule pathway for regulated proteolysis: prokaryotic and eukaryotic strategies.细胞生物的趋势。gydF4y2Ba17gydF4y2Ba,165 - 172 (2007)。gydF4y2Ba
Csibra如是说。e . &斯坦G.-B。FPCount protocol-in-lysate净化(免费的)协议。gydF4y2Baprotocols.io。gydF4y2Bahttps://doi.org/10.17504/protocols.io.bzudp6s6gydF4y2Ba(2021)。gydF4y2Ba
Csibra如是说。e . &斯坦G.-B。FPCount protocol-Full协议。gydF4y2Baprotocols.io。gydF4y2Bahttps://doi.org/10.17504/protocols.io.bztsp6negydF4y2Ba(2021)。gydF4y2Ba
Csibra如是说。e . &斯坦G.-B。FPCount protocol-Short协议。gydF4y2Baprotocols.io。gydF4y2Bahttps://doi.org/10.17504/protocols.io.bzt6p6regydF4y2Ba。(2021)。gydF4y2Ba
R核心团队。接待员:统计计算的R项目。gydF4y2Bahttps://www.r-project.org/gydF4y2Ba(2021)。gydF4y2Ba
Csibra如是说大肠FPCountR:荧光蛋白校准板读者。gydF4y2Bahttps://doi.org/10.5281/zenodo.5760028gydF4y2Ba(2021)。gydF4y2Ba
确认gydF4y2Ba
G.B.S.和提到过承认资助英国皇家工程院(RAEng CiET 1819 \ 5)。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
提到过和G.B.S.构思。提到过进行了实验,分析数据,并写了R包。提到过,G.B.S.写了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称没有利益冲突。gydF4y2Ba
同行评审gydF4y2Ba
同行审查的信息gydF4y2Ba
自然通讯gydF4y2Ba感谢匿名审稿人(s)为他们的贡献的同行评审工作。gydF4y2Ba同行审查报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然保持中立在发表关于司法主权地图和所属机构。gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到Creative Commons许可,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
Csibra如是说。,Stan, GB. Absolute protein quantification using fluorescence measurements with FPCountR.Nat CommungydF4y2Ba13gydF4y2Ba6600 (2022)。https://doi.org/10.1038/s41467 - 022 - 34232 - 6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467 - 022 - 34232 - 6gydF4y2Ba
评论gydF4y2Ba
通过提交评论你同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果你发现一些滥用或不符合我们的条件或准则请国旗是不合适的。gydF4y2Ba