摘要gydF4y2Ba
尽管目前已获批准的疫苗在降低COVID-19严重疾病风险方面取得了成功,但迅速出现的病毒变异继续推动大流行感染浪潮,造成众多全球公共卫生挑战。进展将取决于预防性疫苗活性的未来进展,包括能够产生更有效的交叉反应性T细胞诱导和持久的交叉反应性抗体反应的候选疫苗的进展。我们在小鼠和非人灵长类动物(NHPs)中评估了与SARS-CoV-2 Spike受体结合结构域(RBD)免疫原混合的两亲和力(AMP)佐剂AMP- cpg作为淋巴结靶向蛋白亚单位疫苗(ELI-005)。amp介导的靶向CpG DNA引流淋巴结导致全面的局部免疫激活,其特征为广泛的转录重编程,炎症蛋白组学环境,以及先天性免疫细胞的激活作为抗原导向的适应性免疫的关键协调者。AMP-CpG在小鼠体内的启动免疫诱导了对预防效果和预防严重疾病至关重要的多个解剖部位的强而持久的T细胞反应。长期记忆反应在再次暴露于抗原后迅速扩大。同时,RBD特异性抗体寿命长,并表现出对变体RBD的交叉反应性识别。amp - cpg佐剂的启动-增强免疫在NHPs中是安全且耐受性良好的,同时促进产生多细胞因子的循环T细胞反应在关注的变体(VOC)之间交叉反应。淋巴结中rbd特异性生发中心(GC) B细胞的扩张与快速血清转化相关,变异特异性中和抗体反应超过恢复期人血浆中的反应。这些结果证明了淋巴结佐剂靶向协调先天免疫和产生强大的适应性反应对疫苗效力至关重要的希望。gydF4y2Ba
简介gydF4y2Ba
2019年冠状病毒病(COVID-19)大流行不断演变,导致全球卫生持续面临挑战,尽管广泛使用了有效疫苗,但全球范围内的感染浪潮仍推动了显著的发病率和死亡率gydF4y2Ba1gydF4y2Ba.随着病毒传染性的增加,引起关注的病毒变异(VOC)的连续出现gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,以及能够部分逃脱中和抗体的突变gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba已被证明是成功控制病毒传播的重大挑战。虽然目前批准的疫苗继续提供预防住院和严重疾病的宝贵保护,但尽管疫苗接种覆盖率很高,但仍观察到社区病毒传播率很高gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.值得注意的是,尽管有证据表明疫苗诱导的中和抗体滴度可能迅速下降,并且观察到对近期VOC的活性降低,但严重疾病的预防似乎持续存在gydF4y2Ba9gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.因此,中和抗体滴度被认为是批准疫苗保护的主要相关因素gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba在没有消毒免疫的情况下,对疾病最坏结果的有效长期保护可能依赖于强健的记忆B和交叉反应性T细胞反应,它们能够快速重新激活,以遏制新生的病毒感染。促进具有这些免疫特征的反应的疫苗可以改善患者的预后,同时还可以防止由于增加暴露于自然人畜共患宿主而导致的未来冠状病毒病原体的出现。gydF4y2Ba
我们之前报道了ELI-005的开发,这是一种蛋白亚单位疫苗,将Spike受体结合结构域(RBD)蛋白与淋巴结靶向TLR-9激动剂AMP-CpG结合,由与CpG DNA结合的二酰基脂质组成gydF4y2Ba17gydF4y2Ba.RBD免疫原包含体液免疫和细胞免疫的靶点gydF4y2Ba18gydF4y2Ba分子大小(34 kDa)预测皮下给药后淋巴结积聚gydF4y2Ba17gydF4y2Ba,gydF4y2Ba19gydF4y2Ba.传统的低分子量(<20 kDa)疫苗佐剂在外周给药后很容易被吸收到循环血液中,amp修饰已知可通过与注射部位组织白蛋白的非共价结合促进淋巴结积累gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.因此,amp引导的疫苗成分向引流淋巴结的生物分布可以显著改善向关键免疫细胞的传递,并参与协调免疫反应的大小和质量的机制,同时限制暴露于免疫无关的部位或耐受通过血液清除的制剂优先到达的部位。此前,这种方法在ELI-005中的应用促进了高效的rbd特异性T细胞和中和抗体反应,在小鼠中采用三剂量免疫方案,证明淋巴结靶向疫苗有可能产生细胞和体液反应的诱人平衡免疫gydF4y2Ba17gydF4y2Ba.gydF4y2Ba
在这里,我们描述了ELI-005在小鼠中的进一步评估,包括开发一种简化的启动-促进方案,以快速诱导voc定向的交叉反应性抗体滴度以及高效的T细胞反应。通过比较可溶性和AMP-CpG,我们探讨了引流淋巴结中先天性免疫反应激活的差异潜在机制及其对佐剂有效靶向淋巴结的依赖。我们还评估了ELI-005在恒河猴中的T细胞和体液免疫原性,作为人类受试者潜在安全性和活性的预测模型。gydF4y2Ba
结果gydF4y2Ba
AMP-CpG促进小鼠强烈而持久的细胞和体液抗sars - cov -2反应gydF4y2Ba
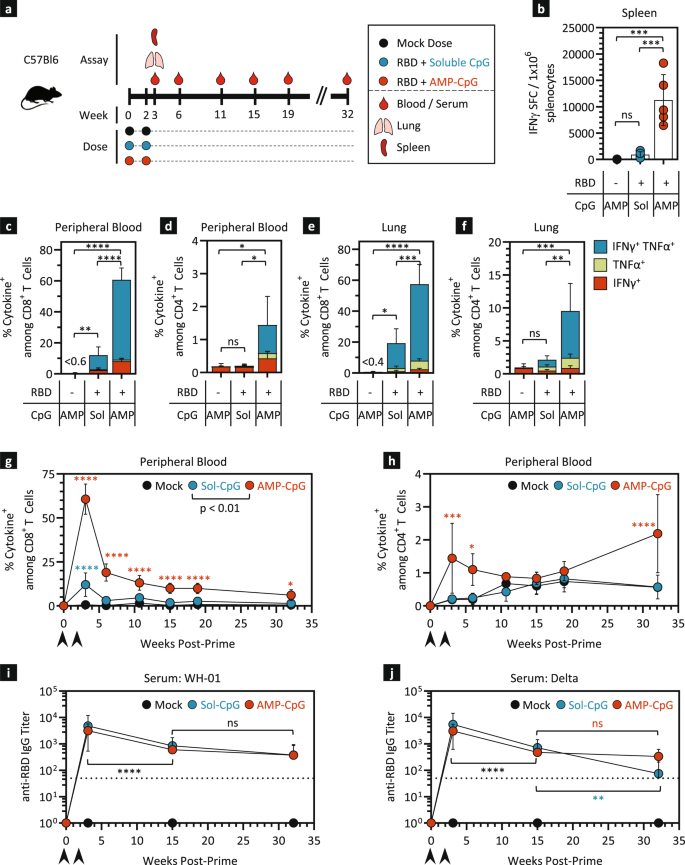
先前对ELI-005的评估表明,在小鼠三剂量免疫方案后,ELI-005可有效诱导rbd特异性免疫,其特征为高频外周和组织常驻T细胞反应,以及持久的中和抗体滴度gydF4y2Ba17gydF4y2Ba.为了提高ELI-005免疫用于潜在临床转导的可行性,我们评估了在第0周和第2周使用10µg Wuhan-Hu-1 (WH-01) SARS-CoV-2 Spike RBD混合CpG DNA佐剂的初始-增强方案。gydF4y2Ba1gydF4y2Ba).为了评估amp修饰对诱导免疫应答的大小和寿命的重要性,用1 nmol AMP-CpG(由与CpG-7909 DNA结合的二酰基脂质组成)或未修饰的可溶性CpG类似物给RBD抗原。在增加剂量后一周检测细胞和体液反应,以表征急性反应,并在32周内纵向评估长期免疫持久性,如图所示。gydF4y2Ba1gydF4y2Ba.与可溶性CpG处理的小鼠相比,用ELI-005免疫的小鼠,包括AMP-CpG,脾脏IFNγ斑点形成细胞(SFCs)的数量增加了12倍。gydF4y2Ba1 bgydF4y2Ba).同样,与可溶性CpG接种相比,AMP-CpG诱导显著增加了rbd特异性细胞因子产生CD8gydF4y2Ba+gydF4y2Ba在体外直接使用重叠的RBD肽刺激后,外周血中的T细胞增加(图2)。gydF4y2Ba1 cgydF4y2Ba).CD4评估gydF4y2Ba+gydF4y2Ba外周血中的T细胞表现出类似的反应层次,仅AMP-CpG免疫诱导rbd特异性细胞因子的频率显著增加gydF4y2Ba+gydF4y2Ba细胞(图。gydF4y2Ba1 dgydF4y2Ba).在CD8中也观察到类似的趋势gydF4y2Ba+gydF4y2Ba和CD4gydF4y2Ba+gydF4y2Ba从灌注的肺组织中分离出的T细胞,这是常驻T细胞免疫的一个重要部位,有助于早期发现和调解新生病毒感染(图。gydF4y2Ba1 e, fgydF4y2Ba).考虑到AMP-CpG在初始-增强方案后促进显著增强的峰值免疫反应的强度,以及长寿命免疫保护的重要性,对免疫原性进行了长达32周的纵向测量。AMP-CpG免疫小鼠的循环rbd特异性CD8水平较高gydF4y2Ba+gydF4y2Ba细胞因子gydF4y2Ba+gydF4y2Ba在整个评估期间,与可溶性CpG或mock免疫的动物相比(图2)。gydF4y2Ba1 g hgydF4y2Ba).总之,这些结果证明了ELI-005启动-增强免疫的效力和AMP-CpG在促进多种组织中显著增强和持久的细胞免疫的关键作用,这对潜在的预防性保护或调节疾病严重程度至关重要。gydF4y2Ba
一个gydF4y2Ba图示显示动物给药和实验时间表。C57Bl/6 J小鼠分别用10µg WH-01 Spike RBD蛋白和1 nmol可溶性或AMP-CpG免疫2次。gydF4y2BabgydF4y2Ba在加强剂量后7天,用Spike RBD OLPs重新刺激脾细胞,并通过ELISpot检测IFNγ的产生。所示为IFNγ SFCs每1 × 10的频率gydF4y2Ba6gydF4y2Ba脾细胞。流式细胞术分析CD8细胞因子的产生gydF4y2Ba+gydF4y2Ba(gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba)和CD4gydF4y2Ba+gydF4y2BaT细胞(gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba).所示为细胞因子百分比gydF4y2Ba+gydF4y2BaCD8之间的细胞gydF4y2Ba+gydF4y2Ba或CD4gydF4y2Ba+gydF4y2BaT细胞:外周血加强剂量后7天的峰值反应(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba),以及灌注的肺组织(gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba)和超过32周的外周血纵向分析(gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba).测定WH-01 RBD血清抗RBD IgG滴度(gydF4y2Ba我gydF4y2Ba)及Delta RBD (gydF4y2BajgydF4y2Ba)的蛋白质。模拟疫苗含有AMP-CpG,不添加抗原。所示值为均值±标准差。gydF4y2Ba*gydF4y2BapgydF4y2Ba< 0.05,gydF4y2Ba**gydF4y2BapgydF4y2Ba< 0.01,gydF4y2Ba***gydF4y2BapgydF4y2Ba< 0.001,gydF4y2Ba****gydF4y2BapgydF4y2Ba细胞因子经单因素方差分析< 0.0001,Tukey事后分析gydF4y2Ba+gydF4y2BaT细胞频率或抗体滴度(gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BajgydF4y2Ba).gydF4y2Ba
体液反应的长期评估显示,可溶性和AMP-CpG免疫组在prime-boost免疫后血清转化迅速。针对免疫抗原WH-01 RBD和Delta RBD的血清IgG抗体滴度在加强免疫后不久达到峰值,并在本研究期间保持在高水平(图2)。gydF4y2Ba1 i, jgydF4y2Ba).总的来说,这些数据表明,与AMP-CpG佐剂的ELI-005产生了有效的交叉反应性体液免疫反应,并长期保持在显著水平。gydF4y2Ba
AMP-CpG诱导T细胞记忆反应,在抗原再次暴露时迅速扩大gydF4y2Ba
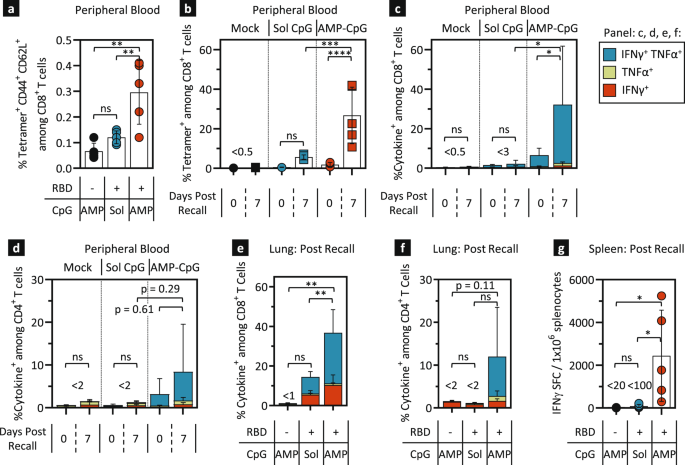
循环的rbd特异性T细胞在增强后的持续存在表明ELI-005促进了持久记忆T细胞的发育。对这种长寿命T细胞群的分析显示,循环rbd特异性四聚体的数量显著增加gydF4y2Ba+gydF4y2Ba带有CD44的细胞gydF4y2Ba+gydF4y2BaCD62LgydF4y2Ba+gydF4y2BaCD8的中央记忆表型gydF4y2Ba+gydF4y2BaT细胞。AMP-CpG疫苗诱导的应答比可溶性CpG比较组大2.5倍(图2)。gydF4y2Ba2gydF4y2Ba),这表明效应T细胞在未来接触SARS-CoV-2时可能会更快地扩张。因此,我们在增强后17周皮下注射10µg WH-01 RBD后,研究了抗原再暴露后的回忆反应。7天后分析的循环血液中的回忆反应证实了rbd特异性CD8的快速扩增gydF4y2Ba+gydF4y2BaELI-005免疫动物中的T细胞(14倍,从攻击前的1.9%到召回后的26.8%,图。gydF4y2Ba2 bgydF4y2Ba).相比之下,可溶性CpG免疫小鼠的回忆反应显著降低,表明AMP-CpG免疫动物的长期记忆反应扩展具有实质性优势。gydF4y2Ba
C57Bl/6 J小鼠(gydF4y2BangydF4y2Ba= 5)分别用10µg WH-01 RBD蛋白和1 nmol可溶性或AMP-CpG免疫2次。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba第2次给药17周后,采集血液以达到预召回时间点,第二天皮下注射10µg WH-01 RBD蛋白,7天后第二次采血。gydF4y2Ba一个gydF4y2Ba攻毒前外周血白细胞CD44和CD62L染色。图示为四聚体的百分比gydF4y2Ba+gydF4y2BaCD44gydF4y2Ba+gydF4y2BaCD62LgydF4y2Ba+gydF4y2BaCD8之间的细胞gydF4y2Ba+gydF4y2BaT细胞。gydF4y2BabgydF4y2Ba外周血CD8gydF4y2Ba+gydF4y2Ba攻毒前后收集的T细胞用Spike RBD特异性四聚体染色,流式细胞术分析。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba给药2后30周,小鼠皮下注射10µg WH-01 RBD蛋白,7天后进行检测。CD8gydF4y2Ba+gydF4y2Ba从血液中采集的T细胞(gydF4y2BacgydF4y2Ba)及灌注肺(gydF4y2BaegydF4y2Ba)和CD4细胞gydF4y2Ba+gydF4y2Ba从血液中采集的T细胞(gydF4y2BadgydF4y2Ba)及灌注肺(gydF4y2BafgydF4y2Ba)用WH-01 RBD OLPs刺激,流式细胞仪检测细胞内细胞因子。gydF4y2BaggydF4y2Ba用WH-01 RBD OLPs重新刺激脾细胞,elisa法检测IFNγ的产生。模拟疫苗含有AMP-CpG,不添加抗原。所示值为均值±标准差。gydF4y2Ba*gydF4y2BapgydF4y2Ba
考虑到在刺激后17周观察到的强大T细胞回忆反应,在刺激后30周,另一组动物被召回。CD8gydF4y2Ba+gydF4y2Ba和CD4gydF4y2Ba+gydF4y2Ba用10µg皮下WH-01 RBD抗原在召回前和召回后7天测量T细胞反应。在AMP-CpG免疫的动物外周血中,产生多功能细胞因子CD8的百分比gydF4y2Ba+gydF4y2Ba和CD4gydF4y2Ba+gydF4y2Ba攻毒后T细胞分别增加5倍至32%和近3倍至8.5%(图。gydF4y2Ba2 c, dgydF4y2Ba).而CD8只有2.3%gydF4y2Ba+gydF4y2Ba1.3%的CD4gydF4y2Ba+gydF4y2Ba显示细胞因子的T细胞gydF4y2Ba+gydF4y2Ba可溶性CpG组表型。值得注意的是,长期CD8gydF4y2Ba+gydF4y2Ba和CD4gydF4y2Ba+gydF4y2Ba在AMP-CpG免疫32周后,即使在它们被召回后,应答仍然高于可溶性CpG组的应答水平。gydF4y2Ba
分析了对SARS-CoV-2进入点和全身保护重要的组织中的细胞免疫反应。在第32周WH-01 RBD攻毒后7天,对免疫小鼠灌注的肺组织和脾脏进行分析。原AMP-CpG免疫动物的抗原召回诱导大量肺常驻T细胞分泌多功能细胞因子。在这些动物中,37%的CD8gydF4y2Ba+gydF4y2BaT细胞(图;gydF4y2Ba2 egydF4y2Ba)和12%的CD4细胞gydF4y2Ba+gydF4y2BaT细胞(图;gydF4y2Ba2 fgydF4y2Ba)分泌细胞因子,而可溶性CpG处理的小鼠分别为14%和<2%。在脾脏中也观察到类似的趋势,AMP-CpG免疫产生的平均频率接近2500 IFNγ SFC / 10gydF4y2Ba6gydF4y2Ba每10个脾细胞反对<100个IFNγ SFCgydF4y2Ba6gydF4y2Ba可溶性CpG组脾细胞。这些数据表明,amp - cpg辅助的ELI-005产生了强大而持久的T细胞记忆群,在再次暴露于SARS-CoV-2抗原后,这些T细胞记忆群可以迅速而有效地扩大,在免疫监测和疾病控制的重要位点提供强大的长期细胞免疫。在回忆后7天,体液反应没有显示出血清滴度的增加,这表明抗体回忆反应可能滞后于T细胞(补充图)。gydF4y2BaS1a bgydF4y2Ba).RBD的鼻内刺激也导致RBD特异性细胞因子产生CD8水平的增加gydF4y2Ba+gydF4y2Ba和CD4gydF4y2Ba+gydF4y2Ba灌注肺样本中的T细胞表明,疫苗诱导的反应可能在病毒进入部位的局部抗原暴露后被有力地召回(补充图)。gydF4y2BaS2gydF4y2Ba).gydF4y2Ba
ELI-005在长时间内高度稳定gydF4y2Ba
先前的数据证明了eli -005诱导免疫的效力和持久性。然而,支持大规模免疫运动的全球疫苗分发需要在接近环境温度下的稳定性,而不依赖于超低温储存供应链。为了检验ELI-005的稳定性,进行了一项免疫原性研究,在给药前将配制好的疫苗剂量在普通冰箱温度(4°C)下储存2-4周或在室温(22°C)下储存3天。第二次免疫一周后,评估动物的细胞和体液免疫反应。产生CD8的细胞因子gydF4y2Ba+gydF4y2Ba和CD4gydF4y2Ba+gydF4y2Ba外周血和肺中的T细胞以及血清抗体滴度显示出与图中观察到的几乎相同的趋势。gydF4y2Ba1gydF4y2Ba注射前新鲜配制剂量(补充图。gydF4y2BaS3a-egydF4y2Ba).这表明ELI-005有可能在储存条件下保持免疫原性,从而实现有效的全球分销,而无需昂贵和不切实际的物流需求。gydF4y2Ba
AMP-CpG在引流淋巴结中刺激免疫编排的全面转录编程gydF4y2Ba
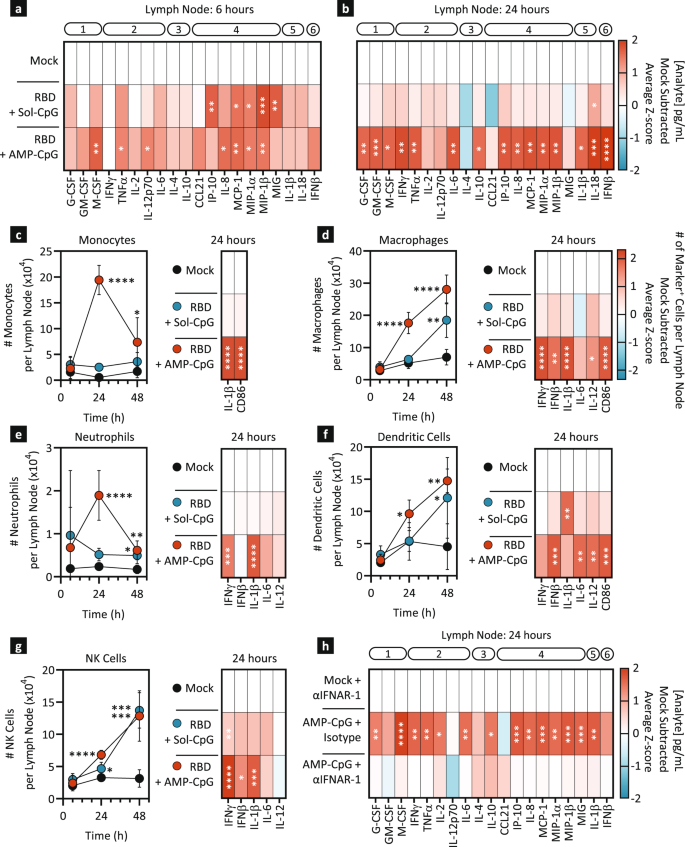
ELI-005增强的免疫原性与过去观察到的AMP-CpG在体内输送到引流淋巴结的改善有关gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.为了进一步探索由此产生的免疫生物学,在使用纳米线引流淋巴结时评估了568个免疫相关基因转录本的综合小组。将WH-01 RBD与可溶性或AMP-CpG混合免疫小鼠一次,并评估引流腹股沟淋巴结在指定时间点对基因转录的差异调节(图2)。gydF4y2Ba3gydF4y2Ba).用AMP-CpG处理的小鼠早在免疫后2小时就表现出急性和显著的炎症趋化因子mRNA上调(补充图。gydF4y2BaS4a-cgydF4y2Ba),包括gydF4y2BaCcl3gydF4y2Ba(MIP-1α),gydF4y2BaCcl12gydF4y2Ba(MCP-5)和gydF4y2BaCxcl10gydF4y2Ba(IP-10),是单核细胞、巨噬细胞和树突状细胞(DCs)的重要化学引诱剂。这一趋势持续到6小时,当额外的趋化因子gydF4y2BaCcl7gydF4y2Ba(MCP-3)和gydF4y2BaCcl9gydF4y2Ba(MIP-1γ)被检测到,这可能增强了专业APCs向淋巴结的趋化募集(图。gydF4y2Ba3 bgydF4y2Ba和补充图。gydF4y2BaS4d egydF4y2Ba).相比之下,可溶性CpG处理的小鼠显示出非常有限的趋化因子转录谱仅限于gydF4y2BaCcl12gydF4y2Ba(MCP-5)。AMP-CpG处理的淋巴结在24小时内表现出全面的转录激活,反映了对下游适应性免疫原性至关重要的强大先天免疫活性的多个轴(图。gydF4y2Ba3汉英gydF4y2Ba).特别感兴趣的是转录特征,表明apc的涌入,为病原体识别做好了准备(例如,gydF4y2BaTlr3/4/9gydF4y2Ba,gydF4y2BaMyd88gydF4y2Ba(细胞质PRRs),抗原处理和呈递(如组织蛋白酶,gydF4y2BaTap1gydF4y2Ba,gydF4y2Baβ2米gydF4y2Ba)和共刺激(例如,gydF4y2BaCd40gydF4y2Ba,gydF4y2BaCd86gydF4y2Ba).淋巴结中先天免疫细胞募集和激活的转录证据进一步与上调的炎症相关(例如,gydF4y2Ba肿瘤坏死因子gydF4y2Ba,gydF4y2BaStat3gydF4y2Ba)和抗病毒药物(例如:gydF4y2BaStat1gydF4y2Ba, IRFs)过程提示这些通路在amp - cpg驱动的急性免疫激活中的潜在作用。相比之下,可溶性CpG在淋巴结中诱导的转录变化很小,这与先前的证据一致,表明在体内淋巴结堆积不良,免疫原性降低。免疫后72 h的评估显示,可溶性cpg介导的转录变化出现峰值,主要由B细胞募集和激活指标主导(例如,gydF4y2BaCd19gydF4y2Ba,gydF4y2BaCd79agydF4y2Ba,gydF4y2BaBtkgydF4y2Ba,无花果。gydF4y2Ba3 fgydF4y2Ba,补充图。gydF4y2BaS4f ggydF4y2Ba).相反,AMP-CpG免疫的淋巴结在这个时间点显示出最小的B细胞相关转录模式。相反,分析显示了模式识别和趋化因子编码转录水平下降的证据,但抗原呈递上调和炎症通路的持续特征与专业apc的淋巴结动员一致,以协调下游适应性免疫。总的来说,这些数据表明了可溶性和amp - cpg诱导的转录编程之间的显著对比。这证明了amp修饰对影响naïve淋巴结转化为高度炎症和抗病毒生态位的至关重要,使APCs能够检测、处理和向适应性免疫系统呈递抗原,最终形成强大的下游适应性免疫。gydF4y2Ba
C57Bl/6 J小鼠(gydF4y2BangydF4y2Ba= 2)分别用10µg WH-01 RBD蛋白和1 nmol可溶性或AMP-CpG免疫1次。gydF4y2Ba一个gydF4y2Ba图示显示动物给药和实验时间表。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba通过NanoString nCounter®小鼠免疫面板分析整个淋巴结mRNA的热图表示。所示为模拟减法,基因转录水平的平均z分数显著(gydF4y2BapgydF4y2BaRosalind软件测定< 0.05)在6 h下调(≥- 1.5倍变化,蓝色)或上调(≥1.5倍变化,红色)(gydF4y2BabgydF4y2Ba), 24小时(gydF4y2BacgydF4y2Ba),及72小时(gydF4y2BafgydF4y2Ba)注射后相对于模拟免疫。不重要的值gydF4y2BapgydF4y2Ba≥0.05以灰色表示。使用基因本体数据库将基因聚类为11组(方框插入)。可溶性CpG的对数转换转录本值的火山图表示(gydF4y2BadgydF4y2Ba)及AMP-CpG (gydF4y2BaegydF4y2Ba)免疫后24小时的动物gydF4y2BacgydF4y2Ba.仅含PBS载体的模拟疫苗。采用Rosalind软件进行统计分析。的显著性阈值gydF4y2BapgydF4y2Ba= 0.05(用Rosalind软件测定);垂直虚线表示折叠变化极限为±1.5倍变化。LN淋巴结。gydF4y2Ba
AMP-CpG诱导淋巴结蛋白组和细胞先天免疫反应的强烈急性激活gydF4y2Ba
鉴于amp - cpg介导的淋巴结转录重编程的证据,我们进一步描述了淋巴结蛋白质组学环境和免疫细胞组成,以进一步研究疫苗接种后诱导适应性免疫的关键机制。为此,我们采用了两种方法:首先,采用多重蛋白质组学方法检测可溶性或AMP-CpG免疫诱导的炎症蛋白在淋巴结裂解液中的总表达;其次,采用流式细胞术检测淋巴结免疫细胞数量、激活标志物和细胞内细胞因子。在初步免疫后6和24小时收集可溶性或AMP-CpG免疫小鼠的引流淋巴结,并通过Luminex评估裂解物,与仅接受载体模拟注射的动物进行比较(图2)。gydF4y2Ba4 a、bgydF4y2Ba).在6小时可溶性和AMP-CpG免疫诱导了几种蛋白质分析物质的相似增加,包括与先天细胞募集和先天适应性免疫细胞相互作用的空间淋巴结组织相关的趋化因子(IP-10, MCP-1, MIP-1α, MIP-1β;无花果。gydF4y2Ba4gydF4y2Ba,补充图。gydF4y2BaS5agydF4y2Ba).接种后24小时的评估显示,虽然可溶性CpG免疫的应答几乎普遍恢复到基线水平,但AMP-CpG诱导的应答持续存在,并扩大到包括许多与先天细胞介导的适应性免疫协调相关的因素(图2)。gydF4y2Ba4 bgydF4y2Ba,补充图。gydF4y2BaS5bgydF4y2Ba).AMP-CpG免疫导致几乎所有测试分析物的全面稳定升高,包括生长因子、th1相关的促炎细胞因子、Th2和调节细胞因子、趋化因子、炎性体相关细胞因子和I型干扰素。鉴于观察到AMP-CpG诱导强烈的淋巴结促炎环境,我们进一步评估了各种免疫细胞在初次免疫后6、24和48小时的淋巴结中协调这一过程的重要性。gydF4y2Ba4 c ggydF4y2Ba、折线图、补充图。gydF4y2BaS5c-ggydF4y2Ba).24 h流式细胞仪分析(补充图;gydF4y2Ba6gydF4y2Ba)显示AMP-CpG,而非可溶性CpG,显著增加了所有分析的固有细胞系的总数,包括单核细胞、巨噬细胞、中性粒细胞、dc和NK细胞。值得注意的是,在AMP-CpG免疫的动物中,单核细胞和中性粒细胞的数量在24小时达到峰值,随后下降,这与它们在急性反应中的作用一致,而巨噬细胞、dc和NK细胞的数量在48小时继续增加。重要的是,虽然可溶性CpG免疫可导致巨噬细胞、dc和NK细胞的总淋巴结群的相似升高,但AMP-CpG普遍促进了先天性细胞激活状态的显著增强,这由产生多种关键细胞因子(IFNγ、IFNβ、IL-1β、IL-6、IL-12)的淋巴结居住细胞的数量和24小时CD86表面表达的升高所表明(图2)。gydF4y2Ba4 c ggydF4y2Ba、热图、补充图gydF4y2BaS5c-ggydF4y2Ba).结合观察到的淋巴结蛋白质组学数据,这些数据表明了amp修饰在体内CpG DNA使淋巴结转运和强大的先天免疫激活的重要作用。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BaggydF4y2BaC57Bl/6 J小鼠(gydF4y2BangydF4y2Ba= 5)分别用10µg WH-01 Spike RBD蛋白和1 nmol可溶性或AMP-CpG免疫。模拟免疫动物只接受PBS载体。收集淋巴结进行蛋白提取(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)或流式细胞术(gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba).在6小时内收集淋巴结(gydF4y2Ba一个gydF4y2Ba)及24小时(gydF4y2BabgydF4y2Ba)免疫后均质,用Luminex检测提取蛋白水平。结果表示为模拟减去分析物浓度(pg/ml)的z分数的热图。分析物按功能类别进行注释:(1)生长因子,(2)Th1细胞因子,(3)Th2/调节细胞因子,(4)趋化因子,(5)炎症小体,(6)I型干扰素。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba分别于6、24、48 h采集淋巴结,流式细胞术检测单细胞悬液。折线图表示每个淋巴结随时间变化的细胞亚群数量。热图是模拟减去特定细胞亚群的z分数,表示每个淋巴结的各自标记。gydF4y2BahgydF4y2BaC57Bl/6 J小鼠(gydF4y2BangydF4y2Ba= 5)在AMP-CpG疫苗免疫前1天腹腔注射IFNAR-1阻断抗体。模拟免疫动物只接受PBS载体。24小时后从淋巴结中提取蛋白。Luminex评估的分析物浓度在热图中表示,显示模拟减去分析物浓度的z分数(pg/ml),并注释为gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba.所示值为平均值±标准差。gydF4y2Ba*gydF4y2BapgydF4y2Ba
通过观察干扰素β的诱导,干扰素反应的强烈转录特征,以及AMP-CpG免疫后所有主要先天免疫细胞系在淋巴结免疫反应中的明显参与,我们假设激活可能部分通过刺激I型干扰素抗病毒反应途径进行。为了研究这一信号级联在AMP-CpG诱导的先天反应中的作用,用IFNAR-1阻断单抗预处理小鼠,以消除IFNα和IFNβ信号转导。免疫小鼠24 h后收集淋巴结进行蛋白质组学分析。当用非活性同型对照抗体预处理的对照组小鼠显示几乎所有测量分析物的升高时,amp - cpg诱导的淋巴结炎症环境被IFNAR-1阻断完全消除(图2)。gydF4y2Ba4 hgydF4y2Ba,补充图。gydF4y2BaS5hgydF4y2Ba),证实该通路在amp - cpg诱导的免疫激活中起关键作用。gydF4y2Ba
AMP-CpG刺激非人类灵长类动物(NHPs)针对多种VOC的广泛反应性细胞免疫反应gydF4y2Ba
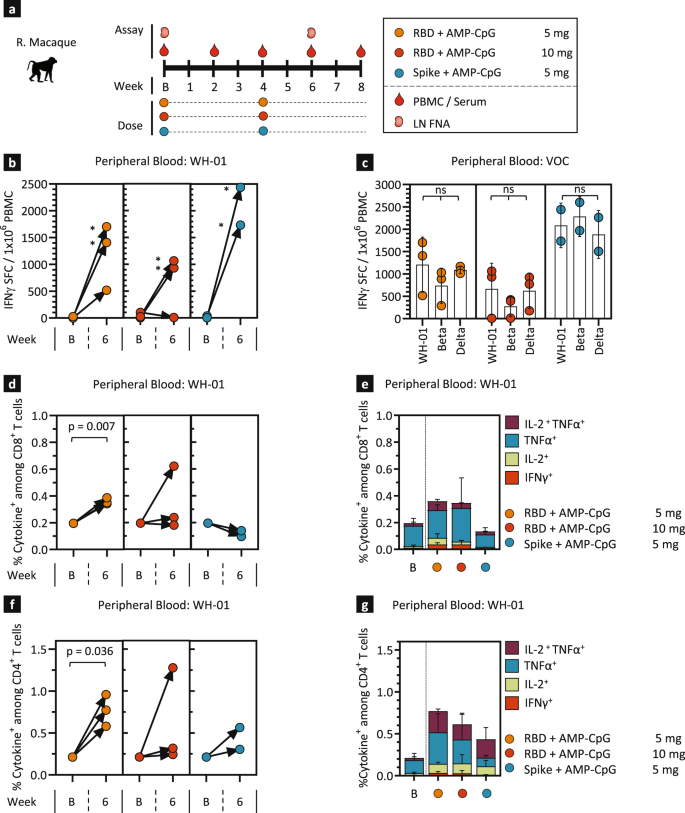
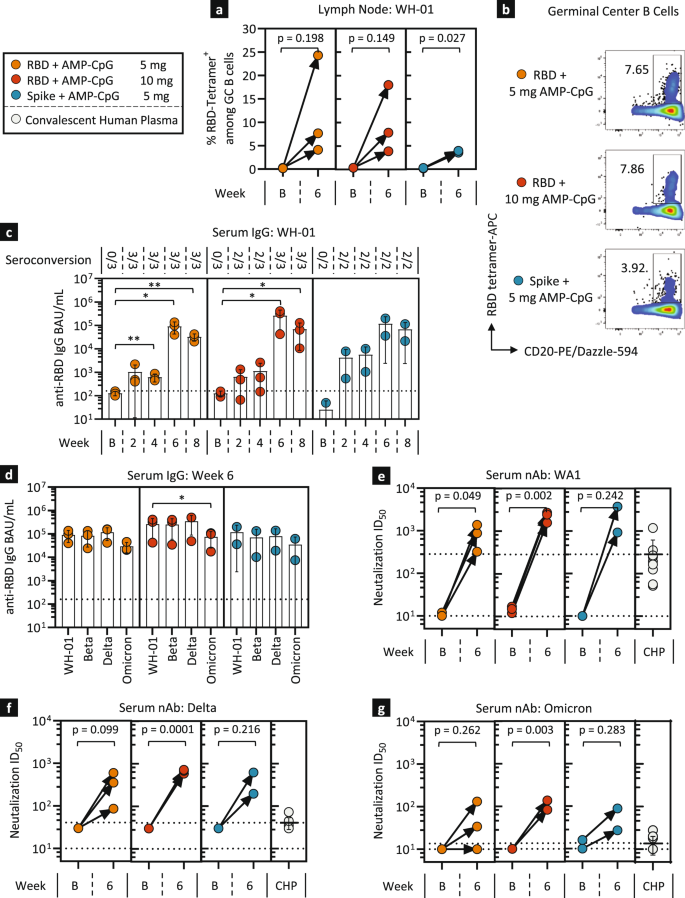
根据ELI-005免疫小鼠后观察到的强大的细胞和体液免疫,我们对NHPs进行了免疫原性评估,以评估人类受试者潜在反应的预测活性。对8只成年雌性恒河猴进行了免疫原性评估(图2)。gydF4y2Ba5gydF4y2Ba), 4-5岁,接种140µg WH-01 RBD与5 mg (gydF4y2BangydF4y2Ba= 3)或10毫克(gydF4y2BangydF4y2Ba= 3)的AMP-CpG,或140µg完整的WH-01刺突蛋白与5 mg AMP-CpG混合(gydF4y2BangydF4y2Ba= 2)。通过对体温、体重、血细胞计数、血清细胞因子测定的纵向监测,安全性评估显示无不良事件或潜在临床风险迹象(补充图)。gydF4y2BaS7gydF4y2Ba),以及大致的临床观察,包括监测局部注射部位。在整个研究过程中,收集了外周血单个核细胞(pmcs)、血清和淋巴结细针吸入物(FNA),用于分析细胞和体液免疫反应(图2)。gydF4y2Ba5gydF4y2Ba).在加强免疫后的第6周,所有疫苗组的个体动物在体外用wh01 RBD重叠肽(OLPs)刺激后,PBMC中IFNγ SFC的频率显著升高,大多数动物每10只动物中有超过1,000个SFCgydF4y2Ba6gydF4y2BaPBMC(无花果。gydF4y2Ba5 bgydF4y2Ba).通过vocs特异性OLP的刺激来评估诱导反应的潜在交叉反应性,与WH-01相比,Beta和Delta OLP刺激的IFNγ SFC频率没有显著差异(图1)。gydF4y2Ba5度gydF4y2Ba),这表明eli -005诱导的T细胞反应可能针对VOC序列中保守的表位。通过分析体外刺激后多细胞因子的产生,进一步评估pbmc衍生的T细胞反应。在免疫组中,WH-01 RBD与5 mg AMP-CpG混合在第6周时引起了最强健的外周血T细胞反应,CD8为0.45%gydF4y2Ba+gydF4y2BaT细胞(图;gydF4y2Ba5 d, egydF4y2Ba)和0.8%的CD4gydF4y2Ba+gydF4y2BaT细胞(图;gydF4y2Ba5 f, ggydF4y2Ba)被观察到产生IL-2, TNFα, IFNγ,或这些刺激的组合。其他疫苗组的细胞因子水平相对较低gydF4y2Ba+gydF4y2BaCD8gydF4y2Ba+gydF4y2BaT细胞反应,细胞因子gydF4y2Ba+gydF4y2BaCD4gydF4y2Ba+gydF4y2Ba反应呈持续上升趋势,表明CD4gydF4y2Ba+gydF4y2BaT细胞反应在NHPs中比以前在小鼠中观察到的更占优势。gydF4y2Ba
恒河猴(gydF4y2BangydF4y2Ba= 2/3)在第0周和第4周分别用140µg WH-01 RBD蛋白混合5 mg或10 mg AMP-CpG或140µg全WH-01 Spike蛋白混合5 mg AMP-CpG免疫。在基线和第6周收集pbmc用于T细胞反应评估。gydF4y2Ba一个gydF4y2Ba图示显示动物给药和实验时间表。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba在IFNγ elisa法分析之前,在0周和6周用WH-01 RBD OLPs或6周用VOC OLPs刺激pmcs。所示为每1 × 10的IFNγ SFCsgydF4y2Ba6gydF4y2BaPBMCs。gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba在流式细胞仪分析细胞内细胞因子之前,用WH-01 OLPs刺激pmcs。所示为总(gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba)和个体产生IL-2、TNFα、IFNγ细胞因子(gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba) CD8gydF4y2Ba+gydF4y2Ba(gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba)和CD4gydF4y2Ba+gydF4y2BaT细胞(gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba).所示值为平均值±标准差。gydF4y2Ba* pgydF4y2Ba
AMP-CpG诱导淋巴结生发中心(GC)的发展,并在NHPs中快速诱导交叉反应中和抗体反应gydF4y2Ba
在第6周,所有疫苗组合诱导了RBD特异性GC B细胞(RBDgydF4y2Ba+gydF4y2BaCD20gydF4y2Ba+gydF4y2BaBcL6gydF4y2Ba+gydF4y2Baki - 67gydF4y2Ba+gydF4y2Ba),与基线水平相比,淋巴结的频率升高(图。gydF4y2Ba6 a、bgydF4y2Ba).在整个研究过程中,在纵向时间点评估血清中rbd特异性IgG。对WH-01 RBD特异性血清IgG的评估显示,早在初次免疫后的第2周和第4周,所有RBD免疫治疗组的血清转化迅速且几乎普遍(图2)。gydF4y2Ba6摄氏度gydF4y2Ba).在第6周和第8周增强后,所有rbd免疫组的IgG血清浓度进一步增加,第6周的峰值反应相对于基线升高了5000倍。在使用完整Spike蛋白免疫后,观察到类似的IgG反应趋势,这表明RBD和全长Spike与AMP-CpG佐剂联合使用都具有免疫原性。gydF4y2Ba
恒河猴(gydF4y2BangydF4y2Ba= 2/3)免疫,见图。gydF4y2Ba5gydF4y2Ba并在不同时间点评估淋巴结FNA和血清中对SARS-CoV-2的体液反应。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba所示为四聚体的频率gydF4y2Ba+gydF4y2Barbd特异性GC B细胞(CD20gydF4y2Ba+gydF4y2BaBcL6gydF4y2Ba+gydF4y2Baki - 67gydF4y2Ba+gydF4y2Ba)和相应的rbd特异性B细胞的代表性流式细胞术点图。评估WH-01的rbd特异性血清IgG结合单位浓度(gydF4y2BacgydF4y2Ba)及VOC (gydF4y2BadgydF4y2Ba) rbd结合活性,纵向或基线和第6周。gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba通过假病毒抑制活性测定中和抗体反应。显示的是IDgydF4y2Ba50gydF4y2BaWA1的值(gydF4y2BaegydF4y2Ba), Delta (gydF4y2BafgydF4y2Ba)及欧米克隆(gydF4y2BaggydF4y2Ba)与恢复期人血浆(CHP)相比。所示值为均值±标准差。虚线表示区分血清转化阳性或阴性样本的检测下限,以及在适当情况下观察到的人类血浆比较物的平均值。gydF4y2Ba*gydF4y2BapgydF4y2Ba< 0.05;gydF4y2Ba**gydF4y2BapgydF4y2Ba双侧Mann-Whitney检验< 0.01 (gydF4y2Ba一个gydF4y2Ba,gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba),或配对单因素方差分析,再进行Dunnett事后分析(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba).gydF4y2Ba
评估抗体交叉反应,以评估诱导IgG反应识别与VOC驱动近期大流行感染波相关的一组RBD变体的潜力。AMP-CpG免疫诱导血清IgG反应,具有针对几种主要VOC的广泛交叉反应性。在第6周,在所有rbd免疫组中,Beta或Delta rbd相对于WH-01的rbd特异性IgG血清浓度没有明显下降(图2)。gydF4y2Ba6 dgydF4y2Ba).IgG对Omicron RBD的反应较强,但相对于WH-01、Beta和Delta有所下降。类似的趋势也出现在用全部Spike免疫原免疫的动物身上。gydF4y2Ba
在所有免疫动物的血清中观察到,在中和ID为第6周时,针对WA1的病毒特异性中和抗体水平一致增加gydF4y2Ba50gydF4y2Ba大约比在一组恢复期人类血浆样本中观察到的水平高10倍(图2)。gydF4y2Ba6 egydF4y2Ba).第6周针对Delta和Omicron变体的中和抗体反应也相对于基线持续升高,但与针对疫苗免疫原的wa1特异性反应相比有所降低(图)。gydF4y2Ba6 f, ggydF4y2Ba).然而,这些变异导向的反应,包括对Omicron的特异性反应,始终高于恢复期人类血浆比较物,这表明AMP-CpG疫苗诱导的交叉反应中和反应可能超过人类自然感染通常诱导的水平。gydF4y2Ba
AMP-CpG在NHPs引流淋巴结中诱导强大的促炎转录编程gydF4y2Ba
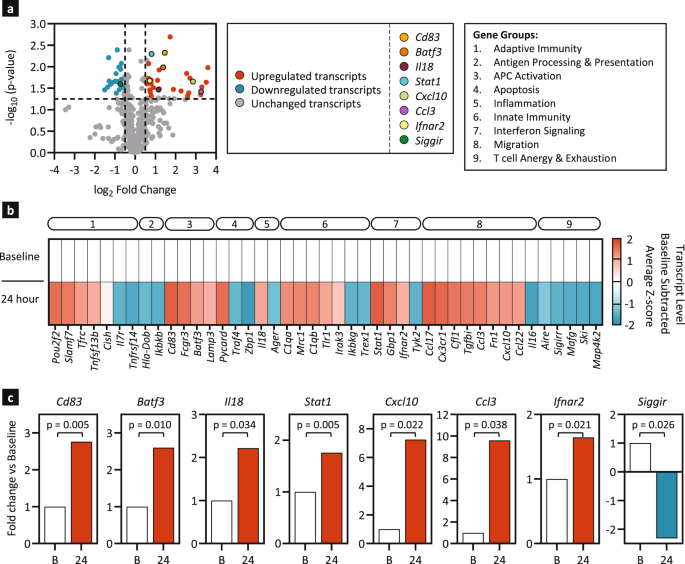
为了研究AMP-CpG接种的NHPs的信号模式,在基线和免疫后24 h收集淋巴结FNA,使用Nanostring进行免疫应答的转录分析。在跨越多个免疫协调轴的各种基因本体类别中,观察到许多基因转录水平的动态变化(图。gydF4y2Ba7一个gydF4y2Ba).总的来说,44个基因相对于基线有差异表达;其中27个基因在接种后显著上调了至少1.5倍,17个基因下调了至少1.5倍(图2)。gydF4y2Ba7 bgydF4y2Ba).上调的转录本包括参与适应性和先天免疫、APC激活、干扰素信号转导和迁移的基因,而参与T细胞无能和衰竭的基因则被高度下调。值得注意的是,gydF4y2BaCd83gydF4y2Ba而且gydF4y2BaBatf3gydF4y2Ba这些转录本对于DC激活和抗原交叉呈递CD8很重要gydF4y2Ba+gydF4y2BaT细胞gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,和促炎Th1细胞因子一样被高度诱导,gydF4y2BaIl18gydF4y2Ba(无花果。gydF4y2Ba7 cgydF4y2Ba).AMP疫苗显示出强烈的基因诱导主要涉及干扰素信号,包括gydF4y2BaStat1gydF4y2Ba而且gydF4y2BaIfnar2gydF4y2Ba.最大的一类上调基因与迁移有关,包括gydF4y2BaCxcl10gydF4y2Ba(IP-10),对巨噬细胞、T细胞、NK细胞和dc具有趋化作用gydF4y2BaCcl3gydF4y2Ba(MIP-1α),它在淋巴结中协调T细胞- apc相遇,以增强记忆T细胞的大小gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba.相反,与T细胞无能和衰竭相关的基因被下调,包括gydF4y2BaSiggirgydF4y2Ba抑制TLRs的信号转导,gydF4y2BaIl18r1gydF4y2Ba而且gydF4y2BaIl1r1gydF4y2Ba消极地调节炎症gydF4y2Ba27gydF4y2Ba.这些结果与在小鼠中收集的结果有显著的相似之处,并进一步证实,在NHPs中使用AMP-CpG免疫诱导促炎环境,以促进适应性免疫,包括T细胞启动和引流淋巴结的激活。gydF4y2Ba
恒河猴(gydF4y2BangydF4y2Ba= 3)分别于第0、4和10周接种140µg WH-01 RBD和5 mg AMP-CpG。在基线和第10周后24小时收集淋巴结FNAs。使用Nanostring nCounter®NHP免疫面板进行纳米串分析,比较基线和增强后24小时间淋巴结FNA中的基因表达。gydF4y2Ba一个gydF4y2Ba770个基因24小时对数转换转录本值的火山图表示。的显著性阈值gydF4y2BapgydF4y2Ba= 0.05(用Rosalind软件测定);垂直虚线表示折叠变化极限为±1.5倍变化。gydF4y2BabgydF4y2Ba差异表达的基因转录物热图。所示为模拟减法,基因转录水平的平均z分数显著(gydF4y2BapgydF4y2Ba< 0.05,由Rosalind软件确定)相对于基线值下调(≥- 1.5倍变化,蓝色)或上调(≥1.5倍变化,红色)。不重要的值gydF4y2BapgydF4y2Ba≥0.05以灰色表示。利用基因本体数据库将基因聚类为9组(方框插入),并在热图顶部标注:(1)适应性免疫,(2)抗原处理和呈递,(3)APC激活,(4)凋亡,(5)炎症,(6)先天免疫,(7)干扰素信号,(8)迁移,以及(9)T细胞无力和衰竭。gydF4y2BacgydF4y2Ba所选基因转录本的折叠变化条形图。采用Rosalind软件进行统计分析。gydF4y2Ba
讨论gydF4y2Ba
尽管有效疫苗得到了批准和广泛采用,但COVID-19大流行继续导致全球感染浪潮,原因是出现了更多变异gydF4y2Ba28gydF4y2Ba以及通过自然感染或免疫获得的相对短暂的消毒免疫gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba.随着病毒变型逐渐发展出与祖先毒株更大的突变偏差,并获得更大的传染性,未来候选疫苗活性的目标可能从通过中和抗体预防病毒感染转变为T细胞介导的预防进展到严重疾病、住院和死亡。虽然目前批准的疫苗显示出中和抗体迅速减少,但T细胞反应可能更持久gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba同时也为目前和未来更广泛的VOC识别提供了潜力gydF4y2Ba31gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba.因此,能够促进体液和细胞免疫平衡、提供长期持久性、广泛的交叉反应性病毒识别和回忆时快速记忆再激活的疫苗将是进一步开发的有吸引力的候选疫苗。gydF4y2Ba
因此,ELI-005在小鼠和NHPs中的启动增强免疫诱导了平行T细胞和抗体免疫。NHPs中的抗体反应超过了恢复期人血浆中和多种VOCs的能力。重要的是,仅在两次剂量后就检测到欧米克隆特异性中和反应,这表明其优于目前批准的疫苗,后者已被证明需要第三次剂量才能在人体中诱导类似反应gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.此外,eli -005在NHPs中诱导的抗体反应伴随着淋巴结GC - B细胞反应的强劲发展,被认为与人类疫苗中延长的记忆B细胞反应相关gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.这些反应,显示出广泛交叉中和体液识别和持久记忆B细胞反应GC前体诱导的潜力,可能提供具有改善持久性和相关特异性的免疫,以应对病毒进化和快速下降的抗体水平的双重挑战。gydF4y2Ba
有趣的是,在小鼠中观察到的增强后rbd特异性IgG滴度并不能预测NHPs诱导的滴度峰值的强度。然而,以前在小鼠中使用3剂方案导致rbd特异性IgG反应显著升高,与在启动-增强免疫后观察到的NHPs反应更一致gydF4y2Ba17gydF4y2Ba.因此,prime-boost免疫后小鼠与NHP IgG反应缺乏相关性可能与最佳免疫方案的种特异性差异有关。此外,免疫原优化可能为增强免疫原性提供额外的机会。基于WH-01序列的重组RBD在小鼠体内经常表现出次优的体液免疫原性,这可能通过序列修饰来优化以提高ACE2结合的亲和力和稳定性,或通过免疫原支架来促进多价展示gydF4y2Ba40gydF4y2Ba.这种免疫原工程策略是进一步优化疫苗效力的有吸引力的选择,可以很容易地与AMP-CpG结合,通过协同淋巴结免疫激活来提高活性。gydF4y2Ba
eli -005诱导的小鼠T细胞反应在脾脏、外周血和肺中表现出明显的增殖峰值;对系统和病毒进入点的病毒感染的早期检测很重要的部位。重要的是,在收缩时,eli -005诱导的记忆T细胞反应在小鼠中维持了>32周,并在回忆时表现出深刻的扩张。在自然感染和免疫(包括原始SARS冠状病毒)后,在人类受试者中观察到长寿命的抗病毒T细胞反应,感染后T细胞记忆存在数年gydF4y2Ba41gydF4y2Ba.通过早期病毒识别、立即执行抗病毒效应子功能和快速扩展,这些反应为长期保护免受病毒进展和严重疾病发作提供了关键贡献。与此一致的是,我们观察到小鼠的长期记忆T细胞反应在重新暴露于抗原后迅速扩大到峰值水平。此外,在肺和脾脏中存在这些持久的前哨T细胞群,可能在容易检测到呼吸道病毒进入或新生感染的全身体征的位置提供有效的病毒监测来源。gydF4y2Ba
与小鼠一样,在NHPs中,外周血中有大量ELI-005诱导的T细胞,证实了ELI-005活性转化为预测人类免疫的模型。此外,用WH-01、Beta、Delta和Omicron表位刺激后,观察到广泛的病毒反应性,细胞因子产生水平相似。这与人类rbd特异性T细胞反应的表位定位研究相一致,这些研究表明,虽然病毒变体通常会发生与部分抗体中和相关的点突变,但大多数T细胞特异性表位都保持了,这代表了持久免疫识别的更一致的目标gydF4y2Ba42gydF4y2Ba.gydF4y2Ba
在引流淋巴结中有效积累疫苗成分可以有效协调先天免疫机制,控制后续适应性免疫的质量和效力。虽然许多分子佐剂已被证明具有免疫调节活性,但它们在体内的效力往往因暴露于免疫监测和协调的原发部位较差而受到限制gydF4y2Ba19gydF4y2Ba.相反,从注射部位通过体循环的快速、大小依赖的清除,以及进入传入淋巴的低效被动摄取,导致生物分布远离淋巴结,流向与免疫无关的部位或促进耐受的器官gydF4y2Ba19gydF4y2Ba.amp修饰已被证明可以通过促进CpG与组织常驻白蛋白的物理结合来克服这一挑战,白蛋白是一种最佳大小(~65 kDa)的伴侣蛋白,可通过淋巴引流而不是毛细血管吸收进行清除gydF4y2Ba21gydF4y2Ba.在实践中,我们观察到,增强AMP-CpG到淋巴结的传递诱导了局部先天免疫反应的多效性作用,这与下游细胞和体液免疫的显著改善相关。gydF4y2Ba
与小鼠中可溶性CpG的剂量匹配疫苗相比,AMP-CpG在给药后引发了显著的淋巴结转录组重编程。先前的报道证实,免疫后淋巴结中的可溶性CpG水平下降或无法检测到gydF4y2Ba21gydF4y2Ba.在这里,可溶性CpG对淋巴结转录组明显缺乏影响,而AMP-CpG诱导明显的差异转录水平,其标志是早期和持续的趋化因子上调,随后是增强潜在的抗原呈递、病原体识别、抗病毒反应和APC参与机制,表明先天性免疫的强大募集和协调。在NHP淋巴结中观察到的转录特征显示出类似的模式,这表明在预测人类活动的模型中具有共同的激活机制,尽管与小鼠相比,TLR-9在NHPs中的表达模式更为有限。在小鼠中观察到的转录重编程特征通过蛋白质组分析得到了证实,其中可溶性CpG仅支持有限组趋化因子的短暂增加。相比之下,AMP-CpG诱导的趋化因子水平在早期出现类似的增加,几乎所有被评估的分析物都出现了强劲的增加。通过列举激活和产生细胞因子的免疫细胞系,观察到可溶性和AMP-CpG的进一步分化机制,其中AMP-CpG诱导共刺激标记物表达和细胞因子产生模式与蛋白质组学评估中看到的相似,并表明先天免疫细胞的全面协调以建立淋巴结炎症环境。AMP-CpG诱导APC活性显著增强,以DC和巨噬细胞共刺激和细胞因子产生为标志,对T细胞的最佳激活至关重要。综上所述,这些观察结果为amp修饰增强CpG向淋巴结传递的重要性提供了证据,以实现TLR-9激动在协调先天免疫和适应性免疫方面的免疫调节潜力。gydF4y2Ba
TLR-9与B型CpG DNA(包括CpG-7909)的接触主要被认为诱导B细胞和浆细胞样dc的成熟,相对于其他CpG亚类,其促进I型干扰素产生的能力较弱。gydF4y2Ba43gydF4y2Ba).这与可溶性CpG接种后小鼠淋巴结中IFNβ和干扰素诱导转录物的缺乏一致。然而,在AMP-CpG的情况下,接种小鼠和NHPs后24 h IFNβ和干扰素诱导的转录本显著升高。此外,在小鼠中,通过阻断IFNAR-1,淋巴结炎症蛋白组学环境的发展几乎完全被取消,这表明I型干扰素在amp - cpg介导的淋巴结急性炎症反应协调中起着关键作用。虽然这一观察背后的机制不是本研究的主题,但值得注意的是,A型CpG产生的I型干扰素依赖于回文DNA序列的大分子组装,这些DNA序列通过TLR-9聚类驱动信号转导gydF4y2Ba44gydF4y2Ba.已知amp修饰的CpG促进插入脂质双分子层密集装饰细胞膜gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba这种模式可能类似于对a型CpG干扰素反应至关重要的自组装结构。我们推测,AMP-CpG修饰内体腔面膜小叶可能有助于TLR-9聚类导致的I型干扰素信号的增强。gydF4y2Ba
尽管有效疫苗在发达国家得到了授权、批准和广泛采用,但由于冷链储存和分配方面的挑战限制了低收入国家的可得性,全球可得性一直很低gydF4y2Ba47gydF4y2Ba.全球疫苗覆盖率的提高被认为是朝着限制在疫苗可及性差的人群中社区传播导致的进一步变异出现迈出的重要一步。这些变种,包括最近的Omicron变种,继续延长大流行,推动全球感染浪潮。对暴露于室温或冷藏条件下的ELI-005的评估表明,在没有持续超低温储存的情况下,温度敏感性降低,T和B细胞介导的免疫原性保持在相当的水平。在分发ELI-005疫苗时,可能减少对能源和物流密集的运输基础设施的依赖,从而改善全球疫苗的获取。gydF4y2Ba
总之,这些研究揭示了amp修饰CpG DNA定向淋巴结传递的潜力,从而通过对淋巴结固有免疫的全面编程来诱导免疫原性反应。这种方法在亚单位疫苗开发中的应用提供了一种针对传染病抗原提供平衡、有效和持久的细胞和体液免疫的策略,例如在小鼠和NHPs中验证ELI-005免疫原性。通过与蛋白质亚单位免疫原混合开发简单配方的潜力进一步表明,在大量未满足医疗需求的潜在适应症中快速应用的潜力。gydF4y2Ba
方法gydF4y2Ba
疫苗组件gydF4y2Ba
在小鼠研究中,疫苗由10µg SARS-CoV-2 Spike RBD WH-01蛋白(GenScript, cat# Z03483),结合1 nmol AMP-CpG-7909 (AMP-CpG, Avecia)或可溶性CpG 7909(可溶性CpG, InvivoGen, tlrl-2006,)组成。模拟治疗组在没有抗原的情况下接受匹配剂量的佐剂,或单独用载体(磷酸盐缓冲盐水,PBS)治疗。抗原再激发剂量包括10µg SARS-CoV-2 Spike RBD WH-01蛋白,双侧皮下注射至尾基底或鼻内。为了测试存储温度条件的实验,将剂量混合并在4°C或室温(22°C)下存储指定时间。在NHP研究中,疫苗由SARS-CoV-2 Spike RBD whi -01蛋白(GenScript;cat# Z03483)或SARS-CoV-2 WH-01尖刺蛋白(Acro生物系统公司,SPN-C5H9), 140µg与AMP-CpG混合,每剂量5或10 mg。gydF4y2Ba
试剂gydF4y2Ba
对于体外细胞样本的刺激,在SARS-CoV-2 Spike RBD (R319-S591, GenScript)上生成了具有11个氨基酸重叠的15-mers的OLP肽库。由于模块化的OLP池设计,包含VOC突变的序列可以与相应的突变肽交换。gydF4y2Ba
动物gydF4y2Ba
动物研究是在新伊比利亚研究中心或查尔斯河加速器和发展实验室批准的机构动物护理和使用委员会(IACUC)的协议下进行的,遵循联邦、州和地方的动物护理和使用指南。在小鼠研究中,从杰克逊实验室(Bar Harbor, ME)购买6- 8周大的雌性C57BL/6 J小鼠。在第0周和第2周,在小鼠尾巴底部(双侧,各50 μ l)皮下注射所指示的抗原-佐剂组合。在第二次给药后7天,以及抗原激发前1天和激发后7天采集外周血样本(如适用)。在第二次给药后7天或抗原激发后7天收集脾脏和肺组织。在右心室灌注10 mL PBS后采集肺。肺组织物理分离,用含胶原酶D (1 mg/mL)和脱氧核糖核酸酶I (25 U/mL)的RMPI 1640培养基消化。gydF4y2Ba
在NHP研究中,8只来自印度、4-5岁的近亲繁殖雌性恒河猴(gydF4y2Ba解剖gydF4y2Ba)被随机分为3组,每组2或3只动物。所有动物都被安置在新伊比利亚研究中心(新伊比利亚,洛杉矶)。在第0周和第4周,动物在大腿上部接受皮下免疫。在基线和整个研究过程中采集血液样本,并进行pbmc处理。在基线、0、2、6、24和48小时,以及启动剂量后2、4、6和8周收集血清。在第0周和第4周从腹股沟淋巴结收集淋巴结FNAs用于流式细胞术分析淋巴结驻留细胞,在第10周后24小时用于NanoString分析。gydF4y2Ba
ICS测定细胞活化和细胞因子gydF4y2Ba
在小鼠疫苗免疫原性研究中,对TNFα和IFNγ进行了ICS分析。外周血细胞(每次加强剂量后7天收集)和肺白细胞(最后一次加强剂量后收集)在37℃、5% CO2条件下,在brefeldin A (Invitrogen, cat# 00-4506-15)和莫能菌素(BioLegend, cat# 420701)存在下,用0.2µg每孔rbd衍生重叠肽刺激过夜(18-20小时)。活/死固定(水)死细胞染色试剂盒(Invitrogen,目录号:用L34966, 1:100)流式细胞仪检测细胞活力。细胞表面用抗CD4抗体(PE-Cy7,克隆:GK1.5, Invitrogen cat# 25-0041- 82,1:20 0)和CD8a抗体(APC,克隆:53-6.7,eBioscience cat# 17-0081- 83,1:20 0)染色,随后用BD CytoFix/CytoPerm (BD, 554714)固定。细胞进一步用抗IFNγ (PE,克隆:XMG1.2, BD cat# 554412, 1:200)、TNFα (FITC,克隆:MP6-XT22, BD cat# 554418, 1:200)和CD3 (APC-Cy7,克隆:17A2, BD cat# 560590, 1:200)抗体染色。阳性对照为PMA (50 ng/ml)和离子霉素(1µM),阴性对照为完全培养基加等效体积DMSO。细胞渗透性和固定(Invitrogen,目录号:;00-5523-00)。样本采集采用FACSCanto II (BD),数据分析采用FlowJo V10软件(BD)。gydF4y2Ba
在小鼠先天免疫反应分析中,对免疫后6-48 h收集的腹股沟淋巴结固定/渗透单细胞悬液(BD, cat# 554714)进行表面激活标记物染色和ICS分析。活/死固定染色(Aqua, Invitrogen, cat# L34966, 1:100)用于排除死细胞。细胞用CD11b (BV605,克隆:M1/70,克隆:101237,1:25 5),CD11c (BV421,克隆:N418,克隆:生物基因# 117330,1:40),CD3 (AF700,克隆:17A2,生物基因# 100216,1:100),CD19 (AF700,克隆:6D5,生物基因# 115528,1:100),Ly6C (BV650,克隆:HK1.4,生物基因# 128049,1:25 5),Ly6G (PerCP-Cy5.5,克隆:1A8,生物基因# 127616,1:100),NKp46 (PE-Dazzle594,克隆:29A1.4,生物基因# 137630,1:15 0),MHCII (APC-Cy7,克隆:M5/114.15.2,生物基因猫# 107628,1:100),CD86 (BV785,克隆:gl1,生物基因猫# 105043,1:140),IFNγ (BV711,克隆:XMG1.2,生物基因猫# 505835,1:50),IL12p40 (PECy7,克隆:C15.6,生物基因猫# 505210,1:80),IL1β (PE,克隆:NJTEN3, Invitrogen猫# 12- 7113 - 82,1:30 30),IL6 (FITC,克隆:MP5-20F3, Invitrogen猫# 11-7061- 82,1:10 0),IFNβ (APC, ASSAYPRO,猫# 32183-05161 T, 1:6)。样本采集采用BD FACS Symphony,数据分析采用BD FlowJo V10软件。gydF4y2Ba
巨噬细胞定义为CD3gydF4y2Ba−gydF4y2Ba/ CD19gydF4y2Ba−gydF4y2Ba/ NKp46gydF4y2Ba−gydF4y2Ba/ CD11cgydF4y2Ba−gydF4y2Ba/ Ly6GgydF4y2Ba−gydF4y2Ba/ CD11bgydF4y2Ba+gydF4y2Ba/ Ly6CgydF4y2Ba低gydF4y2Ba;单核细胞定义为CD3gydF4y2Ba−gydF4y2Ba/ CD19gydF4y2Ba−gydF4y2Ba/ NKp46gydF4y2Ba−gydF4y2Ba/ CD11cgydF4y2Ba−gydF4y2Ba/ Ly6GgydF4y2Ba−gydF4y2Ba/ CD11bgydF4y2Ba+gydF4y2Ba/ Ly6CgydF4y2Ba高gydF4y2Ba;DC定义为CD3gydF4y2Ba−gydF4y2Ba/ CD19gydF4y2Ba−gydF4y2Ba/ NKp46gydF4y2Ba−gydF4y2Ba/ CD11bgydF4y2Ba−gydF4y2Ba/ CD11cgydF4y2Ba+gydF4y2Ba;中性粒细胞定义为CD3gydF4y2Ba−gydF4y2Ba/ CD19gydF4y2Ba−gydF4y2Ba/ NKp46gydF4y2Ba−gydF4y2Ba/ CD11cgydF4y2Ba−gydF4y2Ba/ CD11bgydF4y2Ba+gydF4y2Ba/ Ly6CgydF4y2Ba地中海gydF4y2Ba/ Ly6GgydF4y2Ba+gydF4y2Ba;NK细胞定义为CD3gydF4y2Ba−gydF4y2Ba/ NKp46gydF4y2Ba+gydF4y2Ba.数据以每个淋巴结随时间变化的总细胞数表示,或以各自细胞因子或表面标记物阳性细胞数的z -score表示。gydF4y2Ba
在NHP研究中,冷冻的pbmc被解冻并放置一夜。10gydF4y2Ba6gydF4y2Ba将PBMCs/well重悬在添加了抗cd49d单克隆抗体(克隆号:9F10, BD cat# 555502, 1:400)、抗cd28单克隆抗体(克隆号:CD28.2, BD cat# 555726, 1:400)、高尔基抑制剂莫能菌素(Fisher Scientific, cat# NC0176671)和brefeldin A (Fisher Scientific, cat# 50- 111 -9757)的R10培养基中,在37℃下孵育8小时,然后在4℃下维持一夜。第二天,用抗CD4抗体(PE-Cy5.5,克隆:S3.5, Invitrogen公司# MHCD0418, 1:100)、CD8 (AF647,克隆:RPA-T8, BioLegend公司# 344726,1:400)、CD45RA (FITC,克隆:5H9, BD公司# 556626,1:20)、CCR7 (BV650,克隆:G043H7, BioLegend公司# 353234,1:20)和水活/死染料(Invitrogen公司,L34957, 1:200)对细胞进行表面染色,随后用BD CytoFix/CytoPerm (BD, 554714)固定。进一步用抗CD3抗体(APC-Cy7,克隆:SP34-2, BD猫# 557757,1:200),CD69 (ECD,克隆:TP1.55.3, Beckman Coulter猫# 6607110,1:100),IFNγ (AF700,克隆:B27, BioLegend猫# 506516,1:400),IL-2 (BV421,克隆:MQ1-17H12, BioLegend猫# 500328,1:20),IL-4 (PE,克隆:8D4-8, BioLegend猫# 500704,1:100),TNFα (BV605,克隆:MAb11, BioLegend猫# 502936,1:20),IL-17A (PE- cy7,克隆:BL168, BioLegend猫# 512315,1:200)。在BD FACS Symphony上采集固定在1.5%甲醛中的细胞,并用BD FlowJo V10软件分析数据。gydF4y2Ba
小鼠外周血细胞抗原特异性四聚体染色gydF4y2Ba
使用RBD-PE四聚体对小鼠样本进行mhc四聚体染色,用于序列VNFNFNGL(埃默里大学的NIH四聚体核心设施,cat# 54971),以及抗CD8a (APC,克隆:53-6.7,eBioscience cat# 17-0081- 82,1:20 0)、CD3 (APC- cy7,克隆:17A2, BD cat# 560590, 1:200)、CD44 (PE-Cy7,克隆:IM7, eBioscience cat# 25-0441- 82,1:10 0)和CD62L (FITC,克隆:mel14, eBioscience cat# 11-0621- 82,1:10 0)的抗体。使用活/死固定(水)死细胞染色试剂盒(Invitrogen, cat# L34966)在流式细胞术中评估细胞的活力。细胞被渗透并用转录因子染色缓冲集固定(eBioscience, cat# 00-5523-00)。样本采集采用BD FACSCanto II,数据分析采用BD FlowJo V10软件。gydF4y2Ba
酶联免疫斑点法gydF4y2Ba
在小鼠研究中,收集脾脏并加工成单细胞悬液。红细胞在ACK裂解缓冲液中裂解(Quality Biological Inc., cat# no.)。118156101)。使用小鼠IFNγ ELISpot试剂盒(MabTech, cat# Q00824-1X20210623DS)按照制造商的指示进行IFNγ elisa试剂盒测定。0.1 × 10gydF4y2Ba6gydF4y2Ba小鼠脾细胞被沉积到每个孔,在37℃和5% CO条件下,每孔用0.2µg rbd衍生重叠肽(GenScript)刺激小鼠脾细胞过夜gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
对于NHP研究,elisa试剂盒使用Monkey IFNγ ELISpotPLUS试剂盒(MabTech, cat# 3241M-4HPW)进行检测。用RPMI + 10% FBS在室温下封闭预涂的96孔elisa板2小时。0.2 × 10gydF4y2Ba6gydF4y2Ba将pmcs镀入每个孔,每孔用0.4 μg rbd衍生的OLPs刺激WH-01、Beta和Delta变体。这些斑点是根据制造商的说明开发的。两种动物模型均以PMA (50 ng/mL)和离子霉素(1µM)为阳性对照,以RPMI + 10% FBS + DMSO为阴性对照。用S6免疫斑点分析仪(CTL)对斑点进行扫描和定量。gydF4y2Ba
酶联免疫吸附试验(ELISA)测定抗体滴度gydF4y2Ba
elisa法测定血清抗体结合效价。在小鼠研究中,ELISA板被CoV-2 RBD蛋白包被(每孔200 ng;GenScript;cat# Z03483)在4°C过夜。用2%的牛血清白蛋白在室温下预阻塞板2小时。将连续稀释的小鼠血清转移到ELISA板上,rt培养2小时。用洗涤缓冲液冲洗板4次(bilegend;然后用1:2000稀释的辣根过氧化物酶(HRP)结合的兔抗小鼠IgG (Fcγ)二抗(Jackson免疫研究,cat# 315-035-046)在RT下孵育1小时。再次用洗涤缓冲液洗涤四次,然后用3,3 ',5,5 ' -四甲基联苯胺在RT下显影10分钟,用1 N硫酸停止反应。用ELISA平板阅读器测定450 nm处的吸光度。在0.5 OD(光密度)的吸光度临界值下测定滴度。 For NHP assays, ELISA plates were coated with 100 ng/well of SARS-CoV-2 RBD antigen. The detection antibody used was horseradish peroxidase (HRP)–conjugated goat anti-human IgG (H + L) (ThermoFisher, cat# SA5–10283) at a 1:2000 dilution. The WHO International Standard for anti-SARS-CoV-2 immunoglobulin (anti-RBD IgG High 20/150, NIBSC) was used for reference values. Serum titers were determined at an absorbance cutoff of 0.5 OD and converted into binding antibody units/mL (BAU/mL) using the WHO standard.
用纳米线分析基因转录本gydF4y2Ba
在小鼠研究中,在指定时间点从免疫的C57BL/6 J小鼠中收获腹股沟淋巴结,加工成单细胞悬液,并用RLT缓冲液溶解(Qiagen, cat# 79216)。免疫信号的转录谱是使用568个小鼠免疫应答基因的nCounter小鼠免疫面板生成的(NanoString Technologies)。对于NHP研究,使用nCounter NHP免疫小组的770猕猴免疫反应基因(NanoString Technologies)评估淋巴结FNA。使用nSolver软件v4.0 (NanoString Technologies)评估转录反应,使用ROSALIND软件进行差异基因表达。gydF4y2Ba
小鼠淋巴结蛋白质组学gydF4y2Ba
为测定淋巴结细胞因子/趋化因子含量,动物接种疫苗,免疫后6-48 h采集腹股沟淋巴结。对于ifnar1阻断,在免疫前24小时腹腔注射拮抗单抗(克隆:MAR1-5A3, BioXcell cat# BP0241)或同型对照(克隆:MOPC-21, BioXcell cat# BP0083)。在使用TissueLyser II (Qiagen)均质前,将含有Mini蛋白酶抑制剂鸡尾酒(Roche, 53945000)和HALT磷酸酶抑制剂(Thermo Fisher, 78442)的蛋白提取缓冲液(Invitrogen, EPX-9999-000)添加到完整的淋巴结中。使用Luminex细胞因子和Chemokine试剂盒(EMDMillipore, cat# m巨细胞- 70k和MECY2MAG-73K)分析离心清除的裂解物。gydF4y2Ba
淋巴结FNAs中NHP抗原特异性GC B细胞分析gydF4y2Ba
生物素化RBD蛋白(Acro Biosystems, cat# SPD-C82E9)与荧光色素偶联链霉亲和素APC (BioLegend, cat# 405207)络合生成RBD-四聚体。将FNA的淋巴结细胞与rbd -荧光色素复合物孵育,随后用水活/死染料(Invitrogen, L34957)、抗人IgM (FITC,克隆:G20-127, BD猫# 555782,1:5)、抗人IgG (PE- cy7,克隆:G18-145, BD猫# 561298,1:20)、抗人CD3 (AF700,克隆:SP34-2, BD猫# 557917,1:20)、抗人PD-1 (BV650,克隆:EH12.1, BD猫# 564104,1:20)、抗人CD20 (PE/Dazzle 594,克隆:2H7, BioLegend猫# 302348,1:20)、抗人CD4 (APC-Cy7,克隆:APC-Cy7)OKT4, BioLegend猫# 317418,1:20)和抗人类CXCR5 (PerCP-eF710,克隆:MU5UBEE, ThermoFisher猫# 46-9185- 42,1:20)。使用转录因子染色缓冲组(ThermoFisher, cat# 00-5521-00)固定/渗透细胞,并进一步用抗人Bcl-6 (PE,克隆:7D1, BioLegend cat# 358504, 1:20)和抗人Ki-67 (BV421,克隆:11F6, BioLegend cat# 151208, 1:20)进行染色。样本采集在BD FACS Symphony上进行,数据分析采用BD FlowJo V10软件。gydF4y2Ba
新型冠状病毒血清假病毒中和试验gydF4y2Ba
SARS-CoV-2假病毒检测gydF4y2Ba48gydF4y2Ba由Genecopoeia执行。使用了来自Washington 1 (WA1) D614G、Delta和Omicron变体的SARS-CoV-2 spike -假型慢病毒。简单地说,以1.2 × 10的密度播种过表达ACE2和TMPRSS2的HEK293T细胞系gydF4y2Ba4gydF4y2Ba细胞/一夜之间。制备热灭活血清样品的3倍连续稀释液,并与50 μ L假病毒混合。混合物在37°C下孵育1小时,然后加入HEK-293T-hACE2细胞。72 h后,裂解细胞,测定萤火虫荧光素酶活性。SARS-CoV-2中和滴度定义为样本稀释时,观察到RLU相对于病毒控制井的平均水平降低50%。从经pcr检测确诊为SARS-CoV-2感染(COVID-19)的患者中恢复的恢复期血清样本和血浆样本来自US Biolab (Rockville, MD)和ALLCELLS (Alameda, CA)。在症状出现后平均30天收集样本。接收所有样品并在−80°C冷冻保存,直到分析。gydF4y2Ba
统计数据gydF4y2Ba
两个实验组的比较采用Mann-Whitney检验。对于所有涉及三个或更多组的分析,采用后续的Tukey、Dunnett或Šidák事后分析进行单向方差分析。使用Graphpad Prism v9.4进行统计分析。使用ROSALIND软件进行纳米串统计分析,实现广义线性模型来计算每个基因的折叠变化和p值。使用Benjamini-Hochberg错误发现率方法计算调整后的p值。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
支持本研究中提出的研究结果的数据集可根据合理要求从通讯作者处获得。纳米串数据可在基因表达综合(GEO)中获得,登录号分别为GSE214555和GSE214564,用于小鼠和NHP数据集。Elicio Therapeutics将及时审查所有数据请求,以验证该请求是否受任何知识产权义务的约束。任何可以共享的数据都将通过材料转让协议发布。gydF4y2Ba
参考文献gydF4y2Ba
马塞林,J. R.等。新变种时代的COVID-19疫苗与SARS-CoV-2传播:回顾与展望gydF4y2Ba打开论坛感染。说。gydF4y2Ba9gydF4y2Ba, ofac124(2022)。gydF4y2Ba
科伯,B.等人。跟踪SARS-CoV-2峰值的变化:D614G增加COVID-19病毒传染性的证据gydF4y2Ba细胞gydF4y2Ba182gydF4y2Ba, 812 - 827。e19(2020).
普兰特,J. A.等。Spike突变D614G改变SARS-CoV-2的适应性。gydF4y2Ba自然gydF4y2Ba592gydF4y2Ba, 116-121(2021)。gydF4y2Ba
Volz, E.等人。评估SARS-CoV-2 Spike突变D614G对传播力和致病性的影响。gydF4y2Ba细胞gydF4y2Ba184gydF4y2Ba, 64 - 75。e11(2021).
霍夫曼,等人。SARS-CoV-2变体B.1.351和P.1逃脱中和抗体。gydF4y2Ba细胞gydF4y2Ba184gydF4y2Ba, 2384 - 2393。e12汽油(2021)。gydF4y2Ba
王,P.等。新型冠状病毒变体B.1.351和B.1.1.7的抗体耐药性。gydF4y2Ba自然gydF4y2Ba593gydF4y2Ba, 130-135(2021)。gydF4y2Ba
邓,等。SARS-CoV-2突变株L452R的传播、传染性和中和性。gydF4y2Ba细胞gydF4y2Ba184gydF4y2Ba, 3426 - 3437。e8(2021)。gydF4y2Ba
Emary, K. R. W.等。ChAdOx1 nCoV-19 (AZD1222)疫苗对SARS-CoV-2关注变种202012/01的有效性(B.1.1.7):一项随机对照试验的探索性分析gydF4y2Ba《柳叶刀》gydF4y2Ba397gydF4y2Ba, 1351-1362(2021)。gydF4y2Ba
库斯汀,T.等人。bnt162b2 - mrna接种个体SARS-CoV-2变异突破率增加的证据值得关注。gydF4y2Ba地中海Nat。gydF4y2Ba27gydF4y2Ba, 1379-1384(2021)。gydF4y2Ba
Singanayagam等人。英国接种疫苗和未接种疫苗的SARS-CoV-2 delta变体(B.1.617.2)的社区传播和病毒载量动力学:一项前瞻性、纵向、队列研究gydF4y2Ba柳叶刀感染。说。gydF4y2Ba22gydF4y2Ba, 183-195(2022)。gydF4y2Ba
萨多夫,J.等。单剂量Ad26.COV2的安全性和有效性。新冠肺炎疫苗。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba384gydF4y2Ba, 2187-2201(2021)。gydF4y2Ba
沃西等人。针对SARS-CoV-2的ChAdOx1 nCoV-19疫苗(AZD1222)的安全性和有效性:对巴西、南非和英国四项随机对照试验的中期分析gydF4y2Ba《柳叶刀》gydF4y2Ba397gydF4y2Ba, 99-111(2021)。gydF4y2Ba
Shinde, V.等。NVX-CoV2373新型冠状病毒疫苗对B.1.351变种的免疫效果gydF4y2Ba心血管病。j .地中海。gydF4y2Ba384gydF4y2Ba, 1899-1909(2021)。gydF4y2Ba
张哲,等。四种COVID-19疫苗的体液和细胞免疫记忆。gydF4y2Ba细胞gydF4y2Ba185gydF4y2Ba, 2434 - 2451。e17(2022)。gydF4y2Ba
S, C. K.等。mRNA-1273疫苗对非人类灵长类动物SARS-CoV-2保护的免疫相关性gydF4y2Ba科学gydF4y2Ba373gydF4y2Ba, eabj0299(2022)。gydF4y2Ba
隋勇,张志勇,张志勇,等。新型冠状病毒感染的免疫相关性研究。gydF4y2Ba病原体gydF4y2Ba10gydF4y2Ba, 138(2021)。gydF4y2Ba
斯坦巴克,m.p.等人。一种淋巴结靶向的两亲体疫苗可诱导对SARS-CoV-2的有效细胞和体液免疫。gydF4y2Ba科学。睡觉。gydF4y2Ba7gydF4y2Ba, eabe5819(2021)。gydF4y2Ba
Lakshmanane, P.等人。病毒刺突蛋白的受体结合结构域是SARS-CoV-2患者抗体的免疫显性和高度特异性靶点。gydF4y2Ba科学。Immunol。gydF4y2Ba5gydF4y2Ba, eabc8413(2020)。gydF4y2Ba
Trevaskis, N. L. Kaminskas, L. M. & Porter, C. J. H.《从下水道到救世主——靶向淋巴系统促进药物暴露和活性》。gydF4y2BaNat. Rev. Drug Disco。gydF4y2Ba14gydF4y2Ba, 781-803(2015)。gydF4y2Ba
莫伊尼汉,K. D.等。通过增加淋巴引流和提高血清稳定性增强肽疫苗的免疫原性。gydF4y2Ba癌症Immunol。ResgydF4y2Ba6gydF4y2Ba, 1025-1038(2018)。gydF4y2Ba
刘,H.等。分子疫苗中基于结构的淋巴结靶向编程。gydF4y2Ba自然gydF4y2Ba507gydF4y2Ba, 519-522(2014)。gydF4y2Ba
Grosche, L.等人。CD83分子——一个重要的免疫检查点。gydF4y2Ba前面。Immunol。gydF4y2Ba11gydF4y2Ba, 721(2020)。gydF4y2Ba
Ataide, m.a.等人。BATF3编程CD8+ T细胞记忆。gydF4y2BaImmunol Nat。gydF4y2Ba21gydF4y2Ba, 1397-1407(2020)。gydF4y2Ba
Hugues, S.等人。趋化因子依赖性CD8+ T细胞的动态成像有助于CD8+ T细胞的反应。gydF4y2BaImmunol Nat。gydF4y2Ba8gydF4y2Ba, 921-930(2007)。gydF4y2Ba
Castellino, F.等人。趋化因子通过引导CD8+ T细胞到达CD4+ T细胞-树突状细胞相互作用的位点来增强免疫。gydF4y2Ba自然gydF4y2Ba440gydF4y2Ba, 890-895(2006)。gydF4y2Ba
Askew, D.等。单纯CD8表达瞬时表面CCR5gydF4y2Ba+gydF4y2Ba炎症淋巴结内的T细胞依赖于高内皮小静脉相互作用并增强细胞依赖性记忆反应。gydF4y2Baj . Immunol。gydF4y2Ba196gydF4y2Ba, 3653(2016)。gydF4y2Ba
Wald, D.等人。SIGIRR, toll样受体-白细胞介素1受体信号通路的负调控因子。gydF4y2BaImmunol Nat。gydF4y2Ba4gydF4y2Ba, 920-927(2003)。gydF4y2Ba
曹毅,等。Omicron可以逃脱现有的大多数SARS-CoV-2中和抗体。gydF4y2Ba自然gydF4y2Ba602gydF4y2Ba, 657-663(2022)。gydF4y2Ba
Pérez-Alós, L.等。SARS-CoV-2疫苗接种后免疫力下降的建模及其影响因素。gydF4y2BaCommun Nat。gydF4y2Ba13gydF4y2Ba, 1614(2022)。gydF4y2Ba
莱文,e.g.等人。6个月内对BNT162b2 Covid-19疫苗的免疫体液反应减弱。gydF4y2Ba心血管病。j .地中海。gydF4y2Ba385gydF4y2Ba, e84(2021)。gydF4y2Ba
Goel, r.r.等人mRNA疫苗诱导对SARS-CoV-2及其关注变体的持久免疫记忆。gydF4y2Ba科学gydF4y2Ba374gydF4y2Ba,(2021)。gydF4y2Ba
Shin H.-S。et al。中东呼吸综合征幸存者记忆T细胞反应的纵向分析。gydF4y2Ba中国。感染。说。gydF4y2Baciab1019(2021)。gydF4y2Ba
勒伯特,N.等。COVID-19和SARS病例中的SARS- cov -2特异性T细胞免疫,以及未感染对照组。gydF4y2Ba自然gydF4y2Ba584gydF4y2Ba, 457-462(2020)。gydF4y2Ba
Vardhana, S, Baldo, L, Morice, W. G. & whry, E. J.了解T细胞对COVID-19的反应对于告知公共卫生战略至关重要。gydF4y2Ba科学。Immunol。gydF4y2Bahttps://doi.org/10.1126/sciimmunol.abo1303gydF4y2Ba(2022)。gydF4y2Ba
Tarke, A.等人。SARS-CoV-2疫苗接种诱导免疫T细胞记忆,能够交叉识别从Alpha到Omicron的变体。gydF4y2Ba细胞gydF4y2Ba185gydF4y2Ba, 847 - 859。e11(2022)。gydF4y2Ba
郑,s.m.s.等。同源和异源冠状病毒疫苗或BNT162b2疫苗接种后抗SARS-CoV-2 Omicron变种BA.1的中和抗体。gydF4y2Ba地中海Nat。gydF4y2Ba28gydF4y2Ba, 486-489(2022)。gydF4y2Ba
Cele, S.等。欧米克隆广泛但不完全逃脱辉瑞BNT162b2中和。gydF4y2Ba自然gydF4y2Ba602gydF4y2Ba, 654-656(2022)。gydF4y2Ba
潘,t.g.等。高亲和性生发中心B细胞被主动选择进入浆细胞室。gydF4y2Ba实验,医学。gydF4y2Ba203gydF4y2Ba, 2419-2424(2006)。gydF4y2Ba
Laidlaw, B. J.和Ellebedy, A. H.生发中心B细胞对SARS-CoV-2的反应。gydF4y2BaNat. Rev. Immunol。gydF4y2Ba22gydF4y2Ba, 7-18(2022)。gydF4y2Ba
Dalvie, n.c.等人。设计的SARS-CoV-2受体结合结构域提高了酵母的可制造性和小鼠的免疫原性。gydF4y2BaPNASgydF4y2Ba118gydF4y2Ba, e2106845118(2021)。gydF4y2Ba
赵俊杰和帕尔曼。呼吸道冠状病毒对T细胞介导的免疫应答。gydF4y2BaImmunol。ResgydF4y2Ba59gydF4y2Ba, 118-128(2014)。gydF4y2Ba
Lang-Meli, J.等人。恢复期和mrna接种个体的sars - cov -2特异性T细胞表位库。gydF4y2BaNat。MicrobiolgydF4y2Ba7gydF4y2Ba, 675-679(2022)。gydF4y2Ba
toll样受体9激活的治疗潜力。gydF4y2BaNat. Rev.药物发现gydF4y2Ba5,gydF4y2Ba471 - 484(2006)。gydF4y2Ba
Kerkmann等人。在浆细胞样树突状细胞中,基于核酸的纳米颗粒的自发形成是CpG-A诱导高干扰素-α的原因。gydF4y2Ba生物。化学。gydF4y2Ba280gydF4y2Ba, 8086-8093(2005)。gydF4y2Ba
Ma, L.等人。通过嵌合受体增强疫苗增强CAR-T细胞对实体肿瘤的活性gydF4y2Ba科学gydF4y2Ba365gydF4y2Ba, 162-168 (2019)gydF4y2Ba
刘浩,邝,B. & Irvine, d.j。膜锚定免疫刺激寡核苷酸用于体内细胞修饰和局部免疫治疗。gydF4y2BaAngew。化学。——Int。艾德。gydF4y2Ba50gydF4y2Ba, 7052-7055(2011)。gydF4y2Ba
菲格罗亚,J. P.等。低收入和中等收入国家对COVID-19疫苗和疗法的迫切需求。gydF4y2Ba《柳叶刀》gydF4y2Ba.gydF4y2Ba397gydF4y2Ba, 562-564(2021)。gydF4y2Ba
聂,J.等。基于伪病毒的SARS-CoV-2中和抗体定量研究gydF4y2BaProtoc Nat。gydF4y2Ba15gydF4y2Ba, 3699-3715(2020)。gydF4y2Ba
确认gydF4y2Ba
我们感谢D. M. Lidgate的专业医学写作帮助,感谢CSD生物统计公司的C. S. Davis, Capstan Therapeutics的A. Bot和麻省理工学院的D. J. Irvine的有益建议和讨论。我们感谢Elicio Therapeutics的资金支持。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
l.m.s.、a.j.和M.P.S.对这项工作做出了同样的贡献。l.m.。有好处,A.J,。米秒,密纹唱片,L.K.M. P.C.D.起草了手稿。m.p.s., l.k.m., C.M.H.和P.C.D.提供了监督,并审查并最终确定了手稿草案。l.m.s., m.p.s.和P.C.D.设计了小鼠免疫原性和转录组学研究,并分析了数据。l.m.s.、e.p.和M.P.S.进行了小鼠免疫原性和转录组学研究。A.J.和P.C.D.设计了小鼠蛋白质组学和体外细胞表征研究,并分析了数据。A.J.和E.P.进行了小鼠蛋白质组学和体外细胞特性研究。L.K.M, j.f., f.v.和P.C.D.设计了NHP研究。C.C.进行NHP样品采集。l.m.s., m.p.s., E.P.和L.K.M.进行了NHP样品分析。 L.K.M., L.M.S., M.P.S., and P.C.D. analyzed the NHP data. All authors reviewed and approved the version for publication.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
l.m.s., a.j., m.p.s., e.p., c.m.h., L.K.M和P.C.D.是Elicio Therapeutics的员工,因此,他们获得工资和福利,包括公司的股票和股票期权的所有权。p.c.d., m.p.s., l.m.s.和C.M.H.有一项两亲性SARS-CoV-2疫苗专利正在申请给Elicio。其他作者宣称没有利益竞争。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Seenappa, l.m., Jakubowski, A., Steinbuck, M.P.gydF4y2Baet al。gydF4y2Ba双亲性cpg疫苗接种可在小鼠和非人类灵长类动物中诱导强烈的淋巴结激活和COVID-19免疫。gydF4y2Banpj疫苗gydF4y2Ba7gydF4y2Ba, 128(2022)。https://doi.org/10.1038/s41541-022-00560-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41541-022-00560-3gydF4y2Ba