摘要
单萜(C10H16)由植被大量排放到大气中(>100 TgC年−1),在那里,它们很容易与羟基自由基和臭氧反应,形成新的粒子,从而形成云,影响地球的辐射收支,从而影响气候变化1,2,3..尽管大多数单萜以两种手性镜像形式存在,称为对映体,但这些(+)和(−)形式在测量或建模研究中很少区分4,5,6.因此,单萜类对映体在植物中的个体形成途径及其生态功能尚不清楚。在这里,我们在一个封闭的热带雨林生态系统中,在没有紫外线和大气氧化化学的情况下,在一个为期四个月的控制干旱和复湿实验中,展示了对映体分离的大气单萜烯和异戊二烯数据7.令人惊讶的是,释放的对映异构体显示出不同的日发射峰,对渐进式干燥的反应不同。同位素标记表明,植被排放的(−)-α-蒎烯主要是新合成的,而(+)-α-蒎烯主要是储存池排放的。随着干旱的发展,(−)-α-蒎烯排放源转移到存储池,有利于云的形成。干旱前两种α-蒎烯对映体的混合比与其他单萜的相关性更好,表明不同的酶控制。这些结果表明,对映体分布是理解森林生态系统中驱动单萜烯排放的潜在过程和预测气候变化对大气反馈的关键。
主要
到目前为止,很少关注单萜烯((+)和(−))的不同手性形式,因为这两种对映体具有相同的物理性质和与OH和O的反应速率3.(ref。8),因此,大多数大气场和模拟研究并没有区分它们4,5,6.然而,这隐含地假设两个对映体的源和汇是相同的,即使单个对映体的产生途径和驱动因素是不确定的。最近的森林测量显示,对映体的浓度不等(非外消旋体),有时甚至彼此不相关9,10,表明不同的源机制。尽管一些报告表明,对映体的生物合成在整个个体植物中是同质的10同质森林中的树叶、树皮和土壤凋落物具有明显的手性特征11,强烈表明这些手性物种(因此,通常是单萜类)的释放和去除过程还没有得到充分的理解。
异戊二烯排放比单萜烯排放更容易理解,模型预测和测量普遍精确一致12,13.异戊二烯的合成由2-C甲基-d-赤藓糖醇4-磷酸途径,光合作用吸收CO2转化为异戊二烯前体,异戊二磷酸,并直接从叶片排放(从头排放)12.单萜的合成也由2-发生C甲基-d-赤藓糖醇4-磷酸途径合成,但一些单萜是由甲戊酸途径合成的。这两种途径都会产生异戊二酯,异戊二酯与其异构体二磷酸二甲基烯丙酯结合,形成常见的单萜前体二磷酸香叶酰14,15.被称为萜合酶的酶将香叶酰二磷酸转化为一组单萜,这样,由特定酶产生的手性单萜通常是一种手性形式,(−)或(+)16,17.单萜烯可以通过从头排放或从存储池中释放,因此与生物合成时间无关。典型的热带阔叶植物通常在整个叶片中非特异性地储存单萜,主要是在脂质阶段,但也有少量在叶片内的水相18,19.调节单萜烯生产和潜在储存的过程可能决定了植物的整体手性排放特征,目前尚不清楚这些特征将如何响应干旱等极端气候事件。在整个二十一世纪,干旱预计将变得更加频繁20.从而破坏生态系统的功能21森林挥发性有机化合物(VOCs)的排放22.报告的单萜对干旱的排放响应是高度可变的,依赖于单个植物,因此基于经验的非手性排放清单是不可靠的23,24,25,26,27.然而,由于手性化合物直接连接到潜在的酶驱动过程,它们可以形成改进的排放方案的基础。
通过在线气相色谱-质谱联用(GC-MS),我们在封闭的生物圈2热带雨林(B2-TRF)中以每小时为间隔分离和测量α-蒎烯、camphene和柠檬烯,以及(−)-β-蒎烯、γ-萜烯和异戊二烯的对映体(图2)。1).同时还检出反式β-癸烯和β-月桂烯,但在线GC-MS方法无法分离。B2-TRF不断被外部空气冲洗,所有入射波长低于385 nm的光都被周围玻璃面板内的聚酯薄膜过滤28.在进行了三周的环境测量以建立正常的干旱前条件(年日(doy) 252-280)后,施加了9.5周的干旱以引起生理变化并驱动生化过程的差异反应(doy 281-337)。干旱阶段分为两个阶段(轻度干旱和重度干旱),相对湿度(RH)最小,土壤湿度下降和植被响应。在干旱结束时,向深层土壤中加水三天(doy 337-340),随后由头顶上的洒水器输送“雨水”(doy 347-356)。Isotopically贴上标签13有限公司2在干旱前和严重干旱期间,两次被添加到封闭大气中,能够使用离线气相色谱-同位素比质谱仪(GC-IRMS)区分新生和存储池排放。13C标记与长期大气通量监测相结合,使我们能够精确确定干旱如何影响通量和不同单萜对映体的来源。
对映体有明显的发展趋势
总单萜烯(由(−)-α-蒎烯、(+)-α-蒎烯、(−)-β-蒎烯、(−)-柠檬烯、(+)-柠檬烯、(−)-莰烯、(+)-莰烯和γ-萜烯组成)在干旱前保持相对稳定,但在23天后达到峰值(早期干旱),在56天后达到峰值(严重干旱)(图2)。2).在深水复湿过程中,当水重新引入最低土壤水平时,总单萜烯浓度开始下降。这种下降在降雨后(雨水再湿)继续,但在测量期结束时没有完全恢复到干旱前的水平。当分离对映体单萜时,也观察到两个浓度峰值的相同模式(对应于早期和重度干旱期);然而,对映体的峰大小显示出强烈的对比行为。(-)-α-蒎烯白天浓度在早期干旱中较高,而(-)-β-蒎烯在重度干旱中浓度是早期干旱的10倍(图2)。2 b).(+)-α-蒎烯峰浓度在早期和重度胁迫条件下基本相同。夜间浓度方面,(−)-α-蒎烯、(+)-α-蒎烯和(−)-β-蒎烯在严重干旱时均表现出较高的浓度(图2)。2摄氏度).在严重干旱结束时,手性单萜的释放量开始减少,而胁迫标记物己醛则增加,表明叶片受损7.雨水复湿后,(−)-β-蒎烯、(−)-α-蒎烯和(+)-α-蒎烯的夜间含量均恢复到干旱前水平(图2)。2摄氏度).虽然白天对映体的浓度也都从严重干旱的最大值下降,但它们没有达到干旱前的水平。干旱前(−)-α-蒎烯浓度与(−)-β-蒎烯、(−)-柠檬烯、(+)-柠檬烯和(+)-莰烯浓度的相关性较好,与(+)-α-蒎烯的相关性较差(扩展数据图)。1 a, b).相反,在严重干旱条件下,(−)-α-蒎烯浓度与(+)-α-蒎烯的相关性优于其他化合物。此外,在夜间,对映异构体相关性良好,而在白天,它们表现出独立的模式(当从头发射是重要的)(扩展数据图。1 c, d).值得注意的是,目前基于单萜烯排放模型的预期是干旱会引起(−)-α-蒎烯和(+)-α-蒎烯的等效反应,这是不正确的。
单萜和异戊二烯的数据可分为干旱前(PD)、早期干旱(ED)、重度干旱(SD)、深水再湿(DRW)和雨水再湿(RRW) 5个阶段。时间安排13有限公司2脉冲由黑点线表示。一个,白天异戊二烯和总单萜体积混合比(VMR)。线周围的阴影区域表示绝对测量不确定度。b,(−)-α-蒎烯和(+)-α-蒎烯及其他单萜的平均日间VMR。c,(−)-α-蒎烯和(+)-α-蒎烯及其他单萜的平均夜间VMR。为b而且c,线周围的阴影区域表示计算出的测量不确定度。d、土壤湿度(SM)和相对湿度(RH)。注意对映体的不同尺度。e,饼状图显示了每个阶段对映体单萜在白天的组成。其他单萜烯包括(−)-莰烯、(+)-莰烯、(−)-柠檬烯、(+)-柠檬烯和γ-萜烯。
虽然(−)-α-蒎烯一直主导着总单萜的排放,但(−)-β-蒎烯在严重干旱期间超过(+)-α-蒎烯成为第二丰富的单萜(图2)。2 e).因此,(+)-α-蒎烯与(-)-β-蒎烯的比值可作为干旱程度的表征指标。值得注意的是,来自土壤的单萜的通量并不影响这些对映体的比例,因为在整个实验过程中定期采集的样品表明,土壤始终保持对映体单萜的适度稳定吸收(扩展数据图)。2).因此,土壤吸收并没有驱动观察到的对映体分馏。此外,空气与风扇强烈混合,导致测量的是整个生态系统的响应,而不是单个物种。对四种单萜烯排放的周期性测量Clitoria fairchildiana树和四棵风笛手植物(来自试管)在扩展数据图中提供。2 b, c.单个植物的响应被合并在大气测量中,表明大气测量是生态系统的净响应。此外,还计算了异戊二烯和单萜烯相对于陆地表面积和树木生物量碳的通量,以帮助与真实世界进行比较(扩展数据表)1).
单萜烯的这些反应与异戊二烯的反应相反(通过GC-MS测量;看到方法详情)。在干旱前,树冠中的异戊二烯在26天内增加了3倍,达到约300 ppb的平均浓度(图2)。2),这可能是因为干旱开始前表土水分(5 cm土壤水分)从35%下降到26%,土壤对异戊二烯的强吸收减弱29,30..在干旱早期,异戊二烯和总单萜烯平行增加,异戊二烯峰值较早。到重度干旱期,表层土壤水分从26%下降到15%,平均异戊二烯浓度下降并稳定在100 ppb左右,与干旱前的初始值相当,而总单萜烯在重度干旱期继续增加。因此,在严重干旱条件下,单萜与异戊二烯的比值明显高于早期干旱条件下。在B2-TRF中不会发生实质性的OH氧化化学反应,因为玻璃不能传输产生OH的波长的光,并且新鲜空气中的臭氧会损失到大型空气处理装置的表面。没有任何重要的光化学反应反映在异戊二烯与其氧化产物的比例上(异戊二烯的含量比典型的亚马逊雨林测量值高100倍)31)和异戊二烯与单萜烯的比例(生物圈2中异戊二烯的优势约为3倍,因为其OH反应系数更快)。活动结束后,在B2-TRF内也测量了臭氧,发现其浓度非常低,平均为1.1±0.7 ppb,而在生物圈2外,空气中臭氧的平均浓度为49.2±1.2 ppb。
不同的对映体发射源
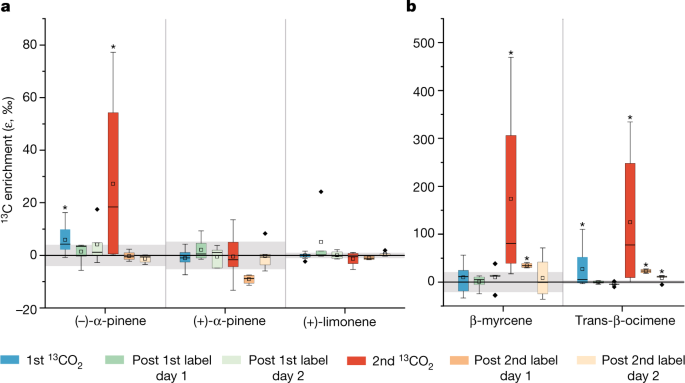
试验中2 d(预旱和重度干旱),CO2用沉重的标签13碳同位素(13有限公司2)被引入B2-TRF大气中,以区分从头和存储型单萜烯排放(图。3.).对于(−)-α-蒎烯,在中富集13C在两个脉冲中。脉冲后采集的大气样品显示,平均而言,基线ε13(−)-α-蒎烯C值下降至脉冲前值。这表明(-)-α-蒎烯的排放主要是从头开始的,但不应完全排除在干旱前,一小部分也在标记CO后进入存储池排放2从b2 -后机匣冲洗出来相比之下,没有明显的合并13(+)-α-蒎烯和(+)-柠檬烯的对映体均为C,表明这些对映体是单独生成的,主要从存储池中释放32.因此,在干旱时期,这些单萜类化合物在白天的含量增加。2 b)来自于存储池排放的增加。
单萜烯排放的碳源(从头或储存)被ε明确地分开13单萜及其对映体的C值13C-enriched有限公司2在干旱前的一个早晨添加(第113有限公司2)和严重干旱(第二)13有限公司2)阶段。13有限公司2气体被引入到大气中,这样植物就吸收了CO2直接产生单萜烯排放(从头产生)将产生富集于13C.因此,没有被浓缩的排放13C来自存储池。一个,手性单萜的富集。b,非手性单萜的富集。灰色阴影表示ε的标准差13C值的化合物在环境空气中没有13有限公司2脉搏。穿过灰色方框的黑线代表平均值。箱形图表示中位数、第25和第75百分位。小方块表示平均值,胡须表示采集到的不被视为异常值的最大和最小数据点。显著13c富集值由方框上方的星号(*)表示(即,如果P≤0.05)。n个值在扩展数据表中给出3..
观察到ε的增加13C值清楚地表明(-)-α-蒎烯、反式-β-洋烯和β-月桂烯是由新同化的光合碳合成的,并在标记脉冲期间产生。合并13C通过(−)α-蒎烯,反式β-西烯和β-月桂烯在第二次脉冲期间增加,即使总体上13在干旱条件下,碳的吸收下降,可能是因为更多新吸收的碳被用于生产这些特定化合物。反式-β-癸烯和β-月桂烯是重要的排放物,因为它们比其他单萜烯与有害活性氧反应更快。这与亚马逊雨林的测量结果一致,在亚马逊雨林中,热胁迫叶片中西烯和β-月桂烯的排放量增加5.
对映异构体有明显的日环
在干旱前观察到两种不同类型的昼夜周期。(-)-α-蒎烯和(-)-β-蒎烯与光合有效辐射(PAR)和同化率(一个(+)-α-蒎烯和(+)-柠檬烯次之,与水汽压亏差(VPD)和温度峰值在下午早些时候一致。扩展数据表提供了林下层和林冠层VPD和温度的全天和白天平均值2.目前的大气模型预测α-蒎烯排放是温度和光的函数,因此,将单萜烯排放峰值错误地放置在真实峰值之间,无法再现通过分解对映体揭示的干旱诱导的变化33.
在干旱前期和干旱前期,(-)-α-蒎烯和(-)-β-蒎烯均达到峰值一个11点到12点之间。(+)-α-蒎烯和(+)-柠檬烯在14:00 - 15:00达到峰值,与最高温度和VPD一致(图2)。4摄氏度).(−)-α-蒎烯和(−)-β-蒎烯日际周期的最大值在当天晚些时候逐渐转移,并在下午与(+)-α-蒎烯日际周期合并,同化率和PAR (一个)下降(植被碳吸收减少),VPD增加。随着复湿,同化速率开始恢复(碳吸收增加),同时峰(-)α-蒎烯和(-)β-蒎烯从14:00移回12:00。因此,(−)-α-蒎烯的日最大值在逐渐干燥的下午转移,这可能表明排放的新排放更少,而更多的是存储池的特征(图2)。4).(-)-β-蒎烯的日周期与(-)-α-蒎烯的日周期相同,说明(-)-β-蒎烯也可能由从头排放过渡到储存池排放。发射时间的变化尤其重要,因为这将影响与云凝结核形成有关的过程。到了下午,蒸发和感热通量之间的分区发生了变化,有利于后者。更多的感热通量增强了下午的湍流,这将有利于后期排放的物种垂直运输到更凉爽、氧化程度更高的地区。
通过对所选单萜及其对映异构体在光照、温度和土壤湿度下的昼夜循环比较,可以发现某些单萜的排放驱动因素发生了变化。一个(−)-α-蒎烯和(+)-α-蒎烯,(−)-β-蒎烯和(+)-柠檬烯的平均日数周期。在所有平均日珥仓中,单萜类日珥循环均以其各自的最大值归一化,发现这两种化合物都发生在严重干旱期间。线周围的阴影区域是平均绝对不确定度。b、同化(一个)和光合有效辐射(PAR)。同化率线周围的阴影区域代表1σ.c、蒸汽压差(VPD)和温度。区域3和区域4是雨林围栏的最上面部分(扩展数据图。3).VPD线周围的阴影区域表示1σ.
单萜一般储存在叶片的脂质相而不是水相中18,19.单萜相对不溶于水,根据它们的亨利常数,在水相和气相之间迅速分裂34.水相储存量很小,在早晨气孔打开,水分从叶片流失到大气中,水相储存量很快就会清空,因此,从水相储存量中排放的任何单萜烯可能都可以忽略不计18.单萜烯具有较大的辛醇/水分配系数(≈20,000-30,000),这意味着它们可以以相对较大的馏分储存在脂相中,从脂相中释放到大气中的速度较慢18.对排放行为的一个合理解释是,在整个测量期间,(+)-α-蒎烯和(+)-柠檬烯储存在脂相中,缓慢地泄漏到大气中,在一天的晚些时候达到峰值,而不是从头排放。随着光合作用的减弱和生物量降解的增加,(-)-α-蒎烯和(-)-β-蒎烯的排放由主要的从头合成转变为主要的存储池排放。
通过对具有相似属性的酶进行分组(即,光和温度依赖性,主要单萜烯产物),一个三酶-组-两库模型可以解释观察到的异戊二烯和单萜烯排放(扩展数据图)。4).异戊二烯由光激活的异戊二烯合酶(酶族1)产生,(−)-α-蒎烯和(−)-β-蒎烯由光激活的酶族2产生并直接(从头)释放。然而,(-)-α-蒎烯和(-)-β-蒎烯也都分裂为脂质相,在干旱胁迫下释放。第3组酶负责在没有光活化的情况下连续合成(+)-α-蒎烯和(+)-柠檬烯,也分配到脂相。
与潜在颗粒形成和生长相关的生态系统排放的变化很重要,因为云凝结核生产效率的提高、云的形成和随后的降雨可能代表着对干旱的生物圈-大气负反馈。在干旱早期,新生单萜的排放量增加。高通量的活性异戊二烯将抑制树冠上方的OH自由基水平,使排放达到更高、更冷的高度,在那里新形成的气溶胶可能会促进对流35.在严重干旱情况下,异戊二烯排放量减少,而单萜烯排放量进一步增加,因为异戊二烯不会有效地产生颗粒或极低的VOCs。在单萜中,α-蒎烯的产量增加最多,其氧化得到极低的挥发性有机化合物和高得率的颗粒。因此,本文给出的结果与上述负反馈机制一致。此外,单萜烯排放在干旱期间转移到下午晚些时候,意味着它们在感热通量和湍流较高的时期释放,这将促进富含单萜烯的空气团运输到云形成的水平。扩展数据图5用MEGAN发射模型对α-蒎烯的对映体进行了温度和光照预测。在干旱期间,测量到的排放量大大超过了预测的排放量,而且模拟数据没有考虑到在日珥排放剖面中观察到的变化。光和温度峰值的差异在现实世界中比在封闭环境中更重要,这可能会减少对映异构体的混合表示所带来的误差。然而,在生物圈2号中,光峰和温度峰之间的较大差异使得潜在的对映体发射差异得以发现。
对映体的释放特征被破译是因为B2-TRF提供了一个独特的场所,可以在受控条件下进行干旱,除了在大气化学成分大大减少的环境中进行大气同位素标记外,还有全面的生物测量。这些结果表明,热带雨林干旱胁迫的程度可以通过(−)-α-蒎烯在下午和早上的比例来衡量,也可以通过(−)-β-蒎烯在单萜烯总量中的比例来衡量,从干旱前到严重干旱,(−)-β-蒎烯在单萜烯总量中的比例几乎是三倍。出乎意料的是,来自不同单萜烯的(-)对映体表现出相同的日周期,而来自同一单萜烯的相反对映体表现出不同的日周期。值得注意的是,如果考虑单个对映体,则可以从外部空气测量中评估生态系统中单萜烯排放的从头来源和存储池来源,以及响应干旱的碳循环变化。这里提出的对映体结果与先前的研究一致,这些研究表明,目前将VOC排放简单地与光照和温度联系起来的方法不足以模拟与干旱相关的变化。额外的复杂程度,理想情况下是基于真实的物理过程,如存储池和酶模型,可以根据这些新结果考虑。这强调了一种新的、对映体特异性的排放建模方法,基于本文提出的酶-基团模型,将比目前的方法更准确,更具有生物学基础36,特别是关于排放成分和粒子产生效率之间可能存在的反馈。而单萜对映体在被OH或O氧化的速度上没有物理性质上的差异3.或对典型亚马逊森林气溶胶样本的吸收速率8,最近的研究表明,二聚物光化学产物组合确实具有不同的疏水性37.值得注意的是,这些结论是基于这样一个假设,即B2-TRF确实代表了在缺乏大气化学的情况下真实世界热带雨林的特征干旱响应。我们得出的结论是,对映体分解的单萜烯需要忠实地评估关键热带地区,如亚马逊雨林,如何排放单萜烯,并对未来极端干旱事件的预测增加做出反应。
方法
热带雨林中观
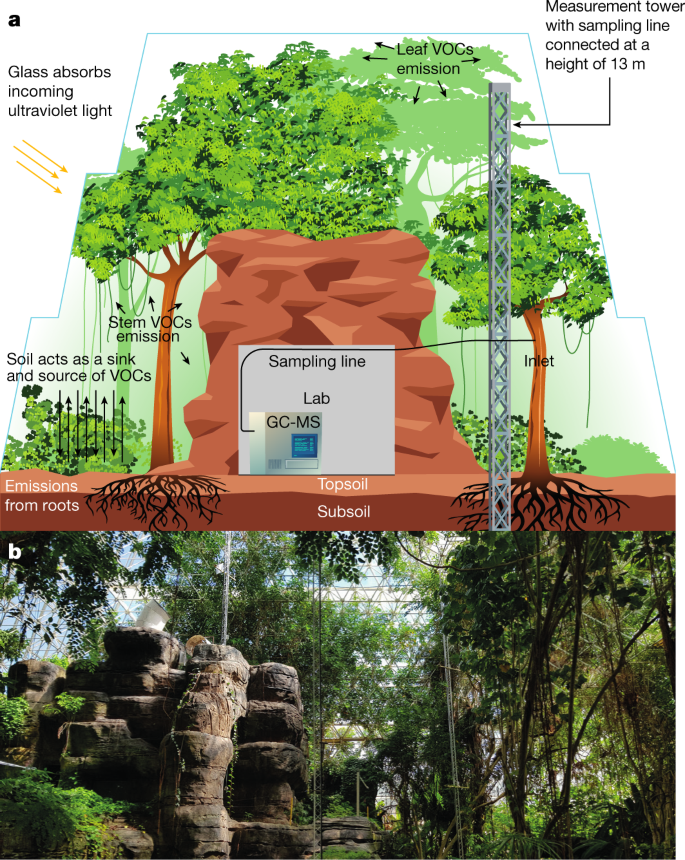
生物圈2的热带雨林中观圈覆盖约1,950米2它是热带雨林生态系统的代表,与南美洲的热带雨林生态系统类似。它包含在一个27,700米3.玻璃金字形的外壳,位于美国亚利桑那州图森附近29(无花果。1).园内有95种热带植物,其中乔木23种,林下植物67种。最具优势的物种是c . fairchildiana,商dioica,Arenga pinnata,热带榕属植物benjamina,Syngonium podophyllum,风笛手sp。穆萨sp.而且Pachira aquatica.为了重现真实的雨林环境,例如树冠下的弱光、较大的树木和林下植物(穆萨sp。风笛手sp。扶桑)被种植在玻璃外壳的边缘,以阻挡阳光直射。大部分生物量(约85%)分布在大(胸高为> ~ 15cm直径)乔木中,约10%分布在林下乔木中,约5%分布在林下草本物种中(包括穆萨sp。月桃sp。Hedychiumsp.和姜Sp .,沿着墙壁种植)。Clitoria fairchildiana主导树冠层(约33%)。Pterocarpus indicus而且h . tiliaceus它们分别占树冠面积的15%和10%。所有其他树种都只占5%或更少。
在热带雨林中没有使用进一步的照明。土壤剖面由深达4米的底土层和厚度各异(70-100厘米)的表土层组成。30..位于热带雨林中心的是一座小型人工“山”,在这座山中建造了一个实验室,用于在线GC-MS,并且可以控制内部的环境温度和湿度。因此,生物圈2号是热带雨林未来排放模型的理想数据源和测试平台,其他森林生态系统的类似设施是必要的。
干旱实验
这个实验是在水、大气和生命动力学(WALD)活动期间进行的。为了确保干旱的及时进展,在2019年5月31日实验前,对生态系统水分的控制首先关闭了美观的水景(瀑布、池塘、溪流)。在干旱期开始之前,为了模拟降雨,热带雨林被喷洒系统从上方湿润,每周三次,大约使用2万升水。2019年10月7日浇水后,雨林生物群落被晾干。在严重干旱期间(2019年11月1日至2019年12月2日),使用大型空气处理机积极降低RH。空气首先冷却以产生冷凝,然后再加热以保持温度。为了提高干旱条件,várzea亚生境的孤立流域持续的地下水位在整个严重干旱期间被排干。在某些阶段,使用空气处理装置通过冷凝来去除湿度,否则,雨林生物群落将自然干燥,直到2019年12月3日。第一次进入雨林的水是通过生物圈2号下面的混凝土和钢结构顶部土壤下的排水管道网络引入的。2019年12月12日11时,再次使用洒水系统和约35000升水从上方为雨林浇水,12月19日11时,约36000升水。 The rainforest was then watered at 00:00 every two days afterwards, adding 20,000 l of water to the rainforest over a 4.5-h period. The rainforest temperature was controlled throughout the experiment and the temperature at 13 m was, on average, between 28 and 32 °C during daylight hours and between 21 and 24 °C during night-time hours7.
使用连接到数据记录器的传感器(PAR传感器(Apogee SQ-110, Campbell Scientific, Logan, UT, USA),使用Vaisala HMP45C传感器(Vaisala Oyj, Vantaa, Finland;通过Campbell Scientific购买))。传感器每15分钟通过AM16/32B多路复用器向集中式CR1000数据记录器(Campbell Scientific, Logan, UT, USA)报告一次。数据记录仪通过NL100通信模块连接到中央数据库(Campbell Scientific, Logan, UT, USA)。PAR传感器位于中央测量塔13米的高度,湿度和温度传感器位于东北测量塔13米的高度,以及采样入口。土壤水分数据如图所示。二维是4个不同土壤坑(土壤湿度和温度传感器(SMT-100, Truebner GmbH, Neustadt,德国)和水势传感器(TEROS 21, METER Group, Pullman, WA,美国)在所有4个5厘米深的坑和土壤-混凝土界面(底土底部)每15分钟记录的测量结果的平均值。传感器宽30mm,垂直插入土壤,中点处为土壤深度,每个深度为±1.5 cm。
雨林围护体充当了一个半封闭系统,在这个系统中,与外界环境有不断的空气交换。使用六氟化硫(SF6)在低ppb水平下作为示踪气体,因为它完全是人为的,其在背景空气中的浓度< 10ppt,因此只受泄漏和冲洗的影响(扩展数据图)。3 b).测量空气交换率,25至30毫升SF6注入雨林,从而产生约1ppb的浓度(约为背景空气的125倍,约8 ppt)。科幻小说6采样发生在仪器实验室旁边,使用单个过滤入口连接到¼“OD特氟龙管。SF的浓度6使用SRI温室气体气相色谱(SRI Instruments, Torrance, CA, USA),在350°C下使用电子捕获检测器测量1ml的自动样品循环。用HayeSep D色谱柱在65°C分离SF6样品和超高纯度N2N载流2O.每2.5分钟收集样品并进行分析。SF的指数衰减6用生物圈2号雨林中的浓度来计算汇率,并报告为% /小时7,29.一度SF的百分比汇率6,利用VMR ?方程对测量数据进行校正c= VMRu+ (VMRu× ER),其中VMR .u是未更正的数据,ER是汇率百分比和VMRc为修正后的数据,并假定传入的VOCs vmr可以忽略不计。活动结束后,使用臭氧分析仪(205型,2B Technologies, Boulder, CO, USA)对B2-TRF中的臭氧进行了量化。
异戊二烯和单萜烯环境混合比例的测定
2019年9月9日至12月23日,生物圈2号雨林内13层高的环境空气以每分钟约800毫升的流量连续吸入−1通过一个主要的聚四氟乙烯进口管道,该管道由37米长的0.625厘米(¼”)聚四氟乙烯油管组成。选择13 m作为取样高度,因为这是围地中叶面积指数最大的高度。主入口管路安装有一个Cole-Parmer EW-02915-31过滤器。大约26米后,一个t型件连接到主入口管路,主入口管路使用7米长的0.3175 cm(1/8”)聚四氟乙烯管连接到热解吸装置(TD) (TT24-7xr, Markes International Ltd., UK)。所有取样线都绝缘并加热至50°C,以避免水在线内凝结。为了避免取样死容积,在输油管后面的流道上安装了一个泵。在采样过程中,该泵以70 - 200毫升/分钟的流量从主入口管路抽取空气−110分钟。收集的空气首先通过水冷凝器(Kori-xr, Markes International Ltd., UK)进行采样。这样可以去除水分,同时保持目标VOCs不变。然后将除湿样品预浓缩到30°C的冷注入阱中(Material emissions, Markes International Ltd., UK)。取样后,用氦气以50 ml min的流速吹扫注入阱1分钟−1然后快速加热至300°C,解吸3分钟。样品以3ml min的氦流量从冷阱中取出−1,包括分流2毫升每分钟−1,并注入分离柱。
使用气相色谱仪(6890A, Agilent Technologies, UK)分析雨林环境空气。载气为6.0级氦气(Airgas,美国),样品化合物的分离采用30 m β-DEX 120色谱柱(Sigma-Aldrich GmbH,德国),内径0.25 mm,膜厚0.25 μm。所使用的温度程序如下:40°C持续5分钟,然后40°C至150°C,持续4°C−1150°C至200°C, 30°C min−1.柱流量设置为1ml min−1.
气相色谱仪与四极质谱仪(5973N,安捷伦技术公司,英国)耦合,在选择离子模式下操作,用于鉴定质量离子68、69、93、94、119、120、136和137,每个停留时间为60 ms。
目标化合物的鉴定是通过首先在扫描模式下操作质谱仪来获得完整的质谱,以便能够与NIST 70-eV电子电离库进行比较。为了进一步确认,将含有目标化合物的气体标准混合物(Apel-Riemer Environmental Inc., 2019)注入GC-MS系统。同样的气体标准混合物也被注入到吸附剂墨盒中,随后解吸到气相色谱-飞行时间质谱仪中,操作条件与在线GC-MS相同。使用液体标准,单个化合物的顶空被带到吸附剂墨盒上,也被解吸到气相色谱-飞行时间质谱计中。然后,从色谱图中得到的单个化合物的保留时间与气体标准混合物的色谱图进行交叉检查。
质谱仪每周进行一次调整,并在整个活动中检查线性度。气体标准混合物注入系统后,每次调整和10个样品分析。常规校准通过最初用气体标准混合物以20 ml min的流量冲洗TD系统来进行−1静置2分钟,去除死容积。然后以20ml min的流量注入校准气体−15分钟后,直接在TD内的冷注入疏水阀上。然后用与常规样品相同的TD GC-MS参数处理校准气体样品。这一步重复了三次,然后继续采样。然后将质谱仪对注入校准气体样品的响应与上一次质谱仪调谐以来的时间进行对比,以跟踪质谱仪灵敏度的下降,从而对原始数据进行校正和校准。为了检查线性关系,使用相同的程序,将校准气体注入时间从0.5分钟逐步增加到12.5分钟,间隔为2.5分钟。
Werner等人描述了整个生态系统对干旱的响应,并提出了来自质子转移反应飞行时间质谱仪(PTR-TOF-MS)的数据,以表示异戊二烯,以与相应的土壤和试管通量数据保持一致7.值得注意的是,Werner等人的图1e中显示的异戊二烯数据为日平均值(24小时),而图中显示的数据为日平均值。2日间平均值(PAR > 0.1 μmol m−2年代−1).这里的重点是对映体单萜,它只能通过GC-MS技术测量,因为需要预先分离。因此,为了一致性,我们使用相同的GC-MS仪器测量异戊二烯。尽管在时间特征上大致相似,但在干旱早期,来自两个系统的异戊二烯痕迹的浓度有所不同(PTR-TOF-MS较低)。尽管对两个系统进行了严格的调查,但没有发现导致差异的原因,即使进水口彼此靠近。因此,我们得出结论,造成差异的唯一合理原因是,两种仪器的采样线具有不同的流速,从而对不同的局部影响空气进行了采样。由于异戊二烯的时间行为仅被用作新生排放信号一般行为的指标,因此在这种情况下,仪器之间异戊二烯浓度的短期差异并不重要,使用其他数据集也可以得出相同的结论。
数据管理
测得的最高个体vmr出现在干旱早期,(−)-α-蒎烯超过3ppb, (+)-α-蒎烯超过400ppt。1 c).然而,为了评估所有测量化合物在每个阶段的总体趋势,通过应用Savitzky-Golay滤波器来平滑每小时的总单萜烯和异戊二烯数据,以保留长期趋势,同时去除短期波动(扩展数据图。6).数据集进一步分为白天和夜间,使用在测量点收集的PAR数据。然后使用平滑函数(MATLAB)抑制每种化合物趋势线上的噪声,并使用相同的函数传播不确定性。为了获得每种化合物的平均日数周期,在运动的五个阶段中每个阶段都取了所有数据的平均组成。对每组应用一个窗口长度为5个数据点的移动中位数计算。干旱前、早期干旱、重度干旱、深水再湿和雨水再湿的日周期平均分别超过435、526、349、136和193个数点。β-月桂烯、(+)-β-蒎烯、α-松烯和松烯也被观察到,但不包括在内,因为在整个测量期间,它们的平均含量不到平均总单萜烯的5%。也观察到Ocimene,但未使用在线GC-MS系统校准。
VPD (kPa)由温度(T)和相对湿度根据参考。38, VPD = 0.6108(1−RH/100)e17.27T/ (237.3 +T).区域3和区域4是两个高度区域,包含了生物圈2雨林的大部分冠层(扩展数据图。3).环境条件是位于这些区域的所有传感器的平均值。净生态系统交换(NEE)是根据CO的摩尔变化每15分钟计算一次2以及CO的含量2与外界空气交换时所损失或获得的,NEE = ((CO2t−有限公司2t−1) + (co227米−有限公司2外) × ER))/面积,其中CO .2t、有限公司2t−1、有限公司227米和有限公司2外一氧化碳的摩尔数是多少2在计算的时间,之前的时间步长,27米或雨林顶部的空气流出,外面的空气进入雨林。面积是指雨林的土壤表面积。一氧化碳的摩尔数2是根据理想气体定律和CO2浓度,单位是CO的摩尔2= (V×P) / ((273.15 +T大街)×R) × [co2) / 106,其中V为产地来源证的代表性体积2测量(雨林体积分数或空气交换体积),P表示压力(使用WeatherHawk WXT530, Vaisala Oyj, Vantaa, Finland测量生物圈2雨林内外的压力),T大街表示测量区域的平均空气温度或室外空气温度(使用HMP45C温湿度传感器(Vaisala Oyj, Vantaa, Finland)测量),R为气体常数,[CO2]表示CO2用GMP343 CO测量生物圈2内的浓度2传感器(Vaisala Oyj,万塔,芬兰)和生物圈2号外部的GMP220传感器(Vaisala Oyj,万塔,芬兰)和空气流入内部的Aerodyne Dual QCL (Aerodyne研究公司,比勒里卡,MA,美国)。生态系统同化(一个, μmol m−2年代−1)由NEE计算,并假设夜间呼吸(R)是白天呼吸的代表(在热带森林生态系统中,这是一个合理的假设39,40),一个= nee−R.
13有限公司2脉冲标记实验
的13有限公司2脉冲于2019年10月5日08:00 (MST)和2019年11月23日09:00 (MST)进行,以配合光合作用活动峰值41.研究人员特意在阳光直射量大的日子里进行脉冲实验,这样光合作用的速率就会很高,以最大限度地提高CO的含量2吸收。在第一次脉冲期间,雨林用10 lpm(99%)熏蒸13有限公司2(MilliporeSigma, Burlington, MA, USA) 15分钟。为了平衡干旱期间减少的碳同化率,20 lpm为99%13有限公司2在第二次脉冲时被释放了超过15分钟。的δ13大气CO的C值2使用可调谐红外激光直接吸收光谱仪(Aerodyne Research, Billerica, MA, USA)在每个脉冲期间对热带雨林中的细菌进行监测。在第一次脉冲的4小时和第二次脉冲的5.2小时之后,穿过雨林的气流增加了,在中午,窗户暂时从b2 -后机匣和过量的外壳上移除13有限公司2被通风到外面的空气,使进入13C进入介观世界可以更准确地追溯到一个固定的时间点。
确定对映体13碳同位素比值
在大气塔13米高度的热带雨林生态系统中分析了空气中丰富的单萜对映体对。预脉冲、第一次脉冲、第一次后脉冲、第二次后脉冲、第二次后脉冲分别采样5、16、36、11和14个玻璃弹。对于萜烯的积累,在控制流速为200ml min的情况下,将环境空气吸入充满约100mg Tenax (Sigma,德国)作为吸附剂的玻璃筒中−1使用手持泵(SKC Ltd, Dorset, UK),持续90分钟。玻璃盒保存在4°C,直到分析。样品在弗莱堡大学的一个系统上进行分析,该系统由气相色谱仪(7980,Agilent Technologies,德国)耦合到质量选择检测器(5975C, Agilent Technologies,德国),并配备TD (Gerstel,德国)和冷注射系统(Gerstel,德国)组成。用于分析13C同位素比率,该系统通过燃烧炉(GC5接口,Elementar Analysensysteme GmbH, Langenselbold, Germany)耦合到同位素比率质谱仪(isprime precisION, Elementar Analysensysteme GmbH, Langenselbold, Germany)。为了进行分析,将空气取样玻璃筒加热到220°C 5分钟,以热吸附萜烯,并将其导入冷注射系统,该系统保持在−70°C。通过将冷注入系统加热到240°C 3分钟,萜烯被导向气相色谱分离柱(β - dex 120手性,60 m × 250 μm × 0.25 μm, Supelco,美国),氦气流1 ml min−1.烤箱程序在45°C开始,保持1分钟,然后以2°C min的速率逐步增加到60°C, 150°C和210°C−1, 1°C min−13.5℃min−1,分别。将洗脱液分离,约10%直接用于萜烯鉴定的质量选择检测器。为此,质量选择检测器运行在SIM模式检测米/z68 93 119和136。剩余的洗脱液通过燃烧炉,在850°C的温度下,萜烯被氧化生成CO2和H2H2阿纳菲恩的水陷阱13C /12CO的C比2采用同位素比质谱仪进行测定。
异戊二烯分析的细节由Werner等人提供。7.简单地说,大气中异戊二烯的浓度是在热带雨林的13米高度测定的。为此,将环境空气通过¼”加热的全氟烷氧管吸入质子转移反应飞行时间质谱仪(4000ultra PTR-TOF-MS, IONICON Analytik,因斯布鲁克,奥地利)。测量5分钟,每50 - 60分钟(贴标1)和每30 - 66分钟(贴标2)交替进行;在这些间隔中,质量控制后使用2分钟平均值。
异戊二烯校准气体的显式校准使用液体校准装置(IONICON Analytik,因斯布鲁克,奥地利)获得的稀释曲线定期进行。所得数据用软件包PTRwid进行处理。
异戊二烯的标记13C从13有限公司2被计算为丰度之比的单13c标记异戊二烯同位素(米/z69经PTR-TOF-MS分析为米/z69)与总异戊二烯,即非标记异戊二烯同位素(米/z68被测量为米/z69)加上单标记同位素。由于天然的丰富13C(1.1%),考虑到异戊二烯分子的5个C原子,单标记异戊二烯的本底水平为5.5%。从所示数据中减去这一背景水平(扩展数据图。7一个).
统计信息
的t-用于图中所示数据的测试。3.和扩展数据图。7 e是单尾,双样本,方差不相等吗t-使用MATLAB R2017b软件进行的测试(扩展数据表3.).
GC-IRMS数据处理
13C同位素从GC中洗脱的速度略快于它们12C对应,即δ13C值在峰值上不均匀42.对于色谱上未解析的化合物,如(−)-α-蒎烯(扩展数据图)。7 e),从峰的开始到它与随后未确定的溶蚀峰之间的槽积分,得到δ13C值似乎被人为地增加了13C.绝对δ13这些化合物的C值不能报告。因此,我们报告测量δ之间的相对偏移13C的值13有限公司2脉冲和环境条件,ε13c = (12C /13C)脉冲/(12C /13C)环境)−1.单击“确定”。(−)-α-蒎烯相对于其附体的丰度改变了其表观δ13C值时,我们确信这些色谱效应不能相对地说明13C的富集过程中,该化合物13有限公司2脉冲有两个原因。首先,13样品中C的富集13有限公司2相对于周围δ的可变性,脉冲明显富集13C值,其相对峰值高度的变化范围较大。第二,13C的富集只在13有限公司2当(−)-α-蒎烯以各种组合形式与溶蚀驼峰中的其他三个峰集成时,而当其他任何一个峰单独集成时,则不会产生脉冲(扩展数据图)。7 e).
未见(+)-α-蒎烯富集13选C。13有限公司2脉搏。然而,鉴于它的小尺寸和较差的分辨率从之前的未标记峰值,我们不能明确排除轻微13C富集(+)-α-蒎烯。月桂烯、反式-β-西烯和(+)-柠檬烯均具有良好的前端溶解和较差的尾部溶解。这些化合物要么显示高13C的富集13有限公司2脉冲(两次脉冲均为反式β-洋烯,第二次脉冲为月桂烯)或完全不富集(第一次脉冲为月桂烯,两次脉冲均为(+)-柠檬烯)。因为这些色谱上相似的峰只显示较大13在某些化合物中C的富集,而在其他化合物中没有,我们认为这些化合物的明显存在或不存在标签摄取是可靠的结果(扩展数据图)。7 c, d).
土壤单萜类吸收与排放试验
为了研究单萜烯是如何被土壤吸收和排放的,三个由聚氯乙烯制成的土壤室被放置在预先安装在B2-TRF周围的土壤圈上(扩展数据图)。2).使用吸附剂墨盒,样品从大气中取出,位于进口(MR自动取款机)的土壤室,同时从出口(MR土壤).在200ml min采集样品−1使用手持泵(SKC Ltd, Dorset, UK)进行大约10分钟的冲洗。吸附剂墨盒由惰性涂层不锈钢制成(SilcoNert 2000 (SilcoTek,德国))。吸附剂由150mg Tenax TA和150mg Carbograph 5TD (560 m2g−1).碳图颗粒的大小在20-40目范围内。Carbograph 5TD由LARA s.r.l.(罗马,意大利)和Buchem B.V. (Apeldoorn,荷兰)提供Tenax。
数据可用性
本手稿中使用的所有数据都是公开的(https://doi.org/10.5281/zenodo.6517513).
参考文献
Jokinen, T.等人。从生物排放中生产极低挥发性有机化合物:测量产量和大气影响。国家科学院学报112, 7123-7128(2015)。
恩格尔hart, G. J., Asa-Awuku, A., Nenes, A. & Pandis, S. N.新鲜和陈年单萜二级有机气溶胶的CCN活性和液滴生长动力学。大气压。化学。理论物理。8, 3937-3949(2008)。
lathawornkitkul, J., Taylor, J. E., Paul, N. D. & Hewitt, C. N.地球系统中生物源性挥发性有机化合物。新植醇。183, 27-51(2009)。
Yáñez-Serrano, a.m.等。热带雨林中的单萜化学物种形成:在亚马逊高塔天文台(ATTO)随季节、高度和时间的变化。大气压。化学。理论物理。18, 3403-3418(2018)。
贾丁,K. J.等。热带森林-大气对气候变暖响应的单萜“温度计”。植物细胞环境。40, 441-452(2017)。
Guenther, A.等。来自自然的气体和气溶胶排放模型2.1版(MEGAN2.1):生物源排放建模的扩展和更新框架。Geosci。模型开发。5, 1471-1492(2012)。
沃纳,C.等人。在一个实验森林干旱和恢复期间的生态系统通量。科学374, 1514-1518(2021)。
Zannoni, N.等。令人惊讶的手性成分在亚马逊雨林中随着高度、时间和季节的变化而变化。Commun。地球环境。1, 4(2020)。
Williams, J., Yassaa, N., Bartenbach, S. & Lelieveld, J.热带和北方森林的镜像碳氢化合物。大气压。化学。理论物理。7, 973-980(2007)。
Song, W., Staudt, M., Bourgeois, I. & Williams, J.对映体单萜烯发射随化学型、光和温度变化的实验室和现场测量。Biogeosciences11, 1435-1447(2014)。
Staudt, M., Byron, J., Piquemal, K. & Williams, J.在海洋松林中发现的隔间特异性手性蒎烯排放。科学。总环境。654, 1158-1166(2019)。
夏基,t.d.,叶,s.s.植物异戊二烯排放。为基础。Rev.植物物理。植物分子生物学。52, 407-436(2001)。
卡尔,T.等人。热带森林和火灾排放实验:亚马逊地区低层大气中生物挥发性有机化合物的排放、化学和运输。j .地球物理学。研究大气压。112, d18302(2007)。
帕祖基,L. & Niinemets, Ü。多底物萜合酶的存在及其生理意义。前面。植物科学。7, 1019(2016)。
单萜类化合物的生物合成和分解代谢。化学。牧师。87, 929-954(1987)。
李志强,李志强,李志强,李志强。火炬松单萜类合成酶研究(松果体taeda)产生蒎烯异构体和对映体。拱门。物化学。Biophys。372, 197-204(1999)。
Degenhardt, J., Köllner, T. G. & Gershenzon, J.单萜和倍半萜合酶与植物萜类骨架多样性的起源。植物化学70, 1621-1637(2009)。
Niinemets U。,Loreto, F. & Reichstein, M. Physiological and physicochemical controls on foliar volatile organic compound emissions.植物科学9, 180-186(2004)。
Niinemets U。地中海硬叶植物叶片组织中非特异性单萜类储存对排放动力学和组成影响的模型分析Quercus物种。全球Biogeochem。周期16, 57-1-57-26(2002)。
政府间气候变化专门委员会。气候变化2014:综合报告。第一、第二和第三工作组对政府间气候变化专门委员会第五次评估报告的贡献151 pp (IPCC, 2014)。
《森林与气候变化:森林的强迫、反馈和气候效益》。科学320, 1444-1449(2008)。
洛雷托,F. & Schnitzler, j.p。非生物胁迫和诱导BVOCs。植物科学15, 154-166(2010)。
Kainulainen, P., Oksanen, J., Palomäki, V., Holopainen, J. & Holopainen, T.干旱和涝渍胁迫对针叶单萜的影响挪威云杉.可以。j .机器人。70, 1613-1616(1992)。
Turtola, S., Manninen, a.m.。,Rikala, R. & Kainulainen, P. Drought stress alters the concentration of wood terpenoids in Scots pine and Norway spruce seedlings.j .化学。生态。29, 1981-1995(2003)。
拉沃尔等人。干旱减少了地中海常绿橡树的单萜排放量Quercus冬青属植物:贯通位移实验结果。Biogeosciences6, 1167-1180(2009)。
Ghirardo, A.等。测定四种常见北方/高山树木萜烯的从头排放和池排放13有限公司2标签和PTR‐MS分析。植物细胞环境。33, 781-792(2010)。
Lüpke, M., Leuchner, M., Steinbrecher, R. & Menzel, a .针叶树物种对实验干旱响应的单萜排放源的量化。国内工厂9, plx045(2017)。
生物圈2的红树林介观:设计、建立和初步结果。生态。Eng。6, 21-56(1996)。
Pegoraro, E.等人。大气CO升高的影响2干旱对温带和热带雨林中异戊二烯的来源和汇的影响。全球变化生物学。11, 1234-1246(2005)。
Pegoraro, E., Rey, A., Abrell, L., Van Haren, J. & Lin, G.干旱对生物圈2热带雨林异戊二烯生产和消耗的影响。全球变化生物学。12, 456-469(2006)。
兰福德等人。遥远亚马逊上空异戊二烯排放和氧化产物的季节性。环绕。科学。大气压。2, 230-240(2022)。
Asensio, D., Penuelas, J., Filella, I. & luusia, J.土壤VOCs交换对水分、温度和根系存在的响应的在线筛选。植物的土壤291, 249-261(2007)。
自然挥发性有机化合物排放的季节和空间变化。生态。达成。7, 34-45(1997)。
水作为溶剂的亨利定律常数汇编(4.0版)。大气压。化学。理论物理。15, 4399-4981(2015)。
阿伯特,t.h. &克罗宁,t.w.气溶胶通过增加湿度对大气对流的促进作用。科学371, 83-85(2021)。
梅西纳,P.等人。ORCHIDEE和MEGAN模型中的全球生物源挥发性有机化合物排放及其对关键参数的敏感性。大气压。化学。理论物理。16, 14169-14202(2016)。
贝尔克罗斯,A., Bé, A. G., Geiger, F. M. & Thomson, R. J.二聚α-蒎烯氧化产物的分子手性和云活化电位。j。化学。Soc。143, 16653-16662(2021)。
兰伯斯,H. & Oliveira, R. S. in植物生理生态学187-263(施普林格,2019)。
Restrepo-Coupe, N.等。是什么驱动了亚马逊盆地光合作用的季节性?巴西通量网涡流通量塔测量的跨站分析。阿格利司。对。Meteorol。182 - 183, 128-144(2013)。
胡蒂拉,L. R.等。季节性对亚马逊雨林中碳和水交换的控制。j .地球物理学。Biogeosci >,112, g03008(2007)。
Rascher, U.等人。模拟热带雨林干旱期间光合作用的功能多样性——叶面积、光合电子传递和气孔导度对减少净生态系统碳交换的贡献植物细胞环境。27, 1239-1256(2004)。
Ricci, M. P., Merritt, D. A., Freeman, K. H. & Hayes, J. M.同位素比率监测质谱数据的获取和处理。Org。Geochem。21, 561-571(1994)。
确认
我们非常感谢来自欧洲研究委员会(ERC整合拨款#647008)的财政支持2),以及Philecology基金会、Biosphere 2、l.k.m。我们要感谢B2WALD团队的所有成员的宝贵支持,详情见B2WALD捐款清单(https://doi.org/10.25422/azu.data.14632662).J.B.得到了马克斯·普朗克研究生中心和约翰内斯Gutenberg-Universität美因茨(MPGC)的支持。这项工作得到了欧盟委员会地平线2020 ULTRACHIRAL项目的支持。fetopen - 737071)。我们非常感谢来自2B Technologies的J. Birks为活动后测试提供了臭氧仪器。
资金
马克斯·普朗克学会提供的开放获取资金。
作者信息
作者及隶属关系
贡献
J.B.有了这个想法,进行了在线GC-MS采样,分析了数据并撰写了论文。j.k进行了离线GC-IRMS实验室分析并计算了ε13C值。gp计划并执行了常压枪弹取样。J.v.H.计算了同化率和大气水势数据,提供了气象数据,并帮助进行了干旱实验。S.N.L, L.K.M.和C.W.监督和规划了该项目,进行了干旱实验和13有限公司2标签实验,并对论文进行评论。J.W.有了这个想法,监督了这个项目并写了论文。所有作者都对手稿的撰写和编辑做出了贡献。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
同行评审
同行评审信息
自然感谢Franz Badeck和其他匿名审稿人对本工作的同行评审所作的贡献。同行评审报告是可用的。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
扩展的数据图形和表格
扩展数据图1测量化合物之间的相关性。
一个,b,测得的大气中单萜烯浓度的相关矩阵。一个, Pre-drought。b,严重干旱。颜色表示相关性的强度和方向。相关性是基于皮尔逊相关系数。c,d(+)-α-蒎烯和(−)-α-蒎烯在干旱各阶段的相关性。c,日间相关性。d,夜间相关性。夜间的数据相关性更强,这表明排放源比白天的来源更相似。
扩展数据图2从分支试管和土壤室中获取的吸收管数据。
一个,位于B2-TRF附近的土壤室中单个单萜类植物的平均土壤通量。所示值是三个土壤室出口样品和2-3个大气样品筒在土壤室进口处的计算中值。b,c,测量了两个试管的四个分支的排放物c . fairchildiana(b),风笛手sp。c)显示干旱期间不同的排放趋势。doy 280上的虚线表示干旱的开始,doy 346上的虚线表示干旱的结束和雨水再湿润的开始。doy 337上的灰色阴影线显示了地下深复湿的日子。
图3 B2-TRF菌群和SF菌群示意图6泄漏率。
一个, B2-TRF的高度被划分为五个区域。A13是GC-MS对大气进行采样的位置。b,科幻小说6整个测量周期的泄漏率百分比。科幻小说6注入B2-TRF大气中,用GC-MS测量,以表征流经通风导致的空气损失率。
图4三酶基模型示意图。
实线箭头表示该化合物的主要发射途径,虚线箭头表示次要途径。
图5测量的(−)-α-蒎烯时间剖面与MEGAN模型的比较。
一个,用MEGAN模型计算α-蒎烯发射量和α-蒎烯通量之和随时间的函数,该模型使用测量塔上从13米处测量的温度数据和在生物圈2号外测量的PAR数据。b,(−)-α-蒎烯和(+)-α-蒎烯浓度的日变化周期,以及(−)-α-蒎烯和(+)-α-蒎烯的联合发射通量。c296号径条严重干旱期间(−)-α-蒎烯和(+)-α-蒎烯浓度的日变化周期,以及(−)-α-蒎烯和(+)-α-蒎烯的联合发射通量。
扩展数据图6日日间平均浓度和平滑平均图。
一个、异戊二烯和总单萜。b(-)-α-蒎烯,(+)-α-蒎烯,(-)-β-蒎烯和其他单萜烯的总量。c,(−)-α-蒎烯、(+)-α-蒎烯、(-)-β-蒎烯的夜间平均浓度及其他单萜总量。d校准(−)-α-蒎烯测量值(黑色)与平滑的白天(红色)和夜间(棕色)趋势线。平滑的线条是通过应用Savitzky-Golay滤波器和移动平均滤波器来创建的,如“数据管理”部分所述。
扩展数据图713C富集异戊二烯和(-)-α-蒎烯。
一个,13用PTR-TOF-MS测量的异戊二烯C富集量显示,标记脉冲当天的富集量显著高于标记脉冲前的水平,但标记脉冲之后的几天则没有。b,从GC-IRMS中获得的色谱图,显示所识别化合物的峰。c, GC-IRMS色谱图显示反式-β-西胺峰。综合区域以灰色阴影表示。d, GC-IRMS色谱图显示β-月桂烯峰。整合区域以灰色阴影表示。e的箱形图表示13C富集(−)-α-蒎烯。每种方法都代表了GC-IRMS色谱中(−)-α-蒎烯峰的不同积分方式。积分方法在箱形图上方的子图中描述。为一个而且e,灰色方框为不存在时环境空气中化合物含量的标准差13有限公司2脉搏。穿过灰色方框的黑线代表平均值。箱形图表示中位数,以及第25和第75百分位。小方块表示平均值,胡须表示不被视为异常值的最大和最小采集数据点。重要结果由方框上方的星号(*)表示(即,如果P≤0.05)。统计资料e所示为扩展数据表3 b.
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
拜伦,J.,克罗伊茨维泽,J.,事务长,G.。et al。手性单萜揭示森林排放机制和干旱响应。自然609, 307-312(2022)。https://doi.org/10.1038/s41586-022-05020-5
收到了:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41586-022-05020-5