摘要gydF4y2Ba
通过伴侣-引子途径组装的黏附菌毛是介导宿主组织定植和革兰氏阴性细菌生物膜形成的毛发样附属物gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.古老的伴侣-引子途径菌毛是最多样化和最广泛的伴侣-引子途径粘连素,由于其在最棘手的多药耐药病原体中普遍存在,是很有前途的疫苗和药物靶点gydF4y2Ba1gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba.然而,它们的结构和组装-分泌过程尚不清楚。在这里,我们展示了介导生物膜形成的原型古Csu菌毛的冷冻电子显微镜结构gydF4y2Ba鲍曼不动杆菌gydF4y2Ba一种臭名昭著的多药耐药医院病原体。与经典的1型和P型菌毛的厚螺旋管相比,古代菌毛组装成超薄的锯齿形结构,由优雅的固定机构固定。分子固定为菌毛提供了高机械稳定性和超弹性,据我们所知,这是首次在生物分子中观察到的特性,同时能够更经济、更快地生产菌毛。此外,我们证明了在细胞表面的锚定形成通过外膜驱动毛的分泌。这些发现表明,锚定形成抑制剂可能代表一种对抗耐多药细菌感染的新策略。gydF4y2Ba
主要gydF4y2Ba
黏附菌毛,或称毛毛,是介导细菌感染和生物膜形成的毛发状表面附属物。在革兰氏阴性菌中,大多数粘附菌毛是由蛋白质亚基通过伴侣-引子途径(CUP)组装而成的。gydF4y2Ba1gydF4y2Ba.CUPs被细分为三组,包括六个主要的系统发育分支:另类(α-fimbriae),经典(β-, γ-, κ-和π-fimbriae)和古老(σ-fimbriae)gydF4y2Ba1gydF4y2Ba.研究得最好的经典CUPs包括具有尖端粘连素亚基的刚性菌毛(如P和1型菌毛)以及已知起多粘连素作用的较薄的柔性菌毛(如Saf, Psa和F4)gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.尽管经典的和替代的CUPs仅限于β-和γ-变形菌门,但古老的CUPs更为普遍,存在于广泛的门中gydF4y2Ba1gydF4y2Ba.古老的CUPs是很有希望的疫苗和药物靶点,因为它们广泛分布在最棘手的病原体中,包括全耐药病原体gydF4y2Ba答:baumanniigydF4y2Ba和gydF4y2Ba铜绿假单胞菌gydF4y2Ba1gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba.gydF4y2Ba
致密生物膜的形成是生物的基本特征gydF4y2Ba答:baumanniigydF4y2Ba作为一种医院病原体,因为它适合在表面生存和持久性gydF4y2Ba4gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.这种生物膜的形成是由通过古老的伴侣-引子Csu - csud途径组装的Csu菌毛介导的gydF4y2Ba4gydF4y2Ba.Csu菌毛包括形成菌毛棒的主要亚基CsuA/B,适配器亚基CsuA和CsuB,以及通过暴露的疏水指状环与各种基质结合的双结构域尖端粘附素CsuEgydF4y2Ba7gydF4y2Ba.形成棒状的CsuA/B亚基偏离了标准的Ig-fold,采用了不同寻常的结构,从β-sheet中突出两个突出的发夹A ' -A″和B - B 'gydF4y2Ba8gydF4y2Ba.这种双发夹结构是古代杯子所特有的gydF4y2Ba8gydF4y2Ba.此外,与传统和替代CUPs的厚而硬的纤维相比,Csu霹雳纤维出奇地薄gydF4y2Ba7gydF4y2Ba这表明了一种本质上不同的菌毛结构。经典的CUP刚性菌毛通过填充到厚的中空螺旋管中形成四元结构gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba可以拉长和放松,以抵抗强烈的冲洗流动gydF4y2Ba12gydF4y2Ba.古菌毛的分子结构和生物力学性质尚不清楚。因此,我们试图使用冷冻电子显微镜(cryo-EM)获得Csu毛杆的结构,并使用光镊测量Csu毛杆的力延伸响应。gydF4y2Ba
Csu毛杆结构gydF4y2Ba
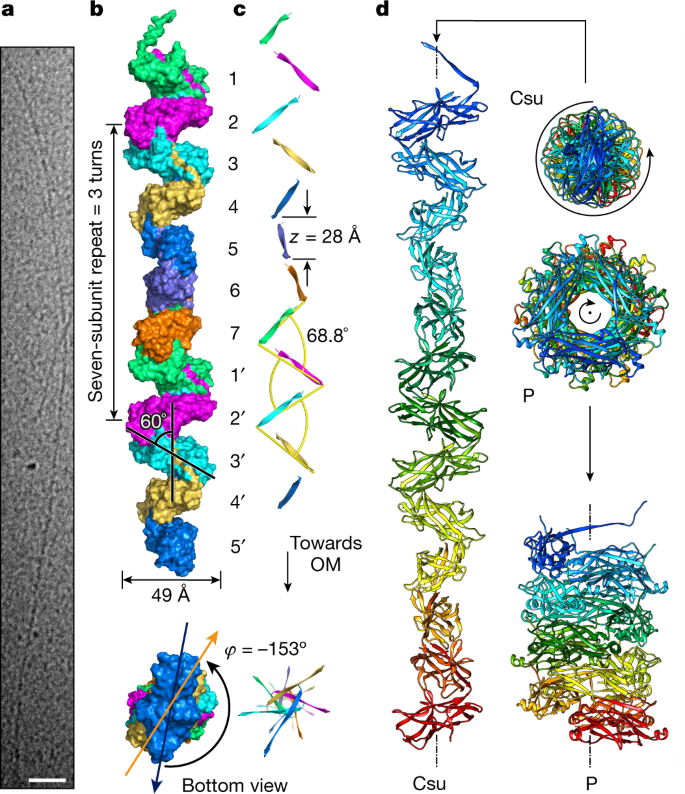
低温电镜显微照片显示毛毛又细又长,但非常坚硬(图。gydF4y2Ba1gydF4y2Ba).Csu杆的结构确定为3.4的总体分辨率Å(扩展数据图。gydF4y2Ba1gydF4y2Ba,补充表gydF4y2Ba1gydF4y2Ba及补充视频gydF4y2Ba1gydF4y2Ba).Csu菌毛是一种细长的(约23 Å)左旋纤维,呈螺旋状上升(gydF4y2BazgydF4y2Ba)的28.0 Å和子单元之间的旋转(gydF4y2BaφgydF4y2Ba−153°(图;gydF4y2Ba1 b, cgydF4y2Ba).毛突相对于螺旋轴倾斜约60°,彼此倾斜约69°,侧投影时毛突呈锯齿状。这种建筑与传统的传统建筑有本质上的不同gydF4y2Ba10gydF4y2Ba(无花果。gydF4y2Ba1 dgydF4y2Ba).值得注意的是,在Csu棒材中,每个亚单位的螺旋上升比P菌体长3倍(图2)。gydF4y2Ba1 dgydF4y2Ba).因此,古老的组合似乎更经济,Csu毛蕊在相同的毛蕊合并速度下,预计其长度增长速度是P毛蕊的三倍。gydF4y2Ba
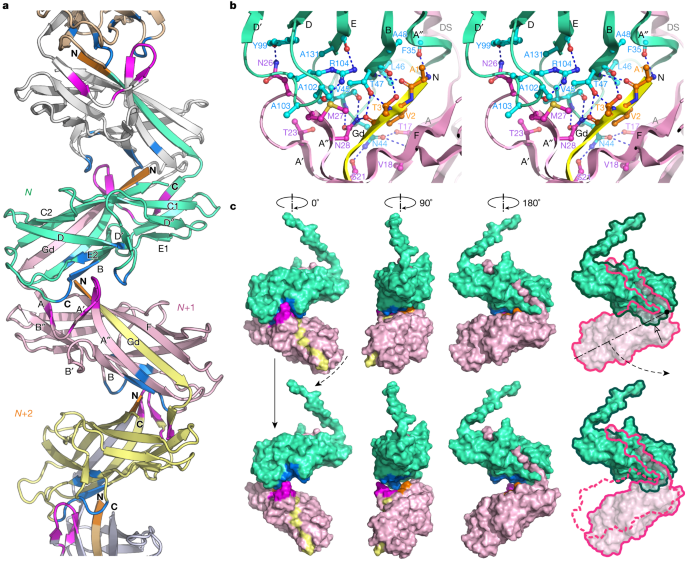
与它们的经典对应物相反,Csu棒中的亚基不是通过一个,而是通过两个结合机制连接在一起。首先,即将到来的CsuA/BgydF4y2BaNgydF4y2Ba+ 1gydF4y2Bapilin亚基插入其供体链GdgydF4y2BaNgydF4y2Ba+ 1gydF4y2Ba进入前CsuA/B的疏水槽gydF4y2BaNgydF4y2Ba亚基(无花果。gydF4y2Ba2gydF4y2Ba).这与其他CUPs中的供体链互补(DSC)相似gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba.第二种结合机制是古代系统特有的,包括一个A ' -A ', B - B '双发夹,从CsuA/B的一侧像手臂一样突出。gydF4y2Ba2gydF4y2Ba和扩展数据图。gydF4y2Ba2gydF4y2Ba).在菌毛中,CsuA/BgydF4y2BaNgydF4y2Ba+ 1gydF4y2Ba不仅提供GdgydF4y2BaNgydF4y2Ba+ 1gydF4y2BaCsuA / BgydF4y2BaNgydF4y2Ba,而且还将其A ' -A "发卡插入CsuA/B的口袋gydF4y2BaNgydF4y2Baβ-链B和E2与环D-D '(图;gydF4y2Ba2 a, bgydF4y2Ba).此外,GdgydF4y2BaNgydF4y2Ba+ 2gydF4y2Ba第三亚单位CsuA/BgydF4y2BaNgydF4y2Ba+ 2gydF4y2Ba与CsuA/B互补gydF4y2BaNgydF4y2Ba+ 1gydF4y2Ba通过其突出的n端与CsuA/B中的β-链A”和B结合gydF4y2BaNgydF4y2Ba.因此,CsuA / BgydF4y2BaNgydF4y2Ba牢固地固定在CsuA/B的两个延伸表面之间gydF4y2BaNgydF4y2Ba+ 1gydF4y2Ba- gdgydF4y2BaNgydF4y2Ba+ 2gydF4y2Ba模块(图。gydF4y2Ba2 a - cgydF4y2Ba):一个来自A ' A "发夹(图。gydF4y2Ba2摄氏度gydF4y2Ba(洋红色)),另一个来自Gd的n端部分gydF4y2BaNgydF4y2Ba+ 2gydF4y2Ba(无花果。gydF4y2Ba2摄氏度gydF4y2Ba(橙色))。最后,CsuA/B中β- A链和A - A '环的残基gydF4y2BaNgydF4y2Ba+ 1gydF4y2Ba在CsuA/B底部的A " -B环中与残基形成若干接触gydF4y2BaNgydF4y2Ba,从而将两个主要的绑定位点连接起来,形成连续的600个Å的绑定面gydF4y2Ba2gydF4y2Ba有41个相互作用残基和13个氢键(图;gydF4y2Ba2 bgydF4y2Ba及补充视频gydF4y2Ba1gydF4y2Ba).聚类接触提供了近三分之一的相互作用表面(32%)和氢键网络(31%)。gydF4y2Ba
一个gydF4y2Ba,杆的卡通图。在A链和A’-A”发夹上,Gd给体链N端和受体位点分别以洋红色、橙色和海蓝色显示。两个中心亚基中的N和C末端以及β链被标记。gydF4y2BabgydF4y2Ba,抱紧接触的立体视图。相邻亚基CsuA/BgydF4y2BaNgydF4y2Ba和CsuA / BgydF4y2BaNgydF4y2Ba+ 1gydF4y2Ba,和GdgydF4y2BaNgydF4y2Ba+ 2gydF4y2Ba亚单位CsuA/BgydF4y2BaNgydF4y2Ba+ 2gydF4y2Ba补充CsuA / BgydF4y2BaNgydF4y2Ba+ 1gydF4y2Ba,分别以绿色、粉色和黄色显示。相互作用的残留物显示为球和棒。虚线代表氢键。参见补充视频gydF4y2Ba1gydF4y2Ba.gydF4y2BacgydF4y2Ba钉钉的结构决定了钉钉形成或钉钉拉伸过程中菌毛的刚性和亚基运动轨迹。相邻的两个亚基(绿色和粉红色)和第三个亚基(黄色)的Gd的分子表面,如图所示,在绕毛根螺旋轴旋转后观察结构得到三个方向。顶部,全封闭结构。底部,部分打开构象的模型,由围绕连接器旋转下部亚基约17°产生。所涉及的胶扣残留物的颜色如中所述gydF4y2Ba一个gydF4y2Ba.开放的箭头指向埋在子单元之间的表面。参见补充视频gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
Gd和绒毛球状结构域之间的连接器是柔性的,但a’-A”发夹和Gd N末端限制了绒毛的旋转为上下运动(图2)。gydF4y2Ba2摄氏度gydF4y2Ba及补充视频gydF4y2Ba2gydF4y2Ba).因此,锚定接触赋予了菌毛刚性,并决定了在锚定形成或菌毛拉伸过程中亚单位运动的轨迹(图。gydF4y2Ba2摄氏度gydF4y2Ba).gydF4y2Ba
Csu霹雳是超弹性之字形弹簧gydF4y2Ba
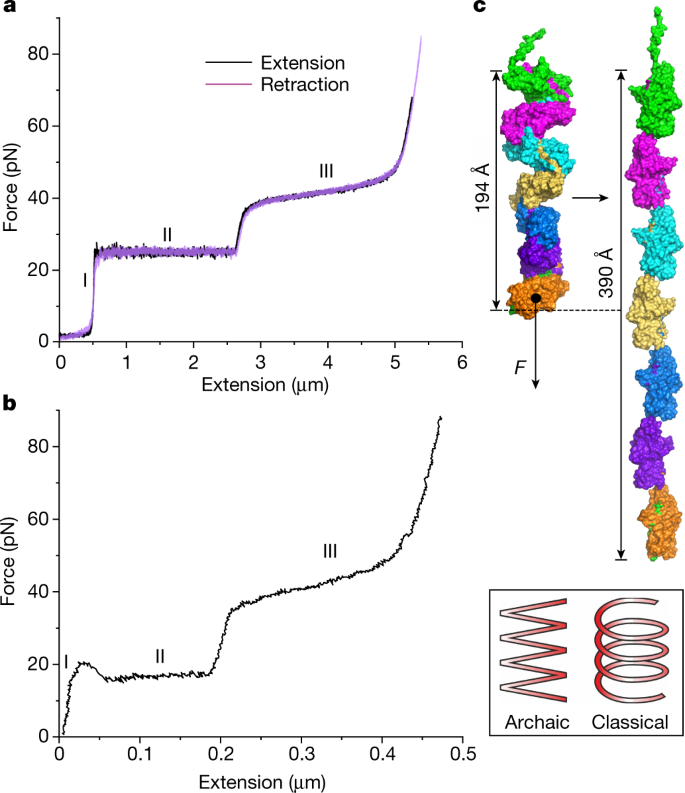
使用光镊力谱法对单个Csu菌毛的生物力学特性进行了检测(试验示意图见扩展数据图)。gydF4y2Ba3gydF4y2Ba).正如我们之前的生物膜定量表明,Csu菌毛有效地结合聚苯乙烯使用指尖手指gydF4y2Ba7gydF4y2Ba,我们使用聚苯乙烯微珠作为探针珠进行测量。在进行这些测量之前,我们用探针珠摩擦缺乏菌毛的细胞表面,以确认没有来自膜系索的力响应。没有一个控制单元显示任何系绳(扩展数据图。gydF4y2Ba3 bgydF4y2Ba).因此,我们可以评估扩展下的Csu力响应(黑色曲线),其中包括先前报道的刚性经典P pili的三个区域gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba(无花果。gydF4y2Ba3gydF4y2Ba和扩展数据图。gydF4y2Ba3.gydF4y2Ba).最初,力随杆的拉伸线性增加,表示杆的弹性拉伸(区域I),然后,力随杆的拉伸不变(区域II),该区域被解释为杆的四阶螺旋构象的有序展开。因此,在Csu霹雳,它应该对应于一个线性化之字形灯丝。最后,力再次线性增加,并转移到表示弹性拉伸的s型曲线,并且可能是柱状结构的变化(区域III)gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.当反转运动并允许毛束后退时,古典和古代毛束显示出本质上不同的收缩反应。先前的研究表明,刚性经典的CUP菌毛表现出与恢复螺旋结构所需的菌毛松弛相关的力下降gydF4y2Ba21gydF4y2Ba.相比之下,Csu菌毛的收缩响应(图。gydF4y2Ba3.gydF4y2Ba(紫色曲线))完美地跟踪了延伸,让人想起形状记忆金属在受到外部应力变形后恢复原始形状。因此,古老的Csu菌毛就像一个超弹性的分子之字形弹簧。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba、个别WT的力伸展及收缩测量例子(gydF4y2Ba一个gydF4y2Ba)和Val2Ala (gydF4y2BabgydF4y2Ba) Csu毛用光镊。注意扩展的不同规模。罗马数字(I-III)表示力延伸(黑色)和收缩(紫色)曲线中定义的三个区域。扩展数据图中显示了非纤毛细菌的其他例子和对照试验。gydF4y2Ba3.gydF4y2Ba.gydF4y2BacgydF4y2Ba, Csu菌毛可以通过握紧开口伸展到两倍的长度。表面图显示了一个七亚单位螺旋重复棒和最大延伸纤维的模型。插图:在分子弹簧设计的概念差异示意图之间的古(之字形)和刚性经典(螺旋)杆。gydF4y2BaFgydF4y2Ba力。gydF4y2Ba
通过拟合一个可扩展的蠕虫状链模型(考虑了熵弯曲波动和焓拉伸)来分析区域I的力响应,揭示了Csu pili的持续长度为0.89±0.17µm,拉伸模量为870±120 pN(平均值±s.d),表明该结构具有高刚度(表1)gydF4y2Ba1gydF4y2Ba;拟合区域I的可扩展虫状链示例示于扩展数据图。gydF4y2Ba3 dgydF4y2Ba).利用持续长度和拉伸模量,计算了区域I的毛弹簧常数和抗弯刚度(弯曲刚度;表格gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
值得注意的是,区域II的平均长度与平均菌毛的估计长度相同(表2)gydF4y2Ba1gydF4y2Ba).因此,Csu之字形长丝可逆地展开成正好是其长度两倍的线性构象。这种近乎整数的延伸率(2.01)也在建模中被揭示出来,这是毛状结构的特殊几何结构的结果:打开锁扣将毛状结构的倾斜从大约60°改变为大约0°或从余弦gydF4y2Ba∼gydF4y2Ba0.5gydF4y2Ba∼gydF4y2Ba1(无花果。gydF4y2Ba3 cgydF4y2Ba).Csu之字形灯丝的延展性不如螺旋管,如P菌毛,它可以展开到原始长度的六倍左右gydF4y2Ba22gydF4y2Ba.然而,Csu菌毛可以在更高的力下被进一步拉伸(区域III)。在P菌毛中,这一过程与杆亚基中α-螺旋的展开和亚基的拉伸有关gydF4y2Ba20.gydF4y2Ba表明在这些力作用下,CsuA/B可能发生较大的构象变化。gydF4y2Ba
打开压紧触点所需的平均力类似于许多紧密填充的螺旋管束的unwind力gydF4y2Ba22gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Ba).这一显著的巧合表明,这两种不同的结构都进化为适应相似的剪切力。然而,Csu霹雳比古典霹雳更有活力。而经典的1型毛筒在放卷速度大于0.006 μm s时,其放卷力迅速增大gydF4y2Ba−1gydF4y2Ba,导致力在0.1µm s时增加了20 pNgydF4y2Ba−1gydF4y2Ba(ref。gydF4y2Ba23gydF4y2Ba),在20 μ s范围内,Csu菌毛的力响应基本不变gydF4y2Ba−1gydF4y2Ba,仅增加约5个pN(扩展数据图。gydF4y2Ba3 hgydF4y2Ba).Csu之字形长丝对拉伸力的快速响应可能是由于其线性化的四元结构,其中子单元只与最近的邻居相互作用。相比之下,在P菌毛的螺旋管中,每个菌毛与其他10个亚基相互作用,这大大降低了unwind速率,限制了响应流体流速突然变化或波动的能力gydF4y2Ba23gydF4y2Ba.因此,古老的之字形细丝可以潜在地介导湍流环境中的细菌附着。gydF4y2Ba
咬合形成驱动毛毛分泌gydF4y2Ba
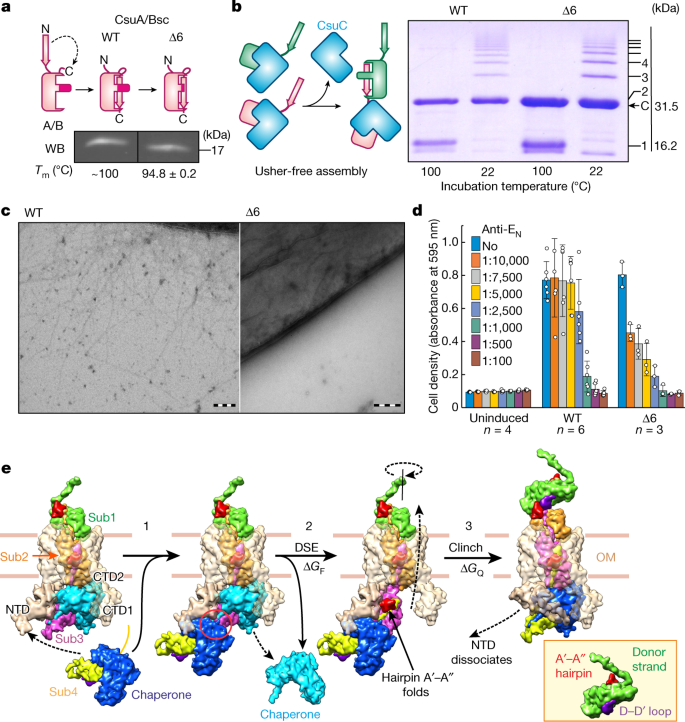
考虑到钉钉的相互作用面积较大,我们假设钉钉或其形成可能具有附加功能,并通过诱变评估其在毛毛稳定性、组装和分泌中的作用。首先,我们替换了a’a”发卡的大部分(残基TEGNMN;扩展数据图。gydF4y2Ba2摄氏度gydF4y2Ba)加上一个甘氨酸(Δ6;扩展数据表gydF4y2Ba1gydF4y2Ba及补充表gydF4y2Ba2gydF4y2Ba).自补型CsuA/B亚基(CsuA/Bsc) Δ6突变体的表达水平和热稳定性与野生型CsuA/Bsc相似(图2)。gydF4y2Ba4gydF4y2Ba,扩展数据表gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba4gydF4y2Ba- - - - - -gydF4y2Ba6gydF4y2Ba).此外,缺失对CsuA/B聚合物在周质中的无引子组装没有影响(图2)。gydF4y2Ba4 bgydF4y2Ba).然而,Δ6突变完全消除了细胞表面毛的表达,这可以通过两种细胞相关毛的成像观察到。gydF4y2Ba4摄氏度gydF4y2Ba和扩展数据图。gydF4y2Ba4gydF4y2Ba)和表面剪切菌毛(扩展数据图。gydF4y2Ba5gydF4y2Ba),提示该缺失破坏了通过usher通道的菌毛易位。同样,A’-A”发夹内较短的缺失(MN到G, QTE到G, EGNM到G)不影响亚基的稳定性或组装,但阻止了毛的分泌(扩展数据表)gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba4gydF4y2Ba- - - - - -gydF4y2Ba6gydF4y2Ba).B-B '发夹(AAT到G)的缺失实际上也消除了分泌,尽管它与邻近的毛尖没有直接接触。这一结果强调了它在维持A’A”发夹的结合能力构象中的作用。D-D’环(AART到G, AAR到G, ART到GG)的缺失构成了a’-A”发夹受体位点的主要部分,类似地阻止了Csu菌群的表面表达,尽管它们也显著降低了亚基稳定性,导致无引物组装效率较低。与缺失突变体相比,在同一区域的残基取代表现出更高的稳定性,但在细胞表面没有毛(Tyr99Ala/Ser)或只有非常少量的毛状物质(Arg104Ala)。此外,除部分埋藏的Met27外,A’-A”发夹和受体位点的关键残基(Asn28、Asn26、Gly25和Ala103)的取代取消或严重抑制了分泌,只允许在一些细菌上组装少数毛状结构。与EM和原子力显微镜(AFM)成像数据一致,使用western blotting对热分离(表面剪切)WT和met27突变体的菌毛进行分析,发现了一条厚厚的CsuA/B条带,而在其他突变体的表面剪切菌毛中没有检测到CsuA/B,或检测到CsuA/B数量减少。gydF4y2Ba5 bgydF4y2Ba).Csu菌毛为细菌提供了强大的“降落伞效应”,这是菌毛细胞抵抗沉淀的一种特有能力,这是对菌毛分泌的额外控制(扩展数据图)。gydF4y2Ba5度gydF4y2Ba).正如预期的那样,除了Met27Ala外,所有的螯合突变要么大幅降低(Arg104Cys和更大程度上的Val2Ala),要么基本上消除了降落伞效应,这进一步表明了螯合接触在菌毛分泌中的作用。gydF4y2Ba
一个gydF4y2Ba, WT和Δ6 CsuA/Bsc结构示意图,并对提取的周质进行western blot (WB)分析gydF4y2Ba大肠杆菌gydF4y2Ba表达这些结构。熔化温度(gydF4y2BaTgydF4y2Ba米gydF4y2Ba)的含量如下表所示gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba).gydF4y2BabgydF4y2Ba、CsuC辅助CsuA/B组装原理图及CsuC- (CsuA/B) SDS-PAGE分析gydF4y2BangydF4y2Ba从与WT共表达CsuC或Δ6 CsuA/B的细胞周质中纯化的复合物,在22°C或100°C下预培养。CsuC (C, 31.5 kDa)和(CsuA/B)位置gydF4y2BangydF4y2Ba与gydF4y2BangydF4y2Ba= 1-8gydF4y2BangydF4y2BakDa)。gydF4y2BacgydF4y2Ba的透射电镜阴性染色gydF4y2Ba大肠杆菌gydF4y2Ba包含WT或Δ6gydF4y2Ba基督教社会联盟gydF4y2Ba基因簇。比例尺,200nm。gydF4y2BadgydF4y2Ba,通过WT或Δ6形成生物膜gydF4y2Ba基督教社会联盟gydF4y2Ba大肠杆菌gydF4y2Ba不同浓度的抗尖端(anti-CsuE NTD, anti-EgydF4y2BaNgydF4y2Ba)抗体。数据为均数±标准差。单井数据用圆表示,井数(gydF4y2BangydF4y2Ba)表示。其他突变体的分析见扩展数据图。gydF4y2Ba4gydF4y2Ba- - - - - -gydF4y2Ba7gydF4y2Ba数据汇总在扩展数据表中gydF4y2Ba1gydF4y2Ba.gydF4y2BaegydF4y2Ba, Csu毛堆组装-分泌周期(扩展数据图。gydF4y2Ba8gydF4y2Ba).Δ的gydF4y2BaGgydF4y2BaFgydF4y2Ba折叠能量和ΔgydF4y2BaGgydF4y2Ba问gydF4y2Ba第四结构形成的自由能分别由伴侣和引子驱动组装和分泌保存(补充视频gydF4y2Ba3.gydF4y2Ba).Western blot和凝胶来源数据见补充图。gydF4y2Ba1 b, cgydF4y2Ba.gydF4y2Ba
值得注意的是,突变并没有阻止生物膜的形成(图。gydF4y2Ba4 dgydF4y2Ba和扩展数据图。gydF4y2Ba7一个gydF4y2Ba),尽管它们使生物膜更容易受到抗尖端(抗csue n端结构域(NTD))抗体的抑制。与这一发现相一致的是,我们用Eu在突变菌表面检测到了CsuE尖端亚基gydF4y2Ba3 +gydF4y2Ba-标记抗尖端抗体(扩展数据图。gydF4y2Ba7 bgydF4y2Ba).这一结果表明,由CsuA、CsuB和csue亚基组成的某种形式的短毛毛或尖端纤原体仍可能在细胞表面组装并出现指尖附着位点。值得注意的是,观察到由这些短结构介导的生物膜更容易受到抗尖端抗体的抑制,这表明最佳的附着需要毛杆的参与。这表明生物力学性质或细菌细胞间杆介导的相互作用可能在这一过程中发挥作用,促进了这一课题的研究。gydF4y2Ba
为了研究Gd N末端在键合形成中的作用,我们用丙氨酸取代了介导相互作用的绒毛之间重要疏水接触的val2。gydF4y2Ba2 bgydF4y2Ba).突变耐受性良好,不影响组装,但导致非典型的短毛(表gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba4gydF4y2Ba).Val2Ala菌毛的力延伸响应在形状上与WT菌毛相似,但在所有三个延伸区域都要短得多(图2)。gydF4y2Ba3 bgydF4y2Ba).7倍短的展开区域II表明Val2Ala菌毛比WT菌毛短7倍(表2gydF4y2Ba1gydF4y2Ba).此外,突变受损的触点的打开需要更低的张力。因此,这种突变提供了一个中间案例,表明分泌菌毛的长度与握紧接触的强度呈正相关。Arg104Cys突变体代表了另一种有趣的中间情况。尽管突变Arg104Cys显著减少了表面毛毛的总数,但与受突变影响的其他毛毛相比,这些毛毛更长,并介导了更强的降落伞效应(扩展数据图)。gydF4y2Ba4gydF4y2Ba和gydF4y2Ba5 b, cgydF4y2Ba).Arg104Cys菌毛的力-伸展曲线与WT菌毛相似,但其展开力明显较低,区域II较短(表104cys)gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba3我gydF4y2Ba).因此,在Val2Ala的情况下,这种突变对紧合接触的紧密性和第四系菌毛结构的长度都有负面影响。综上所述,螯合的形成与菌毛杆的分泌有关,是Csu菌毛在细胞表面高效表达的必要条件。gydF4y2Ba
为了了解锁结形成如何促进分泌,我们基于Csu系统和经典CUPs的可用结构对组装-分泌过程进行了建模(图2)。gydF4y2Ba4 egydF4y2Ba扩展数据图gydF4y2Ba8gydF4y2Ba及补充视频gydF4y2Ba3.gydF4y2Ba).即将到来的csu - csua /B预装配综合体gydF4y2Ba24gydF4y2Ba被吸收到引子NTD上,而生长的毛状体的伴染色体基(由Sub1-Sub2-Sub3片段表示)位于引子c端结构域CTD1和CTD2gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba(图1-2步骤gydF4y2Ba4 egydF4y2Ba和扩展数据图。gydF4y2Ba8gydF4y2Ba).伴侣结合Sub4的Gd取代了GgydF4y2Ba1gydF4y2Ba通过供体链交换(DSE)将碱基伴侣链连接到Sub4和Sub3gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba.DSE导致Sub3的完全折叠并形成A ' -A '和B-B '发夹gydF4y2Ba8gydF4y2Ba.然而,由于Sub2进入了狭窄的引子通道,伴随子结合的Sub4只是部分折叠,并且缺少自己的双发夹,因此Sub3不能与其相邻的亚基形成键合接触gydF4y2Ba24gydF4y2Ba.细胞表面的亚基Sub1和Sub2之间只能形成键合接触(图2)。gydF4y2Ba4 egydF4y2Ba(步骤3))。因此,双发夹的形成不是在DSE之前,而是在DSE之后,有三个目的。首先,它提供了一个额外的折叠潜力来驱动组装gydF4y2Ba8gydF4y2Ba.其次,它可以防止过早的亚基附着,从而使纤维保持分泌所需的细长结构。最后,它使亚基易位后立即形成第四纪结构。gydF4y2Ba
分泌步骤包括将碱基从NTD切换到ctd。这种转换似乎不是由碱基与CTDs的结合所驱动的,因为碱基与CTDs之间既没有重要的疏水作用,也没有亲和作用(扩展数据图)。gydF4y2Ba9gydF4y2Ba),质疑驱动CUPs分泌的力量和能量的起源。FimD引子NTD最近被证明可以护送基地,直到它到达ctd,并与CTD2形成相互作用,这可能有助于基地从NTD释放gydF4y2Ba29gydF4y2Ba.我们的研究结果表明,第四系结构的形成极大地促进了毛杆的分泌,代表了另一种驱动力。由于形成单个钉结会使纤维长度恰好减少一个绒毛的长度,因此钉结的形成可能会主动地将亚基拉到细胞表面,而不会在每个周期中引入它们的位置变化(扩展数据图)。gydF4y2Ba8gydF4y2Ba).此外,锁扣的形成可能会防止分泌步骤的倒退,这可能会导致底座在从NTD释放后从引子上滑落,永久堵塞组件(扩展数据图。gydF4y2Ba8 bgydF4y2Ba).未来对CsuD引子组装-分泌机制的结构研究将有助于验证这些假设。gydF4y2Ba
讨论gydF4y2Ba
基于搭扣dsc的之字形灯丝可能是最早、应用最广泛的通过CUP组装的灯丝结构。这种经济的设计使毛杆具有惊人的高机械稳定性,快速的动态性能和超弹性。毛毛分泌过程涉及到一种优雅的机制,只允许在细胞表面形成固定(图。gydF4y2Ba4 egydF4y2Ba).因此,与伴侣蛋白保留亚基的折叠能量以驱动毛的组装类似,usher抑制第四系结构的形成,保留亚基间接触的能量以通过膜驱动毛的分泌。值得注意的是,经典CUP亚基的聚合物可以很容易地采用古代菌毛的之字形纤维结构(扩展数据图)。gydF4y2Ba9罪犯gydF4y2Ba),这表明两种菌毛在到达最终第四纪结构形成阶段之前可能遵循相似的保守分泌途径。因此,不能排除刚性螺旋菌毛的分泌可能部分由亚基间的中间接触驱动,而不是最终的亚基间接触,这一课题值得进一步研究。更灵活的聚胶菌毛的分泌过程以及尖端纤原纤维结构也不清楚。它可能涉及较弱的四元相互作用,缺乏高分辨率的表征。阐明无处不在的古生菌毛的结构和组装-分泌过程将为开发抗持续性细菌感染的附着形成抑制剂铺平道路。gydF4y2Ba
方法gydF4y2Ba
细菌菌株和质粒gydF4y2Ba
大肠杆菌gydF4y2Ba用菌株DH5α进行质粒繁殖。蛋白表达gydF4y2Ba大肠杆菌gydF4y2BaBL21-AI (FgydF4y2Ba−gydF4y2Ba经济新闻gydF4y2BaTgydF4y2BahsdgydF4y2Ba年代gydF4y2BaBgydF4y2Ba(右gydF4y2BaBgydF4y2Ba−gydF4y2Ba米gydF4y2BaBgydF4y2Ba−gydF4y2Ba)gydF4y2Ba加gydF4y2Ba扩张型心肌病gydF4y2BaaragydF4y2BaB:: T7RNAP -gydF4y2Ba春节gydF4y2Ba一个;英杰公司)。基于pBAD-Csu(A/B)ABCDE构建表达质粒gydF4y2Ba7gydF4y2BapET101-6HCsuA / BdscgydF4y2Ba8gydF4y2Ba和pET101-CsuC6H-CsuA / BgydF4y2Ba24gydF4y2Ba.用反PCR法产生缺失和替换。被删除的密码子被精确地使用一对对应于被删除序列下游的意义链或上游的互补链的引物删除。为了产生插入和替换,寡核苷酸被设计成分别包含额外的核苷酸或核苷酸变化。扩增片段经DpnI处理,纯化后钝端自结扎后转化gydF4y2Ba大肠杆菌gydF4y2BaDH5α。为了在pBAD-Csu中引入突变,首先将质粒的NotI - SpeI片段亚克隆到pGEM5、pSP72或pBluescript载体中,通过PCR产生突变,然后利用NotI和SpeI酶将pBAD-Csu中的原序列替换为突变片段。通过中间结构和最终结构的测序确认突变。在补充表中提供了寡核苷酸和生成质粒的列表gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
蛋白表达及纯化gydF4y2Ba
WT和突变体CsuA/B与CsuC伴侣蛋白共表达,携带一个c端HisgydF4y2Ba6gydF4y2Ba标签,在周围gydF4y2Ba大肠杆菌gydF4y2Ba含有pET101-CsuC6H-CsuA/B-##质粒系列(补充表gydF4y2Ba2gydF4y2Ba).WT和突变体CsuA/Bsc均表达于gydF4y2Ba大肠杆菌gydF4y2Ba含有pET101-6HCsuA/Bdsc-##质粒系列(补充表gydF4y2Ba2gydF4y2Ba).如前所述,通过渗透休克获得质周组分gydF4y2Ba30.gydF4y2Ba.简而言之,球团细胞在20 mM Tris-HCl pH 8.0, 5 mM EDTA的20% (w/v)蔗糖中重悬。在冰上孵育10分钟后,通过离心收集细胞(7000gydF4y2BaggydF4y2Ba15分钟),小心地重新悬浮在冰冷的5毫米MgSO中gydF4y2Ba4gydF4y2Ba.细胞在7000度时再次成粒gydF4y2BaggydF4y2Ba静置15分钟,收集上清液(即质周部分)。WT和突变体CsuCgydF4y2BaHis6gydF4y2Ba——(CsuA / B)gydF4y2BangydF4y2Ba通过镍螯合色谱从周质中纯化络合物,基本上如上所述gydF4y2Ba24gydF4y2Ba.WT和突变体CsuA/BscgydF4y2BaHis6gydF4y2Ba如前所述,通过镍螯合色谱纯化gydF4y2Ba8gydF4y2Ba,对20 mM双- tris丙烷进行透析,pH值9.0,并在Mono Q 5/50GL柱上通过阴离子交换层析进一步纯化(GE Healthcare)。对于圆二色测量,使用PD-10脱盐柱将缓冲液交换为12.5 mM磷酸钾,pH值为7.0 (GE Healthcare)。使用NanoDrop 2000分光光度计(赛默飞世尔科学公司)测量蛋白质浓度。gydF4y2Ba
为了表达Csu缘毛的WT和突变变体,gydF4y2Ba大肠杆菌gydF4y2Ba将抗氨苄西林pBAD- csu (pBAD-(CsuA/B)ABCDE)及其衍生物转化BL-21-AI细胞(补充表)gydF4y2Ba2gydF4y2Ba).选择克隆在添加100 μg ml的Luria-Bertani (LB)培养基中培养gydF4y2Ba−1gydF4y2Ba氨苄西林于37℃过夜,用1:400稀释后的含80-100 μg ml的LB培养基刷新gydF4y2Ba−1gydF4y2Ba氨苄青霉素。细胞在37℃下生长到600 nm光密度0.8-1.0,然后用0.2%进行诱导gydF4y2BalgydF4y2Ba(+)-阿拉伯糖蛋白表达,并进一步培养2.5小时。细胞通过两轮5000℃离心收集gydF4y2BaggydF4y2Ba30分钟,7000gydF4y2BaggydF4y2Ba10分钟。细菌颗粒在0.5 mM Tris-HCl, pH 7.4, 75 mM NaCl中重悬,在65°C下孵育1 h。孵育后,细菌通过两轮9,500的离心制成颗粒gydF4y2BaggydF4y2Ba10分钟。仔细收集含有分离Csu菌毛的上清液,并在4°C保存后进行分析。在低温电镜分析前,采用负染透射电镜对制剂质量进行评价。gydF4y2Ba
纯化菌毛的EM阴性染色分析gydF4y2Ba
将纯化的Csu菌毛涂抹在formvar涂层的发光放电金网格(琼脂科学)上,孵育1分钟。将多余的样品吸干后,用两滴水冲洗网格,再次吸干,然后用2%的乙酸铀酰染色。图像是在80kv的JEM-1400 Plus透射电子显微镜(JEOL)上获得的。gydF4y2Ba
低温电子显微镜gydF4y2Ba
含有分离的Csu菌毛的上清液浓缩至约10 g lgydF4y2Ba−1gydF4y2Ba使用分子质量截断为100 kDa的Vivaspin设备(Sartorius Stedim)。然后,4 μ l样品被应用到发光放电的Quantifoil R2/2 300目铜网格涂有超薄碳(电子显微镜科学)。在4°C和100%湿度下,使用Vitrobot Mark IV(赛默飞世尔科学公司)将网格吸干并浸入液态乙烷中冷冻。数据采集于300 kV Titan Krios电子显微镜(Thermo Fisher Scientific)上,配有Gatan K3直接电子探测器,操作在超分辨率模式下,像素大小为0.433 Å,离焦范围为−1.0至−3.0 μm。每个Å的总剂量为60个电子,并在40帧中平均分配,以考虑剂量加权。SerialEM (v.3.6)用于自动冷冻电镜数据收集。冷冻电镜数据收集的详细情况汇总在补充表中gydF4y2Ba1gydF4y2Ba.Csu菌毛的典型冷冻电镜显微照片见补充图。gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
低温电镜图像处理和重建gydF4y2Ba
使用MotionCor2 (v.1.2.3)对剂量分割的视频帧进行波束诱导运动校正。gydF4y2Ba31gydF4y2Ba.使用CTFFIND (v.4.1.13)估计CTF。在RELION (v.3.0.8)中进行图像处理和螺旋重建gydF4y2Ba32gydF4y2Ba.在EMAN 2中使用e2helixboxer程序从602张选定的显微照片中手动挑选细丝gydF4y2Ba33gydF4y2Ba进行二维分类,生成自动选择模板。螺旋细丝自吸后,以400像素的盒大小提取出480064个片段。经过2D和3D分类步骤后,使用255,833个片段进行3D细化。这些片段被重新缩放到1.35 Å的像素大小。利用RELION (v.3.0.8)中的随机梯度下降算法,从二维粒子从头生成重建的起始模型。螺旋对称参数使用传统的傅里叶-贝塞尔分析以及SPRING (v.0.86)中的segclassconstruct和seggridexplore模块进行估计。gydF4y2Ba34gydF4y2Ba.螺旋参数的初始估计(−157°螺旋扭曲,26.3 Å螺旋上升)使用搜索范围- 150°至−165°的扭曲和26 Å至30 Å的上升进行测试。螺旋对称(−153°螺旋扭曲,28 Å螺旋上升)在高分辨率3D细化过程中应用和细化,生成分辨率为6.18 Å的地图。应用软蒙版与凸起的余弦边缘14像素和gydF4y2BaBgydF4y2Ba-因子锐化产生了一个全局分辨率为4.8 Å的地图,通过使用独立细化的半重建之间的金标准傅里叶壳相关程序进行评估(FSC 0.143)gydF4y2Ba35gydF4y2Ba.经过两次贝叶斯抛光,然后进行3D细化和后处理,分辨率进一步提高到3.42 Å。最终的图谱显示了清晰的β链分离和大体积侧链的密度,与报道的分辨率一致。来自RELION的cryo-EM地图的像素大小略有偏差,通过使用UCSF Chimera包中的Fit in map工具计算不同体素大小的地图的相互相关系数值的范围调整为1.2949 Å (v.1.15)gydF4y2Ba36gydF4y2Ba.gydF4y2Ba
模型构建和细化gydF4y2Ba
通过对CsuA/Bsc (Protein Data Bank, PDB)晶体结构的拟合,人工建立Csu菌毛的初始模型:gydF4y2Ba6 fm5gydF4y2Ba)gydF4y2Ba8gydF4y2Ba利用UCSF Chimera将实验电子密度转化为实验电子密度。使用Chimera Fit in Map工具调整两个亚基之间的角度,首先将三个亚基二聚体对接到地图中的相邻区域,其中一个亚基重叠,并对重叠亚基的方向求平均,然后将三个二聚体完全重叠,并对所有三个二聚体的亚基方向求平均。连接供体链与A链的短连接器使用Coot (v.0.9.4)建模。gydF4y2Ba37gydF4y2Ba.通过结合Coot中的手动调整和PHENIX (v.1.8.2)中的真实空间优化,对结构进行了优化。gydF4y2Ba38gydF4y2Ba.最初的四亚基模型被简化为一个具有三个供体链互补亚基(四条链)的模型,它们占据了地图中最高分辨率的位置。使用MolProbity (v.4.5.1)对模型进行验证gydF4y2Ba39gydF4y2Ba.细化统计信息在扩展数据表中给出gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
AFMgydF4y2Ba
在添加氨苄西林的LB琼脂平板上培养细菌,用0.02%阿拉伯糖诱导产生菌毛。如前所述,用AFM成像带有菌毛的细菌细胞gydF4y2Ba40gydF4y2Ba做了一些修改。简单地说,将细菌细胞悬浮在100µl的milliq水中,并将10µl的悬浮液放置在新切割的云母表面(Goodfellow Cambridge)。样品在室温下孵育5分钟并吸干,然后放入干燥器中至少干燥2小时。使用Nanoscope V Multimode 8 AFM仪器(Bruker)收集图像,使用Bruker ScanAsyst模式,并使用以50-90 kHz共振频率振荡的Bruker ScanAsyst-air探头,使用Nanoscope (V .1.8)软件进行选择。根据扫描尺寸和样本数量(每张图像256或512个样本),以0.8-1.5 Hz的扫描速率在空气中收集图像。最终的图像在两个轴上进行平面拟合,并以振幅(误差)模式呈现。gydF4y2Ba
生物膜测定和生物膜抑制gydF4y2Ba
大肠杆菌gydF4y2Ba含有pBAD-Csu或其衍生物的菌株BL21在100 mg l的LB培养基中培养过夜gydF4y2Ba−1gydF4y2Ba氨苄青霉素。将5 ml新鲜培养基放入50 ml聚丙烯管中,加入100 μl过夜培养物,在37℃下剧烈震动培养2 h。稀释(100、500、1000、2500、5000、7500和10000倍)抗CsuE N末端多克隆抗体(Innovagen AB使用纯化的CsuE N末端定制生产)gydF4y2Ba7gydF4y2Ba在50 μl LB中,分成微量滴度板孔。用0.2%阿拉伯糖诱导细菌培养,150 μl重复与抗体稀释液混合在微量平板孔上。在37℃孵育2小时,轻轻摇晃。然后用300 μ l磷酸盐缓冲盐水冲洗两次井。任何剩余的生物膜用1%结晶紫染色15分钟,用水冲洗,晾干,溶解在250µl 0.2% Triton X-100中。使用96孔板光谱仪读取器测定595 nm处的光密度。使用Origin 2015 Sr软件(OriginLab)制作图。gydF4y2Ba
西方墨点法gydF4y2Ba
蛋白质在18% SDS聚丙烯酰胺凝胶中电泳分离,并在Bio-Rad A缓冲液(25 mM Tris, pH 8.3, 192 mM甘氨酸,20%甲醇和0.1% SDS)中转移到免疫印迹聚偏氟乙烯膜(Bio-Rad Laboratories)上,在100 V或350 mA下作用1小时。膜用5%脱脂奶在磷酸盐缓冲盐水/Tween-20中阻塞,与抗csua /B兔多克隆抗体(Innovagen AB定制)孵育gydF4y2Ba8gydF4y2Ba随后用IRDye 680rd偶联抗兔山羊抗体(Li-Cor Biosciences)孵育。使用Odyssey系统(Li-Cor Biosciences)检测蛋白带,并使用ImageJ (v.1.53k)进行量化。gydF4y2Ba
光镊测力gydF4y2Ba
为了测量Csu菌毛的生物力学特性,我们使用了一个定制的力测量光镊装置,该装置围绕一个倒置的Olympus IX71显微镜(Olympus)构建,并配备了一个水浸物(UPlanSApo60XWIR, ×60/1.2 NA;1920 × 1440像素CMOS相机(C11440-10C, Hamamatsu)gydF4y2Ba41gydF4y2Ba.为了以最小的漂移量对高信噪比的力数据进行采样,我们使用了Allan方差方法来识别噪声gydF4y2Ba42gydF4y2Ba.我们使用功率谱方法对131,072 Hz的微球位置进行采样,并平均32个连续数据集,每个数据集0.25 s。为了延伸一个壁束,我们以50纳米s的恒定速度移动压电台gydF4y2Ba−1gydF4y2Ba并对50赫兹的力和位置进行采样。为了评估菌毛第四系结构的平均轮廓长度,我们通过反转压电阶段来屈曲菌毛,直到菌毛接触细菌细胞壁。为了估算毛毛的持续长度和拉伸模量,我们用可扩展的蠕虫状链模型拟合I区域的初始力升gydF4y2Ba43gydF4y2Ba.根据这些值,我们通过拉伸模量除以轮廓长度来计算弹簧常数,通过保持长度乘以玻尔兹曼常数(4.1 pN nm)来计算弯曲刚度(弯曲刚度)。我们通过取区域I的末端延伸与区域III的开始之间的差来计算高原长度。同样,我们通过取区域I和区域III之间区域的力的平均值来计算高原力。最后,我们使用前面概述的方法估计区域III的长度gydF4y2Ba19gydF4y2Ba.所有数值均以均数±s.e.m表示。gydF4y2Ba
温度依赖性折叠转变分析gydF4y2Ba
使用Chirascan CD光谱仪(应用光物理)和110-QS大比色管(helma)测量圆二色性。在以0.150 mg ml插入目标蛋白之前,首先从缓冲液(pH 7.0时12.5 mM磷酸钾)中测量光谱背景4次gydF4y2Ba−1gydF4y2Ba浓度。在195-260 nm波长范围内测量20°C的CD光谱4次,每3 s测量间隔1 nm。对于熔化光谱,蛋白质被加热4°C,温度从19°C上升到99°C。每个光谱在30 s温度稳定时间后测量一次,波长范围为195-260 nm,每次2 s测量之间间隔1 nm。所有熔化光谱的测量时间为1 h 28 min。每个频谱都被平滑了4倍。在225 nm波长下,以1°C min的速率将样品从20°C加热到99°C,记录熔点曲线gydF4y2Ba−1gydF4y2Ba.圆二色性测量12秒,最初每1.0°C,后来每0.5°C,误差范围为0.15°C。每段录音耗时1小时19分钟。用2 M氢氧化钾对样品间的残留蛋白进行纯化。利用Chirascan用户界面中的曲线拟合函数将熔融数据拟合到sigmoid曲线+斜率方程中。gydF4y2Ba
组装-分泌过程的建模gydF4y2Ba
基于Csu菌毛棒(本文)的冷冻电镜结构和CsuA/Bsc (PDB:gydF4y2Ba6 fm5gydF4y2Ba)gydF4y2Ba8gydF4y2Bacsu - csua /B伴侣-亚基复合物(PDB:gydF4y2Ba5 d6hgydF4y2Ba)gydF4y2Ba24gydF4y2Ba.由于CsuD引子没有可用的结构,引子的模型是基于经典CU通路中的FimD引子的结构:晶体结构(PDB:gydF4y2Ba3 rfzgydF4y2Ba)gydF4y2Ba26gydF4y2Ba构象1和2的低温电镜结构(PDB编码)gydF4y2Ba6 e14灯头gydF4y2Ba和gydF4y2Ba6 e15gydF4y2Ba分别gydF4y2Ba29gydF4y2Ba).Phyre2蛋白质折叠识别服务器gydF4y2Ba44gydF4y2Ba基于整个FimD(构象1)的结构自动模拟了92%的CsuD完整氨基酸序列,置信度为100.0%。根据与预组装复合物结合的NTD的晶体结构,构建了引子在毛毛分泌不同阶段的NTD模型(PDB:gydF4y2Ba1 ze3gydF4y2Ba和gydF4y2Ba4 b0mgydF4y2Ba)gydF4y2Ba25gydF4y2Ba,gydF4y2Ba27gydF4y2BaFimD构象的低温电镜结构。立体化学分析gydF4y2Ba傻瓜gydF4y2Ba.gydF4y2Ba
统计和再现性gydF4y2Ba
所有数据均以均数±标准差表示。Csu菌毛的低温电镜图像如图所示。gydF4y2Ba1gydF4y2Ba从大约100个显微照片的数据集中选择,代表了一个单一毛的典型图像。WT和Δ6突变体表面剪切菌毛材料的冷冻电镜图像是从不同放大倍率下记录的约20张显微照片的数据集中选择的。西方的污点在无花果上。gydF4y2Ba4gydF4y2Ba和扩展数据图。gydF4y2Ba5 bgydF4y2Ba和gydF4y2Ba6gydF4y2Ba是三个独立实验的代表。WT CsuA/Bsc熔炼三次;扩展数据图显示了一次熔化实验的CD光谱。gydF4y2Ba6 bgydF4y2Ba.生物膜定量(扩展数据图。gydF4y2Ba7一个gydF4y2Ba)和细胞表面的CsuE曝光(扩展数据图。gydF4y2Ba7 bgydF4y2Ba)实验进行了两次,对更小的突变体进行了几次检查。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
坐标以登录码存放在PDBgydF4y2Ba7 zl4gydF4y2Ba.相应的低温电磁图以登录代码存放在EMDBgydF4y2Baemd - 14777gydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
Nuccio, S. P. & Baumler, A. J.伴侣/引子装配路径的进化:家族分类。gydF4y2BaMicrobiol。摩尔。杂志。牧师。gydF4y2Ba71gydF4y2Ba, 551-575(2007)。gydF4y2Ba
Zav'yalov, V., Zavialov, A., Zav'yalova, G. & Korpela, T.与经典伴侣/引座器组装的革兰氏阴性病原体的黏附细胞器:从临床角度来看的结构和功能。gydF4y2Ba《。牧师。gydF4y2Ba34gydF4y2Ba, 317-378(2010)。gydF4y2Ba
布希,A. &瓦克斯曼,G.伴侣-引子途径:多样性和毛套组装机制。gydF4y2Ba费罗斯。反式。r . Soc。Lond。BgydF4y2Ba367gydF4y2Ba, 1112-1122(2012)。gydF4y2Ba
托马斯,A. P.,多尔西,C. W.,埃德尔曼,R. E. & Actis, L. A.附着在非生物表面上的生物膜形成gydF4y2Ba鲍曼不动杆菌gydF4y2Ba:涉及一种新颖的陪同-引座员菌菌装配系统。gydF4y2Ba微生物学gydF4y2Ba149gydF4y2Ba, 3473-3484(2003)。gydF4y2Ba
Giraud, C.等。PprA-PprB双组分系统激活CupE,这是第一个非原型gydF4y2Ba铜绿假单胞菌gydF4y2Ba伴生-引子通路系统装配毛。gydF4y2Ba环绕。Microbiol。gydF4y2Ba13gydF4y2Ba, 666-683(2011)。gydF4y2Ba
塞奎拉,g.m.和法勒,a.y.gydF4y2Ba鲍曼不动杆菌gydF4y2Ba致病性gydF4y2BaIUBMB生活gydF4y2Ba63gydF4y2Ba, 1055-1060(2011)。gydF4y2Ba
Pakharukova, N.等人。结构基础gydF4y2Ba鲍曼不动杆菌gydF4y2Ba生物膜的形成。gydF4y2Ba国家科学院学报美国gydF4y2Ba115gydF4y2Ba, 5558-5563(2018)。gydF4y2Ba
Pakharukova, N.等人。古老的和替代的伴侣通过提供不完整的结构信息来保存绒毛折叠能量。gydF4y2Ba生物。化学。gydF4y2Ba293gydF4y2Ba, 17070-17080(2018)。gydF4y2Ba
Mortezaei等人。肠毒素的结构和功能gydF4y2Ba大肠杆菌gydF4y2Ba来自不同装配路径的伞毛。gydF4y2Ba摩尔。Microbiol。gydF4y2Ba95gydF4y2Ba, 116-126(2015)。gydF4y2Ba
医院,M. K.等。伴侣-引子毛的结构揭示了棒材开卷的分子基础。gydF4y2Ba细胞gydF4y2Ba164gydF4y2Ba, 269-278(2016)。gydF4y2Ba
医院,M. K.等。1型伴侣-引子毛杆的冷冻电镜结构。gydF4y2Ba结构gydF4y2Ba25gydF4y2Ba, 1829-1838(2017)。gydF4y2Ba
巴伯切克,C. R. E.布利特,E. & Andersson, M.细菌粘附菌毛。gydF4y2Ba亚晶胞。物化学。gydF4y2Ba87gydF4y2Ba, 1-18(2018)。gydF4y2Ba
乔杜里等人。尿病原学中FimC-FimH伴侣-粘连蛋白复合物的x线结构gydF4y2Ba大肠杆菌gydF4y2Ba.gydF4y2Ba科学gydF4y2Ba285gydF4y2Ba, 1061-1066(1999)。gydF4y2Ba
绍尔,F. G.等。伴侣功能与毛长发生的结构基础。gydF4y2Ba科学gydF4y2Ba285gydF4y2Ba, 1058-1061(1999)。gydF4y2Ba
扎维亚洛夫,A. V.等。荚膜F1抗原的结构和生物发生gydF4y2Ba鼠疫杆菌gydF4y2Ba:保存的折叠能量驱动纤维形成。gydF4y2Ba细胞gydF4y2Ba113gydF4y2Ba, 587-596(2003)。gydF4y2Ba
Sauer, F. G., Pinkner, J. S., Waksman, G. & Hultgren, S. J.毛簇亚基的伴侣启动促进了驱动纤维形成的拓扑转变。gydF4y2Ba细胞gydF4y2Ba111gydF4y2Ba, 543-551(2002)。gydF4y2Ba
Remaut, H.等人。伴侣辅助毛束组装中的供体-链交换通过协调的β链置换机制进行。gydF4y2Ba摩尔。细胞gydF4y2Ba22gydF4y2Ba, 831-842(2006)。gydF4y2Ba
安德森,M., Fallman, E., Uhlin, B. E. & Axner, O.gydF4y2Ba大肠杆菌gydF4y2BaP菌毛。gydF4y2BaBiophys。J。gydF4y2Ba91gydF4y2Ba, 2717-2725(2006)。gydF4y2Ba
安德森,M.,法尔曼,E., Uhlin, B. E. & Axner, O.粘链模型的延伸和展开gydF4y2Ba大肠杆菌gydF4y2BaP菌力在压力下。gydF4y2BaBiophys。J。gydF4y2Ba90gydF4y2Ba, 1521-1534(2006)。gydF4y2Ba
Baker, J. L., Dahlberg, T., Bullitt, E. & Andersson, M. α螺旋和半胱氨酸-半胱氨酸二硫键对细菌粘附毛对胁迫抗性的影响。gydF4y2Ba国家科学院学报美国gydF4y2Ba118gydF4y2Ba, e2023595118(2021)。gydF4y2Ba
Andersson, M., Axner, O., Almqvist, F., Uhlin, B. E. & Fallman, E.用光镊评估生物聚合物的物理性质:细菌菌毛的折叠和再折叠分析。gydF4y2BaChemPhysChemgydF4y2Ba9gydF4y2Ba, 221-235(2008)。gydF4y2Ba
Jass, J.等人。物理性质gydF4y2Ba大肠杆菌gydF4y2Ba光镊测量P菌毛。gydF4y2BaBiophys。J。gydF4y2Ba87gydF4y2Ba, 4271-4283(2004)。gydF4y2Ba
安德森,M., Uhlin, B. E. & Fallman, E.的生物力学特性gydF4y2Ba大肠杆菌gydF4y2Ba菌毛为尿路附着反映寄主环境。gydF4y2BaBiophys。J。gydF4y2Ba93gydF4y2Ba, 3008-3014(2007)。gydF4y2Ba
Pakharukova, N.等人。对古老和替代性伴侣-引子途径的结构性洞察揭示了一种新的毛根生物发生机制。gydF4y2Ba公共科学图书馆Pathog。gydF4y2Ba11gydF4y2Ba, e1005269(2015)。gydF4y2Ba
西山等人。1型菌毛组装平台FimD识别伴侣-亚基复合物的结构基础。gydF4y2BaEMBO J。gydF4y2Ba24gydF4y2Ba, 2075-2086(2005)。gydF4y2Ba
潘,G.等人。FimD引子结合到其同源FimC-FimH衬底的晶体结构。gydF4y2Ba自然gydF4y2Ba474gydF4y2Ba, 49-53(2011)。gydF4y2Ba
于,等。变构机制控制伴侣/引子通路中的交通。gydF4y2Ba结构gydF4y2Ba20.gydF4y2Ba, 1861-1871(2012)。gydF4y2Ba
Geibel, S., Procko, E., Hultgren, s.j., Baker, D. & Waksman, G. FimD引子折叠蛋白转运的结构和能量基础。gydF4y2Ba自然gydF4y2Ba496gydF4y2Ba, 243-247(2013)。gydF4y2Ba
Du, M.等。细菌外膜引子FimD对生长菌毛的切换机制。gydF4y2Ba自然gydF4y2Ba562gydF4y2Ba, 444-447(2018)。gydF4y2Ba
Pakharukova, N., Tuittila, M., Paavilainen, S. & Zavialov, A. Csu毛的甲基化,结晶和SAD分期的Csu -Csu伴侣-粘附素亚基预组装复合物gydF4y2Ba鲍曼不动杆菌gydF4y2Ba.gydF4y2BaActa Crystallogr。FgydF4y2Ba73gydF4y2Ba, 450-454(2017)。gydF4y2Ba
郑世强等。MotionCor2:改进冷冻电子显微镜光束诱导运动的各向异性校正。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 331-332(2017)。gydF4y2Ba
他,S. & Scheres, S. H. W. RELION中的螺旋重建。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba198gydF4y2Ba, 163-176(2017)。gydF4y2Ba
唐,G.等。EMAN2:用于电子显微镜的可扩展图像处理套件。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba157gydF4y2Ba, 38-46(2007)。gydF4y2Ba
Desfosses, A., Ciuffa, R., Gutsche, I. & Sachse, C. spring -用于从电子低温显微照片中单粒子螺旋重建的图像处理包。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba185gydF4y2Ba, 15-26(2014)。gydF4y2Ba
Scheres, s.h和Chen, S.在低温em结构测定中过拟合的预防。gydF4y2BaNat方法。gydF4y2Ba9gydF4y2Ba, 853-854(2012)。gydF4y2Ba
彼得森,E. F.等人。UCSF chimera -用于探索性研究和分析的可视化系统。gydF4y2Baj .第一版。化学。gydF4y2Ba25gydF4y2Ba, 1605-1612(2004)。gydF4y2Ba
Emsley, P., Lohkamp, B., Scott, W. G. & Cowtan, K.白骨顶的特征与发育。gydF4y2BaActa Crystallogr。DgydF4y2Ba66gydF4y2Ba, 486-501(2010)。gydF4y2Ba
亚当斯,P. D.等。PHENIX:构建自动化晶体结构测定的新软件。gydF4y2Ba学报。Crystallogr。DgydF4y2Ba58gydF4y2Ba, 1948-1954(2002)。gydF4y2Ba
陈,v.b.等。MolProbity:大分子结晶学的全原子结构验证。gydF4y2BaActa Crystallogr。DgydF4y2Ba66gydF4y2Ba, 12-21(2010)。gydF4y2Ba
Balsalobre, C., Morschhauser, J., Jass, J., Hacker, J. & Uhlin, B. E. sfa决定因素的转录分析,揭示mmRNA在病原菌菌毛生物发生中的处理事件gydF4y2Ba大肠杆菌gydF4y2Ba.gydF4y2Baj . Bacteriol。gydF4y2Ba185gydF4y2Ba, 620-629(2003)。gydF4y2Ba
斯坦格纳等人。cook - triplet镊子:更紧凑、更坚固、更高效的光学镊子。gydF4y2Ba选择列托人。gydF4y2Ba43gydF4y2Ba, 1990-1993(2018)。gydF4y2Ba
安德松,M. Czerwinski, F. & Oddershede, L. B.优化光镊的主动和被动校准。gydF4y2Baj .选择。gydF4y2Ba13gydF4y2Ba, 044020(2011)。gydF4y2Ba
在张力作用下的刚性链条和细丝。gydF4y2Ba大分子gydF4y2Ba28gydF4y2Ba, 7016-7018(1995)。gydF4y2Ba
Kelley, L. A., Mezulis, S., Yates, C. M., Wass, M. N. & Sternberg, M. J. Phyre2蛋白质建模、预测和分析门户网站。gydF4y2BaProtoc Nat。gydF4y2Ba10gydF4y2Ba, 845-858(2015)。gydF4y2Ba
后焦平面位置检测光镊的校准。启科学。Instrum。gydF4y2Ba77gydF4y2Ba, 103101(2006)。gydF4y2Ba
Nishiyama, M., Vetsch, M., Puorger, C., Jelesarov, I. & Glockshuber, R.伴侣-亚基复合物结合域的鉴定和表征gydF4y2BaJ. Mol.生物学。gydF4y2Ba330gydF4y2Ba, 513-525(2003)。gydF4y2Ba
杜布诺维茨基,a.p.等人。Caf1A引子c端结构域表面的保守疏水簇对F1抗原组装很重要。gydF4y2BaJ. Mol.生物学。gydF4y2Ba403gydF4y2Ba, 243-259(2010)。gydF4y2Ba
Werneburg, g.t.等。该菌毛引子通过结构域掩蔽控制蛋白质相互作用,具有低聚物的功能。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba22gydF4y2Ba, 540-546(2015)。gydF4y2Ba
确认gydF4y2Ba
我们感谢斯德哥尔摩科学实验室的Cryo-EM瑞典国家设施的工作人员和帕萨迪纳加州理工学院贝克曼研究所传输电子显微镜资源中心的工作人员在数据收集期间提供的帮助;C. Sachse, J. Huiskonen和S. Huber对螺旋重建的建议。这项工作得到了芬兰科学院(321762)和S. Juselius基金会(2019)对A.V.Z.的资助;国立卫生研究院(RO1 AI127401)给G.J.;瑞典研究委员会(SRC)(2019-04016)硕士学位;SRC(2019-01720)和肯普基金会(JCK-1724)向B.E.U.;和SRC(2016-04451)到S.D.K.gydF4y2Ba
资金gydF4y2Ba
图尔库大学(UTU)包括图尔库大学中心医院提供的开放获取资金。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
N.P.净化菌毛。N.P, A.V.Z, D.G.和y - w.c.编制网格并收集低温电磁数据。N.P.解决了初始的低分辨率结构,N.P.和a.v.z获得了高分辨率低温电磁图。H.M.建立了菌毛模型,细化了结构,模拟了菌毛杆的分泌过程和结构演化,并进行了热力学测量。M.T.制造了基因结构和突变体。M.T, N.P, S.P.和a.v.z进行生化实验。T.D.进行了力谱实验。slm进行了AFM实验。A.V.Z, g.j., M.A.和B.E.U.监督这项工作。A.V.Z, N.P, h.m., g.j., m.a., b.e.u., U.L.和S.D.K.分析了数据并撰写了论文。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢Marion Mathelié-Guinlet, Han Remaut和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
扩展数据图1 Csu毛杆三维电子显微镜图的分辨率估计和选定区域。gydF4y2Ba
一个gydF4y2Ba,局部分辨率估计;地图的等高线高度是0.065。gydF4y2BabgydF4y2Ba,在0.143相关阈值下的金标准傅里叶壳相关估计。gydF4y2BacgydF4y2Ba,密度图模型拟合(立体视图)。上面板:相邻子单元CsuA/B之间交互区域的密度gydF4y2BaNgydF4y2Ba和CsuA / BgydF4y2BaN + 1gydF4y2Ba和CsuA/B亚基的GdgydF4y2BaN + 2gydF4y2Ba(GdgydF4y2BaN + 2gydF4y2Ba).链一gydF4y2BaNgydF4y2Ba和FgydF4y2BaNgydF4y2Ba在CsuA / BgydF4y2BaNgydF4y2Ba,股BgydF4y2BaN + 1gydF4y2BaC2gydF4y2BaN + 1gydF4y2Ba,和FgydF4y2BaN + 1gydF4y2Ba在CsuA / BgydF4y2BaN + 1gydF4y2Ba和供体链GdgydF4y2BaN + 1gydF4y2Ba和GdgydF4y2BaN + 2gydF4y2Ba贴上标签。低面板:亚基核心片段的密度,包括残基75-84、95-98和110-111。地图的等高线高度是0.085。gydF4y2Ba
图2毛杆中CsuA/B亚基的结构。gydF4y2Ba
一个gydF4y2Ba, CsuA/B的卡通代表gydF4y2BaNgydF4y2Ba(粉红色)由下一个亚基CsuA/B的Gd供体链补充gydF4y2BaN + 1gydF4y2Ba(黄色)在杆。A链和A’-A”发夹上的触点残基,供体链Gd的n端和受体位点分别被漆成洋红色、橙色和海蓝色。n -末端和β-链被标记。gydF4y2BabgydF4y2Ba,菌毛CsuA/B的叠加gydF4y2BaNgydF4y2Ba- gdgydF4y2BaN + 1gydF4y2Ba模块采用晶体结构自补CsuA/B (CsuA/Bsc, PDB代码6FM5)gydF4y2Ba8gydF4y2Ba,色带图)。CsuA / BgydF4y2BaNgydF4y2Ba- gdgydF4y2BaN + 1gydF4y2Ba被描绘成gydF4y2Ba一个gydF4y2BaCsuA/Bsc漆成绿色。虚线表示CsuA/Bsc中连接Gd链和c端非结构化连接子。gydF4y2BacgydF4y2Ba, CsuA/B亚基的卡通表示突出了其功能或结构作用或在本研究中均被检测的残基(球棒模型)。颜色编码与gydF4y2Ba一个gydF4y2Ba除了整个双发夹(A ' -A '和B-B '发夹)被洋红色突出显示。gydF4y2Ba
扩展数据图3力扩展测量协议和曲线,显示非毛束控制、多毛束相互作用和单毛束响应的结果。gydF4y2Ba
一个gydF4y2Ba安装和测量程序。1) 10 μ m的聚l -赖氨酸涂层珠被固定在覆盖套上,作为细菌的安装座。一种细菌被光学镊子捕获并附着在涂有涂层的珠子上。2)捕获塑料探针珠,利用有功功率谱法校准捕获器刚度gydF4y2Ba45gydF4y2Ba.随后,探针珠被轻轻地带到接近(约1-2微米)的安装细菌,并使用压电阶段切线移动到细菌。一旦有绒毛附着,探针珠从平衡位置移动,这可以在实时摄像机图像和实时力响应中观察到。3)附着菌毛后,压电级以0.1 μ m/s的速度移动,同时保持陷阱静止,导致细菌和探针珠复合物分离。4)区域II中Csu毛在拉伸作用下的延伸示意图。顶部,探针珠已附着,并锁紧。中间,菌毛中一半的亚基是展开的。底部,整个菌毛展开成线状细丝。gydF4y2BabgydF4y2Ba,一个控制测量的例子,其中探针珠被推入与非纤毛细菌(BL21-AI)接触gydF4y2Ba大肠杆菌gydF4y2Ba携带空表达式向量的应变)。通常情况下,在分离之前,力仅线性增加,这已经发生在0.02微米的延伸处,并且没有迹象表明探针珠从膜中挤出缆绳。gydF4y2BacgydF4y2Ba,由多菌群相互作用产生的力-延伸曲线示例。如果探针珠太靠近有多个菌毛的细菌,就可能发生这种情况。最初,力响应表现为混乱,之后(约1.4 μ m的延伸)三个菌毛同时拉伸到区域II,产生离散的解绕力响应。他们的联合反应是一个倍数gydF4y2BangydF4y2Bax23pn。在延伸1.75µm时,只有最长的菌毛仍附着在珠上,在延伸2.3µm时,最后的菌毛与珠分离。gydF4y2BadgydF4y2Ba,示例数据包括计算出的蠕虫状链(可扩展蠕虫状链模型(eWLC));虚线红色)拟合WT毛力曲线的区域I。gydF4y2BaegydF4y2Ba-gydF4y2BaggydF4y2Ba,来自单个WT菌毛的力曲线的另外三个例子。在gydF4y2BafgydF4y2Ba,区域II的开始部分显示了一个力碰撞,源于与较短的毛团同时相互作用,在0.7 μ m延伸时脱落。gydF4y2BahgydF4y2Ba,动态力谱数据显示了展开力如何随着拉伸速度的增加而增加(黑点,误差条代表一个标准偏差,n = 5)。红色方框为引用文献的第1型毛簇动态数据。gydF4y2Ba23gydF4y2Ba.gydF4y2Ba我gydF4y2Ba,来自R104C突变菌毛的力延伸曲线示例。gydF4y2Ba
图4细菌细胞表面Csu菌毛形态分析。gydF4y2Ba
一个gydF4y2Ba,原子力显微镜图像gydF4y2Ba大肠杆菌gydF4y2Ba表达WT和突变体Csu pili。gydF4y2BabgydF4y2Ba,负染透射电子显微镜(TEM)显微照片gydF4y2Ba大肠杆菌gydF4y2Ba表达WT和突变体Csu pili。细胞在含0.02%阿拉伯糖的LB培养基中培养。为了TEM成像,标本用醋酸铀酰染色。突变在扩展数据表中解释gydF4y2Ba1gydF4y2Ba.对于更高分辨率的图像,请参阅补充图中的源数据。gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
图5突变对Csu菌毛分泌和Csu介导的降水抗性的影响。gydF4y2Ba
一个gydF4y2Ba,对热处理后得到的表面剪切毛毛进行低温电镜分析gydF4y2Ba大肠杆菌gydF4y2Ba携带WT和Δ6gydF4y2Ba基督教社会联盟gydF4y2Ba基因簇。显微照片在Talos Arctica显微镜上用离焦−3.5 μm记录,放大倍率为22000(上图)和45000(下图)。gydF4y2BabgydF4y2Ba,对热处理后的表面剪毛进行Western blottinggydF4y2Ba大肠杆菌gydF4y2Ba含有WT或突变体gydF4y2Ba基督教社会联盟gydF4y2Ba基因簇。CsuA/B用兔多克隆抗CsuA/Bsc抗体和IRDye 68rd5偶联抗兔山羊二抗检测。请注意,该抗体还与一种移动速度比CsuA/B稍慢的蛋白质发生反应。该条带与CsuA/B无关,因为它存在于ΔCsuA/B突变体和未诱导细胞的提取物中。虽然M27突变体显示出与WT相似的CsuA/B水平,但在其他突变体中检测到没有或非常少量的CsuA/B分泌(与WT相比<10%,星形带指示)。这与细胞成像结果相关(扩展数据图。gydF4y2Ba4gydF4y2Ba除了突变体N26C,其提取物中存在少量CsuA/B,但未观察到毛状结构。WB源数据参见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2BacgydF4y2Ba突变对csu介导的细菌沉淀抗性的影响。Csu菌毛为细菌提供了一种强大的“降落伞效应”,使它们高度抵抗沉降。离心后,表达WT菌毛的细菌细胞形成软颗粒,其体积比含有空表达载体(pBAD-ESNPA)的对照细胞形成的致密颗粒大几倍。除了M27的点突变显示WT表型(这里以M27A为例),R104C和V2A显示稍软的颗粒(用星号标记)外,所有突变体都观察到致密的颗粒。用相同数量的WT和突变型细菌细胞进行实验gydF4y2Ba一个gydF4y2Ba-gydF4y2BacgydF4y2Ba.突变在扩展数据表中解释gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
图6突变对补充CsuA/B的供体链稳定性的影响以及CsuA/B形成dsc -聚合物的能力。gydF4y2Ba
一个gydF4y2Ba,质周提取物的Western blottinggydF4y2Ba大肠杆菌gydF4y2Ba表达WT和突变体CsuA/Bsc。从等量的细胞中获得质周提取物。CsuA/Bsc用兔多克隆抗CsuA/Bsc抗体和IRDye 68rd偶联抗兔山羊抗体检测,方法见。gydF4y2BabgydF4y2Ba, WT CsuA/Bsc在不同温度下的CD谱。gydF4y2BacgydF4y2Ba,在225 nm处,WT和CsuA/Bsc取代变异体的摩尔椭圆度随温度的变化。由数据产生的熔化温度列在扩展数据表中gydF4y2Ba1gydF4y2Ba.gydF4y2BadgydF4y2Ba,突变对CsuA/B形成dsc -聚合物能力的影响。CsuA/B的WT和突变型与His共表达gydF4y2Ba6gydF4y2Ba-tagged CsuC ingydF4y2Ba大肠杆菌gydF4y2Ba,由Ni共纯化的质周提取物gydF4y2Ba2 +gydF4y2Ba-亲和层析,SDS-PAGE分析。电泳前,配合物在22或100°C孵育。条形表示熔化的CsuA/B单体的位置(1;16.2 kDa)和6个短CsuA/B聚合物;箭头所示为suc监护人的位置(31.5 kDa)。突变在扩展数据表中解释gydF4y2Ba1gydF4y2Ba.WB和凝胶源数据见补充图。gydF4y2Ba1b和dgydF4y2Ba.gydF4y2Ba
图7突变对csu介导的生物膜形成和细胞表面CsuE暴露的影响。gydF4y2Ba
一个gydF4y2Ba,定量聚苯乙烯微量滴定板中形成的生物膜gydF4y2Ba大肠杆菌gydF4y2Ba含有小波型或突变体的gydF4y2Ba基督教社会联盟gydF4y2Ba不同浓度抗尖端抗体的基因簇。未诱导细胞和含有空表达载体的诱导细胞被用作阴性对照。数据以平均值±标准差表示。单井数据用开圈表示(WT, n = 6;对照,n = 4;突变体,n = 3)。gydF4y2BabgydF4y2Ba, CsuE暴露在细胞表面,尽管突变阻止了亚基在毛杆上的固定。重组gydF4y2Ba大肠杆菌gydF4y2Ba隐匿的gydF4y2Ba基督教社会联盟gydF4y2Ba基因簇中含有缺失的触点序列(见扩展数据表)gydF4y2Ba1gydF4y2Ba)在阿拉伯糖的存在下生长2小时以诱导基因转录。将培养物分成4 ml等份,用不同浓度的针对CsuE亚基n端结构域的多克隆抗体(抗尖端抗体或αE抗体)培养1小时gydF4y2BaNgydF4y2Ba)贴上Eu标签gydF4y2Ba3 +gydF4y2Ba-螯合[N1-(4-异硫氰基苯)-二乙基三胺-N1,N2,N3,N3-四(乙酸乙酯)-铕(III)](左图)或与250 ng/ml标记抗体(右图)在1%牛血清白蛋白存在下进行三次复制。通过5000×g离心清洗细菌四次,并在磷酸盐缓冲盐水(PBS)中重新悬浮。细胞重悬于1ml PBS中,与铕荧光增强剂溶液(Kaivogen,芬兰)和时间分辨的铕1:1混合gydF4y2Ba3 +gydF4y2Ba荧光用1420 VICTOR多标记计数器(PerkinElmer)在96孔板中测量。用分光光度计在595 nm处测量细胞光密度。该图显示了细胞光密度的计数。数据为平均值±标准差(n = 3个细菌培养)。非诱导细胞或gydF4y2Ba大肠杆菌gydF4y2Ba以空载体(pBAD-ENSPA)为阴性对照。gydF4y2Ba
扩展数据图8 Csu毛堆组装-分泌机制。gydF4y2Ba
一个gydF4y2Ba,装配步骤。(1) CsuA -CsuA/B伴侣-亚基预组装复合物,其中CsuA/B部分由GgydF4y2Ba1gydF4y2BaCsuC供体链gydF4y2Ba24gydF4y2Ba与引子NTD结合,而生长毛的基部由3 - csua /B亚基片段(Sub1-Sub2-Sub3)与引子c端结构域CTD1和CTD2接触。在经典CU体系中,NTD主要通过其n端尾(N-tail)和球形域的表面残基与伴侣蛋白相互作用,分别占结合表面的60%和40%gydF4y2Ba27gydF4y2Ba.(2)预组装复合物(Sub4)亚基的Gd供体链取代GgydF4y2Ba1gydF4y2Ba在拉进拉出供体链交换(DSE)过程中,覆盖在菌毛基部的伴侣供体链gydF4y2Ba15gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,连接Sub4与菌毛。这也导致Sub3的完全折叠和A ' -A '和B-B '发夹的形成gydF4y2Ba8gydF4y2Ba.前护毛者被释放。(3-4)在可逆过程中,毛根沿引子通道向上移位。由于A ' -A ", B-B '双发夹,引座机内的运动被限制在一个相对狭窄的路径。为了使Sub2的A’-A”发卡更靠近Sub1的受体口袋,引子通道外的分泌毛(很可能)必须旋转引子(见补充视频)gydF4y2Ba3.gydF4y2Ba).(5)仍然处于可逆过程中,Sub2从引子分泌通道中出来,向引子边缘倾斜,使Sub2 a’-A”发夹更接近Sub1 D-D’环。NTD的球状结构域与CsuC分离,因为这些蛋白质之间的角度变得不适合相互作用,而灵活的n尾仍然结合在一起,这从FimD构象1的结构中可以明显看出gydF4y2Ba29gydF4y2Ba.(6) Sub2 A’-A”发卡与Sub3 Gd供体链n端从两侧与Sub1结合,而Sub1 D-D’环从正面覆盖Sub2 A’-A”发卡,并通过第二层相互作用锁定。锁扣的形成可能是通过减少其形成途径的数量来促进的:如图所示,当Sub1和Sub2靠近彼此时,A’-A”发夹和Gd n端阻止了Sub1的侧旋。gydF4y2Ba2摄氏度gydF4y2Ba.钉结形成将Sub2连接到刚性的毛柄上,使亚基无法重新进入引子通道。这种机制可以防止毛毛回溯,驱动单向分泌。(7) Du等认为,在分泌周期完成后,引子NTD的N-tail到达CTD2,对伴侣蛋白失去亲和力gydF4y2Ba29gydF4y2Ba.NTD被释放以接受一个新的预装配综合体。gydF4y2BabgydF4y2Ba,缺乏适当的毛杆第四阶结构可能导致分泌倒退和纤维从组装平台滑落。毛杆四阶结构可以潜在地充当棘轮状机制,防止分泌步骤的倒退以及危险事故,其中底座在从NTD释放后从引子滑出,永久卡住组件。参见补充视频gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
扩展数据图9菌毛基底转换热力学和从之字形结构到螺旋管结构的演化路径预测。gydF4y2Ba
一个gydF4y2Ba在经典的CUP体系中,预组装配合物对引入NTD和CTD1-2的亲和性。在经典CUPs中,NTD主要通过其n端尾巴(N-tail,波状线)与伴侣蛋白相互作用,形成较强的结合亲和力。FimC-FimH伴侣-粘附素亚基复合物与来自Type 1菌毛系统的FimD引子的NTD结合(1)的特征是gydF4y2BaKgydF4y2BadgydF4y2Ba= 0.96 μm (gydF4y2BaΔGgydF4y2BaogydF4y2Ba=−34.3 kJ/mol)gydF4y2Ba46gydF4y2Ba通过F1抗原系统将Caf1M-Caf1伴侣-亚单位复合物与Caf1A的NTD结合(4)gydF4y2BaKgydF4y2BadgydF4y2Ba= 2.4 μm (gydF4y2BaΔGgydF4y2BaogydF4y2Ba=−32 kJ/mol)gydF4y2Ba27gydF4y2Ba.然而,在Caf1M-Caf1伴侣亚基或Caf1M-Caf1- caf1复合物与单个CTD2之间没有检测到结合gydF4y2Ba47gydF4y2Ba或CTD1-2结构(5)(S. Roy和A. Zavialov,未发表数据)。尽管Werneburg等人认为,在1型菌群系统中,FimC-FimH复合物对CTDs的亲和力高于NTDgydF4y2Ba48gydF4y2Ba,他们出色的绑定数据似乎与这一结论相悖。观察到FimC-FimH复合物对引子的高亲和力(gydF4y2BaKgydF4y2BadgydF4y2Ba= 12.5 nM,gydF4y2BaΔGgydF4y2BaogydF4y2Ba=−45 kJ/mol)(2)可能是由FimH的凝集素结构域与usher通道的相互作用决定的(3),而不是与CTDs结合,因为在他们的研究中,删除CTDs仅适度降低了亲和力(30倍,gydF4y2BaΔGgydF4y2BaogydF4y2Ba=−8.4 kJ/mol)。此外,对1型系统进行了结构分析gydF4y2Ba26gydF4y2Ba,gydF4y2Ba28gydF4y2Ba似乎没有揭示碱基和CTDs之间任何特别重要的疏水相互作用,这将证实它们之间存在紧密结合,而n -尾和预组装复合物形成了相当大的gydF4y2Ba∼gydF4y2Ba600年,一个gydF4y2Ba2gydF4y2Ba疏水接口gydF4y2Ba27gydF4y2Ba.同时,需要指出的是,在这样一个涉及膜蛋白的复杂系统中获得准确的数据是一项具有挑战性的任务。因此,当获得更准确的数据时,这些计算可能会发生重大变化。此外,该因子在不同系统中驱动毛毛分泌的作用可能不同,不同系统中不同因子的相对贡献目前尚不清楚。gydF4y2BabgydF4y2BaCsu和Pap毛杆片段由两个相邻亚基(N和N+1)和来自第三个亚基(GdgydF4y2BaN + 2gydF4y2Ba)被叠加在第一亚基的Cα原子上。CsuA / BgydF4y2BaNgydF4y2Ba和CsuA / BgydF4y2BaN + 1gydF4y2Ba都是青色和蓝色的,爸爸gydF4y2BaNgydF4y2Ba和爸爸gydF4y2BaN + 1gydF4y2Ba紫色和粉色,还有GdgydF4y2BaN + 2gydF4y2Ba在黄色的。从Csu之字形结构到管状螺旋结构的改变需要第二个亚基像箭头所示的那样旋转90°。gydF4y2BacgydF4y2Ba,与中的片段相同gydF4y2BabgydF4y2Ba分别显示。红色、橙色、绿色和深绿色分别为A’-A”发夹、Gd链n端部分、D-D’环以及Csu棒中亚基之间的键合接触区域。PapA亚基中的相应区域具有相同的颜色。gydF4y2BadgydF4y2Ba,预测了从之字形到螺旋管结构的进化路径。这些图像显示了(b)中相邻的亚基,以说明亚基间角度的变化(上面的图像),以及七个亚基的毛杆片段,以说明杆结构的变化(下面的图像)。(1) Csu菌毛,古代CUP菌毛的一个成员。A ' -A "发夹锁定子单元之间的角度。(2) Csu棒中PapA亚基叠加CsuA/B亚基得到的假设模型。这一假设模型表明,A’-A”发夹的缺失(或初始缺失)可能使亚基相互相对旋转,形成更紧凑的螺旋填料。在没有A ' -A "发夹的情况下,更长的n端尾可能是为了稳定亚基间的接触。(3)假设的早期中间体。A’-A”发夹(如CsuA/B)转变为α-螺旋(如PapA)可能使亚基之间的角度发生了变化,而Gd供体链的n端尾部可能有助于保持稳定。(4)假设的晚期中间产物。 Further change in the angle may have resulted in various open spiral architectures still lacking connections between the subunit layers. (5) Pap pilus, a member of the classical CUP fimbriae. The final step in the evolution would be the formation of interactions between subunit layers. At this stage, most structures stabilizing the open spiral architectures would have become unnecessary and disappeared.
补充信息gydF4y2Ba
补充信息gydF4y2Ba
补充图1 - 3,补充表1和2,以及补充视频1 - 3的图例。gydF4y2Ba
补充视频1gydF4y2Ba
Csu毛杆的结构。视频中显示的3.4 Å分辨率低温电磁图的等高线水平为0.065。该模型揭示了参与锚定相互作用表面的氨基酸残基。gydF4y2Ba
补充视频2gydF4y2Ba
压合触点的开闭模型。Gd与绒毛球状结构域之间的连接器是柔性的,但a´a´发夹和Gd n端限制了绒毛的旋转为上下运动。因此,锚定接触赋予了菌毛刚度,并决定了在锚定形成或菌毛拉伸时亚基运动的轨迹。gydF4y2Ba
补充视频3gydF4y2Ba
古代系统的组装-分泌机制模型。Csu毛的每一个分泌步骤通过引子通道使毛移位,长度恰好为一个亚基,并且退出的亚基与之前的亚基形成一个固定。请注意,视频中没有显示DSE过程。DSE过程以一种拉进拉出的方式发生,其中毛根基部的伴侣蛋白被新到来的亚基的供体链序列逐步取代。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Pakharukova, N., Malmi, H., Tuittila, M.。gydF4y2Baet al。gydF4y2Ba古风陪护引子毛里自隐成超弹性之字形弹簧。gydF4y2Ba自然gydF4y2Ba609gydF4y2Ba, 335-340(2022)。https://doi.org/10.1038/s41586-022-05095-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05095-0gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba