摘要gydF4y2Ba
细菌细胞壁成分提供了各种独特的分子结构,被固有免疫系统的模式识别受体(PRRs)检测为非自身。大多数细菌种类形成一个由肽聚糖(PGN)组成的细胞壁,这是一种由短肽交联形成链的交替氨基糖组成的聚合结构。Muramyl二肽(MDP)已被证明是肽聚糖的最小免疫原性成分gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2 gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba.MDP由胞质核苷酸结合寡聚结构域蛋白2感知gydF4y2Ba4gydF4y2Ba(NOD2)。一旦接触,它就会触发促炎基因的表达,而这种功能对于维持健康的肠屏障功能至关重要gydF4y2Ba5gydF4y2Ba.在这里,我们使用正向遗传筛选来识别MDP检测所需的因素gydF4y2BaNgydF4y2Ba-乙酰氨基葡萄糖激酶(NAGK)对MDP的免疫刺激活性至关重要。NAGK在免疫细胞中广泛表达,以前曾被描述为有助于己糖胺生物合成挽救途径gydF4y2Ba6gydF4y2Ba.在机制上,NAGK通过直接磷酸化NOD2的上游gydF4y2BaNgydF4y2Ba-乙酰muramic acid的部分MDP在其C6位置的羟基上,生成6-gydF4y2BaOgydF4y2Ba-phospho-MDP。nagk磷酸化的mdp -但不是未修饰的mdp -构成了NOD2的激动剂。来自缺乏NAGK的小鼠的巨噬细胞完全缺乏MDP感知。这些结果揭示了氨基糖代谢和对细菌细胞壁的先天免疫之间的联系。gydF4y2Ba
主要gydF4y2Ba
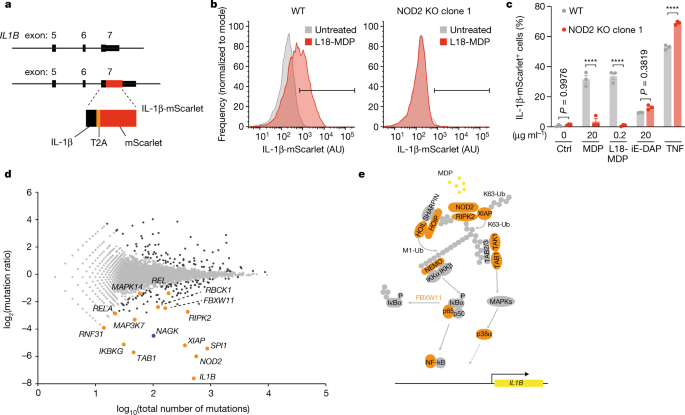
为了确定识别MDP所需的因素,我们在KBM-7细胞中进行了前向遗传筛选,KBM-7细胞是一种易于基因陷阱诱变的近单倍体细胞系gydF4y2Ba7gydF4y2Ba.为了鉴定发生mdp依赖促炎基因表达的细胞,我们生成了一个克隆细胞系,其中mScarlet与内源性白介素- 1b (IL-1B)的C端相连(KBM-7-IL-1B)gydF4y2BamScarletgydF4y2Ba),由自裂肽分离(图;gydF4y2Ba1gydF4y2Ba).选择IL-1B是因为其在这些细胞中NF-κB活化后具有较高的诱导性。KBM-7-IL-1BgydF4y2BamScarletgydF4y2Ba用L18-MDP处理细胞,这是MDP的亲脂衍生物,其中C6位置的OH基被硬脂酸酯化gydF4y2Ba8gydF4y2Ba.这种修饰增强了MDP的摄取,并水解了细胞内的酯键,在细胞质中释放MDP。L18-MDP刺激的细胞以nod2依赖的方式表达了高水平的mScarlet(图。gydF4y2Ba1 b, cgydF4y2Ba).当用MDP刺激细胞时,也得到了类似的结果,尽管需要更大量的MDP才能达到类似的激活水平。正如预期的那样,特异性NOD1激动剂iE-DAP处理后IL-1B-mScarlet的表达gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba或TNF刺激在没有NOD2的情况下没有减少(图2)。gydF4y2Ba1 cgydF4y2Ba).KBM-7-IL-1BgydF4y2BamScarletgydF4y2Ba对细胞进行基因陷阱诱变,用L18-MDP进行扩增和刺激。然后我们根据mScarlet表达的高低对这些细胞进行分类。我们使用深度测序来识别基因陷阱插入和计算基因突变的富集gydF4y2Ba11gydF4y2Ba.这项研究揭示了102个基因(gydF4y2BaPgydF4y2Ba邻接的gydF4y2Ba< 0.05),正向调节mdp依赖的IL-1B-mScarlet的表达(图;gydF4y2Ba1 dgydF4y2Ba).还有gydF4y2BaIL1BgydF4y2Ba我们确定了编码NOD2通路组成部分的基因gydF4y2Ba12gydF4y2Ba,包括gydF4y2BaNOD2gydF4y2Ba,gydF4y2BaRIPK2gydF4y2Ba而且gydF4y2BaXIAPgydF4y2Ba,以及许多NF-κB和MAPK信号通路相关因子的编码基因(图。gydF4y2Ba1 egydF4y2Ba).除了这些预期的组件之外,我们还确定了gydF4y2BaNAGKgydF4y2Ba作为一款非常重要的热门游戏(gydF4y2BaPgydF4y2Ba邻接的gydF4y2Ba< 3.02 × 10gydF4y2Ba−23gydF4y2Ba).NAGK是糖激酶/Hsp70/肌动蛋白超家族的成员,其成员以依赖于atp的方式磷酸化某些底物gydF4y2Ba13gydF4y2Ba.在己糖胺生物合成挽救途径中,NAGK介导的磷酸化gydF4y2BaNgydF4y2Ba-乙酰葡萄糖胺(GlcNAc)到GlcNAc-6-磷酸,然后用于生物合成UDP-GlcNAc,所需的关键成分gydF4y2BaOgydF4y2Ba与- - - - - -gydF4y2BaNgydF4y2Ba-acetylglucosaminylation和gydF4y2BaNgydF4y2Ba与糖基化gydF4y2Ba14gydF4y2Ba(扩展数据图。gydF4y2Ba1gydF4y2Ba).GlcNAc可以通过内源性糖缀合物或营养来源的溶酶体降解而获得,但在营养来源丰富的情况下,GlcNAc在UDP-GlcNAc生物合成中似乎只起很小的作用gydF4y2Ba6gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.因此,在缺乏NAGK的情况下,mdp依赖的促炎基因表达的缺失似乎不太可能归因于这一途径的缺陷。事实上,在该筛选中,没有其他打捞途径或UDP-GlcNAc生物合成成分被确定为重要的打击(扩展数据图。gydF4y2Ba1 bgydF4y2Ba).共表达分析显示,NAGK与主要与免疫细胞功能相关的基因共表达,如粒细胞活化(扩展数据图)。gydF4y2Ba2 gydF4y2Ba).事实上,在不同的细胞类型和组织中,NAGK主要在免疫细胞中表达,最显著的是在髓质室中。总之,这些数据表明,NAGK在MDP识别中具有重要作用,导致促炎基因表达,独立于其在己糖胺挽救途径中的功能。gydF4y2Ba
一个gydF4y2Ba, CRISPR工程的gydF4y2BaIL1BgydF4y2Ba导致IL-1B和mScarlet的内源性框架内融合,由自裂肽(T2A)分离。gydF4y2BabgydF4y2Ba,流式细胞仪分析L18-MDP刺激野生型(WT)和nod2敲除(KO)克隆KBM-7-IL-1B诱导IL-1B-mScarlet的情况gydF4y2BamScarletgydF4y2Ba细胞培养16小时。数据显示为一个代表的三个独立的实验,表明门控策略。AU,任意单位。gydF4y2BacgydF4y2Ba流式细胞术分析野生型和nod2敲除克隆KBM-7-IL-1B诱导IL-1B-mScarlet的情况gydF4y2BamScarletgydF4y2Ba细胞按指示刺激16小时。数据是卑鄙的gydF4y2Ba±gydF4y2Ba东南部。米的gydF4y2BangydF4y2Ba= 3个独立的生物样本。使用Šídák的多重比较检验进行双向方差分析。Ctrl,控制。gydF4y2BadgydF4y2Ba,在L18-MDP处理16 h的细胞中,基因筛选显示IL-1B-mScarlet的阳性和阴性调控因子。对于每个基因(点),IL-1B-mScarlet高表达细胞与IL-1B-mScarlet低表达细胞的突变频率之比,与在两个细胞群中鉴定的独特突变的总数量作对比。富集突变的基因显示为黑色(双面费雪精确测试,错误发现率(FDR)校正gydF4y2BaPgydF4y2Ba值(gydF4y2BaPgydF4y2Ba邻接的gydF4y2Ba) < 0.05)。编码NOD2通路已知组分的基因(橙色点)和新的调控因子NAGK(蓝色点)被标记出来。gydF4y2BaegydF4y2Ba, NOD2信号通路模型。在屏幕中识别的基因产物以橙色突出显示;REL和SPI1没有描述。****gydF4y2BaPgydF4y2Ba< 0.0001。gydF4y2Ba
NAGK操作在NOD2的上游gydF4y2Ba
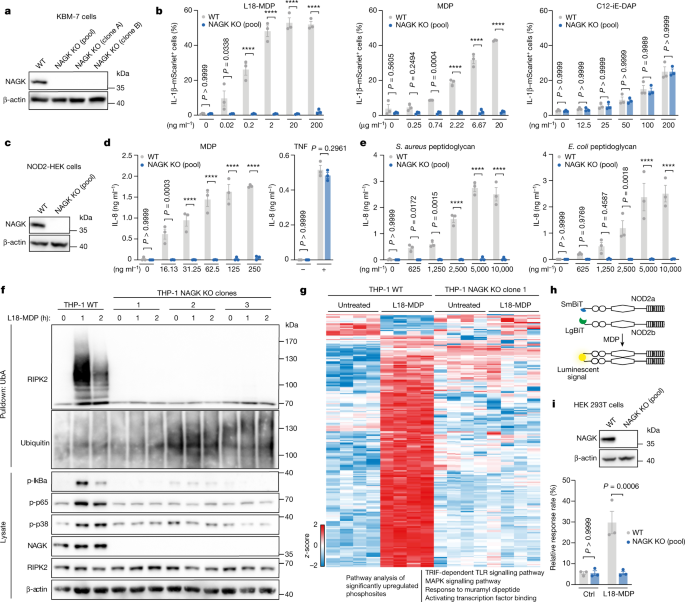
为了验证NAGK在mdp驱动的促炎信号传导中的参与,我们使用CRISPR-Cas9在KBM-7细胞中靶向NAGK,并将衍生的NAGK缺陷细胞系进行不同的刺激(图2)。gydF4y2Ba2 a, bgydF4y2Ba).nagk缺陷细胞对大范围浓度的NOD2刺激L18-MDP或MDP无反应。相反,通过C12-iE-DAP和其他信号级联激活的NOD1在KBM-7细胞中诱导IL-1B-mScarlet表达,不受NAGK缺乏的影响(图2)。gydF4y2Ba2 bgydF4y2Ba).用IL-1β或TNF治疗,或用Pam刺激TLR2-TLR1 (TLR2/1)gydF4y2Ba3 gydF4y2Ba埋头gydF4y2Ba4gydF4y2Ba或PKC与phorbol 12-肉豆蔻酸13-乙酸酯(PMA)结合导致il - 1b报告基因表达独立于NAGK(扩展数据图)。gydF4y2Ba3 gydF4y2Ba).趋化因子IL-8和IP-10的产生也观察到NAGK在MDP反应中的必要和特定需求(扩展数据图)。gydF4y2Ba4gydF4y2Ba),以及在测量NOD2和NOD1刺激后诱导的一系列促炎或抗病毒转录本时(扩展数据图。gydF4y2Ba4 bgydF4y2Ba).值得注意的是gydF4y2BaNOD2gydF4y2Ba而且gydF4y2BaRIPK2gydF4y2Ba在NAGK敲除细胞中没有变化,这表明NAGK在转录阶段对NOD2和RIPK2没有影响。在表达nod2的HEK 293细胞中也得到了类似的结果。gydF4y2Ba2摄氏度gydF4y2Ba).当这些细胞受到MDP刺激时,促炎趋化因子IL-8的产生完全依赖于NAGK,而tnf依赖的活性与NAGK无关(图2)。gydF4y2Ba二维gydF4y2Ba).由于这些细胞提供了选择性研究NOD2的机会(没有其他肽聚糖(PGN)感知模式识别受体(PRR)通路在这些细胞中起作用),我们继续确定NAGK对NOD2的需求是否超出了合成激动剂MDP的感知。为此,我们用其中一种的纯化PGN处理这些细胞gydF4y2Ba金黄色葡萄球菌gydF4y2Ba或gydF4y2Ba大肠杆菌gydF4y2Ba.遗传消融gydF4y2BaNAGKgydF4y2Ba导致这些细胞无法对来自两种细菌来源的广泛的PGN浓度作出反应,IL-8的产生完全依赖于NAGK的存在(图2)。gydF4y2Ba2 egydF4y2Ba).我们在使用报告试验测量NF-κB活性时获得了类似的结果(扩展数据图)。gydF4y2Ba5 a、bgydF4y2Ba).为了研究NAGK在人单核细胞系中的作用,我们生成了gydF4y2BaNAGKgydF4y2Ba−−/gydF4y2BaTHP-1细胞(扩展数据图。gydF4y2Ba5度gydF4y2Ba).缺乏NAGK的THP-1细胞对MDP刺激无反应,而它们的NOD1反应完全完整(扩展数据图)。gydF4y2Ba5 dgydF4y2Ba).在NOD2识别MDP后,适配器蛋白RIPK2被招募并泛素化,代表NF-κB上游NOD2激活的近端读数gydF4y2Ba16gydF4y2Ba.用L18-MDP刺激后,THP-1细胞显示出强烈的RIPK2泛素化,而在nagk敲除细胞中不存在gydF4y2Ba(gydF4y2Ba无花果。gydF4y2Ba2 fgydF4y2Ba).我们还观察到IκBα、p65和p38磷酸化的时间依赖性和nagk依赖性增加。在缺乏NAGK的KBM-7细胞中也得到了类似的结果。gydF4y2Ba5 egydF4y2Ba).为了更全面地了解L18-MDP刺激后的磷酸化事件,我们对野生型和缺乏nagk的THP-1细胞进行了磷蛋白组分析gydF4y2Ba17gydF4y2Ba(无花果。gydF4y2Ba2 ggydF4y2Ba).在L18-MDP刺激后,我们在野生型细胞中检测到200个磷酸化位点显著上调,25个磷酸化位点下调。功能富集分析确定了各自的蛋白质参与先天免疫信号。相反,在缺乏nagk的THP-1细胞中,L18-MDP刺激后,这些磷酸基均未发生显著变化。这些结果与NAGK缺失完全钝化mdp依赖的信号转导的观点一致。最后,为了解决NAGK缺乏是否直接影响NOD2的激活,我们研究了刺激后NOD2的二聚化或多聚化。我们生成了NOD2结构,这些结构被n端融合到蛋白质片段互补报告系统的组件上,该系统通过互补获得荧光素酶活性(图。gydF4y2Ba2 hgydF4y2Ba).使用该系统,我们观察到表达这些结构的HEK 293T细胞在L18-MDP处理后荧光素酶活性增加。在缺乏NAGK的细胞中没有观察到发光信号(图。gydF4y2Ba2我gydF4y2Ba).总之,这些实验表明,NAGK是NOD2上游特异性需要的,但不是其他促炎信号通路。gydF4y2Ba
一个gydF4y2Ba野生型和NAGK敲除型KBM-7-IL-1B中NAGK的表达gydF4y2BamScarletgydF4y2Ba细胞免疫印迹(代表三个独立的实验)。gydF4y2BabgydF4y2Ba野生型和nagk敲除KBM-7-IL-1BgydF4y2BamScarletgydF4y2Ba分别用指定剂量的L18-MDP(左)、MDP(中)或C12-ie-DAP(右)处理细胞16小时。数据是卑鄙的gydF4y2Ba±gydF4y2Ba东南部。米的gydF4y2BangydF4y2Ba= 3个独立的生物样本。使用Šídák的多重比较检验进行双向方差分析。gydF4y2BacgydF4y2Ba, NAGK在野生型和NAGK敲除nod2表达HEK细胞中的表达(代表两个独立的实验)。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba按指示刺激野生型和nagk敲除nod2表达的HEK细胞,16 h后用酶联免疫吸附试验(ELISA)检测IL-8的产生。数据是卑鄙的gydF4y2Ba±gydF4y2Ba东南部。米的gydF4y2BangydF4y2Ba= 3个独立的生物样本。使用Šídák的多重比较检验进行双向方差分析。gydF4y2BafgydF4y2Ba在野生型或nagk敲除THP-1细胞中,L18-MDP刺激后,RIPK2泛素化、NF-κB和MAPK激活标记物。泛素化蛋白通过内源性泛素化蛋白与固定泛素相关结构域(UbA)结合的下拉而富集。印迹代表三个生物重复中的一个。gydF4y2BaggydF4y2Ba,用L18-MDP处理野生型或nagk -敲除THP-1细胞1小时后磷酸显著变化的热图(Student’sgydF4y2BatgydF4y2Ba-test FDR < 0.05,gydF4y2BazgydF4y2Ba分数)。费舍尔的确切gydF4y2BatgydF4y2Ba-经L18-MDP处理后磷酸化显著上调的试验(gydF4y2BaPgydF4y2Ba< 0.02;丰富的术语包括基因本体生物学过程、KEGG、基因本体分子功能等。gydF4y2BahgydF4y2Ba, NOD2-NanoBiT发光检测示意图。gydF4y2Ba我gydF4y2Ba,野生型和NAGK敲除HEK 239T细胞中NAGK表达的免疫印迹(代表两个独立的实验)。用所示的构建物转染细胞gydF4y2BahgydF4y2Ba用L18-MDP处理24 h。用NOD2 - NOD2相互作用诱导的发光来测量NOD2二聚,用阳性和阴性对照归一化。数据是卑鄙的gydF4y2Ba±gydF4y2Ba东南部。米的gydF4y2BangydF4y2Ba= 3个独立的生物样本。使用Šídák的多重比较检验进行双向方差分析。gydF4y2Ba
NAGK磷酸化MDPgydF4y2Ba
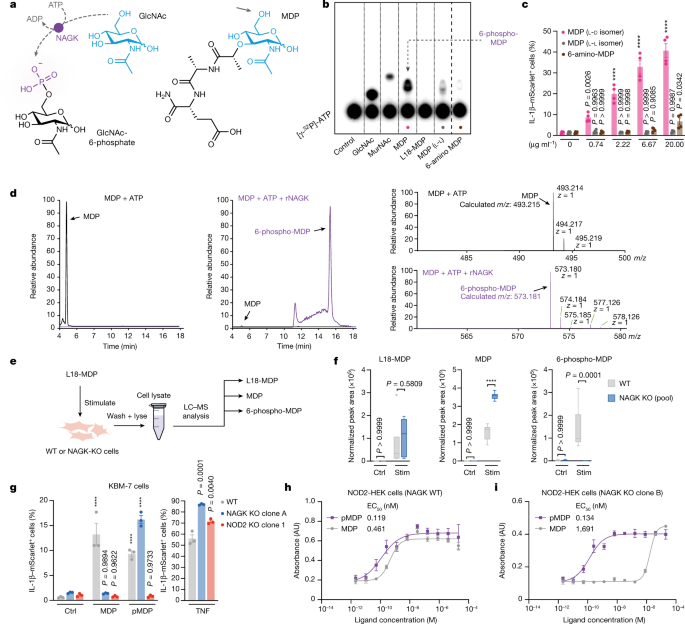
NAGK与NOD2相关的上游作用表明NAGK要么在MDP摄取中起作用,要么直接修饰MDP使其具有刺激性。在缺乏NAGK的情况下,荧光标记的muramyl-三肽衍生物的摄取不受影响(扩展数据图)。gydF4y2Ba6 a、bgydF4y2Ba).然而,glcnac -已知是NAGK底物的概念支持了直接修饰假说gydF4y2Ba13gydF4y2Ba,gydF4y2Ba18gydF4y2Ba-作为基序存在于MDP的糖部分(图。gydF4y2Ba3gydF4y2Ba).根据这一假设,构建了一个突变的NAGK(D107V),预计它会破坏酶的活性gydF4y2Ba13gydF4y2Ba,并不能挽救nagk缺陷细胞中的NOD2信号(扩展数据图。gydF4y2Ba7gydF4y2Ba).为了评估NAGK是否能直接磷酸化MDP,我们将重组人NAGK在gydF4y2Ba大肠杆菌gydF4y2Ba并将其用于各种底物的体外激酶试验。通过薄层色谱(TLC)观察磷酸盐向各自底物的潜在转移。为此目的,[gydF4y2BagydF4y2Ba32gydF4y2BaP]ATP被添加到激酶检测中,这使我们能够通过TLC通过磷成像看到磷酸化的底物。这些实验表明,NAGK易于磷酸化MDP及其相关分子gydF4y2BaNgydF4y2Ba-acetylmuramic acid (MurNAc)达到与其真实底物GlcNAc相似的水平(图。gydF4y2Ba3 bgydF4y2Ba).值得注意的是,薄层色谱分析进一步表明gydF4y2BalgydF4y2Ba-gydF4y2Bal -gydF4y2BaMDP的异构体显示明显减少gydF4y2BagydF4y2Ba-磷酸盐信号(图;gydF4y2Ba3 bgydF4y2Ba),表明MDP与NAGK的相互作用在一定程度上具有立体特异性gydF4y2BalgydF4y2Ba-gydF4y2BadgydF4y2Bamdp异构体。这在一定程度上解释了这一发现gydF4y2Bal-lgydF4y2Ba-异构体没有刺激活性gydF4y2Ba19gydF4y2Ba(无花果。gydF4y2Ba3 cgydF4y2Ba).NAGK在GlcNAc C6位置的OH基上磷酸化gydF4y2Ba20.gydF4y2Ba;因此,我们假设MDP在这个位置也被磷酸化。事实上,与这一概念一致,L18-MDP,其中C6位置的OH基被硬脂酸酯化,在体外实验中没有磷酸化(图2)。gydF4y2Ba3 bgydF4y2Ba).此外,6-氨基-MDP(其中C6位置的OH基被氨基取代的一种MDP变体)在本实验中显示出强烈的信号减弱。这种假带可能是由于6-氨基MDP制剂在化学合成过程中被少量的MDP污染。6-氨基-MDP对KBM-7细胞没有nod2的刺激作用,这与C6位磷酸化的OH基对MDP的刺激活性至关重要的观点一致。只有在高剂量时才检测到轻微的激活,我们将其归因于MDP的污染(图。gydF4y2Ba3 cgydF4y2Ba).通过液相色谱-串联质谱(LC-MS /MS)分析了在NAGK和ATP存在下培养的MDP,证实MDP获得了一个磷酰基的质量(图2)。gydF4y2Ba3 dgydF4y2Ba).此外,对这些材料的核磁共振分析表明,nagk介导的MDP磷酸化确实发生在其C6位置的羟基上(扩展数据图)。gydF4y2Ba8gydF4y2Ba).事实上,L18-MDP在体外不能被NAGK磷酸化,但在细胞内以NAGK依赖的方式具有强大的nod2刺激活性,这表明它在摄取后水解为MDP。为了研究这一过程,我们用L18-MDP处理野生型或缺乏nagk的KBM-7细胞30分钟,然后对细胞进行裂解,并使用靶向LC-MS /MS分析裂解液(图2)。gydF4y2Ba3 egydF4y2Ba).L18-MDP在野生型和nagk缺陷型细胞中检测到的水平相似。gydF4y2Ba3 fgydF4y2Ba).此外,MDP在两种细胞群中的存在表明L18-MDP在细胞中被水解为MDP。值得注意的是,与细胞内需要NAGK磷酸化MDP的观点一致,我们在野生型细胞中检测到MDP大量转化为6-磷酸化MDP,而在缺乏NAGK的细胞中没有这种转化。与野生型细胞相比,缺乏nagk的细胞表现出胞质MDP的积累,这一事实强调了这一点。gydF4y2Ba3 fgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba(左)GlcNAc以nagk依赖的方式转化为GlcNAc-6-磷酸。MDP。糖部分用蓝色表示。箭头表示可磷酸化的羟基在MDP的C6位置。gydF4y2BabgydF4y2Ba,用薄层色谱法分析了与指定配体的激酶反应。虚线表示图像被裁剪以去除多余车道的位置。该图像代表了三个生物复制。gydF4y2BacgydF4y2Ba,野生型KBM-7-IL-1BgydF4y2BamScarletgydF4y2Ba用指定剂量的MDP (gydF4y2Bal-dgydF4y2Ba异构体),MDP (gydF4y2Bal-lgydF4y2Ba异构体)或6-氨基MDP 16小时。数据是卑鄙的gydF4y2Ba±gydF4y2Ba东南部。米的gydF4y2BangydF4y2Ba= 4个独立的生物样本。Dunnett多重比较检验的双向方差分析。与未处理的对照组进行比较,为了可比性,描述了三次。gydF4y2BadgydF4y2Ba,提取的MDP体外激酶反应的离子色谱图(左)不含(中)重组NAGK (rNAGK)。色谱峰显示MDP(黑色)或6-磷酸化MDP(紫色)。对,这些峰对应的质谱,有理论质量和检测质量。gydF4y2BaegydF4y2Ba,细胞L18-MDP, MDP和6-phospho-MDP的LC-MS含量分析示意图。gydF4y2BafgydF4y2Ba在用L18-MDP处理的野生型和nagk -敲除KBM-7细胞中分析L18-MDP、MDP和6-phospho-MDP。图基风格的箱形图gydF4y2BangydF4y2Ba= 6个独立的生物样本。使用Šídák的多重比较检验进行双向方差分析。机枪兵,刺激。gydF4y2BaggydF4y2Ba野生型、nagk敲除型或nod2敲除型KBM-7-IL-1B中IL-1B-mScarlet的表达gydF4y2BamScarletgydF4y2Ba未处理或用MDP、pMDP或TNF在洋地黄苷缓冲液中刺激16小时的细胞。数据是卑鄙的gydF4y2Ba±gydF4y2Ba东南部。米的gydF4y2BangydF4y2Ba= 3个独立的生物样本。双向方差分析(MDP和pMDP)或单向方差分析(TNF)与Dunnett多重比较检验。与未处理对照(MDP或pMDP)或野生型细胞(TNF)进行比较。gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba在洋地黄苷缓冲液中,MDP或pMDP刺激野生型或nagk缺陷的表达nod2的HEK细胞16小时,NF-kB报告活性。数据是卑鄙的gydF4y2Ba±gydF4y2Ba东南部。米的gydF4y2BangydF4y2Ba= 3个独立的生物样本。拟合四参数剂量-反应曲线计算半最大有效浓度(ECgydF4y2Ba50gydF4y2Ba).gydF4y2Ba
为了研究在缺乏NAGK的情况下,6-磷酸化MDP是否能够刺激NOD2,我们用MDP或体外磷酸化MDP (pMDP)刺激细胞。我们使用洋地黄苷为基础的膜透性来进行这些实验,以解释净电荷的差异,从而解释两种分子的膜透性。正如预期的那样,MDP刺激导致野生型KBM-7细胞的激活,而NAGK-或nod2缺陷细胞没有这种活性。然而,当我们将pMDP注入这些细胞时,野生型和nagk敲除细胞都显示出强烈的报告信号,而nod2敲除细胞则没有反应(图2)。gydF4y2Ba3 ggydF4y2Ba).接下来,我们用增加剂量的这些化合物刺激未修饰的表达nod2的HEK细胞。这表明MDP和pMDP显示出高效力,其中pMDP的活性略高(图2)。gydF4y2Ba3 hgydF4y2Ba).半最大有效浓度(ECgydF4y2Ba50gydF4y2BaMDP为0.461 nM, pMDP为0.119 nM。gydF4y2Ba3 hgydF4y2Ba).当我们用这些化合物刺激缺乏nagk的细胞时,pMDP保留了其效力,并计算出ECgydF4y2Ba50gydF4y2Ba0.134纳米。然而,MDP的效力大大降低。尽管在使用的两种最高剂量(20 μ M和4 μ M)下观察到相当大的NF-κB活性,但计算出的ECgydF4y2Ba50gydF4y2Ba值上升约4 log至1,691 nM(图。gydF4y2Ba3 h,我gydF4y2Ba).使用IL-8产量作为NOD2下游的另一个读数证实了这些观察结果:野生型细胞对洋地黄苷递送的MDP和pMDP反应同样良好,仅在pMDP刺激下,nagk缺陷细胞也观察到类似的反应。然而,MDP在刺激nagk敲除细胞时表现出明显降低的效力(扩展数据图)。gydF4y2Ba9gydF4y2Ba).综上所述,这些结果表明,NAGK直接在C6位置的OH基上磷酸化MDP,生成磷酸化MDP。这一磷酸化事件对于MDP对NOD2的刺激至关重要。gydF4y2Ba
鼠标bmdm需要NOD2上游的NAGKgydF4y2Ba
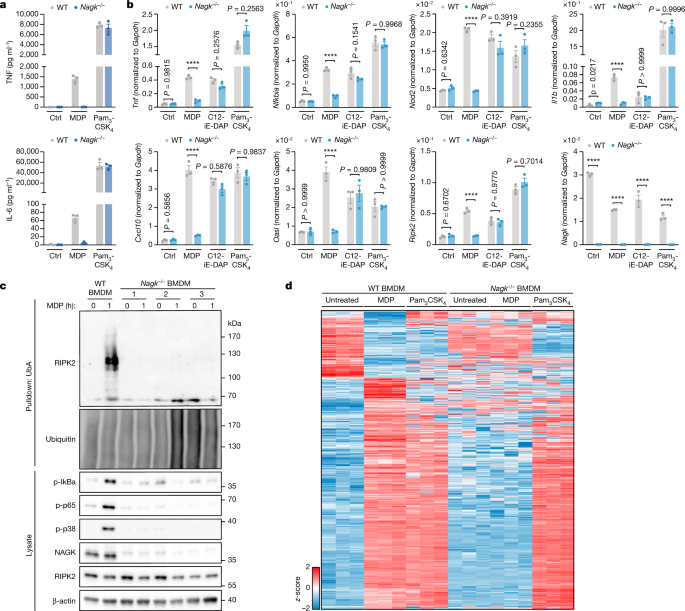
为了确定NAGK是否对原代细胞中的NOD2信号转导至关重要,我们通过靶向crispr - cas9介导的缺失NAGK- 2-5外显子来生成NAGK缺陷小鼠gydF4y2BaNagkgydF4y2Ba基因。gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba小鼠在12周龄时表现出健康和预期的大小。为了研究MDP在这些小鼠中的识别,我们从野生型和野生型小鼠中获得骨髓来源的巨噬细胞(BMDMs)gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba我们在干扰素下研究的小鼠gydF4y2BagydF4y2Ba启动条件。与用细胞系得到的结果一致,gydF4y2BaNagkgydF4y2Ba−−/gydF4y2BaELISA检测显示,MDP刺激后BMDMs不产生TNF或IL-6。gydF4y2Ba4gydF4y2Ba).NAGK缺陷特别影响MDP的识别,因为BMDMs来自野生型和gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba当TLR2/1配体Pam刺激小鼠时,小鼠能够产生相似水平的TNF和IL-6gydF4y2Ba3 gydF4y2Ba埋头gydF4y2Ba4gydF4y2Ba.接下来,我们测量了NOD2、NOD1或TLR2/1刺激后许多促炎或抗病毒转录本的产生(图2)。gydF4y2Ba4 bgydF4y2Ba).野生型BMDMs表现出强烈的转录诱导,而gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba在MDP处理后,细胞转录不活跃。野生型和gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba种群对NOD1和TLR2/1刺激表现出相似的信号应答。gydF4y2Ba
一个gydF4y2BaELISA检测野生型和野生型中TNF和IL-6的产生gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba小鼠BMDMs按指示刺激24小时。数据是卑鄙的gydF4y2Ba±gydF4y2Ba东南部。米的gydF4y2BangydF4y2Ba= 3个独立的生物样本。gydF4y2BabgydF4y2Ba、野生型和野生型指示转录本的定量PCR分析gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba用MDP、C12-iE-DAP或Pam处理BMDMsgydF4y2Ba3 gydF4y2Ba埋头gydF4y2Ba4gydF4y2Ba5小时。基因表达水平归一化至gydF4y2BaGapdhgydF4y2Ba.数据是卑鄙的gydF4y2Ba±gydF4y2Ba东南部。米的gydF4y2BangydF4y2Ba= 3个独立的生物样本。使用Šídák的多重比较测试对日志转换数据进行双向方差分析。gydF4y2BacgydF4y2BaMDP刺激野生型和MAPK后,RIPK2泛素化和NF-κB和MAPK激活标记gydF4y2BaNagkgydF4y2Ba−−/gydF4y2BaBMDMs。与固定化UbA结合的内源性泛素化蛋白的下拉富集了泛素化蛋白。印迹代表野生型的三个生物复制之一,并呈现所有三个gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba老鼠。gydF4y2BadgydF4y2Ba, MDP处理1小时后野生型BMDMs中磷含量显著变化的热图(学生的gydF4y2BatgydF4y2Ba-test FDR < 0.01,gydF4y2BazgydF4y2Ba分数)。gydF4y2BaZgydF4y2Ba-分数为这些磷酸盐gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba用Pam处理的两种基因型中的任一MDP处理的BMDMsgydF4y2Ba3 gydF4y2Ba埋头gydF4y2Ba4gydF4y2Ba包括1小时。所有BMDM实验均在IFN下进行gydF4y2BagydF4y2Ba-启动条件,每个条件3只小鼠。gydF4y2Ba
使用泛素下拉确定RIPK2泛素化作为野生型和野生型NOD2激活的近端读数gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba我们在野生型BMDMs中观察到强烈的RIPK2泛素化,但在缺乏NAGK的BMDMs中没有RIPK2泛素化。这种RIPK2泛素化的缺失gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba与野生型mdp处理的样本中强烈的磷酸化诱导相比,IκBα, p65和p38磷酸化的缺失是平行的。gydF4y2Ba4摄氏度gydF4y2Ba).接下来,我们进行了野生型和磷蛋白组学分析gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba用MDP或Pam处理BMDMsgydF4y2Ba3 gydF4y2Ba埋头gydF4y2Ba4gydF4y2Ba作为对照(图;gydF4y2Ba4 dgydF4y2Ba).MDP刺激后,在野生型细胞中检测到1041个磷酸位点显著上调,298个磷酸位点下调。相比之下,只有4个磷酸盐发生了显著变化gydF4y2BaNagkgydF4y2Ba−−/gydF4y2BaMDP刺激后的BMDMs。不出所料,帕姆gydF4y2Ba3 gydF4y2Ba埋头gydF4y2Ba4gydF4y2Ba治疗导致磷蛋白组在野生型和gydF4y2BaNagkgydF4y2Ba−−/gydF4y2BaBMDMs。总之,这些结果表明,原代小鼠巨噬细胞需要NAGK来感知nod2激动性刺激。gydF4y2Ba
结论gydF4y2Ba
在这里,我们发现氨基糖激酶NAGK在MurNAc部分C6位置的羟基上磷酸化MDP。这种依赖nagk的MDP磷酸化是使宿主的先天免疫系统可见的病原体相关分子模式所必需的。在所有可能参与NOD2的细胞中(包括原发巨噬细胞),nagk缺陷完全减弱了对MDP的反应。来自革兰氏阴性和革兰氏阳性细菌的复合肽聚糖制剂也依赖于NAGK对NOD2的反应。对NAGK的需求仅仅来源于其直接磷酸化MDP的能力,因为体外磷酸化的MDP可以绕过对细胞NAGK的需求。我们假设MDP磷酸化是其成为NOD2直接配体的关键前提。然而,在缺乏生化数据证明结合的情况下,这仍然是推测性的,可以想象,NOD2需要其他中间步骤来识别磷酸化的muramyl肽。gydF4y2Ba
许多致病菌已经进化到利用pgn特异性特异性地修饰MurNAc部分的6 ' -OH基团gydF4y2BaOgydF4y2Ba-acetyltransferases。这种修饰强烈地影响了它们的致病性,因为它增加了它们的PGN对溶菌酶的抗性gydF4y2Ba21gydF4y2Ba.gydF4y2Ba金黄色葡萄球菌gydF4y2Ba例如,关键取决于它的表达方式gydF4y2BaOgydF4y2Ba-乙酰转移酶A (OatA)的致病性。此外,gydF4y2Ba金黄色葡萄球菌gydF4y2Ba缺乏OatA会在受感染的宿主中引发更强的促炎细胞因子gydF4y2Ba22gydF4y2Ba.虽然这可以部分归因于由于溶菌酶敏感性而增加的配体可用性,但我们的结果表明PGN缺乏gydF4y2BaOgydF4y2Ba-乙酰化的MurNAc也会获得免疫刺激活性,因为它是NAGK磷酸化的底物。gydF4y2Ba
NAGK与细菌细胞壁成分识别的功能联系与它在原核生物中的原始功能是一致的。在细菌中,NAGK在PGN组分的回收中起着重要的作用。这一过程对于细菌生长和适应过程中细胞壁的重塑至关重要gydF4y2Ba23gydF4y2Ba.NAGK在进化过程中一直被保留,即使在没有含glcnac的细菌细胞壁或几丁质外骨骼的生物体中也是如此。相反,NOD2首先出现在脊椎动物中(扩展数据图。gydF4y2Ba10gydF4y2Ba).由于MDP很容易在细胞内转化为6-磷酸化MDP,并且考虑到NAGK的原始存在及其在免疫细胞中的表达,我们推测NOD2进化为感知6-磷酸化MDP而不是MDP。根据这一观点,缺乏NAGK的细胞可以用来自的NAGK补充gydF4y2Ba果蝇gydF4y2Ba以恢复其NOD2响应(扩展数据图。gydF4y2Ba10 bgydF4y2Ba).在这方面,探索脊椎动物中是否存在PGN分解代谢酶的其他进化残留物,以及这些因素是否也有助于自我识别与非自我识别,将是有趣的。gydF4y2Ba
方法gydF4y2Ba
细胞培养gydF4y2Ba
kkb -7细胞在Iscove 's Modified Dulbecco 's Medium (IMDM)(赛默飞世尔科学公司)中培养,补充10%热灭活胎牛血清(FCS)(赛默飞世尔科学公司)和1%青霉素-链霉菌素-谷氨酰胺溶液(赛默飞世尔科学公司)。THP-1细胞在含有相同补充物的RPMI 1640培养基中培养。HEK 293T (293T)保存在Dulbecco的改良Eagle 's培养基(DMEM)(赛默飞世尔科学公司)中,含有相同的补充剂。从Invivogen中获得表达人NOD2的NOD2- hek细胞和NF-κB-SEAP报告盒(HEK-Blue-NOD2细胞)。按照Invivogen的建议,在DMEM中添加10%热灭活FCS、zeocin、blasticidin和normocin。细胞系最初检测支原体污染为阴性,但此后没有常规检测。gydF4y2Ba
一代的gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba老鼠gydF4y2Ba
NagkgydF4y2Ba−−/gydF4y2Ba如所述,在受精卵中通过crispr - cas9介导的基因编辑生成小鼠gydF4y2Ba24gydF4y2Ba.简而言之,原核期受精卵是由C57BL/6J雄性与超排卵的C57BL/6J雌性交配获得的。胚胎电穿孔使用NEPA21电穿孔仪和1毫米电极与agydF4y2BaNagkgydF4y2Ba-特异性CRISPR-Cas9核糖核蛋白(RNP)溶液,由200 ngµl组成gydF4y2Ba−1gydF4y2BaSpCas9蛋白(Integrated DNA Technologies (IDT)),每个crRNA (IDT) 3.0µM,和6.0µM tracrRNA (IDT)。内含子1-2中的原间隔序列为GAGTGTAGCAGGCACTAAAC,内含子5-6中的原间隔序列为ACGATTGAAACTGAAGGTTA。电穿孔后,受精卵转入假孕CD-1培养小鼠。为排除额外不必要的修改,假定脱靶部位gydF4y2BaNagkgydF4y2Ba-特异性crrna使用CRISPOR在线工具进行预测gydF4y2Ba25gydF4y2Ba.F的基因组DNAgydF4y2Ba1gydF4y2Ba小鼠的pcr扩增和Sanger测序验证,未显示额外的序列变异。gydF4y2Ba
所有小鼠均根据上巴伐利亚州政府动物福利和使用委员会批准的机构指南进行处理,并被安置在特定无病原体设施(21±1°C, 12小时明暗循环,平均湿度约为55%)的标准笼子中,并在神经病理学中心的动物设施中自由获得食物和水。gydF4y2Ba
bmdm的生成和培养gydF4y2Ba
bmdm产生于野生型和野生型的股骨和胫骨gydF4y2BaNagkgydF4y2Ba−−/gydF4y2Ba12周龄的C57BL/6小鼠在添加8% FCS、20% L929上清和1%青霉素-链霉素-谷氨酰胺溶液的DMEM中培养6天。6天后,通过细胞刮取将细胞分离,并重新装入10厘米的培养皿中进行磷蛋白组学和泛素拉降(10gydF4y2Ba7gydF4y2Ba6孔板用于定量PCR (qPCR) (10gydF4y2Ba6gydF4y2BaELISA检测24孔板(2.5 × 10gydF4y2Ba5gydF4y2Ba每孔细胞)。gydF4y2Ba
BMDM增产方案gydF4y2Ba
用小鼠IFN引物bmdmgydF4y2BagydF4y2Ba(5 ng mlgydF4y2Ba−1gydF4y2Ba(ImmunoTools)培养16小时,然后用新鲜IFN替换培养基gydF4y2BagydF4y2Ba(5 ng mlgydF4y2Ba−1gydF4y2Ba在用指示刺激治疗前2小时:MDP(10µg mlgydF4y2Ba−1gydF4y2Ba, Invivogen), C12-iE-DAP (400 ng mlgydF4y2Ba−1gydF4y2Ba, Invivogen), PamgydF4y2Ba3 gydF4y2Ba埋头gydF4y2Ba4gydF4y2Ba(500 ng mlgydF4y2Ba−1gydF4y2BaInvivogen)。刺激ELISA(24小时),磷酸化蛋白组(1小时),qPCR(5小时)和泛素拉下(1小时)。gydF4y2Ba
KBM-7 IL-1B-mScarlet报告细胞的生成gydF4y2Ba
近单倍体KBM-7细胞用四种质粒电穿孔生成KBM-7- il - 1bgydF4y2BamScarletgydF4y2Ba记者细胞。一个编码Cas9的pRZ-CMV-Cas9质粒,pBlueScript II SK(+)包含一个由t2a -苏氨酸-甘氨酸- mscarlet和两个编码针对IL-1B的单导RNA (sgRNAs)的pL-U6-guide RNA (gRNA)质粒组成的供体盒。供体盒两侧有sgRNA位点和同源臂,分别位于终止密码子上游约400 bp和下游约500 bp处gydF4y2BaIL1BgydF4y2Ba轨迹。sgRNA的识别位点切断了上游和下游gydF4y2BaIL1BgydF4y2Ba在摄取到转染细胞后,停止密码子并释放敲入盒。附近的sgRNA识别序列gydF4y2BaIL1BgydF4y2Ba通过同义突变消除供体DNA序列中的终止密码子。然后根据不同的病原体相关分子模式刺激选择单细胞克隆进行活性测定。gydF4y2Ba
单倍体基因筛选鉴定NOD2调控基因gydF4y2Ba
如前所述,对单倍体KBM-7细胞进行超深全基因组突变gydF4y2Ba26gydF4y2Ba.简而言之,在293T细胞中转染并产生了含有bfp的基因陷阱逆转录病毒变体,并在48小时后初步收集,随后再收集6次。逆转录病毒颗粒在88,880处进行超离心浓缩gydF4y2BaggydF4y2Ba在4℃下保存2小时,并在4℃下保存一夜。通过基因陷阱病毒产生随机基因组突变,近单倍体KBM-7-IL-1BgydF4y2BamScarletgydF4y2Ba报告细胞以2.5 × 10接种gydF4y2Ba6gydF4y2Ba每毫升细胞数,经螺旋感染反复转导(1200gydF4y2BaggydF4y2Ba, 90 min, 21°C)。得到的突变体库用于遗传筛选。gydF4y2Ba
为了鉴定NOD2调控因子,对KBM-7-IL-1B进行诱变gydF4y2BamScarletgydF4y2Ba报告细胞以2.5 × 10接种gydF4y2Ba6gydF4y2Ba用L18-MDP (200 ng mlgydF4y2Ba−1gydF4y2Ba) 16小时。收集细胞并用PBS冲洗。细胞通过40 μm细胞过滤器(Greiner, 542040),然后用一球体积的无甲醇4%甲醛溶液(Thermo Scientific)在37℃下固定13分钟。用含1% FCS的PBS停止固定,细胞再次通过40 μm细胞过滤器计数。细胞重悬至最终浓度为10gydF4y2Ba8gydF4y2BaDNA用最终浓度为5µg ml的DAPI (Sigma- Aldrich, D9542)染色gydF4y2Ba−1gydF4y2Ba.用含1% FCS的PBS洗涤三次后,细胞在10点重悬gydF4y2Ba8gydF4y2Ba在PBS和1% FCS中,每毫升细胞,储存在4°C,并使用70 μm喷嘴在BD融合细胞分选机(BD Biosciences)上分选。单倍体细胞是根据DAPI通道中的DNA含量来鉴定的,其中大约有10个gydF4y2Ba7gydF4y2Ba后4%的IL-1B-mScarlet细胞gydF4y2Ba低gydF4y2Ba和前4% IL-1B-mScarletgydF4y2Ba高gydF4y2Ba细胞被分选以分离基因组DNA。以流式细胞仪为基础的研究的门控策略在补充图中提供。gydF4y2Ba2 gydF4y2Ba.gydF4y2Ba
单倍体基因筛选分析gydF4y2Ba
用于全基因组单倍体遗传筛选,诱变KBM-7-IL-1BgydF4y2BamScarletgydF4y2Ba在通过深度测序鉴定基因陷阱突变之前,用mScarlet荧光对细胞进行表型检查。与人类基因组(hg19)进行了比对gydF4y2Ba11gydF4y2Ba并在mScarlet信号升高或降低的细胞中,在基因的意义取向上共产生了1,640,694个独特突变(平均每个基因约101个突变)。对于每个受影响的基因,采用双侧Fisher 's精确测试来计算mScarlet荧光升高或降低人群中突变的富集程度。结果gydF4y2BaPgydF4y2Ba-值根据Benjamini-Hochberg方法进行多次测试。对于每个基因,在mscarlett -high细胞中发现的映射到该基因的独特感觉插入的比例被对应的mscarlett -low细胞中独特感觉插入的比例所除。为了数据可视化,每个基因的突变比为(gydF4y2BaygydF4y2Ba-轴)随后与mscarlett -high和mscarlett -low细胞中基因中识别的独特突变的组合数量(gydF4y2BaxgydF4y2Ba设在)。gydF4y2Ba
细胞刺激试验gydF4y2Ba
除非另有说明,使用以下浓度进行细胞刺激试验(读数:流式细胞仪,ELISA或qPCR): MDP(20µg mlgydF4y2Ba−1gydF4y2Ba, Invivogen), L18-MDP (200 ng mlgydF4y2Ba−1gydF4y2Ba, Invivogen), iE-DAP(20µg mlgydF4y2Ba−1gydF4y2Ba, Invivogen), C12-ie-DAP (200 ng mlgydF4y2Ba−1gydF4y2Ba), TNF (6.25 ng mlgydF4y2Ba−1gydF4y2BaPeproTech)。KBM-7细胞(2.5 × 10gydF4y2Ba6gydF4y2Ba(每孔最终体积100 μ l)在37°C刺激16小时。对于流式细胞术研究,mscarlett阳性细胞在BD LSR Fortessa上进行分析。酶联免疫吸附试验中,旋转细胞,收集上清。THP-1细胞(2.5 × 10gydF4y2Ba6gydF4y2Ba(每孔最终体积100 μ l)在37°C刺激16小时。酶联免疫吸附试验中,旋转细胞,收集上清。gydF4y2Ba
每毫升10万个NOD2-HEK细胞(每孔50 μ l)接种于96孔透明板中。48 h后,将细胞转入含有指示刺激的HEK-Blue检测培养基(Invivogen)。肽聚糖(PGN)gydF4y2Ba金黄色葡萄球菌gydF4y2Ba用溶菌酶(20µg mlgydF4y2Ba−1gydF4y2Ba)在50 mM Tris (pH 6.8)中,在37°C下孵育45分钟,然后在95°C下热失活5分钟,离心澄清。然后使用含有消化后PGN的清除上清进行处理。超纯,可溶性PGNgydF4y2Ba大肠杆菌gydF4y2Ba直接用来刺激细胞。刺激16小时后,使用平板阅读器(Tecan Spark 20M)测量620 nm处的吸光度。对于洋地黄苷的渗透实验,如前所述,用渗透缓冲液处理细胞gydF4y2Ba27gydF4y2Ba: 50 mM HEPES (pH 7.0), 100 mM KCl, 3 mM MgClgydF4y2Ba2 gydF4y2Ba, 0.1 mM DTT, 85 mM蔗糖,0.2% BSA, 1 mM ATP和0.1 mM GTP加或不加10µg mlgydF4y2Ba−1gydF4y2Ba洋地黄皂苷(Sigma)与指示配体补充10分钟。然后取出缓冲液,将细胞置于培养基中16 h。gydF4y2Ba
分析流式细胞术gydF4y2Ba
细胞在BD LSR Fortessa上进行分析。数据采集采用BD FACSDiva 8.0.1和8.0.2软件。流式细胞术数据采用FlowJo 10.7进行分析。所有直方图都显示为标准化模式。IL-1β-mScarlet的百分比gydF4y2Ba+gydF4y2Ba细胞来自于对野生型和缺乏nagk的未经处理的细胞群进行门控。gydF4y2Ba
非洲联合银行下拉gydF4y2Ba
用MDP刺激1000万个BMDMs或2000万个THP-1或KBM-7细胞(对于BMDMs, 10µg mlgydF4y2Ba−1gydF4y2Ba)或L18-MDP(用于THP-1s和KBM-7s, 200 ng mlgydF4y2Ba−1gydF4y2Ba),在PBS中洗涤,并在500µl DISC缓冲液(150 mM NaCl, 50 mM Tris pH 7.5, 10%甘油,1% Triton X-100)中溶解,并加入cOmplete蛋白酶抑制剂鸡尾酒(Roche)和10 mMgydF4y2BaNgydF4y2Ba-乙基马来酰亚胺冰敷20分钟。样品在17000下离心澄清gydF4y2BaggydF4y2Ba10分钟后直接添加到20µl包装的谷胱甘肽Sepharose beads预先与100µg GST-UbA结合。珠粒在转轮上4°C孵卵过夜,DISC缓冲液洗涤3次,用2 × SDS样品缓冲液(4% SDS, 20%甘油,120 mM Tris-Cl pH 6.8, 0.02%溴酚蓝)洗脱。gydF4y2Ba
crispr - cas9介导的敲除细胞系的生成gydF4y2Ba
THP‐1,KBM-7, NOD2-HEK和HEK 293T细胞被RNPs靶向NAGK或NOD2。使用了以下grna: NAGK grna1:5 ' - gcctagggcctatctctgg -3 ', NAGK grna2:5 ' -TTAATCACCACCGATGCCGC-3 ', NOD2 grna1:5 ' -GGACTGGCTGCTGTCCTGGG-3 ', NOD2 grna2:5 ' -CGAGCACATTTCACAACCTG-3 '。将合成的化学稳定的crRNA:tracrRNA对(IDT)在95°C下退火5分钟并在室温下孵育30分钟,然后将gRNAs与重组NLS-Cas9蛋白在室温下混合10分钟。对于每对gRNA,每100 pmol gRNA加入40 pmol Cas9。将100万个细胞重悬于20µl核反缓冲液P3 (Lonza)中(用于KBM-7细胞)或缓冲液SG(用于THP-1细胞、NOD2-HEK细胞和HEK 293T)中。在该缓冲液中添加RNPs,并用以下程序进行核感染:THP-1 (FF-100程序),KBM-7 (EH-100程序),NOD2-HEK细胞(CM-130), HEK 293T (CM-130)。核感染后,从温培养基的核感染试管中收集细胞,转移到KBM-7和THP-1的6孔板上,转移到NOD2-HEK细胞和HEK 293T细胞的24孔板上。细胞静置48小时,进行最小稀释克隆。大约三周后,当菌落可见时,收集克隆,用western blotting或MiSeq分析gydF4y2Ba28gydF4y2Ba.亲本细胞系作为野生型对照。除非另有说明,在实验中使用池敲除。gydF4y2Ba
强力霉素诱导细胞系的产生gydF4y2Ba
从KBM-7细胞裂解物的cDNA中扩增出人NAGK或人NOD2,并采用常规Gibson克隆(pLI_hsNAGK_WT_Puro)将其克隆到dox-on慢病毒质粒中。HA-taggedgydF4y2Ba果蝇gydF4y2Ba利用IDT对NAGK (CG6218)进行密码子优化合成,利用常规Gibson克隆(pLI_dmNAGK_Puro)将其克隆到dox-on慢病毒质粒中。从野生型序列中克隆出NAGK糖结合突变体(pLI_hsNAGK_D107V_Puro),采用Gibson突变克隆技术进行突变。转导指示的基因型,并选择质粒整合使用嘌呤霉素(1µg mlgydF4y2Ba−1gydF4y2Ba).多克隆细胞群用于进一步实验。对于刺激,细胞用强力霉素(1µg mlgydF4y2Ba−1gydF4y2Ba刺激前5小时。gydF4y2Ba
放射性标记NAGK激酶活性测定gydF4y2Ba
人类NAGK蛋白磷酸化各种氨基糖的能力如先前对细菌MurK蛋白所描述的那样进行了分析gydF4y2Ba29gydF4y2Ba.简而言之,10 nM NAGK与0.1 mM或1 mM底物、0.5 mM ATP和微量[gydF4y2BagydF4y2Ba32gydF4y2Ba-P]ATP(哈特曼分析)在反应缓冲液(50 mM HEPES pH 7.5, 50 mM NaCl, 10 mM MgClgydF4y2Ba2 gydF4y2Ba).反应在37°C下孵育1小时,并在TLC上观察1µl反应产物(硅胶60 F254, Merck)。丁醇-甲醇-氨-水(5:4:2:1 [vol/vol/vol/vol])作为流动缓冲液,薄层色谱板采用荧光成像分析(Typhoon FLA 9000, GE Healthcare)。gydF4y2Ba
体外MDP色谱和质谱分析gydF4y2Ba
对于MDP,在LC-MS /MS分析之前,用胰蛋白酶消化pMDP和NAGK鉴定样品。蛋白质用5 mM二硫赤糖醇在37°C下还原30分钟,半胱氨酸用碘乙酰胺烷基化(最终浓度15 mM)在黑暗中反应30分钟。用7.4 ng测序级改良猪胰蛋白酶(Promega)进行消化。MDP和pMDP检测使用easy - lc 1200系统(赛默飞世尔科学公司)耦合到Orbitrap Elite质谱仪(赛默飞世尔科学公司)。样品在300 nl min分离gydF4y2Ba−1gydF4y2Ba在易喷柱(PepMap RSLC C18, 15厘米× 75微米内径,赛默飞世尔科学)。溶剂A为2%乙腈,0.1%甲酸,溶剂B为95%乙腈,0.1%甲酸。在分离过程中,分别使用2% ~ 35%溶剂B (30 min)和35% ~ 80%溶剂B (5 min)两个连续梯度。质谱采集在正离子模式下进行,扫描范围为250 ~ 1800gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba分辨率为12万。使用Xcalibur Qual Browser 4.1.31.9 (Thermo Fisher Scientific)生成提取的离子色谱图gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba493.215 MDP和gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba573.181磷- mdp质量公差为10ppm。NAGK鉴定使用了Ultimate 3000纳米lc系统(赛默飞世尔科学公司)耦合QExactive HF-X质谱仪(赛默飞世尔科学公司)。样品以20µl min的流速转移到捕集柱(Acclaim PepMap 100, 100 μm × 2 cm, nanoViper C18, Thermo Fisher Scientific)gydF4y2Ba−1gydF4y2Ba在250 nl min分离gydF4y2Ba−1gydF4y2Ba易喷柱(PepMap RSLC C18, 50 cm × 75 μ m内径,赛默飞世尔科学公司)。溶剂A为0.1%甲酸,溶剂B为0.1%甲酸乙腈。为了分离,在30分钟内使用3%到25%的溶剂B,在5分钟内使用25%到40%的溶剂B。质谱采集在正离子模式下进行,扫描范围为gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba350到1600,分辨率60k。在15k分辨率下采集数据依赖的HCD MS/MS谱。光谱分析使用MASCOT V2.6.1(矩阵科学)和UniProt数据库的人类子集。进一步检查电位gydF4y2Ba大肠杆菌gydF4y2Ba重组NAGK制剂中的杂质,用UniProt进一步分析了光谱gydF4y2Ba大肠杆菌gydF4y2Ba序列数据库。gydF4y2Ba
细胞L18-MDP, MDP和6-phospho-MDP提取协议gydF4y2Ba
收集500万个KBM-7野生型和NAGK池敲除细胞,包括未经处理的细胞和用L18-MDP (200 ng ml)刺激的细胞gydF4y2Ba−1gydF4y2Ba) 30分钟,然后用37°C的PBS清洗两次,然后在液氮中冷冻并保存在- 80°C。使用300µl冷90%甲醇(LC-MS级Optima, Fisher Scientific)提取细胞。标记d5 -色氨酸(CDN同位素)添加到样品中(10µl 0.005 mg ml)gydF4y2Ba−1gydF4y2Ba)作为内部标准。在短暂涡旋后,样品在Bioruptor (BioNordika)中进行超声检测,温度设置为4°C,循环15次,每次30秒,休息30秒,然后在Eppendorf thermoixer (Fisher Scientific)中以4°C, 2000转/分的速度振荡15分钟。在4°C下15,000 g离心15分钟后(Eppendorf微离心机,Fisher Scientific),将上清收集到一个新的预冷却1.5 ml管中,并在室温下干燥(SpeedVac真空浓缩器,Thermo Fisher Scientific)。干燥样品在50µl H中重新构成gydF4y2Ba2 gydF4y2BaO (LC-MS级Optima, Fisher Scientific),在4°C下以2000转/分的速度涡旋和摇晃15分钟。在15000离心后gydF4y2BaggydF4y2Ba上清在4°C下保存15分钟,在LC-MS小瓶中收集,并在−80°C保存,直到LC-MS分析。gydF4y2Ba
细胞L18-MDP, MDP和6-phospho-MDP LC-MS分析gydF4y2Ba
LC-MS采集过程中,样品在冰箱中解冻,并在自动进样器中保存在4°C。采集是在LC Vanquish系统上进行的,该系统连接到配有加热电喷雾电离源(HESI)的Orbitrap 480 Exploris MS(赛默飞世尔科学公司)。注入10微升细胞提取物,分子在Luna Omega Polar C18上分离,100 × 2.1 mm色谱柱,粒径为3 μ m,孔径为100 Å,使用多孔Polar C18保护筒(Phenomenex),梯度15分钟(缓冲液a: 0.1%甲酸在HgydF4y2Ba2 gydF4y2BaO、缓冲液B: 0.1%甲酸乙腈;流量在300 μ l mingydF4y2Ba−1gydF4y2Ba;前0.5分钟为0% B, 9.5分钟为0-99% B, 99% B维持2分钟,1分钟降至0%,2分钟与0% B平衡)。柱温保持在45℃。剖面数据在负模式下采集,设置如下:喷雾电压3.4 kV,加热毛细管温度350°C,鞘气60任意单位,辅气20任意单位,扫气0,漏斗射频水平60%。全质谱(50 - 1000gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba)积累3 × 10后获得gydF4y2Ba6gydF4y2Ba离子在Orbitrap (AGC目标300%,最大注入时间100ms,微扫描1)在120,000分辨率。gydF4y2Ba
感兴趣的标准化合物与样品一起处理,并注入质量以充电和保留时间说明;D5-tryptophan (208.10 - -208.20;3.0-4.0分钟),L18-MDP (757.40-757.50;9.0-10.0分钟),MDP (491.20-491.21;2.0-3.0 min)和pMDP (571.10-571.20;2.0 - -2.9分钟)。在色谱杂质的情况下,采用内标空白作阴性试验。gydF4y2Ba
峰高(AH)和峰面积(AA)从MS原始文件中提取,用于对d5 -色氨酸、L18-MDP、MDP和pMDP进行有针对性的分析,使用Xcalibur Processing Setup Quan(4.2.47版本,Thermo Scientific)。采用平滑点1,基线窗口50,区域噪声因子5,峰值噪声因子10,峰值最小峰高3.0。L18-MDP, MDP和6-phospho-MDP相对丰度归一化到各自样品中内部标准d5 -色氨酸的水平。每个分子的丰度用归一化峰面积(AA)表示。gydF4y2Ba
PhosphoproteomicsgydF4y2Ba
我们应用了EasyPhos协议gydF4y2Ba17gydF4y2Ba使磷酸肽富集THP-1样品:8 × 10gydF4y2Ba6gydF4y2Ba用L18-MDP (200 ng ml)刺激THP-1野生型或NAGK-KO克隆1细胞4个重复gydF4y2Ba−1gydF4y2Ba) 1小时,然后用冰冷的TBS洗净,用2%脱氧胆酸钠和100 mM Tris-HCl pH 8.5溶解并立即煮沸。对于bmdm,有三种野生型和gydF4y2BaNagkgydF4y2Ba−−/gydF4y2BaBMDM细胞群要么不处理,要么用MDP(10µg mlgydF4y2Ba−1gydF4y2Ba)或帕姆gydF4y2Ba3 gydF4y2Ba埋头gydF4y2Ba4gydF4y2Ba(500 ng mlgydF4y2Ba−1gydF4y2Ba) 1小时,然后按上述步骤处理。超声处理后,蛋白质量调整为1 mg,然后还原(10 mM三(2-羧基(乙基)膦)(TCEP),烷基化(40 mM 2-氯乙酰胺),用胰蛋白酶和lysC(1:100,酶:蛋白,w:w)过夜。异丙醇(最终浓度50%)、三氟乙酸(TFA,最终浓度6%)和磷酸一钾(KHgydF4y2Ba2 gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba最终浓度为1 mM)加入到其余的消化裂解液中。裂解物被摇动,然后在2000度旋转3分钟gydF4y2BaggydF4y2Ba,上清液用TiO孵育gydF4y2Ba2 gydF4y2Ba在40°C(1:10,蛋白质:珠子,w:w)浸泡5分钟。珠粒用异丙醇洗涤5次,用40%乙腈(ACN)和15%氢氧化铵(25% NH)洗脱5% TFA和磷酸盐gydF4y2Ba4gydF4y2BaOH)在C8舞台尖端。在45°C下SpeedVac 20分钟后,磷酸盐在SDB-RPS级尖上脱盐,并在5µl 2%乙腈和0.3% TFA中再溶解,并注入质谱仪。gydF4y2Ba
样品被加载到内部填充C18 1.9 μm重质颗粒(Maisch博士)的50厘米色谱柱上,使用easy - lc 1000系统(赛默飞世尔科学公司)耦合到MS (Q Exactive HF-X,赛默飞世尔科学公司)。自制柱式烤箱将柱温保持在60℃。将肽引入到有缓冲液A(0.1%甲酸)的色谱柱上,用于数据独立采集的磷酸盐以3%缓冲液B(80%乙腈,0.1%甲酸)为起始,以70分钟的梯度洗脱,然后以350 nl min的流速逐步增加至40分钟19%,20分钟41%,5分钟90%和5分钟95%gydF4y2Ba−1gydF4y2Ba.采用数据独立采集的质谱方法,其中一次全扫描(300 ~ 1650gydF4y2Bam / zgydF4y2Ba,gydF4y2BaRgydF4y2Ba= 60000在200gydF4y2Bam / zgydF4y2Ba,最大注射时间60 ms),目标为3 × 10gydF4y2Ba6gydF4y2Ba首先进行离子分析,然后在32个分辨率为30,000的窗口中,前体离子以更高能量的碰撞解离破碎(阶梯碰撞能量25%,27.5%,30%),并以3 × 10的AGC目标进行分析gydF4y2Ba6gydF4y2Ba在正极性剖面模式下,离子和最大注入时间为54毫秒。gydF4y2Ba
磷蛋白组学数据处理gydF4y2Ba
质谱原始文件由spectronau14版软件处理gydF4y2Ba30.gydF4y2Ba使用directDIA选项。在默认设置中添加了丝氨酸/苏氨酸/酪氨酸磷酸化作为可变修饰,包括半胱氨酸卡酰胺甲基化作为固定修饰,n端乙酰化和蛋氨酸氧化作为可变修饰。使用人工Uniprot FASTA数据库(2015年审评21039项,未审评70579项)。在肽和蛋白质水平上,FDR设置为小于1%,并指定了肽的最小长度为7个氨基酸。以胰蛋白酶和赖氨酸为蛋白酶,最多漏切两条,酶特异性设定为精氨酸和赖氨酸的c端,与预期一致。使用Perseus软件v.1.6.2.2进行数据分析gydF4y2Ba31gydF4y2Ba.磷酸化的定位截止值设置为0,但随后使用Perseus插件过滤定位概率为0.75gydF4y2Ba32gydF4y2Ba.gydF4y2Ba
NanoBit蛋白质-蛋白质相互作用试验gydF4y2Ba
通过标准克隆方法生成NOD2与SmBiT(11个氨基酸)和LgBiT (17.6 kDa)的n端融合结构。在接近时,SmBiT-LgBiT会产生强烈的NanoLuc荧光素酶信号。蛋白质-蛋白质相互作用试验:2.0 × 10gydF4y2Ba4gydF4y2Ba野生型和gydF4y2BaNAGK -gydF4y2Ba敲除的HEK 293T细胞在96孔白色不透明板上每孔播种。第二天,细胞分别用每种结构物或对照载体30 ng转染三份,使用氯化钙和gydF4y2BaNgydF4y2Ba,gydF4y2BaNgydF4y2Ba-双(2-羟乙基)-2-氨基乙磺酸缓冲盐水转染法。37°C孵育5 h后,改变培养基,用200 ng ml刺激细胞gydF4y2Ba−1gydF4y2BaL18-MDP 24小时。第二天,根据制造商的说明,使用NanoGlo荧光素酶测定系统(Promega)测定发光。相对响应率(relative response ratio, RRR)计算方法为:感兴趣的平均发光值与阴性对照之差除以阳性(SmBiT-PRKACA和LgBiT-PRKAR2A)与阴性对照(空向量)之差,再乘以100%得到比例为百分比:gydF4y2Ba
MTP摄取测定gydF4y2Ba
mtp -荧光素的合成如前所述,用于muramylpeptide生物素化gydF4y2Ba33gydF4y2Ba.MurNAc-Ala -gydF4y2BadgydF4y2Ba-isoGln-Lys购自Invivogen公司,NHS荧光素购自Thermo Scientific公司作为起始试剂。作为副产物,乳酸- ala -gydF4y2BadgydF4y2Ba还分离出- isogln - lys -荧光素(lac-TP-fluorescein)。文中给出了完整的实验细节和结构鉴定数据gydF4y2Ba补充的方法gydF4y2Ba.gydF4y2Ba
KBM-7细胞(2.5 × 10gydF4y2Ba6gydF4y2Ba(每孔终体积100 μ l)与MurNAc-Ala-孵育gydF4y2BadgydF4y2Ba- isogln - lys -萤光素(mtp -萤光素)或lac- tp -萤光素(20µM)在37°C的指定时间。然后用冰冷的PBS冲洗细胞五次。采用BD LSR Fortessa细胞流式细胞术检测细胞内荧光素水平。gydF4y2Ba
MDP磷酸化用于细胞培养实验和核磁共振分析gydF4y2Ba
反应混合物含有50毫米HEPES pH 8.0, 10毫米MgClgydF4y2Ba2 gydF4y2Ba, 50 mM NaCl, 5 mM ATP, 1.6或2 mM MDP,加入或不加入3.6 μ M重组NAGK,在37℃下孵育2 h。孵育后,将反应混合物加热到95°C 5分钟,使重组NAGK失活并沉淀。溶液在20000度下离心澄清gydF4y2BaggydF4y2Ba5 min,收集上清进行刺激(反应混合物记为pMDP)。gydF4y2Ba
核磁共振分析gydF4y2Ba
混合物被冷冻干燥,氘交换是通过冷冻干燥样品溶液在氘水(DgydF4y2Ba2 gydF4y2BaO;99.98%, Deutero)两次。核磁共振波谱测量是在300k的Bruker Avance上进行的gydF4y2Ba3gydF4y2Ba700 MHz光谱仪配备反向5毫米四共振z级冷冻探头(光谱仪频率:700.43 MHz用于gydF4y2Ba1gydF4y2BaH, 176.12 MHz为gydF4y2Ba13gydF4y2BaC和283.54 MHzgydF4y2Ba31gydF4y2BaP).丙酮作为外部标准,用于校准gydF4y2Ba1gydF4y2BaH (gydF4y2BaδgydF4y2BaHgydF4y2Ba= 2.225 ppm)和gydF4y2Ba13gydF4y2BaC (gydF4y2BaδgydF4y2BaCgydF4y2Ba= 30.89 ppm) NMR谱;以85%磷酸作为外标,对gydF4y2Ba31gydF4y2Ba核磁共振谱(gydF4y2BaδgydF4y2BaPgydF4y2Ba= 0.00 ppm)。所有数据均采用Bruker TOPSPIN V 3.1或更高版本(Bruker BioSpin Corporation)进行采集和处理。所使用的参数集是从各自的Bruker标准参数集开始调整的,这些参数集都包含在这个软件中。二维gydF4y2Ba1gydF4y2BaH,gydF4y2Ba31gydF4y2Ba混合时间为120 ms,记录P-HMQC-TOCSY谱。gydF4y2Ba
ELISAgydF4y2Ba
细胞因子使用小鼠TNF和小鼠IL-6 ELISA试剂盒(BD Bioscience)或人IP-10或人IL-8 ELISA试剂盒(BD Bioscience)根据制造商说明进行测量。gydF4y2Ba
人NAGK的表达与纯化gydF4y2Ba
完整的人类gydF4y2BaNAGKgydF4y2Ba对基因进行密码子优化表达gydF4y2Ba大肠杆菌gydF4y2Ba克隆到修饰过的pET21载体上,带有n端His-MBP标签。gydF4y2Ba大肠杆菌gydF4y2BaBL21 Rosetta (DE3)细胞在3l TB培养基中培养至gydF4y2Ba一个gydF4y2Ba600gydF4y2Ba0.3 mM IPTG在37℃下诱导蛋白表达4 h。将细胞球重悬于裂解缓冲液(20 mM HEPES pH 7.5, 300 mM NaCl, 10 mM咪唑pH 8.0, 5%甘油,0.05% Triton X-100, 1 mM β-巯基乙醇)中,超声干扰。重组NAGK通过Ni-NTA亲和层析纯化,用裂解缓冲液洗涤,然后用缓冲液HS (20 mM HEPES pH 7.5, 1 M NaCl, 10 mM咪唑pH 8.0, 5%甘油,1 mM β-巯基乙醇),然后用缓冲液A (20 mM HEPES pH 7.5, 150 mM NaCl, 10 mM咪唑pH 8.0, 5%甘油,1 mM β-巯基乙醇)。HIS-MBP-NAGK在补充250 mM咪唑的缓冲液A中洗脱。随后,在透析缓冲液(20 mM HEPES pH 7.5, 50 mM NaCl, 2 mM DTT)中通过TEV蛋白酶裂解在4℃下去除His-MBP标记。用HiTrap Q柱(GE Healthcare)进一步纯化蛋白质,用B缓冲液线性梯度洗脱(20 mM HEPES pH 7.5, 2 M NaCl, 2 mM DTT)。对于最终的纯化,含有NAGK蛋白的组分被装载在Superdex 16/60 S200尺寸的排除色谱柱(GE Healthcare)上,在20 mM HEPES pH 7.5, 150 mM NaCl, 5%甘油,1 mM TCEP中。将蛋白质样品浓缩并在液氮中快速冷冻,并在−80°C保存。gydF4y2Ba
qPCRgydF4y2Ba
RNA从2 × 10中分离得到gydF4y2Ba6gydF4y2BaKBM-7单元或1 × 10gydF4y2Ba6gydF4y2BaBMDM细胞使用总RNA纯化迷你旋转柱试剂盒(Genaxxon Bioscience GmbH)根据制造商的协议。用DNaseI (Thermo Scientific)对提取的RNA中剩余的DNA进行消化。cDNA合成用RevertAid逆转录酶(Thermo Scientific)和Oligo(dT)18引物进行。使用固相可逆固定化磁珠(GE Healthcare)对合成的cDNA进行清除。在qPCR反应中,分别使用了PowerUp SYBR Green Master Mix (Thermo Scientific)和引物对。本研究使用的qPCR引物见补充表gydF4y2Ba2 gydF4y2Ba.gydF4y2Ba
西方墨点法gydF4y2Ba
刺激后,细胞在DISC裂解缓冲液(150 mM NaCl, 50 mM Tris pH 7.5, 10%甘油,1% Triton X-100)中裂解,补充cOmplete蛋白酶抑制剂鸡尾酒(Roche)和10 mMgydF4y2BaNgydF4y2Ba-乙基马来酰亚胺,然后将2× SDS裂解缓冲液(126 mM Tris-HCl pH 8, 20% v/v甘油,4% w/v SDS, 0.02% w/v溴酚蓝,5% v/v β-巯基乙醇)反复冷冻-煮沸循环。样品用SDS-PAGE分离,转移到硝化纤维膜上。使用以下抗体进行探测:兔抗nagk (1:10 00, ab203900, Abcam)、兔抗ripk2(1:10 00, 4142,细胞信号技术)、小鼠抗β-肌动蛋白辣根过氧化物酶(HRP) (1:10 00, sc-47778, Santa Cruz生物技术)、兔抗磷酸化p65(1:10 00, 3033,细胞信号技术)、兔抗磷酸化p38(1:10 00, 9211,细胞信号技术)、小鼠抗磷酸化IκBɑ(1:10 00,9246,细胞信号技术)、小鼠抗泛素(1:10 00,3936,细胞信号技术)、抗小鼠IgG hrp链接(1:5 000,7076,细胞信号技术),抗兔IgG - hrp(1:5 000, 7074,细胞信号技术)。凝胶源数据见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
生物信息学gydF4y2Ba
基因表达数据从BioGPS主页下载:gydF4y2Bahttp://biogps.org/downloads/gydF4y2Ba(人U133A/GNF1H基因图谱平均值矩阵)。进行分析和绘图gydF4y2BaRgydF4y2Ba(版本4.1.0)。低变异基因(gydF4y2BaσgydF4y2Ba²<1)被排除在分析之外。对于剩余的基因,使用碱基R函数cor()计算Pearson相关矩阵。基因按相关系数排序gydF4y2BaNAGKgydF4y2Ba,截止日期为gydF4y2BargydF4y2Ba≥0.7。剩余113个基因使用PANTHER GO-slim进行基因本体富集分析gydF4y2Ba34gydF4y2Ba.结果按显著性排序,以FDR≤10为临界值gydF4y2Ba−7gydF4y2Ba(FDR由Benjamini-Hochberg程序计算)。gydF4y2BaRgydF4y2Ba分析和绘图的代码可在Github:gydF4y2Bahttps://github.com/Pestudkaru/Corr_analysisgydF4y2Ba.gydF4y2Ba
NAGK-NOD2的系统发育比较gydF4y2Ba
执行迭代BLAST (PSI-BLAST)搜索,以使用默认设置(BLOSUM62矩阵;缺口成本-存在:11扩展:1;条件构成分数矩阵调整;PSI-BLAST阈值:0.005)。gydF4y2Ba智人gydF4y2Ba(NCBI AAH05371.1)和gydF4y2Ba大肠杆菌gydF4y2Ba(NCBI WP_097585995.1)蛋白序列作为起始参考。所有显著序列(E值小于0.05)被选择用于后续PSI-BLAST轮(最多5轮)。序列上传到geneous Prime,根据长度(287-456个氨基酸)进一步选择。进行了Clustal Omega校准,以确定基于人类NAGK结构的活性位点残基的守恒性。除去非典型异构体和低质量蛋白序列,最终得到748个NAGK蛋白序列。使用默认设置的genous Tree Builder来计算显示为分支图的系统发育树。对于NOD2蛋白同源物鉴定,分别在哺乳动物、爬行动物、鸟类、两栖动物、鱼类和无脊椎动物物种中进行迭代BLAST (spi -BLAST)搜索。推导NOD2序列并上传到geneous Prime,使用Clustal Omega进行比对。CARD和NACHT结构域用于识别217个NOD2序列,然后将其覆盖到NAGK树上。gydF4y2Ba
统计数据gydF4y2Ba
除非另有说明,统计学显著性由单向或双向方差分析和Dunnett或Šídák校正多次测试确定。准确的重复数目(gydF4y2BangydF4y2Ba)在图形图例内显示。使用GraphPad Prism 9进行数据绘图和统计分析。如果使用一个比较条显示多个比较,则比较条的大勾表示显著性水平上的语句所引用的参考数据。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
基于质谱的蛋白质组学数据已通过PRIDE合作伙伴存储库保存到ProteomeXchange Consortium,并可通过标识符获取gydF4y2BaPXD022384gydF4y2Ba.深度测序原始数据(全基因组遗传筛选)已存入NCBI序列读取档案,登录号为gydF4y2BaPRJNA841795gydF4y2Ba.相应的处理数据见补充表gydF4y2Ba1gydF4y2Ba.LC-MS原始数据已提交给MassIVE,可通过ID访问gydF4y2BaMSV000088170gydF4y2Ba.材料和试剂可根据要求从通讯作者处获得。gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
代码的可用性gydF4y2Ba
分析和绘图的R代码可在Github:gydF4y2Bahttps://github.com/Pestudkaru/Corr_analysisgydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
Ellouz, F., Adam, A., Ciorbaru, R. & Lederer, E.细菌肽聚糖衍生物佐剂活性的最低结构要求。gydF4y2Ba物化学。Biophys。Commun >,gydF4y2Ba59gydF4y2Ba, 1317-1325(1974)。gydF4y2Ba
莫瑟,C.西奈,P.和亚当,A.细菌肽聚糖衍生物的全合成和辅助活性。gydF4y2Ba物化学。Biophys。Commun >,gydF4y2Ba66gydF4y2Ba1316-1322(1975)。gydF4y2Ba
小谷,S,渡边,Y,木下,F, Shimono, T. & Morisaki, I.合成的免疫佐剂活性gydF4y2BaNgydF4y2Ba-乙酰-muramyl-肽或-氨基酸。gydF4y2BaBiken J。gydF4y2Ba18gydF4y2Ba, 105-111(1975)。gydF4y2Ba
吉拉丁,s.e.等人。Nod2是一种通过muramyl dipeptide (MDP)检测肽聚糖的通用传感器。gydF4y2Ba生物。化学。gydF4y2Ba278gydF4y2Ba, 8869-8872(2003)。gydF4y2Ba
Caruso, R., Lo, B. C. & Nunez, G.宿主-微生物群在炎症性肠病中的相互作用。gydF4y2BaNat. Rev. Immunol。gydF4y2Ba20.gydF4y2Ba, 411-426(2020)。gydF4y2Ba
Chiaradonna, F., Ricciardiello, F. & Palorini, R.营养感应己糖胺生物合成途径作为癌症代谢重组的枢纽。gydF4y2Ba细胞gydF4y2Ba7gydF4y2Ba, 53(2018)。gydF4y2Ba
凯瑞特,j.e.等。人类细胞中的单倍体基因筛选可以识别病原体使用的宿主因子。gydF4y2Ba科学gydF4y2Ba326gydF4y2Ba, 1231-1235(2009)。gydF4y2Ba
Matsumoto, K.等。6- o -酰基muramyl二肽类似物对小鼠感染非特异性抗性的刺激。gydF4y2Ba感染。Immun。gydF4y2Ba32gydF4y2Ba, 748-758(1981)。gydF4y2Ba
Chamaillard等人。NOD1在宿主识别含二氨基海二酸的细菌肽聚糖中的重要作用。gydF4y2BaImmunol Nat。gydF4y2Ba4gydF4y2Ba, 702-707(2003)。gydF4y2Ba
吉拉丁,s.e.等人。Nod1从革兰氏阴性细菌肽聚糖中检测到一种独特的muropeptide。gydF4y2Ba科学gydF4y2Ba300gydF4y2Ba, 1584-1587(2003)。gydF4y2Ba
费斯勒,E.等。由DELE1协调的通路将线粒体应激传递到细胞质。gydF4y2Ba自然gydF4y2Ba579gydF4y2Ba, 433-437(2020)。gydF4y2Ba
Caruso, R., Warner, N., Inohara, N. & Nunez, G. NOD1和NOD2:信号、宿主防御和炎症疾病。gydF4y2Ba免疫力gydF4y2Ba41gydF4y2Ba, 898-908(2014)。gydF4y2Ba
韦霍芬,韦霍芬,伯杰,陈洪杰,桑格,韩德立希。人的结构gydF4y2BaNgydF4y2Ba-乙酰氨基葡萄糖激酶与gydF4y2BaNgydF4y2Ba-乙酰葡萄糖胺和与ADP/葡萄糖:洞察底物特异性和调控。gydF4y2BaJ. Mol.生物学。gydF4y2Ba364gydF4y2Ba, 388-399(2006)。gydF4y2Ba
Akella, n.m., Ciraku, L. & Reginato, m.j.火中浇油:己糖胺生物合成途径在癌症中的新兴作用。gydF4y2BaBMC医学杂志。gydF4y2Ba17gydF4y2Ba, 52(2019)。gydF4y2Ba
坎贝尔等人。谷氨酰胺剥夺触发nagk依赖的己糖胺挽救。gydF4y2BaeLifegydF4y2Ba10gydF4y2Ba, e62644(2021)。gydF4y2Ba
达姆加德,R. B.等。泛素连接酶XIAP在炎症和先天免疫中招募LUBAC为NOD2信号通路。gydF4y2Ba摩尔。细胞gydF4y2Ba46gydF4y2Ba, 746-758(2012)。gydF4y2Ba
Humphrey, S. J, Karayel, O., James, D. E. & Mann, M.使用EasyPhos平台的高通量和高灵敏度磷蛋白组学。gydF4y2BaProtoc Nat。gydF4y2Ba13gydF4y2Ba, 1897-1916(2018)。gydF4y2Ba
上原,T. & Park, J. T. ThegydF4y2BaNgydF4y2Ba乙酰-gydF4y2BadgydF4y2Ba-葡萄糖胺激酶gydF4y2Ba大肠杆菌gydF4y2Ba以及它在murrein循环中的作用。gydF4y2Baj . Bacteriol。gydF4y2Ba186gydF4y2Ba, 7273-7279(2004)。gydF4y2Ba
Inohara, N.等。NOD2介导的细菌muramyl二肽的宿主识别。对克罗恩病的影响。gydF4y2Ba生物。化学。gydF4y2Ba278gydF4y2Ba, 5509-5512(2003)。gydF4y2Ba
Blume, A., Berger, M., Benie, A. J., Peters, T. & Hinderlich, S.配体与gydF4y2BaNgydF4y2Ba-乙酰氨基葡萄糖激酶的STD NMR研究。gydF4y2Ba生物化学gydF4y2Ba47gydF4y2Ba, 13138-13146(2008)。gydF4y2Ba
Bera, A., Herbert, S., Jakob, A., Vollmer, W. & Gotz, F.为什么致病性葡萄球菌如此耐溶菌酶?的肽聚糖gydF4y2BaOgydF4y2Ba-乙酰转移酶OatA是水稻耐溶菌酶的主要决定因素gydF4y2Ba金黄色葡萄球菌gydF4y2Ba.gydF4y2Ba摩尔。Microbiol。gydF4y2Ba55gydF4y2Ba, 778-787(2005)。gydF4y2Ba
Shimada, T.等人。gydF4y2Ba金黄色葡萄球菌gydF4y2Ba避免以溶菌酶为基础的肽聚糖消化,这种消化与吞噬作用、炎症小体激活和IL-1β分泌有关。gydF4y2Ba细胞宿主微生物gydF4y2Ba7gydF4y2Ba, 38-49(2010)。gydF4y2Ba
Vollmer, W, Joris, B, Charlier, P. & Foster, S.细菌肽聚糖(murein)水解酶。gydF4y2Ba《。牧师。gydF4y2Ba32gydF4y2Ba, 259-286(2008)。gydF4y2Ba
Wefers, B., Bashir, S., Rossius, J., Wurst, W. & Kuhn, R.使用CRISPR/Cas9系统对小鼠受精卵进行基因编辑。gydF4y2Ba方法gydF4y2Ba121 - 122gydF4y2Ba, 55-67(2017)。gydF4y2Ba
Concordet, J. P. & Haeussler, M. CRISPOR: CRISPR/Cas9基因组编辑实验和筛选的直观指南选择。gydF4y2Ba核酸测定。gydF4y2Ba46gydF4y2Ba, w242-w245(2018)。gydF4y2Ba
布罗克曼等人。单细胞蛋白质状态的遗传线路图揭示了GPCR信号的关闭开关。gydF4y2Ba自然gydF4y2Ba546gydF4y2Ba, 307-311(2017)。gydF4y2Ba
Lee, J. et al.来自早期核内体的膜酰肽的ph依赖性内化使Nod1和Nod2信号通路得以实现。gydF4y2Ba生物。化学。gydF4y2Ba284gydF4y2Ba, 23818-23829(2009)。gydF4y2Ba
Schmid-Burgk, J. L.等。OutKnocker:一个快速和简单的基因分型设计核酸酶编辑细胞系的网络工具。gydF4y2Ba基因组Res。gydF4y2Ba24gydF4y2Ba, 1719-1723(2014)。gydF4y2Ba
瑞斯,J.,伯金,A. &梅耶尔,C.对一个gydF4y2BaNgydF4y2Ba-acetylmuramic酸/gydF4y2BaNgydF4y2Ba-乙酰氨基葡萄糖激酶gydF4y2Baacetobutylicum梭状芽胞杆菌gydF4y2Ba.gydF4y2Baj . Bacteriol。gydF4y2Ba193gydF4y2Ba, 5386-5392(2011)。gydF4y2Ba
Bruderer, R.等。通过数据独立采集和应用将定量蛋白质组分析的限制扩展到对乙酰氨基酚处理的三维肝脏微组织。gydF4y2Ba摩尔。细胞。蛋白质组学gydF4y2Ba14gydF4y2Ba, 1400-1410(2015)。gydF4y2Ba
Hogrebe, A.等人。大规模磷蛋白组学常用定量策略的基准测试。gydF4y2BaCommun Nat。gydF4y2Ba9gydF4y2Ba, 1045(2018)。gydF4y2Ba
Tyanova, S.等。用于(蛋白质)组学数据综合分析的Perseus计算平台。gydF4y2BaNat方法。gydF4y2Ba13gydF4y2Ba, 731-740(2016)。gydF4y2Ba
Gisch, N., Buske, B., Heine, H., Lindner, B. & Zahringer, U.具有nod2刺激活性的生物素化muramyl三肽的合成。gydF4y2BaBioorg。地中海,化学。列托人。gydF4y2Ba21gydF4y2Ba, 3362-3366(2011)。gydF4y2Ba
Mi, H., Muruganujan, A., Ebert, D., Huang, X. & Thomas, P. D. PANTHER版本14:更多基因组,新的PANTHER GO-slim和富集分析工具的改进。gydF4y2Ba核酸测定。gydF4y2Ba47gydF4y2Ba, d419-d426(2019)。gydF4y2Ba
确认gydF4y2Ba
感谢L. Hansbauer、M. Kösters、H. Käßner和S. Thomsen的杰出技术支持;S. Suppmann和蛋白生产核心设施(MPI,慕尼黑)用于表达重组GST-UbA;BioSysM流式细胞仪的极大支持;Z. Sun进行有益的讨论;S. Bauernfried提供了mScarlet瞄准结构;M. Berouti用于生成化学结构图形。这项工作得到了ERC (ERC-2020- adg - 101018672 ENGINES)和德意志Forschungsgemeinschaft (DFG,德国研究基金会)CRC 1403/A03(项目id 414786233)对V.H的资助,得到了欧盟研究和创新视野2020框架计划(2014-2020)的资助,根据Marie skodowska - curie资助协议,编号754388和德国卓越计划框架内的慕尼黑大学机构战略LMUexcellent的资助。ZUK22)授予c.a.s.,由马克斯普朗克科学促进会授予,由Helmholtz协会“ExNet-0041-Phase2-3 (SyNergy-HMGU)”授予,由Else Kröner费森尤斯基金会(fortrag - ggmbh)授予w.w.,由DFG (Project-ID 405101514)授予M.Y.,由ERC (ERC-2018- stg - 804182 SOLID)授予L.T.J.gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
概念化:C.A.S.和V.H.调查:c.a。A.-M.G, C.C.d.O.M, M.C.T, k, C.V, E.F, D.N, G.K。中华民国,A.W。M.K.P,合著,净收益和T.F.写作:C.A.S. V.H.和所有作者的意见。资源:w.w., M.Y, t.f., L.T.J, M.M.和V.H.gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢Stephen E. Girardin和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
图1 UDP-GlcNAc生物合成和挽救途径。gydF4y2Ba
一个gydF4y2Ba, UDP-GlcNAc生物合成和挽救途径的示意图(改编自gydF4y2Ba6gydF4y2Ba).gydF4y2BabgydF4y2Ba,数据来自图。gydF4y2Ba1 dgydF4y2Ba基因显示在gydF4y2Ba一个gydF4y2Ba(用橙色突出显示)。gydF4y2Ba
图2 NAGK在免疫细胞中表达。gydF4y2Ba
一个gydF4y2Ba使用包含44,775个探针的微阵列数据集Human U133A/GNF1H Gene Atlas构建包含7,064个最可变转录本(σgydF4y2Ba2 gydF4y2Ba> 1)。所有转录本均按与gydF4y2BaNAGKgydF4y2Ba, r≥0.7时作截点。其余113份转录本用于基因本体论分析。gydF4y2BabgydF4y2Ba,基因本体分析。高度相关的基因gydF4y2BaNAGKgydF4y2Ba被用来识别过度代表的生物过程。结果按照错误发现率(FDR)测量的显著性顺序绘制。颜色代码从红色(高显著性)到紫色(低显著性)。圆圈的大小表示有多少基因被发现是任何给定的GO项的一部分。x轴上显示的是折叠富集。gydF4y2BacgydF4y2Ba的两两比较gydF4y2BaNAGKgydF4y2BaGO术语“Granulocyte activation”与回归线(蓝色)和95%置信区间(浅蓝色)相关最高的四个基因。数据以日志的形式描述gydF4y2Ba2 gydF4y2Ba表达式的值。在原假设两个变量不是线性相关的情况下,进行了双尾t检验。多次检测均未进行校正。gydF4y2BaRgydF4y2Ba= Pearson相关系数,p = p -value。gydF4y2BadgydF4y2Ba,热图显示的表达模式gydF4y2BaNAGKgydF4y2Ba与最富集的GO基因一起称为“粒细胞活化”。列中的基因采用Pearson相关聚类。从蓝色到红色表示原木gydF4y2Ba2 gydF4y2Ba平均强度值。gydF4y2Ba
图3 NAGK不影响其他NF-kB激活免疫通路。gydF4y2Ba
流式细胞术分析KBM-7-IL1BgydF4y2BamScarletgydF4y2BaWT(灰色)和NAGKgydF4y2BaKOgydF4y2Ba池(深蓝色)细胞处理与指示增加剂量PamgydF4y2Ba3 gydF4y2Ba埋头gydF4y2Ba4gydF4y2Ba、PMA、重组IL-1β和TNF作用16 h。的意思是gydF4y2Ba±gydF4y2Bas.e.m的gydF4y2BangydF4y2Ba= 3个独立的生物样本;使用Šídák的多重比较检验进行双向方差分析。**** p < 0.0001或如所示。gydF4y2Ba
图4 NAGK是NOD2转录免疫应答所必需的。gydF4y2Ba
一个gydF4y2Ba、IL-8和IP-10生产KBM-7-IL1BgydF4y2BamScarletgydF4y2BaWT(灰色),NAGKgydF4y2BaKOgydF4y2Ba池细胞(深蓝色)和克隆细胞(浅蓝色)按指示被刺激。的意思是gydF4y2Ba±gydF4y2Bas.e.m的gydF4y2BangydF4y2Ba= 4个独立的生物样本;Dunnet多重比较检验的双向方差分析。gydF4y2BabgydF4y2BaqPCR分析KBM-7-IL1B的指示转录本gydF4y2BamScarletgydF4y2BaWT(灰色)和NAGKgydF4y2BaKOgydF4y2Ba池(深蓝色)细胞经MDP或iE-DAP处理4小时。基因表达水平归一化到gydF4y2BaGAPDHgydF4y2Ba.的意思是gydF4y2Ba±gydF4y2Bas.e.m的gydF4y2BangydF4y2Ba= 4 (n = 3 forgydF4y2BaIFIT1gydF4y2Ba,gydF4y2BaCXCL10gydF4y2Ba,gydF4y2BaNAGKgydF4y2Ba)独立的生物样本;使用Šídák的多重比较检验对日志转换数据进行双向方差分析。**** p < 0.0001或如所示。gydF4y2Ba
图5表达nod2的HEK细胞、THP-1细胞和KBM-7细胞中MDP的检测需要NAGK。gydF4y2Ba
一个gydF4y2Ba而且gydF4y2BabgydF4y2Ba, WT(灰色)和NAGKgydF4y2BaKOgydF4y2Ba按指示刺激NOD2-HEK细胞,并在16小时后测定NF-kB活性。的意思是gydF4y2Ba±gydF4y2Bas.e.m的gydF4y2BangydF4y2Ba= 3个独立的生物样本;使用Šídák的多重比较检验进行双向方差分析。gydF4y2BacgydF4y2Ba,免疫印迹法监测THP-1 WT和NAGK中NAGK的水平gydF4y2BaKOgydF4y2Ba克隆细胞。(代表三个独立的实验)。gydF4y2BadgydF4y2Ba、IL-8产生THP-1 WT(灰色)、NAGKgydF4y2BaKOgydF4y2Ba克隆1号(深蓝色)或克隆3号(浅蓝色)细胞在使用指示刺激治疗后进行监测。的意思是gydF4y2Ba±gydF4y2Bas.e.m的gydF4y2BangydF4y2Ba= 3个独立的生物样本;Dunnett多重比较检验的双向方差分析。**** p < 0.0001或如所示。gydF4y2BaegydF4y2Ba,在KBM-7-IL1B中使用免疫印迹法监测L18-MDP刺激后RIPK2泛素化和NF-kB和MAPK激活标记物gydF4y2BamScarletgydF4y2BaWT和NAGKgydF4y2BaKOgydF4y2Ba池或克隆细胞。泛素化蛋白通过内源性泛素化蛋白与固定泛素相关结构域(UBA)结合的下拉而富集。印迹代表三个生物重复中的一个。gydF4y2Ba
扩展数据图6 NAGK不影响MTP的摄取。gydF4y2Ba
一个gydF4y2Ba而且gydF4y2BabgydF4y2Ba,左上角荧光素标记分子的示意图。柱状图和直方图代表流式细胞术对KBM-7-IL1B的分析gydF4y2BamScarletgydF4y2BaWT(灰色)和NAGKgydF4y2BaKOgydF4y2Ba用mtp -荧光素(gydF4y2Ba一个gydF4y2Ba)或lac-TP-Fluorescein (gydF4y2BabgydF4y2Ba), MFI表示荧光强度的中值。柱状图代表平均值gydF4y2Ba±gydF4y2Bas.e.m的gydF4y2BangydF4y2Ba= 3个独立的生物样本;使用Šídák的多重比较检验进行双向方差分析。直方图表示三个独立实验中的一个实验。同样未经处理的样品用于mtp -荧光素和lac- tp -荧光素摄取实验作为对照。**** p < 0.0001或如所示。gydF4y2Ba
图7 NAGK的激酶活性是NOD2上游所必需的。gydF4y2Ba
一个gydF4y2Ba,免疫印迹显示KBM-7-IL1B中NAGK水平gydF4y2BamScarletgydF4y2BaWT或NAGKgydF4y2BaKOgydF4y2Ba用WT或D107V NAGK重组池细胞。gydF4y2BabgydF4y2Ba,流式细胞术分析这些细胞未处理(浅灰色)或多西环素处理(深灰色)后,MDP(深蓝色)或c12 - ee - dap(绿色)刺激16小时。的意思是gydF4y2Ba±gydF4y2Bas.e.m的gydF4y2BangydF4y2Ba= 3个独立的生物样本;Dunnett多重比较检验的双向方差分析。**** p < 0.0001或如所示。gydF4y2Ba
扩展数据图8 NAGK在O-6位点磷酸化MDP。gydF4y2Ba
2 mM MDP和5 mM ATP在37°C下50 mM HEPES pH 8.0, 10 mM MgCl中孵育2小时gydF4y2Ba2 gydF4y2Ba, 50 mM NaCl,加入或不加入3.6 μ M重组NAGK (rec. NAGK)。gydF4y2Ba一个gydF4y2Ba, 1 dgydF4y2Ba31gydF4y2BaP NMR分析显示了新信号的出现(δgydF4y2BaPgydF4y2Ba= 4.72, 4.62 ppm)衍生自存在rec. NAGK的单磷酸,同时,ATP部分转化为ADP(图。gydF4y2Ba3gydF4y2Ba).gydF4y2BabgydF4y2Ba,由2DgydF4y2Ba1gydF4y2BaH,gydF4y2Ba31gydF4y2BaP-HMQC-TOCSY, δ处的信号gydF4y2BaPgydF4y2Ba4.72 PPM可作为β-异位体的磷酸盐,δgydF4y2BaPgydF4y2Ba4.62 ppm分别为磷酸- mdp的α-异位体之一。所描绘的区域显示了各自的相互关系gydF4y2Ba31gydF4y2BaP信号传递给MurNAc残基(α: δ)对应的异构质子(H-1)gydF4y2BaHgydF4y2Ba5.18、维gydF4y2Ba3 gydF4y2BaJgydF4y2BaH1, H2gydF4y2Ba= 3.6 Hz;β,δgydF4y2BaHgydF4y2Ba4.68、维gydF4y2Ba3 gydF4y2BaJgydF4y2BaH1, H2gydF4y2Ba= 8.5 Hz)。用2D法确定磷酸盐的附着位置gydF4y2Ba1gydF4y2BaH,gydF4y2Ba31gydF4y2BaP-HMQC (gydF4y2BacgydF4y2Ba)及2DgydF4y2Ba1gydF4y2BaH,gydF4y2Ba13gydF4y2BaC-HSQCgydF4y2Ba部门gydF4y2Ba(gydF4y2BadgydF4y2Ba).对于α-异位体,磷酸盐与δ点的质子呈交叉相关gydF4y2BaHgydF4y2Ba分别为4.06-4.03和4.00-3.97 ppm,它们在δ处与碳结合gydF4y2BaCgydF4y2Ba63.5 ppm。对于β-异构体,磷酸盐与δ点的质子呈交叉相关gydF4y2BaHgydF4y2Ba分别为3.84-3.81和3.81-3.78 ppm,它们在δ处与碳结合gydF4y2BaCgydF4y2Ba65.4 ppm。这表明MDP的O-6位点发生了磷酸化。gydF4y2Ba
图9 6-phospho-MDP刺激nagk缺陷细胞。gydF4y2Ba
一个gydF4y2Ba而且gydF4y2BabgydF4y2Ba,以指定浓度的洋地黄苷缓冲液中的MDP或pMDP处理WT或nagk缺陷的NOD2-HEK细胞,并在16 h后通过ELISA检测IL-8的产生。的意思是gydF4y2Ba±gydF4y2Bas.e.m的gydF4y2BangydF4y2Ba= 3个独立的生物样本。gydF4y2Ba
NAGK从原核生物到真核生物是保守的,果蝇NAGK可以在NOD2的上游工作。gydF4y2Ba
一个gydF4y2Ba,以顺时针方向排列指示物种(细菌、古细菌、轮虫、线虫、扁形蠕虫、节肢动物、棘皮动物、软体动物、孔虫、辐射动物、两栖动物、鱼类、爬行动物、鸟类和哺乳动物)的NAGK蛋白的分支图。含有NOD2蛋白序列的物种以深粉色标记。蓝点代表感兴趣的特定物种的位置。gydF4y2BabgydF4y2Ba, KBM-7-IL1BgydF4y2BamScarletgydF4y2BaWT, NAGKgydF4y2BaKOgydF4y2Ba池单元或NAGKgydF4y2BaKOgydF4y2Ba用强力环素诱导的果蝇NAGK (CG6218)重建池细胞。16h后用流式细胞仪分析,或检测其上清液中IP-10的产生情况。的意思是gydF4y2Ba±gydF4y2Bas.e.m的gydF4y2BangydF4y2Ba= 4个独立的生物样本;Dunnett多重比较检验的双向方差分析。**** p < 0.0001或如所示。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
该文件包含补充方法和补充图1-2gydF4y2Ba
补充表1gydF4y2Ba
NOD2调控因子单倍体遗传筛选结果表gydF4y2Ba数据按照方法部分的描述进行处理。列为:基因符号,在IL-1B-mScarlet中各自基因中发现的突变gydF4y2Ba低gydF4y2Ba在IL-1B-mScarlet中发现的所有其他突变gydF4y2Ba低gydF4y2Ba细胞,在IL-1B-mScarlet各自的基因中鉴定出突变gydF4y2Ba高gydF4y2Ba在IL-1B-mScarlet中发现的所有其他突变gydF4y2Ba高gydF4y2Ba单元,p值,fdr校正p值。gydF4y2Ba
补充表2gydF4y2Ba
qPCR引物gydF4y2Ba提供了本研究使用的qPCR引物,并标明了种类、目的基因、取向和各自的序列。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
斯塔福德,c.a.,加索尔,AM。德·奥利维拉·曼恩,C.C.gydF4y2Baet al。gydF4y2BaNOD2的激活需要NAGK对muramyl肽的磷酸化。gydF4y2Ba自然gydF4y2Ba609gydF4y2Ba, 590-596(2022)。https://doi.org/10.1038/s41586-022-05125-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05125-xgydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba