摘要gydF4y2Ba
过继T细胞治疗癌症的疗效可能受到来自外在因素和内在抑制检查点的抑制信号的限制gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2 gydF4y2Ba.靶向基因编辑有可能克服这些限制,增强T细胞的治疗功能gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5克ydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10克ydF4y2Ba.在这里,我们在不同的免疫抑制条件下进行了多个全基因组CRISPR敲除筛选,以确定可以靶向防止T细胞功能障碍的基因。这些筛选集中在RASA2上,RASA2是一种RAS gtp酶激活蛋白(RasGAP),我们认为它是人类T细胞中的信号检查点,在急性T细胞受体刺激时下调,并可随着慢性抗原暴露逐渐增加。RASA2的消融增强了MAPK信号和嵌合抗原受体(CAR) T细胞的细胞溶解活性,以响应靶抗原。体外重复的肿瘤抗原刺激显示,与对照细胞相比,rasa2缺陷T细胞表现出更高的激活、细胞因子的产生和代谢活性,并在持续杀伤癌细胞方面表现出明显优势。在白血病小鼠模型中,rasa2敲除CAR - T细胞在骨髓中比对照细胞具有竞争适应度优势。在多个T细胞受体和CAR - T细胞疗法的临床前模型中,消融RASA2延长了移植液体或实体肿瘤的小鼠的生存期。总之,我们的研究结果强调RASA2是一个有希望的靶点,可以增强T细胞治疗癌症的持久性和效应功能。gydF4y2Ba
主要gydF4y2Ba
CAR - T细胞在一些侵袭性恶性血液肿瘤中已经发生了转变,T细胞受体(TCR)转基因T细胞(TCR T细胞)在实体肿瘤的早期临床研究中显示出了有希望的结果gydF4y2Ba1克ydF4y2Ba.然而,许多癌症,特别是实体肿瘤,对目前的T细胞疗法没有反应,或在最初的反应后迅速进展。在肿瘤内,免疫抑制微环境对抗肿瘤免疫的有效性构成了实质性的障碍gydF4y2Ba2 gydF4y2Ba,gydF4y2Ba11gydF4y2Ba.此外,持续暴露于抗原可导致T细胞功能障碍,强调需要平衡效应功能和工程T细胞的长期持久性gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.选择性基因的靶向操纵正在作为一种策略进行测试,以提高过继T细胞疗法的疗效gydF4y2Ba5克ydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba.然而,人类T细胞的最佳基因靶点还没有被系统地探索。大规模的CRISPR筛选可以加速基因扰动的发现,从而提高工程T细胞的功效gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10克ydF4y2Ba.我们之前在原代人T细胞中开发了一个发现平台,并将其应用于识别T细胞增殖的新遗传调控因子gydF4y2Ba13gydF4y2Ba.在这里,我们描述了在肿瘤微环境(TME)中常见的几种免疫抑制条件下进行的无偏倚遗传筛查,揭示了肿瘤微环境(TME)的消融gydF4y2BaRASA2gydF4y2Ba基因作为T细胞克服多种抑制信号的策略。我们发现,消融RASA2增强了对抗原的敏感性,改善了CAR - T和TCR T细胞的效应功能和持久性。最后,我们证明了抗原特异性T细胞的rasa2消融术可以增强肿瘤控制并延长液体和固体肿瘤的多种临床前模型的生存期。gydF4y2Ba
CRISPR屏幕聚集在RASA2上gydF4y2Ba
抑制TME和T细胞内在检查点可以影响工程T细胞靶向实体肿瘤的疗效gydF4y2Ba14gydF4y2Ba.我们开发了一种系统的方法来识别可以使T细胞抵抗TME中遇到的一系列抑制信号的遗传扰动。我们之前使用了CGS-21680,一种腺苷激动剂gydF4y2Ba13gydF4y2Ba,模拟腺苷A升高gydF4y2Ba2gydF4y2Ba对低氧TME中高水平腺苷的反应的抑制信号gydF4y2Ba15gydF4y2Ba.在这里,我们扩展了这一策略,以模拟TME中T细胞功能的多重挑战。为了模拟内在的检查点信号,我们专注于钙和钙调神经磷酸酶信号的抑制剂(他克莫司和环孢素),这是T细胞激活的一个关键途径,在肿瘤浸润的T细胞中经常被抑制gydF4y2Ba16gydF4y2Ba.为了在TME中模拟一个突出的外部抑制信号,我们使用了TGFβ,一种限制肿瘤内T细胞功能的典型抑制细胞因子gydF4y2Ba17gydF4y2Ba.最后,作为T调节细胞(TgydF4y2Ba注册gydF4y2Ba细胞)是多种肿瘤类型T细胞功能障碍的重要介质gydF4y2Ba18gydF4y2Ba,我们调整了我们的筛选平台,以分析细胞-细胞相互作用,从而揭示基因赋予抵抗效应T细胞抑制TgydF4y2Ba注册gydF4y2Ba细胞。gydF4y2Ba
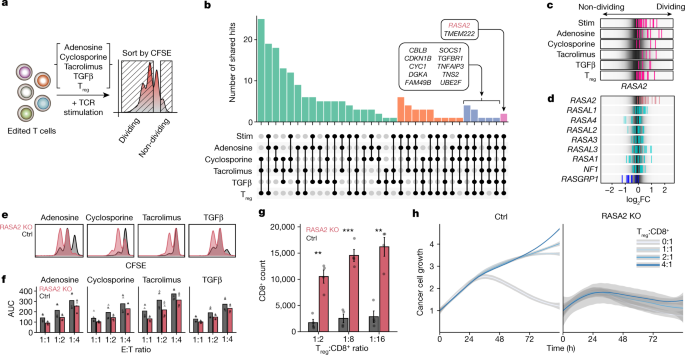
为了确定对这些抑制条件的抗性调控因子,我们在原代人T细胞中应用了单引导RNA (sgRNA)慢病毒感染,并使用Cas9电穿孔(SLICE)混合全基因组crispr敲除(KO)屏幕gydF4y2Ba13gydF4y2Ba.在这里,我们分析了在多个独立供体和抑制条件下的原代人T细胞中总共六种不同的全基因组筛选(图2)。gydF4y2Ba1gydF4y2Ba).在上述每种条件下,我们通过流式细胞术进行细胞分选,鉴定了促进T细胞增殖的基因靶点,从而在重新刺激细胞后,在分裂细胞(低羧基荧光素琥珀酰亚酯(CFSE)染色)中富集的sgrna,而非分裂细胞(高CFSE染色)中富集的sgrna。正如预期的那样,在屏幕条件下,与非分裂细胞相比,高度分裂的细胞中靶向必需基因的向导减少了,并且基因命中与人类T细胞的高表达相关gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba(扩展数据图。gydF4y2Ba1 a, bgydF4y2Ba).在所有筛选之间共享的高分裂细胞与非分裂细胞中富集的基因命中分析集中在两个候选抗性靶基因上:gydF4y2BaTMEM222gydF4y2Ba而且gydF4y2BaRASA2gydF4y2Ba(无花果。gydF4y2Ba1 bgydF4y2Ba扩展数据图gydF4y2Ba1 cgydF4y2Ba及补充表gydF4y2Ba1克ydF4y2Ba).屏幕命中的交叉比较突出了使用类似抑制线索(例如,他克莫司和环孢素)执行的屏幕之间的共享命中的程度(扩展数据图)。gydF4y2Ba1 dgydF4y2Ba).对高分裂细胞中sgrna的对比分析为每种抑制条件指定了选择性命中,以及为额外验证提供了更一般的抗性概况(补充表)gydF4y2Ba2 gydF4y2Ba).基因命中的一个子集对单个屏幕更具体,例如,gydF4y2Ba图gydF4y2Ba而且gydF4y2BaTGFBR1gydF4y2Ba分别在腺苷和TGFβ条件下得分较高(扩展数据图。gydF4y2Ba1 egydF4y2Ba).通过crispr介导的敲除对所选基因的阵列验证证实了这些无偏筛的潜力,可以发现T细胞抵抗tme相关抑制线索的新调节因子(扩展数据图)。gydF4y2Ba1 egydF4y2Ba及补充表gydF4y2Ba3 gydF4y2Ba).例如,定位gydF4y2BaPDE4CgydF4y2Ba或gydF4y2BaNKX2-6gydF4y2Ba使T细胞抵抗腺苷抑制,然而gydF4y2BaNFKB2gydF4y2BaKO对钙调神经磷酸酶抑制剂他克莫司和环孢素产生耐药性。值得注意的是,我们观察到TGFβ和腺苷耐药之间的相互作用,支持先前描述的这些免疫抑制信号之间的相互作用gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba.我们验证了其他基因靶点,在抑制条件下赋予抗性,例如gydF4y2BaPFN1gydF4y2Ba,gydF4y2BaFAM49BgydF4y2Ba(亦称gydF4y2BaCYRIBgydF4y2Ba),gydF4y2BaCBLBgydF4y2Ba而且gydF4y2BaRASA2gydF4y2Ba.虽然公布的数据支持的作用gydF4y2BaCBLBgydF4y2Ba,gydF4y2BaFAM49BgydF4y2Ba而且gydF4y2BaPFN1gydF4y2Ba调节T细胞功能,据我们所知,gydF4y2BaRASA2gydF4y2Ba以前没有被定义为免疫细胞的调节器gydF4y2Ba8gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba23gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba,人类T细胞耐药基因靶点的全基因组筛选示意图。gydF4y2BabgydF4y2Ba,最高共享基因命中数(gydF4y2BazgydF4y2Ba-评分>1.5)在5个(蓝色)和全部6个(粉红色)的屏幕之间标记。柱状高度是屏幕之间共享基因的数量,由下方面板中的点连接(gydF4y2BangydF4y2Ba= 4人供刺激(stim)和TgydF4y2Ba注册gydF4y2Ba手机屏幕,gydF4y2BangydF4y2Ba腺苷、环孢素、他克莫司= 2gydF4y2BangydF4y2BaTGFβ筛查= 1)。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba、日志gydF4y2Ba2 gydF4y2Ba单个引导rna的折叠变化(FC)(垂直线);背景以灰度显示总体导览分布。gydF4y2BacgydF4y2Ba,指南定位gydF4y2BaRASA2gydF4y2Ba(粉色)在所有抑制条件下。gydF4y2BadgydF4y2Ba针对RasGAP家族成员(除RASA2外)的导子在两个方向上都没有持续富集,而针对RasGEF RASGRP1的导子则如预期的那样从细胞分裂中耗尽。gydF4y2BaegydF4y2Ba, RASA2-KO中CFSE染色与对照的分布(Ctrl;非靶向引导RNA) T细胞在所有抑制条件下。gydF4y2BafgydF4y2Ba,抑制条件下体外癌细胞杀伤试验中癌细胞的生长。AUC,生长曲线下的面积。gydF4y2BangydF4y2Ba= 2个供体一式三份,形状为供体。gydF4y2BaggydF4y2Ba抑制试验证实gydF4y2BaRASA2gydF4y2Ba消融后的T细胞对T细胞有抗性gydF4y2Ba注册gydF4y2Ba细胞体外增殖抑制。条形图显示CD8gydF4y2Ba+gydF4y2Ba刺激后4天细胞计数(gydF4y2BangydF4y2Ba=每组4人;均数±s.e.m.;**gydF4y2BaPgydF4y2Ba< 0.01和***gydF4y2BaPgydF4y2Ba< 0.001,双面配对学生的gydF4y2BatgydF4y2Ba以及)。gydF4y2BahgydF4y2Ba,gydF4y2BaRASA2gydF4y2Ba消融后的T细胞对T细胞有抗性gydF4y2Ba注册gydF4y2Ba在体外癌细胞杀伤试验中,四分之一代表性供体的细胞抑制与对照T细胞相比(扩展数据图中显示的汇总统计数据)。gydF4y2Ba2 ggydF4y2Ba).直线为平均值,阴影区域为3次技术重复的95%置信区间。gydF4y2Ba
我们之前发现gydF4y2BaRASA2gydF4y2Ba作为一种基因靶点,当它被敲除时,可以促进T细胞增殖和体外癌细胞杀伤能力gydF4y2Ba13gydF4y2Ba.观察到gydF4y2BaRASA2gydF4y2Ba在多种免疫抑制环境下,消融术也能促进T细胞的增殖能力,我们随后的工作重点是描述其影响gydF4y2BaRASA2gydF4y2Ba过继细胞治疗临床前模型中的消融。RASA2是一种通过加速活性RAS- gtp水解为RAS- gdp来抑制RAS信号输出的RasGAPgydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba.在这些屏幕中,gydF4y2BaRASA2gydF4y2Ba在抑制T细胞增殖方面,RasGAP家族是独一无二的gydF4y2BaRASA2gydF4y2Ba-靶向指南在多个供体中富集于分裂的T细胞中(图。gydF4y2Ba1 c, dgydF4y2Ba和扩展数据图。gydF4y2Ba1克gydF4y2Ba).相比之下,以编码RAS鸟嘌呤核苷酸交换因子(RasGEF)的基因为靶标的导则gydF4y2BaRASGRP1gydF4y2Ba在T细胞分裂过程中被消耗殆尽,证实了其作为TCR和RAS信号通路的积极调节因子的已知作用gydF4y2Ba26gydF4y2Ba(无花果。gydF4y2Ba1 dgydF4y2Ba).跨组织整体基因表达模式分析gydF4y2Ba27gydF4y2Ba显示,gydF4y2BaRASA2gydF4y2Ba在CD8中选择性表达gydF4y2Ba+gydF4y2Ba和CD4gydF4y2Ba+gydF4y2Ba人类T细胞,这种模式不同于其他RasGAP家族成员,但与观察到的T细胞非常相似gydF4y2BaRASGRP1gydF4y2Ba26gydF4y2Ba(扩展数据图。gydF4y2Ba1 hgydF4y2Ba).有针对性的gydF4y2BaRASA2gydF4y2Ba在另外两个供体中,使用单独的CRISPR引导进行消融,在所有四种可溶性因子抑制条件下,都再现了在筛选中观察到的增殖优势(图。gydF4y2Ba1 egydF4y2Ba和扩展数据图。gydF4y2Ba2模拟gydF4y2Ba).gydF4y2Ba
我们进一步测试了gydF4y2BaRASA2gydF4y2Ba在这些免疫抑制条件下,缺乏T细胞对癌细胞的体外杀伤增加。gydF4y2BaRASA2gydF4y2Ba在这一系列的抑制条件下,与对照编辑的T细胞相比,消融促进了TCR T细胞对癌细胞的杀伤(图。gydF4y2Ba1 fgydF4y2Ba和扩展数据图。gydF4y2Ba2 egydF4y2Ba).与TgydF4y2Ba注册gydF4y2BaRASA2失活使效应T细胞对T细胞产生抗性gydF4y2Ba注册gydF4y2Ba细胞介导的增殖抑制(图;gydF4y2Ba1克gydF4y2Ba和扩展数据图。gydF4y2Ba2 fgydF4y2Ba).这种对抑制的抵抗在T存在下进行的癌细胞杀伤实验中也很明显gydF4y2Ba注册gydF4y2Ba细胞(图。gydF4y2Ba1 hgydF4y2Ba和扩展数据图。gydF4y2Ba2 g hgydF4y2Ba).缺乏rasa2的效应T细胞保持了其强大的细胞毒功能,而对照T细胞在抑制T存在时无法控制肿瘤细胞的生长gydF4y2Ba注册gydF4y2Ba细胞。这些发现支持了这样的观点,即RASA2通常是T细胞增殖和细胞毒功能的负调控因子gydF4y2BaRASA2gydF4y2Ba消融术对多种抑制过继T细胞抗肿瘤活性的机制具有抗性。gydF4y2Ba
RASA2调控tcr依赖的RAS信号gydF4y2Ba
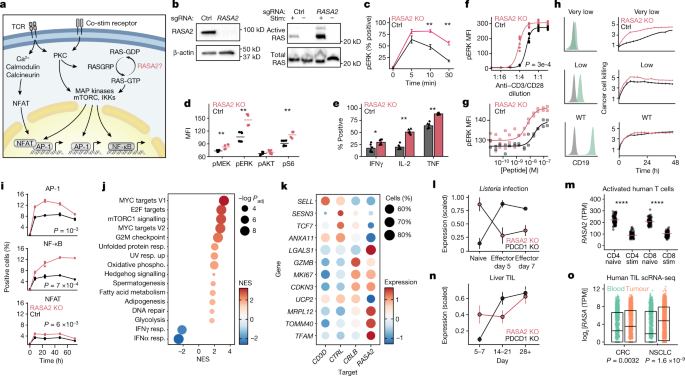
接下来,我们试图定义失活RASA2对人类T细胞中RAS-GTP水平和下游信号事件的影响。RASA2被预测会减弱RAS信号,RAS信号是T细胞中控制细胞激活、增殖和分化的多种途径的主要交集gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Ba).Jurkat T细胞白血病细胞系和原代人T细胞表达正常的RAS蛋白,正如预期的那样,在缺乏致癌基因的细胞中表达RAS蛋白gydF4y2Ba拉gydF4y2Ba突变gydF4y2Ba30.gydF4y2Ba在两种细胞类型中,基础RAS-GTP水平均较低,但在TCR刺激下升高(图2)。gydF4y2Ba2 bgydF4y2Ba和扩展数据图。gydF4y2Ba3gydF4y2Ba).我们发现敲除RASA2会导致更高的RAS- gtp水平响应TCR刺激,这与其作为RAS的gtp酶激活蛋白的已知功能一致。这些生化数据与我们的CRISPR筛选结果一致,这些结果支持RASA2在调节T细胞中RAS输出的非冗余作用,而其他gtpase激活蛋白无法挽救。MEK和ERK是RAS-GTP在MAPK信号通路中的关键下游效应子gydF4y2Ba29gydF4y2Ba.与TCR激活后RAS-GTP水平升高一致,我们观察到与相应对照相比,RASA2-KO原代T细胞中MEK和ERK磷酸化水平更高。尽管RASA2-KO T细胞与对照细胞遵循相似的MAPK信号传导总体动力学,但它们达到了磷酸化(p)ERK和pMEK水平的更高峰值(图2)。gydF4y2Ba2摄氏度gydF4y2Ba和扩展数据图。gydF4y2Ba3 b, cgydF4y2Ba).RASA2-KO T细胞也有更高水平的刺激诱导的S6磷酸化,这是MAPK信号级联的下游中介。gydF4y2Ba二维gydF4y2Ba和扩展数据图。gydF4y2Ba3 d, egydF4y2Ba).总之,这些数据支持RASA2作为调节MAPK信号通路对TCR刺激反应的RasGAP的作用。gydF4y2Ba
一个gydF4y2Ba在T细胞中,RAS信号通路和下游转录程序。图片改编自参考文献。gydF4y2Ba29gydF4y2Ba.IKK, NF-κB激酶抑制剂。gydF4y2BabgydF4y2BaWestern blot显示,TCR刺激后Jurkat细胞中RASA2蛋白表达,gtp结合活性RAS蛋白表达。gydF4y2BacgydF4y2Ba,基于流式细胞术的磷酸化erk动力学分析。gydF4y2BadgydF4y2BaMAPK和AKT-mTOR通路中的标度磷蛋白平均荧光强度(MFI)。gydF4y2BaegydF4y2Ba,受刺激T细胞的效应细胞因子水平。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba, anti-CD3/CD28刺激TCR后10 min的pERK水平(gydF4y2BafgydF4y2Ba)或T2细胞预载同源肽(gydF4y2BaggydF4y2Ba).gydF4y2BahgydF4y2Ba(左)工程Nalm6癌靶细胞(绿色)与未染色细胞(灰色)的CD19表达。右,CAR - T细胞杀伤表达不同CD19水平的Nalm6细胞,通过膜联蛋白染色测量。数据为均数±标准差。两份代表捐赠者的技术副本中的一份。WT,野生型。gydF4y2Ba我gydF4y2Ba转录因子应答mCherry报告者Jurkat细胞阳性百分比。gydF4y2BajgydF4y2BaTCR刺激后RASA2-KO与对照细胞差异表达基因的GSEA。网点大小表示已调整gydF4y2BaPgydF4y2Ba值(gydF4y2BaPgydF4y2Ba邻接的gydF4y2Ba;双面排列测验)。NES,归一化富集分数;磷,磷酸化;分别地。,response.kgydF4y2Ba,受刺激的RASA2-KO T细胞中差异表达基因与指示靶基因扰动gydF4y2Ba13gydF4y2Ba.颜色表示平均表达水平,大小表示可检测到表达的细胞百分比(gydF4y2BangydF4y2Ba= 2名捐赠者)。gydF4y2BalgydF4y2Ba- - - - - -gydF4y2BaogydF4y2Ba, RASA2在小鼠模型中的表达gydF4y2Ba李斯特菌gydF4y2Ba感染gydF4y2Ba38gydF4y2Ba(gydF4y2BalgydF4y2Ba;gydF4y2BangydF4y2Ba= 3只小鼠;均数±s.e.m),体外激活人T细胞gydF4y2Ba20.gydF4y2Ba(gydF4y2Ba米gydF4y2Ba;gydF4y2BangydF4y2Ba= 91名捐赠者;双侧Wilcoxon检验),一种肿瘤浸润T细胞小鼠模型gydF4y2Ba38gydF4y2Ba(直到)(gydF4y2BangydF4y2Ba,显示T细胞转移后的天数;gydF4y2BangydF4y2Ba= 3只小鼠;均数±s.e.m)和人肿瘤浸润T细胞(橙色)或外周T细胞(绿色)(gydF4y2BaogydF4y2Ba).gydF4y2BaogydF4y2Ba,方框限为四分位数,水平线为中位数(gydF4y2BangydF4y2Ba= 12名结直肠癌捐赠者gydF4y2Ba40gydF4y2Ba(CRC)和gydF4y2BangydF4y2Ba= 14名非小细胞肺癌捐赠者gydF4y2Ba41gydF4y2Ba(NSCLC);双面Wilcoxon检验)。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba,线表示平均数;gydF4y2BangydF4y2Ba= 2人一式三份;双面Wilcoxon检验。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BangydF4y2Ba= 2人一式三份;拟合4参数剂量-响应曲线;双样本Kolmogorov-Smirnov检验。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ****gydF4y2BaPgydF4y2Ba< 0.0001。gydF4y2Ba
我们也确认了gydF4y2BaRASA2gydF4y2Ba消融术不会导致不受控制的T细胞增殖,这可能会降低其作为T细胞治疗中基因编辑靶点的效用。在没有TCR刺激的情况下,对照和RASA2-KO T细胞的活力都稳步下降,而白细胞介素-2 (IL-2)的停用加剧了这种下降(扩展数据图)。gydF4y2Ba3 fgydF4y2Ba).我们发现RASA2-KO T细胞仍然依赖于TCR刺激MAPK信号(由pERK指示)、增殖(由CFSE染色指示)和激活(由CD69表达指示),除了CD69表达变化外,基线水平没有一致的变化gydF4y2Ba13gydF4y2Ba(扩展数据图。gydF4y2Ba3 ggydF4y2Ba).此外,与对照T细胞相比,我们检测到在TCR刺激下,rasa2缺陷T细胞中多种效应细胞因子水平更高,而在未受刺激的细胞中没有发现差异(图2)。gydF4y2Ba2 egydF4y2Ba和扩展数据图。gydF4y2Ba4gydF4y2Ba).总之,这些结果表明,在TCR刺激的T细胞中,gydF4y2BaRASA2gydF4y2Ba消融促进了关键信号通路的级联,以促进更有效的效应功能。值得注意的是,gydF4y2BaRASA2gydF4y2Ba在没有TCR刺激的情况下,消融不会导致细胞因子依赖的丧失或不受控制的增殖。gydF4y2Ba
RASA2gydF4y2Ba消融术使T细胞对抗原敏感gydF4y2Ba
我们接下来测试是否烧蚀gydF4y2BaRASA2gydF4y2Ba在体外扩增对低水平目标同源抗原的敏感性。在大范围抗cd3和抗CD28(抗cd3 /CD28)浓度下,与对照T细胞相比,RASA2-KO T细胞具有更高水平的ERK磷酸化、激活和增殖(图2)。gydF4y2Ba2 fgydF4y2Ba和扩展数据图。gydF4y2Ba4 bgydF4y2Ba).为了用更生理的刺激来测量这种抗原敏感性,将NY-ESO-1抗原特异性T细胞与预先加载了越来越高浓度同源NY-ESO-1肽的T2细胞联合培养。该实验证实,RASA2 KO在一系列肽浓度范围内导致更高水平的pERK,有效地使T细胞对抗原敏感(图2)。gydF4y2Ba2 ggydF4y2Ba).抗原敏感性的提高对于能够检测和杀死低靶抗原表达的癌细胞的T细胞工程尤为重要gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba.为了测试这一点,我们设计了T细胞来表达一种靶向CD19表面蛋白的CAR,并编辑它们来破坏其中任何一种gydF4y2BaRASA2gydF4y2Ba或控制位点(扩展数据图。gydF4y2Ba4 c, dgydF4y2Ba而且gydF4y2Ba方法gydF4y2Ba).我们使用基于cd28的CD19 CAR,被报道是一种高度敏感的CAR,来测试是否丢失gydF4y2BaRASA2gydF4y2Ba表达可能进一步提高对低抗原靶点的敏感性gydF4y2BaRASA2gydF4y2Ba消融gydF4y2Ba33gydF4y2Ba.这些CAR - T细胞与经过工程改造表达一系列CD19水平的癌细胞共同培养,并通过膜联蛋白染色检测癌细胞的杀伤。尽管RASA2- ko和对照CAR - T细胞都能有效地杀死表达高CD19水平的白血病细胞,但与低抗原表达的对照T细胞相比,RASA2失活增强了白血病靶细胞的体外杀伤(图2)。gydF4y2Ba2 hgydF4y2Ba和扩展数据图。gydF4y2Ba4 e, fgydF4y2Ba).总的来说,这些数据表明缺乏RASA2的T细胞即使对低水平的抗原也敏感,这可以增强它们检测和杀死抗原暗淡的癌细胞的能力。gydF4y2Ba
RASA2 KO促进T细胞重编程gydF4y2Ba
接下来,我们分析了RASA2-KO细胞的下游转录网络。首先,为了评估T细胞激活的关键转录程序,我们使用了一套Jurkat T细胞转录报告系统。利用激活蛋白1 (AP-1)、活化T细胞核因子(NFAT)和核因子κ B (NFкB)的响应元件设计了这些报告系,这些响应元件驱动mCherry荧光报告的表达。这些研究表明gydF4y2BaRASA2gydF4y2Ba消融显著增加TCR刺激诱导的AP-1和NFкB的转录活性,并在较小程度上增加NFAT,这与RAS和MAPK信号通路的下游转录效应一致(图2)。gydF4y2Ba2我gydF4y2Ba和扩展数据图。gydF4y2Ba5gydF4y2Ba).为了系统地分析原代RASA2-KO T细胞的转录变化,我们在与靶癌细胞共培养48小时后,对RASA2-KO细胞或对照编辑的抗原特异性T细胞进行了全转录组rna测序(RNA-seq)分析。在RASA2-KO T细胞中上调最多的两个基因是gydF4y2BaDUSP6 shpgydF4y2Ba而且gydF4y2BaSPRED2gydF4y2Ba,它们会减弱RAS信号,并可能作为一种反馈机制,对RAS信号的增加做出反应gydF4y2Ba34gydF4y2Ba(扩展数据图。gydF4y2Ba5 bgydF4y2Ba).基因集富集分析(GSEA)强调了在RASA2-KO T细胞中上调的多个关键通路,包括与细胞周期、转录活性和细胞代谢相关的通路(图2)。gydF4y2Ba2 jgydF4y2Ba).值得注意的是,考虑到代谢状态对T细胞功能的重要性,缺乏rasa2的T细胞表现出与氧化磷酸化和糖酵解相关的基因表达增加(扩展数据图。gydF4y2Ba5 c, dgydF4y2Ba).为了测试这些代谢变化是否普遍存在于超激活的T细胞中,我们分析了先前在crispr扰动的原代人类T细胞中生成的单细胞RNA-seq (scRNA-seq)数据集gydF4y2Ba13gydF4y2Ba.我们比较了RASA2-KO T细胞中差异表达的基因与缺失的T细胞中差异表达的基因gydF4y2BaCBLBgydF4y2Ba,编码一种典型的TCR信号负调控因子。而RASA2或CBLB的失活则增加了gydF4y2BaGZMBgydF4y2Ba,gydF4y2BaMKI67gydF4y2Ba而且gydF4y2BaCDKN3gydF4y2Ba和降低的表达gydF4y2Ba出售gydF4y2Ba而且gydF4y2BaTCF7gydF4y2Ba(无花果。gydF4y2Ba2 kgydF4y2Ba),我们的分析显示gydF4y2BaRASA2gydF4y2Ba还诱发了一种独特的基因特征。这一特征包括参与线粒体活动的核心基因的差异表达,如gydF4y2BaMrpl12, tomm40, tfamgydF4y2Ba而且gydF4y2BaUCP2gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba.RASA2的代谢调控被强调为驱动氧化磷酸化的基因之间的强负相关gydF4y2BaRASA2gydF4y2Ba来自免疫细胞的数千个转录数据集的表达(扩展数据图。gydF4y2Ba5 e, fgydF4y2Ba而且gydF4y2Ba方法gydF4y2Ba).总的来说,我们对RASA2 KO T细胞转录状态的分析显示了一种增强的效应记忆状态(即减少gydF4y2BaTCF7gydF4y2Ba而且gydF4y2Ba出售gydF4y2Ba与更高的氧化磷酸化状态相结合,这通常与中央记忆T细胞有关gydF4y2Ba37gydF4y2Ba.gydF4y2Ba
据我们所知,rasa2在T细胞生物学中没有被描述的作用,我们接下来评估了它在T细胞中的内源性转录调节。分析我们之前发表的scRNA-seq数据集gydF4y2Ba13gydF4y2Ba透露,gydF4y2BaRASA2gydF4y2Ba在人T细胞刺激后下调(扩展数据图。gydF4y2Ba5克gydF4y2Ba).对两个已发表的小鼠急性细菌感染RNA-seq数据集的进一步分析gydF4y2Ba38gydF4y2Ba以及一大批体外激活的人类T细胞gydF4y2Ba20.gydF4y2Ba证实T细胞刺激会急剧下调gydF4y2BaRASA2gydF4y2Ba表达水平(图;gydF4y2Ba2 l, mgydF4y2Ba).刺激后RASA2的急性内源性减少可能给T细胞一个增强效应功能的窗口,以及基因消融gydF4y2BaRASA2gydF4y2Ba可能会通过完全和持久的RASA2缺失来放大这一现象。此外,通过分析外部数据集,我们测试了RASA2是否可能在T细胞功能障碍中发挥作用。与检查点在调节T细胞功能中的作用一致,gydF4y2BaRASA2gydF4y2Ba暴露于慢性感染的小鼠T细胞上调了多少gydF4y2Ba39gydF4y2Ba或者重复抗原刺激gydF4y2Ba12gydF4y2Ba以及肿瘤浸润T细胞gydF4y2Ba38gydF4y2Ba(无花果。gydF4y2Ba2 ngydF4y2Ba和扩展数据图。gydF4y2Ba5 h,我gydF4y2Ba).已发表的人类患者scRNA-seq数据集gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba也显示出更高的gydF4y2BaRASA2gydF4y2Ba与外周T细胞相比,肿瘤浸润T细胞的水平下降,提示RASA2在TME中抑制T细胞反应的潜在作用(图2)。gydF4y2Ba2 ogydF4y2Ba).对已发表的全基因组CRISPR抑制和CRISPR激活T细胞产生细胞因子的数据集的分析进一步支持了这种负调控因子的作用gydF4y2Ba42gydF4y2Ba,这表明压抑的gydF4y2BaRASA2gydF4y2Ba倾向于增加效应细胞因子的产生,并且gydF4y2BaRASA2gydF4y2Ba激活倾向于减少这些细胞因子的产生(扩展数据图。gydF4y2Ba5 jgydF4y2Ba).最后,我们发现转基因过表达RASA2在人T细胞中抑制T细胞活化和体外扩增(扩展数据图)。gydF4y2Ba5 k - ngydF4y2Ba).总之,这些观察结果表明,在急性刺激期间下调的RASA2可以在慢性刺激的T细胞中上调,作为内在信号检查点抑制T细胞功能。gydF4y2Ba
RASA2 KO增加癌细胞杀伤能力gydF4y2Ba
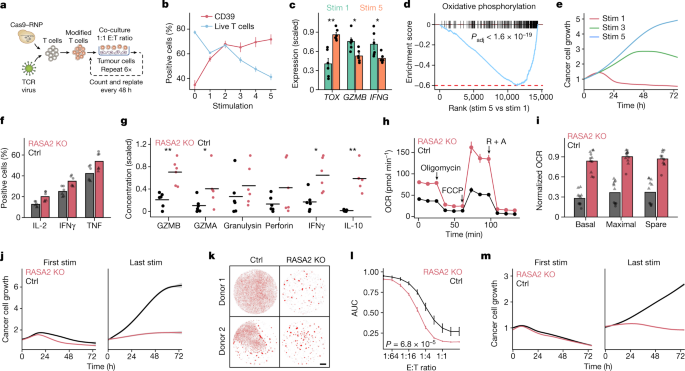
我们接下来测试是否消融gydF4y2BaRASA2gydF4y2Ba我们发现在肿瘤浸润T细胞中上调,可以改善慢性抗原暴露诱导的T细胞功能障碍。我们建立了一种重复刺激实验,其中抗原特异性T细胞与新鲜靶细胞以1:1效应靶(E:T)的比例共培养,每48小时重复一次(图2)。gydF4y2Ba3gydF4y2Ba而且gydF4y2Ba方法gydF4y2Ba).这种重复刺激实验显示抗原特异性T细胞相对富集,T细胞活力和激活水平下降,代谢谱改变,关键细胞表型标志物进行性变化,总体上与功能失调的T细胞状态一致gydF4y2Ba43gydF4y2Ba(无花果。gydF4y2Ba3罪犯gydF4y2Ba和扩展数据图。gydF4y2Ba6 a、bgydF4y2Ba).在功能水平上,T细胞在反复暴露后逐渐失去了控制癌细胞扩张的能力(图。gydF4y2Ba3 egydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,体外T细胞持久性建模实验示意图。RNP,核糖核蛋白。gydF4y2BabgydF4y2Ba,每次刺激后用流式细胞术检测T细胞活力和CD39水平(gydF4y2BangydF4y2Ba= 4位捐赠者;平均值±s.e.m.)。gydF4y2BacgydF4y2Ba,第一次和第5次刺激后关键基因在T细胞中的表达(gydF4y2BangydF4y2Ba= 3个供体,经CAR或TCR刺激;均数±s.e.m.;双面Wilcoxon检验)。gydF4y2BadgydF4y2Ba,第一次和第5次刺激后T细胞间差异表达基因的GSEA。调整gydF4y2BaPgydF4y2Ba-value的双侧排列检验。gydF4y2BaegydF4y2Ba,癌细胞与TCR T细胞在多次刺激后共培养。这条线是三倍的拟合平均值。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,重复刺激后效应细胞因子的产生,流式细胞术测定(gydF4y2BafgydF4y2Ba;gydF4y2BangydF4y2Ba= 2人一式三份;形状为供体)或多重ELISA (gydF4y2BaggydF4y2Ba;gydF4y2BangydF4y2Ba= 3位捐赠者;技术副本为点;线表示平均值;双面Wilcoxon检验)。gydF4y2BahgydF4y2Ba,肿瘤反复刺激后TCR T细胞耗氧率(OCR)变化。箭头表示添加寡霉素、FCCP和鱼藤酮+抗霉素A (R + A)(每6个技术重复1个供体;平均值±s.d)gydF4y2Ba我gydF4y2Ba、线粒体应激试验测得的耗氧率(gydF4y2BangydF4y2Ba= 6个技术重复2个供体;形状表示供体;每个供体的最大值为1)。gydF4y2BajgydF4y2Ba,刺激1次和5次后癌细胞死亡。阴影部分表示三次重复的95%置信区间。gydF4y2BakgydF4y2Ba, RFP成像gydF4y2Ba+gydF4y2BaA375细胞与暴露于重复刺激下的T细胞共培养。比例尺,1毫米。gydF4y2BalgydF4y2Ba,在效应T细胞范围内癌细胞生长曲线下面积的汇总统计:靶细胞比率(gydF4y2BangydF4y2Ba= 7位捐赠者;均数±s.e.m.;双样本Kolmogorov-Smirnov检验)。gydF4y2Ba米gydF4y2Ba在6次刺激后,RASA2-KO CD19 CAR - T细胞仍保持高效杀伤。数据仅代表三个捐助国之一。阴影部分表示三次重复的95%置信区间。统计检验表明,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01。gydF4y2Ba
RNA-seq分析gydF4y2BaRASA2gydF4y2Ba重复刺激T细胞的表达表明,尽管gydF4y2BaRASA2gydF4y2Ba急性刺激后水平下降,重复暴露肿瘤后水平升高(扩展数据图)。gydF4y2Ba6 bgydF4y2Ba).这些发现进一步表明,在慢性刺激的环境下,RASA2可以作为一个检查点来抑制T细胞的反应。我们在重复刺激实验的功能水平上进行了测试,发现gydF4y2BaRASA2gydF4y2Ba消融通常限制了许多功能障碍的表型。例如,gydF4y2BaRASA2gydF4y2Ba消融限制了反复暴露肿瘤时观察到的T细胞活力下降(扩展数据图)。gydF4y2Ba6摄氏度gydF4y2Ba).我们还观察到,在重复刺激后,RASA2-KO T细胞与对照编辑的T细胞相比,表现出更高水平的磷酸化mapk信号、激活和多种效应细胞因子(图2)。gydF4y2Ba3 fgydF4y2Ba和扩展数据图。gydF4y2Ba6 dgydF4y2Ba).rasa2缺陷T细胞的增强效应状态是通过ELISA检测被刺激T细胞上清液中的免疫调节细胞因子和细胞溶解分子独立证实的(图2)。gydF4y2Ba3 ggydF4y2Ba).RASA2gydF4y2Ba-gydF4y2BaKO T细胞被发现处于比对照细胞更有效的记忆分化状态(扩展数据图)。gydF4y2Ba6小时gydF4y2Ba).典型T细胞衰竭基因相似gydF4y2BaRASA2gydF4y2Ba和对照编辑的T细胞经过多次刺激后,表明RASA2-KO T细胞在体外没有差异耗尽(扩展数据图。gydF4y2Ba6我gydF4y2Ba).RNA-seq分析显示,RASA2-KO T细胞表达较高水平的与细胞周期相关的基因(gydF4y2BaVRK1gydF4y2Ba,gydF4y2BaAURKAgydF4y2Ba而且gydF4y2BaKNL1gydF4y2Ba)、脂肪酸代谢(gydF4y2BaSLC27A2gydF4y2Ba)和线粒体在重复刺激后与对照编辑的T细胞进行比较(扩展数据图。gydF4y2Ba7一个gydF4y2Ba).鉴于代谢适应度在抵抗T细胞功能障碍方面的重要性,我们在这个重复刺激实验中评估了对照和RASA2-KO T细胞在功能水平上的代谢特征gydF4y2Ba44gydF4y2Ba.基于流式细胞术的检测证实,缺乏RASA2的CAR - T和TCR - T细胞的线粒体质量和活性高于对照细胞(扩展数据图)。gydF4y2Ba7 bgydF4y2Ba).海马实时细胞代谢分析显示gydF4y2BaRASA2gydF4y2Ba与重复刺激后对照编辑的T细胞相比,消融导致基础和最大耗氧率以及细胞外酸化率增加(图2)。gydF4y2Ba3 h,我gydF4y2Ba和扩展数据图。gydF4y2Ba7汉英gydF4y2Ba).而对照T细胞在慢性刺激后不能使用替代能源,RASA2-KO T细胞尽管反复暴露抗原仍保持这种能力(扩展数据图)。gydF4y2Ba7 fgydF4y2Ba).总之,通过一系列不同的表型指标,RASA2消融术限制了慢性癌症抗原暴露引起的功能障碍。gydF4y2Ba
接下来,我们测试了其对癌细胞的杀伤能力gydF4y2BaRASA2gydF4y2Ba-消融的T细胞被反复暴露于肿瘤抗原所影响。尽管T细胞gydF4y2BaRASA2gydF4y2Ba在第一次刺激时,消融在我们的癌细胞杀伤试验中具有中等优势,这种优势在多次刺激后变得更加明显(图。gydF4y2Ba3 j, kgydF4y2Ba).对照编辑的T细胞在每次刺激后控制癌细胞生长的能力都会逐渐下降,gydF4y2BaRASA2gydF4y2Ba-烧蚀的T细胞在多次刺激后仍保持其强大的杀伤能力(扩展数据图。gydF4y2Ba8gydF4y2Ba).这种杀死癌细胞的优势在多个人类献血者和效应T细胞与癌细胞的比率中通常是一致的(图。gydF4y2Ba3 lgydF4y2Ba).我们接下来测试了这种对T细胞功能障碍的抵抗是否gydF4y2BaRASA2gydF4y2Ba在TRAC CAR - T细胞中重复了损失。gydF4y2BaRASA2gydF4y2Ba经编辑的TRAC cd19特异性CAR - T细胞与表达cd19的癌细胞反复共培养(扩展数据图)。gydF4y2Ba8 bgydF4y2Ba).从TCR T细胞模型中可以看出,gydF4y2BaRASA2gydF4y2Ba在重复暴露癌细胞后,经过基因编辑的CAR - T细胞继续有效地杀死靶细胞,而经过对照编辑的CAR - T细胞无法控制肿瘤细胞的生长(图2)。gydF4y2Ba3米gydF4y2Ba).使用两种不同的CD19是一致的gydF4y2Ba+gydF4y2Ba癌细胞系和多个人类献血者(扩展数据图。gydF4y2Ba8汉英gydF4y2Ba).重复刺激后的这种杀伤优势是特异性的,当RASA2-KO或对照TRAC CAR - T细胞与抗原阴性癌细胞共培养时,缺乏癌细胞杀伤就证明了这一点(扩展数据图)。gydF4y2Ba8 f, ggydF4y2Ba).总的来说,这些结果表明,T细胞反复暴露于其靶抗原逐渐失去控制癌细胞生长的能力gydF4y2BaRASA2gydF4y2Ba可以使TCR T和CAR - T细胞对这种功能失调状态产生抗性。gydF4y2Ba
RASA2 KO增强T细胞抗肿瘤反应gydF4y2Ba
为了确定这些发现的翻译相关性,我们继续测试在多个过继T细胞治疗的临床前模型中,消融RASA2是否会改善工程T细胞的性能。首先,我们将表达NY-ESO-1的A375黑素瘤细胞移植到免疫缺陷NSG小鼠的侧翼(图。gydF4y2Ba4gydF4y2Ba).T细胞被改造表达1G4 ny - eso -1特异性TCRgydF4y2Ba45gydF4y2Ba并被编辑到消融gydF4y2BaRASA2gydF4y2Ba或安全港管制地点(gydF4y2BaAAVS1gydF4y2Ba)经尾静脉注射转移。转让gydF4y2BaRASA2gydF4y2Ba与接受对照编辑T细胞的小鼠相比,-缺陷T细胞显著减缓肿瘤生长并提高生存率(图2)。gydF4y2Ba4 bgydF4y2Ba和扩展数据图。gydF4y2Ba9 a、bgydF4y2Ba).为了测试TCR T细胞中RASA2的消融是否可以改善对含有相同NY-ESO-1抗原的液体肿瘤的控制,我们将经过工程改造的Nalm6白血病细胞在同源主要组织相容性复合体I类分子(MHCI)上表达NY-ESO-1注入小鼠尾静脉(图2)。gydF4y2Ba4摄氏度gydF4y2Ba).在这个白血病模型中,gydF4y2BaRASA2gydF4y2Ba-缺陷TCR T细胞也改善了肿瘤控制(图。gydF4y2Ba4 dgydF4y2Ba和扩展数据图。gydF4y2Ba9 c, dgydF4y2Ba).因此,gydF4y2BaRASA2gydF4y2Ba消融增强了tcr工程过继T细胞疗法在液体和固体肿瘤模型中的疗效。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba, NY-ESO-1gydF4y2Ba+gydF4y2Ba通过侧翼注射将A375黑色素瘤细胞移植到NSG小鼠体内,并通过尾静脉注射ny - eso -1特异性TCR T细胞。gydF4y2Ba一个gydF4y2Ba,实验时间轴。gydF4y2BabgydF4y2Ba,用卡尺测量肿瘤生长情况(gydF4y2BangydF4y2Ba每组= 6只;均数±s.e.m.;双面未配对的学生的gydF4y2BatgydF4y2Ba以及)。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba, NY-ESO-1gydF4y2Ba+gydF4y2BaNalm6白血病细胞注射到NSG小鼠,然后注射ny - eso -1特异性TCR T细胞。gydF4y2BacgydF4y2Ba,实验时间轴。BLI,生物发光活体成像。gydF4y2BadgydF4y2Ba,利用荧光素酶生物发光活体成像监测肿瘤生长(gydF4y2BangydF4y2Ba= 5只小鼠的RASA2-KO T细胞,gydF4y2BangydF4y2Ba对照T细胞= 4;均数±s.e.m.;双面未配对的学生的gydF4y2BatgydF4y2Ba以及)。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba, Nalm6细胞注射到NSG小鼠,然后注射cd19特异性CAR - T细胞。gydF4y2BaegydF4y2Ba,实验时间轴。gydF4y2BafgydF4y2Ba,利用生物发光成像监测肿瘤生长情况(gydF4y2BangydF4y2Ba每组7只;均数±s.e.m.;双面未配对的学生的gydF4y2BatgydF4y2Ba以及)。gydF4y2BaggydF4y2Ba的生物发光成像队列gydF4y2BafgydF4y2Ba,背部视图。gydF4y2BahgydF4y2Ba,中所示队列的生存率gydF4y2BafgydF4y2Ba.gydF4y2Ba我gydF4y2Ba,流式细胞仪检测nal6m移植NSG小鼠骨髓细胞计数(第7天:gydF4y2BangydF4y2Ba= 5为对照组,gydF4y2BangydF4y2BaRASA2 KO = 6;日16:gydF4y2BangydF4y2Ba=每组6人;均数±s.e.m.;双面Wilcoxon检验)。gydF4y2BajgydF4y2Ba,来自队列的细胞上的抑制性标记的平均荧光强度(归一化至对照)gydF4y2Ba我gydF4y2Ba(平均值±s.e.m.;双面Wilcoxon检验)。gydF4y2BakgydF4y2Ba,混合CAR - T细胞群的百分比(最初注射到小鼠,混合50:50(对照:RASA2-KO CAR - T细胞)),从骨髓中分离,输注到携带nalm6的小鼠后第7天和第16天(gydF4y2BangydF4y2Ba每组= 6只;双面Wilcoxon检验)。gydF4y2BalgydF4y2Ba- - - - - -gydF4y2BaogydF4y2Ba, NSG小鼠在第0天腹腔注射LM7-ffLuc肿瘤细胞,然后腹腔注射对照或RASA2-KO EphA2-CAR - t细胞。gydF4y2BalgydF4y2Ba,实验时间轴。gydF4y2Ba米gydF4y2Ba,定量生物发光成像(mean±s.e.m.;gydF4y2BangydF4y2Ba= 10为对照组,gydF4y2BangydF4y2BaRASA2 KO = 14;双面配对学生的gydF4y2BatgydF4y2Ba以及)。gydF4y2BangydF4y2Ba,各组代表生物发光。gydF4y2BaogydF4y2Ba中队列的生存曲线gydF4y2Ba米gydF4y2Ba.生存gydF4y2BaPgydF4y2Ba-values by log-rank test。统计检验表明。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ****gydF4y2BaPgydF4y2Ba< 0.0001。gydF4y2Ba
为了测试体内RASA2-KO的这种优势是否适用于CAR - T细胞环境,我们通过将CD19-28z CAR敲入到细胞中来生成cd19特异性CAR - T细胞gydF4y2BaTRACgydF4y2Ba先前描述的轨迹gydF4y2Ba46gydF4y2Ba,并同时中断其中任何一种gydF4y2BaRASA2gydF4y2Ba或者gydF4y2BaAAVS1gydF4y2Ba轨迹。这些CAR - T细胞经静脉移植到移植了Nalm6白血病细胞的NSG小鼠中(图2)。gydF4y2Ba4 egydF4y2Ba和扩展数据图。gydF4y2Ba9 egydF4y2Ba).汽车在gydF4y2BaTRACgydF4y2Ba与逆转录病毒载体表达的CAR相比,基因座已被证明可以减少T细胞功能障碍并增加持久性gydF4y2Ba46gydF4y2Ba.尽管如此,我们发现gydF4y2BaRASA2gydF4y2Ba缺陷的TRAC CAR - T细胞在肿瘤控制方面比对照的TRAC CAR - T细胞有明显的优势,通过生物发光成像在用多个不同的人类献血者的细胞处理的小鼠队列中测量(图2)gydF4y2Ba4 f, ggydF4y2Ba和扩展数据图。gydF4y2Ba9 f-hgydF4y2Ba).这种减轻的肿瘤负担导致接受治疗的小鼠的生存时间显著延长gydF4y2BaRASA2gydF4y2Ba-缺陷的TRAC CAR - T细胞(图;gydF4y2Ba4 hgydF4y2Ba和扩展数据图。gydF4y2Ba9我gydF4y2Ba).尽管所有注射了对照编辑CAR - T细胞的小鼠都必须在第60天安乐死,但大多数注射了RASA2-KO人类T细胞的小鼠活过了第60天,其中一部分小鼠表现出超过100天的持久反应。gydF4y2Ba
为了更好地理解这种观察到的肿瘤控制优势,我们在CD19 CAR - T细胞治疗后的两个时间点评估了Nalm6白血病移植小鼠的骨髓。我们发现,与对照组CAR - T细胞相比,RASA2-KO CAR - T细胞处理的小鼠中CAR - T细胞数量显著增加,Nalm6细胞数量减少(图2)gydF4y2Ba4我gydF4y2Ba).在这个体内模型中,骨髓中的RASA2-KO CAR - T细胞也显示出比对照CAR - T细胞更低的典型衰竭相关抑制受体的表面表达(图2)。gydF4y2Ba4 jgydF4y2Ba).进一步对这些细胞进行表型分析,CD4水平无明显差异gydF4y2Ba+gydF4y2Ba: CD8gydF4y2Ba+gydF4y2Ba到第16天,RASA2-KO细胞的成分或分化状态略有倾斜(扩展数据图)。gydF4y2Ba9 j, kgydF4y2Ba).为了直接比较T细胞在同一骨髓生态位中的相对扩张和持久性,我们将大致相同比例的RASA2-KO和对照T细胞混合转移到携带Nalm-6的小鼠体内,发现随着时间的推移,RASA2-KO CAR - T细胞在骨髓生态位中的竞争明显优于对照CAR - T细胞(图2)。gydF4y2Ba4 kgydF4y2Ba和扩展数据图。gydF4y2Ba9 l, mgydF4y2Ba).我们在骨髓中观察到的持久性优势,以及在体外重复的癌细胞杀伤实验中观察到的持久性优势,使我们测试RASA2 KO是否在体内控制重复的白血病注射方面赋予CAR - T细胞优势。这些实验需要优化,这样当小鼠已经复发时,给定供体的CAR - T细胞剂量不会太低,也不会太高,以便所有小鼠都能强有力地控制肿瘤的再挑战。我们发现了一个T细胞供体,在先前确定的低“压力测试”CAR - T细胞剂量下,证明了对初始肿瘤负担的相对持久控制gydF4y2Ba46gydF4y2Ba,然后我们在单独的小鼠队列中重新引入Nalm6细胞3次,间隔7-11天。gydF4y2Ba10gydF4y2Ba).我们发现RASA2-KO CAR - T细胞在减少肿瘤负担和增加肿瘤再挑战模型中的存活率方面优于对照CAR - T细胞,这证明了这一点gydF4y2BaRASA2gydF4y2Ba消融可以改善体内功能持续性(扩展数据图。gydF4y2Ba10 b, cgydF4y2Ba).gydF4y2Ba
为了评估单独过继T细胞转移对小鼠健康的影响,我们向非荷瘤小鼠注射T细胞,并随着时间的推移进行监测。此外,为了评估肿瘤抗原刺激的T细胞,我们用对照和RASA2-KO CD19 TRAC CAR - T细胞治疗了另外一组患有Nalm6白血病的小鼠,以实现肿瘤清除,并在CAR - T细胞注射后观察这些小鼠116天。在这两个队列中,通过视觉检查和体重,在接受RASA2-KO和对照TRAC CAR - T细胞的小鼠中没有观察到差异,与对照TRAC CAR - T细胞相比,RASA2 KO没有改变受体动物的血细胞计数或组织病理学结果(扩展数据图)。gydF4y2Ba10 e, fgydF4y2Ba).总的来说,这些数据表明,在使用TRAC CAR - T细胞的临床前模型中,RASA2可以在CAR - T细胞中被烧蚀,以提高抗肿瘤疗效和生存率,并且没有明显增加安全风险。gydF4y2Ba
最后,考虑到开发用于实体肿瘤的CAR - T细胞疗法的主要临床挑战,我们测试了RASA2 KO是否也可以增强实体肿瘤临床前模型中的CAR - T细胞功能。我们使用了我们之前描述的腹膜内局部骨肉瘤(LM7)模型gydF4y2Ba47gydF4y2Ba表达EphA2的T细胞。CD28z汽车gydF4y2Ba48gydF4y2Ba(扩展数据图。gydF4y2Ba10克gydF4y2Ba).我们将LM7骨肉瘤细胞系注射到NSG小鼠的腹膜中,然后注射经工程改造表达epha2特异性CAR的T细胞(图2)。gydF4y2Ba4 lgydF4y2Ba).肿瘤负荷的生物发光测量显示gydF4y2BaRASA2gydF4y2Ba在该模型中,与对照CAR - T细胞相比,CAR - T细胞中的基因修饰可以显著减缓肿瘤生长并延长生存期(图2)gydF4y2Ba4 m-ogydF4y2Ba和扩展数据图。gydF4y2Ba10 h-jgydF4y2Ba).在这组小鼠中,清除肿瘤的亚组中,RASA2-KO CAR - T细胞能够在第174天清除肿瘤(扩展数据图)。gydF4y2Ba10 kgydF4y2Ba).总之,我们发现gydF4y2BaRASA2gydF4y2Ba消融可以改善TCR T和CAR - T细胞对抗一系列液体和实体肿瘤的临床前模型的性能,突出了其在多种免疫治疗适应症方面的巨大转化潜力。gydF4y2Ba
讨论gydF4y2Ba
外在和内在的抑制信号是目前过继T细胞疗法的主要挑战gydF4y2Ba14gydF4y2Ba.大规模的CRISPR基因筛选提供了一个强大的发现平台,以揭示使T细胞抵抗这些抑制信号的遗传扰动gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10克ydF4y2Ba.在这里,我们使用这样一个筛选平台来模拟各种肿瘤相关的抑制条件,并发现这些筛选集中在gydF4y2BaRASA2gydF4y2Ba作为一个有前途的候选目标,工程抗性的多种抑制信号。我们的结果表明,在没有gydF4y2BaRASA2gydF4y2Ba在抗原暴露时,T细胞经历了增加的RAS信号和激活。这种对目标抗原的放大反应可能会减轻我们所测试的抑制因素所带来的一些抑制效应。值得注意的是,这种对抗原的信号反应的增强并没有使这些细胞出现功能障碍。相反,RASA2 KO通过反复暴露癌症抗原,赋予T细胞更持久的癌症杀伤能力。这些对重复抗原相遇的增强的近端信号反应可能会导致下游转录程序的改变,从而帮助保存T细胞的功能。例如,我们注意到gydF4y2BaRASA2gydF4y2Ba消融导致AP-1和NF-κB转录程序升高,但NFAT反应差异不明显。这种模式被预测可以抵消T细胞无能和/或衰竭,这可能是由无对抗的NFAT信号导致的gydF4y2Ba16gydF4y2Ba.此外,我们观察到有利于氧化磷酸化的代谢状态的转录重编程,这在慢性抗原暴露后线粒体适应性的功能分析中得到了证实,这表明gydF4y2BaRASA2gydF4y2Ba消融可以通过改变T细胞的代谢状态来预防功能障碍。我们还发现gydF4y2BaRASA2gydF4y2Ba在多个慢性刺激模型中,水平都有所升高。尽管据我们所知,RASA2以前没有被认为在T细胞生物学中起作用,但我们在这里证明,RASA2是T细胞信号转导的关键细胞内检查点,其消融导致工程人T细胞中抗原敏感性增加和持久效应功能。gydF4y2Ba
工作亮点gydF4y2BaRASA2gydF4y2Ba作为一个有希望的基因靶点,用于工程改进的下一代T细胞。gydF4y2BaRASA2gydF4y2Ba在体外,T细胞对抗原暗淡靶细胞的反应增强,这可以通过扩大T细胞信号的动态范围,极大地扩大临床中可用的抗原受体库。进一步的临床前试验是必要的,以探索的有效性和安全性gydF4y2BaRASA2gydF4y2Ba消融在T细胞疗法中。一个担忧可能是gydF4y2BaRASA2gydF4y2Ba功能缺失突变虽然不常见,但与一些癌症有关,最突出的是黑色素瘤和多发性骨髓瘤。然而,值得注意的是gydF4y2BaRASA2gydF4y2Ba通常与其他肿瘤抑制因子(如NF-1)共同突变,表明单一突变的转化潜力降低gydF4y2Ba25gydF4y2Ba.使用基因组靶向CAR与CRISPR集成可能有助于降低额外基因的插入突变风险,这些基因可能作为肿瘤抑制因子,这可能与慢病毒或逆转录病毒CAR转导有关。值得注意的是,我们观察到这些RASA2-KO T细胞的适应性优势是刺激依赖的,这表明gydF4y2BaRASA2gydF4y2Ba损失增加抗原敏感性,但不驱动本构增殖。这种刺激依赖性可能与RASA2中的PH结构域有关,该结构域与脂质第二信使磷脂酰肌醇(3,4,5)-三磷酸结合,但不与磷脂酰肌醇(4,5)-二磷酸结合gydF4y2Ba49gydF4y2Ba.磷脂酰肌醇(3,4,5)-三磷酸仅以活性状态存在,并将RASA2招募到质膜上,这表明RASA2的GAP活性依赖于活跃的PI3K信号gydF4y2Ba24gydF4y2Ba.这种对PI3K信号的依赖表明,RASA2可能在细胞激活环境中作为RAS信号的诱导负调控因子。尽管这种刺激依赖减轻了使用的一些担忧gydF4y2BaRASA2gydF4y2Ba在治疗上,这些细胞也可以被改造成自杀开关和合成电路,以更严格地控制T细胞产物gydF4y2Ba50gydF4y2Ba.我们的数据确定RASA2是T细胞反应的强大调节因子,需要继续进行工作来测试不同TCRs和car对非预期抗原靶点的增强反应性。值得注意的是,将RASA2敲除与TRAC CAR敲入相结合,消除内源性TCR,应降低增强潜在自身反应性T细胞的风险,并提高安全性gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba.额外的tcr阳性细胞消耗策略可以进一步降低这种风险。总的来说,我们的研究结果证明了这一点gydF4y2BaRASA2gydF4y2Ba消融增加了T细胞疗法的效力和持久性,这是这些疗法在临床上失败的两个关键领域。结合对压制性线索的抵抗,这使得gydF4y2BaRASA2gydF4y2Ba消融术是产生更有效的T细胞治疗血液学和实体肿瘤适应症的有前途的新策略。gydF4y2Ba
方法gydF4y2Ba
健康供体原代T细胞的分离gydF4y2Ba
从StemCell Technologies(200-0092)购买经鉴定的健康捐赠者的白细胞标本,并持有机构审查委员会批准的同意书和协议。对于筛查,从vititalant(前身为太平洋血液中心)购买经机构审查委员会批准的同意书和协议的鉴定健康献血者的Trima单采后的白细胞减量室残留物。原代人T细胞使用EasySep人T细胞分离试剂盒(17951)根据制造商的协议使用EasySep磁铁进行分离。将细胞置于合适的培养容器中,用12.5 μl ml的Immunocult (Stem Cell Technologies, 10971)激活细胞gydF4y2Ba−1gydF4y2Ba.细胞在10℃下培养gydF4y2Ba6gydF4y2Ba细胞密度为每毫升,用50iu ml的IL-2培养gydF4y2Ba−1gydF4y2Ba(除非另有说明)。细胞在添加5%胎牛血清、50µM 2-巯基乙醇和10 mM的X-Vivo-15培养基中培养gydF4y2BaNgydF4y2Ba乙酰-gydF4y2BalgydF4y2Ba半胱氨酸。外周血单个核细胞(pmcs) 5 × 10冷冻gydF4y2Ba7gydF4y2Ba每瓶细胞使用Bambanker (Bulldog Bio)无血清细胞冷冻培养基。gydF4y2Ba
在抑制条件下合并CRISPR-KO屏幕gydF4y2Ba
如前所述,进行池化CRISPR-KO筛选gydF4y2Ba13gydF4y2Ba.简而言之,如上所述刺激分离的T细胞,24小时后用慢病毒库转导它们以表达全基因组Brunello sgRNA文库gydF4y2Ba51gydF4y2Ba.转导24 h后,用PBS清洗T细胞一次,用Cas9蛋白电穿孔,按上述方法培养扩增。第14天,T细胞用CFSE染色,并在他克莫司(TOCRIS 3631,终浓度5 nM)、环孢素(TOCRIS 1101,终浓度50 nM)、CGS-21680 (TOCRIS 1063,终浓度20µM)或TGFβ1 (Biolegend 781802,终浓度10 ng ml的存在下用Immunocult刺激gydF4y2Ba−1gydF4y2Ba).对于TgydF4y2Ba注册gydF4y2Ba细胞状况,供体CD4匹配gydF4y2Ba+gydF4y2BaCD127gydF4y2Ba低gydF4y2BaCD25gydF4y2Ba+gydF4y2BaTgydF4y2Ba注册gydF4y2Ba在第0天使用磁富集(STEMCELL 18063)分离细胞,用抗cd3 /CD28刺激,并在培养中扩增,直到与cfse染色的效应T细胞以1:1的比例混合。对于所有筛选,在重新刺激后3天,染色的T细胞被分为CFSE高群体和低群体并裂解,并准备基因组DNA,如前所述,为每个样本进行下一代测序gydF4y2Ba13gydF4y2Ba.我们用了四个人做刺激,TgydF4y2Ba注册gydF4y2Ba细胞筛查,两名供体进行腺苷、环孢素和他克莫司筛查,一名供体进行TGFβ筛查。屏幕点击被MAGeCK识别gydF4y2Ba52gydF4y2BaV0.5.9使用默认参数的配对分析。仅针对他克莫司和环孢素,收集分裂细胞,并与仅刺激筛选中匹配供体的未分裂细胞进行比较。在80%以上的样品中,读取计数低于50的导览被过滤掉了。补充表gydF4y2Ba1克ydF4y2Ba详细的指导和基因水平计数,日志折叠变化和MAGeCK评分。寻找共享命中,基因级日志gydF4y2Ba2 gydF4y2Ba折叠变化值按比例计算得到gydF4y2BazgydF4y2Ba分数。a以上基因gydF4y2BazgydF4y2Ba- 95%百分位的得分(gydF4y2BazgydF4y2Ba-score >1.54)定义为共享命中分析的命中数,生成图。gydF4y2Ba1 bgydF4y2Ba和扩展数据图。gydF4y2Ba1 cgydF4y2Ba,详见补充表gydF4y2Ba1克ydF4y2Ba.为了定义抑制条件特异性命中,使用MAGeCK软件将cfse低(高分裂)细胞中的sgRNA计数与仅刺激(stim)条件进行了比较。分析结果见补充表gydF4y2Ba2 gydF4y2Ba.通过对必需基因的退出分析来衡量筛选的质量,我们使用了由DepMap确定的必需基因gydF4y2Ba19gydF4y2Ba基因级测井采用GSEAgydF4y2Ba2 gydF4y2Ba褶皱的变化。为了分析原代人T细胞中屏幕点击的表达,使用DICE数据库,平均两种活化CD4细胞的表达gydF4y2Ba+gydF4y2Ba和CD8gydF4y2Ba+gydF4y2BaT细胞gydF4y2Ba20.gydF4y2Ba.gydF4y2Ba
CRISPR KO在原代人T细胞中使用Cas9-RNP电穿孔gydF4y2Ba
T细胞如上述分离和刺激48小时后,使用Amaxa P3 Primary Cell 96孔4D-Nucleofector Kit (Lonza, V4SP-3960)电穿孔Cas9-sgRNA-RNP。将冻干的crRNA和tracrrna (Dharmacon)在无核酸酶双相缓冲液(IDT 1072570)中以160 μM的浓度重悬。除非另有说明,对照编辑的T细胞被靶向gydF4y2BaAAVS1gydF4y2Ba序列GGGCCACTAGGGACAGGAT,和gydF4y2BaRASA2gydF4y2Ba-编辑的T细胞被靶向gydF4y2BaRASA2gydF4y2Ba-目标序列AGATATCACACATTACAGTG。在某些情况下,如图图例中所示,ctrl组表示非目标控制指南GGTTCTTGACTACCGTAATT。crrna和tRNAs在37°C下以1:1 v/v比络合30分钟。sgRNAs与Cas9 (Stock 40 μM)以1:1 v/v比例混合,37℃孵育15 min,形成RNP复合物。计数T细胞,以1 × 10重悬于P3缓冲液中gydF4y2Ba6gydF4y2Ba每20 μl,与3 μl RNPs混合,加入96孔电穿孔板。使用EH115方案电穿孔细胞,加入80 μl T细胞培养基(X-Vivo-15, Lonza),在37℃下电15 min后立即恢复。一旦恢复,细胞被转移到X-Vivo-15培养基中含有50 IU ml IL-2的适当培养容器中gydF4y2Ba−1gydF4y2Ba.gydF4y2Ba
Cell line认证和测试gydF4y2Ba
细胞系来源如下:A375 (ATCC, CRL-1619), A375-CD19(在本研究中生成),T2细胞(ATCC, CRL-1992),表达荧光素酶,GFP和不同水平CD19的Nalm6细胞(由J.E.生成),表达NY-ESO-1的Nalm6细胞(由J.E.生成),Nalm6细胞系(最初从ATCC, CRL-3273购买),LM7骨肉瘤细胞(由MD安德森癌症中心的Eugenie Kleinerman于2011年提供给G.K的实验室),Jurkat报告细胞(由加州大学旧金山分校的Kole Roybal赠送),Jurkat细胞(原购于ATCC,克隆E6-1), HEK293T细胞(Lenti- XTM 293T细胞系,Takara Bio目录编号:632180)。ATCC和Takara Bio的细胞株提供分析证书。流式细胞术常规检测各细胞系相关抗原表达。使用ATCC STR分析单元验证服务对LM7单元进行常规验证。用Nalm6、A375、LM7和293T细胞检测支原体。使用LookOut支原体PCR检测试剂盒(Sigma Aldrich,目录编号:;MP0035)或MycoAlert支原体检测试剂盒(龙沙,目录编号:; LT07- 218) at St. Jude. The following cell lines were used for short-term assays and not tested for mycoplasma: T2, Jurkat reporter lines. Our results pertain to the performance of primary human T cells. The International Cell Line Authentication Committee register was consulted and no commonly misidentified lines were used.
慢病毒的产生和TCR的T细胞转导gydF4y2Ba
将lentii - x 293T细胞系(Takara Bio 632180)细胞以每15厘米培养皿中1800 - 2000万个细胞的数量播种gydF4y2BalgydF4y2Ba在DMEM + 5% FBS + 1%青霉素-链霉素中培养。用sgRNA转移质粒和第二代慢病毒包装质粒pMD2转染细胞。G (Addgene 12259)和psPAX2 (Addgene 12260)使用Lipofectamine 3000转染试剂按照制造商的方案(L3000001)进行转染。转染6小时后,将转染培养基更换为DMEM + 5% FBS + 1%青霉素-链霉素含病毒促进剂,按制造商说明书(Alstem VB100) 500倍。收集24小时和48小时的病毒上清液,以300度旋转gydF4y2BaggydF4y2Ba4°C浸泡10分钟,以去除细胞碎片。慢病毒颗粒用Alstem沉淀液(Alstem VC100)浓缩,并在4°C保存过夜。病毒在1500度下离心gydF4y2BaggydF4y2Ba在4°C下放置30分钟,然后在冰冷的PBS中以原来体积的100倍重悬,并在- 80°C保存,直到进一步使用。T细胞转导时,TCR刺激24 h后,将浓缩慢病毒以1:25 v/v的比例直接加入到T细胞中,与X-Vivo-15培养基倾斜搅拌。gydF4y2Ba
CRISPR敲入CD19 CARgydF4y2BaTRACgydF4y2Ba使用腺相关病毒gydF4y2Ba
腺相关病毒(AAV)-ITR质粒含有cd191928z CAR和gydF4y2BaTRAC -gydF4y2Ba如前所述,针对同源定向修复的同源臂被使用gydF4y2Ba46gydF4y2Ba.含AAV-ITR的质粒经HEK293T细胞与pHelper和pAAV Rep-Cap质粒经聚乙烯亚胺转染后包装成AAV6。用碘黄醇梯度超离心进一步纯化aav。采用dnnasei (NEB)处理、蛋白酶K (Qiagen)酶切的AAV样品,用引物对左侧同源链(正向:CTTTGCTGGGCCTTTTTCCC,反向:CCTGCCACTCAAGGAAACCT)进行定量PCR测定AAV。定量PCR采用SsoFast EvaGreen Supermix (Bio-Rad 1725201)在StepOnePlus实时PCR系统(Applied Biosystems)上进行。gydF4y2Ba
T细胞如前所述被分离和激活gydF4y2Ba46gydF4y2Ba.T细胞活化48小时后,使用4D Nucleofector 96孔单元(Lonza)电穿孔RNP转染细胞。将60 pmol Cas9蛋白与120 pmol sgRNA (Synthego, TRAC guide RNA (gRNA): ACAGGGUUCUGGAUAUCUGU)在37℃孵育产生一个RNP反应。将200万个细胞电穿孔并稀释到培养基中,在37°C, 5% CO下孵育gydF4y2Ba2 gydF4y2Ba.重组AAV6供体载体在电穿孔后30 ~ 60分钟加入培养,在指定感染倍数(10gydF4y2Ba5克ydF4y2Ba),并与细胞一起孵育过夜。电穿孔后的第二天,编辑过的细胞重悬在T细胞生长培养基中,在标准培养条件下进行扩增,并保持在10的密度gydF4y2Ba6gydF4y2Ba用山羊抗小鼠Fab染色CAR,用流式细胞术评估敲入效率(Jackson ImmunoResearch, 115-606-003)。gydF4y2Ba
TCR T和CAR - T细胞体外抗癌试验gydF4y2Ba
抗原特异性T细胞与预镀的RFP共培养gydF4y2Ba+gydF4y2BaA375或GFPgydF4y2Ba+gydF4y2BaNalm6肿瘤细胞在一个96孔的平板中,从2:1的E:T比例开始,然后用对数gydF4y2Ba2 gydF4y2Ba连续稀释三份。对于目标癌细胞,使用A375 (ATCC, CRL-1619)进行TCR - T检测。对于CAR - T检测,表达cd19的RFPgydF4y2Ba+gydF4y2Ba如前所述,通过内源性CD19基因前的SFFV启动子(靶向CATGGTGGTCAGACTCTCCG)的靶向非病毒敲入产生A375黑素瘤细胞gydF4y2Ba45gydF4y2Ba.对CD19表达均匀低的细胞进行分类。不同CD19表达水平的Nalm6细胞系和表达J. Eyquem生成的NY-ESO-1抗原的Nalm6细胞系。对于膜联蛋白检测的实验,根据制造商的说明使用了膜联蛋白V染料(Essen Bioscience)红色(4641)和绿色(4642)。使用IncuCyte Zoom活细胞成像技术(Essen Bioscience)每2-3小时对平板进行一次成像,持续72-96小时。招标书gydF4y2Ba+gydF4y2Ba或“绿色荧光蛋白”gydF4y2Ba+gydF4y2Ba随着时间的推移,记录每口井的对象数量。癌细胞生长被计算为任何给定时间点的计数,由计数归一化gydF4y2BatgydF4y2Ba= 0。对于显示置信区间为灰色阴影区域的时间轨迹,通过使用R包gam v1.20拟合广义加法模型来平滑轨迹。拟合模型还用于插值轨迹,并计算给定时间间隔曲线下的面积。gydF4y2Ba
屏幕验证实验gydF4y2Ba
对于阵列筛选验证实验,从两个供体中分离T细胞,并使用RNPs编辑,RNPs中含有如上所示的靶向感兴趣基因或对照指南的gRNAs。用于该阵列验证的基因是根据刺激条件下的对数折叠变化、假发现率(FDR)、T细胞中的表达水平和相对对数选择的gydF4y2Ba2 gydF4y2Ba在不同屏幕上的折叠变化(补充表gydF4y2Ba3 gydF4y2Ba).每个基因选择两个grna,一个来自屏幕点击,一个由在线工具设计的正交指南(gydF4y2Bahttps://www.synthego.com/products/bioinformatics/crispr-design-toolgydF4y2Ba).导轨序列详见《补充表》gydF4y2Ba3 gydF4y2Ba.在分离后第9天,用CFSE对T细胞进行染色以跟踪细胞分裂,并用6.25 μ l ml刺激T细胞gydF4y2Ba−1gydF4y2Ba免疫培养10gydF4y2Ba6gydF4y2Ba用于基因靶点验证的药物剂量如下:环孢素,50 nM;他克莫司0.25 nM;Cgs-21680, 100µm;TGFβ, 10ng mlgydF4y2Ba−1gydF4y2Ba.在功能性癌细胞杀伤实验中,使用IncuCyte系统。为了验证TgydF4y2Ba注册gydF4y2Ba细胞电阻TgydF4y2Ba注册gydF4y2Ba按照上述方法分离细胞,并与供体匹配的cfse染色效应T细胞以不同细胞对细胞的比例混合。在功能性癌细胞杀伤实验中,使用IncuCyte系统。gydF4y2Ba
Western blot检测活性RAS蛋白和磷酸化蛋白gydF4y2Ba
为了进行免疫印迹实验,T细胞在RPMI (Gibco 21870076)中在37°C下血清饥饿2小时。饥饿后,用12.5 μl ml免疫培养液刺激细胞0、5、10、30、60 mingydF4y2Ba−1gydF4y2Ba在37°C的水浴中。在每个时间点之后,用冰冷的PBS淬灭刺激,细胞在300℃下旋转gydF4y2BaggydF4y2Ba在4°C下加热5分钟。将每个颗粒重新悬浮在Pierce RIPA缓冲液(Thermo Fisher 89901)中,在4°C下孵育40分钟。细胞裂解物储存在−80°C,直到进一步使用。使用Pierce BCA蛋白测定法(Thermo Fisher 23227)测定蛋白浓度。每个样品15微克蛋白质加载到4-15%三甘氨酸SDS凝胶(Bio-Rad)上,然后使用Biorad Trans-Blot转移系统转移到PVDF膜(Bio-Rad)上。用5%的牛奶在TBST中阻塞膜,在4°C下与一抗孵育过夜。使用的一抗:p-ERK (4370), p-MEK(9154)(细胞信号技术),vinculin (MAB3574) (Millipore Sigma), RASA2 (HPA035375) (Sigma Aldrich), β-肌动蛋白兔单克隆(辣根过氧化物酶(HRP)偶联)(Cell Signaling 5125),抗兔HRP抗体(Cell Signaling 7074),抗小鼠IgG, HRP连接抗体(Cell Signaling 7076), RASA2兔抗人GAP1m (NBP1-89794 Novus Biologicals), GAPDH小鼠抗人GAPDH (sc-47724 Santa Cruz Biotechnology),山羊抗兔IgG-HRP (111-036-045 Jackson免疫研究)和山羊抗小鼠IgG-HRP (sc-2005 Santa Cruz生物技术)。gydF4y2Ba
膜在UCSF的Azure生物系统600成像系统上成像,并在圣裘德的奥德赛Fc成像系统(LI-COR生物科学)上成像。gydF4y2Ba
对于活性RAS试验,T细胞和Jurkat细胞(ATCC(克隆E6-1))在RPMI (Gibco 21870076)中在37°C下血清饥渴2小时。饥饿后,用12.5 μl ml的Immunocult刺激T细胞5mingydF4y2Ba−1gydF4y2Ba在37°C的水浴中。一旦孵育完成,用冰冷的PBS淬灭刺激,细胞在4°C, 300℃下旋转gydF4y2BaggydF4y2Ba5分钟。进一步的检测按照RAS活化检测试剂盒(Cytoskeleton BK008)的方案进行。gydF4y2Ba
western blot凝胶的密度分析采用ImageJ v1.52q软件。使用“Analyze”菜单下的set measurements选项,我们将测量值设置为分析的平均灰色值。接下来,使用矩形工具定义感兴趣的区域(ROI),在感兴趣的带周围绘制一个框架。使用相同的ROI来量化所有波段。使用与蛋白质相同的框架,测量该蛋白质的背景。我们重复加载控制的步骤并记录测量结果。为了进行分析,将波段/控件的像素密度倒置,其背景表示为255−gydF4y2BaXgydF4y2Ba,在那里gydF4y2BaXgydF4y2Ba是蛋白质带或加载控制带的值。蛋白质条带和加载对照的净值由反向条带值减去反向背景值来计算。相对定量值计算为净蛋白质带值与该车道净负荷控制带值的比值。gydF4y2Ba
流式细胞仪检测gydF4y2Ba
对于细胞表面活化标记物,2 × 10gydF4y2Ba5克ydF4y2Ba到5 × 10gydF4y2Ba5克ydF4y2BaTCR T细胞在96孔的圆底板中每孔播种。12.5 μl ml免疫培养刺激TCR T细胞gydF4y2Ba−1gydF4y2Ba在37°C下放置4-6小时。CAR - T细胞通过与CD19共培养而受到刺激gydF4y2Ba+gydF4y2BaNalm6白血病细胞,1:1 E:T比,37℃,4-6小时。然后,将细胞离心,用200 μl细胞染色缓冲液洗涤一次,用抗体(100 μl染色缓冲液中每5 μl抗体)在4℃黑暗条件下染色30 min。用Attune NXT细胞仪(Invitrogen)读取样品,用FlowJo 10.7.1分析。对于衰竭和分化标记,细胞不刺激,而是如上所述进行染色。使用的抗体:Brilliant Violet 421 CD69 (Biolegend 310930), FITC抗人CD154 (Biolegend 310804), PE抗人CD25 (Biolegend 302606), FITC抗人CD279 (PD-1) (Biolegend 621612), Brilliant Violet 711 CD223 (lag3) (Biolegend 369320), Brilliant Violet 421抗人CD366 (tim3) (Biolegend 345008), PE抗人CD39 (Biolegend 328208), PE抗人CD62L (Biolegend 304806), PE CD19 (Beckman Coulter IM1285U)和APC CD19 (Beckman Coulter IM2470U)。gydF4y2Ba
磷酸化流式细胞术:2 × 10gydF4y2Ba5克ydF4y2Ba到5 × 10gydF4y2Ba5克ydF4y2BaTCR T细胞每孔接种于96孔圆底平板(Corning 877254), 12.5 μl ml免疫培养法刺激gydF4y2Ba−1gydF4y2Ba在37°C下加热5、10和30分钟。对于CAR - T细胞染色,CAR - T细胞与CD19共培养活化gydF4y2Ba+gydF4y2BaNalm6白血病细胞在圆形底96孔板中,E:T比例为1:1,在400孔板中短暂旋转gydF4y2BaggydF4y2Ba37℃孵育5分钟。处理结束时,用预热的BD Phosflow Fix Buffer I (BD Biosciences 557870)在37℃下固定细胞10分钟。细胞用染色缓冲液(FBS)清洗一次(BD Biosciences 554656)。接下来,通过添加BD Phosflow Perm Buffer III渗透细胞,并在−20°C下孵育30分钟至一夜。清洗两次,用抗体(每100 μl染色缓冲液中含有5 μl抗体)在室温黑暗中孵育30分钟,然后用染色缓冲液(FBS)洗涤两次。使用Attune NXT细胞仪(Invitrogen)读取样品,并使用FlowJo 10.7.1分析。所使用的抗体:抗mek1 (pS218)/MEK2 (pS222) (BD 562460), Alexa Fluor 488抗erk1 /2磷酸化(Thr202/Tyr204) (Biolegend 675507), PE抗erk1 /2磷酸化(Thr202/Tyr204) (Biolegend 369506), Brilliant Violet 421抗rps6磷酸化(Ser235/Ser236) (Biolegend 608610), PE Mouse抗4ebp1 (pT36/pT45) (BD 560285), Brilliant Violet 421抗akt (pS473) (BD 562599), PE抗p38 MAPK磷酸化(Thr180/Tyr182) (Biolegend 690204)。gydF4y2Ba
细胞内细胞因子染色:12.5 μl ml免疫培养刺激TCR T细胞gydF4y2Ba−1gydF4y2Babrefeldin A (eBioscience 00-4506-51)在37°C作用4-6小时。用于CAR - T细胞刺激,T细胞和CD19gydF4y2Ba+gydF4y2BaNalm6白血病细胞以1:1 E:T比例共培养,与布莱菲丁A在37℃孵育4-6 h。接下来,用Fix & Perm Cell Permeabilization Kit (Thermo Fisher Gas004)对细胞进行固定和渗透,并与氟铬偶联抗体(100 μ l染色缓冲液中每5 μ l抗体)在室温下黑暗中孵育20分钟。使用Attune NXT细胞仪(Invitrogen)读取样品,使用FlowJo 10.7.1分析。使用的抗体:PE小鼠抗人IFNγ (BD Biosciences 554701), BV711小鼠抗人IL-2 (BD Biosciences 563946), Pacific Blue抗人TNF (bioolegend 502920)。gydF4y2Ba
为了进行有丝分裂追踪器探针染色,将T细胞置于96孔板中,每孔20万个细胞,在25 nM的有丝分裂追踪器绿色FM (M7514)或有丝分裂追踪器红色CMXRos (M7512)中,在100µl的温X-Vivo培养基中孵育30分钟。然后用温的完全X-vivo培养基按1:1的体积淬灭细胞,旋转,用温的X-vivo培养基洗涤两次,5% FBS/PBS重悬,然后在Attune流式细胞仪上分析。gydF4y2Ba
用于骨髓分离细胞流式细胞术实验的抗体和试剂包括:PE-Cyanine7抗人CD8a (eBioscience 25-0087-42), APC-Cy7小鼠抗人CD45 (BD Biosciences 557833), BUV395小鼠抗人CD4 (BD Biosciences 563550), BV421小鼠抗人CD62L (BD Biosciences 563862), BV650小鼠抗人CD45RA (BD Biosciences 563963), BV480小鼠抗人CD279 (PD-1) (BD Biosciences 566112), PerCP-eFluor 710抗人CD223 (LAG-3) (eBioscience 46-2239-42), BUV737小鼠抗人CD19 (BD Biosciences 564303),BV785抗人CD366 (Tim-3) (Biolegend 345032), PE CD127 (IL7RA) (Biolegend 351304), PE抗人EGFR (Biolegend 352904), 7-AAD (Invitrogen A1310),计数珠(Invitrogen C36995)对于这些抗体染色,细胞在100µl总染色缓冲液中2µl抗体中重悬(参见“骨髓CAR - T细胞分离、处理和染色”)。gydF4y2Ba
测定抗原剂量-反应曲线的滴定法gydF4y2Ba
T细胞被分离、激活,用含有NY-ESO-1 1G4 TCR的慢病毒转导,并如上所述对RASA2或AAVS1进行编辑。TCR T细胞(2 × 10gydF4y2Ba5克ydF4y2Ba到3 × 10gydF4y2Ba5克ydF4y2Ba)每孔播种,用Immunocult刺激。在pERK染色中,将T细胞(包括转导和未转导的T细胞作为对照)在37℃下以50 μl ml的Immunocult最高剂量刺激2 min、5 min、10 mingydF4y2Ba−1gydF4y2Ba连续稀释2。T细胞在37℃下以12.5 μl ml的Immunocult最高剂量刺激24 h,作为活化标记物gydF4y2Ba−1gydF4y2Ba连续稀释2。后续染色按上述方法进行。gydF4y2Ba
为了测量T细胞对抗原特异性TCR再刺激的敏感性,用Immunocult刺激原代人T细胞,24小时后用浓缩慢病毒转导以表达ny - eso -1特异性T细胞受体,24小时后如上文所述,rnp -编辑RASA2或AAVS1。抗原提呈T2细胞gydF4y2Ba53gydF4y2Ba(ATCC CRL-1992)装上NY-ESO-1gydF4y2Ba157 - 165gydF4y2Ba肽SLLMWITQV (Thermofisher)在37°C孵育1小时。肽的最高终剂量为18 μM,随后按log5连续稀释。用培养基洗涤两次,去除未结合的肽。加入抗原特异性编辑的T细胞,让其与T2细胞相互作用10分钟,然后通过添加固定缓冲液,使用流式细胞仪进行pERK染色,停止反应。gydF4y2Ba
使用Jurkat细胞系的转录报告gydF4y2Ba
激活蛋白1 (AP-1)、活化T细胞核因子(NFAT)和核因子κB (NF-κB)转录活性的Jurkat T细胞报告系统是Kole Roybal(加州大学旧金山分校)提供的礼物,并如前所述生成gydF4y2Ba54gydF4y2Ba.用12.5 μl ml的Immunocult对Jurkat报告细胞进行tcr刺激gydF4y2Ba−1gydF4y2Ba,然后连续稀释2,以达到一定的激活水平。每24小时用流式细胞仪检测细胞mCherry水平。gydF4y2Ba
转基因的产生gydF4y2BaRASA2gydF4y2Ba
创造一个转基因生物gydF4y2BaRASA2gydF4y2Ba利用In-Fusion克隆试剂盒(Takara)将RASA2 ORF (NM_001303246.2, GenScript)克隆到逆转录病毒pSFG载体中,并在N端添加一个Flag标签。将GFP或CAR转基因插入与RASA2相同的逆转录病毒pSFG主干中,作为转基因过表达对照。为了生成表达转基因RASA2的T细胞,使用与CAR - T细胞生成相同的方法进行细胞转导。简而言之,逆转录病毒颗粒是通过将编码rasa2的SFG逆转录病毒载体、编码MoMLV gag-pol的Peg-Pam-e质粒和编码RD114包膜蛋白的质粒瞬时转染HEK293T细胞而产生的。48小时后收集上清液,过滤后冷冻,用于T细胞转导。western blot检测RASA2基因表达。gydF4y2Ba
重复刺激试验gydF4y2Ba
肿瘤细胞在共培养前一天在完整的RPMI培养基中播种。完整的RPMI培养基包括RPMI (Gibco 21870076)、10%胎牛血清、1%胎牛血清gydF4y2BalgydF4y2Ba-谷氨酰胺,1%青霉素链霉素。第二天,将RPMI培养基替换为T细胞培养基,在肿瘤细胞上以1:1的E:T比例和IL-2, 50iu ml接种抗原特异性T细胞gydF4y2Ba−1gydF4y2Ba.随后每48小时重复共培养一次。对于每一次共培养,使用Vi-CELL XR细胞计数器和活力分析仪收集和计数T细胞,并以1:1的E:T比重复到新鲜的靶肿瘤细胞上。在使用T细胞进行任何检测之前,使用EasySep Release Human CD45阳性选择试剂盒(Stem Cell 100-0105)收集、计数和纯化T细胞或通过流动分选纯化T细胞。在ELISA实验中,用靶细胞(A375)刺激TCR T细胞5次后,根据制造商的说明,使用LEGENDplex Human CD8/NK Panel 13-plex (bilegengend 740267)收集共培养上清液并进行分析。gydF4y2Ba
RNA-seq基因表达分析gydF4y2Ba
T细胞在24孔板中进行重复刺激试验,每48小时将T细胞转移到新播种的癌细胞中。每次刺激后,使用BD FACSAria Fusion对培养的T细胞进行分类,从与靶癌细胞共培养的T细胞中获得纯的NY-ESO-1多聚体阳性T细胞,并在TRI试剂(Sigma T9424)中重悬。根据制造商的方案,使用Direct-zol RNA MicroPrep试剂盒(Zymo Research R2061)提取总RNA,并按照前面描述的方法准备测序gydF4y2Ba55gydF4y2Ba由加州大学伯克利分校的功能基因组学实验室进行测序,并由加州大学伯克利分校的文森特·j·科茨基因组学测序实验室进行测序。评价动力学gydF4y2BaRASA2gydF4y2Ba在重复刺激试验过程中,NY-ESO-1 TCR或anti-CD19 CAR - T细胞被靶细胞和TCR刺激5次gydF4y2Ba+gydF4y2Ba或汽车gydF4y2Ba+gydF4y2Ba每次刺激48小时后对细胞进行FACS分选(NGFRt报告)。细胞在TRI试剂(Sigma T9424)中重悬。根据制造商的方案,使用Direct-zol RNA MicroPrep试剂盒(Zymo research R2061)提取总RNA,并按照前面描述的方法准备测序gydF4y2Ba55gydF4y2Ba由加州大学伯克利分校的功能基因组学实验室进行测序,并由加州大学伯克利分校的Vincent J. Coates基因组学测序实验室进行测序。比较基因之间的表达gydF4y2BaRASA2gydF4y2Ba细胞经过上述重复刺激试验,使用可释放的人类CD45阳性选择试剂盒(Stemcell technologies 100-0105)进行五次刺激后分离,制成颗粒,并将RNAlater (Thermofisher, AM7020)发送到加州大学戴维斯基因组中心的DNA技术和表达分析核心进行批量标记-测序rna -测序。gydF4y2Ba
为了分析基因表达,使用Kallisto将reads映射到人类参考转录组(GRCh38 Ensembl release 96)gydF4y2Ba56gydF4y2Ba使用默认参数。在80%以上的样本中,计数为零的基因被过滤掉。用R包DESeq2进行差异基因表达gydF4y2Ba57gydF4y2BaV1.32.0,控制供体方差。差异基因表达分析结果见补充表gydF4y2Ba4gydF4y2Ba.R包fgseagydF4y2Ba58gydF4y2Ba采用v1.18.0进行GSEA,根据DESeq2检验统计量和MSigDB v7.2标志基因集进行基因排序gydF4y2Ba59gydF4y2Ba参照基因列表。gydF4y2Ba
GEO和BioGPS发表的基因表达数据集分析gydF4y2Ba
为了确定RasGAP基因家族的组织特异性表达,从BioGPS网站下载了人类U133A基因图谱,并使用BioMart将探针id与基因符号匹配。为了便于基因之间的比较,每个基因的表达值被缩放到最小为0,最大为1。在扩展数据图中,只有前2%的表达组织被标记。gydF4y2Ba1 hgydF4y2Ba.该数据集中显示了所有可用的RasGAP家族成员的数据。gydF4y2Ba
找到相关的基因gydF4y2BaRASA2gydF4y2Ba免疫细胞中的表达(扩展数据图。gydF4y2Ba5 e, fgydF4y2Ba), R包correlationAnalyzeRgydF4y2Ba60gydF4y2Ba使用V1.0.0。仅使用定义为“正常”(非肿瘤)和“免疫”组织的数据集来寻找与RASA2表达的Pearson相关系数(R)。符号相关系数被用来排序所有基因基于他们的相关gydF4y2BaRASA2gydF4y2BaGSEA的表达和分析如上所述。gydF4y2Ba
生成图。gydF4y2Ba2 kgydF4y2Ba我们发表的来自原代人T细胞的scRNA-seq CROP-seq数据是从基因表达综合(GEO)登录中下载的gydF4y2BaGSE119450gydF4y2Ba并加工生成基因表达和sgRNA条形码矩阵,如前所述gydF4y2Ba13gydF4y2Ba.受刺激细胞间差异表达的基因表达gydF4y2BaRASA2gydF4y2Ba使用Seurat的FindMarkers函数分析sgRNA和非靶向控制指南(ctrl)gydF4y2Ba61gydF4y2Ba4.0 R包。只有来自受刺激样本的细胞有这两种gydF4y2BaCD3DgydF4y2Ba,gydF4y2BaCBLBgydF4y2Ba,gydF4y2BaRASA2gydF4y2Ba使用非靶向(ctrl) sgRNA计算图中各基因的平均表达量。gydF4y2Ba2 kgydF4y2Ba.gydF4y2Ba
生成图。gydF4y2Ba2 l, ngydF4y2Ba和扩展数据图。gydF4y2Ba5 h,我gydF4y2Ba,经处理的RNA-seq数据集从GEO (gydF4y2BaGSE89307gydF4y2Ba,gydF4y2BaGSE86881gydF4y2Ba而且gydF4y2BaGSE138459gydF4y2Ba分别)。对于每个数据集,的表达式gydF4y2BaRASA2gydF4y2Ba而且gydF4y2BaPDCD1gydF4y2Ba从计数矩阵中提取,并缩放到最小值为0,最大值为1,以便进行基因间比较。无花果。gydF4y2Ba2米gydF4y2Ba, RASA2的表达数据从DICE数据库中下载gydF4y2Ba20.gydF4y2Ba(gydF4y2Bahttps://dice-database.org/gydF4y2Ba).对于人类TIL数据(图;gydF4y2Ba2 ogydF4y2Ba),每个数据集的RASA2表达式数据从门户网站下载(gydF4y2Bahttp://crc.cancer-pku.cngydF4y2Ba而且gydF4y2Bahttp://lung.cancer-pku.cngydF4y2Ba).仅使用来自外周和肿瘤样本的标记为“CD8 T细胞”的细胞数据进行分析。gydF4y2Ba
海马化验gydF4y2Ba
通过细胞外通量分析进行代谢表型分析。通过评估OCR测定线粒体底物依赖性和最大呼吸水平。使用96孔细胞外通量分析仪(Seahorse Bioscience)测量OCR。简而言之,使用CD45分离试剂盒(100-0105)从培养物中分离TCR T细胞或CAR - T细胞,并将其镀在预涂有poly-的96孔板上gydF4y2BadgydF4y2Ba-赖氨酸(103729-100)在4 × 10gydF4y2Ba5克ydF4y2Ba每孔用50 μl Seahorse XF RPMI添加10 mM葡萄糖、1 mM丙酮酸和2 mM谷氨酰胺(Seahorse XF RPMI测定培养基包装103681-100)。电镀后,将细胞留在培养箱中1小时,以确保与孔的粘附。在显微镜下观察,确认粘附均匀、融合后,加入补充的Seahorse XF RPMI培养基130 μl,使体积达到180 μl /孔。然后将这些镀好的细胞置于CO中1小时gydF4y2Ba2 gydF4y2Ba在使用Seahorse仪器开始测量之前,在37°C的自由培养箱中。海马水藤应激试验采用海马XF Cell水藤应激试验试剂盒(103015-100),底物氧化应激试验采用安捷伦XF底物氧化应激试验试剂盒,具体为XF长链脂肪酸氧化应激试验试剂盒(103672-100)、XF葡萄糖/丙酮酸氧化应激试验试剂盒(103673-100)和XF谷氨酰胺氧化应激试验试剂盒(103674-100)。使用的药物最终浓度为:寡霉素1.5 μM;羰基氰化物,gydF4y2BapgydF4y2Ba-三氟甲氧基苯腙(FCCP), 1 μM;鱼藤酮+抗霉素A, 0.5 μM;依托莫西,4 μM;Uk5009, 2 μm;BPTES 3 μM。实验是按照制造商的说明进行的。所有海马分析均在海马XFe96分析仪上进行。gydF4y2Ba
NY-ESO-1 TCR T细胞与A375或Nalm6异种移植模型gydF4y2Ba
8 - 10周大的男性或女性NOD-SCIDgydF4y2BaIl2rggydF4y2Ba−−/gydF4y2Ba(NSG)小鼠(gydF4y2Ba亩骶gydF4y2Ba(品系#005557)是从Jax购买的或内部培育的。所有小鼠都按照UCSF IACUC批准的规程进行安置和治疗。小鼠被安置在UCSF LARC动物护理设施的海伦·迪勒家族癌症中心或UCSF帕纳萨斯。它们被安置在一个单独的无特定病原体的房间里。它们被安置在通风笼中,每个笼中最多5只老鼠,在12小时的光照周期中自由地提供食物和水,并控制温度和湿度条件(19-23°C和30-70%)。UCSF使用的IACUC协议包括UCSF临床前治疗核心(IACUC协议an194778 - AN179937的延续)和马森实验室(AN180228-03B)。为了确保同等的治疗前肿瘤负荷,小鼠在T细胞注射前按肿瘤负荷随机分组。对于A375黑素瘤异种移植研究,NSG小鼠植入1 × 10gydF4y2Ba6gydF4y2Ba第0天皮下注射A375黑色素瘤细胞。第7天,1 × 10gydF4y2Ba6gydF4y2BaNY-ESO-1 TCRgydF4y2Ba+gydF4y2BaT细胞通过静脉注射注入尾静脉。用卡尺测量A375细胞进展。对于NY-ESO-1gydF4y2Ba+gydF4y2BaNalm6白血病研究,NSG小鼠静脉注射0.3 × 10gydF4y2Ba6gydF4y2Ba表达ny - eso -1的Nalm6白血病细胞在第0天,其次为0.5 × 10gydF4y2Ba6gydF4y2Ba对照编辑或RASA2-KO ny - eso -1特异性TCR T细胞。使用Xenogen IVIS成像系统(Xenogen)和Living Image软件(Xenogen)进行生物发光成像,以获取成像数据集。当肿瘤测量最大尺寸达到2厘米时,或当小鼠表现出IACUC协议中描述的发病迹象时,如呼吸窘迫、驼驼的姿势、对治疗无反应的病变、身体状况评分为2或更低、体重减轻15%、活动能力受损或下降、肿瘤溃疡或干扰正常功能、干扰正常功能的神经体征时,在IACUC批准的终点对小鼠进行人道安乐死。毛发梳理和勃起减少,或直肠脱垂。在任何实验中都没有超过这些限制。在所有体内实验中,被分配到不同实验组的小鼠的性别、年龄和住所都是匹配的。没有使用统计方法来预先确定样本量。样本量是根据初步实验和先前发表的结果估计的。我们努力使最小样本量达到gydF4y2BangydF4y2Ba= 5只小鼠每个治疗组,这证明足以重复观察统计学显著性差异。每个图例中说明了样本量。对于所有的体内实验,小鼠随机化和注射总是由临床前治疗核心的一名失明成员或马森实验室的一名失明成员完成。肿瘤负荷的测量、小鼠的监测和肿瘤负荷分析由临床前治疗核心的成员进行,这些成员对实验组不知情。对于体内细胞表型和再挑战实验,当临床前治疗中心的工作人员不可用时,J.C.收集数据,并没有对各组进行盲法。为了进行骨髓和脾组织的组织病理学分析,血液病理学家不了解实验组。gydF4y2Ba
CD19-CAR - T细胞和NALM6异种移植模型gydF4y2Ba
动物实验遵循UCSF机构动物护理和使用委员会批准的协议。8 ~ 12周龄NOD/SCID/IL-2Rγ-null (NSG)雄性小鼠通过Jax实验室或内部育种获得。小鼠静脉注射0.5 × 10gydF4y2Ba6gydF4y2Ba4 d后静脉注射0.1 ~ 0.2 × 10gydF4y2Ba6gydF4y2Bacd19特异性CAR - T细胞。通过上述生物发光成像监测肿瘤负荷。在所有体内CAR - T细胞实验中,小鼠在生物发光成像结果的基础上随机进行,以确保在T细胞转移前每组肿瘤负荷分布均匀。gydF4y2Ba
两组独立的NSG小鼠被平行处理,以评估CAR - T细胞单独对小鼠健康的影响。第一组注射0.2 × 10gydF4y2Ba6gydF4y2Ba如上所述,针对RASA2编辑的cd19特异性CAR - T细胞与对照指南。第二个队列作为抗原体验队列,其中NSG小鼠植入0.5 × 10gydF4y2Ba6gydF4y2BaFFLuc-GFP NALM-6细胞,然后以肿瘤清除剂量注射cd19特异性CAR - T细胞。根据UCSF IACUC协议,对小鼠进行生物发光成像随访,并通过体重和任何发病迹象进行监测。生物发光测量表明,接受NALM6细胞的队列在第18天清除了这些肿瘤。经过长时间的监测,来自这些队列的小鼠在第116天被安乐死。小鼠组织(脾脏,骨髓和淋巴结)固定在磷酸盐缓冲福尔马林。在植入前,用含有市售脱钙液的甲酸对胸骨进行脱钙。组织进行石蜡包埋,切片,苏木精和伊红染色。组织最初由UCSF临床前治疗核心的一名失明成员审查,以寻找病理异常的证据,而不了解产生个体动物组织的实验。组织切片由一名盲目的UCSF血液病理学家复查。使用Hemavet 950仪器从这些小鼠的血液中测量全血细胞计数。gydF4y2Ba
在复攻实验中,对供体进行了测试,发现在0.2 × 10的相同CAR - T细胞剂量下,供体表现出持久的肿瘤控制gydF4y2Ba6gydF4y2Ba车gydF4y2Ba+gydF4y2Ba每只老鼠的CAR - T细胞。然后将同样的0.5 × 10植入另一组小鼠gydF4y2Ba6gydF4y2Ba4 d后静脉注射0.2 × 10的NALM-6细胞gydF4y2Ba6gydF4y2BaCD19汽车gydF4y2Ba+gydF4y2BaCAR - T细胞编辑gydF4y2BaRASA2gydF4y2Ba而不是以前的控制指南。在本例中,CAR - T细胞注射后,再给小鼠注射1 × 10gydF4y2Ba6gydF4y2BaFFLuc-GFP NALM-6细胞分别静脉注射7-11天。根据UCSF IACUC协议,我们对小鼠进行了一段时间的生物发光成像随访,并根据体重和上述任何疾病迹象进行监测。在任何实验中都没有超过这些限制。gydF4y2Ba
骨髓CAR - T细胞分离、加工及染色gydF4y2Ba
含nalm -6小鼠用2 × 10处理gydF4y2Ba5克ydF4y2Ba来自捐赠者的TRAC CAR - T细胞先前测试了体内白血病控制效果,并在输注后的第7天和第16天安乐死。提取骨髓时,分离出每条腿的长骨,用PBS在研钵和杵中碾碎,然后用PBS通过细胞过滤器冲洗。然后将细胞离心,用ACK裂解缓冲液(118-156-721,Quality Biological)处理2 min进行红细胞裂解,用FACS缓冲液淬灭反应。每只小鼠剩余的细胞用300 μl的FACS缓冲液重悬。加入Fc阻断(每个样品10 μl) (130-092-575, Miltenyi Biotec)后,细胞进行CAR染色(每个样品1 μl) (115-606-07, Jackson ImmunoResearch),室温孵育30分钟。洗净后,用2%正常小鼠血清(Millipore-Sigma)和Fc block (10 μl)重悬,室温孵育20 min。然后用相应的抗体混合物(100 μl /管染色容积;上述在流式细胞术方法部分发现的特异性抗体)在室温下孵育45分钟。染色后,细胞洗净重悬于300 μl FACS缓冲液中,计数珠(50 μl /样品)(C36950, ThermoFisher Scientific),流式细胞仪分析。gydF4y2Ba
体内CD19 CAR - T细胞竞争实验gydF4y2Ba
CD19 TRAC CAR - T细胞如上所述,使用前面描述的CAR结构生成gydF4y2Ba46gydF4y2Ba.简而言之,该结构包括一个pAAV-TRAC-1928z,包含1.2 kb的基因组TRAC,位于gRNA靶向序列的两侧,一个具有TRAC第一个外显子的自切割P2A肽,随后是1928z CAR和第二个自切割P2A肽。在本实验中,我们使用了该结构的一个版本,该版本包含或不包含截断形式的EGFR (EGFR-t)序列,随后是第三个自裂解P2A肽。如上所述,对这两种不同的CAR - T种群进行了编辑gydF4y2BaAAVS1gydF4y2Ba轨迹或gydF4y2BaRASA2gydF4y2Ba轨迹。最终的产物包括四种CAR - T细胞群,gydF4y2BaRASA2 -gydF4y2Ba编辑CD19 TRAC CAR - T细胞加和不加EGFRt,以及gydF4y2BaAAVS1 -gydF4y2Ba编辑CD19 TRAC CAR - T细胞加和不加EGFRt。然后将这些种群组合成两个混合种群,混合1 (gydF4y2BaAAVS1gydF4y2Ba不含EGFRt +的CD19 TRAC CAR - T细胞gydF4y2BaRASA2 -gydF4y2Ba编辑CD19 TRAC CAR - T细胞与EGFRt)和mix 2 (gydF4y2BaAAVS1 -gydF4y2Ba用EGFRt +编辑CD19 TRAC CAR - T细胞gydF4y2BaRASA2 -gydF4y2Ba编辑CD19 TRAC CAR - T细胞不含EGFRt)。这两个混合种群的混合百分比被证实约为50%:在输注到携带nalm6的小鼠的当天,每个混合输入种群的混合百分比为50%。注射后第7、16天处死小鼠,骨髓处理如上。通过CAR和EGFR染色来确定在这些时间点从骨髓中分离出的AAVS1-KO和RASA2-KO CAR - T细胞的最终百分比。gydF4y2Ba
EphA2-CAR RASA2-KO T细胞生成gydF4y2Ba
先前已经描述了编码EphA2 CARs的逆转录病毒载体的生成gydF4y2Ba48gydF4y2Ba,gydF4y2Ba62gydF4y2Ba.转染前2天,将HEK293T细胞以每10 cm培养皿1 - 200万个细胞的数量进行瞬时转染,获得逆转录病毒颗粒,并在含10%胎牛血清的DMEM中培养。细胞转染CAR逆转录病毒质粒,逆转录病毒包装质粒Peg-Pam3-E和编码RD114包膜蛋白的质粒,使用GeneJuice转染试剂按照制造商的方案(Novagen 70967)进行转染。转染48小时后,收集病毒上清液,以400度旋转gydF4y2BaggydF4y2Ba用0.45- m过滤器过滤5分钟,去除细胞碎片。然后将病毒上清快速冷冻并在−80°C保存,直到进一步使用。gydF4y2Ba
为了生成EphA2-CAR RASA2-KO T细胞,根据irb批准的圣裘德儿童研究医院(SJCRH)的方案,从健康献血者的全血中获得人pbmc。为了产生CAR - T细胞,我们通过淋巴细胞梯度离心法分离出pmcs。第0天,在经过非组织培养处理的24孔板上刺激pmcs,这些板上预先涂有CD3和CD28抗体(抗CD3/CD28;Cd3: okt3, cd28: 15e8;Miltenyi研究)。重组人IL-7和IL-15 (IL-7: 10 ng mlgydF4y2Ba−1gydF4y2Ba;IL-15: 5 ng mlgydF4y2Ba−1gydF4y2Ba;培养第1天添加PeproTech)。用核糖核蛋白(RNPs)靶向电穿孔T细胞gydF4y2BaRASA2gydF4y2Ba第2天使用Lonza 4D电转换仪,第3天用EphA2 car编码逆转录病毒载体转导。sgRNA被设计用于靶向AGATATCACACATTACAGTG (g1)、AGGATCGACTTGTGGAACAA (g2)或非靶向引导序列AGTAGTCGGGATGTCGGCG。将3 μl 60 μM sgRNA (Synthego)与1 μl 40 μM Cas9 (Macro Lab, University of California, Berkeley)混合制备RNPs, sgRNA:Cas9比例为4.5:1,冷冻备用。对于RASA2 KO, 1 × 10gydF4y2Ba6gydF4y2Ba将T细胞重悬于17 μl P3核载体主液(Lonza P3 Primary Cell 4D-NucleofectorTM X Kit S, V4XP-3032)中,加入3 μl RNP。使用EH-115程序电穿孔20微升细胞+ RNP。将1个20 μl电穿孔反应转移到48孔组织培养处理板的1孔中,其中RPMI 1640添加20% FBS, 1% Glutamax, 10 ng mlgydF4y2Ba−1gydF4y2BaIL-7, 5 ng mlgydF4y2Ba−1gydF4y2BaIL-15(恢复介质)过夜。第二天,使用电穿孔细胞进行CAR转导。gydF4y2Ba
T细胞转导时,将500 μl病毒上清液在RetroNectin (Clontech)涂层的24孔非组织培养板上旋转,温度为2000gydF4y2BaggydF4y2Ba90分钟。旋转后,去除病毒上清,电穿孔T细胞以2.5 × 10镀膜gydF4y2Ba5克ydF4y2Ba每孔细胞在2毫升恢复培养基中。48小时后,car - T细胞从retronectin涂层板转移到组织培养板上,并在添加10%胎牛血清、1%谷氨酰胺、10 ng ml的RPMI 1640中扩增gydF4y2Ba−1gydF4y2BaIL-7, 5 ng mlgydF4y2Ba−1gydF4y2BaIL-15。T细胞转导后4-6天用CD19-PE(克隆J3-119, Beckman Coulter)评估CAR表达。未转导的T细胞被用作门控的阴性对照。样品用PBS (Lonza)和1% FBS (Cytiva)清洗和染色。LIVE/DEAD固定水死细胞染色试剂盒(Invitrogen, Thermo Fisher Scientific)用作活性染料。采用FACSCanto II (BD)仪获取流式细胞术数据,使用FlowJo v10进行分析。gydF4y2Ba
EphA2-CAR - T细胞和LM7异种移植模型gydF4y2Ba
动物实验遵循圣裘德儿童研究医院机构动物护理和使用委员会批准的协议。8 - 10周龄的雌性NSG小鼠来自SJCRH NSG菌落。小鼠被安置在圣裘德动物资源中心(ARC)的无特定病原体的个体套房中,该中心是完全经aaalac认证的设施。St Jude G.K.实验室使用的IACUC协议为623-100650。每个笼中最多5只小鼠被安置在通风笼中,在12小时的光照周期中自由地提供食物和水,并控制温度和相对湿度条件(19-23°C和30-70%)。被分配到不同实验组的小鼠性别、年龄和住所相匹配。当iacuc批准的生物发光终点肿瘤测量达到>10时,对小鼠进行人道安乐死gydF4y2Ba10克ydF4y2Ba光子年代gydF4y2Ba1gydF4y2Ba或当小鼠表现出IACUC协议中描述的窘迫迹象时,如呼吸窘迫、驼驼的姿势、对治疗无反应的病变、15-20%的体重减轻、活动能力受损或下降、干扰正常功能的神经体征或梳洗减少。在任何实验中都没有超过这些限制。小鼠腹腔注射1 × 10gydF4y2Ba6gydF4y2BaLM7-GFP-ffluc骨肉瘤细胞。7 d后腹腔注射1 × 10gydF4y2Ba5克ydF4y2BaCAR - T细胞。该实验用来自两名不同健康捐赠者的CAR - T细胞进行了两次。在第二个实验中,长期无肿瘤存活的小鼠(gydF4y2BangydF4y2Ba控制KO = 1,gydF4y2BangydF4y2BaRASA2 KO = 3)再次挑战,腹腔注射1 × 10gydF4y2Ba6gydF4y2Ba174天LM7-GFP-ffluc肿瘤细胞。通过生物发光成像监测肿瘤负荷。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
本文所生成的所有CRISPR筛选数据均在补充表格中提供gydF4y2Ba1克ydF4y2Ba而且gydF4y2Ba2 gydF4y2Ba.验证排列屏幕的结果详见补充表gydF4y2Ba3 gydF4y2Ba.基因差异表达分析见补充表gydF4y2Ba4gydF4y2Ba.RNA-seq实验的原始测序数据随接入沉积在GEO上gydF4y2BaGSE204862gydF4y2Ba.gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
代码的可用性gydF4y2Ba
本手稿中使用的代码可在Zenodo (gydF4y2Bahttps://doi.org/10.5281/zenodo.6808407gydF4y2Ba).gydF4y2Ba
参考文献gydF4y2Ba
Fesnak, a.d., June, C. H. & Levine, B. L.工程T细胞:癌症免疫治疗的希望和挑战。gydF4y2BaNat. Rev. CancergydF4y2Ba16gydF4y2Ba, 566-581(2016)。gydF4y2Ba
Anderson, k.g., Stromnes, i.m.和Greenberg, p.d.肿瘤微环境对T细胞活性的障碍:协同治疗的一个案例。gydF4y2Ba癌症细胞gydF4y2Ba31gydF4y2Ba, 311-325(2017)。gydF4y2Ba
魏,J.等。针对REGNASE-1编程长效效应T细胞用于癌症治疗。gydF4y2Ba自然gydF4y2Ba576gydF4y2Ba, 471-476(2019)。gydF4y2Ba
Su, S.等。CRISPR-Cas9介导的癌症患者原代T细胞PD-1的高效破坏gydF4y2BaSci代表。gydF4y2Ba6gydF4y2Ba, 20070(2016)。gydF4y2Ba
Stadtmauer, E. A.等。crispr工程T细胞在难治性癌症患者中的应用gydF4y2Ba科学gydF4y2Ba367gydF4y2Ba, eaba7365(2020)。gydF4y2Ba
拉普,L. J.等。CRISPR/ cas9介导的PD-1破坏增强了人嵌合抗原受体T细胞的抗肿瘤功效。gydF4y2BaSci代表。gydF4y2Ba7gydF4y2Ba, 737(2017)。gydF4y2Ba
Lynn, R. C.等,c-Jun在CAR - T细胞中的过表达诱导衰竭抵抗。gydF4y2Ba自然gydF4y2Ba576gydF4y2Ba, 293-300(2019)。gydF4y2Ba
尚,W.等。全基因组CRISPR筛选确定FAM49B是肌动蛋白动力学和T细胞激活的关键调节因子。gydF4y2Ba国家科学院学报美国gydF4y2Ba115gydF4y2Ba, e4051-e4060(2018)。gydF4y2Ba
董,m.b.等。在CD8 T细胞中使用基因组尺度的体内CRISPR筛选系统免疫治疗靶点的发现。gydF4y2Ba细胞gydF4y2Ba178gydF4y2Ba, 1189 - 1204。e23(2019)。gydF4y2Ba
陈,Z.等。体内CD8gydF4y2Ba+gydF4y2BaT细胞CRISPR筛查显示Fli1在感染和癌症中的控制。gydF4y2Ba细胞gydF4y2Ba184gydF4y2Ba, 1262 - 1280。e22(2021)。gydF4y2Ba
Binnewies等人。了解肿瘤免疫微环境(TIME)有助于有效治疗。gydF4y2BaNat,地中海。gydF4y2Ba24gydF4y2Ba541-550(2018)。gydF4y2Ba
Vardhana, s.a.等。受损的线粒体氧化磷酸化限制了暴露于持久性抗原的T细胞的自我更新。gydF4y2BaImmunol Nat。gydF4y2Ba21gydF4y2Ba, 1022-1033(2020)。gydF4y2Ba
Shifrut, E.等。原代人类T细胞的全基因组CRISPR筛选揭示了免疫功能的关键调节因子。gydF4y2Ba细胞gydF4y2Ba175gydF4y2Ba, 1958 - 1971。e15(2018)。gydF4y2Ba
林,W. A.和June, C. H.工程免疫细胞治疗癌症的原理。gydF4y2Ba细胞gydF4y2Ba168gydF4y2Ba, 724-740(2017)。gydF4y2Ba
西特科夫斯基,m.v.等人。缺氧诱导因子和腺苷A对免疫反应和炎症组织损伤的生理控制gydF4y2Ba2gydF4y2Ba受体。gydF4y2Ba为基础。启Immunol。gydF4y2Ba22gydF4y2Ba, 657-682(2004)。gydF4y2Ba
马丁内斯,G. J.等。转录因子NFAT促进活化CD8的衰竭gydF4y2Ba+gydF4y2BaT细胞。gydF4y2Ba免疫力gydF4y2Ba42gydF4y2Ba, 265-278(2015)。gydF4y2Ba
Kloss, C. C.等。显性阴性TGF-β受体增强psma靶向的人CAR - T细胞增殖并增强前列腺癌的根除。gydF4y2Ba摩尔。其他。gydF4y2Ba26gydF4y2Ba, 1855-1866(2018)。gydF4y2Ba
Plitas, G.等。调节性T细胞在人类乳腺癌中表现出明显的特征。gydF4y2Ba免疫力gydF4y2Ba45gydF4y2Ba, 1122-1134(2016)。gydF4y2Ba
DepMap 22Q1 Public。gydF4y2Bahttps://doi.org/10.6084/M9.FIGSHARE.19139906.V1gydF4y2Ba(2022)。gydF4y2Ba
施米德尔,B. J.等。遗传多态性对人类免疫细胞基因表达的影响gydF4y2Ba细胞gydF4y2Ba175gydF4y2Ba, 1701 - 1715。e16天(2018)。gydF4y2Ba
Vasiukov, G.等。腺苷/TGFβ轴在乳腺成纤维细胞功能调节中的作用。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba16gydF4y2Ba, e0252424(2021)。gydF4y2Ba
Regateiro, F. S.等。白细胞产生抗炎腺苷受TGF-β调控。gydF4y2Ba欧元。j . Immunol。gydF4y2Ba41gydF4y2Ba, 2955-2965(2011)。gydF4y2Ba
Schoppmeyer, R.等人。人profilin 1是CTL介导的细胞杀伤和迁移的负调控因子。gydF4y2Ba欧元。j . Immunol。gydF4y2Ba47gydF4y2Ba, 1562-1572(2017)。gydF4y2Ba
陈,J.-Y。,Lin, J.-R., Cimprich, K. A. & Meyer, T. A two-dimensional ERK–AKT signaling code for an NGF-triggered cell-fate decision.摩尔。细胞gydF4y2Ba45gydF4y2Ba, 196-209(2012)。gydF4y2Ba
阿拉法特等人。复发性灭活gydF4y2BaRASA2gydF4y2Ba黑色素瘤突变。gydF4y2BaNat,麝猫。gydF4y2Ba47gydF4y2Ba, 1408-1410(2015)。gydF4y2Ba
普里阿特尔,J。J。Teh。s。J。,Dower, N. A., Stone, J. C. & Teh, H.-S. RasGRP1 transduces low-grade TCR signals which are critical for T cell development, homeostasis, and differentiation.免疫力gydF4y2Ba17gydF4y2Ba, 617-627(2002)。gydF4y2Ba
苏,a.i.等。小鼠和人类蛋白质编码转录组的基因图谱。gydF4y2Ba国家科学院学报美国gydF4y2Ba101gydF4y2Ba, 6062-6067(2004)。gydF4y2Ba
Kortum, R. L., Rouquette-Jazdanian, A. K. & Samelson, L. E. Ras和细胞外信号调节激酶信号在胸腺细胞和T细胞。gydF4y2BaImmunol趋势。gydF4y2Ba34gydF4y2Ba, 259-268(2013)。gydF4y2Ba
Macián, F.等。淋巴细胞耐受的转录机制。gydF4y2Ba细胞gydF4y2Ba109gydF4y2Ba, 719-731(2002)。gydF4y2Ba
Gioia, L., Siddique, A., Head, s.r., Salomon, d.r. & Su, a.i. Jurkat细胞系突变的全基因组调查。gydF4y2BaBMC基因组学gydF4y2Ba19gydF4y2Ba, 334(2018)。gydF4y2Ba
Feucht, J.等。CAR激活电位的校准指导替代T细胞命运和治疗效力。gydF4y2BaNat,地中海。gydF4y2Ba25gydF4y2Ba, 82-88(2019)。gydF4y2Ba
Majzner, R. G.等。调整CAR - t细胞活性的抗原密度要求。gydF4y2Ba癌症。gydF4y2Ba10克ydF4y2Ba, 702-723(2020)。gydF4y2Ba
哈米耶,等人。CAR - T细胞吞噬和协同杀伤调节肿瘤抗原逃逸。gydF4y2Ba自然gydF4y2Ba568gydF4y2Ba, 112-116(2019)。gydF4y2Ba
Courtois-Cox, S.等人。一个负反馈信号网络是癌基因诱导衰老的基础。gydF4y2Ba癌症细胞gydF4y2Ba10克ydF4y2Ba, 459-472(2006)。gydF4y2Ba
白苏里,F.等。线粒体呼吸控制炎症T细胞反应中的溶酶体功能。gydF4y2Ba细胞金属底座。gydF4y2Ba22gydF4y2Ba, 485-498(2015)。gydF4y2Ba
Chaudhuri, L., Srivastava, R. K., Kos, F. & Shrikant, p.a.解偶联蛋白2调节代谢重编程和抗原刺激CD8的命运gydF4y2Ba+gydF4y2BaT细胞。gydF4y2Ba癌症Immunol。Immunother。gydF4y2Ba65gydF4y2Ba, 869-874(2016)。gydF4y2Ba
查普曼,N. M., Boothby, M. R. & Chi, H. T细胞静止和激活的代谢协调。gydF4y2BaNat. Rev. Immunol。gydF4y2Ba20.gydF4y2Ba, 55-70(2020)。gydF4y2Ba
菲利普等人。染色质状态定义肿瘤特异性T细胞功能障碍和重编程。gydF4y2Ba自然gydF4y2Ba545gydF4y2Ba, 452-456(2017)。gydF4y2Ba
波肯,K. E.等。耗尽的T细胞的表观遗传稳定性限制了PD-1阻断再活力的持久性。gydF4y2Ba科学gydF4y2Ba354gydF4y2Ba, 1160-1165(2016)。gydF4y2Ba
张,L.等。谱系追踪揭示结直肠癌中T细胞的动态关系。gydF4y2Ba自然gydF4y2Ba564gydF4y2Ba, 268-272(2018)。gydF4y2Ba
郭,X.等。通过单细胞测序对非小细胞肺癌中T细胞的全球特征。gydF4y2BaNat,地中海。gydF4y2Ba24gydF4y2Ba, 978-985(2018)。gydF4y2Ba
施密特,R.等。CRISPR激活和干扰屏幕解码原代人T细胞的刺激反应。gydF4y2Ba科学gydF4y2Ba375gydF4y2Ba, eabj4008(2022)。gydF4y2Ba
Gupta, P. K.等人。CD39表达鉴定最终耗尽的CD8gydF4y2Ba+gydF4y2BaT细胞。gydF4y2Ba公共科学图书馆Pathog。gydF4y2Ba11gydF4y2Ba, e1005177(2015)。gydF4y2Ba
沙平,n.e.等人。肿瘤微环境抑制T细胞线粒体生物发生,以驱动瘤内T细胞代谢不足和功能障碍。gydF4y2Ba免疫力gydF4y2Ba45gydF4y2Ba, 374-388(2016)。gydF4y2Ba
罗斯,t.l.等人。用非病毒基因组靶向重新编程人类T细胞功能和特异性。gydF4y2Ba自然gydF4y2Ba559gydF4y2Ba, 405-409(2018)。gydF4y2Ba
埃奎姆,J.等人。用CRISPR/Cas9将CAR靶向到TRAC位点可以增强肿瘤排斥反应。gydF4y2Ba自然gydF4y2Ba543gydF4y2Ba, 113-117(2017)。gydF4y2Ba
Prinzing, B.等。MyD88/CD40信号使CAR - T细胞处于低分化状态。gydF4y2Ba江森自控的洞察力gydF4y2Ba5克ydF4y2Ba, e136093(2020)。gydF4y2Ba
易志刚,王志刚,曹芳,王志刚,王志刚,王志刚,王志刚,王志刚,王志刚,王志刚,王志刚,王志刚,王志刚。gydF4y2Ba摩尔。其他。中国的方法。Dev。gydF4y2Ba9gydF4y2Ba, 70-80(2018)。gydF4y2Ba
洛克耶,P. J.等。ras gtp酶激活蛋白GAP1(m)在体内作为磷脂酰肌醇-3,4,5-三磷酸结合蛋白的鉴定。gydF4y2Ba咕咕叫。医学杂志。gydF4y2Ba9gydF4y2Ba, 265-268(1999)。gydF4y2Ba
朱,I.等。用于细胞疗法中程序化基因调控的合成受体的模块化设计。gydF4y2Ba细胞gydF4y2Ba185gydF4y2Ba, 1431 - 1443。e16天(2022)。gydF4y2Ba
杜恩奇,J. G.等。优化sgRNA设计,最大限度地提高CRISPR-Cas9的活性和最小化脱靶效应。gydF4y2Ba生物科技Nat。》。gydF4y2Ba34gydF4y2Ba, 184-191(2016)。gydF4y2Ba
李,W.等。MAGeCK能够从基因组规模的CRISPR/Cas9敲除筛选中强大地识别必要基因。gydF4y2Ba基因组医学杂志。gydF4y2Ba15gydF4y2Ba, 554(2014)。gydF4y2Ba
亨德森,R. A.等。来自突变细胞系的hla - a2.1相关肽:抗原呈递的第二途径。gydF4y2Ba科学gydF4y2Ba255gydF4y2Ba, 1264-1266(1992)。gydF4y2Ba
Hyrenius-Wittsten, A.等。在小鼠模型中,SynNotch CAR电路增强实体瘤识别能力,并促进持久的抗肿瘤活性。gydF4y2Ba科学。Transl。地中海。gydF4y2Ba13gydF4y2Ba, eabd8836(2021)。gydF4y2Ba
Cortez, J. T.等。调节性T细胞中的CRISPR筛选揭示了Foxp3的调节剂。gydF4y2Ba自然gydF4y2Ba582gydF4y2Ba, 416-420(2020)。gydF4y2Ba
Bray, N. L, Pimentel, H., Melsted, P. & Pachter, L.近最优概率RNA-seq量化。gydF4y2Ba生物科技Nat。》。gydF4y2Ba34gydF4y2Ba, 525-527(2016)。gydF4y2Ba
Love, m.i, Huber, W. & Anders, S.使用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。gydF4y2Ba基因组医学杂志。gydF4y2Ba15gydF4y2Ba, 550(2014)。gydF4y2Ba
Korotkevich, G.等。快速基因集富集分析。预印在gydF4y2BabioRxivgydF4y2Bahttps://doi.org/10.1101/060012gydF4y2Ba(2021)。gydF4y2Ba
Liberzon等人。分子特征数据库(MSigDB)标记基因集收集。gydF4y2Ba细胞系统gydF4y2Ba.gydF4y2Ba1克ydF4y2Ba, 417-425(2015)。gydF4y2Ba
Miller, H. E. & Bishop, A. J. R.相关分析器:基因共表达相关性的功能预测。gydF4y2BaBMC Bioinf。gydF4y2Ba22gydF4y2Ba, 206(2021)。gydF4y2Ba
Hao, Y.等。多模态单细胞数据综合分析。gydF4y2Ba细胞gydF4y2Ba184gydF4y2Ba, 3573 - 3587。e29(2021)。gydF4y2Ba
Prinzing, B.等。在CAR - T细胞中删除DNMT3A可以防止衰竭并增强抗肿瘤活性。gydF4y2Ba科学。Transl。地中海。gydF4y2Ba13gydF4y2Ba, eabh0272(2021)。gydF4y2Ba
确认gydF4y2Ba
我们感谢Krenciute, Eyquem, Ashworth和Marson实验室的成员对手稿进行了有益的讨论和反馈;感谢K. Roybal实验室的成员,感谢他们有益的讨论和试剂的分享;A.塔尔博特,感谢他在动物注射方面的帮助;来自Preclinical Therapeutics Core的V. Steri, J. Camara Serrano, P. Phojanakong和H. Vinsonhaler对体内实验的所有协助;n·贝内特教授海马实验;S.道奇森对这份手稿提出了有益的建议;行政支援;以及S.派尔在制图方面的协助。J.C.获得了NIH/NCI K08, 1K08CA252605-01, Burroughs Wellcome基金医学家职业奖,Lydia Preisler Shorenstein捐赠者建议基金和Damon Runyon癌症研究基金会医师科学家培训奖的支持。F.B.由关爱稀有动物基金会和德国研究基金会(DFG)支持。 H.O. was supported by NIH grant R35NS105068. The Eyquem laboratory received funding from Parker Institute for Cancer Immunotherapy and the Grand Multiple Myeloma Translational Initiative. This work was supported by NIH/NCI grants R01NS106379-02 and R01CA173750 to S.G., R01NS121249 to G.K., K99CA256262 to D.H., the Assisi foundation to G.K. and the American Lebanese Syrian Associated Charities (ALSAC) to S.G. and G.K. G.K. is funded by the St Jude Comprehensive Cancer Center (SJCCC) Neurobiology and Brain Tumor Program (NBTP), which is funded in part through P30CA021765. Some DNA sequencing was carried out at the DNA Technologies and Expression Analysis Cores at the UC Davis Genome Center, supported by NIH Shared Instrumentation Grant 1S10OD010786-01. Animal studies were performed using the Helen Diller Family Comprehensive Cancer Center’s Preclinical Therapeutics Core which is supported by the National Cancer Institute of the National Institutes of Health under Award Number P30CA082103. The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH. Fig.2gydF4y2Ba由BioRender.com创建,由S. Pyle改编。这项工作得到了帕克癌症免疫治疗研究所、PICI (A.M.和A.A.)、Simons基金会(A.M.)、癌症研究所(CRI) Lloyd J. Old STAR资助(A.M.)、Burroughs Wellcome基金医学家职业奖(A.M.)、Byers家族、B. Bakar、K. Jordan和E. Radutzky (A.M.)的支持。马森实验室获得了创新基因组研究所的资金,A.M.是陈-扎克伯格生物中心的研究员。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
概念化:李鸿源,大肠G.K。S.G J.E嗜和点方法:J.C., E.S., n.k., f.b., w.a.n., t.l.r., s.p.b., k.s., a.a.a., d.h., G.K.和S.K.研究:J.C.和E.S.进行CRISPR筛选;体外筛选验证研究由j.c.、E.S.和N.K.进行;通过j.c., e.s., n.k., f.b., w.a.n., y.y.c., z.l., a.t.s., s.p.b., m.e.d., p.o., s.v., T.L.R, a.a.a., b.p., d.h., M.L.-E进行了RASA2操纵对T细胞影响的体外表征。, M.B.-B。,A.T.S., J.B., B.D., S.B., J.I.-V., S.L., B.H. and S.K.; in vivo experiments were performed by J.C., F.B., W.A.N., Y.Y.C., Z.L., B.P. and M.L.-E. in collaboration with the preclinical therapeutics cores at UCSF and St Jude. Resources: J.C., E.S., F.B., T.L.R., J.E., G.K., T.F., S.G. and A.A. Formal analysis: J.C., E.S., W.A.N. and G.K. Software: E.S. Data curation: J.C. and E.S. Supervision: J.C., E.S., G.K., J.E., A.A. and A.M. Funding acquisition: J.C., E.S., D.H., J.E., H.O., S.G., G.K., A.A. and A.M. Writing, original draft preparation: J.C., E.S. and G.K. Writing, review and editing: J.C., E.S., A.A.A., B.P., S.K., K.S., J.E., H.O., S.G., G.K., A.A. and A.M.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
J.E.是Mnemo Therapeutics的有偿联合创始人,Cytovia Therapeutics的有偿科学顾问,拥有Mnemo Therapeutica和Cytovia Therapeutics的股票,并从Casdin Capital收取咨询费。Eyquem实验室得到了Cytovia Therapeutic和Takeda的研究支持。J.E.是与这项工作有关但不是由这项工作产生的专利的持有人。A.A.是Tango Therapeutics, Azkarra Therapeutics, Ovibio Corporation和Kytarro的联合创始人,Cytomx和Cambridge Science Corporation的董事会成员,Genentech, GLAdiator, Circle, Bluestar, Earli, Ambagon, Phoenix Molecular Designs和Trial Library的科学顾问委员会成员,SPARC, ProLynx和GSK的顾问,SPARC和AstraZeneca的资助或研究支持的获得者。并持有与阿斯利康(AstraZeneca)联合持有的PARP抑制剂使用专利,并从中获得了经济利益(未来可能会这样做)。A.M.是Arsenal Biosciences、Spotlight Therapeutics和Survey Genomics的联合创始人,担任Spotlight Therapeutics和Survey Genomics的董事会成员,是Arsenal Biosciences的董事会观察员(和前董事会成员),是Arsenal Biosciences、Spotlight Therapeutics、Survey Genomics和NewLimit的科学顾问委员会成员,拥有Arsenal Biosciences、Spotlight Therapeutics、NewLimit、Survey Genomics、PACT Pharma和Merck的股票。并获得了Arsenal Biosciences, Spotlight Therapeutics, NewLimit, 23andMe, PACT Pharma, Juno Therapeutics, Trizell, Vertex, Merck, Amgen, Genentech, AlphaSights, Rupert Case Management, Bernstein和ALDA的费用。A.M.是Offline Ventures的投资者和非正式顾问,也是EPIQ的客户。马森实验室得到了Juno Therapeutics、Epinomics、赛诺菲、葛兰素史克、吉利德和Anthem的研究支持。S.G.与Tessa Therapeutics签订了咨询协议,是Immatics的有偿DSMB成员,并在过去两年内从Tidal, Catamaran Bio和Novartis获得了酬金。 The Gottschalk laboratory has received research support from Tessa Therapeutics. A.T.S. is a scientific founder of Immunai and founder of Cartography Biosciences and receives research funding from Arsenal Biosciences, Allogene Therapeutics and Merck Research Laboratories. H.O. has been a compensated consultant within the last 2 years for Bristol-Myers Squibb, Alexion Pharmaceuticals, Amal Therapeutics, Servier Pharmaceuticals, Neuvogen and Eureka Therapeutics. J.C., E.S., A.A. and A.M. are listed as inventors on a world patent application (WO2020014235A1) related to this work,t细胞免疫治疗的基因靶点gydF4y2Ba该公司已获得许可。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢Jason Moffat和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
扩展数据图1 T细胞耐药性的多个全基因组CRISPR筛选。gydF4y2Ba
一个gydF4y2Ba必需基因缺失gydF4y2Ba19gydF4y2Ba跨屏幕条件。x轴为每个屏幕上CFSE低细胞对CFSE高细胞的log2倍变化,y轴为每个bin中必需基因的数量。正如预期的那样,在原代人T细胞的CRISPR KO筛选中,必需基因倾向于LFC为阴性(Stim和Tregs筛选n = 4人,腺苷、环孢素和他克莫司筛选n = 2人,TGFβ筛选n = 1人。归一化富集分数(NES)和调整后的p值(GSEA和双侧排列检验)。gydF4y2BabgydF4y2Ba屏幕点击量在人类T细胞中表达。x轴为每个屏幕的log2倍变化,y轴为激活的人T细胞的表达gydF4y2Ba20.gydF4y2Ba.阳性和阴性抗体都倾向于在人T细胞中高表达,这表明这些合并的KO筛查指向了相关的T细胞生物学(n = 4人用于Stim和Tregs筛查,n = 2用于腺苷、环孢素和他克莫司筛查,n = 1用于TGFβ筛查,点为平均+/−SEM)。gydF4y2BacgydF4y2Ba,跨屏幕条件(x轴)的共享命中(y轴)(z评分> 1.5,方法),包括每个单独屏幕的唯一命中。每个子集的共享点击在补充表中详细说明gydF4y2Ba1克ydF4y2Ba.gydF4y2BadgydF4y2Ba,所有筛选条件下基因水平z分数的成对皮尔逊相关系数的热图。gydF4y2BaegydF4y2Ba,火山图显示y轴上的p值(MAGeCK RRA单侧测试和方法),x轴上的基因水平z评分,比较每种抑制条件下的高分裂细胞与载药条件下的高分裂细胞。突出显示的是发现特定于腺苷和TGFβ筛选的基因,选择用于进一步验证。gydF4y2BafgydF4y2Ba来自筛选的基因靶点被选择为一般(PAN)或更特定于某些抑制环境,并在T细胞中单独敲除。用CFSE染色,Cas9 rnp电穿孔编辑的T细胞在不同的抑制条件下进行刺激和培养。在每种抑制条件下,与对照细胞相比,每种基因KO的细胞增殖百分比(n = 2个供体,每个基因靶点2个sgrna,三次重复)。我们使用FDR调整p值的截止值< 0.05,强调了在预测条件下(腺苷、TGFB和钙/钙调磷酸酶抑制剂-他克莫司和环孢素)发现具有显著耐药性的基因KOs。为清晰起见,显示的是基因靶标根据其抑制筛选条件的显著p值,但所有基因在不同条件下的结果详细列在补充表中gydF4y2Ba3 gydF4y2Ba).正如预期的那样,ADORA2A、TGFBR1和TGFBR2、FKBP1A和PPIA KOs分别在腺苷、TGFB、他克莫司和环孢素条件下产生耐药性。PDE4C和NKX2-6 KO被发现在腺苷条件下具有相对选择性的耐药性,而NFKB2 KO被发现在钙调神经磷酸酶抑制剂(他克莫司和环孢素)条件下增加耐药性。TMEM222虽然在筛选中得分很高,但在该阵列验证中并没有增加增殖优势(点为个体重复,黑色垂直线为平均值,*p < 0.05, **p < 0.01, ***p < 0.001, ***p < 0.0001,用于双侧非配对学生t检验)。gydF4y2BaggydF4y2Ba在这里显示的不同抑制筛选条件下,针对RasGAP基因或RasGEF RASGRP1的指南的对数折叠变化(LFC)。gydF4y2BahgydF4y2Ba, BioGPS数据集中可用的RasGAP家族成员的表达水平(最小为0,最大为1)gydF4y2Ba27gydF4y2Ba包括RASA2在内的健康人体组织的检测结果显示,RASA2在CD8中选择性表达gydF4y2Ba+gydF4y2Ba/ 4gydF4y2Ba+gydF4y2Ba人类T细胞。数据还显示了RASGRP1,一个在TCR信号传导中具有明确作用的RasGEF,其表达模式与RASA2惊人地相似。gydF4y2Ba
扩展数据图2 RASA2被验证为T细胞靶点,可以抵抗抑制条件。gydF4y2Ba
一个gydF4y2Ba, Western blot显示来自4名献血者的T细胞中RASA2消融水平。gydF4y2BabgydF4y2Ba对于两个独立的人类供体(D1和D2), RASA2 KO T细胞比对照T细胞具有刺激依赖性增殖优势。gydF4y2BacgydF4y2Ba, CFSE染色痕迹显示,与载体条件相比,抑制条件如何抑制T细胞增殖,对于一个代表性的人T细胞供体。我们注意到,尽管RASA2-KO和control-edited (CTRL) T细胞都受到不同程度的抑制信号的抑制,但RASA2-KO T细胞在每种条件下都保持一致的增殖优势。gydF4y2BadgydF4y2Ba, y轴上的门控CFSE低(分裂)细胞在x轴上的一系列抑制条件下的总结(平均+/- SEM, 3个重复n = 2个供体)。gydF4y2BaegydF4y2Ba在抑制分子存在的情况下,通过ny - eso -1特异性1G4 TCR-T细胞进行癌症杀伤试验。线条显示活细胞显微镜检测到的A375-RFP+癌细胞的数量,按t = 0时的计数归一化。灰色区域表示一个有代表性的捐赠者进行3次技术重复的95%置信区间。gydF4y2BafgydF4y2Ba, Treg抑制试验。受刺激的CD8 T细胞用CFSE染色,以跟踪其与抑制treg共培养时的增殖情况。来自四种不同的人类供体的T细胞横列显示,行中显示Tregs:CD8比率。gydF4y2BaggydF4y2Ba, treg存在下效应T细胞抗癌实验示意图。gydF4y2BahgydF4y2Ba,癌细胞杀伤(由癌细胞生长曲线的1比例AUC计算)显示在一系列Tregs:CD8比率的y轴上。横线为平均值,圆点为单个井(CTRL =非靶向指南,n = 4个人类供体,每个供体2个重复,双面Wilcoxon检验**p < 0.01, ***p < 0.001)。gydF4y2Ba
RASA2是Ras-MAPK信号的TCR刺激依赖衰减器。gydF4y2Ba
一个gydF4y2BaWestern blot显示,在TCR刺激或不刺激时,RASA2消融对原代人T细胞中活性Ras水平的影响。gydF4y2BabgydF4y2Ba,所有3个T细胞供体的p- mek和p- erk western计算的密度测量值和平均值(平均值±SEM, *p < 0.05, **p < 0.01,双面配对T检验)gydF4y2BacgydF4y2Ba, Western印迹显示,在来自(b)的3名人类供体的原代人T细胞中进行TCR刺激后,随着时间的推移,RASA2消融与对照编辑的T细胞相比对磷酸化mek和磷酸化erk的影响。gydF4y2BadgydF4y2Ba,流式细胞术显示TCR刺激后2个人供体T细胞中Ras信号通路磷酸化蛋白的代表性门控。gydF4y2BaegydF4y2Ba, TCR刺激后Ras信号通路中磷酸化蛋白随时间变化的MFI总结。y轴表示每个标记物的MFI除以FSC-A的MFI以标准化细胞大小(平均+/−SEM, 3个重复n = 2个供体,双面Wilcoxon检验**p < 0.01)。gydF4y2BafgydF4y2Ba,来自2名捐赠者的T细胞在培养基中扩增13天后分裂成含有或不含IL2的培养物,并随着时间的推移跟踪其活力。线是平均值,单个点是重复的。gydF4y2BaggydF4y2Ba,受刺激T细胞和未受刺激T细胞的pERK、CD69和CFSE的流式细胞仪直方图图。RASA2 KO和对照编辑T细胞的基线水平保持相似(除了CD69水平的可变性),而CD3/CD28刺激后,RASA2 KO T细胞显示出高于CTRL KO T细胞的pERK、CD69和增殖水平。结果代表4名人类捐献者。我们注意到供体在基线时CD69的异质表达,其中一些在RASA2 KO T细胞中表现出略高的水平。gydF4y2Ba
图4 RASA2消融增加了对抗原刺激的敏感性。gydF4y2Ba
一个gydF4y2Ba,流式细胞术图显示受控(CTRL)和RASA2 KO T细胞中细胞因子的门控(下一行)和不受PMA刺激(上一行)。gydF4y2Bab,左:gydF4y2Ba用滴定浓度的抗cd3 /CD28复合物刺激TCR后10分钟,流式细胞仪测定磷酸化ERK水平(y轴)(1:1为25 μ l/ml, n = 2个T细胞供体,线显示4参数logistic拟合);gydF4y2Ba中间:gydF4y2Ba用滴定浓度的抗cd3 /CD28复合物(1:1 = 25 μ l/ml免疫培养,n = 2个T细胞供体)刺激18小时后测定T细胞活化标志物CD154阳性细胞的百分比;gydF4y2Ba正确的:gydF4y2Ba抗cd3 /CD28复合物刺激后3天根据CFSE谱进行分裂的细胞百分比(n = 2个T细胞供体,三份,线显示4参数逻辑拟合,来自双样本Kolmogorov-Smirnov检验的p值)。gydF4y2BacgydF4y2BaCD19 CAR- t细胞产生的模式,CAR被敲入gydF4y2BaTRACgydF4y2Ba轨迹gydF4y2Ba46gydF4y2BaRASA2和AAS1被Cas9 RNPs靶向。gydF4y2BadgydF4y2Ba, CAR敲入策略后CD19-CAR阳性T细胞的流式细胞术图(gydF4y2BacgydF4y2Ba).gydF4y2BaegydF4y2Ba,gydF4y2BaTRACgydF4y2BaCAR-T细胞杀伤被设计表达不同CD19水平的目标Nalm6细胞(行),在活细胞显微镜下通过增加CAR-T:Nalm6比率(列)测量膜联蛋白水平超过48小时(两个代表性供体中的一个,3个技术重复,误差条为平均值±标准差)。gydF4y2BafgydF4y2Ba,在一系列效应T细胞与靶细胞比率的y轴上显示的癌细胞杀伤总结(膜联蛋白水平的缩放AUC)。横线为平均值(n = 2个人类供体,每个供体为三次,*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001,对于双面未配对的Student 's t检验,形状表示供体)。gydF4y2Ba
图5 RASA2敲除促进转录重编程,急性和慢性抗原刺激对RASA2表达有差异调节。gydF4y2Ba
一个gydF4y2Ba,在抗cd3 /CD28复合物(柱)滴定稀释(1:1 = 25 μ l/ml)超过72小时的TCR刺激后(点表示3次技术重复,p值来自双样本Kolmogorov-Smirnov测试),三种不同的mCherry报告细胞系对转录因子反应的Jurkat细胞的阳性比例(如图所示)。gydF4y2BabgydF4y2Ba,通过RNA-Seq测定,火山图显示RASA2 KO和对照编辑刺激T细胞之间的差异调控基因。经DESeq2分析(方法),高亮基因BH调整,双尾Wald检验p值< 0.0001,绝对log2倍变化> 1。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba氧化磷酸化(c)和糖酵解(d)基因集富集分析(GSEA)排序基因,基于DESeq2,排序越高表明RASA2 KO富集超过CTRL。p值显示为由双侧置换检验确定。每个富集中最高上调的基因列在每个面板的右侧gydF4y2BaegydF4y2Ba, GSEA与氧化磷酸化基因相关gydF4y2BaRASA2gydF4y2BaGEO表达数据库中免疫细胞的表达,由correlationAnalyzeR(方法)检索。基因之间的Pearson相关系数进行排序gydF4y2BaRASA2gydF4y2Ba查询基因,p值经双侧置换检验,经FDR调整。gydF4y2BafgydF4y2Ba的表达例子gydF4y2BaRASA2gydF4y2Ba还有两个线粒体适应性基因,gydF4y2BaMRPL27gydF4y2Ba(左面板)和gydF4y2BaMRPL14gydF4y2Ba(右图)来自免疫细胞的GEO数据集。顶部显示的是每个散点图的Pearson相关系数(R)和FDR调整p值(padj)。值表示方差稳定变换(VST)后的表达式。gydF4y2BaggydF4y2Ba通过发表的单细胞RNA-Seq数据集测量,两名人类供体的受刺激T细胞与未受刺激T细胞中RASA2的表达gydF4y2Ba13gydF4y2Ba.gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,表示gydF4y2BaRasa2gydF4y2Ba相比gydF4y2BaPdcd1gydF4y2Ba在已发表的RNA-Seq数据集中,从小鼠T细胞的T细胞衰竭模型。对每个数据集中的每个基因的表达量进行缩放,最大值为1,最小值为0(对于(h)内的LCMV样本:Naive组n = 2只小鼠,exhaustion组n = 3只小鼠;对于OVA样本,误差柱为均值±SEM (i):各组n = 3只小鼠,误差柱为均值±SEM)。gydF4y2BajgydF4y2Ba在细胞因子产生的CRISPRa和CRISPRi筛选中,RASA2 sgrna的对数折叠变化(LFC)值gydF4y2Ba42gydF4y2Ba(MAGeCK的基因水平FDR列在每个屏幕上的RASA2)。gydF4y2BakgydF4y2Ba, Western blot检测随后的RASA2表达水平gydF4y2BaRASA2gydF4y2Ba转基因或控制(CTRL)转导在两个T细胞供体。gydF4y2BalgydF4y2Ba,基于RASA2转基因T细胞与GFP对照T细胞计数的T细胞扩张归一化值(n = 3人T细胞供体,均值±SEM,形状为供体)。gydF4y2Ba米gydF4y2Ba(l)中描述的一个样本供体的直方图,染色并分析CD69激活标记的FACS。gydF4y2BangydF4y2Ba,两例经RASA2转基因转导的T细胞供体与对照(n = 2例人T细胞供体,形状为供体)中CD69水平的总结数据。gydF4y2Ba
图6重复肿瘤刺激实验显示,RASA2消融可将T细胞从功能失调状态中拯救出来。gydF4y2Ba
一个gydF4y2Ba,与A375个肿瘤细胞重复共培养后,NY-ESO-1特异性1G4 TCR-T细胞的指标,包括CD8、NY-ESO-1 1G4 TCR和活化标记CD25的阳性百分比(通过流式细胞术评估,n = 4个T细胞供体,系均值±SEM)。gydF4y2BabgydF4y2Ba所选基因的基因表达水平,包括gydF4y2BaRASA2gydF4y2Ba(n = 3个供体TCR-T细胞和n = 3个供体CAR-T细胞,均值±SEM)。gydF4y2BacgydF4y2Ba, T细胞活力,采用流式细胞术活/死染色测定,比较RASA2 KO和对照(CTRL) T细胞(n = 4个供体,均值±SEM,双侧Wilcoxon检验*p < 0.05, **p < 0.01)。gydF4y2BadgydF4y2Ba与对照细胞相比,经过多次刺激的RASA2 KO T细胞显示出更高水平的磷酸化ERK和CD69 (n = 2个供体)。gydF4y2BaegydF4y2Ba与A375肿瘤细胞共培养6次,流式细胞术检测p- erk和CD69阳性T细胞比例(n = 2个供体,均数±SEM,双面Wilcoxon检验*p < 0.05)。gydF4y2BafgydF4y2BaWestern blot检测每次重复CD3/CD28刺激后T细胞p-ERK和p-MEK水平。gydF4y2BaggydF4y2Ba,与目标肿瘤细胞共培养6次后,ny - eso -1特异性TCR-T细胞(上排)和cd19特异性CAR-T细胞(下排)中多种效应细胞因子(下方标记)的流式细胞术数据。gydF4y2BahgydF4y2Ba,与A375肿瘤细胞共培养6次后,2例供体中ny - eso -1特异性T细胞中CD62L水平的直方图。gydF4y2Ba我gydF4y2Ba通过流式细胞术检测T细胞多次刺激后细胞表达耗损相关标志物的百分比,RASA2 KO与control-edited (CTRL) T细胞的表达水平相似(n = 4个供体,均值±SEM, *p < 0.05,双侧Wilcoxon检验ns = p > 0.05,形状表示供体)。gydF4y2Ba
图7 RASA2 KO T细胞的代谢适应度。gydF4y2Ba
一个gydF4y2Ba在RASA2 KO或对照编辑的T细胞(n = 3个独立供体)进行5次刺激后,RNA-Seq分析的火山图(x轴上为log2倍变化,y轴上为-log10未调整的p值,来自双尾Wald测试)。我们注意到,与对照编辑的T细胞相比,RASA2 KO中的TCF7较低,多个线粒体适应性基因在RASA2缺失后上调。gydF4y2BabgydF4y2Ba,通过流式细胞仪测量NY-ESO-1 TCR-T和CD19 CAR-T细胞在重复癌症靶点刺激后的线粒体质量(Mitotracker绿色)和线粒体膜电位(Mitotracker红色CMXRos)的MFI。(n = 2人供体,CAR-T细胞2个技术重复,TCR-T细胞5个技术重复,双面Wilcoxon检验*p < 0.05, ***p < 0.001)。gydF4y2BacgydF4y2Ba,海马线粒体应激试验测定CD19 TRAC-CAR - T细胞的耗氧率(OCR)痕迹,这些细胞未暴露于癌细胞(休息)或暴露于6次重复的肿瘤刺激。箭头表示每个抑制剂的添加量:寡霉素1.5 μM (Olig.), FCCP 1μM,鱼藤酮/抗霉素A 0.5 μM (R/A) (n = 6个技术重复,一个代表的T细胞供体为两个,系为平均值±标准差)。gydF4y2BadgydF4y2Ba,海马mito应激试验中平均基础OCR、最大OCR和备用呼吸能力(SRC)水平(一个代表性T细胞供体为2个,n = 6个技术重复,系均值±SD,双侧Wilcoxon试验为*p < 0.05, **p < 0.01)。gydF4y2BaegydF4y2Ba,与(d)相同的实验,但此处显示细胞外酸化率(ECAR)。SGC =备用糖酵解能力(一个代表性T细胞供体为2个,n = 6个技术重复,系均值±SD,双面Wilcoxon检验**p < 0.01。gydF4y2BafgydF4y2Ba,海马底物氧化应激测试在CD19 CAR-T细胞与癌细胞共培养前或癌细胞靶点重复刺激6次后进行的OCR测量(n = 1人供体,每种条件6个技术重复,**p < 0.01, ****p < 0.0001为单向方差分析测试)。底物抑制剂包括4 μM Etomoxir (XF长链脂肪酸)、2 μM BPTES(谷氨酰胺)和3 μM UK5099(葡萄糖/丙酮酸)。gydF4y2Ba
扩展数据图8重复靶癌细胞暴露后,消融RASA2保留了T细胞的癌细胞杀伤能力。gydF4y2Ba
一个gydF4y2Ba癌细胞杀伤实验显示,对照编辑的ny - eso -1特异性TCR-T细胞在多次刺激后未能控制癌细胞的扩张,而RASA2消融导致了持久的杀伤能力。1、3、6次重复共培养后癌细胞死亡(列)以及一系列效应T细胞与目标癌细胞的比率(行)显示随时间的变化(每一个时间点为三份,线为平均值±标准差,线为广义加性模型拟合曲线,见方法)。gydF4y2BabgydF4y2Ba代表性的流式细胞仪直方图显示,与未受干扰的A375细胞(A375- wt为红色)相比,转染CD19的A375细胞(A375-CD19为青色)中CD19染色。gydF4y2BacgydF4y2Ba,在1次和6次重复癌细胞暴露后,靶细胞A375-CD19细胞生长曲线下面积与靶细胞比例范围的汇总统计(n = 3个重复供体,均值±SEM,双面Wilcoxon检验***p < 0.001)。gydF4y2BadgydF4y2Ba, (c)中CD19特异性CAR-T细胞在一系列效应T细胞与表达CD19的靶向A375-CD19黑素瘤细胞进行1次和6次重复共培养后的癌症杀伤试验的代表性数据。gydF4y2BaegydF4y2Ba,来自一个CAR-T细胞供体的代表性数据,用于靶向Nalm6白血病细胞的癌症杀伤试验(每个时间点为三份,线为平均值±标准差)。gydF4y2BafgydF4y2Ba,活细胞显微镜检测到癌细胞随时间的变化。重复刺激后,来自两个供体的CD19 CAR-T细胞与未受干扰的靶细胞(A375-WT)或经工程改造表达CD19的等基因细胞系(A375-CD19)共同培养。在抗原阴性的情况下,RASA2 KO或CTRL T细胞均未观察到癌细胞死亡。线是3个技术重复的平均值。gydF4y2BaggydF4y2Ba, (f)中数据的量化,对于生长曲线下的面积(y轴),跨多个效应T细胞与目标癌细胞的比例(x轴)(n = 2个供体,均值±SEM,形状表示供体)。gydF4y2Ba
扩展数据图9 TCR-T和CAR-T细胞中的RASA2消融改善了肿瘤控制gydF4y2Ba在活的有机体内gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba,通过卡尺测量植入1x10的NSG小鼠随时间的个体皮下肿瘤生长情况gydF4y2Ba6gydF4y2BaA375黑色素瘤细胞,静脉注射1x10gydF4y2Ba6gydF4y2Bany - eso -1特异性1G4 TCR-T细胞(n =每组6只小鼠)。gydF4y2BabgydF4y2Ba, (a)所示小鼠存活率,log-rank检验精确p值。gydF4y2BacgydF4y2Ba,在植入0.3x10的NSG小鼠中,通过生物发光(BLI作为总通量)测量个体肿瘤生长随时间的变化gydF4y2Ba6gydF4y2BaNalm6白血病细胞(经工程改造表达NY-ESO-1),并注入0.5x10gydF4y2Ba6gydF4y2Bany - eso -1特异性TCR-T细胞(RASA2组n = 5只,CTRL组n = 4只)。gydF4y2BadgydF4y2Ba, (c)所示的两个队列小鼠的存活率,通过对数-秩检验的精确p值。gydF4y2BaegydF4y2Ba流式细胞术数据显示注射Nalm6小鼠前T细胞中CD19-CAR阳性水平。使用百分比来调整每只小鼠的CAR+ T细胞数量相等的目标。gydF4y2BafgydF4y2Ba,在植入0.5x10的NSG小鼠中,单个肿瘤随时间的生长gydF4y2Ba6gydF4y2BaNalm6白血病细胞,注射0.2x10gydF4y2Ba6gydF4y2Bacd19特异性CAR-T细胞(每组7只小鼠)。gydF4y2BaggydF4y2Ba使用生物发光成像(BLI)监测(f)中的肿瘤进展。gydF4y2BahgydF4y2Ba一组NSG小鼠携带Nalm6白血病细胞,注射来自独立献血者的cd19特异性CAR-T(对照编辑的CAR-T细胞每组n = 8只小鼠,RASA2编辑的CAR-T细胞每组n = 7只小鼠),随着时间的推移,单个肿瘤生长。gydF4y2Ba我gydF4y2Ba, (h)所示小鼠存活率,log-rank检验精确p值。gydF4y2BajgydF4y2Ba, CD4gydF4y2Ba+gydF4y2Ba和CD8gydF4y2Ba+gydF4y2BaCAR-T细胞输注后第7天和第16天nalm6小鼠骨髓分离CAR-T细胞的百分比组成(第7天:CTRL组n = 5, RASA2组n = 6, 16天:CTRL组n = 6, RASA2组n = 6,误差条均值±SEM, *p < 0.05, **p < 0.01, ***p < 0.001,双侧Wilcoxon检验****p < 0.0001)。gydF4y2BakgydF4y2Ba, (j)队列CAR-T细胞CD45RA和CD62L染色的分化情况(每组n = 6个,均值±SEM,双面Wilcoxon检验*p < 0.05, **p < 0.01, TSCM = CD62L+CD45RA+, TCM = CD62L+CD45RA-, TEM = CD62L-CD45RA-, TEMRA/EFF = CD62L-CD45RA+)。gydF4y2BalgydF4y2Ba,输入混合细胞群的门控gydF4y2Ba在活的有机体内gydF4y2Ba竞争分析。T细胞首先被CAR门控gydF4y2Ba+gydF4y2Ba细胞,然后是EGFR+/-群体。输入的混合1和混合2分别含有~50/50%的AAVS1和RASA2 KO CAR-T细胞,EGFRt分别位于不同的混合种群中进行鉴定。gydF4y2Ba米gydF4y2Ba,两种不同的混合CAR- t细胞群在输注到携带nalm1的小鼠后第7天和第16天从骨髓中分离出来,并对CAR和EGFRt标记进行染色,以确定CTRL/RASA2 KO CAR- t细胞的百分比gydF4y2Ba在活的有机体内gydF4y2Ba(第7天:CTRL n = 6, RASA2 n = 6,第16天:CTRL n = 6, RASA2 n = 6,误差柱为均值±SEM,双侧Wilcoxon检验*p < 0.05, **p < 0.01)。gydF4y2Ba
扩展数据图10 RASA2消融术增强CAR-T细胞对肿瘤再攻的抵抗力,并具有类似的控制CAR-T细胞的安全性。gydF4y2Ba
一个gydF4y2Ba,含nalm6小鼠的BLI值为0.2x10gydF4y2Ba6gydF4y2Ba第一次注射Nalm6后的TRAC CAR-T细胞,没有任何再激发注射,以及接受0.2x10的Nalm6小鼠gydF4y2Ba6gydF4y2BaCAR-T细胞,然后进一步注射3次Nalm6再活化(1x10gydF4y2Ba6gydF4y2BaNalm6 /注射)。监测小鼠的肿瘤负荷(BLI水平)和存活率。在每个队列中,每组7只小鼠。箭头表示Nalm6白血病复发。gydF4y2BabgydF4y2Ba, (a)中所示BLI值的均值±SEM,直到对照队列中第一只小鼠死亡,双面非配对学生t检验*p < 0.05, **p < 0.01。gydF4y2BacgydF4y2Ba, (a,b)所示队列白血病再攻模型的生存分析。精确的p值对数秩检验。gydF4y2BadgydF4y2Ba,接受CAR-T细胞但未植入肿瘤细胞小鼠的体重随时间的变化(平均值±SEM, n = 2名人类供体,每组3只小鼠)。gydF4y2BaegydF4y2Ba,白细胞(WBC;K/μL),血红蛋白(Hb;g/dL),血小板(Plt;x10gydF4y2Ba4gydF4y2BaK/μL)为仅接受CAR-T细胞的小鼠(n = 2个人类供体,每组n = 3只小鼠)和接受肿瘤清除CAR-T细胞输注的小鼠(n = 1个人类供体,每组n = 6只小鼠,方框为上下四分位数,横线为中位数)。gydF4y2BafgydF4y2Ba,来自(e)小鼠骨髓和脾脏的代表性h&e。胸骨骨髓(40X放大)显示三谱系造血,这在所有动物中都是相似的。正如预期的那样,未患肿瘤的NSG小鼠的白色髓中很少有淋巴样细胞(图中可见血管周围很少有单个核细胞)(20倍放大下的脾脏)。NSG小鼠的红色髓中含有丰富的红系前体(图中可见大量细胞核致密暗的细胞)和巨核细胞。与未患癌的NSG小鼠相比,受体动物的红髓和白髓基本相似;在一些小鼠中,与各组无关,可见脾白髓部分扩张,与移植的淋巴样细胞一致。重要的是,与匹配的TRAC CAR-T对照细胞受体相比,RASA2 KO TRAC CAR-T细胞受体没有显示出淋巴样浸润增加的证据。gydF4y2BaggydF4y2Ba, epha2特异性CAR -逆转录病毒载体方案。4H5:识别EphA2的scFV。SSR:短间隔区。gydF4y2Bah。gydF4y2Ba通过流式细胞术检测CAR在基因靶向t细胞中的表达(CTRL n = 10, RASA2 n = 14)。gydF4y2Ba我gydF4y2BaWestern Blot分析RASA2 KO EphA2-CAR - T细胞与非靶向引导(CTRL)处理的T细胞的表达。测试了两种靶向RASA2的引导rna。gydF4y2BajgydF4y2Ba,来自主图的单个BLI轨迹。gydF4y2Ba4米gydF4y2Ba,一个供体使用RASA2 sgrna,另一个供体使用sgRNA1。gydF4y2BakgydF4y2Ba, (j)实验中未检测到BLI的小鼠再次注射1x10的第二次腹腔肿瘤注射gydF4y2Ba6gydF4y2BaLM7-ffLuc肿瘤细胞174天。图表显示定量生物发光成像(总通量)。虚线表示第二次肿瘤注射。gydF4y2Ba
补充信息gydF4y2Ba
补充图1gydF4y2Ba
西方blots的原始源图像。gydF4y2Ba
补充表1gydF4y2Ba
T细胞抑制筛选的基因和指导水平MAGeCK结果和共享命中分析的结果。gydF4y2Ba
补充表2gydF4y2Ba
特定条件命中的MAGeCK分析结果。gydF4y2Ba
补充表3gydF4y2Ba
阵列筛选验证的引导序列和结果。gydF4y2Ba
补充表4gydF4y2Ba
所有rna序列分析的差异基因表达结果。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
卡内瓦莱,J., Shifrut, E., Kale, N.。gydF4y2Baet al。gydF4y2BaRASA2gydF4y2Ba消融T细胞可以提高抗原敏感性和长期功能。gydF4y2Ba自然gydF4y2Ba609gydF4y2Ba, 174-182(2022)。https://doi.org/10.1038/s41586-022-05126-wgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05126-wgydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba