摘要gydF4y2Ba
脂肪组织与中枢神经系统沟通以维持全身能量平衡。主流观点认为,脂肪分泌的循环激素将代谢状态传递给大脑,大脑整合外周信息,通过去甲肾上腺素能交感神经输出调节脂肪细胞功能gydF4y2Ba1gydF4y2Ba.此外,背根神经节的体感觉神经元支配脂肪组织gydF4y2Ba2gydF4y2Ba.然而,由于缺乏选择性靶向这些神经元的遗传工具,人们对其生理重要性的认识有限。在这里,我们开发了病毒、遗传和成像策略,以特定器官的方式操纵小鼠的感觉神经。这使我们能够看到背根神经节从躯体到皮下脂肪细胞的整个轴突投影,建立了脂肪感觉神经支配的解剖学基础。在功能上,脂肪组织的选择性感觉消融增强了脂肪生成和热生成转录程序,导致脂肪垫扩大,米色脂肪细胞富集和热中性条件下体温升高。感觉消融诱导的表型需要完整的交感神经功能。我们假设,控制米色脂肪神经的感觉神经元通过对交感系统起到制动作用来调节脂肪细胞的功能。这些结果揭示了脂肪组织背根神经节神经支配的重要作用,并可能使未来的研究能够检查不同的内感受系统的感觉神经支配的作用。gydF4y2Ba
主要gydF4y2Ba
哺乳动物脂肪组织高度神经支配。这种神经支配主要是通过表达酪氨酸羟化酶(TH)和分泌去甲肾上腺素的交感神经纤维来研究其传出功能gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4gydF4y2Ba.这些交感神经纤维作用于β-肾上腺素能受体,并在调节棕色和米色脂肪的产热和脂质代谢方面具有公认的作用gydF4y2Ba5gydF4y2Ba.gydF4y2Ba
脂肪神经支配的传入功能尚不清楚。脂肪组织是为数不多的接受迷走感觉神经支配的内脏器官之一gydF4y2Ba2gydF4y2Ba.相比之下,来自背根神经节(DRGs)的体感纤维——最著名的皮肤和肌肉感觉——已被报道支配大鼠和仓鼠的脂肪组织gydF4y2Ba2gydF4y2Ba,gydF4y2Ba6gydF4y2Ba但这种神经支配的程度和重要性在不同物种之间仍有待确定gydF4y2Ba7gydF4y2Ba.虽然使用疱疹病毒追踪的开创性工作已经优雅地绘制了脂肪传入的中心投影gydF4y2Ba8gydF4y2Ba但是,这种感觉神经支配的功能重要性仍然不太清楚,因为传统的化学或外科手术对感觉纤维的去神经化只会导致仓鼠的轻微表型gydF4y2Ba2gydF4y2Ba,gydF4y2Ba9gydF4y2Ba.当我们开始了解DRG神经元的细胞和分子异质性时gydF4y2Ba10gydF4y2Ba脂肪组织gydF4y2Ba5gydF4y2Ba,早期经典去神经方法的特异性需要重新评估。例如,手术去神经不能区分感觉纤维和交感纤维束,而辣椒素去神经被认为是选择性地消融脂肪中的感觉纤维,可以靶向非神经元瞬时受体潜能香草酸(TRPV1)表达细胞gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.此外,辣椒素介导的去神经明显偏向于表达热敏感和痛觉trpv1的神经元(Aδ-和c纤维)。gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,可能会抑制功能丧失的表型gydF4y2Ba9gydF4y2Ba.相比之下,现在已知一个突出的非肽能DRG群体也表达THgydF4y2Ba16gydF4y2Ba,这对TH作为脂肪中交感神经纤维的选择性标记的使用提出了质疑。这些警告促使我们开发新的成像、分子和电路专用工具来检查脂肪组织中的感觉神经支配。gydF4y2Ba
直接可视化和描述DRG投影到脂肪gydF4y2Ba
在传统的追踪研究中,病毒或染料被注射到脂肪中,然后逆行运输回DRG体细胞,并通过组织学进行评估。这种间接测量很容易受到不同宿主示踪剂效率的影响,可能会导致在动物物种之间观察到的差异gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba.理想情况下,直接可视化从DRG体细胞到目标器官的整个投影,例如,通过轴突填充荧光团,将提供最可靠的解剖学证据。然而,小鼠DRG的外周分支在到达目标之前移动了几厘米,这使得使用传统的组织学无法可视化。我们最近开发了HYBRiD,专门用于大组织的整体荧光可视化gydF4y2Ba17gydF4y2Ba为直接表征从DRGs到脂肪的完整感觉神经分布铺平了道路。gydF4y2Ba
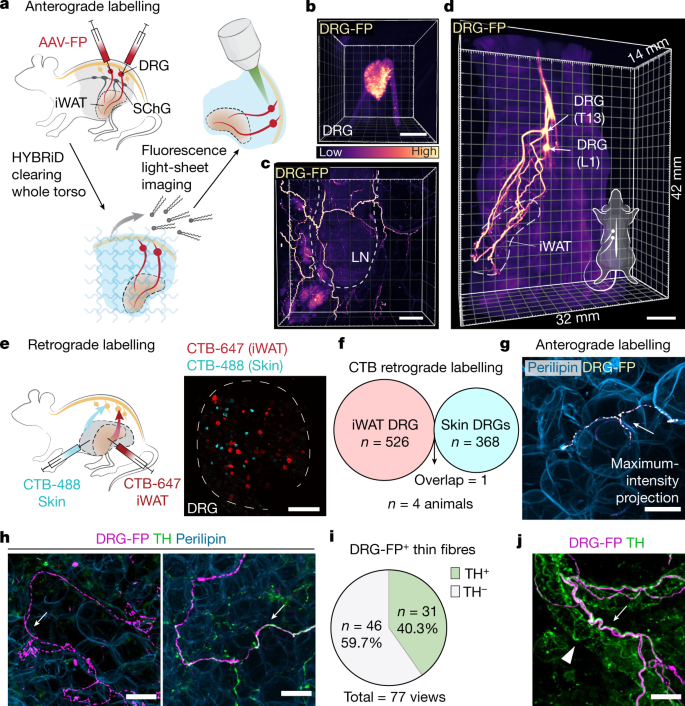
脂肪中选择性标记感觉神经的另一个障碍是常见的泛drg Cre转基因小鼠(如part -Cre, Scn10a-Cre, Advillin-CreERT2)gydF4y2Ba18gydF4y2Ba)也以交感神经元为目标(扩展数据图。gydF4y2Ba1gydF4y2Ba).因此,我们在小鼠中采用了一种三角节内DRG手术,直接将表达荧光蛋白的重组腺相关病毒(AAV)注射到单个DRG中,而不转导交感神经节(图2)。gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba1 bgydF4y2Ba).在接下来的研究中,我们重点研究了腹股沟白色脂肪组织(iWAT),这是一种米黄色脂肪垫,在小鼠生理学中具有公认的作用gydF4y2Ba19gydF4y2Ba.我们将表达荧光蛋白的AAV注射到胸腰椎DRGs(椎体T13和L1水平(T13/L1)。gydF4y2Ba6gydF4y2Ba),以瞄准所有来自这两个神经节的突出纤维。在对整个躯干进行整体HYBRiD清理和光片成像后(图。gydF4y2Ba1gydF4y2Ba),从DRG胞体到iWAT的整个1.2 cm的投影都可以被解析(图。gydF4y2Ba1罪犯gydF4y2Ba及补充视频gydF4y2Ba1gydF4y2Ba),明确表明胸腰椎DRGs直接支配iWAT(扩展数据图。gydF4y2Ba1 cgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,脂肪组织感觉神经支配图谱的工作流程。将AAV表达荧光蛋白(FP)的小鼠组织注射到T13/L1 DRGs(椎体T13和L1水平)中进行整体混合清理和荧光显微镜成像。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba, aav标记DRGs的代表性3D图像体积(T13),光片成像(gydF4y2BabgydF4y2Ba),共聚焦成像显示iWAT中的DRG纤维(以淋巴结为标志)(gydF4y2BacgydF4y2Ba)和成年小鼠躯干的DRG轴突投影(gydF4y2BadgydF4y2Ba).颜色梯度表明相对的强度。LN,淋巴结。gydF4y2BaegydF4y2Ba,来自iWAT和侧腹皮肤的双色CTB标签示意图(左)和drg的代表性全贴装图像(右,T13)。gydF4y2BafgydF4y2Ba从iWAT和皮肤中标记ctb阳性细胞数量的量化。gydF4y2BangydF4y2Ba= 4只老鼠。gydF4y2BaggydF4y2Ba,病毒标记的DRG纤维与脂肪细胞紧密对应的代表性图像。gydF4y2BahgydF4y2Ba, TH的代表图像gydF4y2Ba−gydF4y2Ba和THgydF4y2Ba+gydF4y2Ba实质DRG神经支配。gydF4y2Ba我gydF4y2Ba, TH百分比的量化gydF4y2Ba+gydF4y2BaDRG纤维(来自3个生物样本的13张图像中的77个视图)。gydF4y2BajgydF4y2Ba,病毒标记的DRG纤维沿脉管系统移动的代表图像。白色箭头标记DRG纤维,白色三角形标记th染色交感神经纤维。比例尺,200 μm (gydF4y2BabgydF4y2Ba而且gydF4y2BaegydF4y2Ba), 500 μm (gydF4y2BacgydF4y2Ba), 5毫米(gydF4y2BadgydF4y2Ba)和30 μm in (gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba而且gydF4y2BajgydF4y2Ba).gydF4y2Ba
此外,逆行霍乱毒素B亚单位(CTB)标记也用于确认成像结果。正如预期的gydF4y2Ba6gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba, iWAT主要接受T11-L3 DRGs和椎旁交感神经链神经节(SChGs)的感觉神经支配和交感神经支配;但不来自诺剂量神经节(迷走神经)或侧枝交感神经节(扩展数据图)。gydF4y2Ba2 a, bgydF4y2Ba).脂肪投射DRGs由多种神经元类型组成,并富含肽能纤维和髓鞘纤维(扩展数据图)。gydF4y2Ba2 h,我gydF4y2Ba).考虑到iWAT和皮肤之间的接近性(DRG的主要目标),我们检查了脂肪神经支配是否是皮肤感觉回路的一部分。来自iWAT和邻近侧翼皮肤的双色CTB标记显示,这两个器官由两个不重叠的DRG种群支配(图2)。gydF4y2Ba1 e, fgydF4y2Ba).内脏脂肪(附睾白色脂肪组织(eWAT))也在类似的椎体水平上接受感觉神经支配,但来自不同的人群(扩展数据图)。gydF4y2Ba2 d, egydF4y2Ba).总之,这些3D成像和逆行标记数据表明,胸腰椎DRGs中不同的神经元稳健地投射到脂肪组织。gydF4y2Ba
体积图像使我们能够在高水平的细节下检查脂肪组织中体感末梢的形态和拓扑结构(图。gydF4y2Ba1 g-jgydF4y2Ba).iWAT中的感觉纤维至少可以分为两种主要类型:(1)沿脉管系统传播的较大束(图2)。gydF4y2Ba1 jgydF4y2Ba和扩展数据图。gydF4y2Ba3 egydF4y2Ba(2)实质神经支配,感觉神经末端与脂肪细胞紧密相连(图2)。gydF4y2Ba1 g hgydF4y2Ba和扩展数据图。gydF4y2Ba3 dgydF4y2Ba).TH长期以来被认为是脂肪交感神经支配的交感标记物和代用品gydF4y2Ba4gydF4y2Ba,gydF4y2Ba7gydF4y2Ba.对于较大的束,感觉纤维与TH一起传播gydF4y2Ba+gydF4y2Ba交感神经纤维沿脉管系统分布,但很少像后者那样包裹血管gydF4y2Ba4gydF4y2Ba(无花果。gydF4y2Ba1 jgydF4y2Ba和扩展数据图。gydF4y2Ba3 egydF4y2Ba).值得注意的是,在实质部分,近40%靠近脂肪细胞的薄感觉末梢对TH免疫阳性(图。gydF4y2Ba1 h,我gydF4y2Ba和扩展数据图。gydF4y2Ba3 dgydF4y2Ba),挑战了传统观点,即TH是脂肪中唯一的交感神经标记,重要的是,这表明基于TH的早期研究可能被感觉神经支配所混淆,至少部分混淆。因此,考虑到这些发现,有必要建立脂肪组织中感觉神经支配的具体功能。gydF4y2Ba
选择性靶向脂肪感觉神经支配gydF4y2Ba
脂肪组织中的交感神经输出通过β-肾上腺素能受体起作用,使儿茶酚胺能神经毒素(如6-羟基多巴胺(6-OHDA))和肾上腺素能配体能够特异性地操纵它们的活动。相比之下,感觉纤维更加多样化,并对不同的感觉模式做出反应,因此不能基于单一的信号通路进行操作。因此,一种神经元特异性的,投影定义的遗传方法对于研究脂肪组织中的感觉神经支配是必要的。gydF4y2Ba
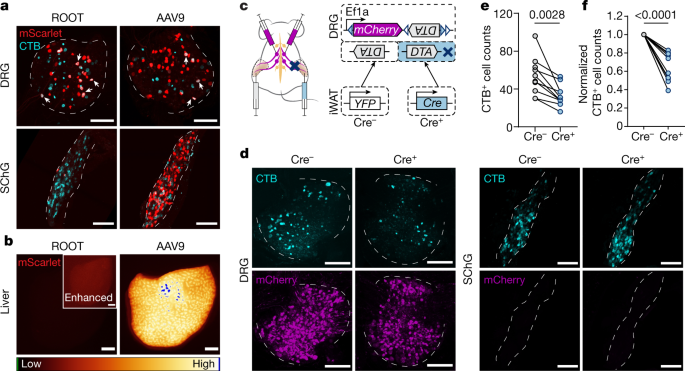
逆行Cre轴突靶注射和Cre依赖有效载荷的体细胞表达的组合已被广泛用于操纵大脑中的投影特异性电路。然而,传统的外周病毒示踪剂,如伪狂犬病毒和单纯疱疹病毒具有剧毒,限制了它们在急性解剖制图之外的应用。在寻找适合长期功能操作的更新和更安全的病毒载体时,我们发现AAV9表现出从iWAT到DRGs的高度逆行潜力(扩展数据图。gydF4y2Ba4gydF4y2Ba).我们采用了已发布的病毒工程管道gydF4y2Ba22gydF4y2Ba生成AAV9的随机突变体(扩展数据图;gydF4y2Ba4 b, cgydF4y2Ba).虽然我们最初的目的是提高从脂肪到DRGs的逆行效率,但进化出的用于器官示踪的新逆行载体(或ROOT)更可取,主要是因为它显著减少了在SChGs、对侧DRGs和肝脏中的脱靶表达(图2)。gydF4y2Ba2 a, bgydF4y2Ba和扩展数据图。gydF4y2Ba4 dgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba, iWAT中逆行标记的ROOT和AAV9的比较。gydF4y2Ba一个gydF4y2Ba,代表性的drg (T13)和schg (T12)全挂载图像,用ROOT-mScarlet或AAV9-mScarlet标记,iWAT连续注射CTB-647。一些AAV和CTB双阳性细胞用白色箭头突出显示。在T13/L1 DRGs中,CTB标记了26.42±6.49%的root标记神经元,9.95±0.92%的aav9标记神经元。数据为均数±s.e.m。gydF4y2BangydF4y2Ba每组4只。gydF4y2BabgydF4y2Ba, iWAT中注射了ROOT-mScarlet或AAV9-mScarlet的动物肝脏的代表图像。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BafgydF4y2BaiWAT drg cre依赖消融的组合病毒策略。gydF4y2BacgydF4y2Ba,单侧感觉消融的组合病毒策略示意图。每只小鼠双侧T13/L1 DRGs注射AAV-mCherry-flex-DTA,单侧iWAT注射ROOT-YFP或ROOT-Cre。术后3周,双侧iWAT内注射CTB-647。gydF4y2BadgydF4y2Ba,有代表性的对侧全贴装图像(CregydF4y2Ba−gydF4y2Ba)和同侧(CregydF4y2Ba+gydF4y2Ba) drg (T13)和schg (T12)。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba, CTB的量化gydF4y2Ba+gydF4y2Ba电话号码(gydF4y2BaegydF4y2Ba)和归一化的单元格数(gydF4y2BafgydF4y2Ba)在iWAT标记的T13和L1 drg中。gydF4y2BangydF4y2Ba= 10只老鼠。采用双尾配对进行统计分析gydF4y2BatgydF4y2Ba测试。gydF4y2BaPgydF4y2Ba值显示在顶部。为gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba而且gydF4y2BadgydF4y2Ba,比例尺,200 μm。gydF4y2Ba
ROOT提供了特异性切除脂肪中感觉神经支配的机会——我们将Cre-依赖的白喉毒素亚单位A (DTA)结构物(mCherry-flex-DTA)双侧注射到T13/L1 DRGs中,同时在iWATs中单侧注射表达Cre-或yfp的ROOT(图)。gydF4y2Ba2摄氏度gydF4y2Ba).在CTB量化的基础上,我们注意到Cre中脂肪投射神经元减少了约40%gydF4y2Ba+gydF4y2Ba同侧DRGs与对照侧比较(图;gydF4y2Ba2 d-fgydF4y2Ba),与以前的病毒DTA消融所达到的效率相当gydF4y2Ba23gydF4y2Ba.在schg中未观察到差异(图。gydF4y2Ba二维gydF4y2Ba和扩展数据图。gydF4y2Ba5gydF4y2Ba).重要的是,侧腹皮肤感觉末梢的结构和功能保持完整(扩展数据图。gydF4y2Ba5中gydF4y2Ba).总之,我们在iWAT中投影定义的部分感觉消融提供了一个特定的功能丧失模型来研究脂肪神经支配的drg。gydF4y2Ba
感觉消融后脂肪基因程序改变gydF4y2Ba
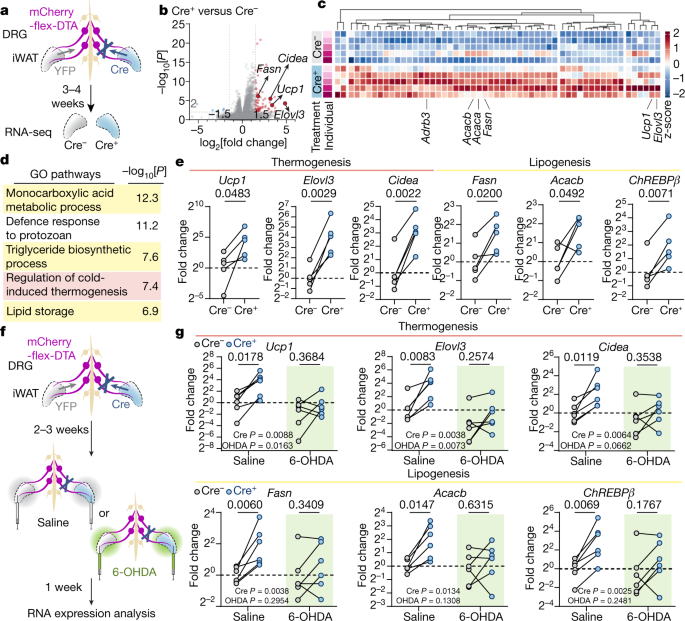
接下来,我们研究了感觉神经支配的丧失如何影响iWAT的分子程序。我们比较了感觉消融iWAT (CregydF4y2Ba+gydF4y2Ba)和未消融的对侧脂肪垫(YFPgydF4y2Ba+gydF4y2Ba)。在病毒注射后3-4周对脂肪垫进行rna测序(RNA-seq)分析。gydF4y2Ba3模拟gydF4y2Ba).无偏基因本体论分析显示,脂肪酸和脂质代谢以及冷诱导的产热途径(图2)。gydF4y2Ba3 dgydF4y2Ba)通过感觉消融增强。在个体基因水平上,成熟的热生棕色/米色细胞标记物在烧蚀侧显著上调,包括gydF4y2BaUcp1gydF4y2Ba(10.4倍,gydF4y2BaPgydF4y2Ba= 1.6 × 10gydF4y2Ba−4gydF4y2Ba),gydF4y2BaElovl3gydF4y2Ba(28.8倍,gydF4y2BaPgydF4y2Ba= 5.2 × 10gydF4y2Ba−5gydF4y2Ba),gydF4y2BaCideagydF4y2Ba(9.1倍,gydF4y2BaPgydF4y2Ba= 3.3 × 10gydF4y2Ba−6gydF4y2Ba).新生脂肪生成标记物(DNL)gydF4y2Ba24gydF4y2Ba,例如gydF4y2BaFasngydF4y2Ba(3.5倍,gydF4y2BaPgydF4y2Ba= 7.1 × 10gydF4y2Ba−7gydF4y2Ba),gydF4y2BaAcacbgydF4y2Ba(2.6倍,gydF4y2BaPgydF4y2Ba= 1.1 × 10gydF4y2Ba−4gydF4y2Ba),也显示表达升高(图;gydF4y2Ba3 b, cgydF4y2Ba).相反的脂质氧化和脂肪生成途径的同时激活是脂肪组织中一个独特但有充分记录的机制,以确保在寒冷或β-肾上腺素能刺激下产生热量的燃料可用性gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba.这些基因的mRNA表达,连同编码ChREBPβ的基因(gydF4y2BaMlxiplgydF4y2Ba;名为“gydF4y2BaChREBPβgydF4y2Ba),是DNL的转录主调控因子gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,经定量PCR (qPCR)证实,消融后iWAT升高(图。gydF4y2Ba3 egydF4y2Ba),但在非靶向eWAT或肩胛间棕色脂肪组织(iBAT)中则没有。gydF4y2Ba6 a、bgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba, cre依赖感觉消融后iWAT的转录谱分析。gydF4y2Ba一个gydF4y2Ba,转录谱图。对cre依赖性单侧感觉消融小鼠的iWAT进行RNA-seq分析。gydF4y2BabgydF4y2Ba, rna测序结果。采用Wald检验进行统计学分析。gydF4y2BacgydF4y2Ba, RNA-seq分析鉴定的上调基因热图。gydF4y2BadgydF4y2Ba基因本体(GO)富集分析上调基因。gydF4y2BaegydF4y2BaqPCR结合逆转录(RT-qPCR)分析单侧感觉消融后iWAT的产热和产脂基因。gydF4y2BangydF4y2Ba= 5只老鼠。采用双尾配对进行统计分析gydF4y2BatgydF4y2Ba测试。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,感觉消融和交感消融iWAT的转录分析。gydF4y2BafgydF4y2Ba,感觉和交感神经双重消融示意图。cre依赖性单侧感觉消融小鼠行双侧交感6-OHDA去神经。gydF4y2BaggydF4y2Ba, RT-qPCR分析有无交感神经去神经的iWAT中产热和产脂基因。gydF4y2BangydF4y2Ba每组6只。采用双向方差分析和Sidak多重比较检验进行统计分析。gydF4y2Ba
因为产热和脂肪生成程序都是交感神经信号的下游gydF4y2Ba24gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,我们接下来测试了感觉引起的基因表达变化是否依赖于完整的交感神经支配。我们双侧注射6- ohda -儿茶酚胺能毒素选择性交感神经去支配(扩展数据图)。gydF4y2Ba6 c, dgydF4y2Ba) -进入先前接受单侧感觉消融的小鼠的iWAT(图。gydF4y2Ba3 fgydF4y2Ba).这个双重消融实验表明,在6- ohda处理的动物中,感觉消融诱导的产热基因和脂肪生成基因被钝化(gydF4y2BaUcp1gydF4y2Ba: 9.4倍(生理盐水)至2.6倍(6-OHDA);gydF4y2BaElovl3gydF4y2Ba: 12.0倍至2.9倍;gydF4y2BaCideagydF4y2Ba: 4.7倍至1.8倍;gydF4y2BaFasngydF4y2Ba: 3.5- 1.6倍;gydF4y2BaAcacbgydF4y2Ba: 3.6- 1.4倍;gydF4y2BaChREBPβgydF4y2Ba: 6.7倍至2.5倍)gydF4y2Ba3 ggydF4y2Ba和扩展数据图。gydF4y2Ba6 e, fgydF4y2Ba),表明感觉调节的基因表达变化至少部分依赖于完整的交感神经功能。gydF4y2Ba
脂肪生理的感觉调节gydF4y2Ba
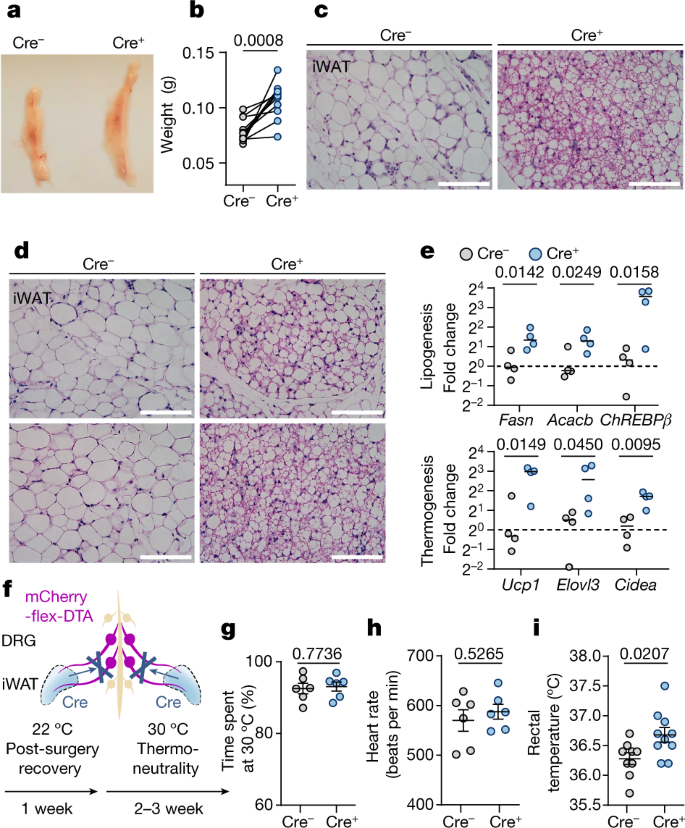
接下来,我们研究了感觉消融诱导的基因变化如何影响脂肪功能(图2)。gydF4y2Ba4得了gydF4y2Ba).我们观察到,在单侧感觉消融的iWAT中,激素敏感脂肪酶(HSL)的磷酸化水平较高,多房型米色脂肪细胞丰富。gydF4y2Ba4摄氏度gydF4y2Ba和扩展数据图。gydF4y2Ba7 d-fgydF4y2Ba),与生热程序的上调相一致(图;gydF4y2Ba3 gydF4y2Ba).这类似于冷暴露或β-肾上腺素能激动后iWAT的颜色。然而,在这些条件下,野生型脂肪垫通常会缩小,可能是由于比DNL更强的脂质利用。相比之下,我们观察到与对侧对照组相比,感觉消融iWAT的脂肪量增加(图2)。gydF4y2Ba4 a、bgydF4y2Ba和扩展数据图。gydF4y2Ba7得了gydF4y2Ba),表明感觉神经支配不仅抵消交感神经活动,而且可能在协调这两个相反的下游通路中发挥作用。gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,代表图像(gydF4y2Ba一个gydF4y2Ba)及脂肪量的量化(gydF4y2BabgydF4y2Ba) iWAT伴cre依赖性单侧感觉消融。gydF4y2BangydF4y2Ba= 11只老鼠。采用双尾配对进行统计分析gydF4y2BatgydF4y2Ba测试。gydF4y2BacgydF4y2BaiWAT伴cre依赖性单侧感觉消融组织学。gydF4y2BadgydF4y2BaiWAT组织学伴cre依赖双侧感觉消融。每个面板都来自不同的鼠标。gydF4y2BaegydF4y2Ba, RT-qPCR分析iWAT与cre依赖性双侧感觉消融。gydF4y2BangydF4y2Ba每组4只。采用双尾未配对进行统计分析gydF4y2BatgydF4y2Ba测试。gydF4y2Ba外:我gydF4y2Bacre依赖性双侧感觉消融后的生理测量。gydF4y2BafgydF4y2Ba双侧感觉消融示意图,生理测量时间线。gydF4y2BaggydF4y2Ba, Cre的两种温度选择试验(30°C与18°C)gydF4y2Ba−gydF4y2Ba(gydF4y2BangydF4y2Ba= 6)和CregydF4y2Ba+gydF4y2Ba(gydF4y2BangydF4y2Ba6)老鼠。gydF4y2BahgydF4y2Ba, Cre心率gydF4y2Ba−gydF4y2Ba(gydF4y2BangydF4y2Ba= 6)和CregydF4y2Ba+gydF4y2Ba(gydF4y2BangydF4y2Ba6)老鼠。gydF4y2Ba我gydF4y2Ba, Cre热中性时的直肠温度gydF4y2Ba−gydF4y2Ba(gydF4y2BangydF4y2Ba= 9)和CregydF4y2Ba+gydF4y2Ba(gydF4y2BangydF4y2Ba= 10)老鼠。为gydF4y2BaggydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba,数据为均数±s.e.m。采用双尾未配对进行统计分析gydF4y2BatgydF4y2Ba-测试韦尔奇修正(gydF4y2BaggydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba).为gydF4y2BacgydF4y2Ba而且gydF4y2BadgydF4y2Ba,比例尺,100 μm。gydF4y2Ba
单侧消融能够准确评估同一动物的脂肪表型。为了确定脂肪感觉神经支配如何影响全身生理,我们进一步在双侧iWAT中消融感觉神经支配。与单侧消融一致,我们观察到米色脂肪细胞的富集(图。gydF4y2Ba4 dgydF4y2Ba),并上调iWAT中脂肪生成和产热基因(图。gydF4y2Ba4 egydF4y2Ba和扩展数据图。gydF4y2Ba8 a、bgydF4y2Ba).这些动物被安置在小鼠热中性(30°C)下。gydF4y2Ba30.gydF4y2Ba(无花果。gydF4y2Ba4 fgydF4y2Ba),以消除其他体温调节机制(如背景棕色脂肪活动)的混淆效应。脂肪感觉消融没有导致体重、食物摄入量、温度敏感性或全身交感神经张力的显著变化(图。gydF4y2Ba4 g hgydF4y2Ba和扩展数据图。gydF4y2Ba8我gydF4y2Ba),但与对照组相比表现出升高的核心体温(图。gydF4y2Ba4我gydF4y2Ba),与iWAT的增强产热计划一致。有趣的是,体温差异在22°C时被归一化(扩展数据图。gydF4y2Ba8 cgydF4y2Ba),表明在热中性时体温升高并非由于中枢体温调节机制(发热)的缺陷。gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba.在高脂肪饮食挑战后,尽管体重略有差异,但与对照组相比,脂肪感觉消融小鼠表现出明显的糖耐量改善(扩展数据图)。gydF4y2Ba8 j-ngydF4y2Ba).这种葡萄糖耐量和体重不成比例的变化类似于prdm16在转基因模型中诱导变白的表型gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba这表明脂肪感觉消融可以通过米色脂肪相关机制保护小鼠免于饮食诱导的葡萄糖耐受不良。gydF4y2Ba
讨论gydF4y2Ba
传统观点认为,脂肪信号通过缓慢扩散的循环激素传递到大脑。在这里,脂肪中感觉神经支配的明确解剖学证据为潜在的快速、空间编码的神经传输从外周器官到大脑提供了电路基础。事实上,我们继续展示了DRG感觉神经元作为局部交感神经功能的抑制中断的证据,让人联想到迷走压力感受器在调节血压中的作用gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba.这些发现填补了中枢神经系统如何监控和协调脂肪功能的重要空白,突出了大脑-身体交流中一个被低估的分支的重要性。gydF4y2Ba
感觉通路如何机械地与交感神经信号相互作用仍有待确定。有研究表明,辣椒素对iWAT的去神经控制通过中枢回路改变了远端iBAT的交感神经输出gydF4y2Ba8gydF4y2Ba,gydF4y2Ba37gydF4y2Ba;然而,这一观察结果可能与交感神经张力的增加相混淆gydF4y2Ba38gydF4y2Ba由于外用辣椒素。相比之下,通过投影特异性消融,我们的脂肪表型在同侧iWAT中受到严格限制,但在远端iBAT或eWAT中没有(图2)。gydF4y2Ba3 gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba和扩展数据图。gydF4y2Ba5gydF4y2Ba而且gydF4y2Ba6gydF4y2Ba),表明感觉-交感神经相互作用的局部特异性(图。gydF4y2Ba3 f, ggydF4y2Ba).交感神经活动的感觉调节在其他器官中也有记载gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba在脊柱或椎骨上gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba.我们没有观察到感觉消融脂肪中总去甲肾上腺素含量的显著变化(扩展数据图。gydF4y2Ba8我gydF4y2Ba),这表明感觉活动可能作用于肾上腺素能受体下游的交感信号,尽管我们不能排除潜在的时空去甲肾上腺素变化,这不能通过单一的、大量的去甲肾上腺素测量来解决。此外,交感神经纤维的重塑是脂肪适应慢性代谢挑战的标志,感觉神经控制是否经历类似的过程仍有待测试,特别是在不同品系的小鼠以及跨物种的小鼠中。gydF4y2Ba
我们的研究提出了许多问题。体感觉神经系统的特征是主要存在于DRG的一阶神经元簇,最近的单细胞转录组显示其具有很大的分子异质性gydF4y2Ba10gydF4y2Ba,gydF4y2Ba44gydF4y2Ba.哪些DRG亚型支配脂肪,以及不同的亚型是否具有不同的功能(即调节产热与脂肪生成)目前尚不清楚。这可能在未来通过结合基于root的逆行靶向与单细胞RNA-seq来确定脂肪支配神经元的身份。这一信息也有助于识别脂肪神经元所感知的内感受信号。既往研究表明,通过FOS染色或体外记录,输注外源瘦素和游离脂肪酸可激活DRGsgydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba;然而,内源性信号(化学或物理)的识别可能需要使用上述建议的器官靶向单细胞RNA-seq方法充分理解假定的受体表达。此外,神经传递的性质也表明,这些内源性活动可能发生在秒级或毫秒级。因此,需要一种匹配能力来读出体内投影特异性DRG活动,以识别触发信号,例如,使用新兴的长期DRG钙成像技术gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba.gydF4y2Ba
我们的研究也有超越脂肪感觉神经支配的意义。内感觉的研究多从迷走神经节的角度进行gydF4y2Ba49gydF4y2Ba.越来越多的证据表明,内部器官的DRG神经支配也在内感受中起着至关重要的作用gydF4y2Ba50gydF4y2Ba.这里的发现可以作为研究DRG神经元在各种其他内部器官中的作用的原理证明。gydF4y2Ba
方法gydF4y2Ba
动物gydF4y2Ba
小鼠被安置在标准的笼子里,在12-12小时的光-暗循环下,自由地获得食物和水,室温保持在22°C左右,湿度保持在30-80%(未控制)。将小鼠单笼进行食物摄入测量,并在30°C下进行热中性暴露实验。本研究使用了来自以下品系的小鼠(年龄至少6周):野生型(WT) C57BL/6J (Jackson stock, 000664), B6.Cg-Gt(ROSA)26SorgydF4y2Batm9 (CAG-tdTomato) Hze / JgydF4y2Ba(杰克逊,007909,Ai9),皮尔特-克雷gydF4y2Ba51gydF4y2Ba, Scn10a-CregydF4y2Ba52gydF4y2Ba.雌雄小鼠均用于解剖制图研究,雄性小鼠用于gydF4y2Ba在活的有机体内gydF4y2Ba功能实验。所有的实验方案都得到了斯克里普斯研究所机构动物护理和使用委员会的批准,并符合美国国立卫生研究院的指导方针。gydF4y2Ba
病毒gydF4y2Ba
CAV2来源于CNRS Vector Core。raavretror - cre是从波士顿儿童医院和Janelia获得的。PHP。S-Cre, PHP。S-DIO-sfGFP (D. Gibbs的礼物)来自Janelia。PHP。S-TdTomato (Addgene, 59462), PHP。S-mScarlet(来自Deisseroth实验室,内部克隆),ROOT-Cre (Addgene, 51904), ROOT-EYFP(内部克隆),PHP。S-mCherry-flex-DTA (Addgene, 58536), ROOT-mScarlet, AAV9-mScarlet和PHP。S-mScarlet使用已发布的协议进行内部打包gydF4y2Ba53gydF4y2Ba.自制的aav经qPCR滴定后,加入6 ~ 10 μl,快速冷冻长期保存。gydF4y2Ba
根系的体内选择gydF4y2Ba
质粒gydF4y2Ba
用于体内选择的质粒改编自以前的出版物gydF4y2Ba54gydF4y2Ba.rAAV-pUBC-sfGFP-Cap和AAV2/9-REP-AAP由pUBC-mCherry-rAB (Addgene, 115239)、pUCmini-iCAP-PHP生成。S (Addgene, 103006), pAAV2/8 (Addgene, 112864)。由于DRGs和iWAT的解剖分离,没有使用in-cis-Lox模块或转基因Cre系。ROOT衣壳库是通过使用NNK简并引物(集成DNA技术)在AAV9的588和589位点之间通过Gibson组装随机插入七聚体生成的gydF4y2Ba54gydF4y2Ba.gydF4y2Ba
AAV衣壳库生产gydF4y2Ba
病毒库是按照前面描述的那样生成的gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba.总之,在HEK293FT (Invitrogen R70007)细胞中,每150 mm板转染rAAV-pUBC-sfGFP-Cap文库DNA仅为10 ng, 60 h后收集病毒进行纯化。gydF4y2Ba
DNA恢复和测序gydF4y2Ba
得到的AAV衣壳库于10时双侧注射入C57Bl/6J雄性小鼠的iWATgydF4y2Ba9gydF4y2Ba每个脂肪垫的病毒基因组(vg)。使用DNeasy血液和组织试剂盒(Qiagen)在注射后两周从注射小鼠的T12-L3 DRGs中恢复rAAV基因组。用Q5高保真聚合酶(New England Biolabs)对含有七聚体插入的片段进行了两轮扩增。在马萨诸塞州总医院对扩增产物进行清理和处理,进行完整的扩增子测序。gydF4y2Ba
NGS数据对齐和处理gydF4y2Ba
使用SAMtools将NGS运行的原始FASTQ文件与含有21 bp氨基酸588和589之间多样化区域的aav9模板DNA片段进行比对(v.1.10)。定量了所有七聚体插入恢复序列中每个21 bp序列的丰度。gydF4y2Ba
手术gydF4y2Ba
小鼠用异氟醚麻醉(4%用于诱导,1.5-2%用于维持),手术区域的皮肤剃除毛发,用乙醇和碘消毒。手术后,小鼠皮下注射氟尼新和局部抗生素软膏进行术后护理。gydF4y2Ba
感觉神经元的逆行示踪标记gydF4y2Ba
注射入iWAT时,在每侧侧皮肤上做一个侧面切口。为了注射入eWAT,在下腹壁上做了一个侧面切口。注射入iBAT时,在肩胛间区做正中切口。对于皮肤注射,进行皮内注射。所有逆行示踪均使用31G(点型2)针Hamilton注射器。每脂肪垫注射0.1%的CTB-488或PBS中CTB-647 (Invitrogen) 4 ~ 5 μl (iBAT为2 μl),或腹部皮肤注射8 ~ 15次,使示踪剂分散。分别缝合腹壁(注射eWAT时)和皮肤(注射iWAT、eWAT或iBAT时)。注射后3-5天取组织,使染料到达DRG体细胞。gydF4y2Ba
逆行病毒标记感觉神经元gydF4y2Ba
如上所述进行注射。对于病毒比较研究(扩展数据图。gydF4y2Ba3gydF4y2BaCAV2-Cre (4.2 × 10gydF4y2Ba12gydF4y2Ba物理粒子/ ml, 5 μl), PHP。S-Cre (1.6 × 10gydF4y2Ba13gydF4y2BaVGs / ml, 3 μl)gydF4y2Ba12gydF4y2BaVGs / ml, 5 μl)与0.01% FastGreen (Sigma-Aldrich)混合,单侧注射于Ai9小鼠iWAT中。AAV9-TdTomato (2 × 10gydF4y2Ba13gydF4y2BaVGs / ml, 2 μl)与0.01% FastGreen (Sigma-Aldrich)混合,单侧注射于WT小鼠iWAT中。gydF4y2Ba
ROOT的表征gydF4y2Ba
如上所述进行注射。对于根特性,AAV9或ROOT- mscarlet (4 × 10gydF4y2Ba13gydF4y2Ba以0.001% F-68和0.01% FastGreen的PBS单剂量给药WT小鼠iWAT。第一次手术后2周,在相同的iWAT脂肪垫中注射0.1%的CTB-647 4 μl,第二次注射后3-5天取组织定量。gydF4y2Ba
6-OHDA治疗gydF4y2Ba
6-OHDA以前曾用于选择性交感神经去支配gydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba.6-OHDA (Tocris) (12 mg mlgydF4y2Ba−1gydF4y2Ba在含0.02%抗坏血酸(Sigma-Aldrich)的生理盐水中),在使用前新鲜制备,并在没有光照的情况下冷藏。在每个iWAT脂肪垫中注射6-OHDA (8 μl)。对照组为0.02%抗坏血酸盐水。注射后7-9天取组织。gydF4y2Ba
神经节内注射DRGgydF4y2Ba
根据之前的报道,进行了腹内DRG注射gydF4y2Ba57gydF4y2Ba.在背部皮肤上做一个中线切口,以暴露背部肌肉。沿着椎体的肌肉被仔细分离以暴露drg。暴露T13和L1椎体水平DRGs, AAV (~1 × 10gydF4y2Ba13gydF4y2Ba在含有0.001% F-68和0.01% FastGreen的PBS中,用拉式玻璃移液管使用Nanoliter 2020注射器(世界精密仪器)将VGs / ml注入神经节(每个神经节约200 nl)。注意避免损伤周围的血管。背肌和皮肤分别缝合。PHP。S-TdTomato或者PHP。S-mScarlet用于顺行标记。gydF4y2Ba
i瓦特神经支配drg的cre依赖消融gydF4y2Ba
选择性消融i瓦特支配的DRGs, ROOT-Cre或ROOT-YFP (4 × 10gydF4y2Ba13gydF4y2Ba用0.001% F-68和0.01% FastGreen的PBS单侧或双侧注射iWAT, PHP注射VGs / ml, 2 μl)。S-mCherry-flex-DTA (1 × 10gydF4y2Ba13gydF4y2Ba如上所述,向T13和L1 DRGs双侧注射VGs / ml,每个神经节200 nl)。术后3-4周提取组织或进行生理测量。gydF4y2Ba
6-OHDA治疗和cre依赖感觉消融gydF4y2Ba
如上所述,将aav注射到iWAT和DRGs中以实现cre依赖的感觉消融。第一次注射后2 ~ 3周,再次向iWAT注射6-OHDA或生理盐水。第二次注射后7-9天提取组织。gydF4y2Ba
iWAT的整体杂交组织清除和免疫标记gydF4y2Ba
为了可视化小鼠躯干和iWAT样本中的感觉神经,使用前面描述的HYBRiD方法清除组织样本gydF4y2Ba17gydF4y2Ba.gydF4y2Ba
样品采集和预处理gydF4y2Ba
小鼠用异氟醚终末麻醉,心内灌注冰冷PBS和冰冷4% PFA, PBS加4%蔗糖(电子显微镜灌注固定剂,1224SK)。对于躯干样本,小心地去除皮肤,让iWAT附着在肌肉上,从中线切断脊髓,以方便清理和成像。所有采集的样品在4%的PFA中4°C固定1-2天,然后在PBS中洗涤。躯干样品在10% EDTA/15%咪唑中脱钙(4℃下7天),然后在25% N,N,N ',N ' -四(2-羟丙基)乙二胺(Quadrol) (1× PBS)中脱色(37℃下4天)。gydF4y2Ba
溶解和水凝胶包埋gydF4y2Ba
躯干和iWAT样品依次在25% Quadrol(在1× PBS中)的50%、70%、80%、95%和95%四氢呋喃中洗涤,100%二氯甲烷(DCM)、100% DCM、100% DCM、95%、95%、80%、70%和50%四氢呋喃中洗涤,然后再用1× PBS清洗任何剩余的有机溶剂。样品在A1P4水凝胶(1%丙烯酰胺,0.125% Bis, 4% PFA, 0.025% VA-044引发剂(w/v), 1× PBS中孵育4℃,氮气脱气,37℃聚合4 h。然后将样品从水凝胶中取出,在37°C下用pH 8.0含6% SDS的20 mM LiOH-Boric缓冲液被动清除,直到样品呈半透明。清理后,将样品在PBST (0.2% Triton X-100)中彻底清洗,然后进行折射率匹配或免疫标记。gydF4y2Ba
ImmunolabellinggydF4y2Ba
iWAT样品与PBST稀释的一抗在室温下孵育。一抗孵育后,在PBST中洗涤,然后在室温下用PBST稀释的二抗孵育。在折射率匹配和安装前,样品在PBST中进行了广泛的洗涤。使用以下抗体:抗perilipin-1 (Cell Signaling, 9349, 1:400),抗th -647 (BioLegend, 818008, 1:300);anti-Ucp1 (Abcam, ab10983, 1:200);anti-rabbit-488 (Jackson immune Research 711-546-152, 1;400);抗兔子-647(杰克逊免疫研究711-606-152,1:400)。gydF4y2Ba
折射率匹配和安装gydF4y2Ba
清除或免疫标记的样品在EasyIndex中折射率匹配(RI = 1.52, Life Canvas),并安装在间隔器(Sunjin Lab)中进行共聚焦显微镜成像或安装在琼脂糖中进行轻片显微镜成像。gydF4y2Ba
全装标本和冷冻切片的组织学分析gydF4y2Ba
小鼠用异氟醚终末麻醉,心内灌注PBS和4% PFA。对于腹部皮肤样本,皮肤被剃光,并使用Nair去除毛发。gydF4y2Ba
神经节和侧腹皮肤全贴装成像gydF4y2Ba
对感兴趣的神经节(DRGs, SChGs和腹腔/肠系膜复合体)进行解剖,并在RapiClear (Sunjin Lab)中使用硅胶间隔器(电子显微镜)进行共聚焦成像。剖开侧腹皮肤,PFA固定,PBS清洗三次,然后使用0.25 mm iSpacers (Sunjin Lab)在fluorommount - g (Invitrogen 00-4958-02)中安装共聚焦成像。gydF4y2Ba
皮肤切片免疫标记分析gydF4y2Ba
剖开侧翼皮肤,PFA固定后,30%蔗糖脱水后植入OCT, 25 μm切片,安装在明胶涂层载玻片上。为了进行免疫荧光分析,皮肤组织切片用5%正常驴血清在含0.3% Triton X-100的PBS中阻塞。在相同的阻断液中制备一抗并孵育过夜(抗-β iii -微管蛋白(Abcam, ab18207, 1:10 00)。第二天,切片在PBS中清洗,然后用二抗(anti-rabbit-647, Jackson immune Research, 711-606-152, 1:500)在室温下孵育2小时,用DAPI染色,然后用延金抗褪色mount (Invitrogen)安装用于共聚焦显微镜成像。gydF4y2Ba
DRG切片的免疫标记gydF4y2Ba
iWAT注射CTB-647小鼠T12 ~ L2 DRGs解剖后PFA固定,30%蔗糖脱水后OCT包埋,20 μm切片。DRG切片按照上述步骤进行染色,使用以下一抗:抗cgrp (Immunostar, 24112, 1:10 00),抗神经丝重肽(Abcam, ab4680, 1:10 00)。二抗和染料包括抗兔-594 (Jackson immune Research, 711-586-152,1:50 0),抗鸡-488 (Jackson immune Research, 703-546-155,1:50 0)和隔离素B4 AlexaFluor 488 (Life Technologies, I21411, 25µg mlgydF4y2Ba−1gydF4y2Ba).gydF4y2Ba
脂肪组织苏木精和伊红染色gydF4y2Ba
用异氟醚麻醉小鼠。提取iWAT、eWAT和iBAT,在4% PFA中4℃过夜固定。石蜡包埋,5 μm切片,载玻片。然后在Sanford Burnham Prebys组织学核心处用苏木精和伊红染色,并使用亮场显微镜成像。gydF4y2Ba
成像gydF4y2Ba
共焦显微镜gydF4y2Ba
使用Olympus FV3000共聚焦显微镜对iWAT标本、全贴装神经节、染色皮肤切片进行成像,使用以下物镜之一:×4/0.28 NA、air (XLFluor, Olympus);×10/0.6 NA,水浸(XLUMPlanFI,奥林巴斯)。使用Fluoview (v.2.4.1.198)获取图像。gydF4y2Ba
纸张显微镜gydF4y2Ba
躯干或iWAT样本使用1%琼脂糖/EasyIndex进行安装。安装的样品在充满EasyIndex并顶部用矿物油密封的SmartSPIM腔内成像。使用×3.6/0.2 NA物镜(lifeccanvas)获取图像,物镜尺寸为1.79 μm, 1.79 μm, 4 μmgydF4y2BaxyzgydF4y2Ba体素的大小。图像采集完成与双边照明沿对称中心平面内的样品。gydF4y2Ba
荧光立体显微镜gydF4y2Ba
使用Leica M165 FC立体显微镜和FLIR bbs - u3 - 51s51 - c相机对新鲜固定的肝脏样品进行成像。使用SpinView (v.2.5.0.80)获取图像。gydF4y2Ba
亮场显微镜gydF4y2Ba
用苏木精和伊红染色的载玻片使用Keyence BZ-X710显微镜和×40/0.6 NA物镜(CFI S Plan Fluor ELWD ADM,尼康)成像。gydF4y2Ba
转录分析gydF4y2Ba
RNA制备及RT-qPCR分析gydF4y2Ba
脂肪组织于12:00 - 14:00解剖,在液氮中快速冷冻。使用TRIzol (Invitrogen)和RNeasy Mini试剂盒(Qiagen)从冷冻组织中提取总RNA。RT-qPCR分析中,总RNA使用Maxima H - First Strand cDNA Synthesis Kit (Thermo Fisher Scientific)进行反转录。将得到的cDNA与引物(Integrated DNA Technology)和SyGreen Blue Mix (Genesee Scientific, 17-507)混合,使用CFX384实时PCR系统(BioRad)进行RT-qPCR。用ΔΔ计算归一化mRNA表达量gydF4y2BaCgydF4y2BatgydF4y2Ba方法,使用gydF4y2Ba真沸点gydF4y2Ba(编码tata -box结合蛋白)mRNA作为内参基因。在ΔΔ上进行统计分析gydF4y2BaCgydF4y2BatgydF4y2Ba.引物序列(正向序列和反向序列,分别为5’到3’)如下:gydF4y2Ba真沸点gydF4y2Ba(CCTTGTACCCTTCACCAATGAC和ACAGCCAAGATTCACGGTAGA);gydF4y2BaUcp1gydF4y2Ba(AGGCTTCCAGTACCATTAGGT和CTGAGTGAGGCAAAGCTGATTT);gydF4y2BaElovl3gydF4y2Ba(TTCTCACGCGGGTTAAAAATGG和GAGCAACAGATAGACGACCAC);gydF4y2BaCideagydF4y2Ba(ATCACAACTGGCCTGGTTACG和TACTACCCGGTGTCCATTTCT);gydF4y2BaFasngydF4y2Ba(GGAGGTGGTGATAGCCGGTAT和TGGGTAATCCATAGAGCCCAG);gydF4y2BaAcacbgydF4y2Ba(CGCTCACCAACAGTAAGGTGG和GCTTGGCAGGGAGTTCCTC);gydF4y2BaChREBPβgydF4y2Ba(tctgcagatcgcgtgggag和CTTGTCCCGGCATAGCAAC)。gydF4y2Ba
RNA文库制备及测序gydF4y2Ba
RNA文库制备和测序在斯克里普斯基因组中心进行。根据制造商推荐的方案,使用NEBNext Ultra Directional RNA Library Prep Kit for Illumina将总RNA样本制备成RNA-seq文库。简而言之,每个样品多聚(A)选择1 μg总RNA,将其转化为双链cDNA,然后对测序适配器进行碎片和连接。然后使用条形码PCR引物PCR扩增8个循环,使用AMPure XP Beads纯化和选择大小,然后加载到Illumina NextSeq 2000上进行100 bp单读测序。gydF4y2Ba
RNA-seq分析gydF4y2Ba
测序的reads与GRCm39参考基因组(Ensembl, v.104;gydF4y2Bahttp://uswest.ensembl.org/Mus_musculus/Info/IndexgydF4y2Ba),基因计数使用Salmon (v.1.5.1)进行量化gydF4y2Ba59gydF4y2Ba.差异基因表达分析gydF4y2BaPgydF4y2Ba-value计算由DESeq2 (v.1.32.0)执行gydF4y2Ba58gydF4y2Ba.利用metscape进行基因本体富集分析gydF4y2Ba59gydF4y2Ba通过证据计数设置基因优先级。gydF4y2Ba
行为和生理分析gydF4y2Ba
机械阈值gydF4y2Ba
小鼠在von Frey室驯化1小时。使用校正后的von Frey细丝(0.07、0.16、0.4、0.6、1.0、1.4、2.0、4.0和6.0 g)采用上下法测量50%力学阈值gydF4y2Ba60gydF4y2Ba.gydF4y2Ba
双温选择法gydF4y2Ba
双温选择试验装置按前文所述设置gydF4y2Ba61gydF4y2Ba.车道被平均划分在两个不同的温度板上,分别设置为30°C和18°C,每只小鼠被放置在其中一条车道上。给小鼠10分钟的适应时间,然后使用EthoVision跟踪系统(Noldus信息技术)在一个带有红外照明的黑暗房间中跟踪1小时。分析了在每个温度区所花费的总时间。gydF4y2Ba
核心体温测量gydF4y2Ba
使用热电偶直肠探头测量核心温度(World Precision Instruments)。当处于热中性状态的小鼠移至室温24 h以上时,测量室温核心体温。gydF4y2Ba
测量血压和心率gydF4y2Ba
如前所述,采用尾袖法和CODA高通量无创血压系统(Kent Scientific)测量血压和心率gydF4y2Ba62gydF4y2Ba.gydF4y2Ba
大体积iWAT中去甲肾上腺素的靶向检测gydF4y2Ba
冷冻iWAT组织在4×重量0.1 mol l中裂解gydF4y2Ba−1gydF4y2Ba高氯酸,离心并通过30 kDa过滤管(Millipore)。滤液在Agilent 6470三重四极杆(QQQ)液相色谱-质谱(LC-MS)系统上使用电喷雾电离(ESI)在正模式下进行分析。AJS ESI源参数设置如下:气体温度设定为250℃,气体流量为12 l mingydF4y2Ba−1gydF4y2Ba喷雾器压力25磅/秒。护套气体温度设置为300℃,护套气体流量设置为12 l mingydF4y2Ba−1gydF4y2Ba.毛细管电压设置为3500 V。代谢物在Agilent Eclipse Plus C18色谱柱(3.5 μm, 4.6 × 100 mm, 959961-902)上进行分离。流动相为:缓冲液A,含0.1%甲酸的水;缓冲液B,乙腈加0.1%甲酸。LC梯度从0 ~ 2 min的5% B开始。从2 ~ 23 min,梯度线性增加至5% A/95% B。23 ~ 28 min,梯度保持在5% A/95% B;28 ~ 29 min,梯度恢复到起始浓度5% b,流速维持在0.7 ml mingydF4y2Ba−1gydF4y2Ba在整个跑步过程中。对去甲肾上腺素进行多重反应监测,观察gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba的前体离子= 170.1gydF4y2Ba米gydF4y2Ba/gydF4y2BazgydF4y2Ba= 152个片段。停留时间为200,破碎器设置为60,碰撞能量设置为4,单元加速器电压设置为4。gydF4y2Ba
代谢研究gydF4y2Ba
接受双侧感觉消融的小鼠在30°C的热中性下喂食高脂肪饮食(HFD) (D12492,研究饮食)。术后1个月(年龄约11-12周龄)开始高热量饮食。每周测量体重。在高热量饮食9周时进行空腹血糖和糖耐量试验,并在高热量饮食13周时测量血浆胰岛素。gydF4y2Ba
葡萄糖耐量试验gydF4y2Ba
小鼠禁食4 h(08:30-12:30)后腹腔注射葡萄糖(1 g kggydF4y2Ba−1gydF4y2Ba).使用OneTouch Ultra 2血糖仪测量指定时间点的血糖水平。gydF4y2Ba
血浆胰岛素测定gydF4y2Ba
在禁食14小时后,进入光周期3小时后采集空腹血液样本。血浆在肝素处理管(Microvette CB 300LH)中分离。使用ELISA试剂盒(Crystal Chem, 90080)测量血浆胰岛素,并使用BioTek Cytation 5 Imaging Reader读取。gydF4y2Ba
西方免疫印迹gydF4y2Ba
在含有Halt蛋白酶抑制剂(Thermo Fisher Scientific, 78430)和磷酸酶抑制剂(Thermo Fisher Scientific, 78420)的RIPA缓冲液(G-Biosciences)中提取全组织蛋白裂解物。蛋白裂解物用双辛酸法测定(Pierce)。蛋白质裂解物在Laemmli缓冲液(BioRad)中变性,用4-12% Mini-PROTEAN TGX SDS-PAGE (BioRad)分解,转移到聚偏二氟乙烯膜上。膜在4℃下用EveryBlot阻断缓冲液(BioRad)稀释的一抗孵育过夜,然后在室温下用EveryBlot稀释的二抗抗兔HRP (Jackson Immuno Research, 711-036-152, 1:10 000)或抗小鼠HRP (Jackson Immuno Research, 715-036-150,1:10 000)孵育。结果使用SuperSignal West Pico PLUS化学发光衬底(Invitrogen)进行可视化。使用以下抗体进行免疫印迹:抗-p- hsl (Ser660) (Cell Signaling, 45804, 1:10 000),抗- hsl (Cell Signaling, 4107, 1:10 000),抗-α-微管蛋白(Abcam, 7291,1:10 000)。具体来说,剥离p-HSL膜后对HSL进行印迹。gydF4y2Ba
成像分析和定量gydF4y2Ba
所有图像都使用ImageJ进行分析。在Imaris中渲染3D体图像。gydF4y2Ba
TH的量化gydF4y2Ba+gydF4y2BaiWAT中的DRG神经gydF4y2Ba
40 μm × 40 μm × 40 μm区域(gydF4y2BaxgydF4y2Ba,gydF4y2BaygydF4y2Ba,gydF4y2BazgydF4y2Ba)是随机选择的,并最大限度地投影gydF4y2BazgydF4y2Ba使用定制的ImageJ脚本,在整堆带TH染色的节内标记iWAT中进行标记。仅保留TdTomato (DRG)阳性信号的区域。使用ImageJ直线函数测量tdtomato阳性纤维的厚度,并在视图中两个不同的地方进行平均。宽度小于2.5 μm(任意截断)的纤维被认为是薄纤维。如果TH-647通道显示与TdTomato信号重叠,则认为该视图为正。我们量化了来自3个生物重复的13张图像,总共77张包含TdTomato阳性细纤维的图像被量化为TH阳性。gydF4y2Ba
腹部皮肤神经密度的定量及iWATgydF4y2Ba
80 μm × 80 μm × 20 μm区域(gydF4y2BaxgydF4y2Ba,gydF4y2BaygydF4y2Ba,gydF4y2BazgydF4y2Ba)是随机选择的,并最大限度地投影gydF4y2BazgydF4y2Ba使用定制的ImageJ脚本在整堆腹面皮肤或iWAT中使用,这些小鼠都接受了三角内标记。在ImageJ中使用自动阈值自动分割含有神经纤维的区域。神经密度以面积计算gydF4y2Ba神经gydF4y2Ba/区域gydF4y2Ba总计gydF4y2Ba.仅保留包含神经信号的视图进行量化。我们量化了来自3个生物重复的39张腹肌皮肤图像中的466次观看,以及来自2个生物重复的31张iWAT图像中的468次观看。gydF4y2Ba
表皮内神经纤维的定量gydF4y2Ba
用抗β iii微管蛋白抗体定量表皮内神经纤维是根据在侧腹皮肤横截面中穿过基底膜的神经纤维数量来确定的。对所有图像进行盲法评分,并在特定条件下进行事后登记。4只小鼠同侧和对侧侧皮肤(每个组织10-15个切片)被定量。gydF4y2Ba
神经节中ROOT/AAV9标记的定量研究gydF4y2Ba
从注射了AAV (ROOT或AAV9)和CTB的小鼠中提取drg和schg,进行如上所述的全贴装成像。用AAV和CTB标记T11-L3 DRGs和T12 SChGs的细胞数量。在T13和L1 DRGs中量化所有AAV标记细胞中AAV和CTB双阳性细胞的百分比,同时对T13和L1 DRGs进行了腹内手术,以供后期的体内实验。gydF4y2Ba
CTB/ROOT/ aav9标记DRG体大小的定量gydF4y2Ba
在使用Fiji的DRG全挂载成像的全堆栈图像中手动量化Soma大小。我们注意到,将结合不同荧光团的CTB(即CTB-488和CTB-647)注射到iWAT中可能会导致标记DRG神经元的胞体直径分布略有不同;因此,在定量ctb标记的DRG体细胞大小时,我们专门使用CTB-647。gydF4y2Ba
肝脏荧光强度的定量gydF4y2Ba
对于表征ROOT的肝脏荧光测定,使用两种不同的曝光时间获得相同的视图。使用较长曝光时间的图像来确定组织的形状,使用较短曝光时间的图像来量化强度,以避免过度饱和。在ImageJ中手动绘制肝脏感兴趣区域和背景,定义肝脏荧光强度为Mean intensitygydF4y2Ba肝gydF4y2Ba−平均强度gydF4y2Ba背景gydF4y2Ba.gydF4y2Ba
研究设计gydF4y2Ba
未使用统计学方法计算样本量。样本量是在前人研究和相关领域文献的基础上,采用相似的实验范式确定的。除了手术后或实验期间健康问题恶化的小鼠和组织学评估的病毒靶向缺失的小鼠外,没有排除任何数据。数据以盲法收集,事后登记,并进行相应的分析,以防止任何偏见。gydF4y2Ba
统计和再现性gydF4y2Ba
所有非rna -seq分析均使用GraphPad Prism 9 (v.9.3.1)进行,并进行相应的统计检验。成对的双尾学生gydF4y2BatgydF4y2Ba-测试比较了一只动物的同侧和对侧。每个动物的左侧或右侧被随机分配为单侧治疗。小鼠被随机分配进行双侧治疗。每个实验的样本量在图例中报告。所有的体内实验都至少进行了两次或从两个具有相同结论的独立队列中分组,除了在一个队列中进行了HFD治疗。对于具有代表性的图像,实验重复次数如下:gydF4y2Ba1罪犯gydF4y2Ba(四),gydF4y2Ba1 e, g h, jgydF4y2Ba(三),gydF4y2Ba2 a - b, dgydF4y2Ba(两个),gydF4y2Ba4gydF4y2Ba(四),gydF4y2Ba4 c, dgydF4y2Ba(二)和扩展数据图。gydF4y2Ba1gydF4y2Ba(三),gydF4y2Ba1 bgydF4y2Ba(四),gydF4y2Ba1 cgydF4y2Ba(两个),gydF4y2Ba2gydF4y2Ba(六),gydF4y2Ba2 fgydF4y2Ba(三),gydF4y2Ba2设定h kgydF4y2Ba(两个),gydF4y2Ba3 a、d、egydF4y2Ba(三),gydF4y2Ba3 bgydF4y2Ba(两个),gydF4y2Ba4 a, hgydF4y2Ba(两个);gydF4y2Ba5 bgydF4y2Ba(两个),gydF4y2Ba7 dgydF4y2Ba(三),gydF4y2Ba7 egydF4y2Ba(两个)。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
大量RNA-seq数据已存入基因表达集合,登录号为gydF4y2BaGSE207664gydF4y2Ba.本研究中所有数值数据均包含在gydF4y2Ba补充信息gydF4y2Ba.支持本研究结果的所有其他数据都太大了,不能公开存放,可以从相应的作者那里获得。gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
代码的可用性gydF4y2Ba
用于测序分析和FIJI分析的代码存放在GitHub (gydF4y2Bahttps://github.com/yelabscrippsgydF4y2Ba).gydF4y2Ba
参考文献gydF4y2Ba
Guilherme, A., Henriques, F., Bedard, A. H. & Czech, M. P.肥胖和糖尿病中脂肪神经支配与胰岛素作用的分子通路。gydF4y2Ba内分泌。gydF4y2Ba15gydF4y2Ba, 207-225(2019)。gydF4y2Ba
巴提斯,刘玉玉,刘玉玉,刘玉玉,白脂组织的神经支配与脂解的控制。gydF4y2Ba前面。Neuroendocrinol。gydF4y2Ba35gydF4y2Ba, 473-493(2014)。gydF4y2Ba
膳食诱导生热和肥胖抵抗所需的βAR信号。gydF4y2Ba科学gydF4y2Ba297gydF4y2Ba, 843-845(2002)。gydF4y2Ba
Chi, J.等。三维脂肪组织成像显示米色脂肪的生物生成和prdm16依赖的交感神经突密度的区域差异。gydF4y2Ba细胞金属底座。gydF4y2Ba27gydF4y2Ba, 226-236(2018)。gydF4y2Ba
Cohen, P. & Kajimura, S.产热脂肪的细胞和功能复杂性。gydF4y2Ba细胞生物学。gydF4y2Ba22gydF4y2Ba, 393-409(2021)。gydF4y2Ba
王志刚,王志刚,王志刚。白色脂肪组织的感觉神经支配。gydF4y2Ba点。j .杂志。gydF4y2Ba253gydF4y2Ba, r942-r944(1987)。gydF4y2Ba
姜辉,丁晓霞,曹勇,王辉,曾伟。脂肪内密集交感神经树突对低温诱导小鼠白色脂肪组织褐变至关重要。gydF4y2Ba细胞金属底座。gydF4y2Ba26gydF4y2Ba, 686-692(2017)。gydF4y2Ba
宋,C. K., Schwartz, G. J. & Bartness, T. J.顺行跨神经元病毒追踪揭示白色脂肪组织的中央感觉回路。gydF4y2Ba点。j .杂志。gydF4y2Ba296gydF4y2Ba, r501-r511(2009)。gydF4y2Ba
福斯特,m.t.和Bartness, t.j.交感神经而非感觉去神经刺激白色脂肪细胞增殖。gydF4y2Ba点。j .杂志。gydF4y2Ba291gydF4y2Ba, r1630-r1637(2006)。gydF4y2Ba
夏尔马,N.等。体感神经元转录同一性的出现。gydF4y2Ba自然gydF4y2Ba577gydF4y2Ba, 392-398(2020)。gydF4y2Ba
巴布塔,R. K.等。辣椒素诱导3T3-L1前脂肪细胞分化的“brite”表型。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba9gydF4y2Ba, e103093(2014)。gydF4y2Ba
陈,J.等。辣椒素激活TRPV1通道可通过连接蛋白43介导的Ca改善内脏脂肪重塑gydF4y2Ba2gydF4y2Ba+gydF4y2Ba涌入。gydF4y2BaCardiovasc。Diabetol。gydF4y2Ba14gydF4y2Ba, 22(2015)。gydF4y2Ba
Baskaran, P., Krishnan, V., Ren, J. & Thyagarajan, B.辣椒素通过激活TRPV1通道依赖机制诱导白色脂肪组织褐变并对抗肥胖。gydF4y2Ba英国人。j .杂志。gydF4y2Ba173gydF4y2Ba, 2369-2389(2016)。gydF4y2Ba
卡特琳娜,M. J.罗森,T. A., Tominaga, M., Brake, A. J. &朱利叶斯,D.一种辣椒素受体同源物,对有害热具有高阈值。gydF4y2Ba自然gydF4y2Ba398gydF4y2Ba, 436-441(1999)。gydF4y2Ba
朱利叶斯,色氨酸通道和疼痛。gydF4y2Ba为基础。细胞发育生物学。gydF4y2Ba29gydF4y2Ba, 355-384(2013)。gydF4y2Ba
李,L.等。皮肤低阈值机械感觉神经元的功能组织。gydF4y2Ba细胞gydF4y2Ba147gydF4y2Ba, 1615-1627(2011)。gydF4y2Ba
努德尔,V.等人。HYBRiD:用于清除哺乳动物身体的水凝胶增强DISCO。gydF4y2BaNat方法。gydF4y2Ba19gydF4y2Ba, 479-485(2022)。gydF4y2Ba
亨特,D. V.等人。adillin在所有成人神经嵴源性神经元中均有表达。gydF4y2BaeNeurogydF4y2Ba5gydF4y2Ba,中国日报学报。0077-18.2018(2018)。gydF4y2Ba
吴,J.等。米色脂肪细胞是小鼠和人体内一种不同类型的热生脂肪细胞。gydF4y2Ba细胞gydF4y2Ba150gydF4y2Ba, 366-376(2012)。gydF4y2Ba
Huesing, C.等。小鼠腹股沟白色脂肪组织交感神经支配。gydF4y2BaJ. Comp. Neurol。gydF4y2Ba529gydF4y2Ba, 1465-1485(2021)。gydF4y2Ba
佐丹奴等人。白色脂肪组织缺乏明显的迷走神经支配和副交感神经支配的免疫组化证据。gydF4y2Ba点。j .杂志。gydF4y2Ba291gydF4y2Ba, r1243-r1255(2006)。gydF4y2Ba
陈,K. Y.等人。工程aav用于有效的非侵入性基因传递到中枢和周围神经系统。gydF4y2BaNat。>。gydF4y2Ba20.gydF4y2Ba, 1172-1179(2017)。gydF4y2Ba
吴,Z., Autry, A. E., Bergan, J. F., Watabe-Uchida, M. & Dulac, C. G.内侧视前区的Galanin神经元控制亲代行为。gydF4y2Ba自然gydF4y2Ba509gydF4y2Ba, 325-330(2014)。gydF4y2Ba
Guilherme, A.等。通过γ3-肾上腺素能和甲状腺激素信号整合控制脂肪细胞产热和脂肪生成。gydF4y2Ba细胞的代表。gydF4y2Ba31gydF4y2Ba, 107598-107598(2020)。gydF4y2Ba
Yu, x.x, Lewin, D. A., Forrest, W. & Adams, S. H. Cold在小鼠棕色脂肪组织中诱导脂肪酸合成和β氧化:来自差异基因表达的预测和体内证实。gydF4y2Ba美国实验生物学学会联合会J。gydF4y2Ba16gydF4y2Ba, 155-168(2002)。gydF4y2Ba
莫提略,e.p.等。在慢性β3-肾上腺素能受体激活期间,棕色、米色和白色脂肪组织中脂解和从头脂肪生成的耦合。gydF4y2Ba脂质Res;gydF4y2Ba55gydF4y2Ba, 2276-2286(2014)。gydF4y2Ba
赫尔曼,m.a.等。脂肪组织中一种新的ChREBP异构体调节全身糖代谢。gydF4y2Ba自然gydF4y2Ba484gydF4y2Ba, 333-338(2012)。gydF4y2Ba
Eissing, L.等人。人体脂肪和肝脏中的从头脂肪生成与ChREBP-β和代谢健康有关。gydF4y2BaCommun Nat。gydF4y2Ba4gydF4y2Ba, 1528(2013)。gydF4y2Ba
叶,W. J., Leahy, P. & Freake, H. C.甲状腺激素和交感神经系统对棕色脂肪组织脂肪生成的调节。gydF4y2Ba点。j .杂志。gydF4y2Ba265gydF4y2Ba, e252-e258(1993)。gydF4y2Ba
坎农,B. & Nedergaard, J.非冷生热及其在代谢研究中的适当测量。gydF4y2BaJ.实验生物学。gydF4y2Ba214gydF4y2Ba, 242-253(2010)。gydF4y2Ba
Gordon, C. J.关于调节与强迫,神经化学诱导的体温变化的术语综述。gydF4y2Ba生命科学。gydF4y2Ba32gydF4y2Ba, 1285-1295(1983)。gydF4y2Ba
Dittner, C., Lindsund, E., Cannon, B. & Nedergaard, J.在热中性状态下,急性甲状腺诱导产热和发热独立于UCP1。gydF4y2Ba摩尔。金属底座。gydF4y2Ba25gydF4y2Ba, 20-34(2019)。gydF4y2Ba
西尔,P.等人。Prdm16决定小鼠皮下白色脂肪组织的产热程序。gydF4y2Baj .中国。投资。gydF4y2Ba121gydF4y2Ba, 96-105(2011)。gydF4y2Ba
池田等。涉及serca2b介导的钙循环的ucp1独立信号通路调节米色脂肪产热和系统葡萄糖稳态。gydF4y2BaNat,地中海。gydF4y2Ba23gydF4y2Ba, 1454-1465(2017)。gydF4y2Ba
Wehrwein, e.a. & Joyner, m.j.动脉压力反射和自主神经系统对血压的调节。gydF4y2BaHandb。中国。神经。gydF4y2Ba117gydF4y2Ba, 89-102(2013)。gydF4y2Ba
曾,W.-Z。et al。PIEZOs介导神经元对血压的感知和压力感受器反射。gydF4y2Ba科学gydF4y2Ba362gydF4y2Ba, 464-467(2018)。gydF4y2Ba
阮,N. L. T.,薛,B. & Bartness, T. J.腹股沟白色脂肪的感觉去神经改变西伯利亚仓鼠交感神经流出到白色和棕色脂肪。gydF4y2Ba杂志。Behav。gydF4y2Ba190gydF4y2Ba, 28-33(2018)。gydF4y2Ba
Ludy蔡明俊。,Moore, G. E. & Mattes, R. D. The effects of capsaicin and capsiate on energy balance: critical review and meta-analyses of studies in humans.化学。感官gydF4y2Ba37gydF4y2Ba, 103-121(2012)。gydF4y2Ba
李志刚,李志刚,李志刚,李志刚。心肌缺血再灌注对心肌交感传入神经激活的影响。gydF4y2Ba安。纽约大学科学学院gydF4y2Ba940gydF4y2Ba, 74-95(2001)。gydF4y2Ba
莫雷利,C.等人。调节血压的周围感觉神经元群的鉴定。gydF4y2Ba细胞的代表。gydF4y2Ba35gydF4y2Ba, 109191(2021)。gydF4y2Ba
Jänig, W.血管收缩神经元躯体交感神经反射的中枢组织。gydF4y2Ba大脑Res。gydF4y2Ba87gydF4y2Ba, 305-312(1975)。gydF4y2Ba
刘,S.等。电针驱动不同npy表达交感神经通路的体位组织和强度依赖。gydF4y2Ba神经元gydF4y2Ba108gydF4y2Ba, 436-450(2020)。gydF4y2Ba
刘,S.等。电针驱动迷走-肾上腺轴的神经解剖学基础。gydF4y2Ba自然gydF4y2Ba598gydF4y2Ba, 641-645(2021)。gydF4y2Ba
蔡泽尔等人。老鼠神经系统的分子结构。gydF4y2Ba细胞gydF4y2Ba174gydF4y2Ba, 999-1014(2018)。gydF4y2Ba
墨菲,K. T.等。瘦素敏感的感觉神经支配白色脂肪。gydF4y2Ba点。j .杂志。gydF4y2Ba304gydF4y2Ba, e1338-e1347(2013)。gydF4y2Ba
加勒森,J. T.等人。白色脂肪传入神经的脂肪分解感觉触发棕色脂肪产热。gydF4y2Ba摩尔。金属底座。gydF4y2Ba5gydF4y2Ba, 626-634(2016)。gydF4y2Ba
陈,C.等。清醒行为小鼠背根神经节的长期成像。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 3087(2019)。gydF4y2Ba
Ju, F.等。自由活动小鼠脊髓的长期双光子成像。预印在gydF4y2BabioRxivgydF4y2Bahttps://doi.org/10.1101/2022.01.09.475306gydF4y2Ba(2022)。gydF4y2Ba
普雷斯科特,s.l. & Liberles, s.d.迷走神经的内部感觉。gydF4y2Ba神经元gydF4y2Ba110gydF4y2Ba, 579-599(2022)。gydF4y2Ba
马歇尔,K. L.等。感觉神经元和尿路上皮细胞中的PIEZO2协调排尿。gydF4y2Ba自然gydF4y2Ba588gydF4y2Ba, 290-295(2020)。gydF4y2Ba
金,A. Y.等人。Pirt是一种磷酸肌醇结合蛋白,是TRPV1的调节亚基。gydF4y2Ba细胞gydF4y2Ba133gydF4y2Ba, 475-485(2008)。gydF4y2Ba
阿加沃,N. Offermanns, S. & Kuner, R.三叉神经节和背根神经节初级痛觉神经元的条件基因缺失。gydF4y2Ba《创世纪》gydF4y2Ba38gydF4y2Ba, 122-129(2004)。gydF4y2Ba
查里斯,R. C.等人。在啮齿动物中广泛和靶向基因传递的系统性AAV载体。gydF4y2BaProtoc Nat。gydF4y2Ba14gydF4y2Ba, 379-414(2019)。gydF4y2Ba
德弗曼,b.e.等。cre依赖的选择产生AAV变体,广泛的基因转移到成人大脑。gydF4y2Ba生物科技Nat。》。gydF4y2Ba34gydF4y2Ba, 204-209(2016)。gydF4y2Ba
6-羟基多巴胺选择性破坏肾上腺素能神经末梢的化学交感神经切除术。gydF4y2BaNaunyn Schmiedebergs Arch。实验病理学研究。Pharmakol。gydF4y2Ba261gydF4y2Ba, 271-288(1968)。gydF4y2Ba
曹强,景俊,崔晓霞,史宏,薛波,交感神经支配对白色脂肪变米色的影响。gydF4y2Ba杂志。代表。gydF4y2Ba7gydF4y2Ba, e14031(2019)。gydF4y2Ba
费舍尔,G.等人。背根神经节直接注射:技术、行为和组织学观察。gydF4y2Baj . >。方法gydF4y2Ba199gydF4y2Ba, 43-55(2011)。gydF4y2Ba
Love, m.i, Huber, W. & Anders, S.使用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。gydF4y2Ba基因组医学杂志。gydF4y2Ba15gydF4y2Ba, 550(2014)。gydF4y2Ba
周,Y.等。metscape为分析系统级数据集提供了面向生物学家的资源。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 1523(2019)。gydF4y2Ba
查普兰,s.r, Bach, f.w, Pogrel, j.w ., Chung, j.m . & Yaksh, t.l.大鼠爪触觉异常痛的定量评估。gydF4y2Baj . >。方法gydF4y2Ba53gydF4y2Ba, 55-63(1994)。gydF4y2Ba
达卡,A.等。TRPM8是小鼠冷感觉所必需的。gydF4y2Ba神经元gydF4y2Ba54gydF4y2Ba, 371-378(2007)。gydF4y2Ba
Daugherty, A., Rateri, D., Hong, L. & Balakrishnan, A.使用体积压力记录法测量小鼠血压,这是一种尾袖法。gydF4y2BaJ. Vis. Exp。gydF4y2Bahttps://doi.org/10.3791/1291gydF4y2Ba(2009)。gydF4y2Ba
确认gydF4y2Ba
我们感谢E. Saez, P. Cohen, C.-H。Lee, K. L. Marshall和I. Daou的意见;B. E. Deverman关于AAV矢量工程的建议;K. Deisseroth, D. Gibbs和C. Ramakrishnan的mScarlet和sfGFP质粒;J. Stirman和K. Spencer提供成像支持;斯克里普斯基因组学中心和桑福德·伯纳姆·普雷比斯组织学中心的工作人员负责样品制备;A. Chesler和R. Z. Hill对手稿的反馈;感谢Ye实验室、Patapoutian实验室和Dorris神经科学中心的所有成员的支持和反馈。这项工作得到了霍华德·休斯医学研究所的支持;NIH批准R35 NS105067和R01AT012051(给A.P.); NIH Director’s New Innovator Award DP2DK128800 (to L.Y.), NIDDK K01DK114165 (to L.Y.), Whitehall Foundation (to L.Y.) and Baxter Foundation (to L.Y.); Y.W. was supported by the Dorris Scholars fellowship. Y.Z. is a Merck Fellow of the Damon Runyon Cancer Research Foundation, DRG-2405-20. M.D.M.-G. was supported by the Fundacion Alfonso Martin Escudero postdoctoral fellowship.
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
y.w., A.P.和L.Y.构思并设计了这项研究。Y.W, V.H.L, Y.Z, V.S.N, M.L.和m.r.s.v。进行实验和数据分析。D.Y.和K.W.对活体动物实验做出了贡献。M.D.M.-G。,V.L.L. and J.Z.L. performed noradrenaline measurements. Y.W., A.P. and L.Y. wrote the manuscript with input from all of the authors. All of the authors provided input and reviewed the manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢纪汝荣和其他匿名审稿人对本工作的同行评议所作的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
图1顺行标记映射脂肪组织的体感觉神经支配。gydF4y2Ba
一个gydF4y2Ba,来自part - cre的DRG (T13)、交感链神经节SChG (T12)的代表图像;Ai9, Scn10a-Cre;Ai9和Scn10a-Cre的全身病毒标记(php . s - diosgfp)(每行3只小鼠)。比例尺:200 μm。gydF4y2BabgydF4y2BaDRG (T13)、SChG (T12)的代表性图像来自小鼠单侧三角内病毒注射T13 DRG(3只小鼠)。自体荧光(647 nm激光)显示组织轮廓。比例尺:200 μm。gydF4y2BacgydF4y2Ba, T13和L1 DRGs中表达荧光蛋白(FP)的AAV在三角节内注射小鼠的iWAT和肛周WAT (pgWAT,指男性的eWAT和女性的外周WAT)的代表性图像(来自3只小鼠)。gydF4y2Ba
图2逆行标记证实脂肪组织的体感神经支配。gydF4y2Ba
一个gydF4y2Ba,经iWAT或eWAT注射CTB-647小鼠的DRG (T13)、SChG (T12)、诺剂量神经节(NG)和乳糜泻/肠系膜上复合体(Ce/M)的代表性图像。gydF4y2BacgydF4y2Ba, iWAT标记DRG中CTB标记细胞数量的量化(gydF4y2BabgydF4y2Ba)或eWAT (gydF4y2BacgydF4y2Ba)沿着椎体水平。每组N = 4。gydF4y2BadgydF4y2Ba,来自iWAT和eWAT的双色CTB标签示意图(左)和T13 DRG的代表图像。gydF4y2BaegydF4y2BaiWAT和eWAT中CTB阳性细胞的定量。(n = 3只小鼠)。gydF4y2BafgydF4y2Ba, iBAT注射CTB-488小鼠DRG (T3)、SChG(星状神经节和T1 SChG)和NG的代表图像。gydF4y2BaggydF4y2Ba,将CTB-647注射到iWAT的小鼠中,定量CTB标记的DRG体大小分布(n = 3只小鼠)。gydF4y2Ba设定hgydF4y2Ba, CTB标记DRG神经元细胞类型的代表性图像和量化(来自4只小鼠)。gydF4y2BajgydF4y2Ba将CTB注射到iWAT或eWAT中的雄性和雌性小鼠中DRG (T11-L6)的总CTB标记神经元的量化(雄性小鼠n = 4,雌性小鼠n = 3)。gydF4y2BakgydF4y2Ba, DRG (L1)的代表性图像,来自雌性小鼠,带有iWAT和pgWAT双色CTB标记(来自3只小鼠)。所有值均为平均值±s.e.m。在gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BajgydF4y2Ba.比例尺:200 μm。gydF4y2Ba
图3顺行标记显示iWAT中体感纤维的形态特征。gydF4y2Ba
一个gydF4y2Ba,在脂肪细胞附近的荧光蛋白(FP)标记DRG (T13和L1)纤维的3D视图。gydF4y2BabgydF4y2Ba,腹侧皮肤内FP标记DRG (T13和L1)纤维的代表性图像。gydF4y2BacgydF4y2Ba,对腹面皮肤内FP标记DRG (T13和L1)纤维的相对神经密度进行量化(3个生物重复的39张图像中的466次观看)和iWAT(2个生物重复的31张图像中的468次观看)。所有值均为平均值±s.e.m。gydF4y2Bad egydF4y2Ba,脂肪实质内FP标记DRG (T13和L1)纤维的代表性图像(gydF4y2BadgydF4y2Ba)及沿船航行(gydF4y2BaegydF4y2Ba).比例尺:30 μm。gydF4y2Ba
图4用于器官追踪优化的逆行向量(ROOT)的开发和表征。gydF4y2Ba
一个gydF4y2Ba, AAV9、rAAV2-retro、PHP小鼠DRG的代表性图像(T13)。S,即注入iWAT的CAV2。比例尺:200 μm。gydF4y2BacgydF4y2Ba,根的发展。gydF4y2BabgydF4y2Ba,gydF4y2Ba在活的有机体内gydF4y2Ba逆行载体的选择和一轮筛选后的氨基酸富集。gydF4y2BacgydF4y2Ba肽插入恢复序列丰度的定量。gydF4y2BadgydF4y2Ba, ROOT与AAV9比较。gydF4y2BadgydF4y2Ba, ROOT和AAV9比较的工作流程。gydF4y2BaegydF4y2Ba同侧和对侧DRGs中AAV+细胞数量的量化(T11-L3)。gydF4y2BafgydF4y2Ba,同侧SChG中AAV+细胞数量的定量(T12)。gydF4y2BaggydF4y2Ba肝脏体积荧光强度的定量研究。所有值均为平均值±s.e.m。统计数据由双尾未配对t检验确定gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba.gydF4y2Ba设定hgydF4y2Ba, DRG代表图像(T13) (gydF4y2BahgydF4y2Ba)和细胞数量的量化(gydF4y2Ba我gydF4y2Ba在iWAT中注射ROOT-mScarlet,在侧翼皮肤中注射CTB。比例尺:200 μm。gydF4y2BajgydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba, AAV9小鼠AAV标记DRG体细胞大小分布的定量(gydF4y2BajgydF4y2Ba)或ROOT (gydF4y2BakgydF4y2Ba)注射到iWAT (AAV9组n = 2只,ROOT组n = 5只)。gydF4y2Ba
图5 i瓦特- drgs的cre依赖性单侧消融特征。gydF4y2Ba
一个gydF4y2Ba, SChG中CTB标记细胞的定量(T12)。n = 8。双尾配对t检验确定的统计量。gydF4y2BabgydF4y2Ba,侧腹皮肤神经纤维的代表性图像。比例尺:200 μm。gydF4y2Bac - dgydF4y2Ba腹面皮肤表皮内神经纤维(IENF)密度的定量。N = 4只小鼠,每个样品定量10-15个非连续切片。gydF4y2BacgydF4y2Ba, Cre-侧(n = 48)和Cre+侧(n = 53)的侧腹皮肤IENF合并密度。所有值均为平均值±s.e.m。由双尾未配对t检验确定的统计量。gydF4y2BadgydF4y2Ba,每只动物平均IENF密度。双尾配对t检验确定的统计量。gydF4y2BaegydF4y2Ba, iWAT神经单侧感觉消融小鼠后爪机械阈值。N = 10只小鼠。双尾配对t检验确定的统计量。gydF4y2Ba
图6 cre依赖的i瓦特- drgs单侧消融基因表达分析。gydF4y2Ba
a - bgydF4y2Ba, eWAT的定量RT-PCR分析(gydF4y2Ba一个gydF4y2Ba)及iBAT (gydF4y2BabgydF4y2Ba) iWAT中cre依赖性单侧感觉消融后。N = 5只老鼠。双尾配对t检验确定的统计量。gydF4y2Bac - dgydF4y2BaiWAT交感神经化学去神经。gydF4y2BacgydF4y2Ba,交感神经化学去神经工作流程。6-OHDA单方面注入iWAT。gydF4y2BadgydF4y2Ba,交感神经化学去神经后iWAT的定量RT-PCR分析。双尾配对t检验确定的统计量。gydF4y2Bae-fgydF4y2Ba, eWAT的定量RT-PCR分析(gydF4y2BaegydF4y2Ba)及iBAT (gydF4y2BafgydF4y2Ba)经cre依赖的单侧感觉消融和双侧交感神经化学去神经。每组6只。统计数据由2-way方差分析确定。gydF4y2Ba
图7感觉消融后iWAT形态变化特征。gydF4y2Ba
a - bgydF4y2Ba、eWAT的脂肪量(gydF4y2Ba一个gydF4y2Ba)及iBAT (gydF4y2BabgydF4y2BaiWAT单侧感觉消融后)。N = 11只小鼠。双尾配对t检验确定的统计量。gydF4y2BacgydF4y2Ba, iWAT、eWAT、iBAT归一化权重。N = 11只小鼠。统计数据由2-way方差分析确定。gydF4y2BadgydF4y2Ba, iWAT单侧感觉消融小鼠iWAT、eWAT、iBAT的代表性组织学图像(n = 3)。比例尺:100 μm。gydF4y2BaegydF4y2Ba,单侧感觉消融小鼠(n = 3) iWAT UCP1染色数字切片(200µm),以淋巴结(LN)为标志。比例尺:500 μm。gydF4y2BafgydF4y2Ba单侧感觉消融小鼠iWAT (n = 4) p-HSL、HSL和α-Tub Western blot检测。gydF4y2Ba
图8感觉消融后iWAT的生理变化特征。gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BabgydF4y2Ba, eWAT的定量RT-PCR分析(gydF4y2Ba一个gydF4y2Ba)及iBAT (gydF4y2BabgydF4y2Ba)来自iWAT双侧感觉消融小鼠(每组n = 4只)。gydF4y2Ba碳氢键gydF4y2Ba小鼠双侧感觉消融的生理测量。gydF4y2BacgydF4y2Ba, Cre- (n = 9)和Cre+ (n = 10)的室温直肠温度。gydF4y2BadgydF4y2Ba, Cre- (n = 9)和Cre+ (n = 10)的体重。gydF4y2BaegydF4y2BaCre- (n = 11)和Cre+ (n = 13)的24 h摄食量。gydF4y2Baf-hgydF4y2Ba,收缩期(gydF4y2BafgydF4y2Ba)、舒张期(gydF4y2BaggydF4y2Ba)和mean (gydF4y2BahgydF4y2Ba) Cre- (n = 6)和Cre+ (n = 6)血压。gydF4y2Ba我gydF4y2Ba,单侧感觉消融小鼠的大量iWAT去甲肾上腺素(NA)含量(n = 9)。gydF4y2BajgydF4y2Ba- - - - - -gydF4y2BangydF4y2Ba,双侧感觉消融小鼠高脂饮食(HFD)在热中性温度下的代谢测定。gydF4y2BajgydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba、Cre- (n = 5)和Cre+ (n = 6)小鼠高热量进食后的体重(j)和增重(k)。gydF4y2BalgydF4y2BaHFD 9周后,Cre- (n = 5)和Cre+ (n = 6)小鼠的空腹血糖水平。gydF4y2Ba米gydF4y2BaHFD 14周后,Cre- (n = 5)和Cre+ (n = 6)小鼠空腹血浆胰岛素水平。gydF4y2BangydF4y2BaHFD 9周后,Cre- (n = 5)和Cre+ (n = 6)小鼠进行ip -葡萄糖耐量试验(1 g/kg)。gydF4y2Ba碳氢键gydF4y2Ba,gydF4y2Baj-ngydF4y2Ba用双尾未配对t检验在gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BabgydF4y2Ba;韦尔奇修正的双尾未配对t检验gydF4y2Ba碳氢键gydF4y2Ba,gydF4y2Bal mgydF4y2Ba;二向方差分析gydF4y2BajgydF4y2Ba,gydF4y2BakgydF4y2Ba,gydF4y2BangydF4y2Ba.gydF4y2Ba
补充信息gydF4y2Ba
补充图1gydF4y2Ba
扩展数据的western blots全扫描图7f。剥离p-HSL后对HSL进行印迹。红色框表示裁剪和显示的区域。gydF4y2Ba
补充视频1gydF4y2Ba
光片显微镜(SmartSPIM)三维渲染小鼠躯干,将表达AAV的FP注入左侧T13和L1 DRGs。为了便于观察,切除了胃肠道。平面内分辨率,1.79 μ m /像素;gydF4y2BazgydF4y2Ba-步长,4µm;图像体积,32毫米× 42毫米× 14毫米。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
王耀华、梁维华、张勇。gydF4y2Baet al。gydF4y2Ba脂肪组织体感神经支配的作用。gydF4y2Ba自然gydF4y2Ba609gydF4y2Ba, 569-574(2022)。https://doi.org/10.1038/s41586-022-05137-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05137-7gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba