摘要gydF4y2Ba
atp水解耦合肌动蛋白聚合是细胞产生力的基本机制gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.反过来,力gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba和肌动蛋白丝(F-actin)核苷酸状态gydF4y2Ba6gydF4y2Ba通过调节f -肌动蛋白与肌动蛋白结合蛋白的接触来调节肌动蛋白动力学,其机制尚不清楚。在这里,我们展示了肌动蛋白的核苷酸状态调节由弯曲力引起的f -肌动蛋白结构转变。adp - f -肌动蛋白和ADP-P的冷冻电镜结构gydF4y2Ba我gydF4y2Ba-F-actin具有足够的分辨率来可视化结合溶剂,揭示了由水分子桥接的亚基间界面,可以调节灯丝晶格的灵活性。尽管在核苷酸间隙中存在着广泛的有序溶剂差异,但这些结构具有几乎相同的晶格和本质上难以区分的蛋白质主链构象,肌动蛋白结合蛋白不太可能区分这些结构。接下来,我们介绍了一种用于重建弯曲纤维的机器学习管道,使我们能够可视化连续的结构变化和侧链级别的细节。弯曲的F-actin结构揭示了亚基间界面的重排,其特征是个体前聚体中螺旋扭曲和变形的大量改变,ADP-F-actin和ADP-P的转变是不同的gydF4y2Ba我gydF4y2Ba-F-actin。这表明磷酸盐硬化肌动蛋白亚基改变了f -肌动蛋白的弯曲结构景观。由于弯曲力引起的核苷酸状态依赖构象转变足以被肌动蛋白结合蛋白检测到,我们提出肌动蛋白核苷酸状态可以作为f -肌动蛋白机械调节的共同调节因子。gydF4y2Ba
主要gydF4y2Ba
肌动蛋白聚合为细胞的基本过程提供动力,包括细胞迁移、细胞器动力学和内吞作用gydF4y2Ba1gydF4y2Ba.分支肌动蛋白网络的推进组装与球状肌动蛋白(G-actin)亚基的核苷酸消耗耦合,随着结合到生长的F-actin中,G-actin亚基水解结合的ATPgydF4y2Ba1gydF4y2Ba.弹性布朗网模型,其中弯曲的细丝推动膜,因为他们聚合gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,定量地解释了这种化学能转化为机械功。在体外实验中,电子显微镜已经在靠近表面的聚合肌动蛋白网络中分辨出了具有数百纳米曲率半径的大量弯曲丝gydF4y2Ba7gydF4y2Ba在细胞gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.gydF4y2Ba
进入F-actin后,亚基在数秒内迅速水解结合的ATP。这就产生了亚稳态ADP-PgydF4y2Ba我gydF4y2Ba-F-actin,在磷酸盐释放前持续数分钟,导致ADP-F-actin的长寿命gydF4y2Ba1gydF4y2Ba.逆行流动同时将老化的纤维从膜上推开gydF4y2Ba11gydF4y2Ba,产生f -肌动蛋白核苷酸状态的空间梯度——纤维年龄的生化标记gydF4y2Ba6gydF4y2Ba.肌动蛋白核苷酸状态和机械力gydF4y2Ba1gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba调节f -肌动蛋白和控制肌动蛋白网络动态的关键肌动蛋白结合蛋白(ABPs)之间的相互作用。f -肌动蛋白解聚蛋白cofilin优先结合并切断adp - f -肌动蛋白gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,有利于膜远端选择性拆卸老化的f -肌动蛋白。科菲林和支链f -肌动蛋白成核子ARP2/3也具有机械调节的特征gydF4y2Ba5gydF4y2BaF-actin-binding活动gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,特别是对灯丝弯曲的反应gydF4y2Ba17gydF4y2Ba,gydF4y2Ba19gydF4y2Ba.这可能有助于分支f -肌动蛋白网络的力敏感性,显示出修改的丝间几何形状gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba以及增强的军力gydF4y2Ba20.gydF4y2Ba在电阻性负载存在的情况下。其他几个ABPs检测f -肌动蛋白的核苷酸状态gydF4y2Ba13gydF4y2Ba,gydF4y2Ba22gydF4y2Ba通过单个纤维的力gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba通过不清楚的机制。gydF4y2Ba
f -肌动蛋白聚合与g -到f的转变相耦合,肌动蛋白亚基的大幅扁平化使其核苷酸裂解活性位点具有水解能力gydF4y2Ba26gydF4y2Ba.相比之下,低温电子显微镜(cryo-EM)在3-4 Å分辨率下的研究仅发现F-actin中适度的核苷酸状态依赖性变化,报告了局部重排gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba肌动蛋白的弹性d环gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba或者几乎相同的骨架构象gydF4y2Ba32gydF4y2Ba.然而,ABPs的结合可以引起大量的重排,特别是铁蛋白,它稳定了未扭曲的f -肌动蛋白晶格gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba.这一差异挑战了传统的ABPs识别f -肌动蛋白核苷酸状态的变构模型,该模型不能直接访问肌动蛋白的隐性核苷酸裂。肌动蛋白核苷酸状态也可以调节f -肌动蛋白的变形能力和相应的介导ABP结合的重排能力gydF4y2Ba13gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,与微米级持久性长度测量结果一致,表明ADP-PgydF4y2Ba我gydF4y2Ba-F-actin比ADP-F-actin硬gydF4y2Ba35gydF4y2Ba.分子动力学模拟支持f -肌动蛋白结构的机械调节gydF4y2Ba36gydF4y2Ba,将模型抽象到亚单位水平,预测灯丝弯曲和螺旋晶格扭曲调制之间的耦合(扭弯耦合)gydF4y2Ba37gydF4y2Ba.最近的细粒度模拟以多个刚体组成的亚基为特征,显示了ATP水解和通过丝晶格释放磷酸盐之间的合作关系gydF4y2Ba38gydF4y2Ba,表明晶格变形的传播与丝状核苷酸状态之间的耦合。然而,在缺乏直接结构可视化的情况下,尚不清楚F-actin中机械诱发的构象转变是否与丝状核苷酸状态相交以控制ABP接合。gydF4y2Ba
f -肌动蛋白的核苷酸裂解中的溶剂gydF4y2Ba
为了研究微妙的F-actin构象变化是否可以解释ABP核苷酸状态感知,我们测定了ADP-F-actin和ADP-P的结构gydF4y2Ba我gydF4y2Ba-F-actin的分辨率提高。如报道的制备ADP-P的方法gydF4y2Ba我gydF4y2Ba-F-actin不同gydF4y2Ba13gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,我们验证了我们的方法(在15 mM KH存在下聚合G-actingydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba),使用荧光显微镜测定法监测科菲林的分离情况(gydF4y2Ba方法gydF4y2Ba).与以前的报告一致gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba, ADP-F-actin在加入cofilin后5 min内迅速解聚,而ADP-PgydF4y2Ba我gydF4y2Ba-F-actin基本保持不变。取代KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba与KgydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba产生中间切断,这表明磷酸盐是导致ADP-P切断大幅减少的具体原因gydF4y2Ba我gydF4y2Ba-F-actin而不是改变缓冲离子强度(扩展数据图。gydF4y2Ba1 a, bgydF4y2Ba).因此,我们使用低温电子显微镜和迭代螺旋实空间精细化(在RELION中实现)来确定ADP-F-actin和ADP-P的结构gydF4y2Ba我gydF4y2Ba-F-actin在分辨率分别为2.4 Å和2.5 Å时,gydF4y2Ba1gydF4y2Ba,gydF4y2Ba方法gydF4y2Ba,扩展数据图。gydF4y2Ba1 c, dgydF4y2Ba和补充表gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
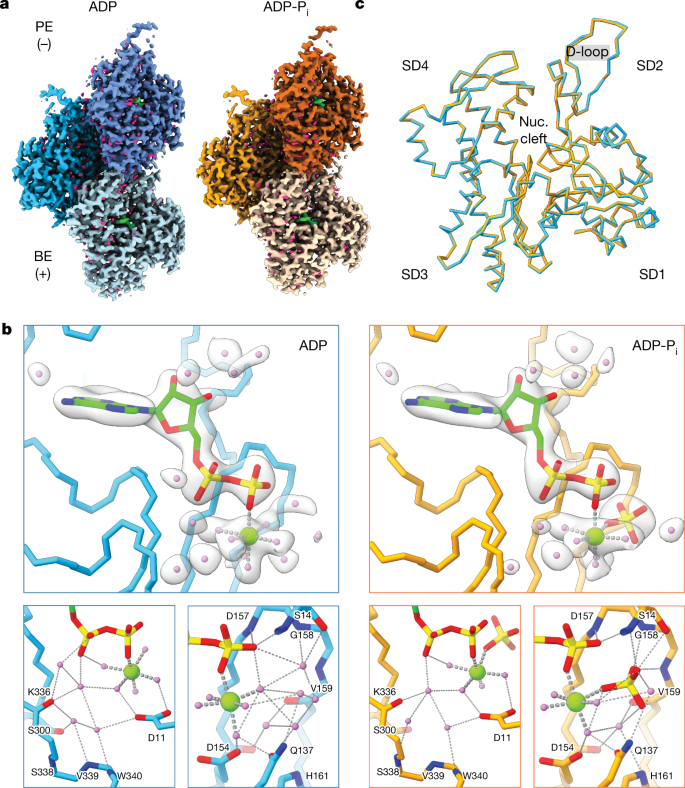
一个gydF4y2Ba, ADP-F-actin(左,蓝色阴影)和ADP-P的Cryo-EM图gydF4y2Ba我gydF4y2Ba-F-actin(右,橙色阴影)。ADP(绿色)和水(洋红色)密度显示。是带刺的结束;PE、尖头。gydF4y2BabgydF4y2Ba, ADP-F-actin(蓝色)和ADP-P的原子模型gydF4y2Ba我gydF4y2Ba-F-actin核苷酸(nuc.)裂口(橙色)用Cα表示。顶部,雕刻透明灰色密度显示为ADP(绿色),POgydF4y2Ba4gydF4y2Ba3−gydF4y2Ba(黄色),MggydF4y2Ba2 +gydF4y2Ba(浅绿色)和水分子(紫色)。在ADP / POgydF4y2Ba4gydF4y2Ba3−gydF4y2Ba氮原子是蓝色的,氧原子是红色的,磷原子是黄色的。下面,在假定的氢键网络中涉及的骨干链和侧链残基(虚线)被显示出来,并用杂原子着色。gydF4y2BacgydF4y2Ba,单个ADP-F-actin(蓝色)与ADP-P的叠加gydF4y2Ba我gydF4y2Ba- f -肌动蛋白(橙色)前体,以Cα表示。gydF4y2Ba
这些地图具有足够的分辨率,可以精确构建和细化ADP、镁、磷酸盐和水分子(图1)。gydF4y2Ba1 bgydF4y2Ba,gydF4y2Ba方法gydF4y2Ba,扩展数据图。gydF4y2Ba1 egydF4y2Ba和补充视频gydF4y2Ba1gydF4y2Ba).在两种核苷酸状态下,大量的水介导的氢键网络稳定了配体。值得注意的是,在ADP-F-actin中,四个水分子取代了无机磷酸盐的氧四面体。其他核苷酸裂口位置也有水分子数量和位置的微小变化。这些f -肌动蛋白活性位点的组成和立体化学与当代的研究一致gydF4y2Ba39gydF4y2Ba,为解释低温电子显微镜图提供了信心。gydF4y2Ba
尽管结合的小分子发生了实质性的变化,但肌动蛋白原体本身构象之间的差异被巧妙地解决了(扩展数据图。gydF4y2Ba2gydF4y2Ba),均极低(0.206 Å Cα均方根偏差(rm.s.d);无花果。gydF4y2Ba1 cgydF4y2Ba).每个残余的r.m.s.d.和每个残余应变伪能分析(一个强调局部变形的度量;gydF4y2Ba方法gydF4y2Ba)证实除了子域2的d -环外,没有有意义的Cα偏差(扩展数据图。gydF4y2Ba2 b, cgydF4y2Ba).这个区域,在f -肌动蛋白中是很灵活的gydF4y2Ba27gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,也对应于我们的地图的最低分辨率区域,因此,差异可能归因于原子模型中分辨率依赖性的不确定性。在螺旋晶格水平上,ADP-F-actin的精细上升幅度略大(ADP-P的28.1 Å vs 27.8 Å)gydF4y2Ba我gydF4y2Ba-F-actin),累积成在较长尺度下亚基定位的可检测差异(扩展数据图。gydF4y2Ba二维gydF4y2Ba).然而,这些结构并没有揭示与ABP结合相关的大小变化(例如,cofilin)gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba).这表明,ABPs中的核苷酸状态敏感性不太可能主要是通过检测伴随磷酸盐释放的f -肌动蛋白构象变化来介导的。gydF4y2Ba
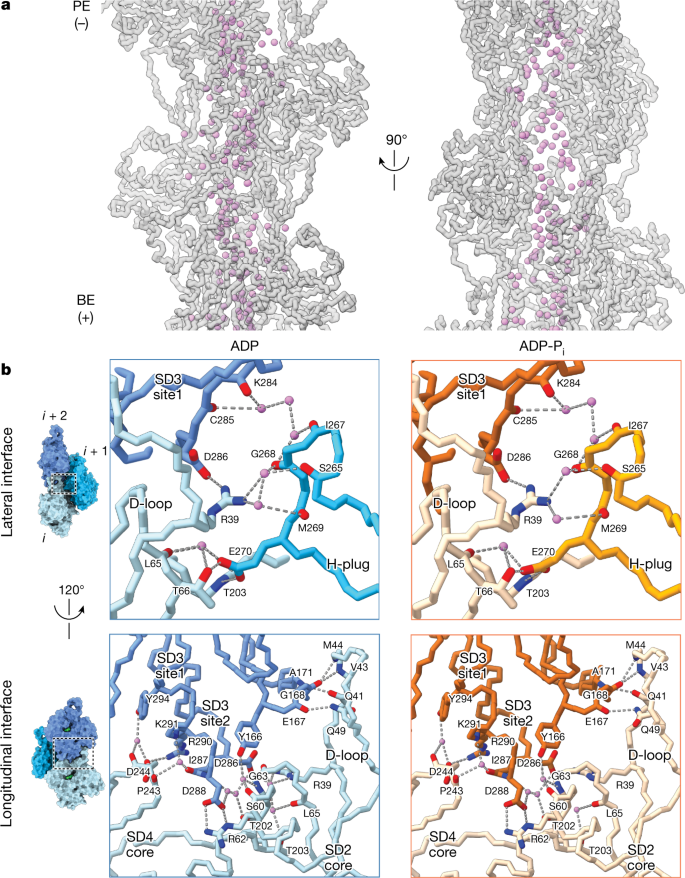
水分子介导亚基间的接触gydF4y2Ba
接下来,我们检测了核苷酸裂外的水分子,推断亚基间界面的溶剂可能会促进灯丝的机械重塑。典型的螺旋重建中,最高分辨率的映射区域是纤维芯(扩展数据图)。gydF4y2Ba1 dgydF4y2Ba),显示出与灯丝轴对齐的连续溶剂化通道。ADP-F-actin和ADP-P在该通道中的水定位基本相似gydF4y2Ba我gydF4y2Ba-F-actin(无花果。gydF4y2Ba2gydF4y2Ba和扩展数据图。gydF4y2Ba2 egydF4y2Ba).溶剂可及袋的分析(gydF4y2Ba方法gydF4y2Ba)表明该灯丝芯可以被大块溶剂接触到,并具有连接到前体核苷酸裂口的小通道。这将丝芯定位为有助于广泛的溶剂介导的链之间的横向相互作用,这种作用发生在三个亚基之间的顶点(图1)。gydF4y2Ba2 bgydF4y2Ba(上))。我们还观察到f -肌动蛋白外表面的有序水分子,这些水分子介导沿着同一链的前体之间的纵向相互作用(图。gydF4y2Ba2 bgydF4y2Ba(底部))。具体相互作用的详细分析gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba载于gydF4y2Ba补充讨论gydF4y2Ba.总之,我们发现亚基间界面被广泛溶剂化,我们假设这可以润滑灯丝内的机械重排。gydF4y2Ba
f -肌动蛋白弯曲变形可视化gydF4y2Ba
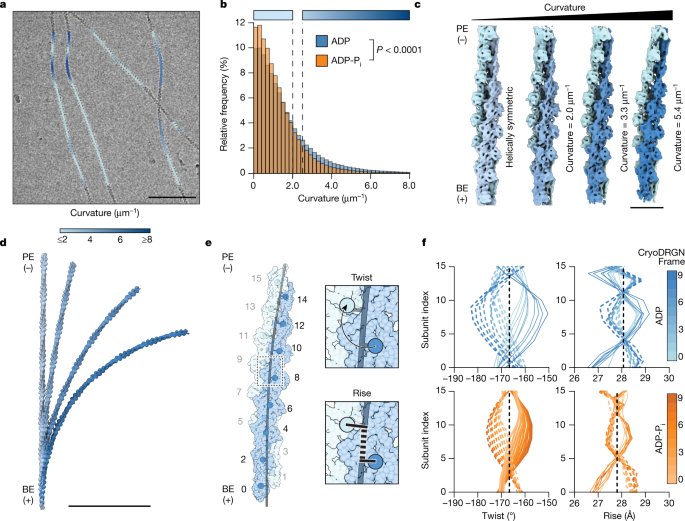
肌动蛋白丝暴露于热波动和流体力gydF4y2Ba12gydF4y2Ba,gydF4y2Ba44gydF4y2Ba在低温电磁网格制备过程中,产生明显的弯曲区域(图5)。gydF4y2Ba3gydF4y2Ba),在螺旋加工过程中通常被排除。尽管其他稳定弯曲的蛋白质丝已被结构表征gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,非平衡弯曲还没有在原子的细节中可视化。由于f -肌动蛋白弯曲在能量上是不利的,因此只有一小部分丝段亚群应该具有明显的变形。此外,弯曲是一个连续体,使得它难以用传统的分类方法进行表征。gydF4y2Ba
一个gydF4y2Ba,具有代表性的ADP-F-actin丝的低温- em显微照片,具有高曲率区域,低通过滤到30 Å。选取的片段根据所示的估计曲率着色。标尺,100nm。gydF4y2BabgydF4y2Ba, ADP-F-actin的归一化曲率直方图(蓝色,gydF4y2BangydF4y2Ba= 374,942)和ADP-PgydF4y2Ba我gydF4y2Ba-F-actin(橙色,gydF4y2BangydF4y2Ba= 470,625)丝段,使用双尾Mann-Whitney进行比较gydF4y2BaUgydF4y2Ba以及。虚线表示直线(≤2.0 μm)的曲率阈值gydF4y2Ba−1gydF4y2Ba)和弯曲(≥2.5 μm)gydF4y2Ba−1gydF4y2Ba)段。颜色条对应于曲率键gydF4y2Ba一个gydF4y2Ba.gydF4y2BacgydF4y2Ba,螺旋对称ADP-F-actin(左图)和cryoDRGN重建ADP-F-actin的采样连续弯曲(右三幅图),低通滤波到8 Å。丝线被涂上深浅不一的蓝色。比例尺,10nm。gydF4y2BadgydF4y2Ba,装订成卷的直的和弯的地图gydF4y2BacgydF4y2Ba,与底部16个原聚体对齐。标尺,100nm。gydF4y2BaegydF4y2Ba,沿弯曲丝轴的捻度和上升量示意图。标明了原聚体编号。gydF4y2BafgydF4y2Ba,沿着主要变率分量采样的cryoDRGN重建的扭转和上升测量。实线和虚线曲线分别对应于偶奇和奇偶原聚体指数的测量值。gydF4y2Ba
因此,我们开发了一种基于神经网络的方法来识别显微图中弯曲的f -肌动蛋白片段(gydF4y2Ba方法gydF4y2Ba和扩展数据图。gydF4y2Ba3.gydF4y2Ba),并估计它们的瞬时面内曲率。正如预期的那样,大部分节段显示出低曲率。然而,细丝的一个子集具有连续曲率梯度的区域,表明弹性弯曲(图。gydF4y2Ba3gydF4y2Ba).与持久性长度测量一致gydF4y2Ba35gydF4y2Ba段曲率分布显示ADP-F-actin的平均曲率明显大于ADP-PgydF4y2Ba我gydF4y2Ba-F-actin (ADP, 1.14 μmgydF4y2Ba−1gydF4y2Ba;ADP-PgydF4y2Ba我gydF4y2Ba0.96μmgydF4y2Ba−1gydF4y2Ba),包括高度弯曲的adp - f -肌动蛋白节段的长尾(图。gydF4y2Ba3 bgydF4y2Ba).热波动的最小玻尔兹曼模型近似地捕捉了曲率分布,但系统偏差与低温-电磁样品制备过程中的流体力一致,增加了高弯曲丝的流行率gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba44gydF4y2Ba(扩展数据图。gydF4y2Ba4gydF4y2Ba而且gydF4y2Ba补充讨论gydF4y2Ba).gydF4y2Ba
为了研究这些弯曲的构象景观,我们检查了16个估计曲率大于任意2.5 μm的原聚体片段gydF4y2Ba−1gydF4y2Ba切断(以后,弯曲的F-actin)。在cryoSPARC中进行从头计算重建并使用RELION进行后续处理后,我们使用非均质性分析工具cryoDRGN生成跨越每个数据集连续弯曲变形的体积(图1)。gydF4y2Ba3 c, dgydF4y2Ba,gydF4y2Ba方法gydF4y2Ba和扩展数据图。gydF4y2Ba5gydF4y2Ba).CryoDRGN不能生成独立的半图用于分辨率评估,但该半图具有~8 Å分辨率的良好α螺旋特征。这些重建主要表现为面内弯曲。gydF4y2Ba3 dgydF4y2Ba和扩展数据图。gydF4y2Ba5 b, egydF4y2Ba),中心轴曲率在估计的线段曲率分布范围内(ADP, 2.0 ~ 5.4 μm)gydF4y2Ba−1gydF4y2Ba;ADP-PgydF4y2Ba我gydF4y2Ba, 3.2 - -4.4μmgydF4y2Ba−1gydF4y2Ba).从这些重建的多个副本缝出的体积的曲率半径一致在几百纳米左右(图。gydF4y2Ba3 dgydF4y2Ba),类似于细胞中观察到的弯曲的f -肌动蛋白gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba.gydF4y2Ba
弯曲重塑了F-actin的晶格gydF4y2Ba
为了检验晶格重构,我们使用ISOLDE灵活地将原子模型拟合到这些映射中,并测量瞬时螺旋参数(上升和扭转;无花果。gydF4y2Ba3 egydF4y2Ba和补充视频gydF4y2Ba2gydF4y2Ba)沿着它们弯曲的中轴(gydF4y2Ba方法gydF4y2Ba).这揭示了惊人的弯曲-扭转耦合,与理论预测一致gydF4y2Ba37gydF4y2Ba,随着丝轴曲率的增加,股的过捻和下捻交替发生。链之间的对称扭曲偏差保持同相,保留标准F-actin的扭曲作为奇/偶原聚体之间的瞬时平均值,以保持晶格结构的完整性。弯曲诱发的扭曲偏差可达15°,远远大于可菲林诱导的扭曲偏差(~5°)gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba.每一股的弯曲-扭转关系可以解析建模为沿着其组成的原聚体的行波(gydF4y2Ba方法gydF4y2Ba),从而增加曲率调制扭转振幅和相位(图5)。gydF4y2Ba3 fgydF4y2Ba,扩展数据图。gydF4y2Ba6gydF4y2Ba和补充表gydF4y2Ba2gydF4y2Ba).包括ADP-F-actin和ADP-PgydF4y2Ba我gydF4y2Ba-F-actin在扭转/原聚体指数空间中表现出几乎相同的传播速度,但ADP-F-actin具有更大的振幅耦合因子。这导致了一种物理解释,即给定的曲率在ADP-F-actin中产生的扭曲偏差大于ADP-PgydF4y2Ba我gydF4y2Ba-F-actin,表明ADP F-actin的晶格更容易变形(扩展数据图。gydF4y2Ba6 bgydF4y2Ba和补充表gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
我们还观察到适度的上升偏差,其表现为明显的驻波而不是行波,其振幅也随着曲率的增加而增加(图1)。gydF4y2Ba3 fgydF4y2Ba).这些上升波的波长大约是扭转波的一半,而且据我们所知,还没有对它们进行详细的理论模拟。虽然上升偏差的物理基础尚不清楚,但我们假设,它们是由亚基变形造成的,以适应扭转重塑和亚基间界面弹性能量的增加。一致地,最弯曲的16-原聚体模型特征是沿每条链纵向相邻原聚体的子结构域之间的距离和角度依赖于核苷酸状态的变化gydF4y2Ba47gydF4y2Ba(扩展数据图。gydF4y2Ba6摄氏度gydF4y2Ba;提供了详细的分析gydF4y2Ba补充讨论gydF4y2Ba).值得注意的是,弯曲的f -肌动蛋白在两种核苷酸状态下都没有表现出与亚基扁平化相关的明显系统差异,亚基扁平化是g到f转变的标志,这表明f -肌动蛋白弯曲具有独特的结构特征。gydF4y2Ba
为了验证cryoDRGN的结果,我们将ADP片段分为三个直仓,一个低曲率仓和一个高曲率仓,所有的大小几乎相等。不对称单粒子重建(gydF4y2Ba方法gydF4y2Ba)的直线对照(7.0 Å, 7.1 Å和7.2 Å分辨率)显示与标准F-actin螺旋参数的偏差可以忽略不计,而低曲率(6.9 Å分辨率)和高曲率(6.4 Å)重建显示扭转和上升模式与cryoDRGN模型一致(扩展数据图)。gydF4y2Ba5 d, f, ggydF4y2Ba和补充视频gydF4y2Ba3.gydF4y2Ba).总的来说,这些数据表明弯曲引起了大量的核苷酸状态调制的f -肌动蛋白构象转变。gydF4y2Ba
核苷酸裂具有剪切应变的特征gydF4y2Ba
接下来,我们试图将伴随纤维弯曲的原聚体结构变形可视化。由于连续构象的灵活性限制了16-原聚体重建的分辨率,我们将重点放在中心的7个亚基(gydF4y2Ba方法gydF4y2Ba).聚焦细化大大提高了弯曲F-actin重建的分辨率(ADP-F-actin, 3.6 Å;ADP-PgydF4y2Ba我gydF4y2Ba-F-actin, 3.7;无花果。gydF4y2Ba4gydF4y2Ba,扩展数据图。gydF4y2Ba7得了gydF4y2Ba和补充表gydF4y2Ba3.gydF4y2Ba),方便直接构建和细化原子模型。我们还重建了两个具有匹配段号的ADP-F-actin箱——都得到了3.7 Å地图,我们在其中建立了控制原子模型(扩展数据图)。gydF4y2Ba7gydF4y2Ba和补充表gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
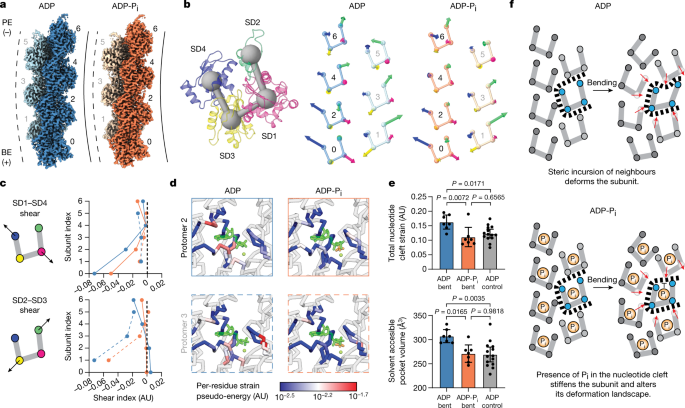
一个gydF4y2Ba,弯曲ADP-F-actin(蓝色)和ADP-P的Cryo-EM图gydF4y2Ba我gydF4y2Ba- f -肌动蛋白(橙色),按链着色。标明了原聚体编号。虚线和实线分别代表弯曲灯丝的凸面和凹面。gydF4y2BabgydF4y2Ba,按子结构域着色的单个肌动蛋白原体的色带表示(左)。由条形连接的球体表示子域质心。右,带向量的原聚体子域质心图(按比例100×),表示来自相应螺旋对称模型的子域平均位移。gydF4y2BacgydF4y2Ba子域1和4(上)和子域2和3(下)的子域剪切指数图(表示协调重排)。蓝线,ADP;橙色线条,ADP-PgydF4y2Ba我gydF4y2Ba.实线和虚线分别表示偶(凹边)和奇(凸边)原聚体。盟,任意单位。gydF4y2BadgydF4y2Ba, Cα表示从弯曲的ADP-F-actin和ADP-P中指示的前体核苷酸分裂gydF4y2Ba我gydF4y2Ba-F-actin,由每个残余菌株的伪能着色。ADP(深绿色),镁(浅绿色)和磷酸盐(橙色)用棍子表示。gydF4y2BaegydF4y2Ba,每个原聚体核苷酸裂解株假能的量化,核苷酸状态与弯曲条件之间的比较(上)。底部,核苷酸裂解溶剂可及体积的等效定量。数据为均值±95%置信区间。gydF4y2BangydF4y2Ba= 7(弯曲)和gydF4y2BangydF4y2Ba= 14(直)。采用单因素方差分析与Tukey事后分析进行统计比较;gydF4y2BaPgydF4y2Ba多次比较修正了数值。gydF4y2BafgydF4y2Ba,通过弯曲力和核苷酸状态联合调节f -肌动蛋白的空间边界机制的卡通模型。gydF4y2Ba
我们将这些非对称模型与我们的螺旋对称模型进行了比较,通过叠加它们的中心前体,揭示了仅在弯曲模型中的系统重排(扩展数据图)。gydF4y2Ba7 dgydF4y2Ba).直线控制只有小的、随机分布的偏差,这表明弯曲结构捕获了构象重排,而不仅仅反映了3.6-3.7 Å分辨率的模型建立不确定性。为了检测单个亚基的内部变形,我们将每个原聚体与来自其核苷酸状态匹配螺旋对称模型的亚基叠加,并检测亚域平均Cα位移(图。gydF4y2Ba4 bgydF4y2Ba,gydF4y2Ba方法gydF4y2Ba和补充视频gydF4y2Ba4gydF4y2Ba).这揭示了复杂的位移模式,依赖于原聚体的链的成员和晶格位置,主要特征是核苷酸裂口周围的亚基剪切。这些重排被剪切指数所捕获(图。gydF4y2Ba4摄氏度gydF4y2Ba;所示向量的点积),它揭示了在我们重构的带刺末端附近增加的剪切,可能是由于相对于曲率平面的晶格的局部方向。虽然ADP和ADP之间的子畴位移模式高度相似gydF4y2Ba我gydF4y2Ba(无花果。gydF4y2Ba4 bgydF4y2Ba), ADP剪切幅值更大(图。gydF4y2Ba4摄氏度gydF4y2Ba),与弯曲ADP段整体平均曲率较高和ADP亚基变形能力增强相一致。gydF4y2Ba
为了识别经历变形的特定结构元素,我们再次进行了每残余应变伪能分析(gydF4y2Ba方法gydF4y2Ba),对刚体位移不敏感。这揭示了三个主要的应变部位:h型塞(扩展数据图)。gydF4y2Ba8gydF4y2Ba(左)),d -环(扩展数据图。gydF4y2Ba8gydF4y2Ba(右))和核苷酸裂(图。gydF4y2Ba4 dgydF4y2Ba).H-plug和D-loop中的应变与它们作为亚基间相互作用的主要介质的作用一致。值得注意的是,与弯曲ADP-P相比,弯曲ADP-F-actin在核苷酸附近的残基中显示出显著更高的总应变(7.5 Å距离截止)gydF4y2Ba我gydF4y2Ba-F-actin或直接ADP-F-actin对照。gydF4y2Ba4 d, egydF4y2Ba).一致,溶剂可及的体积测量(gydF4y2Ba方法gydF4y2Ba)还发现,相对于弯曲的ADP-P,弯曲的ADP-F-actin前体中有扩大的核苷酸裂口gydF4y2Ba我gydF4y2Ba-F-actin和直接ADP-F-actin对照(图。gydF4y2Ba4 egydF4y2Ba).我们还检查了子单元中的详细重排(扩展数据图。gydF4y2Ba8 bgydF4y2Ba而且gydF4y2Ba9gydF4y2Ba,gydF4y2Ba补充讨论gydF4y2Ba和补充视频gydF4y2Ba5gydF4y2Ba而且gydF4y2Ba6gydF4y2Ba).这与肌动蛋白的核苷酸裂作为一个可变形位点的功能基本一致,它协调机械重排,其刚性依赖于磷酸盐的占用。这为肌动蛋白核苷酸状态对f -肌动蛋白弯曲机制的调节提供了结构机制解释。gydF4y2Ba
讨论gydF4y2Ba
我们对由肌动蛋白核苷酸状态调节的机械调节f -肌动蛋白构象景观的直接结构可视化显示了螺旋晶格扭转的大量重构,在原聚体-原聚体接触处产生大量重排。因此,我们推测f -肌动蛋白弯曲可能调节大量abp的结合,因为它们的结合位点通常跨越两个纵向相邻的前聚体。事实上,对弯曲f -肌动蛋白上代表性的力和核苷酸状态敏感ABPs的已知结合位点进行测绘表明,它们可能受到这些结构转变的影响(扩展数据图)。gydF4y2Ba10gydF4y2Ba).尽管核苷酸状态敏感的ABPs有可能检测到由ADP-P释放磷酸盐引起的非常小的结构变化(最可信的是0.3 Å的上升增加)gydF4y2Ba我gydF4y2Ba-F-actingydF4y2Ba22gydF4y2Ba,gydF4y2Ba27gydF4y2Ba我们的高分辨率结构表明,这不太可能是主要机制。我们的弯曲肌动蛋白结构支持另一种模型,在该模型中磷酸盐既使f -肌动蛋白硬化(与先前的研究一致)gydF4y2Ba33gydF4y2Ba并修改弯曲力引起的结构景观,使abp能够识别。该模型进一步与经典的f -肌动蛋白通过磷酸盐抑制ABPs的结合而硬化相一致,ABPs必须从根本上变形晶格才能结合,如cofilingydF4y2Ba15gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba48gydF4y2Ba.gydF4y2Ba
我们的研究也为f -肌动蛋白弯曲的机制提供了见解,这是一种通过机械力调节蛋白质结构的模型。由于力是一种跨丝的离域扰动,目前还不清楚它是如何转化为组成亚基的构象重构的。我们提出了一个机械调节的“空间边界”概念模型,其中晶格重排重新定位了一个亚单元的接触邻居(图。gydF4y2Ba4 fgydF4y2Ba).这将重新塑造可供它占用的物理空间,诱导它变形以减少冲突。该模型预测了亚基晶格位置、局部丝曲率和合成构象之间的耦合,与我们的观察结果一致。配体结合/化学修饰也可以改变亚基的变形情况,为交叉生化和机械调节提供了框架。如图所示,对于肌动蛋白和磷酸盐,这并不需要配体参与来修改蛋白质的基态构象,这与传统的与动态变构相似的变构调节不同gydF4y2Ba49gydF4y2Ba.然而,在空间位界框架中,配体协同调节机械变形,而不是改变蛋白质的固有构象波动(一种非排他的调节模式)。我们一致发现,肌动蛋白的核苷酸分裂介导亚基剪切变形,使其生化成分调节f -肌动蛋白的机制。这进一步表明,力可以调节f -肌动蛋白的核苷酸水解和磷酸盐释放动力学,正如之前预测的那样gydF4y2Ba50gydF4y2Ba.除了f -肌动蛋白之外,我们预计空间边界机制也可以解释其他多亚基复合体的关节力学和生化调节,这是未来研究的课题。gydF4y2Ba
方法gydF4y2Ba
蛋白质制备gydF4y2Ba
鸡骨骼肌肌动蛋白的纯化如上所述gydF4y2Ba51gydF4y2Ba.简单地说,1 g鸡骨骼肌丙酮粉重悬于20 ml g - ca缓冲液(g缓冲液:2 mM Tris-Cl pH 8.0, 0.5 mM DTT, 0.2 M ATP, 0.01% NaN)中gydF4y2Ba3.gydF4y2Ba,补充0.1 mM CaClgydF4y2Ba2gydF4y2Ba),搅拌30分钟。悬浮液在贝克曼Ti70转子中以42,500转/分(79,766gydF4y2BaggydF4y2Ba)煲30分钟。然后,50mm KCl和2mm MgClgydF4y2Ba2gydF4y2Ba加入含有g -肌动蛋白单体的上清液中,刺激f -肌动蛋白聚合1 h。然后加入KCl (0.8 M),孵育30分钟,以促进污染物从F-actin中分离。然后,溶液在Ti70转子中以42,500 rpm (79,766gydF4y2BaggydF4y2Ba) 3小时。颗粒重悬于2ml G-Ca缓冲液中,孵育过夜。然后将混合物在Dounce室中均质10-15次,通过26G和30G针连续剪切,然后在Spectra/Por 1透析管(MWCO 6-8 kDa)中用1 l G-Ca缓冲液透析过夜。然后再用30G的针将肌动蛋白溶液剪开,然后在1升的新鲜G-Ca缓冲液中透析一天。然后在贝克曼Ti90转子在70000转(187354gydF4y2BaggydF4y2Ba) 3小时。然后将上清液的上三分之二装载到HiLoad 16/600 Superdex 200柱(Cytiva)上进行大小排除层析。使用前将纯化的g -肌动蛋白保存在4°C的G-Ca缓冲液中。gydF4y2Ba
Flag-GFP标记的人肌凝蛋白VI-S1(用于将肌动蛋白丝固定到用于分离cofilin试验的覆盖物上)如前所述得到了纯化gydF4y2Ba24gydF4y2Ba在液氮中速冻,−80°C保存。冻干人cofilin 1购自Cytoskeleton (CF01),在MB缓冲液(20 mM MOPS pH 7.4, 5 mM MgCl)中重组gydF4y2Ba2gydF4y2Ba, 0.1 mM EGTA, 50 mM KCl, 1 mM DTT),然后在4℃孵育过夜。然后在液氮中快速冷冻,并保持在−80°C。等量(20 μg)冻干罗丹明肌动蛋白(Cytoskeleton AR05)重悬于18 μl G-Ca缓冲液和2 μl MilliQ水中,4℃孵育至少1 h,然后在Beckman TLA100转子中以100,000 rpm(335,400)的速度超离心澄清gydF4y2BaggydF4y2Ba)煲20分钟。gydF4y2Ba
Cofilin切断化验gydF4y2Ba
玻璃盖套(康宁22 × 50毫米,1½)使用100%丙酮清洗30分钟,使用100%乙醇清洗10分钟,使用2% Hellmanex III液体清洁浓缩液(HellmaAnalytics)在沐浴超声器中清洗2小时,然后用MilliQ水冲洗。清洗后的玻璃盖布涂上1 mg mlgydF4y2Ba−1gydF4y2Bampeg5k -硅烷(Sigma-Aldrich)在96%乙醇,10毫米HCl溶液中摇晃至少16小时。覆膜后,用96%乙醇和水冲洗,然后风干,4℃保存备用。gydF4y2Ba
在KMEH缓冲液(50 mM KCl, 1 mM MgCl)中,将未标记的G-actin和罗丹明G-actin分别稀释至0.9 μM和0.1 μM,制备了20%罗丹明标记的ADP-F-actingydF4y2Ba2gydF4y2Ba, 1 mM EGTA, 10 mM HEPES pH 7.0, 1 mM DTT)补充G- mg (G Buffer + 0.1 mM MgClgydF4y2Ba2gydF4y2Ba),最终肌动蛋白浓度为1 μM。混合物在25℃下孵育1小时,然后在4℃下过夜。使用前,f -肌动蛋白以60,000 rpm (120,744gydF4y2BaggydF4y2Ba)在TLA100转子中停留20分钟,然后在新鲜的KMEH中重新悬浮以去除任何游离的磷酸盐离子。Rhodamine-labelled ADP-PgydF4y2Ba我gydF4y2Ba除KMEH + G-Mg中添加15mm K外,其余制备-F-actin (20%)gydF4y2Ba2gydF4y2BaHPOgydF4y2Ba4gydF4y2Ba(pH值7.0)。混合物在25°C下孵育1小时,然后放在冰上立即使用。罗丹明标记的adp - f -肌动蛋白(20%)存在KgydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba除了15mm KgydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba(pH 7.0)取代KgydF4y2Ba2gydF4y2BaHPOgydF4y2Ba4gydF4y2Ba.gydF4y2Ba
为了制备全内反射荧光(TIRF)样品,将PDMS垫片(Grace Bio-Labs, 103380)放置在盖片上,在孔中加入20 μl 0.25 μM严格肌球蛋白VI S1在MB缓冲液中孵育2分钟,然后用20 μl 0.1%聚乙烯吡啶烷酮(Sigma-Aldrich, 9003-39-8)在MB缓冲液中阻塞1分钟。然后,在孔中加入20 μl的1 μM F-actin 30 s。然后用20 μl MB缓冲液(用于ADP-F-actin)或MB缓冲液+ 15 mM KH洗涤肌动蛋白gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba/ KgydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba(ADP-PgydF4y2Ba我gydF4y2Ba-F-actin / ADP-F-actin存在硫酸盐)。gydF4y2Ba
在尼康H-TIRF系统上使用CFI Apo ×60 TIRF油浸物镜(NA 1.49),一个四滤镜(Chroma)和一个iXon EMCCD相机(Andor),使用尼康的is - elements软件以1 s或2 s帧速率记录TIRF视频。罗丹明被561 nm激光激发。纤丝初始成像2分钟,视频暂停,在孔中加入20 μl的2 μM cofilin在MB缓冲液中(终浓度为1 μM)。然后视频恢复,并记录了额外的8分钟灯丝切断。gydF4y2Ba
Cofilin切断量化gydF4y2Ba
视频分析使用定制的Python脚本,测量在实验过程中灯丝强度的变化。通过使用scikit-image Python包中的函数对视频的前50帧的投影进行操作,识别出含有F-actin的视频区域并生成掩码gydF4y2Ba52gydF4y2Ba.这个投影的背景(使用50像素的滚动球半径计算)被减去,并使用2像素的滤镜大小进行高斯模糊。采用Li自适应阈值对投影进行二值化,去除面积小于100像素的形态学物体,对剩余的二值化图像进行1像素的放大。每个视频的这组掩模应用于视频的所有帧,并在每个掩模的基础上进行肌动蛋白强度的量化。gydF4y2Ba
对于每个掩模,测量每帧的总和像素强度,并通过除以第90百分位强度归一化。最大强度不用于归一化,因为在0秒时,强度通常随缓冲液/科菲林的加入而增加。将相同实验条件下的每个视频中每个掩模的强度迹线进行汇总,并绘制其平均值(扩展数据图)。gydF4y2Ba1 a, bgydF4y2Ba).gydF4y2Ba
低温电子显微镜网格准备gydF4y2Ba
ADP-PgydF4y2Ba我gydF4y2Ba-F-actin按上述方法制备(不加入罗丹明肌动蛋白),然后在KMEH + 15 mM KH中稀释至0.5 μMgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba添加0.01%的NP40替代物(罗氏),这是我们发现的一种添加剂,可以提高我们获得薄玻璃体冰膜的能力。将溶液(3 μl)应用于25°C操作的徕卡EM GP冷冻机中等离子清洗的1.2/1.3孔碳Au 300目栅格(电子显微镜科学)。孵育60秒后,用Whatman编号从后面吸干网格。5 .滤纸4秒,然后在液态乙烷中速冻。gydF4y2Ba
ADP-F-actin样本与最近一项研究中描述的预先存在的数据集相对应gydF4y2Ba41gydF4y2Ba.ADP-F-actin的制备方法如上所述,KH除外gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2BaKMEI缓冲液(50mm KCl, 1mm MgClgydF4y2Ba2gydF4y2Ba1 mM EGTA, 10 mM咪唑pH 7.0, 1 mM DTT) + 0.01% NP40替代KMEH。gydF4y2Ba
低温电子显微镜数据收集gydF4y2Ba
ADP-F-actin和ADP-PgydF4y2Ba我gydF4y2Ba-F-actin数据集收集在同一FEI Titan Krios系统上,工作在300kv,并配备了使用超分辨率模式的Gatan K2-Summit直接电子探测器。使用SerialEM软件套件录制视频gydF4y2Ba53gydF4y2Ba在标称放大倍数×29,000下,对应于样本级别的校正像素大小1.03 Å(超分辨率像素大小为每像素0.515 Å)。每10秒曝光的剂量被分成40帧,总电子剂量为60 egydF4y2Ba−gydF4y2Ba一个gydF4y2Ba−2gydF4y2Ba(1.5 egydF4y2Ba−gydF4y2Ba一个gydF4y2Ba−2gydF4y2Ba每帧),离焦值范围为- 1.5 ~ - 3.5 μm欠焦。为ADP-PgydF4y2Ba我gydF4y2Ba-F-actin数据集,使用光束图像移位从3 × 3网格中的9个孔中收集4834张单次曝光,每一阶段翻译一次。对于ADP-F-actin数据集,这在之前已经报道过gydF4y2Ba41gydF4y2Ba在这里进行了再处理,1548张曝光是直接定向的,使用阶段转换,每个孔一次曝光。gydF4y2Ba
显微图预处理gydF4y2Ba
影片与MotionCor2使用5 × 5补丁对齐gydF4y2Ba54gydF4y2Ba和剂量加权和gydF4y2Ba55gydF4y2Ba由经过傅里叶裁剪的双bin帧生成,得到图像的像素大小为1.03 Å。使用CTFFIND4对非剂量加权和进行对比传递函数(CTF)参数估计gydF4y2Ba56gydF4y2Ba.gydF4y2Ba
合成数据集生成gydF4y2Ba
在噪声低温电磁显微镜中,精确测量f -肌动蛋白的纳米曲率需要高质量的像素级图像分割。传统的基于交叉相关的纤维粒子选择方法使用来自二维类平均或直F-actin映射投影的模板。这种策略有其局限性,特别是在实验图像中,笔直的模板和高度弯曲的灯丝段之间的交叉相关性会较低。此外,纤维从背景信号或非蛋白信号的辨别能力可能较差。为了实现高质量的语义分割,我们实现了一种基于卷积神经网络的方法来识别所有曲率的灯丝段。尽管其他基于机器学习的拾取器最近已经被引入gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba据我们所知,它们并不明确地专注于检测或标记丝状体内部的瞬时曲率。从语义分割的显微图中,我们识别了纤维并测量了它们的瞬时平面内二维曲率。gydF4y2Ba
为了训练神经网络,模拟实验数据使用了合成的有噪声和无噪声投影对。f -肌动蛋白弯曲的三维合成模型是使用自定义Python脚本生成的,该脚本使用ProDy包中的函数加载和操作蛋白质数据库(PDB)模型gydF4y2Ba60gydF4y2Ba.单个肌动蛋白原体被视为刚性物体,并使用环形螺旋函数进行定位:gydF4y2Ba
其中参数定义如下:gydF4y2BaγgydF4y2Ba是沿环面在三维空间中的位置,gydF4y2BargydF4y2Ba为灯丝半径,gydF4y2BaωgydF4y2Ba是平均扭转,gydF4y2BatgydF4y2Ba是沿螺旋曲线的参数化位置,gydF4y2BaφgydF4y2Ba是扭转的阶段,gydF4y2BadgydF4y2Ba1gydF4y2Ba,gydF4y2BadgydF4y2Ba2gydF4y2Ba,gydF4y2BadgydF4y2Ba3.gydF4y2Ba是环面从原点的位移,gydF4y2BacgydF4y2Ba上升参数和gydF4y2BaRgydF4y2Ba是环面的曲率半径。注意,当曲率为零时,这个函数收敛到标准的F-actin螺旋。此外,该方程没有显式地编码紧急的体系结构重构现象,如扭弯耦合。利用该合成丝生成方案,生成了135个弯曲肌动蛋白模型库,其中包含35个前体,并系统地改变了纤维中心轴的曲率和旋转。然后使用EMAN2中的PDB2MRC函数将这些模型转换为卷文件gydF4y2Ba61gydF4y2Ba.这些卷被保存在256个体素盒内(体素大小,4.12 Å)。体积通过0°到359°之间的随机均匀采样值围绕phi角和rot角旋转,倾斜从以90°为中心的高斯概率分布随机采样,sd为2.5°,然后在盒子周围随机平移±250 Å,并沿gydF4y2BazgydF4y2Ba轴产生无噪声投影。通过在傅立叶空间中添加粉色噪声来生成一个成对的噪声投影,就像EMAN2的Python包中实现的那样,生成看起来很真实的合成数据gydF4y2Ba61gydF4y2Ba.这些投影图像被裁剪成一个较小的128像素的盒子大小,以确保灯丝可以跨越图像。通过将无噪声投影低通滤波到40 Å并将其二值化,生成与无噪声-无噪声投影对相关联的双通道语义映射堆栈。gydF4y2Ba
网络架构与培训gydF4y2Ba
使用扩展数据图中概述的架构来训练去噪自动编码器(DAE)。gydF4y2Ba3gydF4y2Ba.除最后一层为线性激活函数外,其余可训练层均为ReLU激活函数。用互相关系数的负数作为损失函数。对于训练,权重是使用TensorFlow中的默认初始化初始化的gydF4y2Ba62gydF4y2Ba.使用亚当优化版的随机梯度下降训练模型,学习率为0.00005,小批大小为16,直到模型收敛(3个周期的验证损失没有改善)。经过网络收敛后,恢复最佳epoch的权重。训练时,生成80万盒尺寸为128 × 128的无噪声投影对,其中90%用于训练,10%用于验证。经网络收敛后,DAE在验证集上的平均相互相关系数为0.9887。gydF4y2Ba
在将模型训练为DAE后,通过复制DAE的卷积编码层和权值,同时添加卷积层来训练语义分割网络。最后一层是一个双通道层,具有sigmoid激活和默认TensorFlow初始化。然后以0.001的学习率训练该语义分割网络。训练时,分别使用3万对噪声输入和128 × 128和128 × 128 × 2维语义分割目标,小批大小为32;90%的合成数据用于训练,10%用于验证。损失函数为二元交叉熵,经过网络收敛后,模型在验证集上的损失为0.0651。合成数据上的示例网络性能如图扩展数据图所示。gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
模型在单个NVIDIA Titan XP GPU和12gb的VRAM上进行训练。DAE每个epoch的训练大约需要1小时,语义分割网络每个epoch的训练大约需要3分钟。在启动该项目后,我们继续开发基于深度学习的灯丝颗粒拾取器。这里描述的体系结构已经被U-net体系结构所取代,我们发现它在更短的时间内用更小的训练集产生了更好的细分gydF4y2Ba63gydF4y2Ba.gydF4y2Ba
粒子挑选gydF4y2Ba
使用自定义的Python脚本将图像传递给全卷积神经网络进行语义分割(FCN-SS),并执行曲率敏感的纤维选取。每一张显微照片都按4到每像素4.12 Å的像素大小进行分类,然后提取128像素的有32像素重叠的瓷砖,并将其作为输入传递到网络。通过在重叠处的最大强度投影将输出拼接在一起,生成显微图的语义分割图。然后,这些地图使用一个固定的、经验确定的阈值0.9进行二值化,并进行骨架化。短于8像素的分支被修剪,并且从灯丝交叉点半径为48像素的像素被移除。然后通过与公共端点的轨迹匹配来识别连续丝,并通过二维样条曲线拟合来估计曲率。为了防止边缘效应引起的伪高曲率值,我们省略了样条末端的50像素。从剩下的细丝切片中,沿着样条在56 Å间隔(对应于一个原聚体长度的步长)测量瞬时曲率,并用于段选择。为了从已识别的细丝中提取片段进行非对称重建,使用相当于两个短间距螺旋上升台阶(56 Å)的步长提取片段。弯曲度大于或等于2.5 μm的灯丝片gydF4y2Ba−1gydF4y2Ba被认为是弯曲的,而那些曲率小于或等于2.0 μm的gydF4y2Ba−1gydF4y2Ba被认为是异性恋。为了从已识别的细丝中选择段进行高分辨率螺旋重建,采用了3倍螺旋上升的步长(83.4 Å),并且在输出元数据(一个relion格式的STAR文件)中标记同一细丝的成员段。gydF4y2Ba
螺旋形图像处理gydF4y2Ba
利用迭代螺旋实空间精化确定高分辨率重建gydF4y2Ba64gydF4y2Ba在RELION中实现的方法gydF4y2Ba65gydF4y2Ba.我们重新处理了ADP-F-actin数据集,该数据集之前生成了2.8 Å分辨率的地图gydF4y2Ba41gydF4y2Ba和ADP-PgydF4y2Ba我gydF4y2Ba-F-actin数据集从这个工作并行。我们基于神经网络的拾取器消除了纤维重叠的交叉点。初始摘取后,利用RELION在512像素的盒子中不进行分箱提取粒子,得到不重叠的原聚体81 Å(3个)。我们的挑选方案不包括psi(面内旋转)角度估计,因此使用全局角度搜索和筛选到35 Å的裸肌动蛋白参考(EMD-24321)低通进行初始细化。在初始对齐后,psi角度被更改为psi先验,所有姿势从元数据文件中删除,倾斜先验设置为90。该数据集随后被处理为先前描述的F-actin低温- em数据处理工作流gydF4y2Ba23gydF4y2Ba,gydF4y2Ba41gydF4y2Ba在relion - 3.1gydF4y2Ba66gydF4y2Ba,进行了如下描述的微小修改。简单地说,最初的2D分类是为了去除垃圾颗粒(ADP-F-actin只挑选0.4%的颗粒,ADP-P只挑选11.2%的颗粒)gydF4y2Ba我gydF4y2Ba-F-actin),其次是三维分类与对齐和五类。为了对齐,使用了倾角周围15°的搜索范围和psi先验,并使用7.5°角采样的腐烂角全局搜索。对于ADP-F-actin,在3D分类阶段没有颗粒被排除,因为所有5类都是高质量的。对于ADP-PgydF4y2Ba我gydF4y2Ba-F-actin,由于其螺旋参数位于搜索范围的边界,且类出现异常,因此剔除了其余片段(共128,533段)的23%的两个类。然后对选定的粒子进行处理,使用上面描述的相同的角度搜索范围(从1.7°开始的局部角度采样)进行3D自动细化,并使用RELION-3.1中实现的螺旋对称搜索。ADP-F-actin的图谱在4.2 Å-resolution, ADP-P的图谱在4.1 Å-resolutiongydF4y2Ba我gydF4y2Ba-F-actin。使用沿螺旋轴修剪至盒子大小50%的松散掩模进行后处理(gydF4y2BazgydF4y2Ba-length),结果是ADP-F-actin的分辨率为3.4 Å, ADP-P的分辨率为3.5 ÅgydF4y2Ba我gydF4y2Ba-F-actin。gydF4y2Ba
然后,进行多次迭代的CTF细化、贝叶斯抛光和3D自动细化。对于这两个数据集,CTF细化最初通过估计每个光学组的各向异性放大倍率进行。离焦值接下来在每个粒子的基础上拟合,散光在每个显微图的基础上拟合,以及光束倾斜估计。为ADP-PgydF4y2Ba我gydF4y2Ba-F-actin数据集,由于数据采集过程中使用了波束图像移位,因此数据分9个光学组进行处理。只有一个光学组用于ADP-F-actin数据集,该数据集是通过阶段翻译收集的。在CTF细化之后,使用贝叶斯抛光来提高数据在每粒子基础上的运动修正。RELION对称搜索的初始螺旋参数被更新,用于后处理的掩模被用于运行另一轮3D自动细化。这个过程重复使用30%gydF4y2BazgydF4y2Ba长度掩模,包括在CTF细化过程中三叶和四阶像差的估计。在第二轮颗粒抛光后,进行了第三轮CTF细化。gydF4y2Ba
在CTF优化的最后一次迭代之后,估计的离焦值在每个连续灯丝的长度上进行平滑处理,类似于之前报道的方法gydF4y2Ba46gydF4y2Ba.最后,使用30%的单轮隐藏优化gydF4y2BazgydF4y2Ba-长度掩模与局部角搜索和平移搜索使用溶剂扁平傅里叶壳相关(FSC)分辨率评估。ADP-F-actin的最终分辨率为2.43 Å, ADP-P的分辨率为2.51 ÅgydF4y2Ba我gydF4y2Ba-F-actin。gydF4y2Ba
弯曲f -肌动蛋白的图像处理gydF4y2Ba
选取弯曲片段在RELION中提取,盒子大小为512 × 512像素,像素大小为1.03 Å /像素(bin 1),初始有灯丝重叠。为了避免参考偏差,从头计算初始模型生成使用cryoSPARCgydF4y2Ba67gydF4y2Ba(v.2.11.0)使用估计曲率大于4.0 μm的ADP-F-actin片段子集gydF4y2Ba−1gydF4y2Ba.随后,这些粒子在cryoSPARC中的均匀细化产生了一个具有清晰曲率的不对称地图。将数据导入RELION-3.0中,进行无对齐的二维分类去除垃圾粒子,然后使用全局角度搜索进行无监督的三类三维分类。两个明显弯曲,低分辨率的班级在相反的方向弯曲和一个垃圾班级产生。然后对弯曲类中的粒子进行监督分类,使用两个弯曲类作为参考,一个直F-actin参考作为诱饵,使用全局角度对齐。只有0.3%的粒子被分配给诱饵,与所选的片段几乎完全具有弯曲的F-actin一致。对两个弯曲类的比对显示,它们几乎相同,但被一个原聚体取代,使它们看起来向相反的方向弯曲。因此,在cryoSPARC中使用全局搜索和第一弯曲类作为参考,将它们的粒子聚集在一起进行均匀细化,低通过滤到30 Å。然后将这些粒子重新导入RELION,并使用cryoSPARC地图低通过滤到10 Å作为参考进行3D自动细化,局部角度搜索,松散70%gydF4y2BazgydF4y2Ba长掩膜和溶剂压平FSCs。重复这一过程,从测量到的曲率在2.5 μm的段生成弯曲较小的图gydF4y2Ba−1gydF4y2Ba4.0μmgydF4y2Ba−1gydF4y2Ba的范围内。gydF4y2Ba
在论证了弯曲纤维重建的可行性后,所有弯曲纤维段的曲率均大于2.5 μmgydF4y2Ba−1gydF4y2Ba然后用高弯曲RELION细化结果作为初始参考,低通过滤到30 Å,在cryoSPARC中进行均相细化处理。这是对ADP-F-actin和ADP-P分别进行的gydF4y2Ba我gydF4y2Ba-F-actin并行执行。然后,数据被重新导入RELION,使用本地搜索进行掩模3D自动优化。连续轮CTF细化,贝叶斯粒子抛光和使用70%的3D自动细化gydF4y2BazgydF4y2Ba-length掩码一直执行到分辨率提高达到平台期。对于弯曲的ADP-F-actin数据集,执行了四轮CTF细化和三轮贝叶斯抛光。对于弯曲的ADP-PgydF4y2Ba我gydF4y2Ba-F-actin数据集,执行了三轮CTF精化和两轮贝叶斯抛光。从这一阶段开始,对数据进行高分辨率不对称分析或连续构象变率分析。gydF4y2Ba
对于高分辨率分析,去除360像素内的片段重叠(对应7个前体),并对粒子进行最终屏蔽(70%)处理gydF4y2BazgydF4y2Ba-length)三维自动优化与局部搜索和溶剂平坦FSC计算。用3DFSC服务器评估这些地图的分辨率各向异性gydF4y2Ba68gydF4y2Ba.对于连续构象变异性分析,在最终屏蔽(90%)之前,将整个512像素盒(对应16个原聚体)内的片段重叠去除gydF4y2BazgydF4y2Ba-length) 3D自动优化(也与局部搜索和溶剂平面化FSC计算)。这些节段及其指定的位姿被用于cryoDRGN神经网络的训练gydF4y2Ba69gydF4y2Ba评估构象变异性。gydF4y2Ba
非对称ADP-F-actin直线对照使用类似的方法生成。所有测得的弯曲度小于等于2.0 μm的灯丝段gydF4y2Ba−1gydF4y2Ba在cryoSPARC中进行从头算图生成和均相细化。然后,它们被导入RELION进行后续的本地3D自动优化、CTF优化和贝叶斯抛光,如上所述。然后,在360像素范围内去除所有的段重叠,生成两个足够大的随机子集,生成与弯曲非对称映射分辨率相当的映射。这两个粒子子集进行了最后的局部3D自动细化,正如弯曲不对称重建所描述的那样,并将得到的~3.7 Å地图作为模型建立和分析的对照。gydF4y2Ba
弯曲f -肌动蛋白的变异性分析gydF4y2Ba
为了对共识进行变异性分析,16原聚体不对称弯曲重建,粒子采样下降2,盒大小为256,像素大小为2.06 Å。训练了两个cryoDRGN神经网络,一个用于弯曲ADP-F-actin数据集,另一个用于弯曲ADP-PgydF4y2Ba我gydF4y2Ba-F-actin数据集。在这两种情况下,该网络都有一个变分自动编码器架构,包含7个1024维编码层和7个1024维解码层,具有10维潜在空间。所有其他参数都设置为默认值。这些网络被训练了40个纪元。使用4个NVIDIA Titan XP gpu,平均epoch时间约为12分钟。对训练过的10维潜在空间中单个粒子嵌入的主成分分析显示,数据集中存在的主要变化是由于弯曲变形引起的柔性构象不均一性。在随后的分析中,沿着这条潜在空间的轨迹进行预测重建采样。gydF4y2Ba
高分辨率原子模型gydF4y2Ba
在模型建立和细化之前,使用phoenix .resolve_cryo_em对地图进行密度修改gydF4y2Ba70gydF4y2Ba,然后使用ressample .exe程序(随FREALIGN .exe分发)通过四次傅立叶解箱,将重采样到一个包含0.2575 Å体素的网格上gydF4y2Ba71gydF4y2Ba).gydF4y2Ba
我们之前的裸ADP-F-actin模型(PDB:gydF4y2Ba7 r8vgydF4y2Ba)被复制并刚体贴合到ADP-F-actin和ADP-P的中央三个前体中gydF4y2Ba我gydF4y2Ba-F-actin地图使用UCSF ChimeragydF4y2Ba72gydF4y2Ba.然后,每个核苷酸状态的原子模型被独立地建立和改进。使用Coot手动调整中央原聚体gydF4y2Ba73gydF4y2Ba,另外两条链被这种更新的原聚体所取代。这些模型包含三种肌动蛋白前体,与相关的ADP和MggydF4y2Ba2 +gydF4y2Ba(和阿宝gydF4y2Ba4gydF4y2Ba3−gydF4y2Ba)配体采用PHENIX实空间精细化gydF4y2Ba74gydF4y2Ba与非晶体对称(NCS)约束。在凤凰中实空间精炼后,使用凤凰.douse放置初始溶剂水分子gydF4y2Ba75gydF4y2Ba将平均尺度参数设置为0.4。最初,每个原聚体大约有140个水分子被放置在这个自动功能中。然后在Coot中手动检查地图和模型,并添加或修剪水分子。随着贴图分辨率从灯丝核心径向下降,凤凰。douse was unable to reliably detect water peaks in all of the map regions using a single threshold. After manual adjustments, all water molecules outside a central slab 28 Å along the filament axis (the approximate span of a single helical rise) were deleted. The water molecules within the slab were then symmetrized to make an 84-Å-long slab containing waters, and two protomer chains were added to the model to fully satisfy all neighbour contacts for the central protomer. Water molecules were then associated with the closest protomer. This central protomer was copied twice and each protomer with its ligands were then fit as rigid bodies into the map to form a new trimer model. Each water molecule was then manually inspected in Coot and adjusted to fit into the map density if needed. A final PHENIX real-space refinement was performed with NCS restraints on the protein chains but not the solvent waters. A summary of validation statistics is provided in Supplementary Table1gydF4y2Ba.gydF4y2Ba
从可变性分析的原子模型gydF4y2Ba
从每个cryoDRGN帧中,相应的螺旋对称中央肌动蛋白原体模型的16个副本被刚体拟合到图中的中央16个原体位点,并组合成一个单一的模型。然后利用分子动力学柔性拟合对图谱和初始模型进行调整gydF4y2Ba76gydF4y2Ba基于ISOLDE的建模软件gydF4y2Ba77gydF4y2Ba实现ChimeraXgydF4y2Ba78gydF4y2Ba,采用二次结构距离和扭转约束。由于cryoDRGN预测的分辨率相对较低(通过目测估计为~8 Å),地图权重降低到自动确定权重的10%。将模拟温度设置为120 K,运行柔性拟合模拟5个实时时钟分钟,然后将模拟温度降低到0 K并停止。这些模型随后用于螺旋参数的测量和子域距离/角度的测量。gydF4y2Ba
弯曲和控制F-actin原子模型gydF4y2Ba
在建立模型之前,使用RELION对地图进行标准后处理。模型被构建到~3.6 Å不对称重建中,通过刚体拟合从相应螺旋对称模型的中心原聚体到图中沿丝长七个中心原聚体位点中的每一个。最初,使用ISOLDE对模型进行了大规模调整。在每种条件下,不施加任何约束加载地图和模型,模拟温度设置为120 K。然后模拟运行5分钟,然后将模拟温度降低到0 K并结束模拟。然后对这些模型进行PHENIX实空间精化处理,而不使用NCS。验证统计信息的摘要载于补充表gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
用于上升分析的扩展F-actin模型gydF4y2Ba
ADP-F-actin和ADP-P的扩展31-原聚体螺旋对称肌动蛋白丝模型gydF4y2Ba我gydF4y2Ba-F-actin是使用UCSF Chimera生成的,如前所述gydF4y2Ba41gydF4y2Ba.从建模的肌动蛋白三聚体开始,生成一个副本,并将带刺端上的两个末端前体叠加到尖头端的两个末端前体上。删除新生成的三聚体的这两个原聚体,将剩下的原聚体与原始模型结合,增加一个原聚体。这个过程被反复重复,直到31-原聚体灯丝产生。gydF4y2Ba
中央孔和核苷酸裂分析gydF4y2Ba
CASTp web服务器gydF4y2Ba79gydF4y2Ba用于识别高分辨率螺旋对称F-actin结构中连续的溶剂可达口袋。为了消除边界效应,每个模型扩展到如上所述的五个原聚体。使用1.4 Å的初始探针尺寸显示了一个溶剂可及的核心,该核心通过狭窄的通道连接到核苷酸口袋,并通过更宽的通道连接到灯丝的外部和本体溶剂。将探针尺寸增加到1.6 Å将中心溶剂通道从这些口袋中隔离出来。水分子包含在灯丝核心的离散口袋中,如图所示。gydF4y2Ba2gydF4y2Ba和扩展数据图。gydF4y2Ba2 egydF4y2Ba.gydF4y2Ba
还使用CASTp服务器,探针尺寸为1.4 Å,以测量非对称的七原聚体F-actin模型中溶剂可及核苷酸囊的体积。测量每个模型中单个原聚体的核苷酸袋体积,以将核苷酸袋与灯丝的中心核心分离。gydF4y2Ba
热波动的分析模型gydF4y2Ba
热弯曲涨落的玻尔兹曼模型进行了描述gydF4y2Ba补充讨论gydF4y2Ba.模型曲线与实验曲率直方图之间的残差(图。gydF4y2Ba3 bgydF4y2Ba)通过计算模型概率分布与每个0.2 μm中心直方图高度的差值来计算gydF4y2Ba−1gydF4y2Ba箱子具有乘法常数的调整玻尔兹曼分布gydF4y2BaαgydF4y2Ba通过最小化调整后的模型与数据之间的残差平方和来拟合每个数据集,收敛到gydF4y2BaαgydF4y2BaADP-F-actin为0.80,ADP-P为0.93gydF4y2Ba我gydF4y2Ba-F-actin。此外,还计算了5 ~ 15 μm整数持续长度的模型分布,以可视化不同持续长度对曲率分布的影响。gydF4y2Ba
上升、扭转和曲率测量gydF4y2Ba
使用定制的Python脚本,沿着变形的肌动蛋白丝轴测量上升和扭转,实现了类似于前面描述的螺旋变形的方法gydF4y2Ba80gydF4y2Ba,gydF4y2Ba81gydF4y2Ba,gydF4y2Ba82gydF4y2Ba.首先,使用3D样条拟合定义中轴。为了最小化边缘效应,对模型进行了两次复制,将其中一个副本的带刺末端的末端三个子单元与原始模型尖头的末端三个子单元对齐,然后将另一个副本的尖头的末端三个子单元与原始模型的带刺末端的末端三个子单元对齐。复制模型中的重叠子单元被删除,以生成最终的42-原聚体模型。这是用来定义中心样条,同时充分减少边缘影响。gydF4y2Ba
为了定义每个灯丝的中轴的3D样条,使用一组路径点实现了一种迭代的、方向无关的方法。最初的41个路径点被定义为沿灯丝滚动窗口中两个连续子单元质心对应的三维坐标集。然后通过路径点集拟合一个具有自然边界条件的三维三次样条,生成初始丝轴。一组线段的长度等于灯丝的半径,一端位于每个子单元的质心处,对其进行对齐,以减小自由端到样条的距离。然后,这些路径点被更新为两个连续自由端点的欧几里得平均值。更新3D三次样条、从亚单位质心定义新的线段扩展以及更新路径点的过程重复500次,以获得最终的中轴样条。gydF4y2Ba
上升是通过计算沿着原聚体质心之间的中轴样条路径移动的距离来测量的。对于每个原聚体,存储中心轴上离亚基质心最近的点,并计算沿样条路径到下一个原聚体的距离。在移动的Frenet-Serret参考系中测量沿变形短距f -肌动蛋白螺旋的前体之间的扭转。Frenet-Serret参考系由沿样条长度的单位切线、单位法向量和单位副法向量的标准正交基定义。计算了沿三维三次样条的位置采样的单位切向量集,对应于每个亚单位(在上升测量期间确定)。然后在法-副法线平面上旋转一个大小等于纤维半径的矢量,该矢量沿Frenet-Serret坐标系中的法向轴方向,在Frenet-Serret坐标系的原点处旋转其尾部,直到其头部与相应亚单位质心之间的距离最小化。这个旋转角度定义了原聚体的绝对角扭转。为了测量沿短螺距螺旋的扭转,计算了连续绝对角扭转之间的差值。gydF4y2Ba
行波分析模型gydF4y2Ba
对弯曲纤维的瞬时捻度与原聚体指数图的检查显示,沿着每条纤维线都有明显的正弦曲线。此外,随着曲率沿cryoDRGN轨迹的增加,这种正弦模式的大小和位置都发生了变化。因此,我们将每条链的弯曲-扭曲现象建模为行波,使用公式:gydF4y2Ba
在哪里gydF4y2BaugydF4y2Ba(gydF4y2BaxgydF4y2Ba,gydF4y2BatgydF4y2Ba为瞬时扭转,gydF4y2Ba一个gydF4y2Ba是曲率和扭转振幅之间的耦合因子,gydF4y2BakgydF4y2Ba是传播因子,它决定了扭转波沿灯丝长度弯曲时的传播速度,gydF4y2BaxgydF4y2Ba曲率,gydF4y2BaωgydF4y2Ba是扭转的周期,gydF4y2BatgydF4y2Ba是沿中轴的位置(参数化为原聚体指数),gydF4y2BaφgydF4y2Ba是捻和的相移吗gydF4y2BaBgydF4y2Ba是整体平均捻度。该方程与每一个16原聚体cryoDRGN模型的测量捻度值和估计曲率进行了联合拟合。每个模型的曲率被测量为中心轴样条的瞬时三维曲率的平均值。对于ADP核苷酸状态,使用了所有帧。为ADP-PgydF4y2Ba我gydF4y2Ba状态下,前三帧曲率低,曲率测量波动,因此由于中央样条的平均曲率测量不准确,它们被省略了。模型参数的拟合值见补充表gydF4y2Ba2gydF4y2Ba,通过实验数据拟合示例函数见扩展数据图。gydF4y2Ba6 a、bgydF4y2Ba.gydF4y2Ba
分析中轴变形gydF4y2Ba
在16原聚体cryoDRGN模型的中心轴上分析了纤维的弯曲变形。在欧氏空间中对沿轴样条采样的坐标进行主成分分析。第一主成分和第二主成分定义的平面代表灯丝最大曲率的平面。由第一主成分和第三主成分组成的平面表示一个捕捉弯曲长丝三维特性的正交平面。通过测量中轴与直线拟合的偏差,也分析了中轴变形。对于每个弯曲的cryoDRGN模型,一条直线对准其中轴的末端56 Å,在带刺端。然后沿中轴进行离散的0.28 Å采样步长,将采样点与直线的距离绘制在扩展数据图中。gydF4y2Ba5 egydF4y2Ba.gydF4y2Ba
肌动蛋白子域测量gydF4y2Ba
Actin子结构域的定义使用先前建立的残差分配约定gydF4y2Ba83gydF4y2Ba子域1 (SD1):氨基酸5 - 32,70 - 144,338 - 375;SD2:氨基酸33-69;SD3:氨基酸145-180,270-337;SD4:氨基酸181-269。使用自定义的Python脚本,在扩展数据图中表示子域之间的欧氏距离、角度和二面角。gydF4y2Ba6gydF4y2Ba被测量。原聚体分度从尖端开始,一直发展到倒刺端。对于跨越多个原聚体的测量,原聚体指数对应于最尖端的原聚体。gydF4y2Ba
亚基剪切测量gydF4y2Ba
对于剪切测量,不对称F-actin模型的每个原聚体都与相同核苷酸状态的对应高分辨率、螺旋对称模型的原聚体对齐。然后计算这些模型之间每个子域的平均位移向量。通过观察非相邻子域之间的反相关位移,我们定义了两个剪切指数来描述这些协调变形:剪切指数1,子域1和4个位移向量的点积,剪切指数2,子域2和3个位移向量的点积。子畴位移向量对的剪切指数在单个大小较大且方向相反的情况下会有较大的负值,表明剪切,而较小的位移或缺乏相关的子畴位移则会产生接近零的值。gydF4y2Ba
应变分析gydF4y2Ba
为了量化不能用刚体运动解释的蛋白质变形,使用定制的Python脚本执行了应变伪能分析,实现了前面描述的方法gydF4y2Ba84gydF4y2Ba,gydF4y2Ba85gydF4y2Ba.简而言之,参考螺旋型f -肌动蛋白原体与被比较模型的每个原体都是刚体拟合的。估算了参考原聚体的每个α -碳在8 Å邻域内的局部变形矩阵。欧拉应变张量是用变形矩阵空间导数的一阶近似来计算的。然后直接从这个应变张量计算剪切应变能。这种蛋白质变形方法的主要优点是旋转不变性,并将刚体运动与内部变形区分开。然而,对于非常大的变形,局部变形估计可能是不准确的,这限制了我们的应变分析只针对个别的原聚体。此外,一阶近似假设连续的,而不是颗粒状的,变形,这使得测量相对假能量。gydF4y2Ba
图,统计和分子图形gydF4y2Ba
使用GraphPad Prism或Matplotlib生成图gydF4y2Ba86gydF4y2Ba.使用GraphPad Prism进行统计检验。利用UCSF Chimera制备分子图形gydF4y2Ba72gydF4y2Ba和加州大学旧金山分校ChimeraXgydF4y2Ba78gydF4y2Ba.gydF4y2Ba
报告总结gydF4y2Ba
关于研究设计的进一步信息可在gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到本文。gydF4y2Ba
数据可用性gydF4y2Ba
Cryo-EM密度图和相应的原子模型已保存在PDB和EMDB中,附带以下登录代码:gydF4y2Ba8 d13gydF4y2BaEMDB:gydF4y2Baemd - 27114gydF4y2Ba);螺旋对称ADP-PgydF4y2Ba我gydF4y2Ba-F-actin (PDB:gydF4y2Ba8 d14gydF4y2BaEMDB:gydF4y2Baemd - 27115gydF4y2Ba);不对称弯曲ADP-F-actin (PDB:gydF4y2Ba8 d15gydF4y2BaEMDB:gydF4y2Baemd - 27116gydF4y2Ba);不对称弯曲ADP-PgydF4y2Ba我gydF4y2Ba-F-actin (PDB:gydF4y2Ba8 d16gydF4y2BaEMDB:gydF4y2Baemd - 27117gydF4y2Ba);非对称直接ADP-F-actin对照1 (PDB:gydF4y2Ba8 d17gydF4y2BaEMDB:gydF4y2Baemd - 27118gydF4y2Ba);非对称直接ADP-F-actin对照2 (PDB:gydF4y2Ba8 d18gydF4y2BaEMDB:gydF4y2Baemd - 27119gydF4y2Ba).Cryo-EM数据集已储存于EMPIAR中,其接入代码如下:ADP-F-actin (gydF4y2Baempiar - 11128gydF4y2Ba);ADP-PgydF4y2Ba我gydF4y2Ba-F-actin (gydF4y2Baempiar - 11129gydF4y2Ba).这些沉积包括原始电影和处理过的粒子堆栈,用于生成沉积在EMDB中的最终重建。cryoDRGN分析、神经网络训练和cofilin切割分析的数据集可在Zenodo获得。用于训练去噪自动编码器和语义分割神经网络以及训练过的网络的合成数据集在gydF4y2Bahttps://doi.org/10.5281/zenodo.6917913gydF4y2Ba.CryoDRGN重构、拟合模型、训练过的CryoDRGN网络以及训练过的CryoDRGN网络所需的数据均可在以下网站获得gydF4y2Bahttps://doi.org/10.5281/zenodo.6928604gydF4y2Ba.Cofilin TIRF显微镜数据可在gydF4y2Bahttps://doi.org/10.5281/zenodo.6929148gydF4y2Ba.评估本研究结论所需的所有其他数据都在稿件中给出。资料可从通讯作者处获取,不受限制。gydF4y2Ba源数据gydF4y2Ba都提供了这张纸。gydF4y2Ba
代码的可用性gydF4y2Ba
所有与本研究相关的定制代码都是开源的,可以不受限制地下载。Cryo-EM分析软件可在GitHub (gydF4y2Bahttps://github.com/alushinlab/bent_actingydF4y2Ba),以及分析TIRF视频的脚本可在Zenodo (gydF4y2Bahttps://doi.org/10.5281/zenodo.6929148gydF4y2Ba).gydF4y2Ba
参考文献gydF4y2Ba
波拉德,T. D.鲍西,G. G.肌动蛋白丝组装和拆卸驱动的细胞运动。gydF4y2Ba细胞gydF4y2Ba112gydF4y2Ba, 453 - 465(2003)。gydF4y2Ba
肌动蛋白聚合驱动的细胞运动。gydF4y2BaBiophys。J。gydF4y2Ba71gydF4y2Ba, 3030 - 3045(1996)。gydF4y2Ba
肌动蛋白聚合产生的力II:弹性棘轮和栓系细丝。gydF4y2BaBiophys。J。gydF4y2Ba84gydF4y2Ba, 1591 - 1605(2003)。gydF4y2Ba
Jégou, A. & Romet-Lemonne, G.机械调节肌动蛋白丝以调节肌动蛋白结合蛋白的作用。gydF4y2Ba咕咕叫。当今。细胞生物。gydF4y2Ba68gydF4y2Ba, 72 - 80(2021)。gydF4y2Ba
通过肌动蛋白丝的细胞力感应。gydF4y2Ba2月J。gydF4y2Bahttps://doi.org/10.1111/febs.16568gydF4y2Ba(2022)。gydF4y2Ba
波拉德,T. D,布兰钦,L.和马林斯,R. D.非肌肉细胞中控制肌动蛋白丝动态的分子机制。gydF4y2Ba为基础。启Biophys。Biomol。结构体。gydF4y2Ba29gydF4y2Ba, 545 - 576(2000)。gydF4y2Ba
卡梅隆,l.a, Svitkina, t.m., Vignjevic, D, Theriot, J. A. & Borisy, G. G.肌动蛋白彗尾的树状组织。gydF4y2Ba咕咕叫。医学杂志。gydF4y2Ba11gydF4y2Ba, 130 - 135(2001)。gydF4y2Ba
Svitkina, t.m, Verkhovsky, a.b, McQuade, K. M. & Borisy, G. G.鱼表皮角化细胞中肌动蛋白-肌球蛋白II系统的分析:细胞体易位的机制。gydF4y2Baj .细胞杂志。gydF4y2Ba139gydF4y2Ba, 397 - 415(1997)。gydF4y2Ba
赤松,M.等。网格蛋白介导的胞吞过程中肌动蛋白骨架的自组织和负荷适应原理。gydF4y2BaeLifegydF4y2Ba9gydF4y2Bae49840(2020)。gydF4y2Ba
Jasnin, M.等人。囊状肌动蛋白网络的弹性产生纳米牛顿的突出力。gydF4y2BaCommun Nat。gydF4y2Ba13gydF4y2Ba3842(2022)。gydF4y2Ba
Ponti, A., Machacek, M., gupta, s.l., waterman - storage, c.m. & Danuser, G.两种不同的肌动蛋白网络驱动迁移细胞的突出。gydF4y2Ba科学gydF4y2Ba305gydF4y2Ba, 1782 - 1786(2004)。gydF4y2Ba
Galkin, V. E, Orlova, A. & Egelman, E. H.肌动蛋白丝作为张力传感器。gydF4y2Ba咕咕叫。医学杂志。gydF4y2Ba22gydF4y2BaR96-R101(2012)。gydF4y2Ba
Zimmermann, D., Santos, A., Kovar, D. R. & Rock, R. S.肌动蛋白年龄调节肌凝蛋白-5和肌凝蛋白-6的运行长度。gydF4y2Ba咕咕叫。医学杂志。gydF4y2Ba25gydF4y2Ba, 2057 - 2062(2015)。gydF4y2Ba
棘阿米巴肌动蛋白(ADF/cofilin)与肌动蛋白丝相互作用的机制。gydF4y2Ba生物。化学。gydF4y2Ba274gydF4y2Ba, 15538 - 15546(1999)。gydF4y2Ba
苏亚雷斯,C.等。Cofilin调节肌动蛋白丝的核苷酸状态,并在裸露和修饰的片段边界处断开。gydF4y2Ba咕咕叫。医学杂志。gydF4y2Ba21gydF4y2Ba, 862 - 868(2011)。gydF4y2Ba
Hayakawa, K., Tatsumi, H. & Sokabe, M., Actin丝作为张力传感器的功能是通过张力依赖的cofilin结合到丝上。gydF4y2Baj .细胞杂志。gydF4y2Ba195gydF4y2Ba, 721 - 727(2011)。gydF4y2Ba
Wioland, H., Jegou, A. & Romet-Lemonne, G. ADF/cofilin对交联肌动蛋白丝产生的扭转应力促进了它们的切断。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba116gydF4y2Ba, 2595 - 2602(2019)。gydF4y2Ba
潘迪特,N. G.等。Arp2/3复合物的力和磷酸盐释放促进肌动蛋白丝分支的分离。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba117gydF4y2Ba, 13519 - 13528(2020)。gydF4y2Ba
Risca, v.i.等人。肌动蛋白丝的曲率偏移了分支方向。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba109gydF4y2Ba, 2913 - 2918(2012)。gydF4y2Ba
Bieling, P.等。力反馈控制自组装分支肌动蛋白网络的电机活性和机械性能。gydF4y2Ba细胞gydF4y2Ba164gydF4y2Ba, 115 - 127(2016)。gydF4y2Ba
穆勒,J.等。薄片肌动蛋白网络的负载适应。gydF4y2Ba细胞gydF4y2Ba171gydF4y2Ba, 188 - 200(2017)。gydF4y2Ba
Ge, P, Durer, Z. A. O, Kudryashov, D., Zhou, Z. H. & Reisler, E. Cryo-EM揭示了ADP -和ADP - befx肌动蛋白丝不同的冠状蛋白结合模式。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba21gydF4y2Ba, 1075 - 1081(2014)。gydF4y2Ba
Mei, L.等。α-连环蛋白直接感知肌动蛋白力的分子机制。gydF4y2BaeLifegydF4y2Ba9gydF4y2Bae62514(2020)。gydF4y2Ba
太阳,x等。通过LIM结构域直接结合绷紧的f -肌动蛋白实现机械感应。gydF4y2BaDev细胞。gydF4y2Ba55gydF4y2Ba, 468 - 482(2020)。gydF4y2Ba
Winkelman, J. D., Anderson, C. A, Suarez, C., Kovar, D. R. & Gardel, M. L.进化多样性的含有LIM结构域的蛋白质通过一种保守机制结合受应力的肌动蛋白丝。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba117gydF4y2Ba, 25532 - 25542(2020)。gydF4y2Ba
小田田,伊瓦沙,艾原,T, Maéda, Y.和成田。球状肌动蛋白向纤维肌动蛋白转变的性质。gydF4y2Ba自然gydF4y2Ba457gydF4y2Ba, 441 - 445(2009)。gydF4y2Ba
美利奴,F.等。低温电子显微镜显示ATP水解时f -肌动蛋白在近原子分辨率下的结构转变。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba25gydF4y2Ba, 528 - 537(2018)。gydF4y2Ba
phalloidin和jasplakininside与肌动蛋白丝结合的结构效应和功能意义。gydF4y2Ba结构gydF4y2Ba28gydF4y2Ba, 437 - 449(2020)。gydF4y2Ba
肌动蛋白的结构与功能。gydF4y2Ba为基础。启Biophys。gydF4y2Ba40gydF4y2Ba, 169 - 186(2011)。gydF4y2Ba
Galkin, V. E. Orlova, A. Schröder, G. F. & Egelman, E. H. f -肌动蛋白的结构多态性。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba17gydF4y2Ba, 1318 - 1323(2010)。gydF4y2Ba
小田田,武田顺,成田等。Maéda。肌动蛋白的结构多态性。gydF4y2Baj·摩尔,杂志。gydF4y2Ba431gydF4y2Ba, 3217 - 3228(2019)。gydF4y2Ba
周淑贞,波拉德,t.d.。三种不同核苷酸结合的肌动蛋白丝的低温电镜结构揭示的肌动蛋白聚合机制。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba116gydF4y2Ba, 4265 - 4274(2019)。gydF4y2Ba
McGough, A., Pope, B., Chiu, W.和Weeds, A. Cofilin改变f -肌动蛋白扭转:对肌动蛋白丝动态和细胞功能的影响。gydF4y2Baj .细胞杂志。gydF4y2Ba138gydF4y2Ba, 771 - 781(1997)。gydF4y2Ba
田中,k等人。复合蛋白结合和肌动蛋白丝拆卸的结构基础。gydF4y2BaCommun Nat。gydF4y2Ba9gydF4y2Ba1860(2018)。gydF4y2Ba
Isambert, H.等。由热波动衍生的肌动蛋白丝的灵活性:结合核苷酸、phalloidin和肌肉调节蛋白的影响。gydF4y2Ba生物。化学。gydF4y2Ba270gydF4y2Ba, 11437 - 11444(1995)。gydF4y2Ba
Saunders, m.g. & Voth, g.a.肌动蛋白丝模型之间的比较:粗粒化揭示了本质差异。gydF4y2Ba结构gydF4y2Ba20.gydF4y2Ba, 641 - 653(2012)。gydF4y2Ba
德·拉·克鲁兹,e.m.,罗兰,J.,麦卡洛,B. R.,布兰乔因,L.和马蒂尔,J.-L.。肌动蛋白丝中扭-弯耦合的起源。gydF4y2BaBiophys。J。gydF4y2Ba99gydF4y2Ba, 1852 - 1860(2010)。gydF4y2Ba
Katkar, H. H.等人。洞察肌动蛋白丝中ATP水解的协同性质。gydF4y2BaBiophys。J。gydF4y2Ba115gydF4y2Ba, 1589 - 1602(2018)。gydF4y2Ba
W. Oosterheert, Klink, B. U. Belyy, A. Pospich, S. & Raunser, S.肌动蛋白丝组装和老化的结构基础。预印在gydF4y2BabioRxivgydF4y2Bahttps://doi.org/10.1101/2022.03.29.486216gydF4y2Ba(2022)。gydF4y2Ba
Das, S.等。phalloidin结合F-actin的D-loop动力学和近原子分辨率的冷- em结构。gydF4y2Ba结构gydF4y2Ba28gydF4y2Ba, 586 - 593(2020)。gydF4y2Ba
龚锐等。机械感觉立体纤毛肌球蛋白-15对肌动蛋白动态调节的结构基础。gydF4y2Ba科学。睡觉。gydF4y2Ba8gydF4y2Baeabl4733(2022)。gydF4y2Ba
肌动蛋白核苷酸结合裂隙中的水分子:对亚基构象的影响和ATP水解的意义。gydF4y2Baj·摩尔,杂志。gydF4y2Ba413gydF4y2Ba, 279 - 291(2011)。gydF4y2Ba
Kang, H.等。识别肌动蛋白上驱动聚合和调节弯曲刚度的阳离子结合位点。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba109gydF4y2Ba, 16923 - 16927(2012)。gydF4y2Ba
阿姆斯特朗等人。低温电子显微镜样品印迹过程中的微尺度流体行为。gydF4y2BaBiophys。J。gydF4y2Ba118gydF4y2Ba, 708 - 719(2020)。gydF4y2Ba
柴田,松美,H,合泽,S。低温电子显微镜揭示弯曲细菌鞭毛钩的扭矩传递机制。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba26gydF4y2Ba, 941 - 945(2019)。gydF4y2Ba
吉布森,K. H.等。钩端螺旋体的非对称鞘控制着鞭毛的超卷曲和运动。gydF4y2BaeLifegydF4y2Ba9gydF4y2Bae53672(2020)。gydF4y2Ba
Orlova, A. & Egelman, E. H.肌动蛋白亚基的构象变化可以改变肌动蛋白丝的柔韧性。gydF4y2Baj·摩尔,杂志。gydF4y2Ba232gydF4y2Ba, 334 - 341(1993)。gydF4y2Ba
麦卡洛,b·R,布兰乔因,L.,玛蒂尔,j·L。& De La Cruz, E. M. Cofilin增加肌动蛋白丝的弯曲灵活性:对切断和细胞力学的影响。gydF4y2Baj·摩尔,杂志。gydF4y2Ba381gydF4y2Ba, 550 - 558(2008)。gydF4y2Ba
郭俊,周鸿祥。蛋白质变构与构象动力学。gydF4y2Ba化学。牧师。gydF4y2Ba116gydF4y2Ba, 6503 - 6515(2016)。gydF4y2Ba
Mani, S., Katkar, H. H. & Voth, G. A.压缩和拉伸变形改变肌动蛋白丝中ATP水解和磷酸盐释放速率。gydF4y2Baj .化学。理论第一版。gydF4y2Ba17gydF4y2Ba, 1900 - 1913(2021)。gydF4y2Ba
帕迪,j.d.和斯普迪奇,j.a.gydF4y2Ba方法酶学gydF4y2Ba第85卷(弗雷德里克森编,D. W. &坎宁安编,L. W.)第18章,164-181(学术,1982年)。gydF4y2Ba
Walt, Svander等人。scikit-image: Python中的图像处理。gydF4y2BaPeerJgydF4y2Ba2gydF4y2Bae453(2014)。gydF4y2Ba
利用样本运动的稳健预测的自动电子显微镜层析成像。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba152gydF4y2Ba36-51(2005)。gydF4y2Ba
郑世强,郑世强等。MotionCor2:用于改进低温电子显微镜的光束诱导运动的各向异性校正。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 331 - 332(2017)。gydF4y2Ba
Grant, T. & grigoriieff, N.使用2.6 Å重建轮状病毒VP6测量单粒子低温- em的最佳暴露。gydF4y2BaeLifegydF4y2Ba4gydF4y2Bae06980(2015)。gydF4y2Ba
CTFFIND4:快速准确的电子显微图像离焦估计。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba192gydF4y2Ba, 216 - 221(2015)。gydF4y2Ba
王f,等。DeepPicker:一种深度学习方法,用于低温- em中完全自动化的粒子选择。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba195gydF4y2Ba, 325 - 336(2016)。gydF4y2Ba
瓦格纳,T.等。spire - cryolo是一种快速、准确的全自动粒子拾取器。gydF4y2BaCommun。医学杂志。gydF4y2Ba2gydF4y2Ba218(2019)。gydF4y2Ba
Bepler, T.等人。用于低温电子显微图像中粒子拾取的正未标记卷积神经网络。gydF4y2BaNat方法。gydF4y2Ba16gydF4y2Ba, 1153 - 1160(2019)。gydF4y2Ba
巴坎,梅雷莱斯,L. M. &巴哈尔,I.普罗迪:从理论和实验推断蛋白质动力学。gydF4y2Ba生物信息学gydF4y2Ba27gydF4y2Ba, 1575 - 1577(2011)。gydF4y2Ba
唐,G.等。EMAN2:用于电子显微镜的可扩展图像处理套件。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba157gydF4y2Ba38-46(2007)。gydF4y2Ba
TensorFlow开发者。TensorFlow (Zenodo, 2022);gydF4y2Bahttps://doi.org/10.5281/zenodo.6574269gydF4y2Ba
Mei, L.等。T-plastin双向交联肌动蛋白的结构机制。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba119gydF4y2Bae2205370119(2022)。gydF4y2Ba
迭代螺旋实空间重建方法:克服真实聚合物所带来的问题。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba157gydF4y2Ba, 83 - 94(2007)。gydF4y2Ba
He, S. & Scheres, S. H. W. RELION的螺旋重建。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba198gydF4y2Ba, 163 - 176(2017)。gydF4y2Ba
齐万诺夫,J.等。用于RELION-3中自动高分辨率低温-电磁结构测定的新工具。gydF4y2BaeLifegydF4y2Ba7gydF4y2Bae42166(2018)。gydF4y2Ba
Punjani, A., Rubinstein, J. L., Fleet, D. J.和Brubaker, M. A. cryoSPARC:快速无监督低温电磁结构测定算法。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 290 - 296(2017)。gydF4y2Ba
谭玉珍等。在单粒子低温电磁中,通过倾斜来确定样品的首选取向。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 793 - 796(2017)。gydF4y2Ba
钟恩德,Bepler, T, Berger, B. & Davis, J. H. CryoDRGN:用神经网络重建异质低温电磁结构。gydF4y2BaNat方法。gydF4y2Ba18gydF4y2Ba, 176 - 185(2021)。gydF4y2Ba
Terwilliger, t.c., Ludtke, s.j, Read, R. J., Adams, P. D. & Afonine, P. V.利用密度修正改进低温- em图。gydF4y2BaNat方法。gydF4y2Ba17gydF4y2Ba, 923 - 927(2020)。gydF4y2Ba
Grigorieff:在gydF4y2Ba方法酶学gydF4y2Ba第579卷(克劳瑟编)第8章,191-226(学术,2016)。gydF4y2Ba
Pettersen, E. F.等。UCSF chimera -一个用于探索性研究和分析的可视化系统。gydF4y2Baj .第一版。化学。gydF4y2Ba25gydF4y2Ba, 1605 - 1612(2004)。gydF4y2Ba
Emsley, P., Lohkamp, B., Scott, W. G. & Cowtan, K.。gydF4y2BaActa Crystalogry。DgydF4y2Ba66gydF4y2Ba, 486 - 501(2010)。gydF4y2Ba
阿凡宁,P. V.等。用于冷冻- em和晶体学的PHENIX实空间精炼。gydF4y2BaActa Crystalogr。DgydF4y2Ba74gydF4y2Ba, 531 - 544(2018)。gydF4y2Ba
Liebschner, D.等。利用x射线、中子和电子测定大分子结构:凤凰的最新进展。gydF4y2BaActa Crystalogr。DgydF4y2Ba75gydF4y2Ba, 861 - 877(2019)。gydF4y2Ba
菲利普斯,J. C.等。可扩展的分子动力学与NAMD。gydF4y2Baj .第一版。化学。gydF4y2Ba26gydF4y2Ba, 1781 - 1802(2005)。gydF4y2Ba
伊索尔德:一个物理上真实的环境,用于建立低分辨率电子密度图的模型。gydF4y2BaActa Crystalogr。DgydF4y2Ba74gydF4y2Ba, 519 - 530(2018)。gydF4y2Ba
戈达德,t.d.等人。UCSF ChimeraX:迎接可视化和分析的现代挑战。gydF4y2Ba蛋白质科学。gydF4y2Ba27gydF4y2Ba14-25(2018)。gydF4y2Ba
田伟,陈春春,雷晓娟,赵晶,梁军。CASTp 3.0:蛋白质表面形貌的计算机图谱。gydF4y2Ba核酸Res。gydF4y2Ba46gydF4y2BaW363-W367(2018)。gydF4y2Ba
波动细丝:螺旋的统计力学。gydF4y2Ba理论物理。启EgydF4y2Ba62gydF4y2Ba, 7135 - 7146(2000)。gydF4y2Ba
Rohou, A. & grigoriieff, N. Frealix:基于模型的电子显微图螺旋丝结构的细化。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba186gydF4y2Ba, 234 - 244(2014)。gydF4y2Ba
德·拉·克鲁兹,e。M。马蒂尔,j。l。力学非均质性有利于张力肌动蛋白丝的破碎。gydF4y2BaBiophys。J。gydF4y2Ba108gydF4y2Ba, 2270 - 2281(2015)。gydF4y2Ba
周淑贞,周淑贞,波拉德,T. D. & Voth, G. A.肌动蛋白丝极化伸长的结构基础。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba117gydF4y2Ba, 30458 - 30464(2020)。gydF4y2Ba
Mitchell, m.r, Tlusty, T. & Leibler, S.蛋白质结构的应变分析和机械变构耦合的低维度。gydF4y2Ba美国国家科学院学报。美国gydF4y2Ba113gydF4y2BaE5847-E5855(2016)。gydF4y2Ba
跨膜通道KcsA蛋白结构数据和变构的弹性应变和扭转分析。gydF4y2Ba理论物理。医学杂志。gydF4y2Ba15gydF4y2Ba036004(2018)。gydF4y2Ba
Matplotlib:一个2D图形环境。gydF4y2Ba第一版。科学。Eng。gydF4y2Ba9gydF4y2Ba, 90 - 95(2007)。gydF4y2Ba
确认gydF4y2Ba
感谢S. Espinosa de los Reyes制备ADP-F-actin网格;R. Ranganathan应变伪能计算伪码;以及H. Ng、J. Sotiris和M. Ebrahim在洛克菲勒大学低温电子显微镜资源中心协助低温电子显微镜数据收集。这项工作由美国国立卫生研究院资助(R01GM141044), Irma T. Hirschl和Monique Weill-Caulier研究奖,g.m.a.r.g.的皮尤生物医学学者奖由H. Li纪念奖学金支持,A.G.C.由NIH T32 GM115327支持。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
M.J.R.和G.M.A.构思了这个项目。M.J.R.开发了定制的低温-电磁分析软件,并执行了论文中提出的所有数据分析。C.H.制备了蛋白质,进行了cofilin分离试验,并制备了低温电镜标本。A.G.C.和R.G.制备了低温电镜标本并收集了低温电镜数据。M.J.R.和G.M.A.撰写了这篇论文,听取了所有作者的意见。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有竞争利益。gydF4y2Ba
同行评审gydF4y2Ba
同行审查的信息gydF4y2Ba
自然gydF4y2Ba感谢Glen Hocky和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行审查报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
扩展的数据图和表gydF4y2Ba
图1 ADP-P的验证gydF4y2Ba我gydF4y2Ba- f -肌动蛋白的制备和螺旋对称重建。gydF4y2Ba
一个gydF4y2Ba,代表性的tirf显微镜视频帧从科菲林切割化验。无cofilin控件显示在每个条件的顶部行,用深色边框表示。比例尺,40 μm。gydF4y2BabgydF4y2Ba,显示平均归一化肌动蛋白通道强度的TIRF视频的量化。图中的误差范围为+/−95% CI。半衰期表示0 s时的指数衰减,可信区间为95%,n值代表独立实验:ADP-F-actin - cofilin(778±24 s, n = 3);ADP-PgydF4y2Ba我gydF4y2Ba- f -actin - cofilin(454±14 s, n = 3);ADP-sulfate-F-actin - cofilin(348±16 s, n = 3);ADP-F-actin + cofilin(50.4±2.1 s, n = 4);ADP-PgydF4y2Ba我gydF4y2Ba-F-actin + cofilin(177.5±10.3 s, n = 3);ADP-sulfate-F-actin + cofilin(86.8±2.5 s、n = 3)。gydF4y2BacgydF4y2Ba, ADP-和ADP- p螺旋对称重建的半映射(左)和映射到模型(右)傅立叶壳相关(FSC)曲线gydF4y2Ba我gydF4y2Ba-F-actin。gydF4y2BadgydF4y2Ba,螺旋对称ADP-F-actin和ADP-P的局部分辨率评估gydF4y2Ba我gydF4y2Ba-F-actin。体育:尖头;是:带刺的结束。gydF4y2BaegydF4y2Ba, ADP核苷基附近的潜在氢键网络。通过杂原子对参与氢键网络的关键侧链和背骨原子进行显示和着色。gydF4y2Ba
图2螺旋对称ADP-F-actin和ADP-P的附加分析gydF4y2Ba我gydF4y2Ba-F-actin模型。gydF4y2Ba
一个gydF4y2Ba,示例低温- em图密度与来自ADP-F-actin(上)和ADP-P的原子模型残基A131-A135叠加gydF4y2Ba我gydF4y2Ba-F-actin(底部)。gydF4y2BabgydF4y2Ba,单个ADP-F-actin原聚体见CgydF4y2BaαgydF4y2Ba表示,用ADP-F-actin和ADP-P之间的每个残差RMSD着色gydF4y2Ba我gydF4y2Ba-F-actin。gydF4y2BacgydF4y2Ba一样,gydF4y2BabgydF4y2Ba,但用每个残余应变伪能着色。gydF4y2BadgydF4y2Ba,扩展的31-原聚体ADP-(蓝色)和ADP- p的叠加gydF4y2Ba我gydF4y2Ba-F-actin(橙色)模型,对准末端倒钩端原聚体。gydF4y2BaegydF4y2Ba,水分子(紫色)包含在ADP-PgydF4y2Ba我gydF4y2Ba-F-actin灯丝的核心。肌动蛋白亚基以透明灰色骨干表示。体育:尖头;是:带刺的结束。gydF4y2Ba
图3神经网络结构和算例性能。gydF4y2Ba
一个gydF4y2Ba,去噪自编码器的神经网络架构图。示例网络输入和输出显示为一个代表性的提取段。gydF4y2BabgydF4y2Ba,语义分割全卷积网络的网络架构图。示例输入和输出的一个代表性提取段显示。gydF4y2BacgydF4y2Ba合成投影图(上)和实验低温-电磁显微图(下)上的丝段的代表性网络性能。比例尺,20纳米。gydF4y2Ba
图4纤维段曲率分布的Boltzmann模型。gydF4y2Ba
一个gydF4y2Ba, ADP-F-actin(上)和ADP-P的曲率分布(左列)gydF4y2Ba我gydF4y2Ba-F-actin(下)的热弯曲概率分布模型。实测分布与理论分布之间的残差图(右列)。灰色曲线对应于调整后的弯曲模型,该模型在能量项中拟合了一个乘法参数。gydF4y2BabgydF4y2Ba, 500 Å弹性杆因热波动弯曲的理论概率分布,模型为玻尔兹曼分布。在5 μm ~ 15 μm范围内,表明纤维弯曲刚度的影响。gydF4y2Ba
图5纤维弯曲变形的附加分析。gydF4y2Ba
一个gydF4y2Ba,螺旋对称ADP-PgydF4y2Ba我gydF4y2Ba-F-actin(左图)和cryoDRGN重建采样ADP-PgydF4y2Ba我gydF4y2Ba- f -肌动蛋白弯曲(右三图)。地图的低通滤波到8 Å,并且线是橙色的阴影。体育:尖头;是:带刺的结束。比例尺,10nm。gydF4y2BabgydF4y2Ba,装订成卷的直的和弯的地图gydF4y2Ba一个gydF4y2Ba排列在底部16个前体上。标尺,100nm。gydF4y2BacgydF4y2Ba,从ADP-F-actin(左)和ADP-P的第0个(青色)和第9个(品红)低温drgn重建的投影gydF4y2Ba我gydF4y2Ba-F-actin(右)在底部原聚体上对齐,并朝向显示最大位移。gydF4y2BadgydF4y2Ba, ADP-F-actin的不对称重建。比例尺,10nm。gydF4y2BaegydF4y2Ba, ADP-F-actin和ADP-P中轴偏离直线的曲线图gydF4y2Ba我gydF4y2Ba-F-actin cryoDRGN重建。第一列和第二列为cryoDRGN重建中心轴的主成分分析。第三列显示了cryoDRGN重建的中心轴从直线到中心轴的带刺终端56 Å的位移。gydF4y2BafgydF4y2Ba,半映射傅立叶壳相关(FSC)曲线控制非对称16原聚体重建。gydF4y2BaggydF4y2Ba,控制不对称16-原聚体重建的扭转和上升测量。gydF4y2Ba
图6纤维弯曲过程中晶格结构重塑的定量。gydF4y2Ba
一个gydF4y2Ba,行波方程的图(黑线)与不同曲率的cryoDRGN重建的测量扭转值(彩色点)拟合。gydF4y2BabgydF4y2Ba,在不同曲率处的扭曲行波函数图,以链分隔。gydF4y2BacgydF4y2Ba, ADP-F-actin(蓝色)和ADP-P最弯曲的cryoDRGN重建的ISOLDE模型的链内、链间和原聚体内子域距离和角度图gydF4y2Ba我gydF4y2Ba-F-actin(橙色)。实线和虚线分别表示偶(凹面)和奇(凸面)前体。gydF4y2Ba
图7高分辨率弯曲f -肌动蛋白不对称重建的分辨率评估和验证。gydF4y2Ba
一个gydF4y2Ba,弯曲ADP-F-actin和ADP-P的局部分辨率评估gydF4y2Ba我gydF4y2Ba-F-actin重建,以及两个独立的直接ADP-F-actin控制。体育:尖头;是:带刺的结束。gydF4y2BabgydF4y2Ba,非对称弯曲ADP-F-actin的半映射(左)和映射-模型(右)傅立叶壳相关(FSC)曲线gydF4y2Ba我gydF4y2Ba-F-actin和直接ADP-F-actin控制。gydF4y2BacgydF4y2Ba,用于非对称重建的3D-FSC曲线,表示弯曲和直线重建之间等效的各向同性分辨率。绿色虚线表示+/−1 s.d。从平均FSC。gydF4y2BadgydF4y2Ba,矢量图(按方向着色,比例为6X)表示CgydF4y2BaαgydF4y2Ba螺旋对称模型和非对称重建模型之间的位移,在中心原聚体上对齐。gydF4y2Ba
图8弯曲f -肌动蛋白中原体间接触位点的应变和柔韧性。gydF4y2Ba
一个gydF4y2BaC、灰色gydF4y2BaαgydF4y2Ba弯曲的f -肌动蛋白中指定的原聚体的表示,相对于h -塞(左)和d -环(右)上的螺旋对称模型,通过计算每个残余应变伪能局部着色。gydF4y2BabgydF4y2Ba,非对称F-actin映射中的D-loop异质性。用ADP-F-actin (7R8V)的docked PDB模型显示了非对称重构中每个独特d环周围的局部密度,该模型具有“内”和“外”d环构象。gydF4y2Ba
图9亚基间界面的空间相遇将丝束弯曲应变传递给原聚体。gydF4y2Ba
一个gydF4y2Ba,纵向界面和gydF4y2BabgydF4y2Ba,弯曲的ADP-F-actin(左)和ADP-P的横向界面gydF4y2Ba我gydF4y2Ba-F-actin(右)。实线和虚线分别表示曲线的内部(凹)和外部(凸)。透明的箭头代表单独的CgydF4y2BaαgydF4y2Ba螺旋对称模型的位移按比例缩放为6X,实箭头显示显示区域按比例缩放为20X的平均位移。体育:尖头;是:带刺的结束。gydF4y2Ba
图10 F-actin弯曲重塑了abp参与的亚基间接口。gydF4y2Ba
一个gydF4y2BaCgydF4y2BaαgydF4y2Ba内链前体6- 8(凹的,矢车菊蓝色)和外链前体7- 9(凸的,浅蓝色)的纵向接口从最弯曲的ADP-F-actin cryoDRGN 16-前体原子模型中提取,叠加在从ADP-F-actin螺旋模型中提取的2个前体的带刺端亚基上(灰色)。框内包含abp的主要接触区域。是:带刺的结束;体育:尖头。显示肌动蛋白子结构域。gydF4y2BabgydF4y2Ba,指示abp(粉色空间填充模型)的绑定接口叠加在的弯曲接口上gydF4y2Ba一个gydF4y2Ba.Cofilin, PDB 5 yu8;冠状蛋白,EMDB 6100 / PDB 2AQ5;ARP2/3 PDB 7 tpt;α连环蛋白,PDB 6 upv;myosin-5, PDB 7 plt。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
补充表1-3:cryo-EM数据收集、精化和验证统计及扭转行波方程参数。补充讨论:详细的结构分析和弯曲变形的热波动模拟。gydF4y2Ba
ADP-F-actin和ADP-P中的溶剂化核苷酸裂解gydF4y2Ba我gydF4y2Ba-F-actin。gydF4y2Ba
ADP-F-actin(蓝色)和ADP-P的视图gydF4y2Ba我gydF4y2Ba-F-actin(橙色)核苷酸裂解。原子模型用Cα表示。显示来自地图的透明灰色密度。绿色,ADP;黄色,阿宝gydF4y2Ba4gydF4y2Ba3−gydF4y2Ba;亮绿色叶,毫克gydF4y2Ba2 +gydF4y2Ba;紫罗兰色,水。在ADP / POgydF4y2Ba4gydF4y2Ba3−gydF4y2Ba氮原子是蓝色的,氧原子是红色的,磷原子是黄色的。gydF4y2Ba
辅助视频2 cryo-DRGN重建的弯曲轨迹上的变形。gydF4y2Ba
ADP-F-actin和ADP-P连续弯曲的低温- drgn重构形态gydF4y2Ba我gydF4y2Ba-F-actin,低通过滤到8 Å,并在两个底部原聚体上对齐,以及相关的螺旋参数。重构的ADP-F-actin链用蓝色着色,重构的ADP-PgydF4y2Ba我gydF4y2Ba- f -肌动蛋白链呈橘黄色。上升和扭曲的测量是由线分开的,随着曲率的增加颜色变深。垂直虚线表示标准f -肌动蛋白的螺旋参数。gydF4y2Ba
ADP-F-actin不对称弯曲和直线重构的形态。gydF4y2Ba
非对称重构ADP图的形态,在中心原聚体对齐。这两个映射都是从非对称的直接ADP映射1开始的。左变形插值到弯曲ADP映射;右变形插值到直ADP映射2。gydF4y2Ba
补充视频4直线和弯曲f -肌动蛋白高亮亚基剪切之间的变化。gydF4y2Ba
原聚体子域剪切从螺旋对称模型到弯曲原聚体模型的变化。向量(按比例100×)表示子域平均位移。gydF4y2Ba
补充视频5变形突出显示弯曲期间的纵向界面变形。gydF4y2Ba
ADP-F-actin(左)和ADP-P的纵向界面形态gydF4y2Ba我gydF4y2Ba-F-actin(右)模型由螺旋对称模型变为弯曲模型。透明的箭头表示螺旋对称模型中的单个Cα位移,实箭头表示指示区域的平均位移,按比例缩放为20倍。gydF4y2Ba
补充视频6变形突出横向界面变形在弯曲。gydF4y2Ba
ADP-F-actin(左)和ADP-P的横向界面形态gydF4y2Ba我gydF4y2Ba-F-actin(右)模型由螺旋对称模型变为弯曲模型。透明的箭头表示螺旋对称模型中的单个Cα位移,实箭头表示按比例缩放20×的指示区域的平均位移。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的使用范围,您将需要直接从版权所有者那里获得许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
雷诺兹,m.j.,八町,C,卡尔,A.G.gydF4y2Baet al。gydF4y2Ba弯曲力和核苷酸状态共同调节F-actin结构。gydF4y2Ba自然gydF4y2Ba(2022)。https://doi.org/10.1038/s41586-022-05366-wgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05366-wgydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba