摘要gydF4y2Ba
SEA复合体(SEAC)是一种生长调节剂,作为GTPase激活蛋白(GAP)作用于Gtr1, Gtr1是一种Rag GTPase,它将营养状态传递到酵母中雷帕霉素复合体1的靶蛋白(TORC1)gydF4y2Ba1gydF4y2Ba.在功能上,SEAC被分为两个亚复合物:具有GAP活性并抑制TORC1的SEACIT和调控SEACIT的SEACATgydF4y2Ba2gydF4y2Ba.这个系统在哺乳动物中是保守的:GATOR复合体,由GATOR1 (SEACIT)和GATOR2 (SEACAT)组成,传递氨基酸gydF4y2Ba3.gydF4y2Ba和葡萄糖gydF4y2Ba4 gydF4y2BamTORC1信号。尽管SEAC/GATOR很重要,但它的结构以及对其功能的分子理解仍然缺乏。在这里,我们解决了原生八亚基SEAC的低温-电磁结构。SEAC具有模块化结构,其中对应于SEACAT的一个类似于copii的笼子绑定了对应于SEACIT的两个柔性机翼。机翼通过Sea3与核心相连,Sea3是两个模块的组成部分。GATOR1的GAP机制在SEACIT中被保守,GAP活性在体外不受SEACAT的影响。在体内,翅膀主要是通过EGO复合体将SEAC招募到液泡中所必需的。我们的结果表明,SEACAT不是SEACIT的直接抑制剂,而是作为TORC1调控因子结合的支架。gydF4y2Ba
主要gydF4y2Ba
在萌芽的酵母中gydF4y2Ba酿酒酵母gydF4y2Ba雷帕霉素复合物1靶点(TORC1)位于液泡膜上,从EGO复合物(EGOC)接收营养来源的输入。gydF4y2Ba5gydF4y2Ba这是哺乳动物调节剂- rag复合物的酵母对应物gydF4y2Ba6gydF4y2Ba.Gtr1和Gtr2是在EGOC中发现的两个rag家族gtpase,根据它们的核苷酸加载状态调节TORC1的活性。Gtr1和Gtr2受专门的gap调控,即seh1相关复合物(SEAC)gydF4y2Ba1gydF4y2Ba和Lst4 / Lst7 (ref。gydF4y2Ba7gydF4y2Ba),分别。SEA复合物(SEAC)最初被描述为一种与coatomer相关的复合物gydF4y2Ba8gydF4y2Ba后来被报道在功能上分为两个亚复合体:SEACIT,它具有Gtr1 GAP活性,从而抑制TORC1(参考文献)。gydF4y2Ba1gydF4y2Ba)和SEACAT,它表面上拮抗SEACIT,从而激活TORC1(参考文献。gydF4y2Ba2gydF4y2Ba).在哺乳动物中,SEAC对应蛋白(GATOR)在功能上也被分为GAP亚复合体(GATOR1)和它的调控因子(GATOR2)。gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
SEAC由八个子单元组成gydF4y2Ba8gydF4y2Ba(括号中的GATOR子单元gydF4y2Ba3.gydF4y2Ba):形成SEACIT (GATOR1)亚复合体的Sea1/Iml1 (DEPDC5)、Npr2 (Nprl2)和Npr3 (Nprl3),以及形成SEACAT (GATOR2)亚复合体的Sea2 (Wdr24)、Sea3 (Wdr59)、Sea4 (Mios)、Seh1 (Seh1L)和Sec13 (Sec13)。在GATOR1中,Nprl2含有催化的“精氨酸指”(Nprl2gydF4y2BaArg78gydF4y2Ba)gydF4y2Ba9gydF4y2Ba而在酵母中,这种功能被分配给了Sea1中的精氨酸(Sea1gydF4y2BaArg943gydF4y2Ba)gydF4y2Ba1gydF4y2Ba.此外,regulator - rag可以在“抑制”和“GAP”模式下结合GATOR1gydF4y2Ba10gydF4y2Ba.目前尚不清楚GATOR1中观察到的GAP机制和结合模式在SEACIT中是否保守。gydF4y2Ba
尽管有报道称哺乳动物氮传感器通过与GATOR2结合来调节GATOR1的活性(参考文献)。gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba), GATOR2如何调节GATOR1是未知的,结构的缺乏阻碍了对TOR信号中枢的更好理解。因此,我们着手解决相应的SEAC的结构。gydF4y2Ba
SEAC的Cryo-EM结构gydF4y2Ba
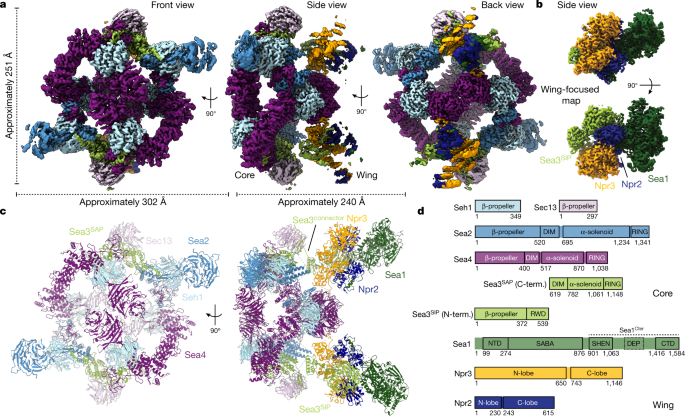
用温和的方法从酵母细胞中纯化内源性SEAC,得到完整且相对稳定的复合物。gydF4y2Ba1gydF4y2Ba).经过大量的样品和数据收集优化,获得了SEAC的低温电子显微镜(cryo-EM)重建,平均分辨率为3.0 Å(图1)。gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba1罪犯gydF4y2Ba).该结构由一个二聚体中心核心组成,作为两个相同的柔性翅膀的对称绑定平台。我们使用了一系列遮罩和重点细化来提高分辨率(扩展数据图。gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba),得到核心和翅膀分别在2.8 Å和2.7 Å分辨率的地图(图5)。gydF4y2Ba1 bgydF4y2Ba).使用AlphaFold结构预测gydF4y2Ba14gydF4y2Ba和Seh1和Sec13的晶体结构,我们建立了一个八聚体SEAC的模型(补充表gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba3.gydF4y2Ba),这与之前的交联和蛋白水解数据一致gydF4y2Ba15gydF4y2Ba,这解释了之前的生化观察结果(见下文)。gydF4y2Ba
SEAC形成一个中空,gydF4y2BaCgydF4y2Ba2个对称的笼状结构,尺寸约为251 Å × 302 Å × 240 Å,包含22个蛋白质链,质量约为2个MDa(图1)。gydF4y2Ba1 cgydF4y2Ba).每个子单元都有两个副本,除了Sea4和Seh1,它们分别有四个和六个副本。中心核包括Seh1、Sec13、Sea2、Sea4和Sea3gydF4y2BactgydF4y2Ba,而机翼则由Sea3组成gydF4y2Ba山gydF4y2Ba, Sea1, Npr2和Npr3(图4)gydF4y2Ba1 dgydF4y2Ba).与功能研究一致,核心亚单元先前已被分配给SEACATgydF4y2Ba2gydF4y2Ba和机翼子单元到SEACITgydF4y2Ba1gydF4y2Ba除了对这两个实体都有贡献的Sea3。由于它们各自在SEAC中的位置,我们称其为Sea3gydF4y2Ba山gydF4y2Ba随着Sea3gydF4y2BaSIPgydF4y2Ba(SEACIT部分)和Sea3gydF4y2BactgydF4y2Ba随着Sea3gydF4y2BaSAPgydF4y2Ba(海猫部分)。一个灵活的连接器(Sea3连接器)将机翼系在核心上,但在密度中不可见(图2)。gydF4y2Ba1 cgydF4y2Ba)连接海洋3号gydF4y2BaSIPgydF4y2Ba和Sea3gydF4y2BaSAPgydF4y2Ba.这种结构使翅膀相对于核心独立运动,并表明在体内,而不是两个独立的子复合体,SEACAT和SEACIT代表一个复合体中的两个模块。这也解释了为什么失去Sea3会导致SEACIT从SEACAT分离gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba.gydF4y2Ba
SEAC是一个类似于大衣的综合体gydF4y2Ba
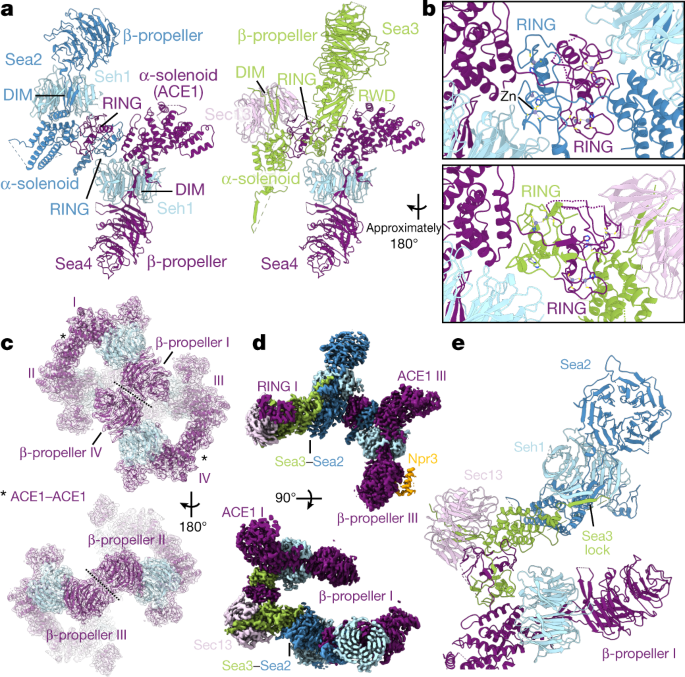
三个主要核心子单元,Sea2, Sea3和Sea4,共享相同的域架构(图4)。gydF4y2Ba1 dgydF4y2Ba).它们由一个n端β-螺旋桨结构域和一个短结构域侵入基序(DIM)组成。gydF4y2Ba17gydF4y2Ba, α-螺线管域和c端RING域。gydF4y2Ba2gydF4y2Ba).这种结构域的排列类似于衣客蛋白,认为这些亚基是从一个共同的原衣客祖先进化而来的gydF4y2Ba8gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.正如预期的gydF4y2Ba8gydF4y2Ba, AlphaFold对相应GATOR2子单元的预测显示了类似的域组织(扩展数据图。gydF4y2Ba4 a、bgydF4y2Ba).这些亚基中的每一个都与SEAC中两个小的coatomer β-螺旋桨中的一个形成二聚体;具体来说,Sea4和Sea2与Seh1结合,而Sea3与Sec13结合。gydF4y2Ba2gydF4y2Ba).二聚发生的机制与核孔中观察到的类似gydF4y2Ba17gydF4y2Ba和COPIIgydF4y2Ba19gydF4y2Ba插入一个DIM,贡献了第七个叶片,并关闭了Seh1和Sec13的开放β-螺旋桨(扩展数据图。gydF4y2Ba4 c, dgydF4y2Ba).这锁定了n端β-螺旋桨结构域相对于α-螺线管的方向,固定了两个结构域的角度,以促进特定的蛋白质-蛋白质相互作用。因此,Seh1和Sec13(以及一般的β-螺旋桨结构域-在SEAC中有16个)发挥着关键的结构作用,解释了它们在体内对SEACAT功能的重要性gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba, Sea4-Seh1, Sea2-Seh1和Sea3-Sec13的结构。Sea2(左)和Sea3(右)都通过c端RING结构域与Sea4相互作用。gydF4y2BabgydF4y2Ba,放大查看Sea2和Sea4(上)或Sea3和Sea4(下)之间的RING-RING相互作用。gydF4y2BacgydF4y2Ba, Sea4-Seh1核心笼结构,由4个Sea4-Seh1二聚体副本组成。每个二聚体编号为I到IV,并标明副本之间的相互作用。gydF4y2BadgydF4y2Ba根据显示Sea2和Sea3之间相互作用的子单元着色的protomer聚焦的地图,连接着相反的Sea4-Seh1的非相互作用副本。gydF4y2BaegydF4y2Ba,显示Sea3锁的SEAC核心原聚体模型,这是Sea3 α-螺线管的扩展,可“锁定”Sea2 DIM。gydF4y2Ba
Sea2 - seh1和Sea3 - sec13二聚体都通过含锌环结构域的异二聚与Sea4 - seh1的一个副本相互作用,这解释了为什么与Sea2和Sea3相比,Sea4以2:1的比例存在(图1)。gydF4y2Ba2 bgydF4y2Ba).与Sea3 RING相比,Sea2和Sea4 RING的结构更加相似。gydF4y2Ba5gydF4y2Ba).RING异二聚体最终被夹在两个coatomer β-螺旋桨Seh1-Seh1 (Sea2和Sea4 RINGs)和Seh1-Sec13 (Sea3和Sea4 RINGs)之间。这种结构解释了为什么去除Sea2、Sea3或Sea4的RING结构域会导致复杂的解离gydF4y2Ba15gydF4y2Ba.RING结构域通常与e3 -泛素连接酶相关gydF4y2Ba20.gydF4y2BaRWD域存在于Sea3gydF4y2BaSIPgydF4y2Ba,在结构上与e2结合酶有关gydF4y2Ba21gydF4y2Ba.在SEAC中,它们显然扮演着结构性的角色——与泛素相关的功能仍有待确定。gydF4y2Ba
核心的中心笼由Sea4-Seh1二聚体(I到IV)的异位四聚体构成(图4)。gydF4y2Ba2摄氏度gydF4y2Ba),类似于COPII笼,其中最小笼由Sec31-Sec13二聚体的异四聚体形成gydF4y2Ba22gydF4y2Ba(扩展数据图。gydF4y2Ba5 bgydF4y2Ba).Sea4 - seh1笼通过Sea4 β-螺旋桨的两个界面形成了一个漩涡状的形状:副本I和IV在前面形成一个灵活的相互作用,而II和III关闭笼的后部并与机翼相互作用(见下文)。相邻的Sea4副本通过α-螺线管结构域同源二聚,折叠成一个“祖先coatomer元素1”(ACE1)(扩展数据图)。gydF4y2Ba5度gydF4y2Ba),在核孔和囊泡外壳的蛋白质中观察到j型结构基序gydF4y2Ba23gydF4y2Ba它已被证明可以介导同质或异质二聚gydF4y2Ba24gydF4y2Ba.gydF4y2Ba
Sea4-Seh1笼是通过Sea2和Sea3之间的相互作用来稳定的,它们将α-螺线管域相互打包,并连接起不相互作用的Sea4-Seh1副本(I-III和II-IV)(图1)。gydF4y2Ba二维gydF4y2Ba).此外,Sea3 α-电磁域的扩展(Sea3锁)包裹在Sea2周围,向Seh1添加β-片,并将Sea2 DIM“锁定”到位(图1)。gydF4y2Ba2 egydF4y2Ba).总之,这一系列复杂的相互作用表明,所有核心子单元都需要形成稳定的功能复合体。gydF4y2Ba
SEAC机翼的结构gydF4y2Ba
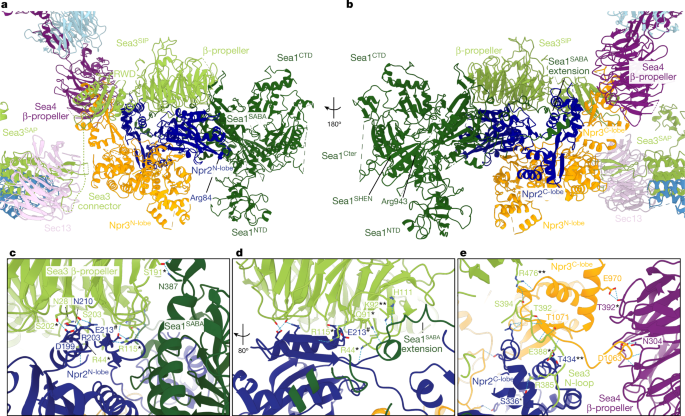
SEAC翼的大部分质量是由SEACIT子单元Sea1、Npr2和Npr3形成的,它们使用类似于GATOR1(参考文献)的相互作用接口。gydF4y2Ba25gydF4y2Ba)(图。gydF4y2Ba3gydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba).Npr2和Npr3由一个n端叶(n -叶)和一个c端叶(c -叶)组成,它们相互作用,通过连接器连接(扩展数据图)。gydF4y2Ba6 bgydF4y2Ba).n叶含有longin结构域,远离SEAC核心,而c叶异质二聚体面对Sea4 β-螺旋桨结构域(II或III)(图)。gydF4y2Ba3 bgydF4y2Ba).如下所述,Npr2gydF4y2BaN-lobegydF4y2Ba还含有催化精氨酸(Npr2gydF4y2BaArg84gydF4y2Ba)(图。gydF4y2Ba3gydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,海事处机翼的结构(gydF4y2Ba一个gydF4y2Ba),并旋转180°(gydF4y2BabgydF4y2Ba).还显示了界面的核心元素。指出了两个功能重要的精氨酸残基的位置。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BaegydF4y2Ba海洋之间的相互作用gydF4y2BaSIPgydF4y2Ba和Sea1-Npr2 (gydF4y2BacgydF4y2Ba),视野旋转80°(gydF4y2BadgydF4y2Ba)及Npr2-Npr3 (gydF4y2BaegydF4y2Ba).在GATOR中保守的Sea3, Sea4, Npr2, Npr3或Sea1中的残基用星号表示,化学上相似的氨基酸用两个星号表示,相互电荷逆转用标签表示(在Npr2中)gydF4y2BaE213gydF4y2Ba).gydF4y2Ba
Sea1位于机翼边缘,利用其SABA域与Npr2相互作用(扩展数据图)。gydF4y2Ba6摄氏度gydF4y2Ba),而c端区(Sea1gydF4y2BactgydF4y2Ba),由SHEN, DEP(未分解)和CTD组成,更灵活,不与机翼的其他部分相互作用(图5)。gydF4y2Ba3 bgydF4y2Ba和扩展数据图。gydF4y2Ba6gydF4y2Ba).我们可以解决Sea1的延期问题gydF4y2Ba萨巴gydF4y2Ba它变得部分有序,并插入到Sea3之间gydF4y2BaSIPgydF4y2Baβ-螺旋桨和Npr2gydF4y2BaC-lobegydF4y2Ba,与后者相互作用并包裹(图5)。gydF4y2Ba3 bgydF4y2Ba和扩展数据图。gydF4y2Ba6 dgydF4y2Ba).Sea1和Npr2之间的相互作用似乎被Sea3所稳定gydF4y2BaSIPgydF4y2Ba,因为它的β-螺旋桨定位在Sea1的顶部gydF4y2Ba萨巴gydF4y2Ba-Npr2gydF4y2BaN-lobegydF4y2Ba结,形成了Sea1-Npr2-Sea3三方相互作用(图。gydF4y2Ba3 c, dgydF4y2Ba).与Sea3的角色一致gydF4y2BaSIPgydF4y2Ba在稳定机翼,删除gydF4y2BaSEA3gydF4y2BaSAPgydF4y2Ba导致细胞对雷帕霉素过敏,类似于其他SEACAT突变体,而gydF4y2BaSEA3gydF4y2Ba导致SEACAT和SEACIT突变体之间的表型中间体(扩展数据图。gydF4y2Ba6 e, fgydF4y2Ba).而且,在没有海3的情况下gydF4y2BaSIPgydF4y2Ba, SEACIT的纯化未能产生稳定的络合物(数据未显示)。因此,Sea3在SEACIT(通过SIP)和SEACAT(通过SAP)中具有双重作用。这些结果与前人的观察结果一致并解释了这些结果gydF4y2Ba裂殖酵母gydF4y2Ba非洲酒gydF4y2Ba,在那里,Sea3是SEACIT的一部分gydF4y2Ba16gydF4y2Ba在哺乳动物中,Wdr59已被证明具有抑制作用,这是在营养剥夺后适当抑制mTORC1所必需的gydF4y2Ba26gydF4y2Ba.gydF4y2Ba
的Npr3gydF4y2BaC-lobegydF4y2Ba除了接触Npr2外,它还被夹在Sea4 β-螺旋桨和Sea3 RWD之间,在组织机翼相对于核心的过程中起着重要作用gydF4y2BaC-lobegydF4y2Ba(无花果。gydF4y2Ba3 bgydF4y2Ba).的Npr3gydF4y2BaC-lobegydF4y2Ba通过在Sea4 β-螺旋桨的正电荷口袋中插入一个负电荷环,使得机翼和核心之间唯一可见的相互作用(图4)。gydF4y2Ba3 egydF4y2Ba和扩展数据图。gydF4y2Ba7 a、bgydF4y2Ba).这种相互作用似乎也被Sea3稳定下来gydF4y2BaSIPgydF4y2Ba通过一个环(n -环)连接β-螺旋桨和插入到Npr3顶部的RWDgydF4y2BaC-lobegydF4y2Ba-Npr2gydF4y2BaC-lobegydF4y2Ba接口(无花果。gydF4y2Ba3 egydF4y2Ba和扩展数据图。gydF4y2Ba7 c, dgydF4y2Ba).Npr3在翅膀中的位置和相互作用解释了为什么删除gydF4y2BaNPR3gydF4y2Ba(ref。gydF4y2Ba15gydF4y2Ba)或gydF4y2BaNPRL3gydF4y2Ba(ref。gydF4y2Ba25gydF4y2Ba)从SEACAT/GATOR2中解离SEACIT/GATOR1(扩展数据图gydF4y2Ba7 egydF4y2Ba).gydF4y2Ba
我们注意到,尽管Wdr59中保留了几个对与Npr2、Npr3和Sea1相互作用很重要的Sea3残基,但在Nprl2、Nprl3和DEPDC5伙伴中基本没有相应的氨基酸保存(图1)。gydF4y2Ba3汉英gydF4y2Ba).这可能解释了与GATOR中的GATOR1和GATOR2相比,SEAC中的SEACAT和SEACIT之间更稳定的关联,以及哺乳动物中需要KICSTOR来稳定GATORgydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba.gydF4y2Ba
SEAC有GAP活动gydF4y2Ba
Npr2gydF4y2BaArg84gydF4y2Ba, gator1当量的催化残渣位于Npr2中gydF4y2BaN-lobegydF4y2Ba位于核心-机翼界面的对面,远离核心或Sea3的任何元素gydF4y2BaSIPgydF4y2Ba(无花果。gydF4y2Ba3gydF4y2Ba).gator1 - regulator - rag活性构象的比较gydF4y2Ba10gydF4y2Ba翅膀的结构表明Npr2gydF4y2BaArg84gydF4y2Ba为催化做好了准备(图。gydF4y2Ba4gydF4y2Ba).Sea1中的一种精氨酸(Sea1gydF4y2BaArg943gydF4y2Ba),也是保守的,以前被认为是催化残渣gydF4y2Ba1gydF4y2Ba.然而,这些残留物以螺旋形式埋藏在Sea1中gydF4y2Ba沈gydF4y2Ba,因此不太可能参与催化(扩展数据图。gydF4y2Ba8gydF4y2Ba).gydF4y2Ba
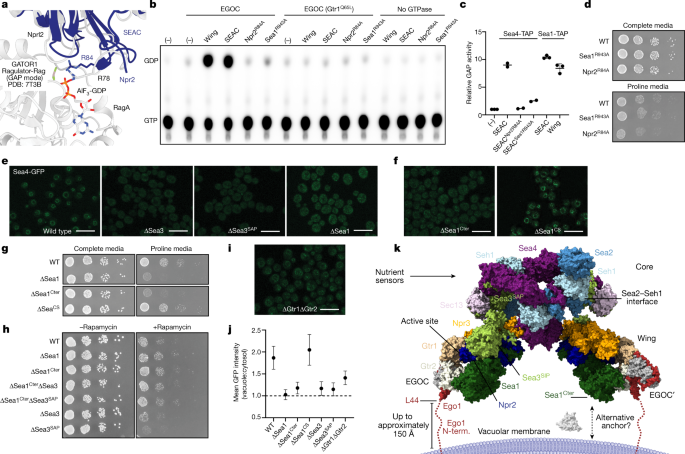
一个gydF4y2Ba, SEAC活性位点的结构,叠加在活性gator1 - regulator - rag结构上。gydF4y2BabgydF4y2Ba,体外GAP测定的代表性薄层色谱法(gydF4y2BangydF4y2Ba= 2-3个独立实验)。gydF4y2BacgydF4y2Ba,野生型SEAC、Sea1之间GAP活性的相对倍数变化gydF4y2BaR943AgydF4y2Ba, Npr2gydF4y2BaR84AgydF4y2Ba和孤立的SEAC机翼。用纯化自Sea1-TAP菌株的蛋白进行了全复合体和翼蛋白的比较。独立数据点用平均值±标准差表示。在适当的地方(gydF4y2BangydF4y2Ba= 2为Sea4-TAP菌株和gydF4y2BangydF4y2Basea - tap菌株= 3)。gydF4y2BadgydF4y2Ba,在脯氨酸上的生长分析,其中gap缺陷突变体呈慢生长表型。gydF4y2BaegydF4y2Ba, SEAC定位,通过可视化内源性标记的Sea4-GFP跟踪,为野生型(WT),∆Sea3,∆Sea3gydF4y2BaSAPgydF4y2Ba和∆Sea1背景。gydF4y2BafgydF4y2Ba,在∆Sea1中的SEAC定位gydF4y2BactgydF4y2Ba和∆Sea1gydF4y2BaCSgydF4y2Ba菌株。gydF4y2BaggydF4y2Ba, Sea1突变株脯氨酸生长测定。gydF4y2BahgydF4y2Ba雷帕霉素生长试验表明gydF4y2BaSEA1gydF4y2Ba突变是上位的gydF4y2BaSEA3gydF4y2Ba突变。gydF4y2Ba我gydF4y2Ba, SEAC定位于∆Gtr1∆Gtr2应变。gydF4y2BajgydF4y2Ba细胞中Sea4-GFP信号的液泡与胞浆比(平均±s.d)的定量gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba而且gydF4y2Ba我gydF4y2Ba(gydF4y2BangydF4y2Ba=每株30个细胞)。gydF4y2BakgydF4y2Ba,液泡膜中SEAC与EGOC结合的模型。另一个锚点显示为一种可能与Sea1相互作用的未知蛋白质gydF4y2BactgydF4y2Ba.比例尺,10 μm。gydF4y2Ba
因此,我们的结构预测,如在GATOR1, Npr2gydF4y2BaArg84gydF4y2Ba而不是Sea1gydF4y2BaArg943gydF4y2Ba为催化精氨酸,且SEAC呈活性构象(即SEACAT与SEACIT的结合不足以抑制其GAP活性)。为了验证这些预测,我们使用我们的原生SEAC纯化物结合重组表达的EGOC建立了体外GAP试验。与我们的结构一致的是,SEAC能够强有力地刺激Gtr1水解GTP,类似于孤立的翅膀(包含Sea3)gydF4y2BaSIPgydF4y2Ba)(图。gydF4y2Ba4 b, cgydF4y2Ba),确认在SEAC的上下文中包含了EGOC绑定。gydF4y2Ba
为了确定哪一种精氨酸负责催化,我们纯化了原生的SEAC变体,其中包含一个丙氨酸取代的Npr2gydF4y2BaArg84gydF4y2Ba或Sea1gydF4y2BaArg943gydF4y2Ba并在体外测试它们的GAP活性。出乎意料的是,两个突变体都有缺陷(图。gydF4y2Ba4 b, cgydF4y2Ba).我们注意到纯化的SEACgydF4y2BaSea1R943AgydF4y2BaSDS-PAGE显示出明显的条带模式,其中与Sea1对应的顶部条带缺失(扩展数据图)。gydF4y2Ba8 bgydF4y2Ba).因此,我们进一步通过阴性染色电镜对这些突变复合物进行了表征。而二维(2D)类平均SEACgydF4y2BaNpr2R84AgydF4y2Ba显示完整的SEAC与野生型相似,来自SEAC的2D类平均值gydF4y2BaSea1R943AgydF4y2Ba显示了缺乏翅膀的异常复合体的存在(扩展数据图。gydF4y2Ba8 cgydF4y2Ba).作为Sea1gydF4y2BaArg943gydF4y2Ba似乎参与了与邻近残基的相互作用(扩展数据图。gydF4y2Ba8gydF4y2Ba),我们假设这种突变破坏了Sea1的结构稳定,进而破坏了机翼的结构稳定,导致GAP活性降低。gydF4y2Ba
与SEAC GAP活性在体内重要一致,我们观察到Npr2的功能缺陷gydF4y2BaR84AgydF4y2Ba但令人惊讶的是,Sea1没有突变gydF4y2BaR943AgydF4y2Ba(无花果。gydF4y2Ba4 dgydF4y2Ba).这表明,Sea1gydF4y2BaR943AgydF4y2Ba突变使复合物在纯化过程中不稳定,但它在体内保留了足够的GAP活性。gydF4y2Ba
机翼将SEAC固定在液泡上gydF4y2Ba
在COPII中,Sec31 - sec13涂层通过Sec31中柔性区域之间的相互作用被招募到膜上。gydF4y2Ba28gydF4y2Ba)和由Sec23-Sec24组成的适配器复合体,Sec23-Sec24本身与膜附着的Sar1-GTP结合gydF4y2Ba29gydF4y2Ba.和Npr2一样,Sec23也是一个使用精氨酸手指的GAPgydF4y2Ba28gydF4y2Ba刺激Sar1的GTPase活性。考虑到COPII和SEAC笼的结构相似,我们推断在SEAC笼中可能存在类似的机制,即翼通过膜附着的EGOC将核心引入液泡膜。gydF4y2Ba
为此,我们使用了内源性GFP标记gydF4y2BaSEA4gydF4y2Ba追踪SEAC在体内的定位。在野生型细胞中,我们观察到强烈的空泡信号在去除Sea3后丢失gydF4y2BaSAPgydF4y2Ba或Sea1(无花果。gydF4y2Ba4 egydF4y2Ba).这表明SEAC是通过SEACIT的翅膀与液泡相连的。gydF4y2Ba
我们测试了Sea1gydF4y2BactgydF4y2Ba,这比机翼的其他部分更灵活,也缺乏可见的相互作用(扩展数据图。gydF4y2Ba8 dgydF4y2Ba)专门参与液泡吸收。删除的gydF4y2BaSEA1gydF4y2BactgydF4y2Ba不仅减少了液泡的定位(图。gydF4y2Ba4 fgydF4y2Ba),但也导致SEACIT突变表型类似于完全删除gydF4y2BaSEA1gydF4y2Ba(无花果。gydF4y2Ba4 ggydF4y2Ba).有趣的是,删除gydF4y2BaSEA1gydF4y2BactgydF4y2Ba是上位性到缺失的gydF4y2BaSEA3gydF4y2BaSAPgydF4y2Ba,强调了Sea1gydF4y2BactgydF4y2Ba在体内发挥重要作用(图。gydF4y2Ba4 hgydF4y2Ba).gydF4y2Ba
在“抑制模式”中,调节剂- rag通过DEPDC5与GATOR1结合gydF4y2Ba沈gydF4y2Ba(ref。gydF4y2Ba25gydF4y2Ba).虽然具有较低的序列守恒性,但Sea1gydF4y2Ba沈gydF4y2Ba类似于DEPDC5gydF4y2Ba沈gydF4y2Ba(扩展数据图。gydF4y2Ba8 egydF4y2Ba).随着Sea1gydF4y2Ba沈gydF4y2Ba是Sea1的一部分吗gydF4y2BactgydF4y2Ba,我们测试了Sea1gydF4y2Ba沈gydF4y2Ba负责在∆Sea1中观察到的表型gydF4y2BactgydF4y2Ba通过移除所谓的“临界带”(CS;扩展的数据图。gydF4y2Ba8 fgydF4y2Ba),它在GATOR1中介导以“抑制模式”与RagA结合gydF4y2Ba25gydF4y2Ba.我们观察到该突变体既没有定位缺陷也没有功能缺陷(图。gydF4y2Ba4 f, ggydF4y2Ba),表明“抑制模式”在酵母中并不保守,正如之前所提出的gydF4y2Ba9gydF4y2Ba.gydF4y2Ba
上述结果表明,SEAC是通过“GAP模式”与EGOC相互作用而被招募到液泡中的。为了检验这一假设,我们确定是否删除gydF4y2BaGTR1gydF4y2Ba而且gydF4y2BaGTR2gydF4y2Ba,这应该删除与EGOC的交互,影响SEAC本地化。奇怪的是,删除gydF4y2BaGTR1gydF4y2Ba而且gydF4y2BaGTR2gydF4y2Ba与删除Sea1和Sea3相比,没有减少液泡SEAC的定位。gydF4y2Ba4 i, jgydF4y2Ba),表明空泡吸收存在另外一种独立于egoc的机制。gydF4y2Ba
液泡上的SEAC模型gydF4y2Ba
为了更好地理解SEAC的调控,我们利用我们的结构和功能数据对液泡膜上的SEAC - egoc超复合物进行了建模(图1)。gydF4y2Ba4 kgydF4y2Ba和扩展数据图。gydF4y2Ba9模拟gydF4y2Ba).考虑到复合物是活性的,我们基于gator1 - regulator - rag结构建模了以“GAP模式”与SEAC翼结合的EGOCgydF4y2Ba10gydF4y2Ba,并考虑了Ego1的n端灵活尾所带来的空间约束。令人欣慰的是,由于Ego1的最后一个有序n端螺旋面向液泡膜,每个翼都能很好地结合EGOC。这个尾部可以延伸到大约150 Å,这使得有足够的空间来防止机翼远端与膜的碰撞。此外,灵活的Sea1gydF4y2BactgydF4y2Ba位于面向膜,而核心最终与膜平行并面向细胞质,使其易于与营养依赖的调控因子结合。在这种结构中,机翼可以适应不同的膜曲率给予他们的灵活性。gydF4y2Ba
根据我们的数据和目前的文献,我们提出SEAC核心(即SEACAT)作为一个脚手架复合物,是必要的,但还不够,以调节翅膀的活动。事实上,考虑到我们体外GAP试验的结果,核的直接抑制似乎不太可能。Sestrin2 (ref。gydF4y2Ba30.gydF4y2Ba)和CASTOR1(引用。gydF4y2Ba31gydF4y2Ba)与Wdr24 (Sea2)和Seh1L (Seh1)结合,它们在我们的结构中在机翼旁边形成一个界面,具有保守结构(图1)。gydF4y2Ba4 kgydF4y2Ba和扩展数据图。gydF4y2Ba10 a, bgydF4y2Ba).在哺乳动物系统中,酵母营养传感器可能与核心结合,以调节翅膀的GAP活动(但在这种调节中可能需要额外的因素)。总的来说,我们的研究结果表明,SEAC核心(SEACAT/GATOR2)作为机翼(SEACIT/GATOR1)的被动调节器,而不是主动调节器。gydF4y2Ba
在修改这篇手稿期间,人类GATOR2复合体的低温-电磁结构已发表gydF4y2Ba32gydF4y2Ba.GATOR2的结构与SEAC核心(SEACAT)几乎相同(扩展数据图)。gydF4y2Ba10 cgydF4y2Ba),数据与我们的研究一致,进一步强调了SEAC和GATOR作用的分子机制是保守的。初步GATOR全配合物的建模表明,GATOR2将限制GATOR1相对于膜的位置,但将使“抑制”和“GAP”模式中的调节剂- rag结合成为可能,可能同时发生(扩展数据图)。gydF4y2Ba10 dgydF4y2Ba).因此,GATOR2可能不会像前面建议的那样,通过这两种绑定模式之间的转换来调节GATOR1gydF4y2Ba10gydF4y2Ba.gydF4y2Ba
方法gydF4y2Ba
酵母菌株gydF4y2Ba
利用经典的重组技术构建了酵母菌菌株。的∆Sea1gydF4y2BaCSgydF4y2Ba利用基于crispr的诱变产生菌株。本研究所用菌株列于补充表gydF4y2Ba2gydF4y2Ba.质粒列于补充表gydF4y2Ba3.gydF4y2Ba.所有菌株均经PCR和/或测序验证。gydF4y2Ba
SEAC净化gydF4y2Ba
表达Sea4-TAP的细胞被培养到光密度(ODgydF4y2Ba600gydF4y2Ba),在6000转/时离心收集。冷冻10分钟,在液氮中速冻,−80°C保存,待进一步使用。细胞在3-5体积的裂解缓冲液(SEAC缓冲液:20 mM HEPES-NaOH, pH 7.4, 300 mM NaCl, 5 mM CHAPS, 10%甘油,2 mM DTT;加上1 mM PMSF和1×完全蛋白酶抑制剂片(罗氏))。所有步骤均在4℃下进行。裂解物在16000转/分离心清除。(30600gydF4y2BaggydF4y2Ba)孵育1 h,上清液用igg耦合Dynabeads M270 (ThermoFisher Scientific)孵育2 h。用裂解和SEAC缓冲液广泛清洗SEAC结合珠,然后用TEV蛋白酶(0.1 mg ml)孵育过夜gydF4y2Ba−1gydF4y2Ba)洗脱缓冲液(20 mM HEPES-NaOH, pH 7.4, 300 mM NaCl, 2 mM DTT)。洗脱液在13000℃离心澄清gydF4y2BaggydF4y2Ba5分钟后立即用于低温电子显微镜网格准备。gydF4y2Ba
EGOC净化gydF4y2Ba
含有Gtr1 (WT或Q65L)和不含任何亲和标记的Gtr2的质粒共转化gydF4y2Ba大肠杆菌gydF4y2BaBL21*,质粒包含6×HIS-Ego1(∆1-37),Ego2(∆1-7)和Ego3的密码子优化序列。加入0.1 mM异丙基-β-诱导蛋白表达gydF4y2BadgydF4y2Ba-硫半乳糖吡喃苷在18°C过夜。gydF4y2Ba
离心收集细胞,重悬于裂解缓冲液(50 mM Tris-HCl pH 7.4, 300 mM NaCl, 5%甘油,20 mM咪唑,0,15% CHAPS, 1 mM MgCl)中gydF4y2Ba2gydF4y2Ba, 1 μg mlgydF4y2Ba−1gydF4y2BaDNase, 1 μg mlgydF4y2Ba−1gydF4y2Ba溶菌酶),补充1 mM PMSF和完全无edta蛋白酶抑制剂鸡尾酒(罗氏)。使用乳化系统(Avestin)裂解细胞,并在15,000转/分离心清除细胞。在4℃下放置45分钟。可溶性部分使用螯合HiTrap FF粗柱(GE Healthcare)进行亲和纯化。洗涤后,用250 mM咪唑洗脱蛋白质。含有复合物的组分被汇集和缓冲交换与HiPrep 26/10柱到25 mM HEPES-NaOH pH 7.4, 150 mM NaCl, 10%甘油,2 mM DTT。然后将样品应用于MonoQ FF色谱柱(GE Healthcare),洗脱梯度从150 mM到1 M NaCl。含有复合物的组分与20 mM EDTA在4℃下孵育过夜,浓缩至10 mg mlgydF4y2Ba−1gydF4y2Ba(使用100 kDa Amicon过滤器),并加载在Superdex GF200 Increase (GE Healthcare)平衡与25 mM HEPES pH 7.4, 150 mM NaCl, 10%甘油,2mm DTT, 2mm EDTA。收集最纯的部分,浓缩到5-10毫克毫升gydF4y2Ba−1gydF4y2Ba.在液氮中快速冷冻,并在- 80°C保存直到使用。gydF4y2Ba
差距分析gydF4y2Ba
200 nM的EGOC (WT或Gtr1Q65L)负载40 nM [α−gydF4y2Ba32gydF4y2BaP]GTP载入缓冲液(20 mM Tris-HCl pH 8.0, 1 mM MgClgydF4y2Ba2gydF4y2Ba, 2毫米DTT)室温30分钟。反应开始时,混合1μl野生型、变种SEAC或wing, 4μl负载的EGOC, 1μl 10X GAP缓冲液(200 mM Tris-HCl pH 8.0, 100 mM MgCl)gydF4y2Ba2gydF4y2Ba, 20 mM DTT, 20 mM GTP)和4 μl SEAC缓冲液,总反应体积为10 μl,室温孵育30 min。加入3 μl STOP缓冲液(1% SDS, 25 mM EDTA, 5 mM GTP和5 mM GDP),在65℃加热4分钟,停止反应gydF4y2BaogydF4y2BaC.将反应(2 ~ 4 μl)在PEI纤维素F板(Merck)上进行标记,用1 M乙酸和0.8 M LiCl薄层色谱法进行分解。干燥后,将板暴露在荧光屏上过夜,并在GE台风荧光屏成像仪中成像。在ImageJ 1.52 2p中进行量化。数据在GraphPad Prism 8中可视化并绘制。gydF4y2Ba
增长分析gydF4y2Ba
指示菌株在完全合成培养基(CSM;2%的葡萄糖,酵母氮碱不含氨基酸和硫酸铵,和dropout混合)。在实验前,菌株被稀释,然后生长到ODgydF4y2Ba600gydF4y2Ba约为0.1。每株菌株被标记在含有0或5 nM雷帕霉素的CSM平板上,在30°C孵育2天,然后成像。每种品系的所有斑点试验至少进行三次。gydF4y2Ba
我们只观察到SEACIT突变体在雷帕霉素上生长时的弱表型(雷帕霉素耐药性略有增加)。由于SEAC在酵母中发出氮的信号,我们研究了SEACIT突变体在脯氨酸上的生长,脯氨酸是一种氮贫乏的来源。这提供了一个更强的表型,因此被用来表征SEACIT突变体。gydF4y2Ba
对于在脯氨酸平板上生长的菌株,通过pJU450质粒转化使其成为原营养型gydF4y2Ba33gydF4y2Ba(包含gydF4y2BaTRP1gydF4y2Ba,gydF4y2BaHIS3gydF4y2Ba而且gydF4y2BaLEU2gydF4y2Ba).菌株在脯氨酸培养基中稀释至外径gydF4y2Ba600gydF4y2Ba约0.1,斑点在CSM (-Trp, -His, -Leu)板(加或减脯氨酸)上,在30°C孵育1-2天后成像。每种品系的所有斑点试验至少进行三次。gydF4y2Ba
荧光显微镜gydF4y2Ba
菌株在CSM中预培养过夜。显像前将菌株稀释至ODgydF4y2Ba600gydF4y2Ba约0.2-0.4,OD成像gydF4y2Ba600gydF4y2Ba约0.7 - 1。在蔡司LSM800共聚焦激光扫描显微镜上收集成堆的图像(每个菌株至少3个),并使用ImageJ 1.52 2p处理。为了比较菌株间的差异,gydF4y2BaZgydF4y2Ba使用最大投影对约2 μm的堆叠进行平均。gydF4y2Ba
为了量化液泡上的GFP信号,细胞在CSM (ODgydF4y2Ba600gydF4y2Ba约0.8-1),用5 μM fm4 -64 (ThermoFisher)在30°C孵育30-40分钟。在ImageJ 1.52中计算液泡中GFP信号与胞浆中GFP信号的比值如下。首先,利用fm4 -64通道的最大投影图像,使用椭圆工具(感兴趣的液泡区域,vROI)勾画液泡。然后,将vROI覆盖在叠加的DIC通道上,用徒手工具用vROI手动跟踪细胞细胞质(cROI)中的ROI,小心地尝试不包括任何来自液泡的信号。只有具有明显液泡染色和足够细胞质面积的细胞被纳入分析(gydF4y2BangydF4y2Ba=每株30个细胞)。然后在GFP通道的最大投影图像上测量每个ROI内的平均强度,用vROI内的平均GFP强度除以cROI内的平均GFP强度,计算液泡与细胞质GFP强度的比值。该协议确保了一种无偏倚的量化方式,因为GFP通道不用于任何ROI确定。数据在GraphPad Prism 8中可视化并绘制。gydF4y2Ba
电子显微镜样品制备gydF4y2Ba
将5 μl刚纯化的SEAC样品应用于QuantiFoil Au 1.2/1.3网格上,之前涂有一层薄薄的氧化石墨烯,并使用徕卡GP2系统在10°C和90%的湿度下进行浸入冷冻。gydF4y2Ba
将6 μl样品直接涂于Carbon Square Mesh, Cu, 300 Mesh, UL grid (Electron Microscopy Sciences)上,孵育3 min,制备负染栅格。用滤纸去除多余的样品,用1%的乙酸铀酰对网格进行染色,然后用滤纸去除多余的污渍并烘干。gydF4y2Ba
电子显微镜数据采集gydF4y2Ba
Cryo-EM数据是在300 kV Titan Krios中使用EPU v.2.14获得的,该设备配有猎鹰4直接电子探测器和Selectris X能量过滤器(ThermoFisher) (DCI洛桑)。影片以EER模式记录,总剂量为40 e/ÅgydF4y2Ba2gydF4y2Ba目标离焦范围为−1.6 ~−0.6 μm,狭缝宽度为10 eV,像素尺寸为0.726 Å (×165,000倍率)。总共收集了15922部电影(分为两个阶段,分别为11,174部和4,748部),并使用类似的显微镜设置在35°倾角下收集了3,182部电影。gydF4y2Ba
阴性染色数据在配备CETA相机(ThermoFisher)(日内瓦DCI)的120 kV Talos L120C中使用EPU v.2.14获得。图像采集的标称像素大小为1.927 Å。野生型SEAC共拍摄334张照片,SEAC共拍摄333张照片gydF4y2BaNpr2R84AgydF4y2Ba以及SEAC的301张图片gydF4y2BaSea1R943AgydF4y2Ba.gydF4y2Ba
低温电子显微镜数据处理gydF4y2Ba
所有处理都在CryoSPARC v.3.2.234中执行。gydF4y2Ba34gydF4y2Ba).使用CryoSPARC Live v.3.2.2实时处理视频,将视频分割为40帧,并使用补丁运动校正和补丁CTF估计。分辨率估计值与FSC值在0.143对应,使用优化的掩码经过细化后自动确定,如图扩展数据图所示。gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
数据处理管道详见扩展数据图。gydF4y2Ba1gydF4y2Ba.倾斜数据集和未倾斜数据集分别进行预处理,并通过多轮异构细化和2D分类执行初始粒子清理后合并。粒子分类为2× (1.452 Å /像素)。从最大的尚未完成的数据集中提取显微图的子集,用于获得从头计算模型,作为异构细化的参考体积。所有异构细化步骤都执行了应用gydF4y2BaCgydF4y2Ba2对称。两个较小的数据集(倾斜数据集和未划分数据集)被合并,使用异构细化进行分类,并与从最大的未划分数据集获得的粒子相结合。然后使用非均匀(NU)细化这些组合粒子gydF4y2Ba35gydF4y2Ba,然后是对称展开(gydF4y2BaCgydF4y2Ba2),粒子减法和局部细化使用掩模在机翼上。为了去除部分络合物,使用未膨胀的粒子进行了一轮聚焦的非均匀细化,使用机翼体积作为参考,不施加对称性。这产生了一类(208,379个粒子)包含完整的复合物,它被解压缩到标称像素大小(0.726 Å每像素),并使用NU细化、局部和全局CTF细化进行细化。这产生了一个2.95 Å分辨率的地图(共识地图),其中翅膀没有被解析。为了提高机翼的分辨率,粒子被对称展开(gydF4y2BaCgydF4y2Ba2),之后进行粒子减法和局部细化。使用不对齐的三维(3D)分类进一步对粒子进行分类,并使用NU细化和局部CTF细化对具有翅膀密度的良好类别进行合并和细化。这产生了一个2.7 Å分辨率的地图(翼聚焦地图)。gydF4y2Ba
3 d可变性分析gydF4y2Ba36gydF4y2Ba揭示了核心的主要运动是由于翅膀的运动,通过Sea3拉动并打开了笼子的前部。因此,我们使用包含Sea2-Seh1、Sea3-Sec13、Sea4-Seh1(定义为原聚体)的掩码,并在该区域执行局部细化,生成一个2.81 Å分辨率的映射(原聚体聚焦映射)。由于Sea2的β-螺旋桨在笼子外是灵活的,它仍然比原聚体的其他部分分辨率低。因此,我们使用了一个较小的掩码,包括Sea2-Seh1, Sea3-Sec13,以及相互作用的Sea4 RING域。这提高了Sea2的n端区域及其相互作用的Seh1副本的分辨率,产生了一个2.79 Å分辨率的地图(Sea2 - sea3聚焦的地图)。gydF4y2Ba
所有地图都使用DeepEMhancer进行锐化gydF4y2Ba37gydF4y2Ba.gydF4y2Ba
Negative-stain数据处理gydF4y2Ba
数据处理采用RELION v.4.0(参考文献)。gydF4y2Ba38gydF4y2Ba).粒子选取采用拉普拉斯-高斯斑点检测自动完成。选定的粒子经过几轮二维分类,直到在良好的类别中获得稳定数量的粒子。gydF4y2Ba
模型建立gydF4y2Ba
从AlphaFold数据库中下载了Sea2、Sea3、Sea4、Sea1、Npr2和Npr3的结构预测gydF4y2Ba14gydF4y2Ba(gydF4y2Bahttps://alphafold.ebi.ac.uk/gydF4y2Ba).pLDDT得分非常低的区域(<50)被从模型中删除,pLDDT得分很高的折叠域(>70)被分离出来,并分别拟合到UCSF Chimera v.1.15(参考文献)的共识图中。gydF4y2Ba39gydF4y2Ba).置信度评分与低温- em密度之间具有较高的相关性,其中pLDDT评分极低的大部分部位不可见。折叠区域与密度拟合较好,但与预测模型的主要差异在于折叠区域之间的方向,大部分折叠区域由pLDDT得分非常低或很低的区域连接。一些被预测为无序的区域被重新建立。Seh1 (PDBgydF4y2Ba3 f3fgydF4y2Ba)gydF4y2Ba40gydF4y2Ba和Sec13 (PDBgydF4y2Ba3 mzkgydF4y2Ba)gydF4y2Ba24gydF4y2Ba分别与密度相匹配。gydF4y2Ba
模型的建立在Coot v.0.9.8.1中进行。gydF4y2Ba41gydF4y2Ba)和实空间优化在Phenix v.1.20.1-4487(参考。gydF4y2Ba42gydF4y2Ba).首先,利用共识图、原聚体聚焦图和sea2 - sea3聚焦图建立原聚体模型;该模型还包括Npr3区域gydF4y2BaC-lobegydF4y2Ba与Sea4相互作用。反复进行模型构建和实空间细化(针对原聚体聚焦的映射),直到模型没有得到改进。然后对原聚体模型进行复制和翻译,以适应UCSF Chimera v.1.15中的共识图中的另一个副本。然后根据共识图对核心二聚体进行实空间细化。机翼被单独构建,并使用以机翼为焦点的地图迭代地进行真实空间优化。gydF4y2Ba
为了建立最终的模型,Npr3的961-975残基被用来将机翼固定在核心上。该区域形成α螺旋拉伸,在原聚体聚焦图中更容易分辨。由于机翼相对于核心是灵活的,最终模型代表了基于Npr3方向的初步位置gydF4y2BaC-lobegydF4y2Ba在共识图中。最后,根据参考模型约束的共识图对完整模型进行了细化,以解释翼的大部分缺乏密度。gydF4y2Ba
模型的质量和与密度的拟合度使用molintegrity来确定gydF4y2Ba43gydF4y2Ba和凤凰v.1.20.1-4487gydF4y2Ba44gydF4y2Ba).gydF4y2Ba
数据来自UCSF ChimeraX v.1.3。gydF4y2Ba45gydF4y2Ba).gydF4y2Ba
SEAC-EGOC超络合物的建模gydF4y2Ba
为了在液泡膜上模拟SEAC-EGOC超复合物,研究了活性gator1 - regulator - rag (PDBgydF4y2Ba7 t3bgydF4y2Ba)用于建模EGOC与翅膀的绑定(扩展数据图。gydF4y2Ba9gydF4y2Ba).的Npr3gydF4y2BaN-lobegydF4y2Ba(1-590)与Nprl3对齐gydF4y2BaN-lobegydF4y2Ba(1-174),因为这种对齐最小化了Nprl3 (Npr3 18-23)和RagA中等效的“绑定”环之间的冲突,同时保持Npr2的对齐gydF4y2BaN-lobegydF4y2Ba和Npr2gydF4y2BaArg84gydF4y2Ba.在GATOR1中,与Npr3的等效物相比,Nprl3绑定环略微向下折叠(扩展数据图)。gydF4y2Ba9 bgydF4y2Ba).重要的是,Npr3中的一个大扩展gydF4y2BaN-lobegydF4y2Ba不是针对RagA的,因此可以在EGOC绑定的上下文中使用。此外,另一个主要冲突发生在RagC和Sea1(残基1090、1400和1404)之间,包括一个在我们的结构中扩展但在GATOR1中折叠的循环(扩展数据图)。gydF4y2Ba9 cgydF4y2Ba).通过改变上述环/侧链的构象,可以很容易地缓解这两种冲突,而不会影响整体结构。gydF4y2Ba
在gator1 - regulator - rag结构中,RagA-RagC异质二聚体的构象与Gtr1略有不同gydF4y2BaGppNHpgydF4y2Ba-Gtr2gydF4y2BaGppNHpgydF4y2Ba在EGOC (PDBgydF4y2Ba6成为jwpgydF4y2Ba)gydF4y2Ba46gydF4y2Ba(扩展数据图。gydF4y2Ba9 dgydF4y2Ba).因此,当使用这个结构来建模EGOC绑定到SEAC翼,使用RagA作为锚点时,会与Sea1发生更多的冲突。这与诱导拟合机制一致,其中Sea1与Gtr2的结合打开了g域之间的空间gydF4y2Ba10gydF4y2Ba.同样,当使用“活跃的”Gtr1时,会观察到严重的冲突gydF4y2Ba三磷酸鸟苷gydF4y2Ba-Gtr2gydF4y2Ba国内生产总值gydF4y2Ba组合(PDBgydF4y2Ba4 arzgydF4y2Ba)gydF4y2Ba47gydF4y2Ba.考虑到这一点,模型如图。gydF4y2Ba4 gydF4y2Ba对应于使用RagA和Gtr1校准的调整器-抹布上安装的EGOC结构。虽然这个模型中,Sea1和Gtr2之间的冲突更多(相比于Sea1和RagC),但EGOC的轻微变化不会改变Ego1最后可见的n端螺旋的方向,它仍然朝向液泡膜。在有regulator - rag的模型中,LAMTOR1中的等效螺旋也采用相同的方向(扩展数据图)。gydF4y2Ba9 dgydF4y2Ba).gydF4y2Ba
统计和再现性gydF4y2Ba
没有使用统计方法来预先确定样本量,也没有使用盲法或随机化。共聚焦显微镜图像如图所示。gydF4y2Ba4 gydF4y2Ba代表在不同的日子进行的三个独立的生物重复实验的至少三个图像。共聚焦显微镜图像显示在扩展数据图。gydF4y2Ba9 egydF4y2Ba分别代表在不同时间进行的生物重复的两个独立实验的至少三个图像。SDS-PAGE图像显示在扩展数据图。gydF4y2Ba1 a, bgydF4y2Ba,gydF4y2Ba7 egydF4y2Ba而且gydF4y2Ba8 bgydF4y2Ba代表每种至少两个独立的提纯。扩展数据图所示的低温电磁显微照片。gydF4y2Ba1 bgydF4y2Ba代表15,922部(未上映)和3,182部(倾斜)电影。gydF4y2Ba
报告总结gydF4y2Ba
关于研究设计的进一步信息可在gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到本文。gydF4y2Ba
数据可用性gydF4y2Ba
deepemhancer -锐化和相关的地图已存放在电子显微镜数据库中,登录代码如下:EMD-gydF4y2Ba15364gydF4y2Ba(一致,用一个紧而宽的蒙版锐化),EMD-gydF4y2Ba15381gydF4y2Ba(SEAC翼),EMD -gydF4y2Ba15373gydF4y2Ba(原聚体聚焦)和EMD-gydF4y2Ba15374gydF4y2Ba(Sea2-Sea3集中)。SEAC和SEAC机翼的模型已存入蛋白质数据库,并带有登录代码gydF4y2Ba8诽谤联盟gydF4y2Ba而且gydF4y2Ba8 ae6gydF4y2Ba,分别。gydF4y2Ba
参考文献gydF4y2Ba
Panchaud, N, Peli-Gulli, m.p.和De Virgilio, C.氨基酸缺失通过Rag家族GTPase Gtr1的GTPase激活蛋白复合物抑制TORC1。gydF4y2Ba科学。信号。gydF4y2Ba6gydF4y2Bara42(2013)。gydF4y2Ba
Panchaud, N, Peli-Gulli, M. P. & De Virgilio, C. seched the GAP that协商TORC1活化:Rag GTPase调节的进化保守。gydF4y2Ba细胞周期gydF4y2Ba12gydF4y2Ba, 2948 - 2952(2013)。gydF4y2Ba
Bar-Peled, L.等。一种具有GAP活性的Rag gtpase肿瘤抑制复合体,其信号为mTORC1的氨基酸充分性。gydF4y2Ba科学gydF4y2Ba340gydF4y2Ba, 1100 - 1106(2013)。gydF4y2Ba
奥罗斯科,J. M.等。磷酸二羟丙酮向mTORC1传递葡萄糖可用性信号。gydF4y2BaNat,金属底座。gydF4y2Ba2gydF4y2Ba, 893 - 901(2020)。gydF4y2Ba
Dubouloz, F., Deloche, O., Wanke, V., Cameroni, E.和De Virgilio, C. TOR和EGO蛋白复合体协调酵母中的微自噬。gydF4y2Ba摩尔。细胞gydF4y2Ba19gydF4y2Ba15-26(2005)。gydF4y2Ba
桑萨克,Y.等人。调节剂- rag复合体将mTORC1靶向到溶酶体表面,是氨基酸激活mTORC1所必需的。gydF4y2Ba细胞gydF4y2Ba141gydF4y2Ba, 290 - 303(2010)。gydF4y2Ba
Peli-Gulli, M. P, Sardu, A., Panchaud, N., Raucci, S. & De Virgilio, C.氨基酸通过Lst4-Lst7刺激TORC1, lst7是Rag家族GTPase Gtr2的GTPase激活蛋白复合体。gydF4y2Ba细胞的代表。gydF4y2Ba13gydF4y2Ba1 - 7(2015)。gydF4y2Ba
Dokudovskaya, S.等。一个包含Sec13和Seh1的保守coatomer相关复合物与液泡动态结合gydF4y2Ba酿酒酵母gydF4y2Ba.gydF4y2Ba摩尔。细胞。蛋白质组学gydF4y2Ba10gydF4y2Ba, m110 006478(2011)。gydF4y2Ba
Shen, K., Valenstein, M. L., Gu, X.和Sabatini, D. M. Nprl2的Arg-78催化gator1激发的Rag GTP酶水解GTP。gydF4y2Ba生物。化学。gydF4y2Ba294gydF4y2Ba, 2970 - 2975(2019)。gydF4y2Ba
埃格里,S. B.等。人gator1 - rag - regululator复合物的Cryo-EM结构揭示了空间约束调控GAP机制。gydF4y2Ba摩尔。细胞gydF4y2Ba82gydF4y2Ba, 1836 - 1849。e5(2022)。gydF4y2Ba
Saxton, R. A, Chantranupong, L., Knockenhauer, K. E., Schwartz, T. U. & Sabatini, D. M. CASTOR1在mTORC1上游感知精氨酸的机制。gydF4y2Ba自然gydF4y2Ba536gydF4y2Ba, 229 - 233(2016)。gydF4y2Ba
沃尔夫森,R. L.等。Sestrin2是mTORC1通路的亮氨酸传感器。gydF4y2Ba科学gydF4y2Ba351gydF4y2Ba43-48(2016)。gydF4y2Ba
陈杰等。SAR1B通过感知亮氨酸水平来调节mTORC1信号。gydF4y2Ba自然gydF4y2Bahttps://doi.org/10.1038/s41586-021-03768-wgydF4y2Ba(2021)。gydF4y2Ba
跳楼者,j等。使用AlphaFold进行高度精确的蛋白质结构预测。gydF4y2Ba自然gydF4y2Bahttps://doi.org/10.1038/s41586-021-03819-2gydF4y2Ba(2021)。gydF4y2Ba
阿尔格里特,R.等。SEA复合体是TORC1通路的调制器,其分子结构和功能。gydF4y2Ba摩尔。细胞。蛋白质组学gydF4y2Ba13gydF4y2Ba, 2855 - 2870(2014)。gydF4y2Ba
Fukuda, T.等。GATOR1-Sea3复合体、TSC复合体和Gcn2激酶对裂变酵母TORC1信号的三方抑制gydF4y2BaeLifegydF4y2Ba10gydF4y2Bae60969(2021)。gydF4y2Ba
夏国昌,史达夫罗普洛斯,葛培杰。核孔膜涂层结构的研究。gydF4y2Ba细胞gydF4y2Ba131gydF4y2Ba, 1313 - 1326(2007)。gydF4y2Ba
德沃斯等人。包被囊泡和核孔复合物的组成具有共同的分子结构。gydF4y2Ba公共科学图书馆杂志。gydF4y2Ba2gydF4y2Bae380(2004)。gydF4y2Ba
法斯,曼西亚斯,杰·D,毕,X.和哥德堡,J. COPII笼中被毛蛋白的结构和组织。gydF4y2Ba细胞gydF4y2Ba129gydF4y2Ba, 1325 - 1336(2007)。gydF4y2Ba
Budhidarmo, R., Nakatani, Y. & Day, c.l . RINGs是泛素转移的关键。gydF4y2Ba学生物化学的发展趋势。科学。gydF4y2Ba37gydF4y2Ba58 - 65(2012)。gydF4y2Ba
Nameki, N.等。小鼠GCN2蛋白RWD结构域的溶液结构。gydF4y2Ba蛋白质科学。gydF4y2Ba13gydF4y2Ba, 2089 - 2100(2004)。gydF4y2Ba
斯塔格,s.m.等。Sec13/31 COPII外套笼的结构。gydF4y2Ba自然gydF4y2Ba439gydF4y2Ba, 234 - 238(2006)。gydF4y2Ba
Brohawn, s.g., Leksa, n.c., Spear, e.d., Rajashankar, K. R. & Schwartz, t.u.核孔复体和囊泡外套共同祖先的结构证据。gydF4y2Ba科学gydF4y2Ba322gydF4y2Ba, 1369 - 1373(2008)。gydF4y2Ba
Whittle, J. R. & Schwartz, T. U. Sec13-Sec16边缘元件的结构,用于组装COPII囊泡涂层的模板。gydF4y2Baj .细胞杂志。gydF4y2Ba190gydF4y2Ba, 347 - 361(2010)。gydF4y2Ba
Shen, K.等。人GATOR1和GATOR1- rag GTPases复合物的结构。gydF4y2Ba自然gydF4y2Ba556gydF4y2Ba, 64 - 69(2018)。gydF4y2Ba
Peng M, Yin N. & Li M. O. SZT2规定了GATOR对mTORC1信号的控制。gydF4y2Ba自然gydF4y2Ba543gydF4y2Ba, 433 - 437(2017)。gydF4y2Ba
沃尔夫森,R. L.等。KICSTOR将GATOR1引入溶酶体,是调节mTORC1的营养物质所必需的。gydF4y2Ba自然gydF4y2Ba543gydF4y2Ba, 438 - 442(2017)。gydF4y2Ba
Bi, X., Corpina, R. A. & Goldberg, J. COPII囊泡外膜Sec23/24-Sar1芽前复合体的结构。gydF4y2Ba自然gydF4y2Ba419gydF4y2Ba, 271 - 277(2002)。gydF4y2Ba
弗尼,M.,贝克,R.,维兰德,F. T.和布里格斯,J. A.囊泡涂层:结构,功能和装配的一般原则。gydF4y2Ba细胞生物的趋势。gydF4y2Ba23gydF4y2Ba, 279 - 288(2013)。gydF4y2Ba
帕尔马尼干酪,A.等。Sestrins通过GATOR复合物抑制mTORC1激酶的激活。gydF4y2Ba细胞的代表。gydF4y2Ba9gydF4y2Ba, 1281 - 1291(2014)。gydF4y2Ba
Chantranupong, L.等。CASTOR蛋白是mTORC1通路的精氨酸传感器。gydF4y2Ba细胞gydF4y2Ba165gydF4y2Ba, 153 - 164(2016)。gydF4y2Ba
瓦伦斯坦,m.l.等。营养传感枢纽GATOR2的结构。gydF4y2Ba自然gydF4y2Ba607gydF4y2Ba, 610 - 616(2022)。gydF4y2Ba
Urban, J.等。Sch9是TORC1的主要靶点gydF4y2Ba酿酒酵母gydF4y2Ba.gydF4y2Ba摩尔。细胞gydF4y2Ba26gydF4y2Ba, 663 - 674(2007)。gydF4y2Ba
Punjani, A., Rubinstein, J. L., Fleet, D. J.和Brubaker, M. A. cryoSPARC:快速无监督低温电磁结构测定算法。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 290 - 296(2017)。gydF4y2Ba
非均匀细化:自适应正则化改进单粒子低温电磁重建。gydF4y2BaNat方法。gydF4y2Ba17gydF4y2Ba, 1214 - 1221(2020)。gydF4y2Ba
三维变率分析:从单粒子低温电磁中分辨连续的灵活性和离散的异质性。gydF4y2Baj . Struct。医学杂志。gydF4y2Ba213gydF4y2Ba107702(2021)。gydF4y2Ba
Sanchez-Garcia, R.等。DeepEMhancer:用于低温- em体积后处理的深度学习解决方案。gydF4y2BaCommun。医学杂志。gydF4y2Ba4 gydF4y2Ba874(2021)。gydF4y2Ba
贝叶斯对低温-电磁结构测定的看法。gydF4y2Baj·摩尔,杂志。gydF4y2Ba415gydF4y2Ba, 406 - 418(2012)。gydF4y2Ba
Pettersen, E. F.等。UCSF chimera -一个用于探索性研究和分析的可视化系统。gydF4y2Baj .第一版。化学。gydF4y2Ba25gydF4y2Ba, 1605 - 1612(2004)。gydF4y2Ba
德布勒,E. W.等。核孔膜的栅栏状外膜gydF4y2Ba摩尔。细胞gydF4y2Ba32gydF4y2Ba, 815 - 826(2008)。gydF4y2Ba
埃姆斯利,P. &考坦,K.库特:分子图形的模型构建工具。gydF4y2BaActa Crystallogr。DgydF4y2Ba60gydF4y2Ba, 2126 - 2132(2004)。gydF4y2Ba
Liebschner, D.等。利用x射线、中子和电子测定大分子结构:凤凰的最新进展。gydF4y2BaActa Crystallogr。DgydF4y2Ba75gydF4y2Ba, 861 - 877(2019)。gydF4y2Ba
威廉姆斯,C. J.等。MolProbity:改进全原子结构验证的更多更好的参考数据。gydF4y2Ba蛋白质科学。gydF4y2Ba27gydF4y2Ba, 293 - 315(2018)。gydF4y2Ba
阿凡宁,P. V.等。用于分析和验证低温-电磁图和原子模型的新工具。gydF4y2BaActa Crystallogr。DgydF4y2Ba74gydF4y2Ba, 814 - 840(2018)。gydF4y2Ba
Pettersen, E. F.等。UCSF ChimeraX:为研究人员、教育工作者和开发人员提供结构可视化。gydF4y2Ba蛋白质科学。gydF4y2Ba30.gydF4y2Ba, 70 - 82(2021)。gydF4y2Ba
张,T.等。自我tc介导的torc1调控Rag gtpase膜栓系的结构研究。gydF4y2Ba科学。睡觉。gydF4y2Ba5gydF4y2Baeaax8164(2019)。gydF4y2Ba
郑俊华等。Gtr1p的晶体结构gydF4y2Ba三磷酸鸟苷gydF4y2Ba-Gtr2pgydF4y2Ba国内生产总值gydF4y2Ba蛋白质复合体揭示了由gtp到gdp转换引发的大规模结构重排。gydF4y2Ba生物。化学。gydF4y2Ba287gydF4y2Ba, 29648 - 29653(2012)。gydF4y2Ba
确认gydF4y2Ba
L.T.获得了EMBO长期奖学金(ALTF 79-2019)的支持。R.L.感谢来自日内瓦州、瑞士国家科学基金会、国家化学生物学研究能力中心和欧洲研究理事会(AdG TENDO)的支持。p.l.k得到了联邦教育和研究部(BMBF, ZIK项目)(03Z22HN23, 03Z22HI2和03COV04),萨克森-安哈尔特欧洲区域发展基金(EFRE) (ZS/2016/04/78115),德国Forschungsgemeinschaft (DFG) (391498659, RTG 2467)和黑尔-威滕堡马丁-路德大学的支持。我们感谢日内瓦DCI (gydF4y2Bahttps://cryoem.unige.ch/gydF4y2Ba)及dci -洛桑(gydF4y2Bahttps://www.dci-lausanne.org/gydF4y2Ba),以支援电子显微镜。我们感谢J. Kefauver、X. Zhou、A. Boland、C. Bourgoint、L. Bonadei和M. Prouteau在项目期间的帮助,感谢Loewith实验室成员的讨论。我们还要感谢C. De Virgilio的Npr2gydF4y2BaR84AgydF4y2Ba和Sea1gydF4y2BaR943AgydF4y2Ba菌株。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
L.T.和R.L.构思并发起了这个项目。L.T.进行了蛋白质纯化、网格制备、数据收集、数据处理、模型构建、共聚焦显微镜成像和分析、体外GAP活性测定和酵母菌株构建。K.H.进行酵母菌株构建和生长试验。cg生成重组的EGOC。C.L.构建酵母菌株并进行蛋白质纯化。A.B.构建的酵母菌株。Y.S.在日内瓦DCI建立并监督了初始的低温电子显微镜数据收集。F.H, f.l.k和p.l.k协助初始低温电磁数据收集,并就样本和数据收集优化提供建议。L.T.和R.L.在听取了所有其他作者的意见后写了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有竞争利益。gydF4y2Ba
同行审查的信息gydF4y2Ba
同行审查的信息gydF4y2Ba
自然gydF4y2Ba感谢Claudio De Virgilio和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
扩展的数据图和表gydF4y2Ba
图1低温电子显微镜(Cryo-EM)测定SEAC的结构。gydF4y2Ba
一个gydF4y2Ba,纯化的SEAC经考马斯亮染色SDS-PAGE。星号表示洗脱样品中存在IgG和TEV蛋白酶。凝胶源数据见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2BabgydF4y2Ba,未展开和倾斜(蓝色)数据集的代表性显微图。gydF4y2BacgydF4y2Ba, Cryo-EM处理管道。聚焦的遮罩显示在3D体量的顶部。gydF4y2BadgydF4y2Ba,代表的二维类平均值来自重建中使用的最终粒子子集。核心和机翼模块显示在两个级别的平均值。gydF4y2Ba
扩展数据图2低温-电磁重建的分辨率。gydF4y2Ba
模拟gydF4y2Ba,半地图之间的傅立叶壳相关(FSC)图,用于确定FSC 0.143处平均分辨率的掩模,一致地图的方向分布图,方向(3D FSC)和局部分辨率估计(gydF4y2Ba一个gydF4y2Ba)、机翼聚焦图(gydF4y2BabgydF4y2Ba),原聚体聚焦图(gydF4y2BacgydF4y2Ba)和Sea2-Sea3焦点地图(gydF4y2BadgydF4y2Ba).gydF4y2Ba
图3映射拟合模型。gydF4y2Ba
一个gydF4y2Ba, FSC之间的模型和地图的完整复合体与共识低温- em地图。gydF4y2BabgydF4y2Ba,模型拟合共识图。gydF4y2BacgydF4y2Ba, FSC之间的模型和地图对机翼聚焦低温- em地图。指出了模型与地图之间的相互关系。gydF4y2BadgydF4y2Ba,模型符合机翼低温-电磁图。gydF4y2BaegydF4y2Ba,代表低温-电磁密度符合模型。gydF4y2Ba
图4 SEAC核心亚基是类似于coatomer的蛋白质。gydF4y2Ba
一个gydF4y2Ba,比较Sea4, Sea3和Sea2的结构与其同源GATOR2亚基(Mios, Wdr59和Wdr24)的AlphaFold预测。gydF4y2BabgydF4y2Ba, GATOR2亚基AlphaFold预测中不同域的pLDDT评分。gydF4y2BacgydF4y2Ba,结构的Nup85-Seh1 (PDB: 3f3f), Sec16-Sec13 (PDB: 3mzk)和Sec31-Sec13 (PDB: 2pm6)。所有这些亚基通过插入第七个叶片与coatomer β-螺旋桨相互作用。gydF4y2BadgydF4y2Ba, Sea2-Seh1, Sea4-Seh1和Sea3-Sec13的结构。用相应的低温-电磁密度图(原聚体聚焦图和Sea2-Sea3聚焦图)显示了Sea2、Sea4和Sea3的畴侵入基序(DIM)。对于Sea3,为了清晰起见,省略了n端β-螺旋桨。gydF4y2Ba
图5 Sea2、Sea3和Sea4 RING畴的结构和SEAC笼的形成。gydF4y2Ba
一个gydF4y2Ba,利用cryo-EM密度显示了Sea2、Sea4和Sea3 RING畴结构。锌离子按从n端到c端的顺序编号。gydF4y2BabgydF4y2Ba, Sea4-Seh1异质四聚体形成的SEAC笼与Sec31-Sec13异质四聚体形成的COPII笼的比较。COPII笼的模型使用PDB代码2pm6和6zg6制作。gydF4y2BacgydF4y2Ba, Sea4 ACE1结构域的结构及其与核孔ACE1结构域的比较(Nup85, PDB:3f3f;Nup145C, PDB:3iko)和COPII (Sec16, PDB:3mzk;Sec31 PDB: 2 pm6)。gydF4y2Ba
图6 SEACIT与GATOR1之间的结构守恒。gydF4y2Ba
一个gydF4y2Ba三聚体Sea1-Npr2-Npr3复合物(SEACIT)与GATOR1 (PDB:7t3b)的比较。gydF4y2BabgydF4y2Ba, Npr2-Npr3异源二聚体(左)与Nprl2-Nprl3(右)的比较。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba例如,Sea1通过其SABA结构域与Npr2相互作用,并通过扩展与c叶相互作用。gydF4y2BaegydF4y2BaSEACAT和SEACIT缺失菌株雷帕霉素生长试验(5 nM)。SEACIT亚基的缺失引起雷帕霉素耐药的轻微增加,而SEACIT亚基的缺失引起雷帕霉素耐药的轻微增加gydF4y2BaSEA2gydF4y2Ba而且gydF4y2BaSEA4gydF4y2Ba引起雷帕霉素过敏。gydF4y2BaSEA3gydF4y2Ba缺失导致中间SEACIT-SEACAT表型。gydF4y2BaegydF4y2Ba,去除海洋3gydF4y2BaSAPgydF4y2Ba足以诱导seacat样表型。gydF4y2Ba
图7 SEAC翼与核心的相互作用。gydF4y2Ba
一个gydF4y2Ba, Npr3的结构gydF4y2BaC-lobegydF4y2Ba以及Sea4 β-螺旋桨。gydF4y2BabgydF4y2Ba, Npr3gydF4y2BaC-lobegydF4y2Ba在Sea4 β螺旋桨的正电荷口袋上有一个带负电荷的小块。静电势在ChimeraX中计算。gydF4y2BacgydF4y2Ba海洋的结构3gydF4y2BaSIPgydF4y2Ba和N-loop。gydF4y2BadgydF4y2Ba, Sea3gydF4y2BaSIPgydF4y2Ban -环与Npr2和Npr3 c叶相互作用,并似乎稳定了Npr3负电荷环与Sea4 β-螺旋桨相互作用的位置。gydF4y2BaegydF4y2Ba从ΔNpr3菌株SEAC纯化得到的考马斯氏染色SDS-PAGE。只得到核心子单元。星号表示洗脱样品中存在IgG和TEV蛋白酶。凝胶源数据见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
图8 sea的结构gydF4y2BactgydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba,大海的位置gydF4y2BaArg943gydF4y2Ba在Sea1gydF4y2Ba沈gydF4y2Ba.gydF4y2BabgydF4y2Ba, EGOC, SEAC和wing的考马斯氏染色SDS-PAGE。而SEACgydF4y2BaNpr2R84AgydF4y2Ba显示一个正常的波段模式,SEACgydF4y2BaSea1R943AgydF4y2Ba缺少与Sea1对应的顶部带(用箭头表示)。当在Sea1中使用TAP标记纯化时,SEAC和wing都显示出相当数量的Npr2。凝胶源数据见补充图。gydF4y2Ba1gydF4y2Ba.gydF4y2BacgydF4y2Ba,阴性染色2D类平均值来自野生型SEAC, SEACgydF4y2BaNpr2R84AgydF4y2Ba和SEACgydF4y2BaSea1R943AgydF4y2Ba.白色箭头表示缺少翅膀的职业。gydF4y2BadgydF4y2Ba, Sea1的位置和灵活性(由局部分辨率表示)gydF4y2BactgydF4y2Ba.gydF4y2BaegydF4y2Ba1、结构比较gydF4y2Ba沈gydF4y2Ba和DEPDC5gydF4y2Ba沈gydF4y2Ba(PDB: 7 t3b)。gydF4y2BafgydF4y2Ba海洋的结构gydF4y2Ba沈gydF4y2Ba显示在ΔSea1中删除的区域gydF4y2BaCSgydF4y2Ba压力。gydF4y2Ba
图9 SEAC-EGOC超级复合体建模。gydF4y2Ba
一个gydF4y2Ba,与GATOR1绑定的调节布模型(PDB:7t3b;间隙模式),叠加在SEAC机翼上。显示了两个交互接口。gydF4y2BabgydF4y2Ba在“GAP”交互界面中,RagA与Npr2-Npr3之间的冲突主要发生在Npr2和Npr3的循环中。在两个确定的“绑定”循环中,只有Npr3绑定循环显示冲突。GATOR1中的这个循环向下折叠。gydF4y2BacgydF4y2Ba在“辅助”交互界面中,Sea1和RagC之间的冲突发生在来自Sea1的一个区域,该区域包括一个循环,当绑定到RagC时,在DEPDC5中折叠回来。gydF4y2BadgydF4y2Ba在RagA-Gtr1上叠加的rag - PDB: 7t3b和EGOC (PDB: 6jwp)的结构比较。由于RagC与GATOR1相互作用,其构象与Gtr2不同。与液泡/溶酶体固定的Ego1/LAMTOR1的n端尾也具有类似的方向。gydF4y2BaegydF4y2Ba, fm4 -64染色定量分析了液泡和细胞质中Sea4-GFP的信号强度。图示为范例型WT和Sea1细胞(定量见图。gydF4y2Ba4 jgydF4y2Ba).比例尺= 10 μm。gydF4y2Ba
图10 GATOR2和GATOR对SEAC的守恒。gydF4y2Ba
一个gydF4y2Ba, Seh1、Sea2和Sea3在SEAC中形成的界面结构。为了清楚起见,省略了Sea2和Sea3的n端。gydF4y2BabgydF4y2Ba,对Seh1L、Wdr24和Wdr59的AlphaFold预测分别叠加到其相应的SEAC亚基上,根据pLDDT评分着色。gydF4y2BacgydF4y2Ba,本研究获得的SEAC核(SEACAT)结构(左)和人类GATOR2 (PDB: 7uhy,右)。两种结构的主要区别在于GATOR2中开放的后接口,这可能是由于缺乏GATOR1的绑定,以及Sea3 (Sea3gydF4y2BaSIPgydF4y2Ba),它在SEAC中成为机翼的一部分(为清晰起见,图中没有显示)。gydF4y2BadgydF4y2Ba, holoGATOR模型使用GATOR2的已知结构(PDB: 7uhy)和对Wdr59的n端区域的AlphaFold预测,GATOR1绑定到Rag-Ragulator的两个副本,一个在“GAP模式”,一个在“抑制模式”(PDB: 7t3c,所谓的双模式)。在该模型中,无论结合模式(GAP vs抑制),LAMTOR1的第一个结构残基与溶酶体膜的假定位置大约等距。GATOR2会阻止机翼的翻转,之前有人提议用它来调节GATOR1功能。最后,DEPDC5将能够与KICSTOR交互。目前尚不清楚这种“双重结合模式”是否与生理相关,但在这种模式下似乎是可能的。gydF4y2Ba
补充信息gydF4y2Ba
补充信息gydF4y2Ba
补充图1(凝胶源图像),表1(低温- em数据收集、提纯和验证统计),表2(本研究使用的酵母菌株)和表3(本研究使用的质粒)。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的使用范围,您将需要直接从版权所有者那里获得许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
Tafur, L., Hinterndorfer, K., Gabus, C。gydF4y2Baet al。gydF4y2BaSEA复合物的Cryo-EM结构。gydF4y2Ba自然gydF4y2Ba(2022)。https://doi.org/10.1038/s41586-022-05370-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05370-0gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba