摘要gydF4y2Ba
精蛋白通常将精子染色质转化为致密且转录不活跃的状态gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2 gydF4y2Ba.开花植物的精细胞缺乏蛋白蛋白,但它们有小的、转录活跃的细胞核,染色质通过一种未知的机制凝聚gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4gydF4y2Ba.这里我们展示了一种组蛋白变体H2B。8,mediates sperm chromatin and nuclear condensation in拟南芥gydF4y2Ba.H2B丢失。8c一个uses enlarged sperm nuclei with dispersed chromatin, whereas ectopic expression in somatic cells produces smaller nuclei with aggregated chromatin. This result demonstrates that H2B.8 is sufficient for chromatin condensation. H2B.8 aggregates transcriptionally inactive AT-rich chromatin into phase-separated condensates, which facilitates nuclear compaction without reducing transcription. Reciprocal crosses show that mutation ofh2b.8gydF4y2Ba减少男性传播,这表明H2B。8-mediated sperm compaction is important for fertility. Altogether, our results reveal a new mechanism of nuclear compaction through global aggregation of unexpressed chromatin. We propose that H2B.8 is an evolutionary innovation of flowering plants that achieves nuclear condensation compatible with active transcription.
主要gydF4y2Ba
在大多数动物中,精子染色质经历了广泛的凝结,这对雄性的生育能力是必不可少的。在动物精子成熟过程中,几乎所有的组蛋白都被富含精氨酸的小蛋白所取代,这有助于DNA的紧密包装gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2 gydF4y2Ba.例如,在哺乳动物精子中,组蛋白仅保留在基因组的5-15%,而组蛋白携带的大部分调控信息丢失了gydF4y2Ba1gydF4y2Ba,gydF4y2Ba5gydF4y2Ba.从组蛋白中解绕DNA需要DNA链断裂,在这个过程中观察到大量的DNA链断裂gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba7gydF4y2Ba.此外,蛋白蛋白阻碍转录gydF4y2Ba8gydF4y2Ba.蛋白蛋白的极端染色质压缩保护了基因组的完整性,使其免受遗传毒性因素的影响,并实现了小而流体动力的精子头部,增强了游泳能力gydF4y2Ba2 gydF4y2Ba,gydF4y2Ba8gydF4y2Ba.采用这样一个过程说明了精子适应性的高进化压力gydF4y2Ba9gydF4y2Ba.gydF4y2Ba
精子凝结也发生在另一大群多细胞真核生物:植物中。与动物类似,绿藻和非种子植物(如苔类、苔藓和蕨类植物)也会产生活动精子,这些精子会在水中游动,到达卵细胞gydF4y2Ba10gydF4y2Ba.与精蛋白介导的精子凝结进化以促进游泳的理论一致gydF4y2Ba2 gydF4y2Ba这些物种的精子核被精蛋白和类精蛋白高度浓缩,转录的RNA很少,如果有的话gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.gydF4y2Ba
大约在1.5亿年前,开花植物与其他陆地植物分道扬镳,不再依赖水来施肥gydF4y2Ba10gydF4y2Ba.开花植物产生不动的、转录活跃的精子gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba4gydF4y2Ba.精子被包裹在花粉粒中,花粉粒是由称为小孢子的单倍体减数分裂产物有丝分裂产生的gydF4y2Ba10gydF4y2Ba.小孢子分裂一次产生一个营养细胞和一个生殖细胞,后者随后分裂产生两个精子细胞gydF4y2Ba10gydF4y2Ba.在受精过程中,营养细胞发育成花粉管,将精子输送到卵细胞gydF4y2Ba15gydF4y2Ba.与花粉管生长所需的高代谢活性相一致,营养细胞中的染色质高度去致密,转录活跃gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.相比之下,精子具有高度浓缩的、以组蛋白为基础的染色质和小核gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.在缺乏蛋白蛋白的情况下,开花植物精子染色质凝聚的机制尚不清楚。gydF4y2Ba
为了了解开花植物精子凝结的机制,我们对来自植物的精子细胞、营养细胞和体细胞进行了超分辨率成像和比较蛋白质组学分析gydF4y2Ba一个。gydF4y2Ba芥gydF4y2Ba.通过这些实验,我们鉴定出一种特异性表达的组蛋白变体H2B。在精子核质中与染色质聚集体共定位的。带有gydF4y2Bah2b.8gydF4y2Ba突变扩大,染色质去致密,而H2B异位表达。体细胞中的8导致相反的表型。结果表明H2B。8is necessary and sufficient for nuclear and chromatin condensation. H2B.8 aggregates chromatin through a phase-separation mechanism that depends on a conserved intrinsically disordered region (IDR). H2B.8 specifically concentrates unexpressed AT-rich euchromatin, which reduces the nuclear volume while maintaining transcription. H2B.8-induced nuclear compaction is important for fertility, ash2b.8gydF4y2Ba突变减少了男性传播。总的来说,我们的研究结果解释了开花植物精子凝聚,并揭示了转录兼容染色质凝聚的新机制。gydF4y2Ba
精子染色质聚集gydF4y2Ba
以前的研究gydF4y2Ba拟南芥gydF4y2BaDAPI染色显示,与体细胞和营养细胞相比,精子染色质高度凝聚,核尺寸较小gydF4y2Ba19gydF4y2Ba.为了更详细地描述精子染色质,我们检查了gydF4y2Ba拟南芥gydF4y2Ba使用超分辨率3D结构照明显微镜(3D- sim)观察精子核。在精子细胞的核质中观察到明显的染色质聚集体(图2)。gydF4y2Ba1gydF4y2Ba).相比之下,营养细胞和叶细胞中的染色质更为均匀,尽管叶细胞在核周围有浓缩的异染色质灶(图2)。gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
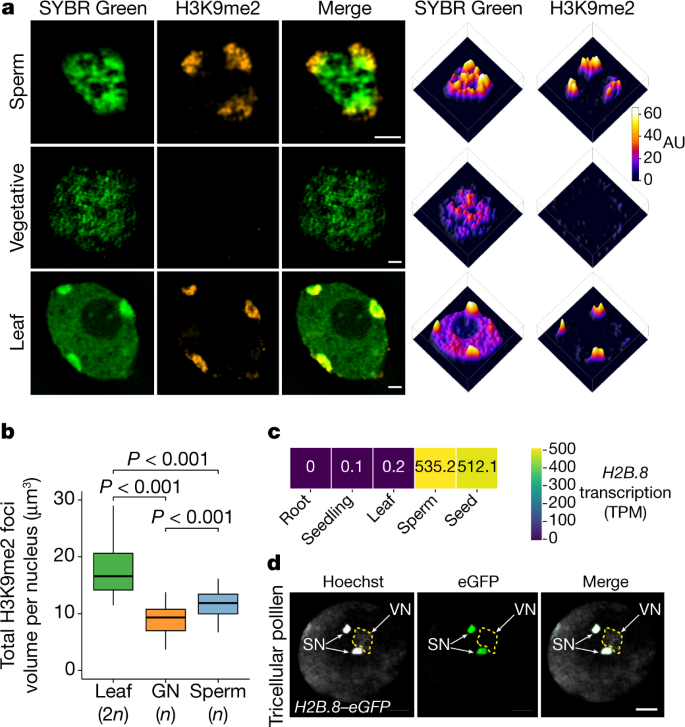
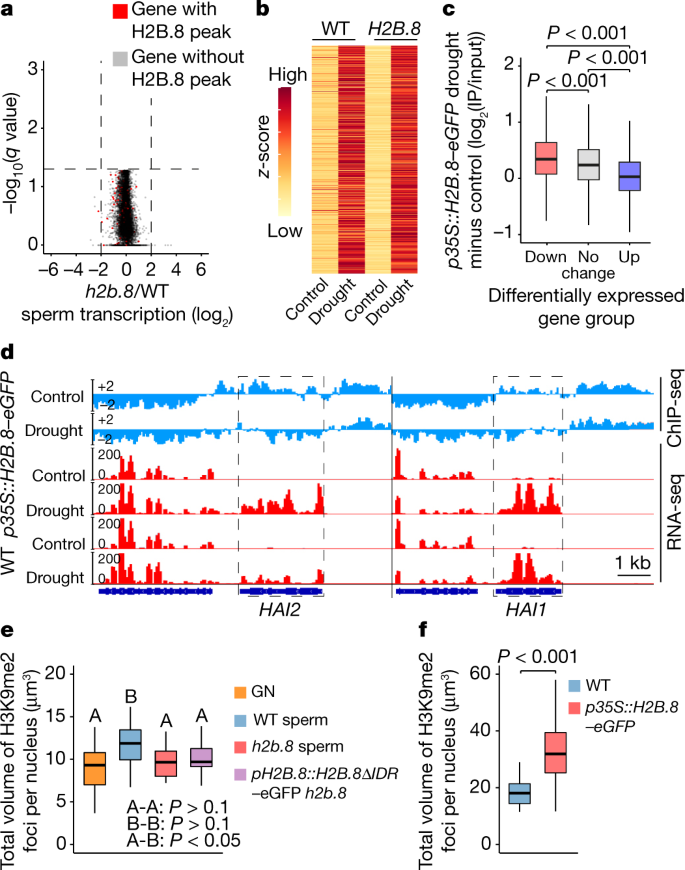
一个gydF4y2Ba,花粉和二倍体叶核的野生型(WT)精子和营养核的超分辨率3D-SIM图像(左)和相关强度曲线(右)。DNA用SYBR Green染色(绿色),H3K9me2免疫定位(橙色)。所示数据代表三个独立的实验。AU,任意单位。gydF4y2BabgydF4y2Ba,二倍体叶核、生殖核和精子核中富含h3k9me2的异染色质中心的总体积。gydF4y2BaPgydF4y2Ba使用单侧方差分析(ANOVA)计算值,然后进行单个双样本Tukey检验;gydF4y2BangydF4y2Ba在两个独立的实验中分别检测了30个原子核。本工作中的所有箱形图均显示中位数(粗黑色条)和第一、第三四分位数,下、上须分别延伸至第一、第三四分位数的四分位数间距或最高值和最低值的1.5倍。gydF4y2BacgydF4y2Ba,gydF4y2BaH2B.8gydF4y2Ba指示组织和细胞的转录水平。TPM,每百万份成绩单。gydF4y2BadgydF4y2Ba的共聚焦图像gydF4y2BapH2B.8: H2B.8-eGFPgydF4y2Ba在花粉中,eGFP信号是精子核(SN)特有的。VN,营养核(虚线标出)。所示数据代表三个独立的实验。标尺,1 μm (gydF4y2Ba一个gydF4y2Ba) 5 μm (gydF4y2BadgydF4y2Ba).gydF4y2Ba
为了了解精子聚集体中染色质的组成,我们对组蛋白H3赖氨酸9二甲基化(H3K9me2)进行了免疫染色,这是一种与沉默的异染色质相关的修饰gydF4y2Ba21gydF4y2Ba.位于精子核周围的较大聚集体与H3K9me2信号共定位(图2)。gydF4y2Ba1gydF4y2Ba).这一结果表明异染色质结构域在精子中持续存在,正如之前报道的那样gydF4y2Ba16gydF4y2Ba.然而,这些异染色质灶在精子细胞中比在叶细胞中显得更大。gydF4y2Ba1gydF4y2Ba).为了进一步研究这方面,我们量化了精子、二倍体叶核和生殖细胞(分裂为精子细胞的单倍体母细胞)细胞核中富含h3k9me2的异染色质病灶的总量。正如预期的那样,与二倍体叶核相比,单倍体生殖核中的异染色质焦点体积减少了一半(图2)。gydF4y2Ba1 bgydF4y2Ba).相反,精子的异染色质病灶比生殖细胞核的大27.5%(图2)。gydF4y2Ba1 bgydF4y2Ba),这表明异染色质凝聚水平降低,或者基因组融入异染色质的比例增加。后一种情况的可能性较小,因为精子细胞中检测到的H3K9me2(与总H3相比)少于叶细胞(扩展数据图)。gydF4y2Ba1gydF4y2Ba).除了异染色质病灶外,精子中其他染色质聚集体的H3K9me2也被耗尽(图2)。gydF4y2Ba1gydF4y2Ba).这一观察结果表明,一种新的机制被用于压缩精子染色质中较少异色的部分。gydF4y2Ba
H2B.8marks sperm chromatin
为了研究精子染色质压实的机制,我们寻找了精子特异性染色质因子。为此,我们对叶片核以及荧光激活细胞分选(FACS)分离的精子和营养核进行了质谱分析。我们发现了组蛋白H2B, H2B.8的变体(编码gydF4y2BaAT1G08170gydF4y2Ba),占精子H2B的12.6%,但在营养细胞和叶细胞的细胞核中不存在(扩展数据图)。gydF4y2Ba1 bgydF4y2Ba).与此结果一致的是,RNA测序(RNA-seq)实验检测到丰富的RNAgydF4y2BaH2B.8gydF4y2Ba精子细胞的转录水平,但没有来自体细胞组织,如叶,根和整个幼苗(图2)。gydF4y2Ba1 cgydF4y2Ba).为了进一步研究发育过程中的蛋白表达模式,我们通过表达H2B产生了报告系。8-eGFP融合蛋白gydF4y2BaH2B.8gydF4y2Ba启动子的gydF4y2Ba拟南芥gydF4y2Ba(gydF4y2BapH2B.8: H2B.8-eGFPgydF4y2Ba).共聚焦成像显示H2B。8is incorporated into sperm following the second pollen mitotic division step, when nuclei are compacted and chromatin aggregates (Fig.1 dgydF4y2Ba及扩展数据图gydF4y2Ba1 cgydF4y2Ba).H2B.8was rapidly lost after fertilization, but reappeared during seed maturation (Extended Data Fig.1 dgydF4y2Ba).没有H2B。8–eGFP was observed in any other cell or tissue except sperm and seeds (Extended Data Fig.1 c, dgydF4y2Ba),这与最近发表的H2B表达分析一致gydF4y2Ba22gydF4y2Ba.gydF4y2Ba
H2B.8mediates chromatin condensation
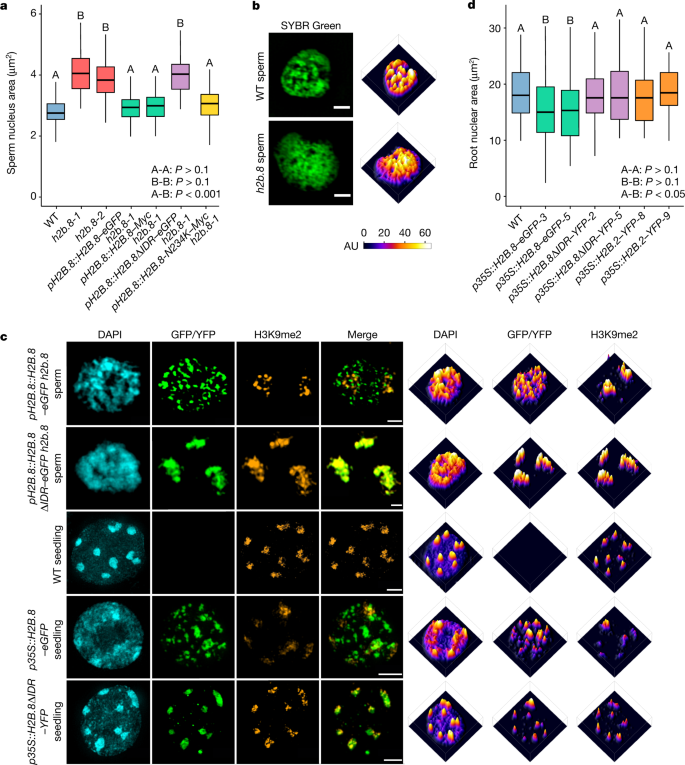
因为H2B的存在。8c或related with nuclear and chromatin condensation, we proposed that H2B.8-induced chromatin condensation is responsible for sperm compaction. To test this hypothesis, we generated two independenth2b.8gydF4y2BaCRISPR敲除突变体(gydF4y2Bah2b.8-1gydF4y2Ba和gydF4y2Bah2b.8-2gydF4y2Ba)(扩展数据图gydF4y2Ba2gydF4y2Ba),并通过共聚焦和3D-SIM成像检测其精子表型。两者的精核gydF4y2Bah2b.8gydF4y2Ba突变体比野生型大40%左右(图2)。gydF4y2Ba2gydF4y2Ba),这表明H2B。8contributes to sperm nuclear compaction. Notably, sperm nuclei ofh2b.8gydF4y2Ba突变体比它们的前身生殖核小,后者也是单倍体(扩展数据图)。gydF4y2Ba2 bgydF4y2Ba).结果表明H2B。8is not the sole mechanism involved in sperm nuclear compaction. In further support of our hypothesis, chromatin was more homogenous and had reduced aggregation inh2b.8gydF4y2Ba突变体(无花果。gydF4y2Ba2 bgydF4y2Ba及扩展数据图gydF4y2Ba2汉英gydF4y2Ba).确认…的作用gydF4y2Bah2b.8gydF4y2Ba我们表达了这些表型的突变gydF4y2BapH2B.8: H2B.8-MycgydF4y2Ba和gydF4y2BapH2B.8: H2B.8-eGFPgydF4y2Ba转基因gydF4y2Bah2b.8gydF4y2Ba突变体(gydF4y2Bah2b.8-1gydF4y2Ba;除非另有说明,所有gydF4y2Bah2b.8gydF4y2Ba突变体(下文简称该等位基因)。两种转基因都成功地挽救了gydF4y2Bah2b.8gydF4y2Ba精子核达到野生型水平(图2)。gydF4y2Ba2gydF4y2Ba),这提供了H2B的证据。8驱动核凝聚。染色质聚集体也恢复gydF4y2BapH2B.8: H2B.8-eGFPh2b.8gydF4y2Ba精子(图。gydF4y2Ba2摄氏度gydF4y2Ba).此外,这些恢复的聚集体与H2B共定位。8-eGFP(无花果。gydF4y2Ba2摄氏度gydF4y2Ba及扩展数据图gydF4y2Ba2 fgydF4y2Ba),这表明H2B。8is directly involved in forming the aggregates.
一个gydF4y2Ba, WT和其他指示基因型的精子核大小。gydF4y2BaPgydF4y2Ba使用单侧方差分析计算值,然后进行单个双样本Tukey检验。标记为A和B的箱形图在两组之间差异显著(gydF4y2BaPgydF4y2Ba< 0.001),但不在组内(gydF4y2BaPgydF4y2Ba> 0.1)。gydF4y2BangydF4y2Ba= 80 (wt;gydF4y2Bah2b.8-1gydF4y2Ba,gydF4y2BapH2B.8: H2B.8-Mych2b.8-1,pH2B.8: H2B.8-N234K-Mych2b.8-1gydF4y2Ba), 79 (gydF4y2BapH2B.8: H2B.8-eGFPh2b.8-1gydF4y2Ba,gydF4y2Bah2b.8-2gydF4y2Ba)或39 (gydF4y2BapH2B.8:: H2B。8ΔIDR–eGFP h2b.8-1经过两次独立实验检验的核。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,超分辨率3D-SIM图像(左)和相关强度谱(右),表明基因型的精子和幼苗核(gydF4y2Bah2b.8gydF4y2Ba是指gydF4y2Bah2b.8-1gydF4y2Ba除非另有说明)。所示数据代表三个独立的实验。标尺,1 μm (gydF4y2BabgydF4y2Ba)、1 μm (gydF4y2BacgydF4y2Ba(上两个面板)和2 μm (gydF4y2BacgydF4y2Ba(下面三个面板)。gydF4y2BadgydF4y2Ba,所示基因型的根核大小(基因型后的数字表示独立的转基因系)。gydF4y2BaPgydF4y2Ba使用单侧方差分析计算值,然后进行单个双样本Tukey检验。标记为A和B的箱形图在两组之间差异显著(gydF4y2BaPgydF4y2Ba< 0.05),但组内无(gydF4y2BaPgydF4y2Ba> 0.1)。gydF4y2BangydF4y2Ba= 100 (wt), 101 (gydF4y2Bap35区域:H2B.2-YFPgydF4y2Ba-9), 103 (gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba3,gydF4y2Bap35区域:H2B.8ΔIDR-YFPgydF4y2Ba-5), 104 (gydF4y2Bap35区域:H2B.8-eGFP -gydF4y2Ba5), 107 (gydF4y2Bap35区域:H2B.8ΔIDR-YFP -gydF4y2Ba2)或109 (gydF4y2Bap35区域:H2B.2-YFPgydF4y2Ba-8)原子核经过两次独立实验检验。gydF4y2Ba
测试H2B是否。8is sufficient to drive chromatin aggregation and nuclear compaction, we ectopically expressed H2B.8 using a strong constitutive promoter (p35区域gydF4y2Ba).与H2B共定位的独特染色质聚集体。8-eGFP诱导gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba体细胞核(图2)gydF4y2Ba2摄氏度gydF4y2Ba及扩展数据图gydF4y2Ba2 ggydF4y2Ba).约30%的细胞核含有大量小H2B。8总量;其余70%的聚集物较少,聚集物较大(图2)。gydF4y2Ba2摄氏度gydF4y2Ba及扩展数据图gydF4y2Ba2 hgydF4y2Ba).H2B的总体积。8一个ggregates was comparable between the two types of nuclei (Extended Data Fig.2 hgydF4y2Ba),这表明H2B。8-containing chromatin aggregates were fusing over time.p35区域:H2B.8-eGFPgydF4y2Ba表达也使根细胞的核大小减少22%(图2)。gydF4y2Ba二维gydF4y2Ba).这些结果表明H2B。8is sufficient for chromatin and nuclear condensation.
H2B.8drives chromatin phase separation
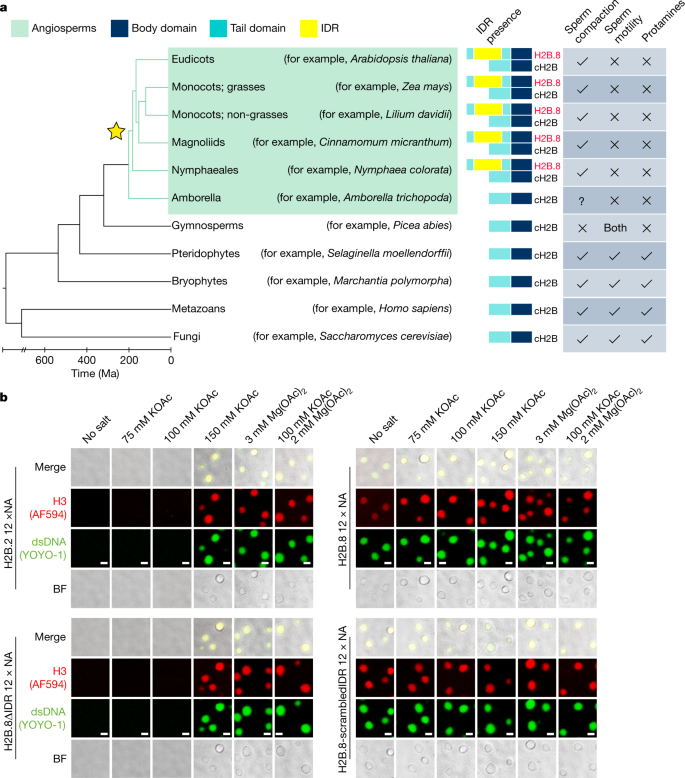
H2B.8is distinguished from other拟南芥gydF4y2BaH2B变体通过一个更长的氨基末端尾部,包含一个93个氨基酸的IDR(扩展数据图)。gydF4y2Ba3 a, bgydF4y2Ba).系统发育分析显示H2B。8is specific to flowering plants and is present in all flowering plant species with published genomes, except the most basalAmborella trichopodagydF4y2Ba(无花果。gydF4y2Ba3gydF4y2Ba及补充表gydF4y2Ba1gydF4y2Ba).值得注意的是,所有检测结果均为H2B。8homologues shared the insertion of an IDR in the histone tail (Fig.3gydF4y2Ba及补充表gydF4y2Ba1gydF4y2Ba),这表明了它的功能重要性。gydF4y2Ba
一个gydF4y2Ba,说明H2B的系统发育树。8 .进化(以星星为标志)。精子染色质压实状态,精子活力和蛋白蛋白或蛋白样蛋白的存在被表示为所代表的真核生物谱系。妈,几百万年前。gydF4y2BabgydF4y2Ba携带H2B的核小体阵列(NA)的体外相分离分析。2, H2B。8, H2B。8ΔIDR and H2B.8 with a scrambled IDR sequence (H2B.8-scrambledIDR) under indicated salt conditions and 100 nM NA concentration. Histone H3 was labelled by Alexa Fluor 594 (AF594, red), and double-stranded DNA (dsDNA) was stained with YOYO-1 (green). BF, bright field. Data shown represent one representative experiment, which has been performed three times with similar results. Scale bars, 2 μm.
idr可以通过相分离驱动生物分子凝聚物的形成gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba.此外,含idr蛋白的相分离可以介导异染色质灶的形成和凝聚gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba.在此基础上的知识和独特的H2B。8foci pattern in sperm and somatic cells that ectopically express H2B.8 (Fig.2摄氏度gydF4y2Ba),我们提出H2B。8一个ggregates chromatin through IDR-mediated phase separation.
为了验证这一假设,我们使用重组荧光团标记的组蛋白八聚体和包含601核小体定位序列12次重复的DNA模板组装核小体阵列。然后,我们测试了这些核小体阵列的相分离特性(图2)。gydF4y2Ba3 bgydF4y2Ba及扩展数据图gydF4y2Ba3 cgydF4y2Ba).阳离子(K)的加入gydF4y2Ba+gydF4y2Ba和/或毫克gydF4y2Ba2 +gydF4y2Ba),以生理上相关的浓度与H2B重组的染色质。8或一个c一个nonical H2B (H2B.2) that naturally lacks an IDR induced the formation of phase-separated droplets (Fig.3 bgydF4y2Ba).这一结果与先前的发现一致,即在生理盐条件下,染色质在体外进行相分离gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba.与报道的染色质凝聚物的液体性质一致gydF4y2Ba27gydF4y2Ba,含有H2B的染色质液滴。8或H2B。2showed fluorescence recovery after photobleaching (FRAP; Extended Data Fig.3 dgydF4y2Ba)和接触后的液滴融合(扩展数据图。gydF4y2Ba3 egydF4y2Ba).gydF4y2Ba
H2B的FRAP。8chromatin droplets was slower than that of H2B.2 droplets (Extended Data Fig.3 dgydF4y2Ba),这反映了内部液滴动力学的减少和更像凝胶的行为。进一步检验H2B是否。8confers different phase-separation properties to chromatin, we examined H2B.8-containing and H2B.2-containing nucleosomal arrays under different salt and array concentrations. Under the same physiological salt concentration, H2B.8-containing nucleosome arrays formed phase-separated condensates at lower chromatin concentrations (Extended Data Fig.3 fgydF4y2Ba).此外,不像典型的染色质相分离需要生理阳离子的帮助gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba, H2B。8-containing nucleosome arrays formed phase-separated droplets under low or no cation conditions (or in the presence of high concentration of the chelating agent EDTA; Fig.3 bgydF4y2Ba及扩展数据图gydF4y2Ba3 ggydF4y2Ba).检验该相分离特性是否依赖于H2B的IDR。8、利用H2B重组核小体阵列。8无IDR (H2B.8ΔIDR)(扩展数据图gydF4y2Ba3 cgydF4y2Ba).类似于H2B。2-containing chromatin, H2B.8ΔIDR-containing nucleosome arrays did not phase separate at lower array concentrations (<50 nM; Extended Data Fig.3 fgydF4y2Ba),在没有盐的情况下无法进行相分离(图2)。gydF4y2Ba3 bgydF4y2Ba及扩展数据图gydF4y2Ba3 ggydF4y2Ba).与idr通过无序状态而不是特定序列基序促进相分离的观点一致gydF4y2Ba23gydF4y2Ba,gydF4y2Ba29gydF4y2Ba含有H2B的染色质。8in which the IDR sequence was randomly scrambled (H2B.8-scrambledIDR) phase separated in a salt-independent manner (Fig.3 bgydF4y2Ba).综上所述,我们的结果表明H2B的IDR。8介导一种新的染色质相分离形式。gydF4y2Ba
测试H2B是否。8phase separation is required for chromatin condensation in vivo, we ectopically expressed H2B.8ΔIDR (p35区域:H2B.8ΔIDR-YFPgydF4y2Ba)或典型的H2B。2个细胞。与全长H2B的效果相反。8, H2B。8ΔIDR or H2B.2 expression did not induce chromatin aggregation and had no effect on nuclear size in root cells (Fig.2 c, dgydF4y2Ba).这一结果证实了染色质和核凝聚依赖于h2b - 8的IDR。接下来我们表达H2B。8ΔIDRgydF4y2Bah2b.8gydF4y2Ba突变植物(gydF4y2BapH2B.8:: H2B。8ΔIDR–eGFP h2b.8),并检查精子核凝聚是否也依赖于IDR。不像全长H2B。8, H2B。8ΔIDR failed to rescue the sperm nuclear size phenotype ofh2b.8gydF4y2Ba(无花果。gydF4y2Ba2, cgydF4y2Ba).这一结果证明了IDR对精子核凝聚的重要性。gydF4y2Ba
除了IDR, H2B。8h一个s several amino acid differences to that of canonical H2Bs in the globular domain, including asparagine 234 (N234), which is canonically a lysine residue that is subject to monoubiquitylation22gydF4y2Ba(扩展数据图gydF4y2Ba3gydF4y2Ba).H2B的无能。8ΔIDR营救gydF4y2Bah2b.8gydF4y2Ba精子核表型(图2)gydF4y2Ba2gydF4y2Ba)表明,没有IDR, H2B。8globular domain cannot mediate nuclear compaction. Nonetheless, as H2B monoubiquitylation is an important modification30.gydF4y2Ba我们检查了N234是否对H2B很重要。8通过表达突变的H2B发挥功能。8with the 234th asparagine replaced by lysine (H2B.8-N234K). The expression of H2B.8-N234K fully complemented theh2b.8gydF4y2Ba精子核大小表型(图2)gydF4y2Ba2gydF4y2Ba),这表明N234不是H2B所必需的。8功能。gydF4y2Ba
染色质和核凝聚对H2B IDR的依赖性。8might result from the disordered state of the IDR and associated phase-separation ability or from IDR-mediated recruitment of unknown chromatin-condensing factors. To test these hypotheses, we expressed H2B.8 with a randomly scrambled IDR sequence (H2B.8-scrambledIDR) or with the native IDR replaced by animal IDR sequences of similar negative charge (H2B.8-EWSR-IDR and H2B.8-TAF15-IDR)31gydF4y2Ba并测量了它们对烟叶核大小的影响。类似于原生H2B的作用。8、H2B的表达。8-scrambledIDR H2B。8-EWSR-IDR和H2B。8-TAF15-IDR all effectively condensed the nuclei of tobacco epidermis (Extended Data Fig.3 hgydF4y2Ba).这一结果表明H2B的功能。8relies on phase-separation ability instead of specific sequence motifs within the IDR. In line with this, although the presence of the IDR is conserved among flowering plants, the sequences of H2B.8 IDRs are diverse (Supplementary Table1gydF4y2Ba).gydF4y2Ba
H2B.8is located in silent euchromatin
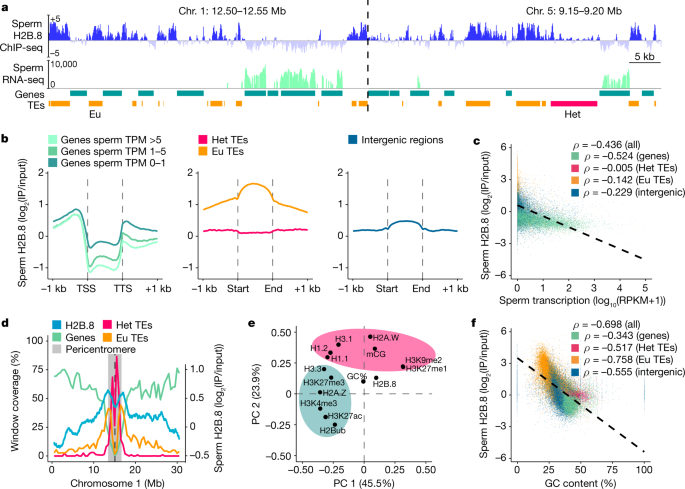
进一步了解H2B。8一个ctivity, we determined the genomic localization of H2B.8 by performing native chromatin immunoprecipitation assay with sequencing (ChIP-seq) onpH2B.8: H2B.8-eGFPh2b.8gydF4y2Ba花粉使用gfp特异性抗体。该分析鉴定出H2B。8peaks that occupied about 17% of the sperm genome. This value was comparable with our mass spectrometry results, which showed that approximately 13% of canonical H2B is replaced by H2B.8 in sperm (Extended Data Fig.1 bgydF4y2Ba).H2B.8was most enriched within so-called euchromatic transposable elements (TEs) (Fig.4 a、bgydF4y2Ba),它们富含at,并且缺乏H3K9me2和其他异色标记gydF4y2Ba32gydF4y2Ba.异色TEs,通常富含gc和h3k9me2gydF4y2Ba32gydF4y2Ba美国的h2b含量相对较少(无花果。gydF4y2Ba4 a、bgydF4y2Ba).H2B.8was excluded from the bodies of transcribed genes compared with inactive genes and intergenic regions, and H2B.8 enrichment and gene transcription were anticorrelated (Fig.4得了gydF4y2Ba).H2B.8distribution along chromosomes followed that of euchromatic TEs, with H2B.8 most abundant at the edges of pericentromeric regions (Fig.4 dgydF4y2Ba及扩展数据图gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
一个gydF4y2BaH2B的基因组快照。精子丰度(loggydF4y2Ba2 gydF4y2Ba(IP/输入)),精子细胞转录(loggydF4y2Ba2 gydF4y2Ba(RPKM))和基因和TE注释(橙色,共色TE;洋红色,异色TE)在代表性区域。RPKM,每千个碱基的转录本每百万次映射的读取。gydF4y2BabgydF4y2Ba,精子H2B图谱。8enrichment over genes (grouped by sperm cell expression), TEs (grouped by chromatin state) and intergenic regions.cgydF4y2Ba,gydF4y2BafgydF4y2Ba,散点图显示精子H2B呈负相关。8精子转录富集(gydF4y2BacgydF4y2Ba)或GC含量(gydF4y2BafgydF4y2Ba)是基因组特征之一。gydF4y2BaρgydF4y2Ba斯皮尔曼的军衔。颜色是一样的gydF4y2BadgydF4y2Ba.gydF4y2BadgydF4y2Ba,基因的覆盖范围,常染色质TEs和异染色质TEs(左)gydF4y2BaygydF4y2Ba轴,500-kb窗口)和H2B。精子中8的富集(右)gydF4y2BaygydF4y2Ba轴;1-kb窗口)沿染色体1。染色体2-5显示在扩展数据图中。gydF4y2Ba4gydF4y2Ba.gydF4y2BaegydF4y2Ba, H2B的PCA。8一个bundance inp35区域:H2B.8-eGFPgydF4y2Ba具有其他染色质标记的幼苗。绿色和粉色阴影区域分别代表正色和异色标记。gydF4y2Ba
进一步了解H2B的染色质偏好。8和whether its localization pattern is intrinsically determined by H2B.8 or other sperm-specific components, we performed native ChIP-seq with seedlings of the ectopic H2B.8 expression line (p35区域:H2B.8-eGFPgydF4y2Ba).这揭示了一种类似的H2B。8localization pattern to that in sperm, with enrichment in euchromatic TEs and intergenic regions (Extended Data Fig.4罪犯gydF4y2Ba).同时具有异位H2B的能力。8to condense somatic cell chromatin and nuclei (Fig.2 c, dgydF4y2Ba),这些结果表明H2B。8deposition does not rely on sperm-specific factors. Next, utilizing available seedling epigenomic data, we explored H2B.8 associations with other chromatin features. Principal component analysis (PCA) revealed that H2B.8 clustered with neither permissive nor repressive chromatin modifications but associated with GC content (Fig.4 egydF4y2Ba).H2B的多元线性回归模型。8further showed that transcription and GC content were the best predictors of H2B.8 localization, with which strong anticorrelations exist (Fig.4 c fgydF4y2Ba扩展数据图gydF4y2Ba4 e, fgydF4y2Ba及补充表gydF4y2Ba2 gydF4y2Ba).这也许可以解释为什么H2B。8is strongly depleted from transcribed genes (Fig.4 bgydF4y2Ba及扩展数据图gydF4y2Ba4摄氏度gydF4y2Ba).在基因组的其余部分,很少有转录,H2B。8一个ccumulated at GC-poor elements, mostly euchromatic TEs and intergenic regions (Extended Data Fig.4 e, ggydF4y2Ba).综上所述,我们的结果表明H2B。8localization is mostly driven by transcription and GC content rather than sperm-specific factors.
目前尚不清楚为什么是H2B。8localization is associated with transcription and GC content; however, our cytological observations provided indications. 3D-SIM showed that unlike the full-length H2B.8, which is largely devoid in heterochromatin, H2B.8ΔIDR preferentially located to heterochromatin when expressed in sperm or seedling cells (Fig.2摄氏度gydF4y2Ba).为了验证这一观察结果,并检查H2B的基因组定位。8ΔIDR,我们对H2B进行了ChIP-seq。8ΔIDR异位表达(gydF4y2Bap35区域:H2B.8ΔIDR-eGFPgydF4y2Ba)幼苗,并将结果与gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba(和gydF4y2Bap35区域:H2B.2-eGFPgydF4y2Ba作为对照)幼苗。与细胞学结果一致,H2B。8ΔIDR preferentially located to pericentromeric heterochromatin, and its abundance along chromosomal arms was generally reduced compared with H2B.8 (Extended Data Fig.5gydF4y2Ba).值得注意的是,虽然IDR的缺失显著降低了H2B的富集。8, H2B增高。8deposition in heterochromatic TEs, it did not disrupt the preferential depletion of H2B.8 from transcribed genes (Extended Data Fig.5 bgydF4y2Ba).这一发现表明H2B的IDR。8is required for the preferential localization of H2B.8 in euchromatin, but not for its exclusion from transcribed regions.
H2B.8does not suppress transcription
染色质凝聚通常与转录抑制有关gydF4y2Ba21gydF4y2Ba.因此,H2B的定位。8in the non-transcribing parts of the genome could arise through two mechanisms. Either H2B.8 suppresses transcription or it is excluded from transcribed regions. To test these hypotheses, we isolated wild-type andh2b.8gydF4y2Ba突变精子细胞并进行rna测序。在野生型和野生型中表达的12198个基因中gydF4y2Bah2b.8gydF4y2Ba精子中没有明显的表达改变gydF4y2Bah2b.8gydF4y2Ba细胞(图。gydF4y2Ba5gydF4y2Ba).同样,我们没有发现任何te在gydF4y2Bah2b.8gydF4y2Ba(扩展数据图)gydF4y2Ba6gydF4y2Ba).野生型和野生型rna序列分析gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗进一步支持了H2B的可忽略效应。8转录(扩展数据图)gydF4y2Ba6 b, cgydF4y2Ba).因此,我们的结果表明,与蛋白蛋白不同,蛋白蛋白以牺牲转录潜力为代价浓缩动物精子gydF4y2Ba8gydF4y2Ba, H2B。8condenses plant sperm without suppressing transcription.
一个gydF4y2Ba,火山图显示基因表达差异gydF4y2Bah2b.8gydF4y2Ba突变型和WT型精子细胞。gydF4y2BangydF4y2Ba= 12,198,在WT或gydF4y2Bah2b.8gydF4y2Ba突变体。gydF4y2BabgydF4y2Ba,描绘转录的热图(gydF4y2BazgydF4y2Ba-score)在野生动物和野生动物中对干旱胁迫的响应中表达上调基因gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗受模拟(对照)和干旱处理。gydF4y2BangydF4y2Ba= 1605。gydF4y2BacgydF4y2BaH2B的差异。8一个bundance between drought and control conditions over differentially expressed gene groups inp35区域:H2B.8-eGFPgydF4y2Ba幼苗。gydF4y2BaPgydF4y2Ba使用单侧方差分析计算值,然后进行单个双样本Tukey检验。gydF4y2BangydF4y2Ba= 711个(向下),26180个(不变)和1605个(向上)基因。gydF4y2BadgydF4y2Ba,例如显示H2B的干旱反应基因的基因组快照。8丰度(log)gydF4y2Ba2 gydF4y2Ba(IP/输入))和转录(日志gydF4y2Ba2 gydF4y2Ba(RPKM))在对照和干旱条件下对指定基因型幼苗的影响。gydF4y2BaegydF4y2Ba标记基因型生殖核和精子核中h3k9me2富集异染色质灶的定量分析。gydF4y2BaPgydF4y2Ba使用单侧方差分析计算值,然后进行单个双样本Tukey检验。标记为A和B的箱形图在两组之间差异显著(gydF4y2BaPgydF4y2Ba< 0.05),但组内无(gydF4y2BaPgydF4y2Ba> 0.1)。gydF4y2BangydF4y2Ba= 30个原子核,分别来自两个独立的实验。gydF4y2BafgydF4y2Ba, WT和h3k9me2富集异染色质病灶的定量分析gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗细胞核。gydF4y2BaPgydF4y2Ba使用独立双样本计算的值gydF4y2BatgydF4y2Ba以及。gydF4y2BangydF4y2Ba= 138和101个核gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba,分别由两个独立的实验检验。gydF4y2Ba
直接检测H2B是否。8inhibits transcriptional activation, we exposedp35区域:H2B.8-eGFPgydF4y2Ba以及野生型幼苗对干旱胁迫的转录反应。可比较的转录组变化gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba和野生型幼苗在干旱处理后的表现(图2)。gydF4y2Ba5 bgydF4y2Ba及扩展数据图gydF4y2Ba6 dgydF4y2Ba).此外,干旱处理和对照的ChIP-seqgydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗显示H2B。8is evicted from genes induced by drought, such as高度ABA-InducedgydF4y2Ba1 (HAI1)gydF4y2Ba和gydF4y2Ba还gydF4y2Ba(ref。gydF4y2Ba33gydF4y2Ba),而受干旱抑制的基因获得h2b8(无花果。gydF4y2Ba5 c, dgydF4y2Ba).这些结果表明H2B。8does not inhibit gene transcription but is instead removed by transcription. This process may underlie the localization of H2B.8 in unexpressed euchromatin.
H2B.8promotes male fertility
探讨H2B的生物学意义。8-mediated sperm condensation, we performed reciprocal crosses between theh2b.8gydF4y2Ba杂合突变体和野生型。当gydF4y2Bah2b.8gydF4y2Ba以杂合突变体为雄性,FgydF4y2Ba1gydF4y2Ba后代携带基因的可能性要低30%左右gydF4y2Bah2b.8gydF4y2Ba比野生型等位基因(gydF4y2BaPgydF4y2Ba< 0.01, Fisher确切检验;补充表gydF4y2Ba3 gydF4y2Ba).相比之下,的传播gydF4y2Bah2b.8gydF4y2Ba与野生型等位基因在雌性(gydF4y2BaPgydF4y2Ba= 0.64,费雪精确检验;补充表gydF4y2Ba3 gydF4y2Ba),证明H2B。8is important for male fertility. The fertility defect ofh2b.8gydF4y2Ba是不是由花粉萌发中断引起的gydF4y2Bah2b.8gydF4y2Ba离体花粉粒萌发率与野生型相当(补充表)gydF4y2Ba4gydF4y2Ba).这个结果与H2B的零效应是一致的。8 .转录(图2)gydF4y2Ba5 a、bgydF4y2Ba及扩展数据图gydF4y2Ba6模拟gydF4y2Ba),并表明生育缺陷最有可能是由精子核增大引起的。gydF4y2Ba
人工杂交是一个有压力的过程,雌蕊(雌性器官)稍微干燥,在比正常情况下更早的发育阶段授粉。调查是否gydF4y2Bah2b.8gydF4y2Ba在一个压力较小的交配环境中,我们研究了自花授粉产生的后代的分离率gydF4y2Bah2b.8gydF4y2Ba杂合的植物。我们观察到预期的孟德尔分离比(gydF4y2BaNgydF4y2Ba= 1462;补充表gydF4y2Ba5gydF4y2Ba),这表明gydF4y2Bah2b.8gydF4y2Ba当植物在实验室条件下进行自交受精时,突变不会影响肥力。H2B。8is transiently expressed in mature seeds (Extended Data Fig.1 dgydF4y2Ba),这个结果也证明了gydF4y2Bah2b.8gydF4y2Ba在实验室条件下不影响种子发育。总的来说,我们的观测表明H2B。8is important for sperm fertility in challenging or stressful situations, such as those created by manual crossing. This finding might be relevant to reproduction under natural environmental conditions, which are usually less favourable than standard laboratory conditions.
H2B.8decondenses heterochromatin
除了3D-SIM观察到精子中染色质的整体凝聚外,异染色质病灶也有轻微的去凝聚(图2)。gydF4y2Ba1 a, bgydF4y2Ba).了解这是否是由H2B引起的。8,we performed immunostaining using H3K9me2-specific antibodies and measured the volume of H3K9me2 foci inh2b.8gydF4y2Ba突变体核。的gydF4y2Bah2b.8gydF4y2Ba突变显著减少了精子中异染色质焦点的体积,使其降至与生殖核相似的水平(图2)。gydF4y2Ba5 egydF4y2Ba).H3K9me2异染色质病灶扩大、去致密gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗核比野生型核多(图2)。gydF4y2Ba5 fgydF4y2Ba及扩展数据图gydF4y2Ba6 egydF4y2Ba).大多数野生型细胞核显示高度浓缩的异染色质病灶,但在野生型细胞核中很少发现gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗核(扩展数据图)gydF4y2Ba6 egydF4y2Ba).大多数gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗核表现出适度分散的异染色质焦点(图2)。gydF4y2Ba5 fgydF4y2Ba及扩展数据图gydF4y2Ba6 egydF4y2Ba),让人想起精子中的那些(图2)。gydF4y2Ba1 a, bgydF4y2Ba).这一结果表明H2B。8c一个uses heterochromatin foci to decondense.
我们的数据还表明异染色质病灶的去浓缩依赖于H2B。8相分离,作为H2B的表达。8ΔIDR不影响异染色质(图2)。gydF4y2Ba5 egydF4y2Ba).异染色质焦点也是相分离凝聚物gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba34gydF4y2Ba这表明两种凝析油之间存在相互作用。的确,尽管H2B。8和heterochromatic condensates were mostly distinct, some physical associations were observed (Fig.2摄氏度gydF4y2Ba及扩展数据图gydF4y2Ba6 egydF4y2Ba).总的来说,我们的结果表明,染色质通过H2B的冷凝。8phase separation affects heterochromatin condensation, probably because H2B.8-associated AT-rich euchromatic TEs are interspersed with heterochromatic TEs in pericentromeric regions (Fig.4 dgydF4y2Ba和扩展数据图。gydF4y2Ba4gydF4y2Ba和gydF4y2Ba6 f, ggydF4y2Ba).与H2B无关的其他假设。8相分离也似是而非;例如H2B。8might directly recruit factors that interfere with heterochromatin condensation.
H2B.8increases chromosomal arm contacts
了解H2B是如何。8mediates chromatin condensation, we performed genome-wide chromosome conformation capture analysis35gydF4y2Ba(Hi-C)在异位表达H2B.8的幼苗上(gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba)和野生型对照。将Hi-C文库测序至千碱基分辨率(扩展数据图)。gydF4y2Ba7一个gydF4y2Ba),我们的野生型接触矩阵与之前发表的实验相当gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba(扩展数据图gydF4y2Ba7 bgydF4y2Ba).如前所述gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,拓扑关联域不存在gydF4y2Ba拟南芥gydF4y2Ba,但端粒经常与着丝粒相关(扩展数据图。gydF4y2Ba7 cgydF4y2Ba).gydF4y2Ba
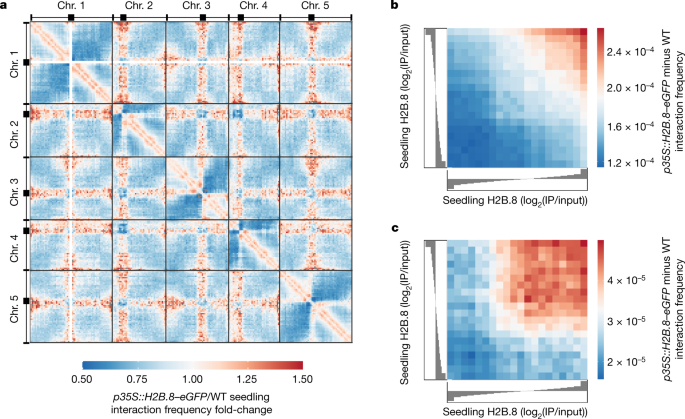
的比较gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba野生型的Hi-C数据显示了高阶染色质结构的改变。在染色体内,异位H2B。8c一个used increased short-range contacts (200 kb–1.1 Mb) (Fig.6gydF4y2Ba及扩展数据图gydF4y2Ba7 dgydF4y2Ba).短程染色体内相互作用表明染色质凝聚,这表明H2B。8主要通过集中线性近端区域形成聚集体(图2)。gydF4y2Ba6gydF4y2Ba及扩展数据图gydF4y2Ba7 dgydF4y2Ba).支持这一观点的是,近距离接触的增加与本地H2B病毒密切相关。斯皮尔曼的gydF4y2BaρgydF4y2Ba= 0.97)。gydF4y2Ba6 bgydF4y2Ba及扩展数据图gydF4y2Ba7 egydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba, WT与的全基因组相互作用频次变化热图gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba500 kb分辨率的幼苗。gydF4y2BabgydF4y2Ba,染色体内短程相互作用频率差异gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba和幼苗H2B分位数上的WT。8富集(日志)gydF4y2Ba2 gydF4y2Ba(IP /输入))。斯皮尔曼的gydF4y2BaρgydF4y2Ba= 0.974。gydF4y2BacgydF4y2Ba,远距离相互作用频率差之间gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba在H2B幼苗的分位数上,染色体臂和中心点周围区域之间的WT。8富集(日志)gydF4y2Ba2 gydF4y2Ba(IP /输入))。斯皮尔曼的gydF4y2BaρgydF4y2Ba= 0.890。gydF4y2Ba
中心周围区域(异染色质)和远端染色体臂(常染色质)之间的接触也增加gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba苗(无花果。gydF4y2Ba6gydF4y2Ba及扩展数据图gydF4y2Ba7 dgydF4y2Ba).同时,胞内粒之间的染色体间相互作用减少(图2)。gydF4y2Ba6gydF4y2Ba及扩展数据图gydF4y2Ba7 dgydF4y2Ba).这些改变与细胞学观察到的异染色质去浓缩和异染色质病灶与H2B的关联一致。8 .凝析油(图2)gydF4y2Ba2摄氏度gydF4y2Ba及扩展数据图gydF4y2Ba6 egydF4y2Ba).H2B的作用。8was local, as the interactions between pericentromeric regions and chromosomal arms increased at regions with abundant H2B.8 (Fig.6摄氏度gydF4y2Ba及扩展数据图gydF4y2Ba7 fgydF4y2Ba).这些观察结果支持了异染色质病灶分散是由H2B引起的假设。8-mediated aggregation of euchromatic TEs that are abundant in and near pericentromeric regions (Fig.4 dgydF4y2Ba和扩展数据图。gydF4y2Ba4gydF4y2Ba和gydF4y2Ba6克gydF4y2Ba).综上所述,我们的Hi-C和ChIP-seq数据表明H2B。8一个chieves a form of global chromatin condensation through the binding and aggregation of transcriptionally inactive AT-rich sequences dispersed throughout the genome.
讨论gydF4y2Ba
我们的研究结果揭示了H2B驱动染色质凝聚的机制。8诱导相分离(扩展数据图)gydF4y2Ba8gydF4y2Ba).精子核中的染色质聚集体减少gydF4y2Bah2b.8gydF4y2Ba突变体(无花果。gydF4y2Ba2 bgydF4y2Ba及扩展数据图gydF4y2Ba2摄氏度gydF4y2Ba),而异位表达H2B。8in somatic cells was sufficient to induce chromatin aggregates in an IDR-dependent manner (Fig.2摄氏度gydF4y2Ba).Hi-C和细胞学观察显示H2B。8f或ms chromatin condensates by increasing interactions between H2B.8-enriched chromosomal regions (Figs.2摄氏度gydF4y2Ba和gydF4y2Ba6 b, cgydF4y2Ba及扩展数据图gydF4y2Ba2 hgydF4y2Ba).由于H2B。8deposition within AT-rich sequences in both pericentromeric regions and chromosomal arms (Fig.4 dgydF4y2Ba和扩展数据图。gydF4y2Ba4gydF4y2Ba和gydF4y2Ba6克gydF4y2Ba),广泛的染色体区域通过相分离浓缩。在间期体细胞中,常染色质占据了细胞核的大部分体积gydF4y2Ba41gydF4y2Ba.因为H2B。8is abundant in euchromatin, H2B.8-induced chromatin condensation is highly effective at condensing nuclei (Fig.2 a, dgydF4y2Ba).gydF4y2Ba
尽管它有效,H2B。8compacts nuclei without compromising transcription (Fig.5 a、bgydF4y2Ba).对于有游动精子的物种来说,精子头的大小至关重要gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2 gydF4y2Ba,gydF4y2Ba9gydF4y2Ba在美国,DNA凝聚可能是最重要的,转录可能是次要的。蛋白蛋白可以极大地浓缩DNA,除了被子植物(开花植物)和裸子植物外,在大多数多细胞真核生物的精子中都发现了蛋白蛋白。gydF4y2Ba3gydF4y2Ba).这包括苔藓植物和蕨类植物,这两种植物都有活动的精子,并使用蛋白蛋白来凝结精子gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba19gydF4y2Ba(无花果。gydF4y2Ba3gydF4y2Ba).相比之下,H2B。8is specific to flowering plants. Flowering plants have immotile sperm and may benefit from a less extreme approach that condenses nuclei without limiting transcription. This moderate level of condensation is still important for fertility, ash2b.8gydF4y2Ba突变可显著减少男性传播(补充表)gydF4y2Ba3 gydF4y2Ba).精子转录(图2)gydF4y2Ba5gydF4y2Ba及扩展数据图gydF4y2Ba6gydF4y2Ba)和离体花粉萌发(补充表)gydF4y2Ba4gydF4y2Ba)不受gydF4y2Bah2b.8gydF4y2Ba突变,生育能力下降可能是由于精子核增大引起的。我们推测,受精发生在深嵌在被子植物母体组织中的胚珠上,可能有利于较小的精子核。与这一观点相一致的是,裸子植物有暴露的胚珠,产生的精子具有未凝聚的核gydF4y2Ba11gydF4y2Ba缺少h2b(无花果。gydF4y2Ba3gydF4y2Ba).因此,H2B。8is an evolutionary innovation of angiosperms that achieves a moderate level of chromatin condensation that is compatible with active transcription.
方法gydF4y2Ba
植物生长条件gydF4y2Ba
一个。gydF4y2Ba芥gydF4y2Ba本研究中使用的植物(Col-0生态型)在22°C和70%湿度的长白天(16 h光照,8 h黑暗)条件下生长。在相同条件下,幼苗在无葡萄糖的萌发培养基上生长。gydF4y2Ba
CRISPR-Cas9突变体的产生gydF4y2Ba
的突变等位基因gydF4y2BaH2B.8gydF4y2Ba是使用CRISPR-Cas9技术生成的吗gydF4y2Ba42gydF4y2Ba.四种单导rna (sgRNAs);补充表gydF4y2Ba6克ydF4y2Ba)使用CHOPCHOP (v.3)设计。gydF4y2Ba43gydF4y2Ba并使用金门系统进行克隆gydF4y2Ba42gydF4y2Ba.构念被转化为gydF4y2Ba根癌土壤杆菌gydF4y2Ba菌株GV3101使用花浸渍野生型(WT) Col-0gydF4y2Ba一个。gydF4y2Ba芥gydF4y2Ba44gydF4y2Ba.通过Sanger测序筛选转化子。选择的细胞系被带到下一代,产生不含Cas9的纯合突变体。行gydF4y2Bah2b.8-1gydF4y2Ba用dCAPS和EcoNI进行基因分型,而gydF4y2Bah2b.8-2gydF4y2Ba经PCR分型(补充表gydF4y2Ba6克ydF4y2Ba).gydF4y2Ba
向量克隆gydF4y2Ba
对于H2B。8reporter constructs (pH2B.8: H2B.8-eGFPgydF4y2Ba和gydF4y2BapH2B.8: H2B.8-MycgydF4y2Ba),上游约2 kbgydF4y2BaH2B.8gydF4y2Ba克隆为启动子和gydF4y2BaH2B.8gydF4y2Ba扩增gDNA序列(补充表)gydF4y2Ba6克ydF4y2Ba).使用多位点网关技术(Thermo Fisher Scientific), PCR产物分别连接到P4P1r和pDONR207上。将序列组装到表达载体pK7m34GW上,并在P2rP3中添加羧基末端eGFP或3× Myc标签。异位H2B。8expression vector (p35区域:H2B.8-eGFPgydF4y2Ba)以相同的方式生成,但使用gydF4y2Ba35个年代gydF4y2Ba启动子。gydF4y2Ba
原生和异位H2B。8ΔIDR expression constructs (pH2B.8: H2B.8ΔIDR-YFPgydF4y2Ba和gydF4y2Bap35区域:H2B.8ΔIDR-YFPgydF4y2Ba,分别)通过重叠PCR去除IDR序列产生,而异位H2B.2(gydF4y2Bap35区域:H2B.2-YFPgydF4y2Ba)克隆自gDNA(补充表)gydF4y2Ba6克ydF4y2Ba).将产物连接到含有基因的pCAMBIA1300载体骨架上gydF4y2Ba35个年代gydF4y2Ba启动子和c端eGFP/YFP使用In-Fusion克隆系统(Takara Bio)。gydF4y2Ba
的gydF4y2BapH2B.8: H2B.8-N234K-MycgydF4y2Ba通过重叠PCR生成构建物(补充表)gydF4y2Ba6克ydF4y2Ba),连接到pDONR207,随后结合到pDONR207gydF4y2BaH2B.8gydF4y2Ba使用MultiSite Gateway Technology (Thermo Fisher Scientific)在pK7m34GW表达载体中添加启动子和c端3x Myc标签。gydF4y2Ba
为gydF4y2Bap35区域:H2B.8-scrambledIDR-eGFPgydF4y2Ba,gydF4y2Bap35区域:H2B.8-EWSR1-IDR-eGFPgydF4y2Ba和gydF4y2Bap35区域:H2B.8-TAF15-IDR-eGFPgydF4y2Ba构建后的乱序didr(由Python 3.9随机打乱IDR的氨基酸序列:DEVIQDISANPPVLENEPVTPSEPTVQEDTRECIETPEETPISVPEGEATPETKVQGDNSDFSSQTRTVDLKEVPSVPPREGTPPTPVVDDVE);EWSR1-IDRgydF4y2Ba31gydF4y2Ba(astdystysqaaaqqgysaytaqptqgygyttqayttqqqptdvsytqqqtayatsyggppgptptptppvqgygtgaydttttgqasyaqsaygqqpaypaygqqqpaataptrppgptpttsqpptsgpssydqssysyqqqqsysygqqpptsyppqtgsysqapsqysqqsssygqqqqfrqdhpssmgvygq)和TAF15-IDRgydF4y2Ba31gydF4y2Ba(sdsgsygqsggeqqsystemygnpgsqgygqasqsysgygqttdssygqnysgsygqsqsgysqsyggyqqkssysqqpynnqgqqqnmessgsqggrapsydqpdygqqdqqsgydqhqgsydeqsnydqqhdsysqnqqsyhsq)序列分别通过gydF4y2Ba拟南芥gydF4y2Ba密码子的使用和合成。然后将合成的碎片融合gydF4y2BaH2B.8gydF4y2Ba(补充表gydF4y2Ba6克ydF4y2Ba).插入克隆到pCAMBIA1300载体,其中包含gydF4y2Ba35个年代gydF4y2Ba启动子和c端eGFP。gydF4y2Ba
将上述向量变换为gydF4y2Bah2b.8-1gydF4y2BaT突变体gydF4y2Ba3 gydF4y2Ba代或WT植物。单插入转基因株系gydF4y2Ba3 gydF4y2Ba或TgydF4y2Ba4gydF4y2Ba在本研究中使用了代,并且在每个实验中至少包括两个独立的转基因系。gydF4y2Ba
精子、营养体和叶核总蛋白提取gydF4y2Ba
如前所述,使用BD FACSMelody细胞分选器(BD Biosciences),用FACS分离精子和营养细胞核(每种细胞类型分离两个重复)gydF4y2Ba45gydF4y2Ba(补充图。gydF4y2Ba2gydF4y2Ba).每个重复共收集200万个分选细胞核(从大约40 ml开放花中分离),加入0.45体积的3.2倍裂解缓冲液(10% SDS, 100 mM TEAB, pH 7.55)。细胞核在95℃裂解5分钟,然后在13000℃离心gydF4y2BaggydF4y2Ba在室温下静置8分钟。裂解液被放入一个新管中。加入十分之一体积的12%磷酸,用移液混合。然后,加入6倍体积的S-Trap缓冲液(90%水溶液MeOH, 100 mM TEAB, pH 7.1),通过移液混合。在4000℃下离心,将蛋白装载到S-Trap Micro柱(Protifi)上gydF4y2BaggydF4y2Ba30岁。用150µl S-Trap缓冲液洗涤三次。蛋白在柱上用4µg胰蛋白酶在50 mM TEAB中于47°C下消化1 h。多肽经离心顺序洗脱(4000gydF4y2BaggydF4y2Ba50 mM TEAB 40µl, 0.2%甲酸40µl, 50%乙腈和0.2%甲酸35µl。gydF4y2Ba
液相色谱-质谱法gydF4y2Ba
洗脱后的肽溶液干燥,将肽溶解于0.1%三氟乙酸和3%乙腈中,进行液相色谱-串联质谱(LC-MS /MS)分析。精子和营养细胞核样品在Orbitrap融合三重质谱联用的UltiMate 3000 rslnano LC系统(Thermo Fisher Scientific)上进行纳米LC - MS/MS分析。样品以0.1%三氟乙酸为前柱,以20µl min的速度装载和捕获gydF4y2Ba1gydF4y2Ba3分钟。然后将捕集柱与分析柱(nanoEase M/Z柱,HSS C18 T3, 100 Å, 1.8µM, Waters)同步切换,使用溶剂A(水,0.05%甲酸)和溶剂B(80%乙腈,0.05%甲酸)的长梯度进行分离,流速为0.3µl mingydF4y2Ba1gydF4y2Ba: 0-3分钟3% B(仅限疏水阀);3-14 min线性增加B至13%;14-113 min, B值提高到39%;113-123 min增加B至55%;然后上升到99% B,再平衡到3% B。gydF4y2Ba
数据是在正离子模式下通过以下质谱仪设置获得的。MS1/OT:分辨率120k,剖面模式,质量范围gydF4y2Bam / zgydF4y2Ba300 - 1800,自动控粒4egydF4y2Ba5gydF4y2Ba填充时间为50毫秒。MS2/IT,采用高能碰撞解离碎片化进行数据依赖分析,参数为:IT快速top30,质心模式,隔离窗口为1.6 Da,电荷状态为2-5,阈值为1.9egydF4y2Ba4gydF4y2Ba,碰撞能量30,自动增益控制目标1.9egydF4y2Ba4gydF4y2Ba,最大注射时间35 ms,动态排除1计数,排除15 s,排除质量窗口为±5 ppm。gydF4y2Ba
对于精子和营养核蛋白质组,使用MaxQuant (v.1.6.1.0)生成重新校准的峰列表。gydF4y2Ba46gydF4y2Ba使用TAIR10_pep_20101214进行无标记定量gydF4y2Ba拟南芥gydF4y2Ba蛋白质序列数据库(TAIR, 35386个条目)和MaxQuant污染物数据库(245个条目)。MaxQuant提供的无标签定量结果和默认参数与同一数据库上内部Mascot Server 2.4.1 (Matrix Science)的搜索结果一起使用。对于所有搜索,前体公差为6 ppm,片段公差为0.6 Da。该酶设置为胰蛋白酶/P,最多允许遗漏2条裂解,氧化(M)和乙酰化(蛋白n项)被设置为可变修饰,氨基甲基化(C)被设置为固定修饰。将检索结果输入到Scaffold 4 (Proteome Software)中,蛋白质的识别概率为99%,肽的识别概率为95%。gydF4y2Ba
组蛋白排列和疾病预测gydF4y2Ba
组蛋白DNA和蛋白序列比对使用CLC Main Workbench软件(v.8.1;试剂盒)。使用PONDR对内在障碍进行预测gydF4y2Ba47gydF4y2Ba使用VL-XT算法。原始数据使用R (v.3.6.0)中的ggplot2绘制。gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba.gydF4y2Ba
组蛋白H2B系统发育分析gydF4y2Ba
从Phytozome下载植物H2B蛋白序列gydF4y2Ba50gydF4y2Ba, CongeniegydF4y2Ba51gydF4y2Ba、睡莲塘gydF4y2Ba52gydF4y2Ba, Magnoliid基因组gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba和UniProtgydF4y2Ba55gydF4y2Ba.人类和酵母H2B序列从UniProt获得,并作为系统发育的外群。gydF4y2Ba
序列被导入到MEGA-XgydF4y2Ba56gydF4y2Ba并使用带有默认参数的MUSCLE进行对齐。系统发育是使用邻居连接测试生成的,应用泊松模型,并允许统一的替代率。H2B.8homologues were identified owing to the distinct branch formed, separate from canonical H2B variants. Several representative H2B.8 homologues were searched using BLAST57gydF4y2Ba查询这些同源物是否为开花植物所特有。H2B.8homologues are presented in Supplementary Table1gydF4y2Ba.gydF4y2Ba
共聚焦显微镜和分析gydF4y2Ba
如前所述分离出小孢子和花粉gydF4y2Ba45gydF4y2Ba用Hoechst 33342染色,用徕卡SP8X共聚焦显微镜检查。幼胚被解剖gydF4y2Ba58gydF4y2Ba用碘化丙啶染色成像。用体视显微镜从干种子中分离成熟胚。成熟胚胎和幼苗(包括根)用0.1% Triton X-100和0.5µg ml在PBS中染色gydF4y2Ba1gydF4y2Ba显微镜检查前DAPI 5-10分钟(Zeiss 880, airscan模式)。如前所述,用2周大的幼苗进行免疫荧光gydF4y2Ba18gydF4y2Ba.gydF4y2Ba
利用ImageJ中的半自动流水线,从dapi染色的全花粉共聚焦图像中定量精子核大小。gydF4y2Ba59gydF4y2Ba.简单地说,使用自动阈值获得核,然后使用高斯模糊处理平滑边缘。重复自动阈值,然后使用魔杖工具选择细胞核。然后测量核面积(μm)gydF4y2Ba2 gydF4y2Ba).分析的体细胞核为根尖伸长区的维管柱细胞。选择这样的细胞核是因为能够准确地识别组织内的细胞类型。使用ImageJ,gydF4y2BaZgydF4y2Ba-堆在根尖内分成不同细胞层的子堆。然后获得最大强度投影,以解释核深度的细微差异。图像分析采用与精核相同的半自动化方法。R进行统计分析;我们使用方差分析和Tukey事后检验进行两两比较。gydF4y2Ba
病灶在WT和gydF4y2Bah2b.8gydF4y2Ba使用ImageJ插件FociPicker3DgydF4y2Ba60gydF4y2Ba.gydF4y2Ba
对于DAPI和H2B。8colocalization (pH2B.8: H2B.8-eGFPgydF4y2Ba和gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba),使用3D ImageJ Suite工具进行Otsu阈值分割gydF4y2Ba61gydF4y2Ba.在每个分割的细胞核中提取DAPI和GFP通道的荧光强度测量。计算20 × 20体素区域的平均值。每个体积值通过除以整个相应核的DAPI或GFP强度之和进行归一化。根据GFP值将区域分为八个分位数,并根据DAPI强度绘制。gydF4y2Ba
H3K9me2疫源地的分类如前所述gydF4y2Ba18gydF4y2Ba.H2B.8-mediated chromatin aggregates were classified in the same way.
量化H2B的大小和数量。8一个ggregates and H3K9me2 domains, we used the 3D ImageJ Suite tools61gydF4y2Ba.在每个荧光通道中,我们使用Otsu阈值进行三维核分割gydF4y2Ba61gydF4y2Ba.使用ggplot2在R中绘制段的数量和体积。gydF4y2Ba
3D-SIM和分析gydF4y2Ba
如前所述,从花粉(从大约1ml的花中收集)中分离精子和营养核gydF4y2Ba45gydF4y2Ba用200 μl Galbraith缓冲液(45 mM MgCl)重悬gydF4y2Ba2 gydF4y2Ba, 30 mM柠檬酸钠,20 mM MOPS和0.1% Triton X-100, pH 7.0)。对于生殖核,人工从花蕾中分离双细胞花粉,并通过DAPI染色和荧光显微镜单独分期。在裂解缓冲液(15 mM Tris-HCl pH 7.5, 2 mM EDTA, 0.5 mM精胺,80 mM KCl, 20 mM NaCl和0.1% Triton X-100)中,用剃须刀片切碎提取细胞核。将悬浮液通过35 μm过滤器(康宁)过滤到1.7 ml管中。核在500时成球gydF4y2BaggydF4y2Ba在200 μl裂解缓冲液中重悬3min。gydF4y2Ba
细胞核在4%无甲基甲醛(Thermo Scientific)溶液中固定5分钟。HiQA号1.5H盖片(CellPath)用10%盐酸洗涤30分钟,然后在H中洗涤三次gydF4y2Ba2 gydF4y2BaO静置5分钟以去除杂质。固定的核在500度时旋转到盖上gydF4y2BaggydF4y2Ba用Shandon Cytospin 2酶孵育3分钟。用4%无甲基甲醛对细胞核进行印迹,重复固定5分钟。除去固定液,盖片在PBS中洗涤三次,每次洗涤5分钟。细胞核在加0.1% Tween-20 (PBST)的PBS中用3% BSA阻断30分钟。如果进行免疫染色,抗体在3% BSA的PBST中稀释200倍,然后在盖片上印迹到细胞核上。抗体孵育在4°C下过夜。用PBST洗涤3次,去除一抗5min。二抗与一抗类似稀释,然后加入细胞核。在室温加湿室中培养1小时。如果不进行免疫染色,该方案此时恢复。 PBST washes were repeated as before. Nuclei were stained in the dark with either DAPI or SYBR Green (Invitrogen) at 2 mg μl1gydF4y2Ba或100倍稀释,分别稀释5分钟。DNA染色用H洗涤去除gydF4y2Ba2 gydF4y2Ba5分钟。用13 μl Vectashield H-1000贴载介质将盖片粘附于载玻片上。在蔡司Elyra PS.1超分辨率显微镜上使用×63油浸透镜对细胞核进行成像。gydF4y2Ba
使用蔡司Zen Black软件对SIM进行三维重建。使用ImageJ的交互式3D表面绘图插件获取与图像相关的强度轮廓gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba.gydF4y2Ba
从WT和中获取体素强度gydF4y2Bah2b.8gydF4y2Ba用Otsu阈值法对精子、细胞核进行分割,提取个体素。荧光强度通过除以总核强度归一化。用ggplot2在R中绘制入盒体素强度的密度。gydF4y2Ba
组蛋白纯化gydF4y2Ba大肠杆菌gydF4y2Ba
序列gydF4y2Ba一个。gydF4y2Ba芥gydF4y2Ba组蛋白H2B。8, H2B。8ΔIDR, H2B.8-scrambledIDR, H2B.2, H2A, H3, H3 mutant K9CC110A and H4 were codon optimized for protein expression inE。gydF4y2Ba杆菌gydF4y2Ba将(Genewiz)合成为pET30a+载体,带不可切割的c端8x his -标签,然后转化为gydF4y2BaE。gydF4y2Ba杆菌gydF4y2Ba菌株BL21和纯化如前所述gydF4y2Ba64gydF4y2Ba.简而言之,在LB培养基中,30 μg ml, 37℃条件下,细胞生长至光密度0.5-0.6gydF4y2Ba1gydF4y2Ba卡那霉素。加入0.5 mM异丙基-β-d-硫代半乳糖苷诱导组蛋白表达,37℃孵育4 h。每分钟4000转离心收集细胞。30min后用1x PBS重悬。重复离心,细胞重悬于洗涤缓冲液(50 mM Tris-HCl pH 7.5, 100 mM NaCl, 1 mM EDTA和5 mM 2-巯基乙醇)中。超声裂解细胞,并在18000 r.p.m.下粉碎碎片。20分钟。丢弃上清,用洗涤缓冲液和1% Triton X-100重悬颗粒。样品被超声处理,然后用洗涤缓冲液再洗涤两次。然后用展开缓冲液(20 mM Tris-HCl pH 7.5, 7 M盐酸胍和5 mM 2-巯基乙醇)重悬颗粒,在室温下混合1.5 h,使颗粒完全溶解。 The sample was centrifuged at 18,000 r.p.m. for 30 min. The supernatant was flash-frozen in liquid nitrogen and then stored at −80 °C.
组蛋白八聚体和核小体重构gydF4y2Ba
widom601序列12x177bp的DNA模板按照前面的描述进行克隆和纯化gydF4y2Ba65gydF4y2Ba.177bp DNA序列序列如下:gydF4y2Ba
5 ' -GAGCATCCGGATCCCCTGGAGAATCCCGGTGCCGAGGCCGCTCAATTGGTCGTAGACAGCTCTAGCACCGCTTAAACGCACGTACGCGCTGTCCCCCGCGTTTTAACCGCCAAGGGGATTACTCCCTAGTCTCCAGGCACGTGTCACATATATACATCCTGTTCCAGTGCCGGACCC-3 'gydF4y2Ba
各自的组蛋白八聚体如前所述重建gydF4y2Ba64gydF4y2Ba.简单地说,将等量的四种组蛋白加入到展开缓冲液(20 mM Tris-HCl pH 7.5, 7 M胍HCl和5 mM B-ME)中,然后透析到折叠缓冲液(2 M NaCl, 10 mM Tris-HCl pH 7.5, 1 mM EDTA和5 mM 2-巯基乙醇)中,然后使用Superdex 200柱(Cytiva)进行纯化。gydF4y2Ba
如前所述,核小体使用盐透析方法组装gydF4y2Ba64gydF4y2Ba.组蛋白八聚体和DNA模板在TEN缓冲液(10 mM Tris-HCl pH 7.5, 1 mM EDTA和2 M NaCl)中混合,在TEN缓冲液中4°C透析16-18 h,在TE缓冲液(10 mM Tris-HCl pH 7.5, 1 mM EDTA)中缓慢泵送持续稀释,使NaCl浓度从2降低到0.6 M。样品在HE缓冲液(10 mM HEPES pH 7.5, 0.1 mM EDTA)中透析4小时后收集。在低浓度(2.5 μg DNA和相应的八聚体在50 μl重构体系中)下组装核小体阵列以评估其质量,并用FEI Tecnai G2 Spirit 120 kV透射电镜检测组蛋白八聚体与DNA模板的化学计量。gydF4y2Ba
Alexa Fluor 594 H3 K9CC110A标记和标记核小体重构gydF4y2Ba
将1.5 M过量的Alexa Fluor 594 (AF594)- c5 -马来酰亚胺(Invitrogen)添加到组蛋白展开缓冲液中,然后在室温下黑暗孵育4小时,对组蛋白H3 K9CC110A进行荧光标记。通过添加10 mM DTT来淬灭偶联反应,通过Superdex 200 Increase 10/300柱(Cytiva)在打开缓冲液中流动af594标记的组蛋白H3来去除游离荧光团。然后将荧光标记的H3与相应的组蛋白结合在展开缓冲液中进行如上所述的组蛋白八聚体重建。组蛋白H3突变体C110A不影响核小体结构或定位gydF4y2Ba66gydF4y2BaH3突变体K9CC110A通常用于将甲基赖氨酸类似物安装在半胱氨酸上,其功能与天然对应物相似gydF4y2Ba67gydF4y2Ba,gydF4y2Ba68gydF4y2Ba.重组前将荧光标记和未标记的组蛋白八聚体按1:100的比例组合,以减少荧光标记过程中对样品的潜在影响gydF4y2Ba27gydF4y2Ba.gydF4y2Ba
体外染色质凝析物形成gydF4y2Ba
体外相分离实验如前所述进行gydF4y2Ba27gydF4y2Ba.简单地说,实验记录在384孔玻璃底板(Cellvis)上,并用光学透明胶膜密封。使用前,384孔板用5K mpeg -硅烷聚乙二醇化,用BSA钝化。核小体阵列样品首先在染色质稀释缓冲液(25 mM Tris)中平衡gydF4y2Ba⋅gydF4y2BaOAc, pH 7.5, 5 mM DTT, 0.1 mM EDTA, 0.1 mg mlgydF4y2Ba1gydF4y2BaBSA, 5% (w/v)甘油),室温孵育5分钟。然后将核小体阵列样品添加到1体积的染色质稀释缓冲液中,其中存在盐(KOAc和/或Mg(OAc))。gydF4y2Ba2 gydF4y2Ba),并转移到聚乙二醇化和bsa钝化的384孔板上,室温孵育30分钟。加入染色质稀释缓冲液后,用YOYO-1碘化物(491/509)(Invitrogen)对核小体阵列内的双链DNA进行染色。gydF4y2Ba
体外FRAP和液滴融合gydF4y2Ba
使用配备×100油浸物镜的NIKON A1共聚焦显微镜,在上述条件下形成染色质凝聚物后,进行体外FRAP和液滴融合实验。用561 nm激光脉冲(重复2次,强度20%,停留时间1 s)对液滴进行漂白。漂白后的强度归一化到漂白前的水平,以获得恢复的措施。使用NIS-Elements AR Analysis软件进行图像分析。gydF4y2Ba
烟草中的瞬时表达gydF4y2Ba
向量(gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba,gydF4y2Bap35区域:H2B.8-scrambledIDR-eGFPgydF4y2Ba,gydF4y2Bap35区域:H2B.8-EWSR1-IDR-eGFPgydF4y2Ba和gydF4y2Bap35区域:H2B.8-TAF15-IDR-eGFPgydF4y2Ba)变成了gydF4y2Ba烟草benthamianagydF4y2Ba通过gydF4y2Ba农杆菌属gydF4y2Ba感染短暂表达。注射后2 d,分离叶表皮,用含有0.2% (v/v) Triton X-100的DAPI溶液进行染色。使用徕卡SP8X共聚焦显微镜获得图像。gydF4y2Ba
干旱胁迫处理gydF4y2Ba
10天大的WT和gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba收集幼苗(每个处理两个重复),在50% (w/v) PEG6000 1x PBS(干旱处理)或1x PBS(对照)中孵育3 h。gydF4y2Ba
组蛋白提取用于免疫印迹gydF4y2Ba
叶组织(0.5 g)在液氮中研磨,悬浮在4ml组蛋白提取缓冲液中(10 mM Tris-HCl pH 7.5, 2 mM EDTA, 0.25 M HCl, 5 mM DTT和1倍蛋白酶抑制剂鸡尾酒(罗氏))。悬浮液通过一层奇迹棉(默克密理博)过滤,并在4000转/分离心。在4°C下放置10分钟。将上清转移到新鲜试管中,与1.75 ml三氯乙酸溶液(T0699, Sigma)混合。沉淀物在4000转/分的转速下离心收集。在4°C下放置20分钟,然后用1ml丙酮洗涤两次。将颗粒风干后,用1倍LDS样品缓冲液(NP0007, Invitrogen)孵育过夜。样品在95°C下变性10分钟。对于精子,FACS对500万个精子核进行了分类(补充图)。gydF4y2Ba2gydF4y2Ba).精子核在1200度离心gydF4y2BaggydF4y2Ba在4°C下放置5分钟。用1 ml组蛋白提取缓冲液重悬核球,加入0.25 ml三氯乙酸溶液混合。组蛋白的沉淀和洗脱方法与叶片相同。抗h3k9me2抗体(Abcam, ab1220)稀释1:50 000,进行免疫印迹。gydF4y2Ba
花粉和幼苗原生ChIP-seq文库制备、测序和分析gydF4y2Ba
约0.5 g 10日龄幼苗(每种基因型2个重复)用杵臼在液氮中研磨,并在核分离缓冲液(0.25 M蔗糖,15 mM PIPES pH 6.8, 5 mM MgCl)中均质gydF4y2Ba2 gydF4y2Ba, 60mm KCl, 15mm NaCl, 1mm CaClgydF4y2Ba2 gydF4y2Ba, 0.9% Triton X-100, 1 mM PMSF和1×蛋白酶抑制剂鸡尾酒(罗氏)),15分钟。通过两层miracle loth(默克密理博)过滤,将细胞核从碎片中分离出来。对于花粉核,我们收集了大约20毫升的开放花和在Galbraith缓冲液中分离的花粉(每个基因型分离两个重复)。在200µl的隔核缓冲液中,用玻璃珠将花粉顶点化,于2000 r.p.m.释放细胞核。3分钟。匀浆依次通过40µm和10µm细胞滤网过滤得到细胞核。为了最大限度地恢复细胞核,在再次进行过滤步骤之前,留在过滤器上的未破碎的花粉粒被回收到玻璃珠中并与核隔离缓冲液涡流。gydF4y2Ba
从幼苗或花粉中分离出悬浮核,在4000℃离心gydF4y2BaggydF4y2Ba在TM2 (50 mM Tris-HCl, 2 mM MgCl)中重悬10分钟gydF4y2Ba2 gydF4y2Ba0.25 M蔗糖,1 mM PMSF和1×蛋白酶抑制剂混合物)。在4000℃冷离心后gydF4y2BaggydF4y2Ba细胞核在MNase消化缓冲液(50 mM Tris-HCl pH 7.5, 5 mM CaCl)中重悬5mingydF4y2Ba2 gydF4y2Ba, 0.25 M蔗糖,1 mM PMSF和1×蛋白酶抑制剂混合物)与适量的MNase (New England Biolabs),在37℃下孵育10分钟。加入EDTA至终浓度为25 mM,停止消化。加入十分之一体积的1% Triton X-100和1%脱氧胆酸钠,将样品放在冰上15分钟。然后,加入低盐缓冲液(50 mM Tris-HCl pH 7.5, 10 mM EDTA, 150 mM NaCl, 0.1% Triton X-100, 1 mM PMSF和1×蛋白酶抑制剂混合物)稀释反应,并在4℃下旋转1小时。离心后,上清液与预洗GFP-Trap珠(Chromotek)在4°C下过夜进行免疫沉淀。用低盐缓冲液和高盐缓冲液(50 mM Tris-HCl pH 7.5, 10 mM EDTA, 300 mM NaCl, 0.1% Triton X-100和1 mM PMSF)分别洗涤2次,并用0.1 M NaHCO洗脱gydF4y2Ba3 gydF4y2Ba和1% SDS),在65°C下摇15分钟。洗脱液经蛋白酶K和rna酶A消化后提取苯酚-氯仿DNA。文库采用Ovation Ultralow System V2制备,并在NextSeq 500 (Illumina)上测序,测序结果为2× 38 bp。gydF4y2Ba
测序reads用Bowtie 2映射到TAIR10 (v.2.3.4.1)gydF4y2Ba69gydF4y2Ba保留单核体碎片。使用Samtools-1.7 rmdup删除重复读取。Bigwig文件通过使用deepTools (v.3.1.1)将IP bam文件规范化到各自的输入来生成。gydF4y2Ba70gydF4y2Ba.每个实验的2个重复被证实是高度相关的;单个重复用于下游分析。配置文件使用IGV (v.2.6.2)可视化。gydF4y2Ba71gydF4y2Ba.gydF4y2Ba
元图和热图背后的数据是用deepTools生成的,并用R中的自定义脚本绘制。gydF4y2Ba
通过幼苗H3K9me2富集(log)来定义TE类gydF4y2Ba2 gydF4y2Ba(免疫沉淀反应/输入))。考虑到H3K9me2在TEs富集的双峰分布,选择0.7作为异色(>0.7)和常色(<0.7)类的截止值。gydF4y2Ba
为了产生峰值,H2B。8或H2B。8ΔIDR enrichment was calculated over 50-bp windows and those with >1.2 log2 gydF4y2Ba(IP/input)保留。使用BEDtools (v.2.28.0)合并150 bp内的WindowsgydF4y2Ba72gydF4y2Ba.区域按大小进行过滤,将<200 bp的区域从分析中删除。H2B.8enrichment was then calculated over the new regions, and those with <1.2 log2 gydF4y2Ba(IP/input)被丢弃。其余区域定义为H2B。8的山峰。gydF4y2Ba
对于基因组覆盖,峰值被划分为50 bp的窗口,并根据重叠划分为基因、TE或基因间组。利用BEDtools确定火山地块与基因和TEs的重叠;25%的特征被一个被定义为重叠的峰值所覆盖。gydF4y2Ba
下载数据gydF4y2Ba73gydF4y2Ba,gydF4y2Ba74gydF4y2Ba,gydF4y2Ba75gydF4y2Ba,gydF4y2Ba76gydF4y2Ba,gydF4y2Ba77gydF4y2Ba,gydF4y2Ba78gydF4y2Ba,gydF4y2Ba79gydF4y2Ba,gydF4y2Ba80gydF4y2Ba以同样的方式进行映射和处理。使用deepTools计算分类基因组区域的PCA、Spearman和Pearson相关性,并使用ggplot2绘制R。gydF4y2Ba
Bisulfite-seq分析gydF4y2Ba
下载的测序读数gydF4y2Ba81gydF4y2Ba使用TrimGalore (v.0.4.1) (gydF4y2Bahttps://github.com/FelixKrueger/TrimGaloregydF4y2Ba),使用默认参数。使用Bismark (v.0.22.2)将读取映射到TAIR10。gydF4y2Ba82gydF4y2Ba,甲基化使用MethylDackel (v.0.5.2) (gydF4y2Bahttps://github.com/dpryan79/MethylDackelgydF4y2Ba),选择——CHG和——CHH选项。在PCA中使用CG甲基化数据。gydF4y2Ba
精子细胞和幼苗RNA-seq文库制备、测序和分析gydF4y2Ba
如前所述,用流式细胞仪分离精细胞gydF4y2Ba83gydF4y2Ba,每个基因型分离两个重复(补充图2)。gydF4y2Ba2 bgydF4y2Ba).使用Direct-zol RNA Microprep试剂盒从每个重复的100万个精子细胞(从大约100毫升开放的花中分离)中提取RNA。使用Plant RNeasy Mini试剂盒从10日龄的幼苗中提取RNA(在正常或干旱/模拟处理条件下,每种基因型分别使用3或2个重复的幼苗)。使用通用RNA-Seq文库制备试剂盒制备文库,并在NextSeq 500 (Illumina)上测序,测序结果为单端(76 bp)或成对端(2× 38 bp)。gydF4y2Ba
测序reads用TopHat (v.2.0.10)映射到TAIR10gydF4y2Ba84gydF4y2Ba.Kallisto (v.0.43.0)gydF4y2Ba85gydF4y2Ba和侦探——(v.0.30.0)gydF4y2Ba86gydF4y2Ba用于获得每百万份成绩单(TPM)值和gydF4y2Ba问gydF4y2Ba值,分别。用| log鉴定差异表达基因和TEsgydF4y2Ba2 gydF4y2Ba(TPM fold-change) |≥2(≥1表示调用干旱响应基因)gydF4y2Ba问gydF4y2Ba< 0.05。火山图是用自定义的ggplot2 R脚本生成的。使用R中的ggplot2生成热图,使用som包将转录变化归一化。gydF4y2Ba
下载数据gydF4y2Ba87gydF4y2Ba,gydF4y2Ba88gydF4y2Ba,gydF4y2Ba89gydF4y2Ba映射,并以相同的方式获得TPM值。gydF4y2Ba
多元线性回归模型gydF4y2Ba
基因组被划分为200 bp的窗口,用于计算每个变量的丰度。对于ChIP-seq数据,请记录日志gydF4y2Ba2 gydF4y2Ba使用deeptools中的multiBigwigSummary计算每个窗口的IP/input。对于亚硫酸酯-序列数据,计算CG甲基化的方法是使用窗口内CG环境中测序的Cs的数量除以CG环境中(C+T)的数量(没有CG位点或对齐的测序读数的窗口被删除)。对于RNA-seq数据,记录日志gydF4y2Ba10gydF4y2Ba(每千碱基的转录本每百万映射读取(RPKM))计算每个窗口。gydF4y2Ba
在R中使用lm函数生成多元线性回归模型。对于每个变量,拟合线性模型来预测H2B。8 .浓缩和调整gydF4y2BaRgydF4y2Ba2 gydF4y2Ba值见补充表gydF4y2Ba2 gydF4y2Ba.逐步向模型中加入变量,通过计算调整值来检验调整后模型的预测能力gydF4y2BaRgydF4y2Ba2 gydF4y2Ba和赤池信息标准分数在R(扩展数据图)。gydF4y2Ba4 fgydF4y2Ba).使用基因组区域的分类变量建立了一个单独的模型来评估H2B之间的关联。8和基因组特征(调整)gydF4y2BaRgydF4y2Ba2 gydF4y2Ba模型的值见补充表gydF4y2Ba2 gydF4y2Ba).gydF4y2Ba
Hi-C文库制备,测序和分析gydF4y2Ba
收集2个10日龄幼苗(1-3 g),用20 ml 2%甲醛溶液在室温下真空固定15 min,然后加入2.162 ml 2.5 M甘氨酸淬灭。固定苗组织用水冲洗三次,用纸巾擦干。gydF4y2Ba
在液氮中研磨释放细胞核,然后用25 ml萃取缓冲液I (0.4 M蔗糖,10 mM Tris-HCl pH 8, 10 mM MgCl)重悬gydF4y2Ba2 gydF4y2Ba5 mM β-巯基乙醇,0.1 mM PMSF和13 μl蛋白酶抑制剂)。细胞核通过奇迹般滤布(Calbiochem)过滤,然后以每分钟4000转的速度离心。在4°C下放置20分钟。丢弃上清,用1 ml萃取缓冲液II (0.25 M蔗糖,10 mM Tris-HCl pH 8, 10 mM MgCl)重悬颗粒gydF4y2Ba2 gydF4y2Ba1% Triton X-100, 5 mM β-巯基乙醇,0.1 mM PMSF和13 μl蛋白酶抑制剂)。然后将混合物在14000转/分的转速下离心。在4℃下,用300 μl萃取缓冲液III (1.7 M蔗糖,10 mM Tris-HCl pH 8, 0.15% Triton X-100, 2 mM MgCl)重悬10 mingydF4y2Ba2 gydF4y2Ba5 mM β-巯基乙醇,0.1 mM PMSF和1 μl蛋白酶抑制剂)。将混合物装入等量的清洁萃取缓冲液III上,在14000转/分的转速下离心。10分钟。用1倍冷的CutSmart缓冲液洗涤细胞核2次,最后以0.5 ml的体积重悬。SDS在65℃下渗透10 min,加入Triton X-100淬火SDS。随后,用400单位的MboI在37°C下轻轻摇晃过夜消化染色质。然后MboI变性停止活动。gydF4y2Ba
被消化的染色质通过生物素-14- dctp插入进行DNA末端修复,然后进行钝端结扎。与蛋白酶K在65℃下解交联后,用苯酚-氯仿萃取法纯化DNA。使用T4 DNA聚合酶从非结扎DNA片段末端去除生物素-14- dctp。通过超声波将DNA剪切到200-600 bp的范围内。接下来,片段进行末端修复,并被链霉亲和素C1磁珠拉下,以丰富含有接触信息的片段。然后将片段末端a尾化,连接测序适配器,通过PCR扩增文库12-14个循环。纯化后,使用Illumina HiSeq X Ten平台对文库进行测序,读取长度为2× 150bp。采用Annoroad基因技术进行Hi-C文库构建和测序。gydF4y2Ba
使用HiC-Pro (v.2.11.1)管道将测序reads映射到TAIR10参考基因组gydF4y2Ba90gydF4y2Ba.由HiC-Pro生成的包含映射读取的bam文件(bwt2merged.bam)被用作fanc (v.0.9.8)的输入文件。gydF4y2Ba91gydF4y2Ba.使用' fanc auto '模块生成500,100,50,10和1kb的接触矩阵(hic文件)。将得到的分辨率为100 kb的hic文件导入“预期”模块,根据染色体内相互作用的基因组距离计算预期相互作用概率。对于矩阵和分数的比较,默认的比较方法是fold-change,并使用' fanc compare '命令。输出(对象)通过“fanc dump”传输到文本文件中,并在R中使用ggplot2将其可视化为热图。探讨是否观察到更高的接触gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba依赖H2B。8incorporation, the genome was binned into 1-kb windows. H2B.8 signals (log2 gydF4y2Ba(IP/input)),并按强度分为20个分位数。将每个分位数对的短程相互作用或中心点周围区域与染色体臂之间的相互作用的相互作用频率差异(由1kb分辨率的FAN-C生成的值)平均并绘制为热图。我们的Hi-C数据的分辨率估计如先前报道gydF4y2Ba92gydF4y2Ba.我们的Hi-C数据被认为达到了1kb的分辨率,因为80%的基因组箱(1kb)有1000个接触点。我们的WT数据与公布的接触矩阵进行了比较gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.gydF4y2Ba
雄性传播试验gydF4y2Ba
杂合的gydF4y2Bah2b.8-1gydF4y2Ba突变体和野生型植物在两个不同的实验中由两个不同的研究人员杂交。突变型与WT等位基因的遗传通过dCAPS基因分型确定。其中一个试验以WT植株为雌性,与杂合子杂交gydF4y2Bah2b.8-1gydF4y2Ba作为雄性的突变植株;共743度gydF4y2Ba1gydF4y2Ba后代进行基因分型,结果列于补充表gydF4y2Ba3 gydF4y2Ba.在第二个实验中,杂合子之间的互反杂交gydF4y2Bah2b.8-1gydF4y2Ba突变株和WT株;总共574和575华氏度gydF4y2Ba1gydF4y2Ba后代基因分型(补充表)gydF4y2Ba3 gydF4y2Ba).在R中使用Fisher精确检验检验统计显著性。gydF4y2Ba
离体花粉萌发gydF4y2Ba
野生型和野生型的离体花粉萌发gydF4y2Bah2b.8gydF4y2Ba是否如前所述gydF4y2Ba18gydF4y2Ba.gydF4y2Ba
统计和可重复性gydF4y2Ba
对实验数据和样本量进行的统计检验在图例中注明。所有数据点均来自生物复制。箱形图显示中位数(粗黑条)和第一、第三四分位数,下、上须分别延伸至第一、第三四分位数的四分位数间距或最高值和最低值的1.5倍。确切的gydF4y2BaPgydF4y2Ba所有图中两两比较的值在补充表中列出gydF4y2Ba7gydF4y2Ba.整个显微照片至少代表了三个独立的实验。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
本研究产生的测序数据(ChIP-seq, RNA-seq和Hi-C)已存入Gene Expression Omnibus,并有登录号gydF4y2BaGSE161366gydF4y2Ba.其余数据均在主论文或补充材料中。gydF4y2Ba
参考文献gydF4y2Ba
Steger, K. & Balhorn, R.精子核蛋白:控制精子染色质质量的检查点。gydF4y2Ba阿娜特。Histol。Embryol。gydF4y2Ba47gydF4y2Ba中文信息学报,273-279(2018)。gydF4y2Ba
Rathke, C, Baarends, W. M, Awe, S.和Renkawitz-Pohl, R.精子发生过程中的染色质动力学。gydF4y2BaBiochim。Biophys。学报gydF4y2Ba1839gydF4y2Ba, 155-168(2014)。gydF4y2Ba
魏伟。开花植物雄性配子体发育与种系分化。gydF4y2Ba性系植物gydF4y2Ba24gydF4y2Ba, 149-160(2011)。gydF4y2Ba
罗素,s.d.和琼斯,d.s.被子植物的雄性生殖系:一个不显眼但重要的细胞系的保留。gydF4y2Ba前面。植物科学。gydF4y2Ba6克ydF4y2Ba, 173(2015)。gydF4y2Ba
哈穆德,s.s.等人。人类精子中独特的染色质包裹了胚胎发育的基因。gydF4y2Ba自然gydF4y2Ba460gydF4y2Ba, 473-478(2009)。gydF4y2Ba
来自精子的“突发新闻”。gydF4y2Ba基本的中国。Androl。gydF4y2Ba23gydF4y2Ba, 11(2013)。gydF4y2Ba
小鼠和人类精子发生过程中瞬时DNA链断裂的阶段特异性和与染色质重塑联系的新见解。gydF4y2Ba医学杂志。天线转换开关。gydF4y2Ba70gydF4y2Ba, 910-918(2004)。gydF4y2Ba
米勒,D.,布林克沃斯,M. &艾尔斯,D.,精子中的父系DNA包装:超过其各部分的总和?DNA,组蛋白,蛋白蛋白和表观遗传学。gydF4y2Ba繁殖gydF4y2Ba139gydF4y2Ba, 287-301(2010)。gydF4y2Ba
Ausio, J, Eirin-Lopez, J. M. & Frehlick, L. J.脊椎动物染色体精子蛋白的进化:对生育能力和精子竞争的影响。gydF4y2BaSoc。天线转换开关。Fertil。增刊。gydF4y2Ba65gydF4y2Ba, 63-79(2007)。gydF4y2Ba
哈肯伯格,D.和特威尔,D.雄性配子体发育的进化和模式。gydF4y2Ba咕咕叫。上面。Dev,杂志。gydF4y2Ba131gydF4y2Ba中文信息学报,257-298(2019)。gydF4y2Ba
Southworth, D. & Cresti, M.植物中鞭毛和非鞭毛精子的比较。gydF4y2Ba点。j .机器人。gydF4y2Ba84gydF4y2Ba, 1301-1311(1997)。gydF4y2Ba
植物精子成熟过程中基本蛋白质的变化,gydF4y2BaMarchantia polymorphagydF4y2Ba.gydF4y2BaExp. Cell ResgydF4y2Ba116gydF4y2Ba, 269-273(1978)。gydF4y2Ba
雷诺兹,W. F.和沃尔夫,S. L.植物精子中的蛋白质。gydF4y2BaExp. Cell ResgydF4y2Ba152gydF4y2Ba, 443-448(1984)。gydF4y2Ba
陆生植物的运动配子:多样性、发育和进化。gydF4y2Ba暴击。《植物科学》gydF4y2Ba20.gydF4y2Ba, 107-213(2010)。gydF4y2Ba
J. F. & J. F.帕拉尼维卢,R.一个富有成果的旅程:花粉管从发芽到受精的导航。gydF4y2Ba为基础。植物生物学杂志。gydF4y2Ba70gydF4y2Ba, 809-837(2019)。gydF4y2Ba
Schoft, v.k.等。组成异染色质去浓缩诱导rna定向DNA甲基化。gydF4y2BaEMBO代表。gydF4y2Ba10gydF4y2Ba, 1015-1021(2009)。gydF4y2Ba
Merai, Z.等。aaa - atp酶分子伴侣Cdc48/p97可分解聚合的着丝粒,脱密异染色质,激活核糖体RNA基因。gydF4y2Ba自然科学进展。美国gydF4y2Ba111gydF4y2Ba中文信息学报,16166-16171(2014)。gydF4y2Ba
何淑娟,Vickers, M., Zhang, J.,冯霞。性细胞中组蛋白H1的自然缺失导致DNA去甲基化、异染色质去致密化和转座子激活。gydF4y2BaeLifegydF4y2Ba8gydF4y2Ba, e42530(2019)。gydF4y2Ba
博格,M. & Berger, F.雄性配子体发育过程中的染色质重塑。gydF4y2Ba植物J。gydF4y2Ba83gydF4y2Ba, 177-188(2015)。gydF4y2Ba
Baroux, C, Raissig, m.t. & Grossniklaus, U.植物配子形成过程中的表观遗传调控和重编程。gydF4y2Ba咕咕叫。当今。麝猫。Dev。gydF4y2Ba21gydF4y2Ba, 124-133(2011)。gydF4y2Ba
冯伟,Michaels, S. D.植物异染色质的组织、转录、复制和修复。gydF4y2Ba为基础。启麝猫。gydF4y2Ba49gydF4y2Ba, 439-459(2015)。gydF4y2Ba
Jiang, D.等。植物组蛋白H2B家族的进化和功能分化。gydF4y2Ba公共科学图书馆麝猫。gydF4y2Ba16gydF4y2Ba科学通报,e1008964(2020)。gydF4y2Ba
Banani, S. F, Lee, H. O, Hyman, A. A.和Rosen, M. K.生物分子凝聚物:细胞生物化学的组织者。gydF4y2BaNat. Rev. Mol.细胞生物学。gydF4y2Ba18gydF4y2Ba, 285-298(2017)。gydF4y2Ba
过度拥挤环境中的内在无序蛋白质:无膜细胞器、相分离和内在无序。gydF4y2Ba咕咕叫。当今。结构体。医学杂志。gydF4y2Ba44gydF4y2Ba, 18-30(2017)。gydF4y2Ba
拉森,a.g.等。HP1α形成的液滴提示了异染色质相分离的作用。gydF4y2Ba自然gydF4y2Ba547gydF4y2Ba, 236-240(2017)。gydF4y2Ba
Strom, A. R.等。相分离驱动异染色质结构域的形成。gydF4y2Ba自然gydF4y2Ba547gydF4y2Ba, 241-245(2017)。gydF4y2Ba
吉布森,b.a.等人。染色质组织的内在和调节相分离。gydF4y2Ba细胞gydF4y2Ba179gydF4y2Ba, 470-484(2019)。gydF4y2Ba
Strickfaden, H.等。浓缩染色质在体外和活细胞中尺度上表现得像固体。gydF4y2Ba细胞gydF4y2Ba183gydF4y2Ba, 1772-1784(2020)。gydF4y2Ba
Borcherds, W., Bremer, A., Borgia, m.b. & Mittag, T.,内在无序的蛋白质区域如何编码驱动液-液相分离?gydF4y2Ba咕咕叫。当今。结构体。医学杂志。gydF4y2Ba67gydF4y2Ba, 41-50(2021)。gydF4y2Ba
Fuchs, G.和Oren, M.书写和阅读H2B单酚化。gydF4y2BaBiochim。Biophys。学报gydF4y2Ba1839gydF4y2Ba, 694-701(2014)。gydF4y2Ba
Wang, J.等。控制朊病毒样RNA结合蛋白相分离驱动力的分子语法。gydF4y2Ba细胞gydF4y2Ba174gydF4y2Ba, 688-699(2018)。gydF4y2Ba
Sequeira-Mendes等人。的功能地形gydF4y2Ba拟南芥gydF4y2Ba基因组是由染色质状态的线性基序组成的。gydF4y2Ba植物细胞gydF4y2Ba26gydF4y2Ba, 2351-2366(2014)。gydF4y2Ba
李春华,李春华,李春华,等。植物抗旱功能的研究进展。gydF4y2Ba植物杂志。gydF4y2Ba160gydF4y2Ba, 379-395(2012)。gydF4y2Ba
Wang, L.等。组蛋白修饰通过相分离机制调节染色质区隔化。gydF4y2Ba摩尔。细胞gydF4y2Ba76gydF4y2Ba, 646-659(2019)。gydF4y2Ba
Dekker, J., marti - renm, m.a.和Mirny, l.a.探索基因组的三维组织:解释染色质相互作用数据。gydF4y2BaNat, Genet牧师。gydF4y2Ba14gydF4y2Ba, 390-403(2013)。gydF4y2Ba
Sun, L.等。热应力诱导转座子激活与三维染色质重排相关gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2BaCommun Nat。gydF4y2Ba11gydF4y2Ba, 1886(2020)。gydF4y2Ba
Grob, S, Schmid, M. W. & Grossniklaus, U.gydF4y2Ba拟南芥gydF4y2Ba确定了结,一个与弗拉门戈轨迹相似的结构gydF4y2Ba果蝇gydF4y2Ba.gydF4y2Ba摩尔。细胞gydF4y2Ba55gydF4y2Ba, 678-693(2014)。gydF4y2Ba
Moissiard, G.等。异染色质凝聚和基因沉默所需的MORC家族atp酶。gydF4y2Ba科学gydF4y2Ba336gydF4y2Ba, 1448-1451(2012)。gydF4y2Ba
冯绍华等。野生型和突变体的全基因组Hi-C分析揭示了高分辨率的染色质相互作用gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba摩尔。细胞gydF4y2Ba55gydF4y2Ba, 694-707(2014)。gydF4y2Ba
Wang, c.m.等。局部染色质堆积的全基因组分析gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba基因组Res。gydF4y2Ba25gydF4y2Ba, 246-256(2015)。gydF4y2Ba
Grewal, s.i.和Jia, s.a revisited异染色质。gydF4y2BaNat, Genet牧师。gydF4y2Ba8gydF4y2Ba, 35-46(2007)。gydF4y2Ba
Castel, B., Tomlinson, L., Locci, F., Yang, Y.和Jones, J. D. G. cas9介导突变的T-DNA结构优化gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba14gydF4y2Ba, e0204778(2019)。gydF4y2Ba
Labun, K.等。CHOPCHOP v3:将CRISPR网络工具箱扩展到基因组编辑之外。gydF4y2Ba核酸类。gydF4y2Ba47gydF4y2Ba, 171-174(2019)。gydF4y2Ba
Clough, S. J. & Bent, a . F.花浸渍:一种简化的方法gydF4y2Ba农杆菌属gydF4y2Ba的-介导变换gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba植物J。gydF4y2Ba16gydF4y2Ba, 735-743(1998)。gydF4y2Ba
博尔赫斯,F.等。基于facs的gydF4y2Ba拟南芥gydF4y2Ba小孢子,精细胞和营养核。gydF4y2Ba工厂方法gydF4y2Ba8gydF4y2Ba, 44(2012)。gydF4y2Ba
Tyanova, S., Temu, T. & Cox, J.:基于质谱的鸟枪蛋白质组学的MaxQuant计算平台。gydF4y2BaProtoc Nat。gydF4y2Ba11gydF4y2Ba中文信息学报,2301-2319(2016)。gydF4y2Ba
罗梅罗等人。无序蛋白的序列复杂性。gydF4y2Ba蛋白质gydF4y2Ba42gydF4y2Ba, 38-48(2001)。gydF4y2Ba
R开发核心团队。gydF4y2Ba统计计算语言与环境gydF4y2Ba(R Foundation for Statistical Computing, 2013)。gydF4y2Ba
威克姆,H.等。欢迎来到整理宇宙。gydF4y2BaJ.开源软件。gydF4y2Ba4gydF4y2Ba, 1686(2019)。gydF4y2Ba
古德斯坦博士等人。Phytozome:绿色植物基因组学比较平台。gydF4y2Ba核酸类。gydF4y2Ba40gydF4y2Ba, 1178-1186(2012)。gydF4y2Ba
Sundell, D.等。植物基因组整合探索者资源:PlantGenIE.org。gydF4y2Ba新植醇。gydF4y2Ba208gydF4y2Ba, 1149-1156(2015)。gydF4y2Ba
张磊等。睡莲基因组与开花植物的早期进化。gydF4y2Ba自然gydF4y2Ba577gydF4y2Ba, 79-84(2020)。gydF4y2Ba
Chen, J.等。gydF4y2Ba鹅掌楸gydF4y2Ba基因组揭示了被子植物的系统发育和种对分化。gydF4y2BaNat。植物gydF4y2Ba5gydF4y2Ba, 18-25(2019)。gydF4y2Ba
Chaw, s.m.等。粗壮樟树基因组填补了开花植物基因组进化认识的空白。gydF4y2BaNat。植物gydF4y2Ba5gydF4y2Ba, 63-73(2019)。gydF4y2Ba
UniProt:蛋白质知识的全球中心。gydF4y2Ba核酸类。gydF4y2Ba47gydF4y2Ba, 506-515(2019)。gydF4y2Ba
Kumar, S., Stecher, G., Li, M., Knyaz, C. & Tamura, K. MEGA X:跨计算平台的分子进化遗传学分析。gydF4y2Ba摩尔。杂志。另一个星球。gydF4y2Ba35gydF4y2Ba中文信息学报,1547-1549(2018)。gydF4y2Ba
约翰逊,M.等。NCBI BLAST:一个更好的web界面。gydF4y2Ba核酸类。gydF4y2Ba36gydF4y2Ba, 5-9(2008)。gydF4y2Ba
皮洛特等人。胚胎和胚乳从雌性配子继承了不同的染色质和转录状态gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba植物细胞gydF4y2Ba22gydF4y2Ba, 307-320(2010)。gydF4y2Ba
Kalyanikrishna, Mikulski, P. & Schubert, D.测量gydF4y2Ba拟南芥gydF4y2Ba芥gydF4y2Ba核的大小和形状。gydF4y2Ba方法Mol. Biol;gydF4y2Ba2093gydF4y2Ba, 107-113(2020)。gydF4y2Ba
杜,等。DNA损伤反应蛋白聚焦沿高let粒子离子轨迹的空间动力学。gydF4y2BaRadiat。Res。gydF4y2Ba176gydF4y2Ba, 706-715(2011)。gydF4y2Ba
Ollion, J, Cochennec, J, Loll, F, Escude, C. & Boudier, T. TANGO:用于研究核组织的高通量3D图像分析的通用工具。gydF4y2Ba生物信息学gydF4y2Ba29gydF4y2Ba, 1840-1841(2013)。gydF4y2Ba
Schindelin, J.等。斐济:生物图像分析的开源平台。gydF4y2BaNat方法。gydF4y2Ba9gydF4y2Ba, 676-682(2012)。gydF4y2Ba
Schneider, C. A, Rasband, W. S. & Eliceiri, K. W. NIH Image to ImageJ: 25年的图像分析。gydF4y2BaNat方法。gydF4y2Ba9gydF4y2Ba, 671-675(2012)。gydF4y2Ba
Chen, P.等。H3.3通过打开高阶染色质主动标记增强子并启动基因转录。gydF4y2BaDev的基因。gydF4y2Ba27gydF4y2Ba科学通报,2109-2124(2013)。gydF4y2Ba
Luger, K., Rechsteiner, T. J.和Richmond, T. J.从重组组蛋白中制备核小体核心颗粒。gydF4y2BaEnzymol方法。gydF4y2Ba304gydF4y2Ba, 3-19(1999)。gydF4y2Ba
Shimko, J. C., Howard, C. J., Poirier, M. G.和Ottesen, J. J.制备半合成和全合成组蛋白h3和h4修饰核小体核心。gydF4y2Ba方法Mol. Biol;gydF4y2Ba981gydF4y2Ba, 177-192(2013)。gydF4y2Ba
西蒙,医学博士等。甲基赖氨酸类似物在重组组蛋白中的位点特异性安装。gydF4y2Ba细胞gydF4y2Ba128gydF4y2Ba, 1003-1012(2007)。gydF4y2Ba
Sanulli, S.等。HP1重塑核小体核心,促进异染色质的相分离。gydF4y2Ba自然gydF4y2Ba575gydF4y2Ba, 390-394(2019)。gydF4y2Ba
Langmead, B. & Salzberg, S. L. Fast与Bowtie的间隙阅读对齐。gydF4y2BaNat方法。gydF4y2Ba9gydF4y2Ba, 357-359(2012)。gydF4y2Ba
Ramirez, F. et al. deepTools2:用于深度测序数据分析的下一代web服务器。gydF4y2Ba核酸类。gydF4y2Ba44gydF4y2Ba, 160-165(2016)。gydF4y2Ba
Thorvaldsdottir, H., Robinson, J. T. & Mesirov, J. P.整合基因组学查看器(IGV):高性能基因组学数据可视化和探索。gydF4y2Ba简短。Bioinform。gydF4y2Ba14gydF4y2Ba, 178-192(2013)。gydF4y2Ba
昆兰,a.r.和霍尔,i.m. BEDTools:一套灵活的比较基因组特征的实用工具。gydF4y2Ba生物信息学gydF4y2Ba26gydF4y2Ba, 841-842(2010)。gydF4y2Ba
斯特劳德,H.等。非cg甲基化模式塑造表观遗传景观gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba21gydF4y2Ba, 64-72(2014)。gydF4y2Ba
Ma, Z.等。gydF4y2Ba拟南芥gydF4y2Baserrate协调组蛋白甲基转移酶ATXR5/6和RNA加工因子RDR6调节转座子的表达。gydF4y2BaDev细胞。gydF4y2Ba45gydF4y2Ba, 769-784(2018)。gydF4y2Ba
李,C.等。H3K27去甲基化酶REF6和染色质重塑atp酶BRM的协同基因组靶向gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2BaNat,麝猫。gydF4y2Ba48gydF4y2Ba, 687-693(2016)。gydF4y2Ba
陈,C.等。胞浆乙酰辅酶a主要在H3K27蛋白位点促进组蛋白乙酰化gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2BaNat。植物gydF4y2Ba3 gydF4y2Ba, 814-824(2017)。gydF4y2Ba
纳斯拉,A.等。det1介导的saga样去泛素化模块的降解控制H2Bub的稳态。gydF4y2BaeLifegydF4y2Ba7gydF4y2Ba, e37892(2018)。gydF4y2Ba
Fiorucci, a.s.等人。gydF4y2Ba拟南芥gydF4y2BaS2Lb独立于组蛋白H2B单泛素化连接H3K4me3中的atcompass样和SDG2活性。gydF4y2Ba基因组医学杂志。gydF4y2Ba20.gydF4y2Ba, 100(2019)。gydF4y2Ba
斯特劳德,H.等。组蛋白H3.1和H3.3变异的全基因组分析gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba自然科学进展。美国gydF4y2Ba109gydF4y2Ba, 5370-5375(2012)。gydF4y2Ba
Choi, J, Lyons, D. B, Kim, M. Y, Moore, J. D.和Zilberman, D. DNA甲基化和组蛋白H1共同抑制转座因子和基因内异常转录。gydF4y2Ba摩尔。细胞gydF4y2Ba77gydF4y2Ba, 310-323(2020)。gydF4y2Ba
Zemach, A.等。的gydF4y2Ba拟南芥gydF4y2Ba核小体重塑器DDM1允许DNA甲基转移酶接近含h1的异染色质。gydF4y2Ba细胞gydF4y2Ba153gydF4y2Ba, 193-205(2013)。gydF4y2Ba
Krueger, F. & Andrews, S. R. Bismark:亚硫酸酯序列应用的灵活对准器和甲基化调用器。gydF4y2Ba生物信息学gydF4y2Ba27gydF4y2Ba, 1571-1572(2011)。gydF4y2Ba
Santos, M. R, Bispo, C.和Becker, J. D.隔离gydF4y2Ba拟南芥gydF4y2Ba通过荧光激活细胞分选(FACS)检测花粉、精子细胞和营养细胞核。gydF4y2Ba方法Mol. Biol;gydF4y2Ba1669gydF4y2Ba, 193-210(2017)。gydF4y2Ba
金,D.等。TopHat2:在存在插入、缺失和基因融合的情况下精确排列转录组。gydF4y2Ba基因组医学杂志。gydF4y2Ba14gydF4y2Ba, r36(2014)。gydF4y2Ba
Bray, n.l., Pimentel, H., Melsted, P. & Pachter, L.,近最优概率rna序列定量。gydF4y2Ba生物科技Nat。》。gydF4y2Ba34gydF4y2Ba, 525-527(2016)。gydF4y2Ba
Pimentel, H., Bray, N. L., Puente, S., Melsted, P. & Pachter, L.结合定量不确定度的RNA-seq差异分析。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 687-690(2017)。gydF4y2Ba
Narsai, R.等。广泛的转录组和表观基因组重塑发生在gydF4y2Ba拟南芥gydF4y2Ba发芽。gydF4y2Ba基因组医学杂志。gydF4y2Ba18gydF4y2Ba, 172(2017)。gydF4y2Ba
沃克,J.等。性谱系特异性DNA甲基化调节细胞减数分裂gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2BaNat,麝猫。gydF4y2Ba50gydF4y2Ba, 130-137(2018)。gydF4y2Ba
坦南鲍姆,M.等。调控染色质景观gydF4y2Ba拟南芥gydF4y2Ba通过耦合integrity和ATAC-seq发现根。gydF4y2Ba工厂方法gydF4y2Ba14gydF4y2Ba, 113(2018)。gydF4y2Ba
仆人,N.等。HiC-Pro:一个优化和灵活的管道,用于Hi-C数据处理。gydF4y2Ba基因组医学杂志。gydF4y2Ba16gydF4y2Ba, 259(2015)。gydF4y2Ba
Kruse, K., Hug, C. B. & Vaquerizas, J. M. FAN-C:染色体构象捕获数据分析和可视化的特征丰富框架。gydF4y2Ba基因组医学杂志。gydF4y2Ba21gydF4y2Ba, 303(2020)。gydF4y2Ba
Rao, s.s.等。千碱基分辨率的人类基因组三维图揭示了染色质环的原理。gydF4y2Ba细胞gydF4y2Ba159gydF4y2Ba, 1665-1680(2014)。gydF4y2Ba
致谢gydF4y2Ba
我们感谢C. Dean, S. Penfield和D. Zilberman对手稿的批判性阅读;S. Lopez和E. Wegel在John Innes中心生物成像设施提供显微镜协助;诺里奇生物科学研究所合作计算基础设施的工作人员,为科学小组提供高性能计算资源;和安诺达基因技术公司(北京,中国)的工作人员进行Hi-C文库制备和测序。这项工作由UKRI-BBSRC博士培训合作伙伴关系奖学金(BBM0112161给T.B.), Marie Skłodowska-Curie行动资助(101033109给S.Z.),生物技术和生物科学研究理事会资助(BBS0096201和BBP0135111给S.H., M.V.和X.F.),植物和微生物科学卓越中心资助(给S.H.和X.F.),国家重点研究和发展计划资助(2019YFA0508403给P.L.;2017YFA0504202 - G.L.),国家自然科学基金项目(32100417 - L.W.;[31991161];32150023, 32125010, 31871443资助P.L.),北京市科学技术委员会资助项目(Z201100005320013资助G.L.),欧洲研究理事会启动基金(' SexMeth ' 804981资助S.Z.和X.F.), EMBO青年研究者奖(资助X.F.)。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
t.b., S.H.和X.F.构思了这项研究。t.b., s.h., l.w., s.z., P.L.和X.F.设计了实验。L.W.进行了体外相分离、FRAP和液滴融合实验,G.L.和P.L.监督这些实验。T.B.(蛋白质组学、3D-SIM、转基因、ChIP-seq、RNA-seq和植物表型分析)、S.H.(共聚焦、转基因和ChIP-seq)和S.Z.(共聚焦、胁迫处理、ChIP-seq、RNA-seq、western blotting、Hi-C分析和植物表型分析)进行了所有其他实验和分析(由X.F.监督)。G.S.和M.V.分别用质谱法和基因组分析协助T.B.。t.b.、S.H.和X.F.撰写了手稿,所有作者都对手稿进行了评论。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益冲突。gydF4y2Ba
同行评审gydF4y2Ba
同行评议信息gydF4y2Ba
自然gydF4y2Ba感谢Steven Jacobsen和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Bab施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。gydF4y2Ba
扩展数据图和表gydF4y2Ba
图1 H2B。8is specifically expressed in sperm and mature seeds.
一个gydF4y2BaWestern blot显示叶片和精子核中H3K9me2水平,组蛋白H3为对照。所示数据代表两个独立的实验。代表,生物复制。源数据见附图。gydF4y2Ba1gydF4y2Ba.gydF4y2BabgydF4y2Ba精子(SN)、营养(VN)和叶核(LN)的多肽计数。cH2B,正态的H2B。gydF4y2BacgydF4y2BaH2B.8共聚焦图像(gydF4y2BapH2B.8: H2B.8-eGFPgydF4y2Ba)在雄性配子体发生过程中结合。最下面的面板是图的复制品。gydF4y2Ba1 dgydF4y2Ba.MN、VN、GN和SN分别为小孢子核、营养核、生殖核和精核。所示数据代表三个独立的实验。比例尺,5 μm。gydF4y2BadgydF4y2Ba,各种组织的共聚焦图像gydF4y2BapH2B.8: H2B.8-eGFPgydF4y2Ba植物。所示数据代表三个独立的实验。鳞条,20 μm(早期胚、叶、根),5 μm(种子)。gydF4y2Ba
图2 H2B。8is required for sperm chromatin aggregation.
一个gydF4y2Ba,对中gydF4y2Bah2b.8gydF4y2BaCRISPR线。gydF4y2Bah2b.8-1gydF4y2Ba在76 bp处有一个单碱基缺失,如箭头所示,导致33个氨基酸后过早终止密码子。gydF4y2Bah2b.8-2gydF4y2Ba67 bp后缺失12 bp, 92 bp后缺失5 bp,产生一个截断的54个氨基酸的蛋白。gydF4y2BabgydF4y2Ba,指示基因型生殖核和精子核的核大小。gydF4y2BaPgydF4y2Ba-值,单侧方差分析,然后是单独的双样本Tukey检验,调整多重比较。标记为A、B和C的箱形图在组间差异显著(gydF4y2BaPgydF4y2Ba< 0.001),但不在组内(gydF4y2BaPgydF4y2Ba> 0.1)。gydF4y2BangydF4y2Ba= 30(生成核),80 (WT),gydF4y2Bah2b.8-1gydF4y2Ba),及77 (gydF4y2Bah2b.8-2gydF4y2Ba经过两次独立实验检验的核。gydF4y2BacgydF4y2Ba,野生型个体SYBR绿色染色体素强度密度图(WT,蓝色)gydF4y2Bah2b.8gydF4y2Ba(红色)精子核。gydF4y2BangydF4y2Ba= 30个原子核。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba、箱形图(gydF4y2BadgydF4y2Ba)及强度(gydF4y2BaegydF4y2Ba)的SYBR绿色病灶在WT(蓝色)和gydF4y2Bah2b.8gydF4y2Ba(红色)精子。gydF4y2BaPgydF4y2Ba-值独立双样本t检验。gydF4y2BangydF4y2Ba= 30个原子核。AU,任意单位。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba, DAPI和H2B的共域化。精子中的8-eGFP信号(gydF4y2BafgydF4y2Ba,gydF4y2BapH2B.8: H2B.8-eGFPgydF4y2Ba)和H2B。8ectopically expressed seedlings (ggydF4y2Ba,gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba).gydF4y2BangydF4y2Ba精子和幼苗分别为37和31个细胞核。gydF4y2BahgydF4y2Ba,共聚焦图像和H2B定量。8 .凝析油gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗。gydF4y2BaPgydF4y2Ba-值独立双样本t检验。gydF4y2BangydF4y2BaH2B大小的原子核= 30和71。8condensates, respectively, examined over two independent experiments. Scale bars, 2 μm.
图3 H2B.8的相分离特性gydF4y2Ba
一个gydF4y2Ba,对中gydF4y2Ba拟南芥gydF4y2BaH2B型(n端尾部-上面板,c端主体-下面板)。H2B的n端尾IDR。8is highlighted with a yellow dashed box. Amino acids are colored according to the RasMol scheme.bgydF4y2BaH2B.8的内在紊乱预测(红色)和H2B。2,一个c一个nonical H2B (blue), by PONDR. Histone profiles are aligned at the interchange between tail and body domains (dashed line). H2B.8 N-terminal tail IDR is highlighted in yellow.cgydF4y2Ba含H2B重组组蛋白八聚体的SDS-PAGE。2, H2B。8, H2B。8ΔIDR or H2B.8-scrambledIDR. For gel source data, see Supplementary Fig.1gydF4y2Ba.gydF4y2BadgydF4y2Ba, H2B光漂白后荧光恢复(FRAP)。或H2B。8-containing chromatin droplets. Average relative fluorescence intensity of the photobleached area across 6 individual chromatin droplets was calculated and displayed at each time point. Error bars, ±SD. Scale bars, 1 μm.egydF4y2Ba, H2B的融合。或H2B。8-containing chromatin droplets (histone H3 and dsDNA were labeled with AF594 and YOYO-1, respectively) over time. Data shown represent one representative experiment, which has been performed twice with similar results. Scale bars, 1 μm.fgydF4y2Ba,gydF4y2BaggydF4y2Ba含H2B的核小体阵列(NA)的体外相分离。2, H2B。8或H2B.8ΔIDR at indicated salt and NA concentrations (inggydF4y2Ba各组NA浓度均为50 nM)。组蛋白H3和dsDNA分别用AF594和YOYO-1标记,显示红绿通道合并图像。所示数据是一个有代表性的实验,已经进行了三次,结果相似。标尺,2 μm。gydF4y2BahgydF4y2Ba,核尺寸量化gydF4y2Ba烟草benthamianagydF4y2Ba表皮细胞核瞬时表达原生和嵌合H2B。8 .如所示。标记为A和B的箱形图在两组之间差异显著(gydF4y2BaPgydF4y2Ba< 0.001),但不在组内(gydF4y2BaPgydF4y2Ba> 0.1)。gydF4y2BangydF4y2Ba= 30 (wt;gydF4y2Bap35区域:H2B.8-EWSR1-IDR-eGFPgydF4y2Ba,gydF4y2Bap35区域:H2B.8-TAF15-IDR-eGFPgydF4y2Ba), 32 (gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba),及33 (gydF4y2Bap35区域:H2B.8-scrambledIDR-eGFPgydF4y2Ba两个独立实验的原子核。gydF4y2Ba
图4异位表达H2B。8in seedlings exhibits a similar deposition profile as native H2B.8 in sperm.
一个gydF4y2Ba,基因的覆盖率,常染色质TEs和异染色质TEs(左Y轴;500 kb窗口)和H2B。富集于sperm (right Y axis; 1 kb windows) along Chromosomes 2 to 5. Chromosome 1 is shown in Fig.4 dgydF4y2Ba.gydF4y2BabgydF4y2BaH2B的基因组快照。8丰度(log)gydF4y2Ba2 gydF4y2Ba(IP/输入))和转录(日志gydF4y2Ba2 gydF4y2Ba(RPKM))gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗,以及基因和TE注释(橙色,正色TE;洋红色,异色TE)在代表性区域。RPKM,每百万次映射读取转录本的每千碱基读取数。gydF4y2BacgydF4y2Ba、H2B的概况和相关热图。富集于gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗超过基因(按幼苗表达分组),TEs(按染色质状态分组)和基因间区域。gydF4y2BadgydF4y2Ba,野生型精子和幼苗以及各自H2B基因、TEs和基因间区域覆盖的基因组比例(%)。8个高峰gydF4y2BapH2B.8: H2B.8-eGFPh2b.8gydF4y2Ba精子和gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗。使用的颜色编码与(gydF4y2BacgydF4y2Ba)和图。gydF4y2Ba4 bgydF4y2Ba.gydF4y2BaegydF4y2Ba上图,散点图显示H2B呈反相关。8富集与GC含量(%)gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗过度表示基因组特征。下图,散点图显示WT幼苗抗gfp富集(loggydF4y2Ba2 gydF4y2Ba(IP/输入))对GC含量(%)的控制。gydF4y2BaρgydF4y2Ba斯皮尔曼军衔。gydF4y2BafgydF4y2BaH2B预测。8using indicated chromatin features, transcription (log10gydF4y2Ba(RPKM+1))和GC含量作为预测因子。y轴表示调整后的RgydF4y2Ba2 gydF4y2Ba预测值和实测值之间的值。gydF4y2BaggydF4y2Ba, H2B的概况。富集于gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba在非基因(TE和基因间)区域的幼苗。按GC含量水平将试验区分为三等份(低GC < 0.29;0.29 <中GC < 0.34;高GC > 0.34)。gydF4y2Ba
扩展数据图5 IDR是排除H2B的必要条件。8来自异染色质。gydF4y2Ba
一个gydF4y2Bah2b的富集(gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba), H2B.2(gydF4y2Bap35区域:H2B.2-eGFPgydF4y2Ba), H2B。8ΔIDR (gydF4y2Bap35区域:H2B.8ΔIDR-eGFPgydF4y2Ba第2和第5行)和幼苗中的H3K9me2(原木gydF4y2Ba2 gydF4y2Ba(IP /输入);1 kb窗口)。灰色虚线定位着丝粒,灰色阴影区表示着丝粒周围异染色质。gydF4y2BabgydF4y2Ba、H2B的概况和相关热图。8ΔIDR富集于gydF4y2Bap35区域:H2B.8ΔIDR-eGFPgydF4y2Ba幼苗超过基因(按幼苗表达分组),TEs(按染色质状态分组)和基因间区域。相比较而言,gydF4y2Bap35区域:H2B.8-eGFPgydF4y2BaChIP-seq数据显示为虚线(如扩展数据图)。gydF4y2Ba4摄氏度gydF4y2Ba).gydF4y2Ba
图6异位表达H2B。8对转录的影响可以忽略不计。gydF4y2Ba
一个gydF4y2Ba-gydF4y2BacgydF4y2Ba,火山图显示不同的TE (gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba)或基因(gydF4y2BabgydF4y2Ba表达在…之间gydF4y2Bah2b.8gydF4y2Ba突变型和野生型(WT)精子细胞(gydF4y2Ba一个gydF4y2Ba),或gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba和WT苗(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba).TPM,每百万份成绩单。对于在WT或gydF4y2Bah2b.8gydF4y2Ba突变精子,n = 20285 (gydF4y2BabgydF4y2Ba)及1472 (gydF4y2BacgydF4y2Ba),用于基因或在其中任何一个基因中含有TPM bbb1的tegydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba或WT幼苗。gydF4y2BadgydF4y2Ba,描述干旱胁迫下野生动物和野生动物基因转录(z-score)的热图gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗受模拟(对照)和干旱处理。gydF4y2BangydF4y2Ba= 771。gydF4y2BaegydF4y2Ba用凝聚、中凝聚或去凝聚的异染色质焦点(H3K9me2信号测量)对指示基因型的幼苗核进行共聚焦图像和定量分析。gydF4y2BangydF4y2Ba= 138 (WT), 71、30和101 (gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba细胞核中有大的、小的、大的和小的H2B。分别为8个焦点)。H2B.8condensates are largely distinct from heterochromatin foci, overlapping only 19.0% ± 10.7% (standard deviation calculated from 53 nuclei) of the volume of heterochromatin foci.fgydF4y2Ba,散点图显示了H3K9me2水平(log2(IP/输入))在WT和之间的1 kb窗口之间的相关性gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗。gydF4y2BaρgydF4y2Ba斯皮尔曼军衔。gydF4y2BaggydF4y2BaH2B的剖面图。富集于gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗在h3k9me2富集区域。gydF4y2Ba
图7 H2B。8一个ffects intra- and inter-chromosomal interactions.
一个gydF4y2Ba,野生型(WT)和gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba幼苗Hi-C库。代表,生物复制。gydF4y2BabgydF4y2Ba本研究生成的Hi-C数据与先前发表的数据之间的相关性gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.gydF4y2BaRgydF4y2Ba, Pearson相关系数。gydF4y2BacgydF4y2Ba, WT分辨率为500kb的Hi-C相互作用频率热图(上);合并的复制)和gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba(低;合并复制)幼苗。gydF4y2BadgydF4y2Ba, WT (Rep 2)和WT的全基因组相互作用频率折叠变化热图gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba(Rep 2) 500kb分辨率下的幼苗,如图2所示。gydF4y2Ba6gydF4y2Ba为Rep 1。gydF4y2BaegydF4y2Ba,染色体内短程相互作用频率差异gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba(Rep 2)和WT (Rep 2)在幼苗H2B的分位数上。8富集(日志)gydF4y2Ba2 gydF4y2Ba(IP/input)),如图所示。gydF4y2Ba6 bgydF4y2Ba为Rep 1。斯皮尔曼的gydF4y2BaρgydF4y2Ba= 0.930。gydF4y2BafgydF4y2Ba,远距离相互作用频率差之间gydF4y2Bap35区域:H2B.8-eGFPgydF4y2Ba(Rep 2)和WT (Rep 2)在幼苗H2B的分位数上在染色体臂和中心点周围区域之间。8富集(日志)gydF4y2Ba2 gydF4y2Ba(IP/input)),如图所示。gydF4y2Ba6摄氏度gydF4y2Ba为Rep 1。斯皮尔曼的gydF4y2BaρgydF4y2Ba= 0.870。gydF4y2Ba
图8 H2B的作用机理。8介导的精子凝结。gydF4y2Ba
H2B.8drives sperm nuclear condensation via the formation of chromatin condensates (yellow), which is dependent on an intrinsically disordered region (IDR) of H2B.8 conserved among flowering plants. Unlike typical chromatin condensation mechanisms, H2B.8-induced condensation does not inhibit transcription. Condensation is achieved by the specific deposition of H2B.8 into inactive AT-rich chromatin, which alters higher-order chromatin architecture to effectively compact the nucleus without sacrificing transcription. H2B.8-mediated chromatin aggregation disperses heterochromatin foci (pink), suggesting interactions between the euchromatic (yellow) and heterochromatic (pink) chromatin condensates in the nucleus.
补充信息gydF4y2Ba
补充信息gydF4y2Ba
本文件包含补充图1和2以及补充表2 - 7(见补充表1的单独文件)。gydF4y2Ba
补充表1gydF4y2Ba
H2B清单。8homologues identified in flowering plant species.
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接从版权所有者处获得许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
何绍文,王立林,何绍文。gydF4y2Baet al。gydF4y2Ba组蛋白H2B。8compacts flowering plant sperm through chromatin phase separation.自然gydF4y2Ba(2022).https://doi.org/10.1038/s41586-022-05386-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05386-6gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba.如果你发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba