摘要
肝癌是世界上最常见的恶性肿瘤之一,转移是导致肝癌患者死亡的主要原因。缺氧是实体瘤的共同特征,并增强了癌细胞的恶性特征。然而,到目前为止,缺氧驱动肝癌进展和转移的确切机制尚不清楚。本研究的目的是探讨长链非编码RNA (lncRNA)在缺氧促进肝癌进展中的作用。我们筛选并揭示了LINC00839作为一种新的低氧反应lncRNA在肝癌中的作用。LINC00839在肝癌组织和细胞系中表达上调,且LINC00839高表达的患者总生存期缩短。LINC00839在缺氧条件下进一步过表达,促进肝癌细胞增殖、迁移和侵袭。从机制上讲,LINC00839结合了多种主要与代谢和RNA转运相关的蛋白,并积极调节formin样蛋白2 (FMNL2)的表达。LINC00839可促进缺氧介导的肝癌进展,提示其可能是一种具有临床价值的生物标志物,可作为肝癌诊断、预后和治疗的分子靶点。
介绍
肝癌是一种主要的恶性肿瘤,在全球癌症相关死亡原因中排名第四1.肝细胞癌(HCC)约占原发性肝癌的90%2.目前,手术切除和肝移植是治疗早期肿瘤最有效的方法2.然而,大多数HCC患者在诊断时不符合手术条件。此外,由于多发局部侵袭和远处转移,远期预后较差3..更好地了解HCC的关键依赖性和潜在的分子机制可能会为HCC患者提供更有效的治疗方法。
缺氧是实体肿瘤的共同和关键特征,其原因是细胞快速增殖导致的氧气消耗过多,以及功能血管不足导致的氧气供应不足4.缺氧微环境有利于细胞增殖、运动、代谢、耐药和干细胞生物学5,6,7.在对缺氧的反应中,癌细胞改变了许多基因的转录,激活了多种致癌信号通路,以协调恶性细胞的表型8.低氧导致低氧诱导因子-1 (HIF-1)的稳定,HIF-1通过激活控制血管生成、糖酵解代谢、侵袭、迁移和红细胞生成的基因表达程序来帮助癌细胞适应低氧应激9,10.然而,导致癌细胞缺氧生存优势的分子细节尚未完全阐明。
人类转录组学研究表明,绝大多数基因组序列普遍转录成各种各样的蛋白质编码rna和非编码rna (ncRNAs),其中蛋白质编码rna所占比例不到3%11.长链非编码RNA (Long non-coding RNA, lncRNA)是一类长度超过200个核苷酸且不具有蛋白质编码潜能的转录物12.越来越多的证据表明,lncrna是特异性调控和保守的,而不是转录噪声的产物13.它们的功能机制是多种多样的,包括作为支架、诱饵或信号的lncrna,可以通过基因组靶向、顺式或反式调控和反义干扰发挥作用14.最近的发现表明,lncRNAs通过与其他细胞大分子(包括DNA、蛋白质和RNA)的相互作用驱动许多重要的癌症表型15.在癌症中发现的低氧反应lncrna数量急剧增加,说明了低氧诱导的基因重编程的复杂性以及lncrna在低氧信号级联和反应中的扩展作用16.表征参与低氧适应的长链非编码转录组,对于全面了解低氧相关肿瘤生物学具有重要意义。
肿瘤或周围细胞外基质(ECM)的高硬度和随后机械组织稳态的丧失是细胞侵袭和肿瘤进展的共同标志17,18.Formins构成了一个多样化的蛋白质家族,它被认为是控制多种细胞和形态发生功能的线状放丝的有效核子19.formmin -样蛋白2 (FMNL2)是formmin中的一员,它在迁移细胞的前沿形成突出的肌动蛋白结构,如板足和丝足,在控制细胞骨架对环境变化的快速适应和支持细胞有效的粘附和迁移中起关键作用20.,21.
在本研究中,我们研究了lncRNA在缺氧促进肝癌进展中的作用。我们在肝癌中鉴定并验证了低氧应答的LINC00839,并系统研究了LINC00839对低氧条件下肝癌细胞增殖、迁移和侵袭的影响。通过机制研究,探讨LINC00839的潜在作用机制及其与FMNL2的联系,为肝癌的临床诊断和治疗提供依据。
材料与方法
RNA-seq生物信息学分析及临床资料
肝癌(LIHC)的RNA-seq和临床数据从癌症基因组图谱(TCGA)数据库(https://cancergenome.nih.gov/)。将Ensembl ID转换为基因符号,并使用gencode v22注释将表达谱划分为lncRNA和mRNA。不同表达的lncrna通过DESeq2 package进行鉴定,设置log2FoldChange > 1和padj < 0.001作为显著不同表达的阈值。使用starBase数据库进行共表达分析22.使用GO数据库进行基因本体(Gene Ontology, GO)分析23,24.利用京都基因与基因组百科全书(KEGG)数据库进行通路富集分析25,26,27.我们还根据FMNL2的表达是否高于或低于所有样本的中位数,将肿瘤样本标记为“高”或“低”,并使用R包绘制Kaplan Meier图。
细胞系和培养
肝癌细胞株Li-7、SNU-387和SNU-182由中国科学院干细胞库提供,人肝细胞株HL-7702由上海天宇公司提供。所有细胞在罗斯威尔公园纪念研究所(Roswell Park Memorial Institute, RPMI) 1640培养基中培养,培养基中添加10%胎牛血清(FBS)和1%青霉素/链霉素,并在含5% CO的潮湿环境中保存2在37℃,这被认为是常压条件。为了模拟缺氧,细胞在1% O浓度下培养23气培养箱缺氧。
实时定量聚合酶链反应(qPCR)
使用RNeasy Mini Kit (Qiagen, Germany)从细胞中提取总RNA。利用PrimeScript™RT Master Mix (Takara, Japan)进行互补DNA (cDNA)合成。qPCR使用TB Green®Premix Ex Taq™II (Takara,日本),在标准条件下,根据制造商的说明,使用LightCycler480系统(Roche,瑞士)进行。引物由Takara (Tokyo, Japan)合成,以β-actin基因为内源对照。数据分析使用2-△△Ct方法。引物列于表中1.
细胞计数试剂盒-8 (CCK-8)测定
使用CCK-8 (Dojindo, Japan)检测细胞增殖。2 × 103.将每孔100 μL培养基中的细胞接种于96孔板中,在常氧或缺氧条件下孵育一定时间,然后每孔加入10 μL CCK-8溶液,在37℃下孵育2 h,测定450 nm处的光密度(OD)值。
伤口愈合试验
采用伤口愈合法测定细胞迁移量。将细胞100%密度镀于6孔板上,每孔用1 ml吸管头损伤。将细胞与不含FBS的新鲜培养基在常氧或缺氧条件下连续孵育,分别于0 h和24 h观察和拍摄各组伤口愈合情况。
Transwell化验
transwell法检测细胞侵袭。将基质液在4℃下溶解过夜,在不含FBS的培养基中按1:10的体积比稀释,然后在每个tranwell腔中加入100 μL基质液,在37℃下放置2 h,使基质液凝固。1 × 105上transwell室中加入100 μL不含胎牛血清的培养基,下transwell室中加入600 μL含10%胎牛血清的培养基。在常氧或缺氧条件下孵育24 h后,取出上腔细胞,剩余细胞用4%多聚甲醛固定,0.1%结晶紫染色,拍照。
流式细胞术
采用Annexin V-FITC细胞凋亡检测试剂盒(Solarbio, China)检测细胞凋亡。按照说明书收集细胞,用Annexin V-FITC和PI染色,1 h内用流式细胞术分析。
慢病毒和稳定细胞系的构建
基因化学(上海)有限公司构建了表达全长LINC00839或LINC00839 shRNA的慢病毒及其阴性对照慢病毒(NC)。慢病毒分别感染SNU-387细胞株72 h,用1 μg/mL嘌呤霉素筛选稳定过表达或干扰的SNU-387细胞株。
荧光原位杂交(FISH)测定
使用FISH试剂盒(GenePharma, China)检测LINC00839在SNU-387细胞中的位置。采用Cy3荧光染料偶联探针对β-actin、LINC00839或NC进行杂交。将样品置于激光共聚焦扫描显微镜下观察。
RNA拉下试验
使用RNA pull down Kit (BersinBio, China)收集LINC00839的结合蛋白。生物素化RNA探针与细胞蛋白提取物孵育形成RNA -蛋白复合物。通过与链霉亲和素标记的磁珠结合,将配合物与培养液中的其他组分分离,并将蛋白质洗脱以进一步分析。
蛋白印迹(WB)
所有细胞用RIPA裂解缓冲液(Beyotime, China)裂解。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,并将其转移到聚偏氟乙烯(PVDF)膜上(Millipore, America)。将PVDF膜与一抗在4℃下孵育过夜,然后与二抗在室温下孵育1 h,最后用增强化学发光(ECL)溶液孵育曝光。抗体分别为:β-actin (Cell Signaling Technology, 1:1000)、HIF-1α (Cell Signaling Technology, 1:1000)、FMNL2 (Abcam, 1:5000)。
RNA免疫沉淀(RIP)试验
使用RIP Kit (BersinBio, China)收集FMNL2的结合RNA分子。将细胞提取物与抗fmnl2抗体(Santa Cruz Biotechnology, America)或抗igg抗体在4℃下孵育过夜,然后将蛋白A/G磁珠加入样品中,在4℃下孵育1 h,最后洗脱RNA,进行qPCR分析。
组织样本
组织微阵列芯片包含64例HCC患者的HCC组织和26例HCC患者的邻近非肿瘤肝组织,并提供相关的临床病理和生存信息。
道德声明
组织样本来源于国家人类遗传资源共享服务平台(2005DKA21300)。每位患者均获得知情同意,研究方案经上海奥特多生物技术公司伦理委员会批准。所有研究都是按照《赫尔辛基宣言》进行的。
统计分析
采用SPSS 20.0软件进行统计分析。实验数据用至少三个独立实验的平均值±标准差(SD)表示。采用Welch’s t检验比较FMNL2在肿瘤组织和正常组织中的表达。生存分析采用log-rank检验。组间比较采用Student’s t检验。与a的差异P< 0.05认为有统计学意义。
结果
缺氧促进肝癌细胞增殖、迁移、侵袭及HIF-1α的表达
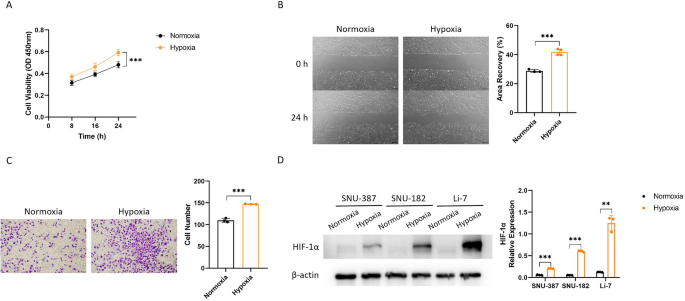
为了证实缺氧是否促进了肝癌细胞的恶性表型,我们分别在常氧和缺氧条件下培养SNU-387肝癌细胞24 h。CCK-8实验、伤口愈合实验和transwell实验显示,与常氧条件下相比,缺氧明显加速了肝癌细胞的增殖、迁移和侵袭(图2)。1a - c)。然而,缺氧不影响肝癌细胞凋亡(补充图2)。1)。WB分析显示缺氧条件下肝癌细胞系中HIF-1α显著上调(图2)。1D)。
缺氧促进肝癌细胞增殖、迁移、侵袭及HIF-1α的表达。(一个) CCK-8测定肝癌细胞在常氧和缺氧条件下的增殖能力(n = 6)。(B)创面愈合实验研究肝癌细胞在常氧和缺氧条件下的迁移能力。(C) transwell法测定肝癌细胞在常氧和缺氧条件下的侵袭能力。(D)常氧和缺氧条件下肝癌细胞中HIF-1α蛋白表达水平的变化。带标记物的原始WB结果见补充文件1.实验数据用至少三个独立实验的平均值±SD表示。**P< 0.01, ***P< 0.001。
低氧反应LINC00839被选择用于肝癌并在低氧条件下进行验证
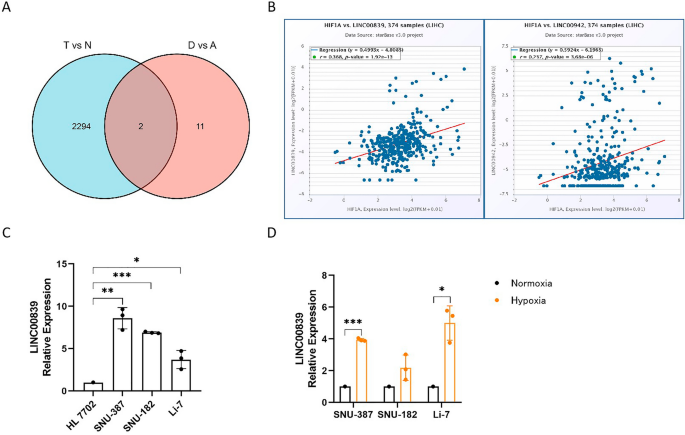
从TCGA数据库中共提取了14826个lncrna。我们首先在肝癌样本(n = 374)和正常样本(n = 50)中鉴定出2296种不同表达的lncrna (T vs. n, log2FoldChange > 1和padj < 0.001)。然后,我们在OS患者之间发现了13种不同表达的lncrna。事件死亡(n = 130)和OS。事件存活(n = 235) (D vs. A, log2FoldChange > 1和padj < 0.001)。我们筛选了两组重叠的lncrna(图2)。2A)、LINC00839和LINC00942,在肝癌组织中均上调表达,且与患者不利生存相关(表2)2)。最后,我们选择LINC00839与HIF1A在LIHC中的共表达分析(n = 374)进行进一步研究,其系数r更高(图2)。2B)。
我们利用qPCR检测了LINC00839在肝癌细胞株和正常肝细胞株中的表达,验证了其表达模式。结果表明,其在肝癌细胞系中的表达水平约为正常肝细胞系的3 ~ 8倍(图2)。2C)。此外,我们的数据显示,与常氧相比,低氧条件下LINC00839在肝癌细胞中有增加的趋势,在SNU-387和Li-7肝癌细胞中差异显著(图3)。2D),提示LINC00839可能参与了缺氧对肝癌进展的促进作用。
LINC00839促进缺氧条件下肝癌细胞的增殖、迁移和侵袭
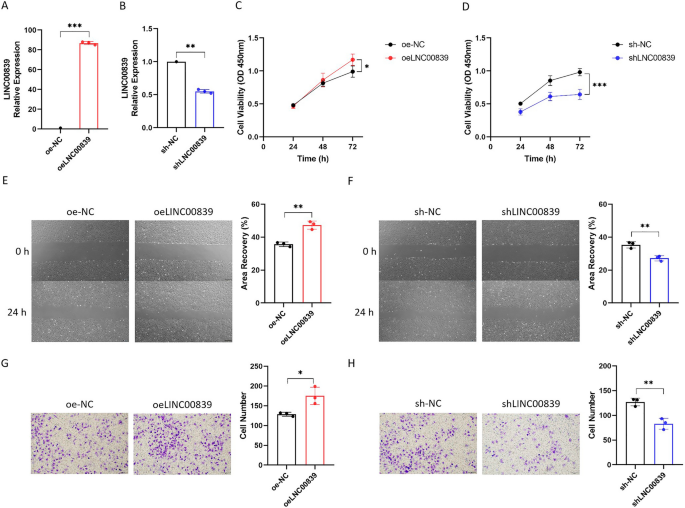
为了研究LINC00839对缺氧条件下肝癌细胞恶性表型的影响,我们构建了过表达LINC00839的慢病毒和LINC00839 shRNA慢病毒,并建立了稳定过表达或干扰的SNU-387细胞系。各组细胞缺氧培养24 h,验证LINC00839的表达(图2)。3.A、B)。首先,CCK-8实验显示,当LINC00839过表达时,SNU-387细胞在缺氧条件下的增殖能力显著提高,而LINC00839的干扰则显著降低了SNU-387细胞的增殖能力(图5)。3.C, D)。接下来,我们通过伤口愈合实验和transwell实验来评估SNU-387细胞在缺氧条件下的迁移和侵袭能力。结果表明,外源表达LINC00839显著促进了SNU-387细胞的迁移和侵袭,而干扰LINC00839则显著抑制了SNU-387细胞的迁移和侵袭(图5)。3.情况)。
LINC00839促进缺氧条件下肝癌细胞的增殖、迁移和侵袭。(一个缺氧条件下,LINC00839过表达慢病毒(oeLINC00839)和过表达NC慢病毒(e-NC)感染肝癌细胞后,LINC00839的相对表达。(B缺氧条件下感染LINC00839 shRNA慢病毒(shLINC00839)和shRNA NC慢病毒(sh-NC)后,LINC00839在肝癌细胞中的相对表达。(C,E,G)缺氧条件下oeLINC00839组和e- nc组细胞的增殖、迁移和侵袭能力。(D,F,H)缺氧条件下shLINC00839组和sh-NC组的增殖、迁移和侵袭能力。红条表示oeLINC00839组,蓝条表示shLINC00839组,黑条表示o - nc组和sh-NC组。实验数据用至少三个独立实验的平均值±SD表示。*P< 0.05, **P< 0.01, ***P< 0.001。
LINC00839位于肝癌细胞的细胞核和细胞质中
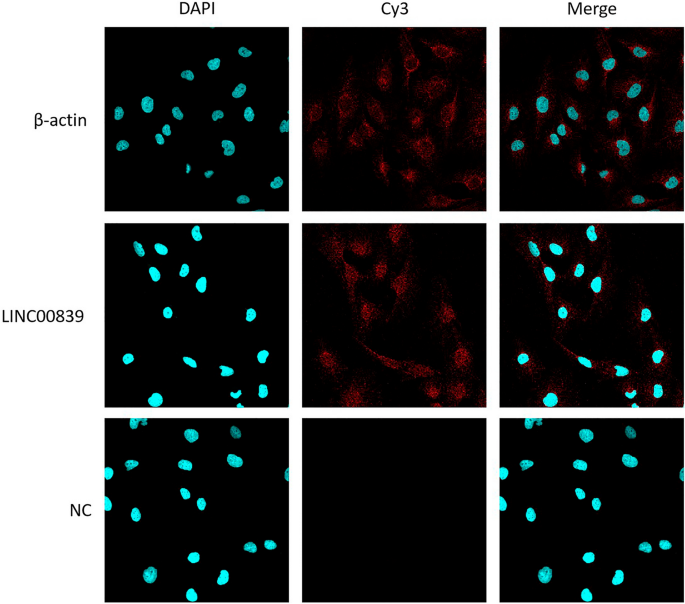
为了进一步研究LINC00839在肝癌中的致癌功能,我们检测了LINC00839在SNU-387细胞中的位置。FISH实验显示,与β-actin相比,LINC00839位于细胞核和细胞质中(图2)。4)。
LINC00839结合蛋白的功能富集分析
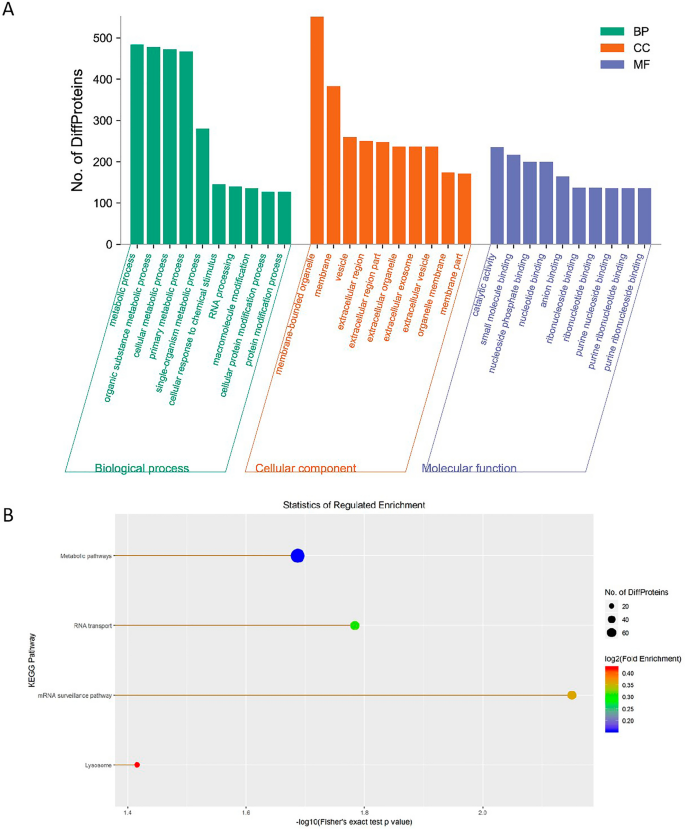
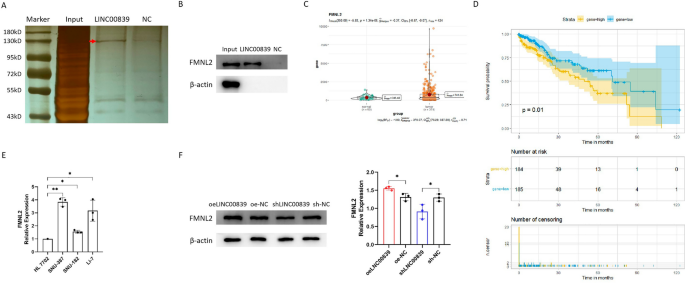
然后,我们使用生物素标记的LINC00839探针进行RNA下拉实验,以确定LINC00839在肝癌中的潜在结合蛋白。采用质谱法(MS)对LINC00839提取的蛋白进行分析,结果可通过ProteomeXchange获得,标识符为PXD034526。为了预测LINC00839结合蛋白的潜在生物学功能和连接,我们进行了GO和KEGG途径富集分析。根据LINC00839结合蛋白在GO富集分析中的分布情况,对蛋白数量进行统计分析,各GO项显著富集,阐明蛋白在生物过程(BP)、细胞成分(CC)和分子功能(MF)中的功能。结果表明,这些蛋白参与了各种BP术语,尤其是代谢过程(图2)。5最富集的CC项与膜结合细胞器有关,而最富集的MF项与催化活性和小分子结合有关(图2)。5A)。KEGG通路富集分析显示,相关通路主要参与代谢途径和RNA转运(图2)。5B)。
LINC00839上调FMNL2蛋白表达水平
将LINC00839探针和NC探针拉下的蛋白样品通过SDS-PAGE进行分离,然后进行银染色。与NC组相比,LINC00839拉低了更多的蛋白质,特别是在130 kD左右的特定条带(图2)。6A).根据质谱结果,我们推测是FMNL2特异性结合到LINC00839上,并使用WB进行检验。结果表明,FMNL2在LINC00839下拉的蛋白复合体中被鉴定出来,而在NC探针下拉的蛋白复合体中没有被鉴定出来(图2)。6B).我们利用RNA-seq和TCGA数据库的临床数据比较了FMNL2在肝癌和正常样本中的表达水平及其预后意义。研究发现,FMNL2在肝癌中高表达,FMNL2表达水平升高与肝癌患者总生存期(OS)恶化相关(图2)。6C, D)。同样,我们也观察到,与正常肝细胞系相比,FMNL2在肝癌细胞系中显著上调(图2)。6E)。此外,检测并比较了稳定过表达和干扰LINC00839细胞系中FMNL2的蛋白表达水平。结果显示,FMNL2在oeLINC00839组中的表达显著增加,而在shLINC00839组中FMNL2的表达明显下降(图2)。6F)。此外,采用RIP法富集与FMNL2结合的RNA分子,然后通过qPCR检测各组中LINC00839的富集情况。然而,结果显示,与IgG组相比,抗fmnl2抗体不能富集LINC00839(补充图2)。2)。
LINC00839上调FMNL2蛋白表达水平。(一个)通过SDS-PAGE分离蛋白样品,然后进行银染色。以lacZ基因作为NC。在LINC00839组中发现了一个特定的条带,并用箭头标记。(B)用WB法检测蛋白质样品。(C) FMNL2在肝癌组织和正常组织中的表达。(D) FMNL2水平与患者OS的相关性。(E) FMNL2在肝癌细胞系和正常肝细胞系中的相对表达。(F) FMNL2蛋白在oeLINC00839组、e- nc组、shLINC00839组和sh-NC组中的表达水平。带标记物的原始WB结果见补充文件1.实验数据用至少三个独立实验的平均值±SD表示。*P< 0.05, **P< 0.01。
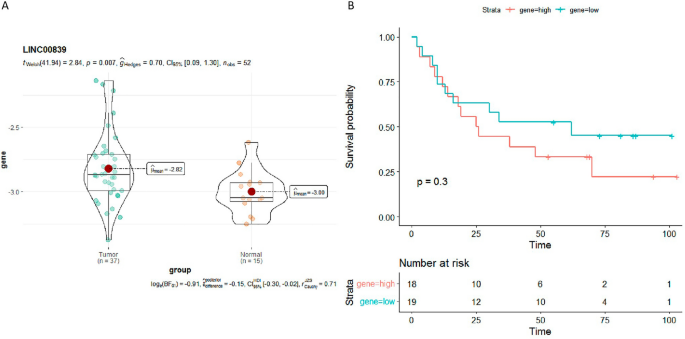
LINC00839在HCC组织中表达上调,并与患者临床病理特征相关
采用qPCR进一步检测64例HCC组织样本和26例邻近非肿瘤肝组织样本中LINC00839的表达水平。不幸的是,仅从37个HCC组织样本和15个非肿瘤肝组织样本中获得了LINC00839表达数据。肝癌中LINC00839水平显著上调(图2)。7A)。进一步探讨了37例HCC患者中LINC00839水平与患者临床病理特征的相关性。LINC00839的上调与不良OS呈正相关(图2)。7B). LINC00839水平与肿瘤大小、病变数、病理分级等其他临床病理特征的相关性见补充图。3..
讨论
据估计,大约50-60%的HCC患者在其一生中接受过全身治疗2.据报道,在过去5年中,基于免疫检查点抑制剂(ICI)的全身治疗提高了患者的总生存率和生活质量28,强调了肿瘤微环境在癌症进展中的关键作用。然而,只有15-20%的应答者获得了实质性的临床益处28.了解癌细胞与其微环境之间的相互作用对于开发新疗法和识别生物标志物至关重要。
中位氧分压(pO2)为6 mm Hg,而正常肝组织为30 mm Hg,说明肝肿瘤氧合不均匀且严重受损29.缺氧是肿瘤微环境的异常物理特性之一,可引起表观基因组的广泛变化,这有利于标志能力的表型选择,包括癌细胞的侵袭性生长能力30..尽管如此,在临床前研究中,大多数癌细胞是在相对较高的环境大气氧浓度(约21%的氧浓度)中培养的,通常被认为是常氧,而体内的实际肿瘤通常处于缺氧状态(1-2%的氧浓度)。31.近年来的研究表明,在不同氧浓度的环境下,癌细胞的生理状态和对药物的敏感性是不同的32.因此,评估缺氧条件下的癌细胞可以更准确地概括其在体内微环境中的生理病理状态。我们的研究结果证明,缺氧条件下肝癌细胞的恶性表型显著增强,包括增殖、迁移和侵袭。此外,缺氧24h后细胞凋亡率无明显变化,这与之前的几项研究结果一致33,34提示肝癌细胞存在缺氧适应反应,以减轻细胞凋亡。例如,研究表明,HCC细胞在缺氧条件下存活是通过激活线粒体分裂和线粒体自噬来调节线粒体动力学33.然而,另一项研究发现,10%的氧气浓度似乎为人类细胞系在培养中长期生长提供了最佳条件,而当其稳态浓度低于或高于最佳浓度时,氧气可能会抑制生长,这表明氧气和氧化代谢产物引起的累积损伤可能会限制细胞的生长35.事实上,即使是很小的氧浓度异常也会导致细胞功能的改变36.本研究中使用的常氧条件与体内氧浓度并不完全一致,这可能会导致一些结果不够客观。因此,在体外基因研究中应该考虑到氧水平,这可能是明确定义和比较整个组织或肿瘤中发生的情况的关键。
最近的大规模转录组测序方法已经确定了数千种在正常组织和来自同一器官的肿瘤之间转录差异的lncrna12.现在人们认识到lncrna是精细调控的,可以识别临床相关的癌症亚型,预测肿瘤行为和疾病预后37.针对lncrna的多种治疗策略已经被开发出来。例如,反义寡核苷酸(ASOs)正在积极研究作为RNA抑制剂来治疗各种疾病38.RNA靶向治疗的发展为以抗癌为目的调节lncrna提供了巨大的机会。因此,进一步探索lncRNA在肝癌发生发展中的作用,有助于开发理想的癌症诊断生物标志物和潜在的药物靶点。在本研究中,我们从TCGA数据库中筛选了两种不同表达且具有预后潜力的lncrna,重点研究了LINC00839在缺氧条件下肝癌进展转移中的作用及潜在机制。我们的数据显示,LINC00839在肝癌中表达水平较高,升高的LINC00839预示预后较差,提示其促瘤作用。据报道,LINC00839在包括HCC在内的多种癌症中表达失调39,40,41,42.然而,LINC00839是否参与HCC的缺氧微环境仍未明确。共表达分析显示,LINC00839表达水平与HIF1A表达水平呈正相关,并且在缺氧培养的肝癌细胞中,LINC00839进一步过表达。HIF-1是低氧胁迫下最重要的转录因子,与靶基因启动子区域内的缺氧反应元件(HREs)结合,协调细胞转录反应43.低氧反应lncrna通常作为hif转录级联的直接或间接效应体,在染色质、转录和转录后水平上调控低氧基因表达发挥关键作用44.LINC00839的上游调节器在很大程度上是未知的。这仍有待进一步调查。
在功能上,本研究表明LINC00839可促进缺氧条件下肝癌细胞的增殖、迁移和侵袭,提示LINC00839可能是一种新的缺氧诱导信号的功能调节剂。lncRNA在基因调控中的关键作用与其特定的亚细胞定位有关。定位于细胞核的lncRNAs可以调节染色质功能,调节无膜核体的组装和功能,而定位于细胞质的lncRNAs大多在转录后水平调控基因表达,特异的细胞器定位lncRNAs可以参与细胞器功能和代谢调节,如线粒体氧化和稳态等45.我们观察到LINC00839在细胞核和细胞质中都有定位,表明其功能机制是多样的。lncRNA与结合蛋白之间的相互作用是决定lncRNA功能作用的核心。因此,我们鉴定了LINC00839的结合蛋白,并进行了GO和KEGG途径富集分析。发现这些蛋白质主要与代谢和RNA转运有关。重编程细胞代谢以最有效地支持肿瘤增殖的能力现在被认为是癌症的核心标志30..LINC00839对缺氧有反应,可能作为能量代谢重编程的调节因子。因此,LINC00839在肝癌中的确切作用有待进一步研究。
FMNL2已被发现是转化细胞迁移和侵袭所必需的,并与驱动特定肿瘤的肿瘤发生和转移密切相关46,47,48.生物信息学分析显示,FMNL2在肝癌中表达上调,并与患者的不利生存相关,我们的数据显示FMNL2可能是LINC00839的功能伙伴。LINC00839可拉低FMNL2,过表达LINC00839可积累FMNL2。这些实验结果表明,LINC00839可能通过上调FMNL2的表达来促进肝癌的进展。然而,RIP实验显示抗fmnl2抗体不富集LINC00839。先前的研究表明,FMNL2直接结合许多肌动蛋白捆绑蛋白,如fastin和cortacn,从而促进癌细胞的迁移21,49.我们推测FMNL2存在于被LINC00839拉下的蛋白复合物中,其他蛋白参与了LINC00839与FMNL2的结合。需要进一步的研究来阐明更详细的机制。
我们还发现LINC00839水平与患者的临床病理特征相关。LINC00839高表达与预后差、肿瘤大小呈正相关。然而,LINC00839表达升高的临床意义还需要一个更大的队列研究来验证。此外,本研究缺乏体内实验,为了更好地了解LINC00839对肝癌的作用,需要补充体内实验。
综上所述,我们的研究报道了缺氧条件下肝癌中LINC00839的显著上调。LINC00839促进缺氧条件下肝癌细胞的增殖、迁移和侵袭。更重要的是,LINC00839可能具有重编程能量代谢的调节作用,可以上调FMNL2的蛋白表达水平。因此,LINC00839被认为是抗癌治疗的潜在靶点。
数据可用性
本研究过程中产生或分析的数据包含在这篇发表的文章及其补充信息文件中,质谱蛋白质组学数据已通过PRIDE存入ProteomeXchange Consortium50具有数据集标识符PXD034526的合作伙伴存储库。
参考文献
布雷,F。et al。2018年全球癌症统计数据:GLOBOCAN估计全球185个国家36种癌症的发病率和死亡率。癌症。68(6), 394-424(2018)。
j·M·洛夫特。et al。肝细胞癌。Nat, rev, Dis, primer7(1), 6(2021)。
马鲁乔,M. &柯维,A.理解、诊断和治疗肝细胞癌的最新进展。癌症。62, 394-399(2012)。
导丝,我。et al。缺氧后肿瘤细胞的命运定位揭示了一种促进转移的ros抗性表型。Commun Nat。10(1), 4862(2019)。
Rankin, E. B.和Giaccia, A. J.缺氧控制转移。科学352(6282), 175-180(2016)。
李建军,李建军,李建军,等。低氧环境对肿瘤细胞代谢适应的影响。肿瘤形成5(1), e190(2016)。
缺氧微环境:癌症干细胞进化的一个决定因素。BioEssays38(增刊1),S65-S74(2016)。
Petrova, V., Annicchiarico-Petruzzelli, M., Melino, G. & Amelio, I.缺氧肿瘤微环境。肿瘤形成7(1), 10(2018)。
低氧诱导因子在生理和医学上的应用。细胞148中文信息学报,399-408(2012)。
HIF-1α通路:肿瘤治疗的作用、调控和干预。Acta制药。罪。B5, 378-389(2015)。
Hangauer, m.j., Vaughn, i.w.和McManus, m.t.人类基因组的普遍转录产生数千个以前未识别的长基因间非编码rna。公共科学图书馆麝猫。9(6), e1003569(2013)。
是的,m。K。et al。人类转录组中长链非编码rna的景观。Nat,麝猫。47(3), 199-208(2015)。
非编码RNA的功能基因组学。科学309(5740), 1527-1528(2005)。
Ulitsky, I.和Bartel, D. P. lincRNAs:基因组学,进化和机制。细胞154(1), 26-46(2013)。
lncrna在癌症中的新作用。Nat,地中海。21(11), 1253-1261(2015)。
Choudhry, H, Harris, a.l.和McIntyre, A.肿瘤缺氧诱导的非编码转录组。Mol. Aspects医学方面47-48, 35-53(2016)。
Seewaldt, V. ECM硬度为肿瘤细胞铺平了道路。Nat,地中海。20.(4), 332-333(2014)。
基质环境和细胞力学特性调节细胞迁移并促进癌细胞的侵袭性表型。众议员掠夺。理论物理。82(6), 064602(2019)。
费克斯,J. &格罗斯,R.。Dev细胞。10, 693-706(2006)。
Gardberg, M。et al。人体组织中与双胍相关的FMNL2的表征。BMC细胞生物学。11, 55(2010)。
费,K。et al。FMNL2调节丝状足中筋膜蛋白的动态。[j]细胞生物学。219(5), e201906111(2020)。
李建辉,刘生,周慧,曲丽华,杨建华,starBase v2.0:基于大规模CLIP-Seq数据解码miRNA-ceRNA, miRNA-ncRNA和蛋白质- rna相互作用网络。核酸类。42, d92-d97(2014)。
ashburn, M。et al。基因本体论:生物学统一的工具。基因本体联盟。Nat,麝猫。25, 25-29(2000)。
碳,年代。et al。基因本体资源:富金矿。核酸类。49, d325-d334(2021)。
Kanehisa, M. & Goto, S. KEGG:京都基因和基因组百科全书。核酸类。28, 27-30(2000)。
迈向了解细胞有机体的起源与演化。蛋白质科学。28, 1947-1951(2019)。
Kanehisa, M, Furumichi, M, Sato, Y., Ishiguro-Watanabe, M. & Tanabe, M. KEGG:整合病毒和细胞有机体。核酸类。49, d545-d551(2021)。
Llovet, J. M., Montal, R., Sia, D.和Finn, R. S.肝细胞癌的分子治疗和精准医学。奈特,克林牧师。肿瘤防治杂志。15, 599-616(2018)。
Vaupel, P., Höckel, M. & Mayer, A.利用pO2组织学检测和表征肿瘤缺氧。Antioxid。氧化还原信号。9, 1221-1235(2007)。
《癌症的特征:新维度》。癌症。12(1), 31-46(2022)。
定义正常氧合、生理氧合和低氧合对肿瘤治疗反应的影响。Br。j . Radiol。87(1035), 20130676(2014)。
Kumar B。et al。生理环境下的肿瘤收集/处理揭示了高度相关的信号网络和药物敏感性。科学。睡觉。8(2), eabh3375(2022)。
林,x。H。et al。缺氧条件下,抑制drp1介导的线粒体分裂和线粒体自噬增加肝癌细胞线粒体凋亡。肿瘤形成9(7), 67(2020)。
郭东东,谢克峰,罗晓军。缺氧诱导的NDRG1升高通过线粒体裂变重编程介导肝癌细胞凋亡。基因741中文信息学报,144552(2020)。
低氧浓度延长培养的人类二倍体细胞的寿命。自然267, 423-425(1977)。
克莱因,s.g.。et al。哺乳动物细胞培养中普遍忽视环境控制的问题需要最佳实践。Nat,生物医学。Eng。5, 787-792(2021)。
杜,Z。et al。整合基因组分析揭示了与人类癌症临床相关的长链非编码rna。Nat。结构。摩尔。杂志。20.中文信息学报,908-913(2013)。
Matsui, M. & Corey, dr . R.非编码rna作为药物靶标。Nat, rev,药物发现。16, 167-179(2017)。
陈,Q。et al。核lncRNA Linc00839作为Myc靶点通过PI3K/AKT信号通路促进乳腺癌化疗耐药癌症科学。111(9), 3279-3291(2020)。
张凤英。et al。LINC00839敲低通过海绵化miR-454-3p抑制鼻咽癌的转移行为。老龄化(纽约州奥尔巴尼)13(24), 26022-26033(2021)。
Yang, L, Pei, L,和Yi J. LINC00839通过miR-338-3p/GLUT1轴调控神经母细胞瘤细胞的增殖、迁移、侵袭、凋亡和糖酵解。Neuropsychiatr。说,治疗。17, 2027-2040(2021)。
周,X。et al。LINC00839/miR-144-3p/WTAP (WT1相关蛋白)轴参与调节肝细胞癌的进展。生物工程12(2), 10849-10861(2021)。
黄颖,林,D.和Taniguchi, C. M.缺氧诱导因子(HIF)在肿瘤微环境中的作用:是敌是友。科学。中国生命科学。60, 1114-1124(2017)。
Shih, J. W. & Kung, H. J. Long:非编码RNA与肿瘤缺氧:新玩家进入旧竞技场。j .生物医学。科学。24, 53(2017)。
Statello, L, Guo, c.j, Chen, L. L.和Huarte, M.长链非编码rna的基因调控及其生物学功能。Nat. Rev. Mol.细胞生物学。22(2), 96-118(2021)。
杨,s.s.。et al。FMNL2破坏COMMD10的稳定性,激活结直肠癌侵袭转移过程中的NF-κB通路。Br。j .癌症117(8), 1164-1175(2017)。
钟斌,王凯,徐华,孔峰。沉默Formin-like 2通过抑制整合素内化抑制胃癌细胞的生长和转移。癌细胞Int18, 79(2018)。
娇,X。et al。formin样蛋白2通过p27相关机制促进人乳腺癌细胞增殖。BMC癌症21(1), 760(2021)。
任x.l。et al。cortatin招募FMNL2促进肌动蛋白聚合和内核体运动。癌症。419, 245-256(2018)。
Perez-Riverol Y。et al。2022年的PRIDE数据库资源:基于质谱的蛋白质组学证据中心。核酸类。50, d543-d552(2022)。
致谢
国家自然科学基金资助项目(82160829;81960840),广西自然科学基金(2021GXNSFBA220073;2018GXNSFAA281298),广西中医药大学自然科学基金(2021QN021),广西中医药重点实验室基金研究(20-065-53),广西研究生教育创新项目(YCSW2021233)。
作者信息
作者及单位
贡献
Y.X.和H.L.构思实验,Y.X.进行实验,Y.K.和Q.F.分析结果,J.L.和M.L.起草工作,W.W.和E.C.修改手稿。所有作者都审阅了手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益冲突。
额外的信息
出版商的注意
b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
谢勇,林,海,魏,文。et al。LINC00839在缺氧条件下通过结合FMNL2促进肝癌恶性。Sci代表12, 18757(2022)。https://doi.org/10.1038/s41598-022-16972-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-16972-z