摘要
过去用于核燃料制造的铀矿开采和磨矿活动的遗留问题仍然令人关切,需要全世界的研究人员进行评估和采取补救行动。向环境排放铀污染水是一个法规问题(世界卫生组织、世卫组织- 15 μg/L、罗马尼亚立法、RO-21 μg/L)、环境和健康问题。因此,化学沉淀法、离子交换法、吸附法、零价铁纳米颗粒固定法等从稀释水溶液中去除U(VI)的技术得到了广泛的应用。我们之前的研究研究了用铁从稀释的水系统中去除U(VI)0在实验室合成的基纳米材料(NMS) (Crane et al. in Water Res 45:2391-2942, 2011)。用NMS处理富碳酸盐水体系,去除U(VI)。经过半小时的反应后,由于其容易形成稳定可溶的碳酸配合物,只有50%左右被去除。考虑到这一点,本文旨在研究吸附/浮选技术,使用原位生成的吸附剂2O3.·nH2O和油酸钠表面活性剂从稀释的水体系中去除U(VI),并更新对过程机理的认识。为了确定U(VI)的去除效率,研究了pH、吸附剂剂量、表面活性剂浓度、接触时间、搅拌速率、U(VI)浓度、加压水容器气压以及伴随的重金属离子(Cu(II)、Cr(VI)和Mo(VI))的影响因素。通过监测脱除效率(%R)的最大值,确定最佳分离参数(建立的工艺参数),并在实际矿井水样(MW)上进行验证。U (VI)的去除率为%R > 98%。采用吸附/浮选技术,分别从“简单”和“用NMS预处理”两种真实矿井水样中去除U(VI)。对于经NMS预处理的矿井水样,它有两种变体:有pH校正和没有pH校正。pH值范围= 7.5 - -9.5,摩尔比率[U (VI)]:[铁(III)] = 1: 75年,[U (VI)]: [NaOL] = 1: 1×102,接触时间30min,搅拌速度250rpm,初始浓度U(VI) 10mg·L−1,压水容器内的空气压力p= 4 × 105N·m−2得到%R > 98%。研究发现,吸附/浮选作为一个单独的操作或与矿井水的NMS预处理和pH调整相结合,都具有良好的%R值(CU (VI)< 1·103mg·L−1).
简介
铀矿石湿法冶金加工对环境造成的放射性污染,以及该工业中使用的其他重金属产生的交叉污染,仍然是对科学家的挑战,也是对全世界人类健康的重大威胁2,3.,4.天气事件产生的矿井水是一种重要的放射性污染物,它调动了大量的U(VI),以及伴随的其他重金属如Cu (II)、Cr (III + VI)和Mo (VI),因此需要高效的修复技术3.,5.不幸的是,已开发的补救技术,如络合工艺6,共同沉淀7,8,9,10氧化还原反应9、离子交换11,12、溶剂萃取13,14,吸附在不同的材料上15,16,17,18,19生物修复20.,21以及纳米材料的固定化5,18,22,23,24,25,26介绍具体的优点和缺点。具体优势的一个例子是开发具有改变性质的新吸附剂,这些吸附剂提供了许多改进的应用,包括选择性。在从水溶液中去除铀的情况下,可以注意到为此目的进行的一些研究。用戊二醛在磁铁矿存在下交联壳聚糖。通过与四乙烯五胺(TEPA)反应对树脂进行化学改性,制得含胺壳聚糖。该树脂对UO的吸收表现出较高的亲和力22 +水溶液中的离子27.具有磁性的希夫碱壳聚糖复合物。该合成物对UO具有较高的吸附亲和力和快速的吸附动力学22 +离子28.通过接枝二乙烯三胺(DETA)和双硫腙修饰的磁性壳聚糖纳米颗粒,在pH值约为5时提高U(VI)的吸附能力29.瓜尔胶的磷酸化与壳聚糖结合制备了一种从微酸溶液中去除U(VI)的高效吸附剂。此外,瓜尔胶/磁铁矿/壳聚糖纳米复合材料的磷酸化对革兰氏菌和革兰氏菌都有抗菌作用30..另一种有趣的新型U(VI)吸附剂是尿素或硫脲基聚合物功能化的二氧化硅珠31.缺点的例子有化学方法、离子交换和溶剂萃取。在处理含有大量污染物的废水方面有很高的效率,但在修复稀释的水系统方面却令人望而却步(103-10年6解决方案)。
浮选是一种吸附式气泡分离技术,它涉及到通过引入表面活性剂使表面活性离子成为表面活性离子,并随后使气体微分散气泡通过泡沫分离柱中的溶液,从而从均匀和非均匀的水系统中去除表面不活性离子。表面活性离子被吸附在上升气泡的表面上,可以被向上携带到泡沫分离柱的顶部,从而从水体系中作为凝结的泡沫(扬子)去除。
在分离过程中,参与相的性质很重要:液相的表面界面性质;泡沫浓缩区物种疏水性强,密度低;气泡均质尺寸,提供传质液体泡沫;泡沫中气泡-颗粒聚集的最佳气体流量。
不同的技术变体,如离子浮选4,32,33,34,35、沉淀浮选36, sorption-flotation12,35,37,38,39,40,胶体吸附浮选41, electro-flotation42, flotoextraction43,44,已经证明了它们对各种稀释水系统的高去污效率45,46,47,48,49,50,51,52.
其主要优点是选择性高,适应性强,脱除效率高,可用于去除无机或有机性质的离子、分子、胶体和微分散物种35,48,49,50,51,52.但也有一些缺点,即电浮选法能耗大,气体分散浮选法气泡不均匀,对多孔材料的要求高。在气泡产生技术中,溶解气浮(DAF)技术因其在原位产生小的均匀气泡而受到青睐。
DAF的应用包括两种形式:(a)通过将气流引入经过浮选处理的试剂条件下的水样直接加压;(b)浮选前,在试剂调节的样品的压力下,用循环水稀释。工业化是最后一个选择,因为它具有成本效益,而且适用于小型、紧凑和相对简单的安装。快速(浮选接触时间小于5分钟)、多用途(去除有机物和重金属如铜、铬和钼)、安装简单是推荐这种分离方法的其他优点。
U(VI)的迁移率在很大程度上取决于pH的变化、环境中氧化还原电位的变化以及其他中性和/或离子的存在,如腐殖酸、硫酸盐、磷酸盐和碳酸盐离子,这些离子与铀酰离子相互作用,使其成为高可溶性络合物。例如,碳酸盐生成高度稳定的铀酰-碳酸盐配合物,并在其生物地球化学和生物利用度方面发挥关键作用53.
考虑到铀污染矿井水的复杂化学性质,以及其他行业使用Cu (II)、Cr (VI)、Mo (VI)等有毒重金属对环境造成的污染,本研究旨在研究吸附/沉淀浮选法在单一污染和多重污染水系统中作为天然类似物去除U(VI),并分别作为真实矿井水样去除U(VI),以更新已有的工艺机制知识。
本研究使用的吸附剂是原位生成的,由铁组成2O3.×n H2考虑到铁的物理化学性质和对多种污染物(包括U(VI)和伴随的重金属)的分离效率高,选择了O和5,23,24,54.这样做是为了获得以下优势:(i)少量试剂与铁(III)循环生成吸附剂载体;(ii)降低获取吸附剂载体的成本;(iii)通过U(VI)的松散片状结构确保与U(VI)的最佳接触;(iv)减少反应时间和产生的废物量。虽然氢氧化铁不是唯一的,但它是一种环境友好和低成本的合成吸附剂的替代品。
为了提高载U(VI)吸附剂的疏水性,在体系中引入了捕收剂(表面活性剂),该捕收剂为油酸钠(NaOL)18H33O2Na。它是一种常见的廉价试剂,具有低毒、易得性、高可用性和在食品中作为粘合剂、乳化剂、抗结结剂和间接添加剂的安全性55.油酸钠的长c链解释了油酸钠的高疏水性和表面活性(表面活性剂)特性48,49,50,51,52.
本文提出的研究是由上述实际的科学兴趣所证明的4,12,32,33,34,35,37,38,39.
先前的研究1U(VI)对Fe的脱除0在实验室(NMS)合成的纳米材料在大约1小时内就能有效地从富含碳酸盐的矿井水中去除U(VI),但在超过24小时的反应时间后,由于可溶的铀酰-碳酸盐络合物的出现,出现了解吸过程5.因此,纳米管-吸附/浮选联合技术正成为一种有前途的处理方法。因此,本文相对于以往研究的新颖之处在于提出了一种利用铁基纳米材料的反应性和DAF技术的分离效率的新型治疗技术。
材料和方法
试剂
所有试剂均为默克分析级。所有溶液均采用米利q纯净水(电阻率> 18.2 MΩ cm)制备。
Na4[UO2(有限公司3.)3.原液(1 g·L−1U(VI))和工作溶液(10 mg·L)−1)用醋酸铀酰(UO2(CH3.首席运营官)2·H2O)和无水碳酸钠(Na2有限公司3.);
铜(不3.)2哞,3.·H2O, K2CrO4,工作溶液(10 mg L−1)的Cu(II), Cr(VI), Mo(VI);
NaOH和HCl, pH调节液(0.01 M和0.1 M);
FeCl3.为吸附剂原位生成的溶液(0.01 M和0.1 M);
NaOL溶液:0.25 M, 0.25 × 103M和0.025 × 103M。
NMS(铁0基纳米材料)在实验室合成1
设备
Heidolph Vibramax 100搅拌器,可变速。
290一个猎户酸碱计;
UNICAM PAY SP9原子吸收分光光度计测定Cu (II), Cr (VI), Fe (III)
cintra404紫外可见分光光度计测定U(VI)和Mo (VI)。
用UHPLC铂蓝法测定NaOL
FT-NIR分光光度计MB3600-AAA用于红外光谱。
Netzsch分析仪TG 449 C STA Jupiter固体样品热分析。
实验方法
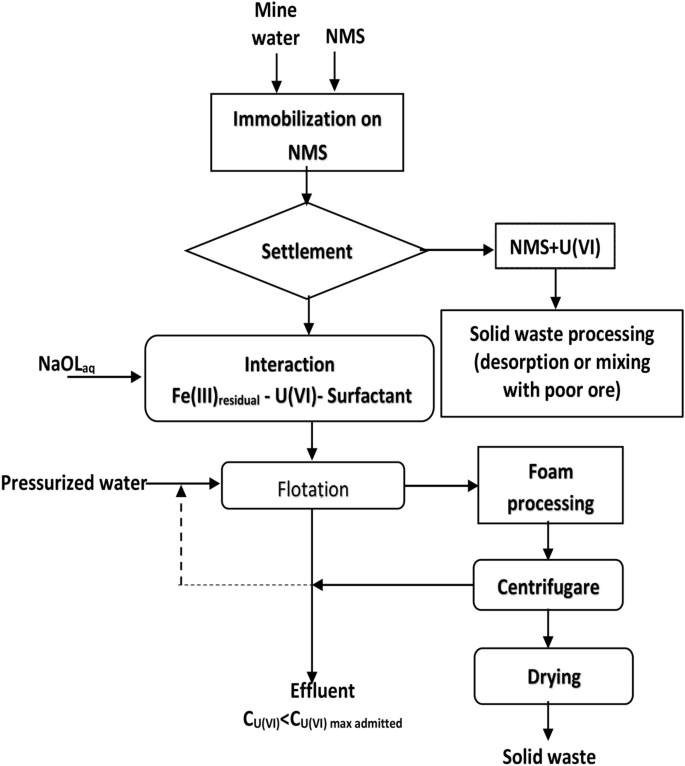
原位生成的吸附剂吸附/浮选实验
实验以批处理方式进行。U(VI)样品(200 mL)与含有0.1 M NaOH的Fe (III)溶液以不同摩尔比[U(VI)]: [Fe (III)]连续搅拌,搅拌时间为先前设定的30分钟56.调整pH值后,样品以不同摩尔比[NaOL]: [U(VI)]与表面活性剂(NaOL)接触,并转移到浮选槽中,浮选槽与加压受水器耦合。在5 × 10的压力下,容器内充满饱和空气的水5N·m−2.一种压力下的水(稀释比V样本V:水在浮选槽底部引入= 3:1),产生大小均匀的微气泡。因此,它们附着在形成的固体表面(原位产生吸附剂,并在其表面加载U(VI)),并上升到浮选槽顶部。浮选时间为5 min,直至所有泡沫在顶部分离。分析了U(VI)、Fe (III)和NaOL的残留浓度。所有实验都进行了三次。
影响因素(pH值、摩尔比、金属离子浓度、必要空气等)的研究%R = f(性能)马克斯建立了U(VI)分离的最佳条件。
去除效率计算公式为:
在那里,
C我为金属离子的初始浓度(mg·L−1);
Cf为金属离子的最终浓度(mg·L−1).
用等温动力学和动力学模型分别表征了U(VI)在不同工况下的吸附过程。结果56表明该过程是混合的,涉及U(VI)和Fe(III)水溶液之间的物理和化学相互作用(共沉淀)。根据相关系数(R2),吸附平衡数据拟合等温线模型的顺序为:Langmuir (0.9808) > Temkin (0.8715) > Freundlich(0.8344)。KF, Qe的接近值经验值和量化宽松政策calc建议该过程涉及化学吸附,这与其他研究证实的该过程遵循伪二级动力学的事实很一致57,58.
优化参数验证实验
两种类型的矿井水样(MW),分别是“简单”和“用NMS预处理”(V样本= 400 mL, pH值范围= 7.5-9.5,mNMS= 0.1 g, τ联系= 30分钟,搅拌速率250转/分)进行先前研究的吸附/浮选工艺。矿水样本(MW1-3)是从位于巴纳特地区的一个前铀矿场收集的。
关于“NMS预处理”样品,提到所使用的纳米材料具有以下特点1:
比表面积(BET分析)为14.8 m2超过80%的研究纳米颗粒为/g;
0 ~ 50 nm粒径分布(TEM分析);
结晶度XRD分析显示为无序/非晶态结构;
表面化学成分XPS分析得到% Fe = 30.5, % O = 32.1, % C = 14.5, % B = 22.9;
氧化物厚度(XPS分析)为3 ~ 4 nm;
表面化学(铁0/铁2 += 0.02和Fe2 +/铁3 += 0.38)1;
结果和讨论
影响因素
浮选pH值
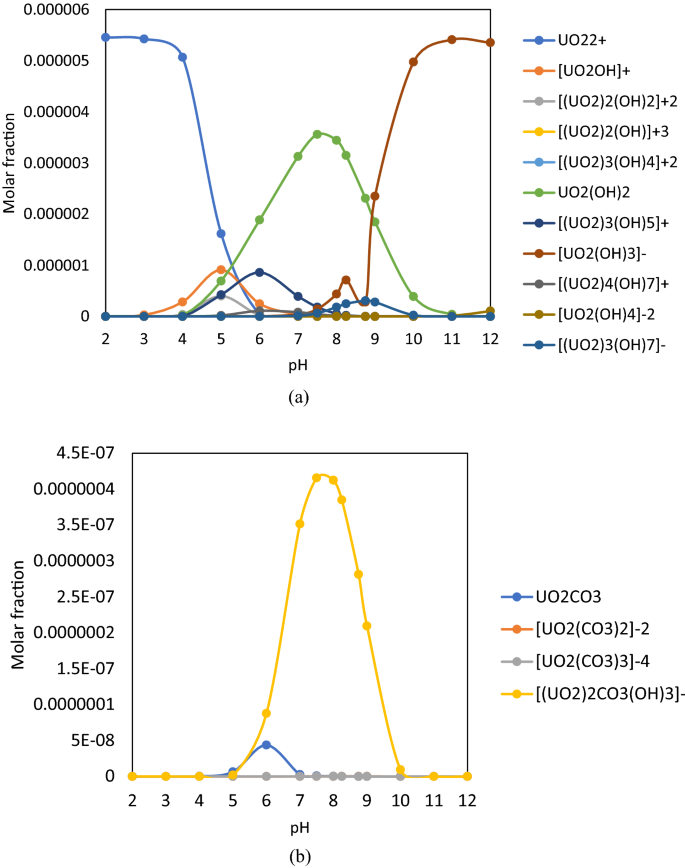
pH值非常重要,因为它决定了稀释水溶液中的电荷、结构和U(VI)种的浓度。1).采用Phreeqc Interactive 3.2.2软件和llnl.dat数据库,仅考虑Na的简单水溶液,计算U(VI)种4[UO2(有限公司3.)3.含有0.042 mM U(VI) (10 mg·L−1U(VI)),分别(实验样品的主要浓度)。pH值在2到12之间,涵盖了所有类型的自然水,如酸性采矿废水和铀矿工业的高酸性水。离子强度由软件测定。
物种计算考虑到简单的水体系只包含简单的化学物质,不添加任何盐,以确保恒定的离子强度。用软件计算离子强度。考虑到所有涉及的物质,摩尔分数的总和是1。摩尔分数非常小的物种没有显示出来。
[U(VI)] = 0.042 mM时得到的曲线与文献一致59.根据图中所示的计算数据。1,在pH 7.0-9.5范围内可能出现的U(VI)为:(a)氢氧根络合物- uo2(哦)2, (UO2(哦)3.]−[(UO2)3.(哦)7]−碳酸络合物- uo2有限公司3., (UO2(有限公司3.)2]−2, (UO2(有限公司3.)3.]−4和[(UO2)2有限公司3.(哦)3.]−与文献一致53,59.由于U(VI)氢氧化物和碳酸盐组分比例不同,分别进行了标绘。
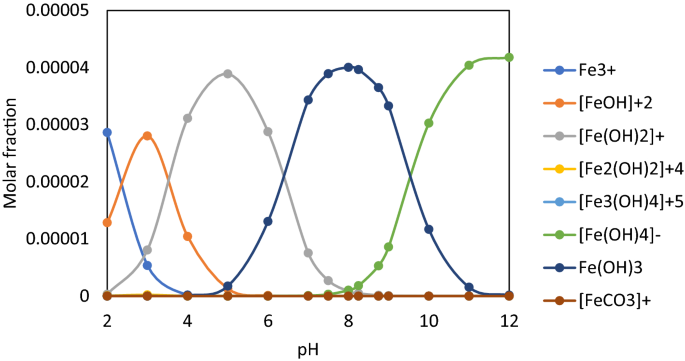
数字2用Phreeqc Interactive 3.2.2软件和llnl.dat数据库计算了吸附剂Fe(III)的种类。
从图中可以看出。2,菲2O3.·nH2O在pH 7.0-9.0之间形成,与[(UO)相同2)2有限公司3.(哦)3.]−和UO2(哦)2.因此,这些物种之间产生了竞争。它们的形成与溶解度乘积(Ksp) Ksp、铁(OH) 3= 4·10-38年< Ksp, UO2 (OH) 2= 1.1·10-22年< Ksp, UO2CO3= 1.8·10-12年< Ksp, FeCO3= 10-10.560,61.
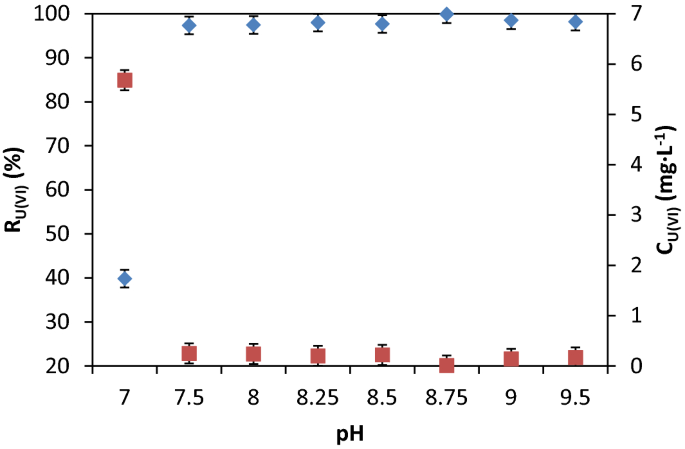
用函数%R = f(pH)研究了pH对吸附-沉淀浮选脱除效率的影响(图1)。3.).
U(VI)样品(200 mL)为10 mg·L−1通过初步试验确定了U(VI)与Fe (III)溶液在摩尔比[U(VI)]: [Fe (III)] = 1:100的条件下接触62在恒定搅拌(250转/分钟)下30分钟,在原位产生吸附剂(Fe2O3.·nH2O)。在最大吸附剂用量对应的pH 7.0-9.5范围内进行pH调整(图5)。4).调整pH值后,在摩尔比[NaOL]: [U(VI)] = 1:1的条件下与表面活性剂(NaOL)接触51,63,转移到浮选池中,以稀释比V稀释样本V:水: = 3:1蒸馏水在压力下,如上所述。分析了U(VI)的残留浓度。
在pH值7.5-9.5范围内,U(VI)的最佳去除率(%R > 98%)非常接近,这可能是通过吸附和/或沉淀研究的U(VI)物种与原位生成的吸附剂物种的物理化学相互作用造成的:[Fe (OH)]2]+、铁(哦)3.和(Fe(哦)4]−在图绘制。2.王等。64证明了吸附剂的表面电荷受老化的影响65原位生成的吸附剂的zeta电位在pH值8左右为正,然后变为负66.
U(VI):吸附剂剂量,[U(VI)]: [Fe(III)]
吸附剂的剂量对于通过吸附/浮选从稀释的水系统中高效去除U(VI)种很重要,可能的相互作用是物理(吸附)或化学(共沉淀)。最佳吸附剂用量是固体废物的最少,但吸附剂载体的最多,以确保最大的效率。
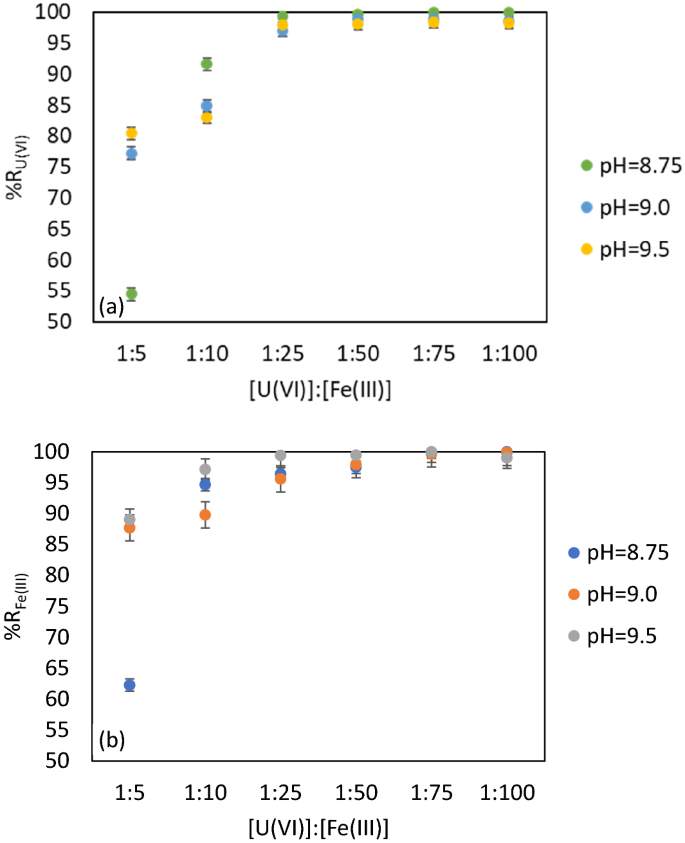
在已知体积0.1 M和0.01 M FeCl的条件下,得到了介于1:5和1:100之间的不同摩尔比[U(VI)]: [Fe(III)]3.解决方案。pH值在7.5-9.5范围内的调整使用0.1 M和0.01 M NaOH溶液。研究的pH值分别为8.5、9.0和9.5(真实矿井水的pH值)。表面活性剂的浓度在所有这些实验中是相同的,以提供最好的固相分离。数字4a、b分别为U(VI)和Fe (III)的残留浓度和回收率。
较低的摩尔比[U(VI)]: [Fe(III)]在1:5到1:25之间是不够的,因为U(VI)的浓度超过了国际水平的法律限制67.根据现行法规,吸附剂-污染物接触面对去除U(VI)无效。
摩尔比[U(VI)]: [Fe (III)] = 1:75, pH = 8.75, 9.0和9.5对应U(VI)和Fe(III)的去除效率的最大值,%R = 99.96% (CU (VI)= 0.0044 mg·L−1和C铁(III)= 0.01 mg·L−1平均值)。
摩尔比,[U(VI)]: [NaOL]
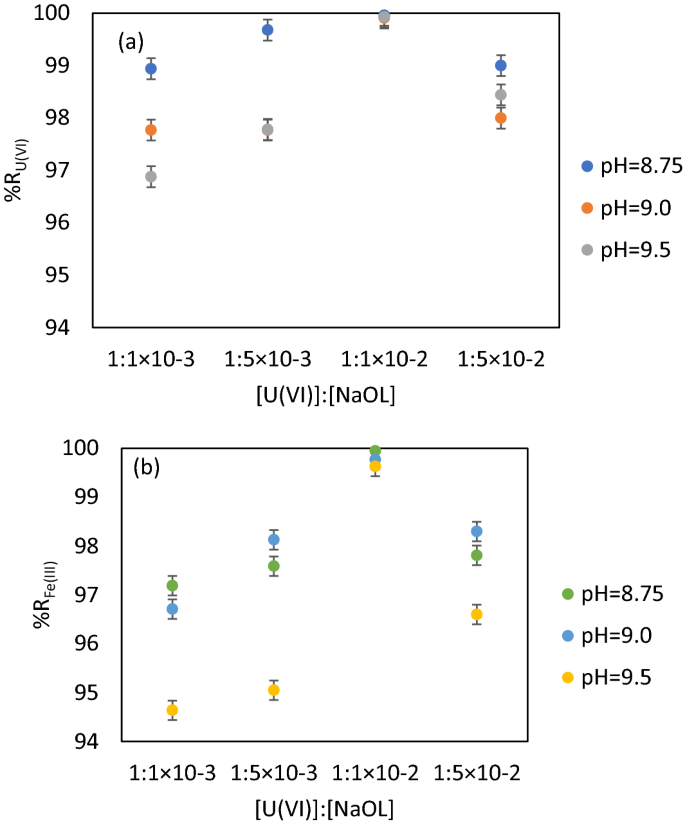
在沉淀浮选中,表面活性剂的消耗为亚化学计量摩尔比。然而,浓度很重要,因为当浓度低于表面活性剂的临界胶束浓度时,可浮性会增加68.
为了使负载U(VI)的吸附剂获得最佳的分离效果,需要确定NaOL的最佳用量,因为NaOL的c链较长,增加了固相的疏水性和可浮性63.油酸钠水溶液种类是pH依赖性的,因此提供了相同的pH值来进行实验。
式中:RH为油酸;R−油酸盐离子;R2H−acid-soap复杂;R2海航是酸皂盐和R22−分别为油酸二聚体。
实验结果如图所示。5.
结果如图5所示。5认为最可靠的摩尔比为[U(VI)]: [NaOL] = 1: 1 × 102.
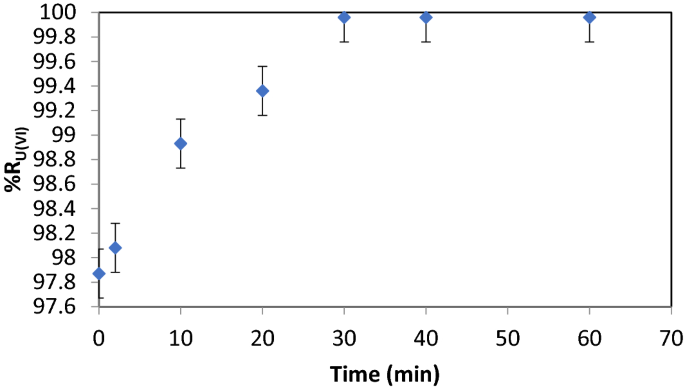
U(VI)与Fe (III)和NaOL的接触时间
接触时间包括原位制备吸附剂所需的时间和pH值调整的时间;测定的工作pH值为8.75,与文献数据一致24,25,69关于Fe的形成2O3.∙n H2O在7.0-9.5范围内析出,如图所示。2.%R值作为接触时间的函数如图所示。6.
可以观察到,30 min后去除效率(%R)达到最大值99.96。接触时间的增加对去除效率没有影响(%R = 99.96)。因此,选择的接触时间是30分钟,因为任何其他更高的值都是不合理的。
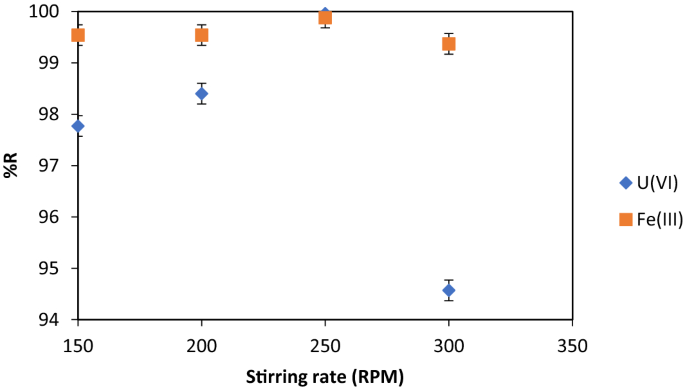
搅拌速度
这个因子在U(VI)在吸附剂上的吸附阶段很重要。高的搅拌速度决定了吸附剂片的尺寸越小,U(VI)去除效率越低。
数字7指出250 RPM是去除U(VI)和Fe (III)的最佳搅拌速率。
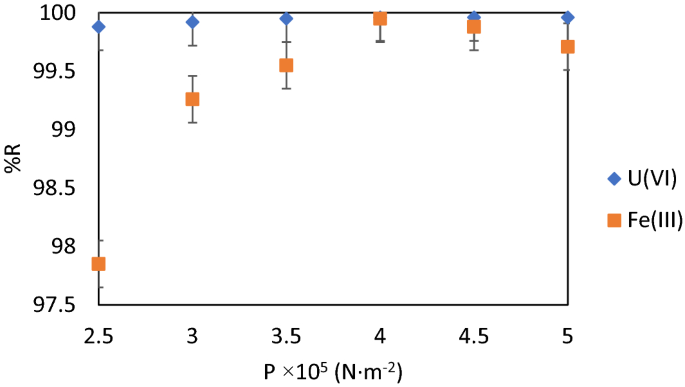
压水容器内的气压(p)
浮选槽的压水容器内的空气压力确保形成均匀的气泡,能够吸起装载U(VI)的固体吸附剂,并确保有足够的上升力使装载的吸附剂集中在浮选槽柱的顶部。因此,较低的气压并不能保证这些条件,反而有利于将装载的吸附剂沉积在浮选槽柱底部的反向过程48,49.较高的空气压力值会产生湍流,对集料气泡加载吸附剂的稳定性产生负面影响。
得到的结果如图所示。8说明气压的最佳工作值为p= 4·105N·m−2,当去除效率最大时:%RU (VI)= 99.96和%R铁(III)分别= 99.95%。
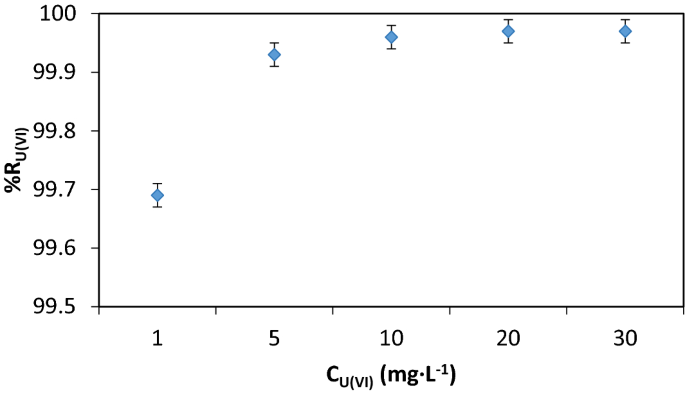
美国(VI)的浓度
污染物浓度的变化对分离效率有重要影响,因为它决定了试剂的消耗和所载吸附剂的体积。
因此,当浓度达到较高值时,所载吸附剂的重量增加,固相的可浮性降低。
数字9U(VI)浓度的增加对脱除效率的影响。增加到99.96%,然后略有下降,浓度大于20 mg·L−1.
最优参数
根据吸附/浮选过程的不同阶段,最佳参数(在最大去除效率%R时)为:
U(VI)浓度10 mg L−1;
浮选pH值为7.5-9.5;
U (VI):吸附剂剂量,[U (VI)]:[铁(III)] = 1: 75;
U(VI)与Fe(III)接触时间= 25分钟;
搅拌速率= 250转/分;
摩尔比[U(VI)]: [NaOL] = 1: 1 × 102;
U(VI)与Fe(III)和NaOL的接触时间= 5分钟;
空气压力,p= 4 × 105N m−2;
浮选时间= 5分钟。
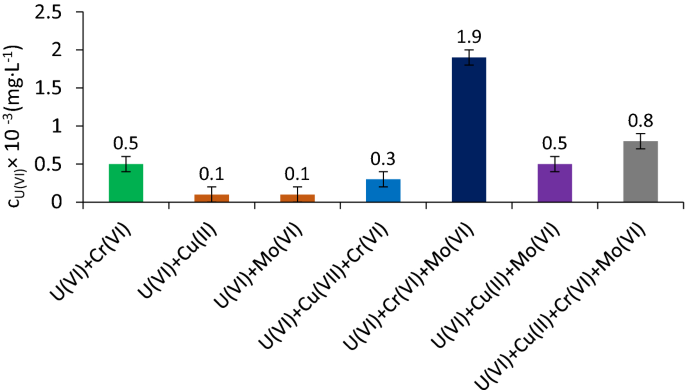
伴随重金属离子的干扰
七个样品(V样本= 200 mL),加入U(VI)、Cu (II)、Cr (VI)、Mo (VI) 10 mg·L−1在上述工作参数的最优值下进行吸附/沉淀浮选,以观察各离子种之间的相互作用。结果表明,在多组分溶液中,Cu(II)和Fe(III)析出,U(VI)可以被吸附和/或析出。Mo (VI)和Cr (VI)也可以吸附在Fe上2O3.∙n H2O在原地生成。
对于Cu(II),得到的结果表明,在工作pH = 8.75时,它以Cu(OH)的形式析出。249,70,71,72.
析出相的形成顺序是从最低的到最易溶的产物,即Fe(OH)3.(Ksp= 2.79 × 10-39年) < UO2(哦)2(Ksp= 1.1 × 10-20年) < UO2有限公司3.(Ksp= 1.8 × 10-12年) < CuCO3.(Ksp= 1.4 × 10-10年)49,60,61,70,71,72,根据前面所述的原则(3.1.1)。
工作pH = 8.75时Cr(VI)的主要形态为CrO42−根据文献73,74.
就Mo (VI)物种而言,研究人员指出其可能的主要物种形态为MoO42−当pH = 7时,其余两种溶液的浓度为H2MoO4和HMoO4−,非常低75.
数字10显示了伴随离子对吸附/沉淀浮选去除U(VI)的影响。可以观察到,当Cu (II)和Mo (VI)在双组分体系中伴随U(VI)时,与Cr (VI)不同,U(VI)的吸附不受Cu (II)和Mo (VI)的影响,从而降低了U(VI)的去除效率。
通过吸附-沉淀浮选过程,考虑到溶液中U(VI)的残留浓度在0.1 ~ 1.9µg·L范围内,U(VI)的去除率非常高(%R > 99)−1远远低于最高允许的法定浓度(0.02 mg·L−1)的规定。
其他研究表明U(VI)的水溶液与原位产生的吸附剂中的重金属相互作用,指出了稀水溶液中的主要金属离子形态,这与研究结果相似。
Riba等人的研究表明,当[U(VI)] = 4.2 mM (10 mg·L)时,溶液的温度会降低−1)与1.2% O接触2 (g)和0.017%的公司2 (g)在pH值为8至9的范围内,优势种为[UO2(有限公司3.)3.]4−和[UO2(有限公司3.)2]2−25.
Wanze出版社。[U(VI)] = 4.2 × 106M溶于0.01 M NaCl溶液中,存在碳酸盐[CO]3.2−= 1 × 10−2有相同的优势物种69.
“哞”的存在42−[Mo (VI)] = 0.3和1 mM (3 mg/L和100 mg/L)的体系在pH值为2到7的情况下,Mitchell进行了验证75.
根据Matis和Mavros,在含Cu(II) = 10 mg/L的稀释水溶液中,pH值为8到10时,Cu(OH)会析出。233.
对于[Cr (VI)]介于1046 × 10−4M在pH 1 ~ 12范围内,优势物种为CrO42−74,76.
得到的结果证明金属之间存在竞争离子离子种类的存在是为了与电荷结合在吸附剂的活性表面74.由于吸附剂的零吸附点随Fe含量的增加而变化2O3.∙n H2O64结果表明,水溶液中Cu (II)析出物和Cr (VI)、Mo (VI)析出物通过吸附析出。实验结果表明,U(VI)有可能以碳酸盐络合物的形式静电结合在吸附剂的带电表面上。
实验结果表明,伴随的重金属对分离效率影响不大。
通过对U(VI)分离效率最高的影响因素的研究,得出了吸附-沉淀浮选分离U(VI)的最佳工作参数为:pH 7.0 ~ 9.5,搅拌速率250 RPM,接触时间30 min,摩尔比[U(VI)]: [Fe(III)]: [NaOL] = 1:75: 1 × 102, p = 4·105N·m−2,稀释比V样本V:水= 3:1,浮选时间5分钟,取决于初始浓度范围U(VI) = 1 - 30 mg·L−1.
建立的合成水体系的最佳工作条件在实际矿井水样上进行了验证,取得了很好的效果。
吸附剂与U(VI)及伴随的重金属的相互作用
对在最佳吸附/沉淀浮选工艺条件下获得的2个样品进行了FT-IR光谱分析,得到了U(VI)与吸附剂相互作用的初步数据2O3.∙nH2O和2-Fe样品2O3.∙nH2O与U(VI)的碳酸配合物。
两个光谱都包括3400厘米−1红外波段可以分配给H2O分子或涂层表面的氢键OH基团,而3037 cm−1红外带是由于α-FeOOH中OH拉伸模式的存在和相应的突出峰H2O在1620 cm附近配位或吸附−177.
U(VI)碳酸盐络合物离子在吸附剂上的固定,在653 cm处观察到离子的移动−1到626厘米−1在示例2中。pH = 8.0附近的正电位值似乎支持这一说法66.
表格1给出了U(VI)与Cr(VI)、Cu(II)、Mo(VI)经吸附/沉淀浮选分离后的扬子盐的特征带。
所有FT-IR光谱特征带见表1呈现以下特定峰值:
在3000-3650厘米−1范围归因于伴生和非伴生羟基;
在1620-1634厘米−1范围取决于水吸附在原位生成的铁上2O3.·nH2O表面;
特征带在1500厘米左右−1数值归因于碳酸盐离子的拉伸振动,这是存在的我(Fe(III)) 1486 cm−1,因为一个(Fe(III) + U(VI)) 1521 cm-1,因为B(Fe(III) + U(VI) + Cr(VI)))在1542 cm处−1,因为C(Fe(III) + U(VI) + Cu(II)))在1512 cm处−1,因为E(Fe(III) + U(VI) + Mo(VI)))在1518 cm处−1,因为D(铁(III) + U (VI) +铬(VI) +铜(II)与肩膀在1519厘米−1,因为F(铁(III) + U (VI) +铬(VI) +钼(VI))与肩膀在1540厘米−1,因为G(铁(III) + U (VI) +铜(II) +钼(VI))与肩膀在1526厘米−1和H(铁(III) + U (VI) +铬(VI) +铜(II) +钼(VI)) 1512厘米−1;
特征带在1400厘米左右−1值可能与FeOOH的变形振动键有关,除样品外所有样品中都存在我(Fe(III))表明U(VI)、Cr(VI)和Mo(VI)可能结合在吸附剂表面,Cu(II)可能在工作pH下以碳酸铜的形式析出;
特征带在703 cm处−1由于νFe-O存在于一个(Fe (III) + U(VI))和B(Fe (III) + U(VI) + Cr (VI))样品,似乎表明U(VI)键合在原位生成的吸附剂上的可能性;
特征条带在682 cm处−1, 647厘米−1、612厘米−1归因于δFe-O从样本我(Fe (III))似乎指出了U(VI)和伴生元素离子成键的活性位点的存在;
络合物的能带特性[(UO2)2(哦)2]2 ++有限公司3.2−只出现在系统中:C(Fe(III) + U(VI) + Cu(II)))在683 cm处−1;E(Fe(III) + U(VI) + Mo(VI)))在690 cm处−1而且F(Fe(III) + U(VI) + Cr(VI) + Mo(VI)))在683 cm处−1;
乐队的δ菲−O和ν菲−O也向较低的值转移,表明化学吸附也可能在这个水平上存在。
FT-IR光谱分析表明,有可能存在[(UO)2)2(哦)2]2 +有限公司3.2−考虑到包括化学吸附在内的反应动力学是拟二级的配合物的形成。同时在工作pH下,Cu (II)可以析出,Cr (VI)和Mo (VI)被吸附在Fe (III)氢氧化物上50,74.
表格2示为U(VI)与Cr (VI)、Cu (II)、Mo (VI)的吸附/沉淀浮选分离后的废液“热分析”结果。
TG/DTG/DTA曲线分析表明,在双组分、三组分和四组分体系中,扬子盐在空气气氛中的非等热降解过程。样品经过三次连续的分解和失水过程(见表2).
第一个吸热过程(20-120°C)指出水分的完全损失。所分析的样品呈现相似的水分。这个阶段的减重量大约是Δm1= 4.57-6.21%,最高温度范围为97.1-109.3°C。
样品在120-250℃的温度范围内似乎是稳定的。接下来是第二步分解过程,即放热(250-350°C),这是主要的降解阶段,失重Δm2= 6.14-8.07%,在273.0-281.0°C和304.1-347.5°C的最高温度范围内。
在较高的温度(350-900°C)下,非挥发性产物热氧化分解的最后一个放热过程发生在第二降解阶段。
在513.7-620.9°C范围内的所有情况下,相似残余权重Δm3.= 1.35 ~ 2.06%指出所研究的金属离子氧化物混合物的存在。
真实矿井水样的重现性和最优参数验证
吸附/沉淀浮选脱除U(VI)的可重复性
之前确定的吸附/沉淀浮选技术的最佳参数在10个相同的样品溶液(Co= 10 mg/L)对应两种不同摩尔比([U(VI)]: [Fe (III)]: [NaOL] = 1:75: 1 × 102和1:100:1 × 102),分别用Student法计算U(VI)去除再现性(表3.).
真实矿井水样的最优参数验证
矿井水样本(MW1-MW3)是从巴纳特地区一个以前的铀矿场收集的,其化学成分见表4.按照所提出的流程进行处理(图5)。12)分别进行pH调节和不进行pH调节。用0.1 M HCl溶液调整pH至8.75工作值。
结果表明,调整pH值后U(VI)的去除率更高,吸附浮选非常有效(图1)。11).
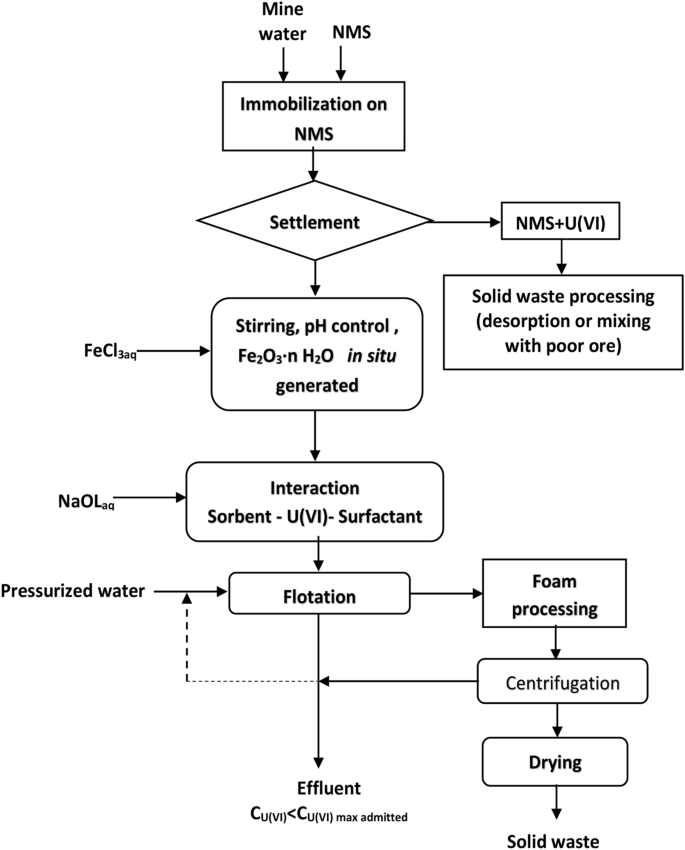
数字12总结了吸附浮选多污染水体系的工艺流程图。
采用吸附浮选法处理多组分体系的分离方案与所研究的体系相适应51.
在不调整pH值的情况下,样品MW1的分离效率为96.6%,样品MW2和MW3的分离效率分别为97.2。13).
当pH值调整为8.75时,用0.1 M HCl溶液%R处理样品U (VI)MW1C-MW3C样品得到> 99(图。13).
可以注意到,ph调整后的样品U(VI)去除率高于其他样品,证实了之前研究的参数的最佳值。
所产生的固体废物可作为制造核燃料的U(VI)次源储存或回收。
采用两种不同的方法,在真实水样上对串联固定化工艺的最佳参数进行了验证:
- 一个。
无需调整pH值和添加吸附剂:真实水样的化学成分如表所示4(300 mL) MW1-MW3预处理0.15 g NMS,在250 RPM搅拌下接触30 min。固相通过倒馏分离。对所得液相,MW1i-MW3i,适宜量为0.25 × 10−3加入M NaOL溶液,在不调整pH和不添加FeCl的情况下进行浮选3.0.1 M,因为Fe2 +和菲3 +在过滤后的溶液中使用NMS提供的作为吸附载体。浮选后的水样MW1f.-MW3f .。获得(无花果。14).
- b。
pH值调整和吸附剂添加:真实水样的化学成分如表所示4(300 mL) MW1-MW3与0.15 g NMS在250 RPM搅拌下预处理30 min。固相通过倒馏分离。对得到的液相MW1i-MW3i,使用0.1 M FeCl调整pH3.溶液中避免加入外来离子,适量为0.25 × 10−3加入M NaOL溶液,浮选样品后得到MW1c-MW3c(图1)。15).
数字13为真实水样固定浮选后的U(VI)残留含量。
两种分离方案的版本,使用了两种U(VI)去除方法,结果如下:一种没有pH调节,也没有铁的原位生成2O3.·nH2O(无花果。14)和另一个pH值调整和原位铁2O3.·nH2O(图生成。15).
在实际水样上的实验结果表明,吸附-沉淀浮选分离U(VI)既可以作为一种单独的方法,也可以作为Fe0基纳米材料被就地使用。
结论
本文研究了一种高效的脱除过程,即在原位生成的吸附剂(Fe)上吸附,以脱除铀工业多组分水体系中特有的U(VI)和一些相关金属离子的可能性2O3.∙nH2O),然后上市(%RU (VI)R和%铁(III)> 99)在工作条件下我,你(VI)= 10 mg∙L−1pH值范围= 7.5 - -9.5,[U (VI)]:[铁(III)] = 1: 75年,接触时间= 30分钟,搅拌速度= 250 RPM, [U (VI)]: [NaOL] = 1: 1×102, p = 4 × 105N∙m−2,浮选时间= 5 min.)。
在建立分离过程中,考虑了存在的物种、可能的相互作用和可能参与该过程的物种(pH值为7.0-9.5)2(哦)2, (UO2(哦)3.]−和[(UO2)3.(哦)7]−), U(VI)碳酸盐配合物(UO2有限公司3., (UO2(有限公司3.)2]−2, (UO2(有限公司3.)3.]−4和[(UO2)2有限公司3.(哦)3.]−), Fe(III)氢氧根络合物(Fe2O3.∙nH2O)。
为了解释分离机理,我们注册了FTIR光谱(范围400-4000 cm)−1)和固体的衍生图(范围20-1000°C), U(VI)集中在泡沫(扬子盐)中。因此,红外光谱分析指出了络合物形成的可能性2)2(哦)2]2 +有限公司3.2−,它可能与在NMS上固定时形成的Fe (III)氧氢氧化物结合,(如果通过预先处理水体系和固定在铁基纳米材料上的串联浮选过程)/或在原位生成Fe2O3.·n H2还有在沉淀浮选过程中形成的O吸附剂。
将该方法应用于经NMS (Fe)预处理的实际样品0基纳米材料),无需pH调整和FeCl3.此外,用倒馏法分离了负载金属离子的固相。分离效率大于99%。
将该方法应用于经NMS (Fe)预处理的实际样品0基纳米材料),具有pH调节和FeCl3.此外,用倒馏法分离了负载金属离子的固相。通过添加FeCl将沉淀后的水相pH调整为pH = 8.753.解决方案。在原位生成吸附剂,将其与固定在NMS上的金属离子加载,最后进入浮选阶段。分离效率大于99%。
多组分真实矿井水样的最优参数验证及铁的能力2O3.∙nH2O与多种金属形态相互作用的研究表明,吸附-沉淀串联浮选在修复技术中是一种优势互补,是该领域的一种新技术。
数据可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
参考文献
Crane, R. A., Dickinson, M., Popescu, i.c. & Scott, T. B.磁铁矿和零价铁纳米颗粒用于铀污染环境水的修复。水Res。45, 2391 - 2942(2011)。
毕利卡,波雅诺夫斯卡,维涅夫斯基。铬污染物与生物元素的两面性。波尔。j .包围。钉。14(1) 5 - 10(2005)。
纽瑟姆,L.,莫里斯,K.和劳埃德,R.铀和其他优先放射性核素的生物地球化学和生物修复。化学。青烟。363, 164 - 184(2014)。
波拉特,埃尔多安。离子浮选法去除废水中的重金属。j .风险。板牙。148(1 - 2), 267 - 273(2007)。
Crane, R. A., Pullin, H. & Scott, t.b .钙、钠和碳酸氢盐对铀在纳米级零价铁纳米颗粒上吸收的影响。化学。Eng。J。277, 252 - 259(2015)。
库尼亚万,陈天安,陈国贤,罗炜华。含重金属废水的物理化学处理技术。化学。Eng。J。118(1 - 2), 83 - 98(2006)。
Aydin, F. A. and Soylak, M.一种新的多元素共沉淀法分离环境样品中的金属离子,Talanta 134-141 (2007)
陈格鲁彻,M. S., Barakat, M.碳酸铀酰铵(AUC)的沉淀:热力学和动力学研究。湿法冶金术85, 163 - 171(2007)。
傅峰,王强。废水中重金属离子的去除研究进展。j .包围。等内容。92, 407 - 418(2011)。
王立凯,Vaccari, d.a, Li, Yang, Shammas, N. K.2005,第5章《环境工程手册》第3卷:物理化学处理过程。Hung和n.k. Shammas©The Humana Press Inc., Totowa, NJ, 143-197。
改进的生物材料基阳离子交换器吸附水和核工业废水中的铀(VI)的性能。j .包围。Radioact。One hundred., 250 - 257(2009)。
使用茜素红S (ARS)改性阴离子交换树脂或通过浮选U-ARS螯合物选择性分离铀。9月,科学。抛光工艺。33(14), 2123 - 2141(1998)。
里奇,g.m.,阿什布鲁克,A.W.溶剂萃取公司。过程冶金原理与应用,Elsevier,阿姆斯特丹(1984)
Yonghui Y。et al。伯胺N反胶束萃取铀(六)的研究1923.j . Radioanal。化学。222(1 - 2), 239 - 241(1997)。
端羧基聚甲基丙烯酸接枝壳聚糖/膨润土复合材料的合成、表征及其在水介质中铀(VI)回收中的应用”。j .包围。Radioact。1068-19(2012)。
Demirel, N., Merdivan, M., Pirinccioglu, N. & Hamami, C.浸渍在聚合物载体上的八ta羧甲基- c -甲基杯[4]间苯二酚对钍(IV)和铀(VI)的吸附研究。分析化学学报485, 213 - 219(2003)。
含壳质/壳聚糖材料在铀回收中的潜力:跨学科综述。Carbohydr。变异较大。8454 - 63(2011)。
尼尔奇,德哈根,t.s.和加马洛迪,s.r.结晶氧化锡纳米颗粒从水溶液中吸附铀和钍离子的动力学、等温线和热力学。海水淡化321, 67 - 71(2013)。
Yusan, S。et al。U(VI)在Tendurek火山凝灰岩上的吸附和热力学行为。j . Radioanal。诊断。化学。283, 231 - 238(2010)。
福汀,杜特尔,加尼尔-拉氏,J.铀的络合和被绿藻吸收与化学形态的关系:游离铀酰离子的重要性。环绕。Toxicol。化学。23(4), 974 - 981(2004)。
Kazy, s.k, Souza, s.f. & Sar, P.铀和钍的隔离假单胞菌Sp:机理和化学表征。j .风险。板牙。163, 65 - 72(2009)。
巴纳托,拉格纳斯多蒂尔,K. V.艾伦,G. F.钛表面铀(VI)和铅(II)的去除2用x射线光电子能谱、水、空气和土壤污染研究纳米管。水、空气、土壤污染2012(223), 3845 - 3857(2012)。
Crane, R. A, Dickinson, M. & Scott, T. B.用于修复钚和铀污染溶液的纳米级零价铁纳米颗粒。化学。Eng。J。262, 319 - 325(2015)。
诺巴特普,Caré, S. & Crane, R.用于环境修复的纳米金属铁:前景和局限性。水、空气、土壤污染。223(3), 1363 - 1382(2012)。
Riba, O., Scott, t.b, Ragnarsdottir, K. V. & Allen, G. C.铀酰在零价铁纳米粒子存在下的反应机理。Geochim。Cosmochim。学报72, 4047 - 4057(2008)。
Scott t.b., Popescu, i.c., Crane, R. A. & Noubactep, C.用于处理含有多种无机污染物的溶液的纳米尺度金属铁。j .风险。板牙。186, 280 - 287(2011)。
Elwakeel, K. Z., Atia, A. A. & Guibal, E.用四乙五胺修饰的磁性壳聚糖树脂快速去除水溶液中的铀。Bioresour。抛光工艺。160, 107 - 114(2014)。
埃尔韦克尔,K. Z.和阿提亚。磁性席夫碱壳聚糖复合物从水介质中吸收U(VI)。j .干净。刺激。70, 292 - 302(2014)。
Elwakeel, K. Z., Hamza, M. F. & Guibal, E.搅拌模式(机械、超声和微波)对氨基和双硫腙功能化磁性壳聚糖杂化材料对铀吸附的影响。化学。Eng。J。411128553(2021)。
哈姆扎,m F。et al。瓜尔胶/磁铁矿/壳聚糖纳米复合材料对铀(VI)的吸附和抗菌应用。分子26, 1920年。https://doi.org/10.3390/molecule26071920(2021)。
哈姆扎,m F。et al。用尿素或硫脲基聚合物功能化的硅珠回收U(VI)和Th(IV):在矿石渗滤液中的应用。科学。总环境。821153184(2022)。
离子浮选——它在湿法冶金作业中的潜力。Int。j .最低Proc。72, 387 - 399(2003)。
马蒂斯,K. A.和马夫罗斯,P.离子浮选法从稀水溶液中回收金属。9月,咕噜咕噜叫。牧师。20.(1), 1(1991)。
Zouboulis, a.i. & Matis。环境技术中的离子浮选。光化层16(2 - 3), 623 - 631(1987)。
Walkowiak, W., Maciejewski, P., Ulewicz, M., kozkowski, C.大环化合物离子浮选:综述,XIX-Th ARS separatoria - zzootypotok,波兰,58-65 (2004)
Shakir, K. Benyamin, K. & Aziz, M.用8-喹啉和表面活性剂沉淀法从水溶液中分离U(V1)。可以。j .化学。6251-55(1984)。
拉扎里迪斯,北K, Hourzemanoglou, A. & Matis, K. A.载金属粘土阴离子交换剂的浮选。第二部分:砷酸盐案件。光化层47(3), 319 - 324(2002)。
马蒂斯,K. A. Zouboulis, A. I. & Lazaridis, N. K.用生物吸附和浮选去除重金属。水、空气、土壤污染。:专注3., 143 - 151(2003)。
马蒂斯,K. A. Zouboulis, A. I. Lazaridis, N. K.和汉考克,I. C.吸附浮选回收金属离子。Int。j .最低Proc。70(1 - 4), 99 - 108(2003)。
Matis, K. A., Zouboulis, A. I., Gallios, G. P., Erwe, T. & Blöcher, C.浮选在分离载金属沸石中的应用。光化层55(1), 65 - 72(2004)。
卢比奥,王晓明,王晓明。吸附颗粒浮选去除重金属离子的研究。分钟。英格。10(7), 671 - 679(1997)。
高鹏,陈晓霞,沈峰,陈刚。无滤池电絮凝-电浮联合去除废水中的铬(VI)。9月,Purif。抛光工艺。43, 117 - 123(2005)。
t.i.奥布申科,阿斯特林,i.m.,托尔斯托洛娃,n.m.,瓦巴内茨,m.a. &康德拉托科,t.a.用浮选法处理有毒金属废水。j .水。化学。抛光工艺。30.(4), 241 - 245(2008)。
Perlova, o.v . & Shirlova, a.a .铀(VI)从有电解质添加剂的稀水溶液中浮选萃取分离(俄语)。敖德萨国立大学先驱学院15(13) 86 - 96(2010)。
A. Mamoukaris, S. Mimis, E. Karakolios, K. Xipolitos & G. Atsioura .废水处理中对环境友好的新方法。j .包围。普罗特。生态。15(3), 1021 - 1027(2014)。
米兰达,R。et al。壳聚糖溶解气浮法处理造纸废水的效果。化学。Eng。J。231, 304 - 313(2013)。
帕拉尼迪,阿德兰,M. N.,阿齐兹,H. A.和默谢德,M. F.溶解气浮(DAF)在半好氧渗滤液处理中的应用。化学。Eng。J。157(2 - 3), 316 - 322(2010)。
斯多伊卡,L.,康斯坦丁,C.和拉卡图苏,从污染的水系统中分离重金属离子的收集器试剂。j .包围。普罗特。生态。13(2), 486 - 496(2012)。
斯托伊卡,L.和康斯坦丁C.水系统的净化,良好实践手册(Depoluarea sistemelor apoase, Ghid de buna practicak)(罗马尼亚文),卷。1, Politehnica出版社,布加勒斯特,罗马尼亚(2010)
Stoica, L., Jitaru, I., Georgescu, D., Filip, D., Razvan, A., Petrescu, S.从铀矿石加工的水残留溶液中回收钼,铀开采和水文地质,Freiberg, Germania, ISBN 3-87361- 267-4,319 - 330 (1998)
离子型和分子浮选,理论、方法和应用(flotaagiia ioniconia qi molecularonia Bazele teoretice, metode yi aplicaielii),(罗马尼亚文),Editura didacticska ii pedagogiconia出版社,布加勒斯特,罗马尼亚(1997)
斯多伊卡,L.,卡图尼亚努,R. &菲利普,Gh。用溶解气浮法去污含有放射性物质的溶液。水。Res。29(9), 2108 - 2112(1995)。
Krestou, A.和Panias, D. UO的铀(VI)形态图22 +/公司3.2−/小时2《欧洲矿物加工与环境保护杂志》第4卷第2期1303-0868页113-129 (2004)
哈希姆,穆克霍帕德耶,萨胡,J. N.,森古普塔,B.重金属污染地下水的修复技术。j .包围。等内容。92, 2355 - 2388(2011)。
世卫组织,1989年。对某些食品添加剂和污染物的评价,粮农组织/世卫组织食品添加剂联合专家委员会第三十三份报告,世界卫生组织776号技术报告系列,日内瓦,1989年,ISBN 92 4 120776 0, ISSN 0512- 3054,25
Popescu (Hostuc), i.c., Stoica, L., Constantin, C. & Stanescu, A.M.吸附U(VI)aq的平衡与动力学原位生成的铁2O3.·n H2O. Rev. de Chimie, 70(10), 3482-3485 (2019)
威特,T. D.,戴维斯,J. A.,佩恩,T. E.,威楚纳斯,G. A.,徐宁。铀(VI)在铁氧体上的吸附:表面络合模型的应用。Geochim。Cosmochim。学报58, 5465 - 5478(1994)。
阿根,杜荪,欧兹德米尔,陈文华,陈文华。改性橡木木屑对重金属的吸附。热力学和动力学。j .风险。板牙。141, 77 - 85(2007)。
溪,C.K.-D。铀酰在铁氧氢氧化物上的吸附:表面络合位点-定位模型的应用。地球化学与宇宙化学学报49, 1931 - 1941(1985)。
斯托伊卡,L.和康斯坦丁,2010。水介质的净化。良好实践指南(Depoluarea系统)。Ghid de buna practica),《罗马尼亚》,2010年第1卷,布加勒斯特理工出版社
IUPAC溶解度数据项目:溶解度数据系列,国际纯与应用化学联盟,牛津佩加蒙出版社(1979-1992)
Scott, t.b., Popescu, i.c., Crane, R.A., Noubactep, C.用于处理含有多种无机污染物的溶液的纳米尺度金属铁,J Hazard Mater. 186(1), 280-287 doi:https://doi.org/10.1016/j.jhazmat.2010.10.113(2011)
库尔卡尼,R. D.和索马森达兰,P.赤铁矿/油酸体系的浮选化学。胶体冲浪。1, 387 - 405(1980)。
C N。,许,朱,L,曾,年代,许,j。金属氧化物纳米颗粒浓度对zeta电位的影响,中国化学工程学报,407,22-28 (2013)
拉汉,r.w., 1976。老化氢氧化铁的表面电荷变化,粘土和粘土矿物,24,320-326。帕加马出版社1976年。在英国印刷。
Heinänen,李永明,李永明。溶解气浮法在芬兰饮用水处理中的应用。水科学。抛光工艺。31(3 - 4), 225 - 238(1995)。
《世卫组织饮用水质量准则》制定背景文件(2012年)
Leja, i . 1982。泡沫浮选的表面化学,静压,纽约。
王志强,李志强,李志强,等。碳酸盐岩对氢氧化铁吸附六价铀的影响。环绕。科学。抛光工艺。37, 3619 - 3624(2003)。
博伊德,公元2015年。第3章水质的基础化学、溶解度和化学平衡综述:导论,第2版,施普林格国际出版社,瑞士。
R.科内利斯,J.卡鲁索,H.克鲁斯,H.休曼,K. 2005。第5章《元素物种手册ii -环境、食品、医药和职业健康中的物种》中的锕系元素,Wiley,英国,521-534。
第8节《兰格化学手册》中的电解质、电动势和化学平衡,第15版,由麦格劳-希尔公司印刷。美国,841 - 856 (1999)
张志军,张建军,徐旭。铁金属去除模拟污染地下水中Cr (VI)的研究。Saf过程。环绕。普罗特。87, 395 - 400(2009)。
Aoki T.和Munemori M.用氢氧化铁(III)从废水中回收铬(VI)——铬(VI)在氢氧化铁(III)上的吸附机理。水Res。16, 793 - 796(1982)。
水中钼化合物的形态紫外光谱和REACH解读国际钼协会报告REACH钼联盟,1-28 (2009)
Sena, m.m., Scarminio, i.s, Collins, K. E. & Collins, c.h.在q -模因子分析和斜投影的辅助下,铬水溶液(VI)的形态。Talanta53, 453 - 461(2000)。
萨里奇,A., Music, S. &野村,K.乌洛托品对FeCl铁氧化物的影响3.解决方案。克罗地亚人。化学。学报71(4), 1019 - 1038(1998)。
Avram, M., Mateescu, Gh.。红外光谱法。在有机化学中的应用(“Spectroscopia în Infrarosu。aplicaaviii în Chimia organicha”),罗马尼亚文,布加勒斯特(1966)
Fedoseev, A.M.等。碱性介质中Pu(IV,VI)氢氧化物/氧化物与金属氢氧化物/氧化物的相互作用。报告没有。PNNL-11900,太平洋西北国家实验室,Richland, WA (1998)
杨晓明,张晓明,张晓明,等。乙醇-异丁醇混合溶剂合成水葫芦羧甲基纤维素(CMC)的研究。Int。j .化学。Eng。达成。5(1) 36-40(2014)。
Singh, R., Misra, V. & Singh, R. P.零价铁纳米粒子的合成、表征及其在去除含铬土壤中六价铬中的作用。j . Nanopart。Res。13, 4063 - 4073(2011)。
王俊,杨建平。羧甲基纤维素在固液界面的吸附和构象的光谱、AFM及相关技术研究。胶体界面科学。291, 75 - 83(2005)。
安德拉德,a . L。et al。溶胶-凝胶法合成二氧化硅包覆磁性纳米颗粒及表征。陶瓷55, 420 - 424(2009)。
Nakamoto, k(2009)。无机和配位化合物的红外和拉曼光谱,第6版,威利,新泽西州。
Niculescu M。et al。1,2-乙醇与金属硝酸盐反应得到Ni(II) - Fe(III)杂多核配位化合物的热和光谱研究。启Roum。詹。58(6), 543 - 552(2013)。
钌离子对α- FeOOH、α- fe沉淀的影响2O3.和菲3.O4在高碱性介质中。j .合金化合物。416, 284 - 290(2006)。
基思,l.s.,法伦,O. M.和福勒,B. A., 2015。铀:金属毒理学手册第4版,爱思唯尔。
Madhavi, V., Prasad, T. N. V. K. V. & Madhavi, G.铁基微粒子和纳米颗粒的合成和光谱表征。伊朗。j .能源环境。4(4), 385 - 390(2013)。
确认
我们要感谢布加勒斯特“理工大学”、应用化学和材料科学系、无机化学、物理化学和电化学系以及国家金属和放射性资源研发研究所(INCDMRR-ICPMRR,布加勒斯特,罗马尼亚)工作人员对这项工作的支持。我们还要感谢布里斯托大学界面分析中心的Thomas B. Scott教授和Richard A. Crane博士为我们提供的铁基纳米材料。我们也想对审稿人的辛勤工作表示感谢,他们帮助我们提供了非常鼓舞人心的推荐、建设性和客观的批评、中肯的问题和评论。因此,对话是非常活跃和富有成效的,为最好的科学创造了友好的氛围。
作者信息
作者和联系
贡献
c、l、s、i、c。P.撰写了主要的手稿文本并准备了数据。O.O.进行TG-DTA分析。所有的作者都审阅了手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于这篇文章
引用这篇文章
康斯坦丁,C,波佩斯库,IC.,奥普拉,O。et al。U(VI)从稀释的水溶液中吸附-浮选去除。Sci代表1216951(2022)。https://doi.org/10.1038/s41598-022-19002-0
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-19002-0

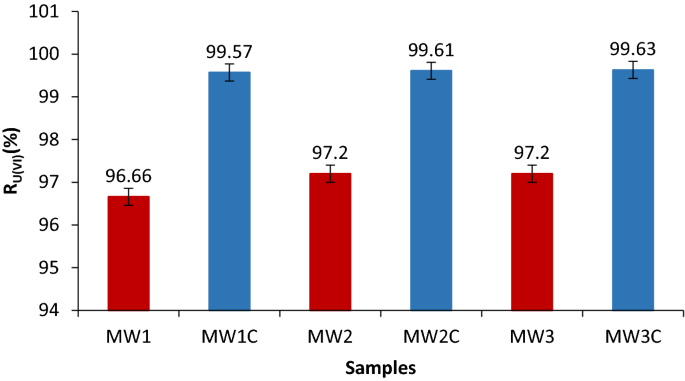
 mw1 - mw3样品没有pH调整和
mw1 - mw3样品没有pH调整和 mw1c - mw3c - pH调节样品。
mw1c - mw3c - pH调节样品。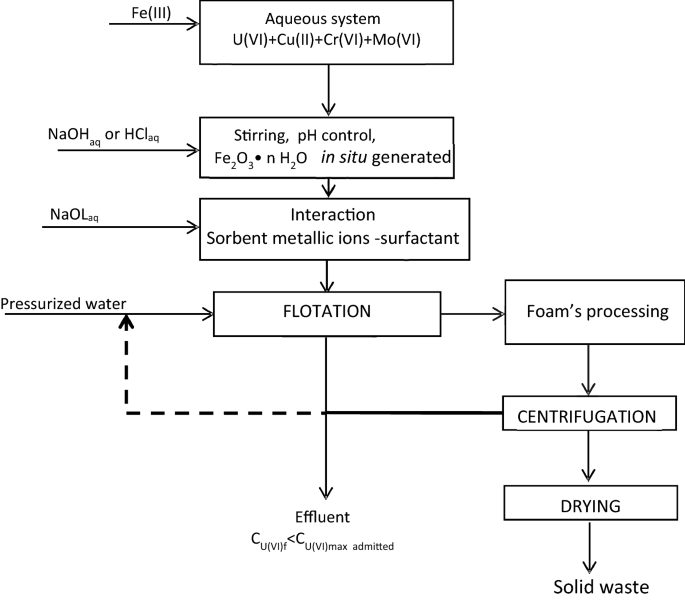
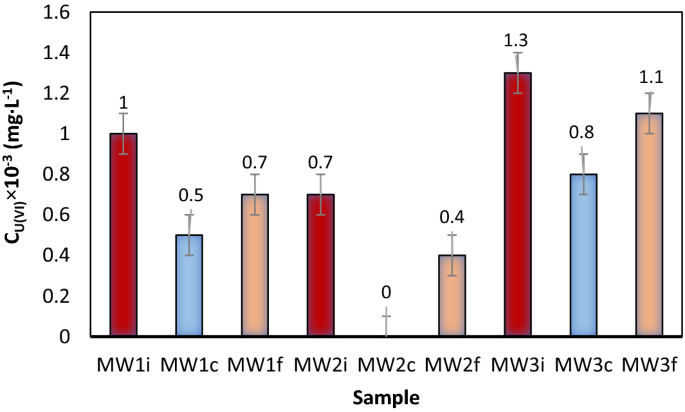
 MW1i-MW3i是NMS上固定后形成的液相;
MW1i-MW3i是NMS上固定后形成的液相; MW1c-MW3c是用FeCl调节pH值的液相3.0.1;
MW1c-MW3c是用FeCl调节pH值的液相3.0.1; MW1f.-MW3f。是在NMS上固定、倒井、添加捕收剂和浮选后形成的液相。
MW1f.-MW3f。是在NMS上固定、倒井、添加捕收剂和浮选后形成的液相。