摘要
体外和体外造血干细胞和祖细胞(HSPCs)生成的进展建立在发育性造血的知识基础上,强调了理解这一过程的重要性。HSPCs通过内皮-造血转化(EHT)在胚胎脉管系统中出现。转录调节因子Tal1在血液发育的早期阶段发挥重要作用,但被认为是EHT的可有可无的。尽管如此,Tal1是用它的绑定伙伴来表达的Lmo2它是同源的Lyl1在EHT时内皮细胞和移行细胞中。在这里,我们使用基于小鼠胚胎干细胞(mESC)的分化系统来模拟造血发育,研究了这些基因的功能。我们首次证明内皮细胞中TAL1的表达对于确保EHT过程的效率和持续的造血输出至关重要。我们的发现揭示了一个重要的功能Tal1从而填补了目前关于该主基因在整个造血发育过程中所起作用的知识空白。
简介
再生医学的一个重要目标是体外或体外生产造血干细胞和祖细胞(HSPCs)用于临床应用。近年来,利用目前关于发育过程和发育性造血的分子调节的知识,已经取得了显著的概念证明1,2.这突出了深入了解这一生物过程以设计有效的再生方法的重要性。
在胚胎期,HSPCs在主要的胚胎动脉内由特化的内皮细胞(称为造血内皮细胞(HE))短暂产生。3.,4.这一事件在脊椎动物物种中是保守的,并已被确定为一种被称为“内皮细胞向造血转变”(EHT)的转分化。5,6,7.
我们工作的目的是评估的贡献Tal1,Lmo2而且Lyl1到造血前干细胞和祖细胞(Pre-HSPCs)的产生,这代表了EHT的中间阶段8.Tal1,Lmo2而且Lyl1形式与Runx1,Gata2,Cbfb,Erg而且Fli1一组由8个主要调节因子组成,它们的联合活性调节着HSPC的发育8,9,10.使用小鼠胚胎干细胞(mESC)为基础的造血分化模型,我们之前已经在这些因素中确定了两种相反的力量,这决定了细胞是否保持内皮身份(Erg而且Fli1)或进行EHT (Runx1,Cbfb而且Gata2)8.同时共表达的所有八个因素维持细胞在Pre-HSPC阶段,但确切的作用Tal1,Lmo2而且Lyl1在这方面尚不清楚8.Tal1对于造血的开始和HE的产生是必需的,但它在内皮细胞中的表达被认为是EHT发生的可有可无的3.,11,12,13,14,15,16.的确,有条件的消融Tal1在Tie2-表达细胞不损害小鼠造血的初始阶段15它的条件表达式Tal1-/-在内皮细胞形成后,mescs来源的培养不能挽救造血功能,从而得出结论Tal1在内皮细胞形成之前发挥其基本功能,为细胞的造血命运做好准备,但在后期没有显著作用12.然而,在第一项研究中,转录之间的滞后Cre-重组酶和TAL1蛋白的实际下调可能为HE细胞和pre - hspc的正常成熟提供了足够的时间。相反,在第二项研究中,TAL1的缺乏应该会损害HE的生成,这可能解释了为什么它在后期的重新表达不能挽救造血细胞的形成。
LMO2是一种支架蛋白,也是TAL1的结合伙伴,其在胚胎造血中的作用主要反映TAL117,18,19.然而,尽管Tal1mESCs的消融完全消除了体外造血,Lmo2消融允许Pre-HSPC的产生,并导致后期缺陷,这表明它是Pre-HSPC成熟所必需的3.,11,17.LYL1是bHLH结构域上与TAL1高度同源的bHLH蛋白18,19.可能正因如此,Lyl1能赔偿损失吗Tal1在成人造血干细胞中20..然而,它不能挽救体外造血Tal1-/-制23.这种蛋白质与造血发育的相关性是难以捉摸的,因为Lyl1-/-小鼠仅表现出轻微的造血缺陷,而生成Lyl1-/-减少80%的小鼠Tal1红系间室的表达显示了两者之间的功能冗余Lyl1而且Tal1在原始红细胞生成中21.Tal1,Lmo2而且Lyl1在单细胞水平上共表达pre - hspc8而且Tal1小鼠卵黄囊内皮细胞的过表达增加了其造血输出,提示其在EHT中发挥作用22.
在目前的工作中,将功能获得实验与体外多组学方法相结合,我们发现Tal1,Lmo2而且Lyl1促进造血程序的激活,似乎参与了VSM相关基因的转录抑制。值得注意的是,使用teteon系统来控制表达Tal1在我们基于mesc的造血分化系统中,我们首次表明内皮细胞中TAL1的表达对EHT的效率和持续的造血输出很重要。
结果
同时的过度表达Runx1,Cbfb,Gata2,Erg而且Fli1,但不是Tal1,Lmo2而且Lyl1生成富含Pre-HPCs的成血管细胞培养物。
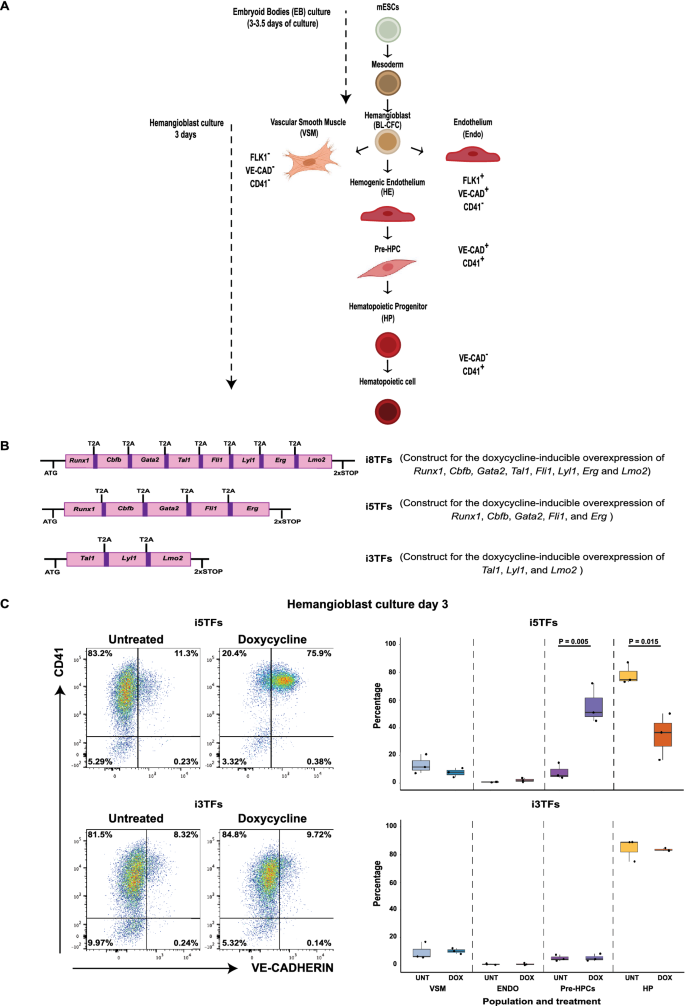
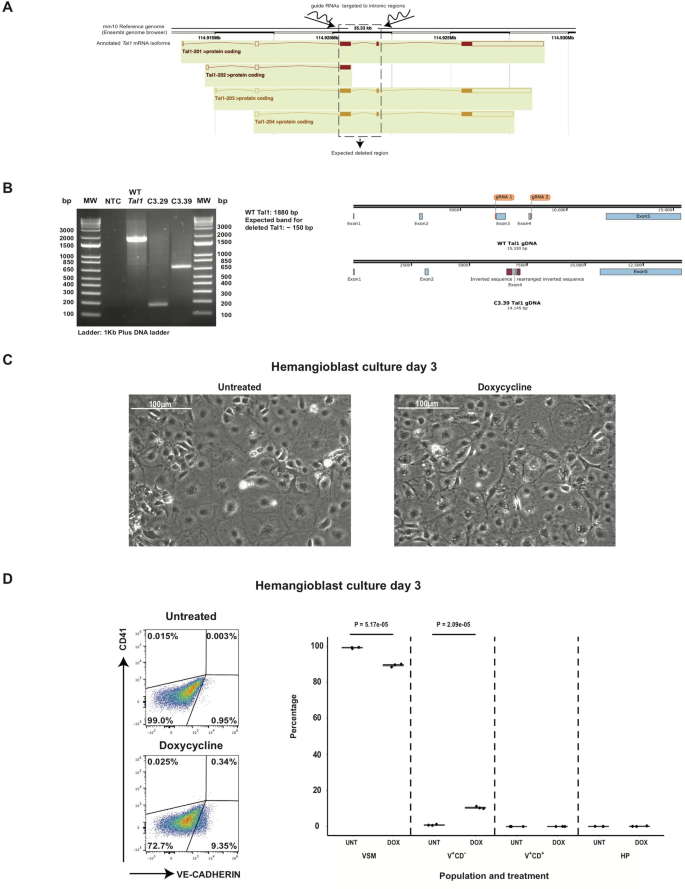
调查…的作用Tal1,Lmo2而且Lyl1在EHT中,我们利用了一个基于mesc的分化系统来模拟造血发育在体外3..分化系统和细胞表面标记在整个研究中用于识别和分离培养中的不同细胞群如图所示。1答:在我们以前的工作中8我们已经证明了强力霉素(dox)诱导的同时过表达Tal1,Lmo2而且Lyl1与Erg,Fli1,Runx1,Cbfb而且Gata2(8 tfs)(图1B)产生mesc衍生的造血培养物(即“成血管细胞培养物”),在体外相当于Pre-HSPCs中高度富集。由于这些祖细胞缺乏造血干细胞的能力,下文简称为Pre-Hematopoietic Progenitor Cells (Pre-HPCs)。确定…的贡献Tal1,Lmo2而且Lyl1对于Pre-HPC表型,我们使用之前描述的诱导盒式交换方法生成了另外两个可过表达的mESC系Tal1,Lmo2而且Lyl1单独(3tf)和Runx1,Cbfb,Gata2,Erg而且Fli1(5TFs)以dox-inducible的方式(图;1B).新细胞系的分化证实两者都能生成VSM (VE-CAD)-CD41-内皮细胞(Endo, VE-CAD+CD41-), Pre-HPCs (VE-CAD+CD41+)和造血祖细胞(HP, VE-CAD-CD41+经形态分析和流式细胞仪检测,结果显示:1C).在成血管细胞培养第1天,dox处理诱导3TFs和5TFs过表达,并在处理后2天用流式细胞仪对培养物进行分析。我们发现就像3tf的个体过表达一样8,它们同时过表达对培养物的组成没有明显影响(图;1C)。与之形成鲜明对比的是,5tf的过表达产生了Pre-HPCs高度富集的培养(图。1C)。通过诱导5tf产生的Pre-HPCs的FACS类型和对其造血潜能的测试清楚地显示了它们在体外产生多种血细胞的能力(补充图。1).这与8tf过表达的效果相似8.
同时的过度表达Runx1,Cbfb,Gata2,Erg而且Fli1,但不是Tal1,Lmo2而且Lyl1生成富含类似Pre-HPCs细胞的成血管细胞培养物。(一个)研究中使用的mESC分化系统方案,显示用于识别不同细胞群的细胞表面标记。(B)描述研究中使用的转基因的方案。T2A =插入基因编码序列之间的病毒T2A肽序列,利用“核糖体跳过”机制,从一个单一的转录本中产生所有蛋白质。(C) FACS分析结果显示,多西环素处理i5tf和i3tf mESCs在培养第1天的成血管细胞中VE-CAD和CD41表达。左:代表性的FACS图。右:总结3次实验结果的箱形图。采用方差分析(ANOVA)检验检验显著性。误差条对应于标准差。
5tf同时过表达可将eVSM细胞转分化为VE-CAD+CD41+细胞的效率比8tf低
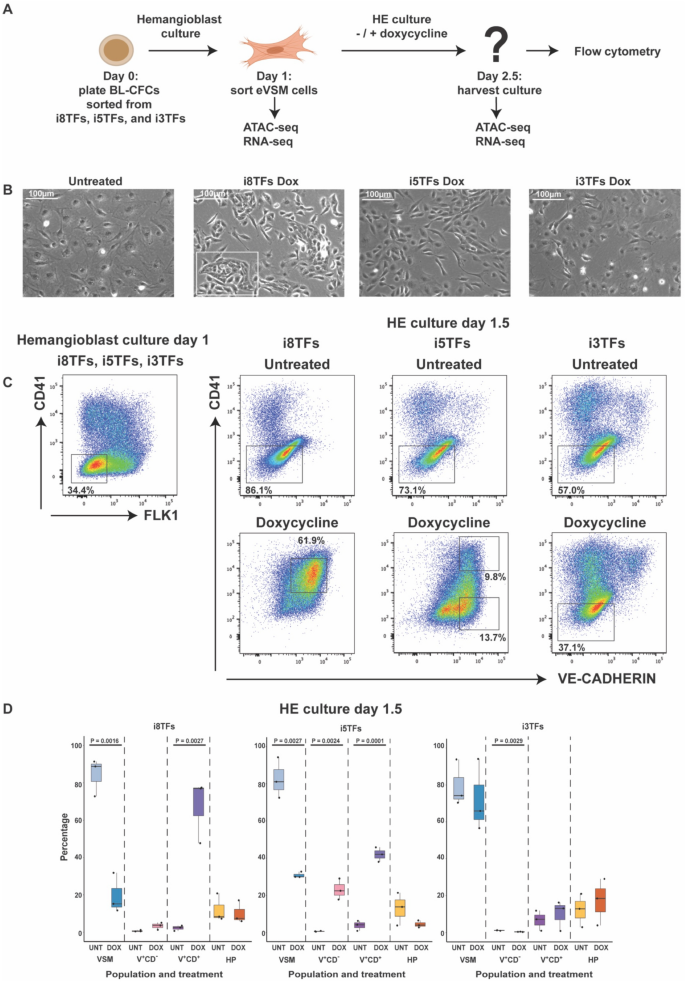
通过仔细检查5tf过表达在成血管细胞培养中的影响,我们注意到存在残留的VSM群体(图2)。1C)相反,在8tf过表达的文化中几乎不存在8.作为Tal1是否有报道在中胚层和内皮细胞中作为心脏命运的抑制因子23,24,25,26,27,这种差异可能反映了3tf在抑制VSM身份方面的作用。另一方面,仅过表达3tf并不能导致VSM细胞频率的降低,因此很难对这些3tf的作用做出确切的结论。因此,我们决定使用另一种方法来研究差异转录因子过表达引起的变化。我们选择了富集VSM细胞(eVSM)的群体(图。2),因为它们提供了一个非造血和非内皮的背景来测试转录因子的活性。此外,它们还可以被转分化为VE-CAD+CD41+通过同时过表达8tf,细胞表型类似Pre-HPCs(图2)。1一个和2C)8.如图所示。2A,我们从i8tf, i5tf和i3tf细胞系中分化mESCs,并从FLK1的每个群体中分类FACS-CD41-成血管细胞培养第1天的eVSM细胞(亲本eVSM)(图;2A、C)。排序FLK1-CD41-细胞被重新镀在促进造血的造血内皮(HE)培养基中3.在缺乏或存在dox的情况下诱导转录因子过表达(图。2A). HE培养1.5天后收获细胞,流式细胞术分析(图;2模拟)。8tf的过表达重复了先前发表的结果,培养中的大多数细胞共同表达VE-CAD和CD41(图。2C, D)。与成血管细胞培养不同的是,在筛选好的eVSM中过表达5tf可产生富含VE-CAD的培养+其中很大一部分细胞不共同表达造血细胞表面标记CD41(图2)。2C, D)。相反,与成血管细胞培养相似,与未处理对照相比,单独过表达3tf并没有明显改变培养细胞中CD41和VE-CAD的表达模式,培养细胞中的大多数细胞显示VSM形态(图。2罪犯)。因此,与所有8tf相比,单独过表达5tf在促进eVSM细胞向VE-CAD转分化方面的效率较低+CD41+细胞。因此,尽管3tf本身不足以改变eVSM细胞的表型,但它们似乎增加了5tf在非造血细胞中促进Pre-HPCs表型获得的能力。
内生Tal1而且Lmo2基因在VE-CAD中有差异表达+CD41-和VE-CAD+CD41+5tf过表达产生的细胞
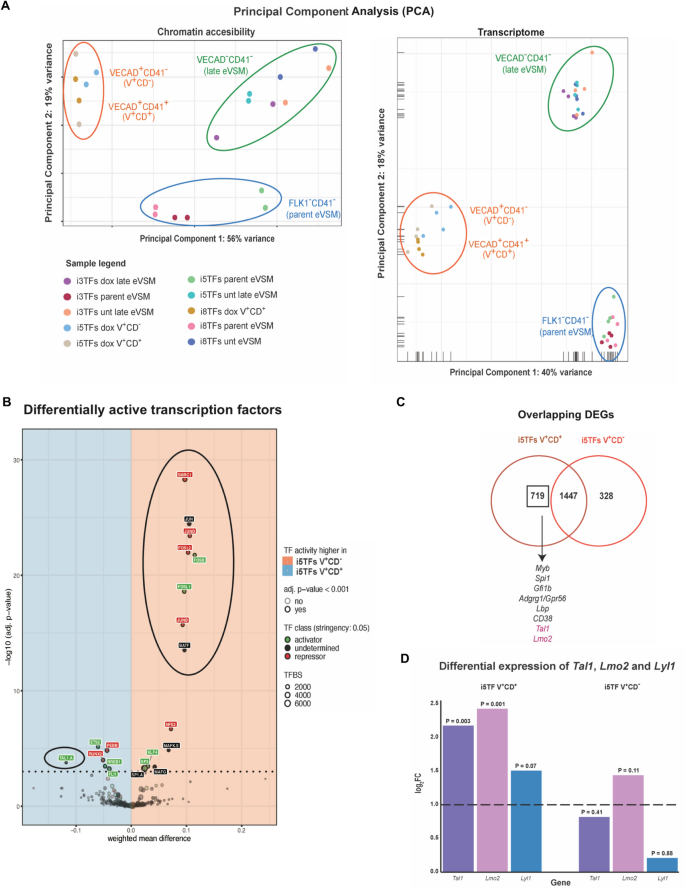
为了深入了解eVSM细胞中差异转录因子过表达引起的变化的机制,我们对在三种dox处理条件下产生的最丰富的细胞类型以及VE-CAD进行了FACS分类-CD41-并通过ATAC-seq和RNA-seq评估其染色质可及性和转录谱(图2)。2A和C)28,29.排序门如图所示。2C.关于染色质可及性和转录数据的主成分分析(PCA)(图2)3.A)确认从三个细胞系中分出的亲本eVSM在性质上是相似的,因为它们在两个分析中都聚集在一起。8tf和5tf过表达的细胞在染色质可及性和转录景观方面与未处理的对照组有很大差异,而3tf过表达的细胞似乎总体上与未处理的对照组相似,这与形态学和细胞荧光观察结果一致。
内生Tal1而且Lmo2基因在i5TFs V中有差异表达+CD+与i5tf V相比+CD−细胞。(一个) ATAC-seq结果(n = 2)(左图)和RNA-seq结果(n = 4)(右图)的PCA图。父eVSM = FLK1−CD41−成血管细胞培养第1天分选的细胞;late eVSM = VE-CAD−CD41−HE培养第1.5天分选的细胞;V+CD−= VE-CAD+CD41−HE培养第1.5天分选的细胞;V+CD+= VE-CAD+CD41+HE培养第1.5天分选的细胞;dox =在HE培养基中与强力霉素一起培养;unt = HE培养基中不含强力霉素。(B)指示细胞系的diffTF分析结果。TFs在i5TFs V中更活跃+CD+显示在蓝色象限,在i5tf V+CD-显示在红色象限。被归类为激活因子的tf用绿色标记,被归类为抑制因子的tf用红色标记,不能被清楚地归类为两者的差异活性tf用黑色标记。根据Pearson相关指数,5%的TF被归类为激活剂或抑制剂(TF分级严格度:0.05)。x轴(加权平均差)显示了两种条件下TF活性的差异。y轴表示tf的显著性。显著性阈值用虚线表示(FDR已调整p-value < 0.05)。tf用一个点表示。每个点的大小与每个预测基因组TFBS (TFBS)的数量成比例。(C)比较i5tf中deg的维恩图+CD+and i5TFs+CD-.在V .中差异表达的一个造血基因亚群+CD+但不是V+CD-如图所示。(D的微分表达式(log2FC)的条形图Tal1,Lmo2而且Lyl1in i5TFs+CD+and i5TFs+CD−与未处理的eVSM细胞进行比较,通过RNA-seq鉴定。
在eVSM细胞中,5tf诱导生成的细胞在造血细胞表面标记CD41的表达上存在差异(图4)。2C,D),这表明造血程序在这些细胞中具有不同的活性。为了更深入地了解这些细胞在分子水平上的差异,我们决定利用生物信息学工具diffTF30..基于ATAC-seq数据和一组预测或验证的TF结合位点,diffTF估计哪些转录因子在两种条件下具有差异活性(以下简称:i5tf V+CD−(即内皮样VE-CAD+CD41−细胞)vs . i5TFs V+CD+(即Pre-HPC-like VE-CAD+CD41+细胞(图)。3.B)。
通过将diffTF应用于我们的数据,我们确定了许多转录因子似乎在i5tf V中具有差异活性+CD-vs . i5TFs+CD+(无花果。3.B). i5TFs中一些最活跃的转录因子+CD−与i5tf V相比+CD+具体到VSM身份,如SWI/SNF亚基Smrc1/Smarcc1激活蛋白-1 (AP-1)转录因子Fosl1,Fosl2,君,君布,君德而且Batf(无花果。3.B).事实上,这两种蛋白质家族在肌肉细胞的发育和生理中都有已知的作用,并且在我们的diffTF分析中,这些转录因子的活性一致地发现了未处理的eVSM细胞的特征(补充图。2)31,32,33,34.相比之下,i5tf中最活跃的转录因子之一V+CD+与i5tf V相比+CD-是Tal1(无花果。3.B)这一意外的发现被以下事实所强化Tal1在i5tf V+CD+而不是在i5tf V+CD−相对于i5tf的VSM(图;3.C, D)。Lmo2遵循相同的表达模式(图;3.C, D)。这一发现表明,内源性表达Tal1而且Lmo2可能在VE-CAD的生成中起作用+CD41+5tf过表达后的细胞。
5tf在成血管细胞培养中过表达不能生成VE-CAD+CD41+在TAL1功能缺失的情况下
根据前面的分析,我们假设损失Tal1能防止VE-CAD的形成+CD41+过表达5tf后的细胞。我们关注的是Tal1因为有证据表明Lmo2来自mESCs的消融允许产生真正的Pre-HPCs,尽管频率较低Lmo2+/+制,Lyl1在我们的数据集中没有显著上调(图;3.D)17.为了验证我们的假设,我们决定生成一个Tal1在i5tf系遗传背景中敲除。利用CRISPR/CAS9技术,我们获得了两条突变系(图。4A、B、补充图3.).区分这些行,我们验证了Tal1基因阻止了血液和内皮细胞的形成,只产生了VSM细胞(图。4C, D)。这证实了功能性TAL1的缺失3..在这些培养物中过表达5tf后,我们只能产生表达内皮标记物VE-CAD的细胞。未检测到表达CD41的细胞(图;4C, D)。因此,我们得出结论,其他5个tf生成VE-CAD需要一个功能性的TAL1+CD41+细胞来自VSM。
5tf在成血管细胞培养中过表达不能生成VE-CAD+CD41+在TAL1功能缺失的情况下.(一个) CRISPR/Cas9策略用于破坏Tal1i5tf的mESC系基因(图从Ensembl基因组浏览器下载并修改)。(B)左:电泳显示基因分型Tal1用于实验的突变的mESCs克隆。右图:WT的格式Tal1吉恩和Tal1根据测序结果重建突变克隆C3.39的基因。(C)成血管细胞培养第3天指示条件的代表性显微镜图像。(D)指示条件的代表性流式细胞仪分析(左图)和显示VSM, V+CD−, V+CD+和HP种群在成血管细胞培养第3天(n = 3)。采用方差分析(ANOVA)检验检验显著性。误差条对应于标准差。
差异表达基因的层次聚类鉴定了3tf和5tf在转录调控方面的功能相互作用
使用DESEq2包35我们鉴定了未处理对照和过表达8tf、5tf和3tf的细胞之间的差异表达基因(DEGs)(补充文件S1).为了比较差异转录因子过表达的影响,我们对四个排序种群的deg进行了层次聚类分析,将我们的数据集分为10个包含相似表达模式基因的聚类(图2)。5A、补充文件S3).生成的簇似乎反映了5tf和3tf对8tf诱导的转录变化的相对贡献,以及pre - hpc样身份的获得。为了证明这一点,簇1包含了大部分仅在i8tf V中下调的基因+CD+,表明它们是5TF和3tf共同作用的结果,而簇2中大部分基因是由于5TF过表达而明显下调的,似乎没有3tf的贡献。这种层次聚类提供了多个证据,表明8tf之间在调节i8tf V基因表达方面存在功能合作+CD+.事实上,我们观察到,当所有8tf同时过表达时,特定的基因子集被沉默(在聚类1中)和上调(在聚类6中),当只有5tf而不是8tf过表达时,其他基因被强烈沉默(在聚类3中),当3tf单独过表达或与其他5tf联合表达时,少数基因(在聚类6和10中)似乎被差异调控。层次聚类分析也强调了i5tf V之间的转录差异+CD+和i8tf V+CD+细胞。这可能表明3tf的表达在Pre-HPCs中特定基因亚群的转录调控中具有非冗余的作用。
3tf过表达有助于eVSM肌肉转录程序的沉默和造血程序的激活。(一个)热图显示了图中所示簇的基因表达。左侧显示了每个聚类中最具代表性的GO术语。* KEGG富集(在聚类7中没有发现显著的GO术语)(B) i3tf未处理(unt) eVSM与i3tf dox处理(dox) eVSM的差异火山图。详细的情节说明可以在图中找到。3..图中圈出VSM细胞特征的tf和造血tf。(C用HOMER软件对i3TFs dox eVSM中差异表达基因进行“已知Motif富集”分析的结果。显示了前5个富集的转录因子基序。Tal1主题用橙色突出显示。(D)比较i3TFs unt eVSM和i3TFs dox eVSM的差异表达基因(DEGs)的选择。粉红色为造血基因,蓝色为vsm相关基因。(E)不同的火山图比较i8tf+CD+to i5TFs+CD+(左面板)和i8TFs dox V+CD+to i5TFs dox V+CD−(右面板)。图中可以找到对图的详细解释。3..VSM和造血tf被圈出。
在eVSM中,3tf的过表达可能导致肌肉转录程序的沉默和造血程序的激活
接下来,我们对每个聚类中的基因进行GO分析(图2)。5A、补充图4- - - - - -8,补充文件S4).该分析使我们能够确定3tf对非造血转录程序的下调,特别是肌肉转录程序(簇1和簇10),造血转录程序的上调(簇6和簇9),以及Wnt、p38 Map激酶和BMP信号通路的调节(簇3和簇10)的贡献。事实上,我们发现簇1富含与肌肉细胞重要功能相关的氧化石墨烯,如细胞外基质组织和肌肉组织发育,以及属于Wnt信号通路的基因(图2)。5A、补充图4A),而聚类6主要富集与造血相关的氧化石墨烯(图。5A、补充图4B)。
与GO分析一致的是,我们通过diffTF分析结合STRING的使用发现(图。5B及补充图9)表明,与i3tf还原eVSM相比,平滑肌特异性tf在i3tf中更活跃。相反,在dox处理的条件下,几种造血tf更活跃。此外,我们发现在i3tf - dox eVSM细胞中上调的基因中,重要的造血调节因子如Cbfa2t323,Tal1目标Gfi110,36而且Myb37也是最早的小鼠造血标志物Itga2b38(无花果。5D),表明仅过表达3tf可能能够促进造血转录程序的部分激活。同样,在下调的基因中,我们发现了一些在血管平滑肌中起作用的基因(Mirt1而且Msx2)39,40,在肌肉发生(Snai2而且Socs1)41,42,引导成血管细胞获得平滑肌(Fosl2)33细胞骨架重塑蛋白和细胞外基质成分,表明仅过表达3tf能够部分抑制肌肉转录程序(图。5D).值得注意的是,i3TFs还原eVSM细胞中近一半的DEGs与i8TFs V中的DEGs不相同+CD+(补充图。10),进一步支持8tf之间的功能相互作用,指导这些因子的转录活性。使用HOMER软件进行的motif富集分析显示,在3TFs过表达时,在DEGs的转录起始位点附近,TAL1 (SCL)结合位点以及VSM转录因子的结合位点(如AP-1, FOSL2)富集。5C),支持我们的diffTF分析结果(图。5B)。
为了进一步了解3tf的作用,我们分析了比较i5tf线和i8tf线的差异tf结果。5E)当比较i8tf时+CD+to the i5tf+CD-,结果与i5tf V之间的比较相似+CD+和i5tf V+CD-如图所示。3.B,其中VSM tf在i5tf V中最为活跃+CD-而造血tf在i8tf V中最为活跃+CD+.当我们比较i8tf V+CD+to the i5tf+CD+,然而,我们发现VSM tf不再是最有差异活性的。5E).自内生Tal1而且Lmo2i5TFs V基因表达上调+CD+,本分析提供正交证据,表明上调至少Tal1而且Lmo2参与了表达它们的细胞中VSM转录程序的下调。
拯救Tal1在造血内皮细胞培养中表达恢复VE-CAD的形成+CD41+和VE-CAD−CD41+从内皮细胞和确保持续的造血输出
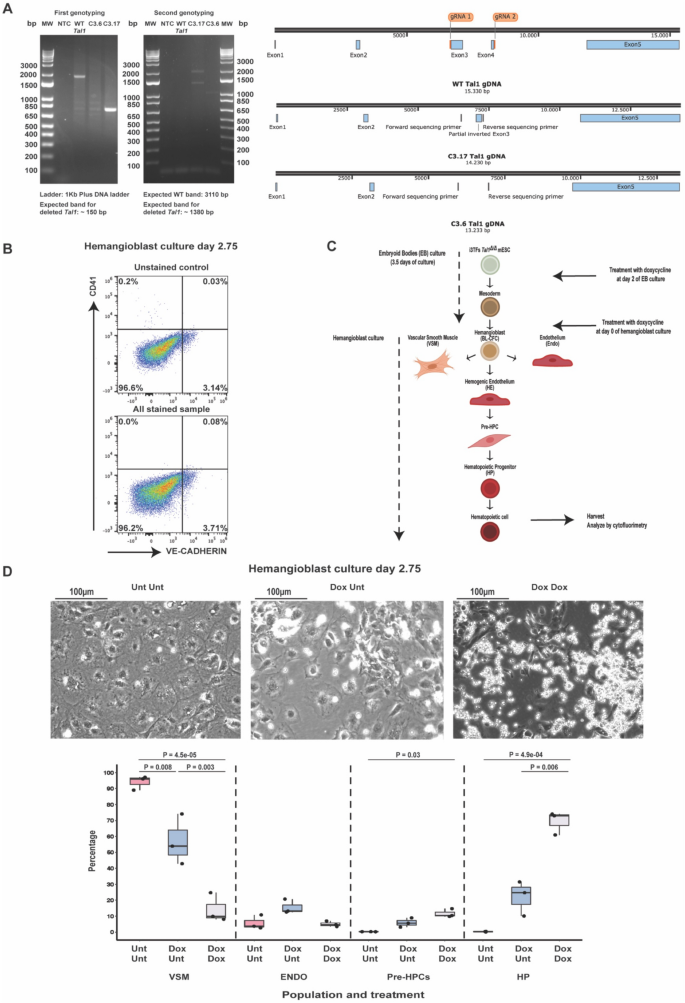
我们之前的分析促使我们评估是否Tal1在内皮形成Pre-HPCs中起作用。其他关于这个问题的研究没有找到证据来支持一种作用Tal1在这个阶段12,15.为了解决这个问题,我们开发了一个新系统。关键是能够保证TAL1在中胚层的活性,从而产生内皮细胞和造血内皮细胞,但在后一种细胞类型中关闭TAL1的活性,以验证是否能够进行血细胞形成。要创建这个新工具,我们禁用Tal1利用CRISPR/CAS9方法,对i3tf系的基因进行了检测。6A、B)。不出所料,这些细胞系既不能产生内皮细胞,也不能产生血细胞,关键造血转录因子的表达大幅降低(补充图。11),证实了功能性TAL1的缺失(图。6B, D)。为了进行实验,我们进行了诱导Tal1,Lmo2而且Lyl1在EB细胞分化的第2天,通过添加dox表达(图;6C),生成FLK1+具有造血潜能的中胚层细胞。排序后的FLK1+这些细胞被镀上dox以维持3tf的表达,或者不镀上dox以创建缺乏TAL1功能表达的成血管细胞培养物。未暴露于还原(Unt Unt条件)的细胞作为阴性对照。他们不能产生任何血液或内皮细胞,但从缺乏功能性TAL1的细胞中产生了VSM。持续的还原(dox - dox条件)处理导致VE-CAD的高频率−CD41+细胞(HP)培养2.75天后。VE-CAD+CD41−细胞(Endo)和VE-CAD+CD41+细胞(Pre-HPCs)也可以被检测到。相比之下,在EB期只添加dox的条件下(dox Unt条件),VE-CAD的频率−CD41+细胞的活性比Dox - Dox条件下低约3倍(图2)。6D).因此在去除dox后造血仍在进行,尽管效率较低。培养第3天,与Dox - Dox相比,转基因TAL1蛋白在Dox - Unt中检测不到表达(图2)。7A &补充图12).正是在这个阶段,我们决定从Dox Unt条件下分离内皮细胞进行造血内皮细胞培养。
描述Tal1Δ/Δ可诱导3TFs胚胎干细胞系。(一个)左:电泳显示基因分型Tal1用于实验的突变的mESCs克隆。右:WT的格式Tal1吉恩和Tal1根据测序结果,从突变克隆C3.17(缺失较短的等位基因)和C3.6中重建基因。(B) 1.75天未处理的血管母细胞培养的代表性流式细胞术分析,比较未染色的细胞(上)和VE-CAD和CD41染色的细胞(下)。3-4%的成血管细胞在红色(VE-CAD)通道中自发荧光。(C)用于表征突变系的实验布局。(D)上:所示条件的代表性显微图像。VSM细胞表现为广泛分布的大细胞;内藤细胞呈细长细胞;HPs表现为圆形漂浮细胞。Unt Unt =未经治疗;Dox Unt = EB第2天添加强力霉素;在EB第2天和成血管细胞培养第0天添加Dox =强力霉素。下图:在指定条件下HE培养中VSM、Endo、Pre-HPC和HP群体相对频率的箱形图(n = 3)。采用方差分析(ANOVA)检验确定显著性,然后采用Tukey HSD检验进行多重检验校正。误差条对应于标准差。
拯救Tal1在致血性内皮细胞培养中表达,可从内皮细胞中形成Pre-HPCs和HP。(一个Western-blot (WB)分析显示,转基因HA-TAL1在第3天的Dox Unt和Dox Dox i3tf中表达Tal1Δ/Δhemangioblast文化。对每个细胞系进行两次独立重复WB。B-ACTIN作为负荷对照。(Bi3tf的代表性流式细胞术分析Tal1Δ/ΔUnt Unt, Dox Unt和Dox Dox血管母细胞培养第3天。方形突出内皮细胞群(VE-CAD)+CD41−)从Dox Unt条件中分选,用于随后的造血内皮细胞培养和RNA-seq。(CRNA-seq (n = 4)分析显示在FACS分类的内皮细胞群中指示基因的表达。(D)血细胞内皮培养结果。上:显示代表性流式细胞仪分析的面板。底部:总结四个独立实验的箱形图。采用方差分析(ANOVA)检验检验显著性。误差条对应于标准差。(E)在没有强力霉素的情况下进行10天液体造血细胞生长试验,总结未处理和强力霉素处理的HE培养中CD45表达的箱状图。整个i3TFsTal1Δ/ΔDox成血管细胞培养作为阳性对照。采用方差分析(ANOVA)检验检验显著性。误差条对应于标准差。Unt Unt =未经治疗;Dox Unt = EB第2天添加强力霉素;在EB第2天和成血管细胞培养第0天添加Dox =强力霉素;CD45 =泛造血标志物。
我们分离VE-CAD+CD41−流式细胞仪对Dox Unt血管细胞培养第3天的细胞进行分选(图2)。7B).部分细胞通过RNA-seq进行评估,其余细胞用于体外培养试验。我们发现这些细胞强烈表达Runx1,Erg,Fli1,Gata2而且Cbfb,以及额外的造血基因,如Gpr56,这是生成HSPC所必需的43,Spi1,是HSPC分化的调节因子(图;7C、补充文件S5).在没有或存在还原的情况下进行造血内皮培养。当3tf未被诱导时,因此在没有TAL1转基因表达的情况下,CD41无表达或极少表达+细胞检测。相比之下,dox的加入导致CD41的显著增加+细胞的频率。这些细胞大多为VE-CAD+CD41+(Pre-HPCs),但更成熟的VE-CAD−CD41+(HP)也被发现(图。7D).造血细胞培养后进行造血细胞生长试验。我们可以持续检测到CD45+而在未处理的培养中,CD45的频率降低+细胞的变化令人惊讶,从无法检测到的水平与dox处理的培养(图。7E及补充图13).综上所述,这些证据似乎表明,在TAL1功能缺失的情况下,EHT过程的效率非常低,从而导致造血产生水平不一致(图1)。7D)。Tal1因此在确保VE-CAD的高效生产中起着至关重要的作用+CD41+内皮细胞和持续的造血输出。
讨论
我们研究的目的是阐明造血调节因子的功能Tal1,Lmo2而且Lyl1在内皮细胞向造血细胞转变(EHT)期间。当它们与造血调节剂结合时强制表达Runx1,Cbfb,Gata2,Erg而且Fli1能生成VE-CAD+CD41+来自mesc来源的成血管细胞培养的类似Pre-HSPCs的细胞和mesc来源的VSM细胞具有非常高的效率8,我们通过调查他们对VE-CAD的贡献来解决我们的问题+CD41+这些系统中的细胞生产。我们比较了过度表达正义的效果Tal1,Lmo2而且Lyl1(3tf)和只是Runx1,Cbfb,Gata2,Erg而且Fli1(5TFs)到所有8个因子(8TFs)一起过表达,在表型和分子水平上。
仅过表达3tf似乎参与了eVSM中造血转录程序的激活和肌肉相关基因的下调。我们对差异转录因子过表达引起的转录变化进行了比较分析,证实了这一点。Tal1中胚层前体对于造血的承诺是必要的吗3.,11多项证据表明,它在抑制心脏和旁轴系交替命运方面具有重要作用23,24,25,26,27.然而,由于一项基于sc- rna -seq的FLK1分化研究,这一问题在业内仍存在争议+原肠胚的中胚层细胞44.在这里,我们提供了第一个实验证据来证明这一点Tal1,与它的结合伙伴结合Lmo2它的同源Lyl1,可能有助于促进VSM转录程序的沉默。这种影响很可能在很大程度上由Tal1与Lmo2,i5tf的内源性上调V+CD+根据我们的差异tf分析,似乎足以下调VSM转录调控因子的活性。我们的结果与先前支持的角色一致Tal1在不同命运的转录抑制中。尽管如此,还需要做更多的工作来证明这种效应与这些转录因子与VSM相关基因的结合直接相关。明确的证据需要在我们的实验系统中对三个转录因子进行染色质占用分析。这将是未来一个有趣的研究方向。
我们的主要发现是内皮细胞中TAL1的表达对于确保VE-CAD的高效生成非常重要+CD41+细胞和持续的造血输出(图;7D)在体外模型中。Schlaeger等人在他们的研究中解决了这个问题。15没有发现任何证据Tal1在EHT中有一席之地。然而,他们的实验系统可能已经允许足够的表达Tal1在Tie2-Cre介导的切除生效之前,SCL是否在胚胎内内皮细胞中发挥更重要的作用仍有待解决,作者自己也没有排除这一点。与此相一致,我们的研究以一种更可控的方式调查了在HE形成和EHT之间的时间窗口中TAL1去除的影响,从而完善了他们的发现,这可以解释我们两项研究之间的明显差异。此外,我们最近的研究结果表明,少数CD41+在HE培养中,TAL1缺失时能够形成的细胞能够产生CD45+细胞。因此,可能在体内也发生了类似的影响,允许小鼠的生存超过E11.5,并防止EHT缺陷的识别,因为主动脉内造血集群(IAHC)的存在和组成没有被评估Tal1fl / flTie2-CRE老鼠。
甄峰等。45研究了斑马鱼胚胎中两种不同的Tal1异构体,并确定了它们的时间需求,表明β-Tal1是HE规范所必需的,α-Tal1是hsc维持所必需的。然而,这项研究并没有确定Tal1在EHT中的具体作用。可能与β-Tal1的敲除相关的HE细胞凋亡阻止了该亚型Tal1在EHT过程中的突出作用的识别。
利用mESC和类似于我们的微分系统,Lichtinger等人。46发现在RUNX1表达之前,TAL1和FLI1存在于HE中与EHT相关基因的启动子中,这表明这些基因处于“启动”状态。尽管他们也使用了鼠标ESC系统,但他们并没有调查其作用的目的Tal1在EHT的特定时间范围内。他们的研究结果支持我们的发现,但他们的工作缺乏相关部分的功能组件Tal1.
尽管5tf在HSPC的形成中起着重要作用,但我们发现5tf在HSPC中大量表达Tal1Δ/Δ内皮细胞不足以产生VE-CAD+CD41+就像它们的过表达不足以生成VE-CAD一样+CD41+细胞Tal1Δ/Δhemangioblast文化。这表明Tal1可能需要5tf在EHT中发挥作用。事实上,RUNX1, GATA2, ERG, FLI1, TAL1, LMO2和LYL1被认为是一种多蛋白复合物,而TAL1本身是一种专性异源二聚体,其活性在很大程度上由蛋白质-蛋白质相互作用调节10,17,47,48.已有研究表明,TAL1可以通过物理相互作用将转录调控因子和染色质重塑复合物招募到其靶基因,同样也可以通过与其他蛋白质的相互作用定向到其靶基因17,23,47.因此,产血内皮细胞中可能需要TAL1来组装包含5tf的多蛋白复合体,或招募转录调节因子,将5tf的基本功能调节到该复合体。进一步的实验研究TAL1和5tf之间的物理和功能相互作用,将有助于我们进一步了解这些重要的血液发育调节因子之间的相互作用。
从翻译的角度来看,我们的研究结果表明,在体外或体外生成HSPCs的努力应该考虑到的重要作用Tal1在Pre-HPC生成中,要么支持使用表达这种造血调节剂的起始细胞,要么利用替代策略来确保其表达。内皮细胞在再生医学中尤其具有吸引力1,2.通过分析公开的小鼠scRNA-seq数据集,我们发现成人内皮细胞表达的频率Tal1和胚胎时期相比非常低49.基于我们的研究结果,似乎任何刺激这种细胞进行EHT的尝试都应该包括增加Tal1活动。
总之,通过我们的工作,我们发现了一个意想不到的突出作用Tal1在EHT中。另外,我们已经证明了Tal1,连同Lmo2而且Lyl1在VSM转分化的细胞中,可能同时激活造血转录程序并抑制肌肉转录程序。
通过我们的生物信息学分析,我们还确定了在5tf和8tf过表达后获得Pre-HPC表型的细胞中差异表达和差异活性的通路和基因。其中,可能存在一些在体内具有调节作用的Pre-HSPCs。因此,我们的工作也构成了对Pre-HSPC形成和EHT潜在的新型调控因子的识别和研究的资源。
方法
ESC系的产生和体外ESC分化为血液和血管谱系
如前所述,所有强力霉素诱导的ESC系都是使用诱导盒式交换方法生成的8,50,51.没有动物被用来产生这些细胞系。通过基因合成(GenScript)和克隆,得到p2lox-5TFs和p2lox-3TFs质粒。因此,它们被转染到A2中。如前所述,鲑鱼ESCs(由明尼苏达大学Michael kyba博士提供)8,50.我们的RNA-seq和diffTF分析证实了所选克隆的过表达结构的功能。5D、补充图2,补充文件S1).
i5tf的生产Tal1Δ/Δ制,i3TFsTal1Δ/ΔmESCs细胞系使用Crispr/CAS9技术完成。两种靶向内含子2和4外显子侧区(相对于Tal1- 201 mRNA)的grna被用于在Tal1基因中产生缺失(图2)。4A、B、6A).使用sgRNA CRISPick工具的CRISPRko功能设计引导rna (https://portals.broadinstitute.org/gppx/crispick/public).在输出列表中选择最佳候选进行实验。在向导的序列被添加到Tal1内含子2引导提高U6启动子的转录效率。用BlpI和BstXI消化p133-pPB质粒所产生的悬空互补序列添加在设计导向的两侧(蓝色序列)。导向性从Sigma-Aldrich购买,作为正义和互补的反义寡核苷酸:
Tal1内含子2:5'TTGGACGCACTGAAACCTGAAAAGGTTTAAGAGC3 ';
反义5 'ttagctcttaaaccttttcaggtttcagtgcgtccaacaag3”。
Tal1内含子4:5'TTGGATGGTTCTAACCAGTGACAGTTTAAGAGC3 ';
反义5'TTAGCTCTTAAACTGTCACTGGTTAGAACCATCCAACAA 3 '。
这些指南通过标准克隆分别克隆到p133-pPB质粒中,其中包含一个RNA聚合酶III依赖的U6启动子,一个修饰的gRNA茎环和一个由Jamie Hackett (EMBL罗马)提供的BFP标签(补充图)。3.).接下来,将p133-pPB质粒与含有Cas9核酸酶结构物和GFP报告基因(pSpCas9-2A-GFP, Addgene ID: 48,138)的pX458质粒共转染,以破坏i5tf和i3tf mESC系中的Tal1基因。转染后,BFP+绿色荧光蛋白+流式细胞仪对ESCs进行分类,低密度播种于小鼠胚胎成纤维细胞(mef)。一周后,取ESC单菌落,扩增PCR分型,引物见《补充表》1,以及Sanger测序。
ESCs的维持、培养和分化(EB分化、成血管细胞培养和成血培养)使用与前面描述的相同的方案进行56(详见补充方法)。本研究生成的ESC系均具有良好的干细胞形态,体外分化后均能生成血液、内皮细胞和血管平滑肌细胞(图2)。1C和2C)。
流式细胞仪和细胞分选
染色方法如前所述52(详见补充方法)。用不同组合的抗体对EBs、成血管细胞和造血内皮细胞进行染色(补充表2).7AAD染料(Invitrogen, A1310)用于排除死亡细胞。使用FACSCanto (Becton Dickinson)和Attune NxT流式细胞仪(Thermo Fisher Scientific)进行FACS分析。细胞分选使用FACSAria (Becton Dickinson)或使用磁分选(MACS MicroBead Technology, Miltenyi Biotec)和抗apc MicroBeads (Miltenyi Biotech)进行。数据随后使用FlowJo v10.1r5 (Tree Star, Inc.)进行分析。
核酸提取、cDNA生成及PCR
基因组DNA (gDNA)提取使用Qiagen的DNeasy Blood & Tissue Kit和QIAmp DNA Micro Kit, RNA提取使用RNeasy Plus Mini Kit和RNeasy Micro Kit (Qiagen), cDNA生成使用RevertAid H Minus RT cDNA Synthesis Kit (ThermoFisher Scientific)。采用KAPA2G Robust HotStart ReadyMix(引物列表见补充表)对ESC系进行PCR分型1).定量PCR (qPCR)使用KAPA SYBR FAST ROX低qPCR Master Mix (2X)试剂盒和应用生物系统公司的7500 Real-Time PCR系统(见补充表中的引物列表)3.).
利用测序(ATAC-seq)分析转座酶可达染色质
图中显示每个群体有5000个细胞。3.用流式细胞仪将A直接分选到1.5 mL Eppendorf管中,加入50µL PBS 10% FBS。ATAC-seq使用与前面描述的相同的协议执行28(详见补充方法)。纯化样品使用安捷伦高灵敏度DNA试剂盒在2100生物分析仪上进行毛细管电泳分析,以验证样品的质量,并在池前对样品进行量化。样本平均混合到两个池中,每个池10个样本。最终的文库在Bioanalyzer上进行毛细管电泳分析,以验证文库的质量,并在测序前进行量化。这些文库用Illumina技术在NextSeq500 (2 × 75 bp读长,中输出)上进行配对端测序。
ATAC-seq数据的处理是使用内部的Snakemake管道完成的,从测序后产生的原始fastq文件开始。Berest, Arnold等人在论文方法部分的“ATAC-seq processing”段落中描述了数据处理的细节。30..
批量rna测序和数据分析
按照SmartSeq2协议的描述执行Bulk RNA-seq29.简单地说,每组25个细胞。3.A)将FACS直接分选到含有0.2% Triton X-100的裂解缓冲液、oligo-dT引物和dNTP混合物中,然后速冻。然后进行反转录,然后进行14个周期的预扩增。然后在Illumina Next Seq测序仪上制备和测序Nextera文库。RNA-seq数据处理使用EMBL银河服务器(https://galaxy.embl.de/)53.FastQC软件对原始测序数据进行质量控制。使用Trim Galore!从配对的末端读取中删除适配器序列(修剪)。再次运行FastQC以对修剪后的读取执行质量控制。使用RNA STAR (Spliced Transcripts Alignment to a reference)比对器将Reads与参考小鼠基因组GRCm38 (UCSC mm10)进行比对54.过滤器SAM或BAM用于使用SAMtools过滤BAM文件,以删除质量差的对齐,并在每次读取时保留一个对齐(跳过使用这些标志位设置的任何对齐:此读取的对齐不是主要的,读取失败平台/供应商质量检查,补充对齐)。使用bamCoverage (deepTools)生成一个覆盖bigWig文件(bin大小为10,缩放/归一化方法为1x)。featurets被用来计算有多少读取已经映射到基因(测量BAM文件中的基因表达)。CollectRNASeqMetrics (Picard工具)用于收集关于RNA与基因组中各种功能位点的排列的指标(http://broadinstitute.github.io/picard/).CollectInsertSizeMetrics (Picard工具)用于绘制插入大小的分布(http://broadinstitute.github.io/picard/).
差异表达分析采用DESeq2包,R软件(3.5.1版本,http://www.R-project.org.)和R studio(版本0.99.879)35.
ATAC-Seq数据的diffTF分析
diffTF 1.6版本与RNA-seq集成一起使用,Hocomocov 11版本和cluster.largeAnalysis.json。在config中设置了以下选项。json: "maxCoresPerRule": 20, "nPermutations": 0, " nbootstrap ": 1000, "nCGBins": 10, " tf ": "all"。文档可以在https://difftf.readthedocs.io/en/v1.6/.Berest、Arnold等人的工作描述了ATAC-Seq测序数据的差异tf分析的数据处理细节。30..
对diffTF结果的字符串分析
对于字符串分析,我们使用了对应于TF类严格度0.001和adj的diffTF分析的输出。p-value < 0.05。我们根据相应细胞的RNA-seq分析筛选出不表达的tf。为了生成交互网络,我们使用了web工具STRING (https://string-db.org/),并只显示与网络中至少另一个tf连接的tf。对于网络生成,我们选择了以下基本设置:网络边“置信度”的含义,主动交互源“Textmining, Experiments, Databases, Co-expression, Neighborhood, Gene Fusion, Co-occurrence”,最小所需交互分数“中等置信度(0.400)”,最大交互次数显示“第一层-none/仅查询蛋白质,第二层-none”。我们选择了以下高级设置:网络显示模式“交互式svg”,显示简化“隐藏网络中断开连接的节点”。聚类方法选择膨胀参数为3的“MCL聚类”。
RNA-seq数据的层次聚类及聚类的GO分析
使用R软件对4个dox处理群体的差异表达基因(DEGs)进行分层聚类分析,并对10个识别的聚类进行GO分析。DESeq2从未处理对照和dox处理样品的成对基因表达比较中识别的所有deg被合并到一个全面的矩阵中。在其中一种条件下,基质中未被鉴定为差异表达的基因被分配一个log2FC值为0,取代“NA”(不可用)值。使用曼哈顿距离计算距离矩阵,并使用Ward 's最小方差法来测量两个观察组之间的差异,将其聚类为10组。使用R stats函数hclust进行聚类,并使用R函数pheatmap生成热图。
GO分析和KEGG55使用R包clusterProfiler执行。使用丰富的绘图包创建了GO和KEGG分析可视化的地图。
基于HOMER的Motif富集分析
利用HOMER工具对i3tf经dox处理后的差异表达基因进行转录因子motif富集分析(http://homer.ucsd.edu/homer/) 56如补充方法(“基于HOMER的Motif富集分析”一节)。
统计分析
每个实验至少进行了三次。采用R软件进行统计分析。
蛋白质提取和定量
用含蛋白酶/磷酸酶抑制剂(罗氏完全不含MINI edta)的RIPA缓冲液(150 mM NaCl, 1% NP-40, 0.5%去氧cholic钠,0.1% SDS, 50 mM Tris pH 8.0)从冷冻细胞颗粒中提取蛋白质,并使用Pierce通用核酸酶用于细胞裂解(ThermoFisher Scientific)处理,如补充方法所述(“蛋白质提取和定量”一节)。使用Pierce BCA蛋白检测试剂盒(ThermoFisher Scientific)检测蛋白浓度。
Western blot分析
蛋白质样品在RIPA缓冲液和4X SDS- page加载缓冲液(200 mM Tris-HCl pH 6.8, 8% SDS[十二烷基硫酸钠],40%甘油,400 mM DTT[二硫苏糖醇],0.4%溴酚蓝)中稀释,并在95°C下变性5分钟,然后加载到NuPAGE Novex 12% bi - tris蛋白凝胶(ThermoFisher Scientific)。将半干燥的蛋白质转移到0.2µm PVDF膜上(来自Biorad的Trans-Blot Turbo Mini 0.2µm PVDF Transfer Packs)。用TBST (TBS [20 mM Tris-Base, 154 mM NaCl, pH 7.5], 0.1% Tween 20) + 5%牛奶在rt下阻断细胞膜30分钟。在4℃下进行一抗染色过夜,在rt下进行二抗染色30分钟。抗体在TBST + 5%牛奶中稀释如下:抗ha抗体(Sigma) 1:1000,抗-β-Actin抗体(Sigma) 1:10 000,抗小鼠酶标二抗(GE Healthcare生命科学)1:10 000 (HA-TAL1染色)和1:10 000 (B-ACTIN染色)。膜用1X PBS + Triton 0.5% + 0.5 M NaCl清洗3次,每次5分钟,1次为10分钟,1X PBS冲洗1次,并使用ECL Prime Western-Blot-System (Merck)冲洗。
参考文献
Lis, R。et al。成人内皮细胞转化为具有免疫功能的造血干细胞。自然545, 439-445(2017)。
Sugimura, R。et al。造血干细胞和人类多能干细胞的祖细胞。自然545, 432-438(2017)。
Lancrin C。et al。成血管细胞通过造血内皮阶段产生造血细胞。自然457, 892-895(2009)。
de Bruijn, M. F., Speck, N. A., Peeters, M. C. & Dzierzak, E.决定性造血干细胞首先在小鼠胚胎的主要动脉区域内发育。EMBO J。19, 2465-2474(2000)。
伯特兰,j.y.。et al。造血干细胞在发育过程中直接来源于主动脉内皮。自然464, 108-111(2010)。
Boisset J.-C。et al。小鼠主动脉内皮生成的造血细胞的体内成像。自然464, 116-120(2010)。
kisa, K. & Herbomel, P.血液干细胞通过一种新型的细胞转化从主动脉内皮中产生。自然464, 112-115(2010)。
Bergiers,我。et al。单细胞转录组学揭示了转录因子在胚胎造血过程中的一种新的动态功能。eLife7, r106(2018)。
Guibentif C。et al。单细胞分析确定了人类从内皮到造血转变的不同阶段。细胞的代表。19, 10-19(2017)。
威尔逊,美国。et al。血液干细胞/祖细胞的组合转录控制:十个主要转录调控因子的全基因组分析。细胞干细胞7, 532-544(2010)。
D’souza, S. L. SCL/Tal-1对血管母细胞的造血功能至关重要,但对其发育无关。血105, 3862-3870(2005)。
恩多,M.,小川,M., Orkin, S. &西川,S.- i。SCL/tal-1依赖过程决定了在内皮分化之前选择最终造血谱系的能力。EMBO J。21, 6700-6708(2002)。
宝卓,C。et al。T细胞白血病癌蛋白SCL/tal-1对于所有造血谱系的发展是必不可少的。细胞86, 47-57(1996)。
罗伯,L。et al。scl基因靶向破坏小鼠卵黄囊造血功能缺失。Proc。国家的。学会科学。92, 7075-7079(1995)。
Schlaeger, t.m, Mikkola, H. K. A, Gekas, C., Helgadottir, H. B. & Orkin, S. H. tie2cre介导的基因切除定义了造血干细胞发育过程中干细胞白血病基因(SCL/tal1)依赖的窗口期。血105, 3871-3874(2005)。
Shivdasani, R. A., Mayer, E. L. & Orkin, S. H.在缺乏t细胞白血病癌蛋白tal-1/SCL的小鼠中缺乏血液形成。自然373, 432-434(1995)。
Stanulovic, V. S., Cauchy, P., Assi, S. A. & Hoogenkamp, M. LMO2是TAL1 DNA结合活性和成血管细胞阶段最终造血启动所必需的。核酸测定。45, 9874-9888(2017)。
坎迪娅·迈克威廉H。et al。EMBL-EBI中的分析工具web服务。核酸测定。41, w597-600(2013)。
Mellentin, J. D., Smith, S. D. & Cleary, M. L. lyl-1是T细胞白血病中染色体易位改变的一种新基因,编码一种具有螺旋-环-螺旋DNA结合基序的蛋白质。细胞58, 77-83(1989)。
苏oullas, G. P., Salmon, J. M., Sablitzky, F., Curtis, D. J. & Goodell, M. A.成人造血干细胞和祖细胞需要Lyl1或Scl来存活。干细胞4, 180-186(2009)。
赵绍坤et al。Lyl1在原始红细胞生成中的新作用。发展145(19), dev162990(2018)。
金,P. G。et al。信号轴涉及刺猬,Notch和Scl促进胚胎内皮到造血的转变。Proc。国家的。学会科学。美国110, e141-e150(2013)。
Chagraoui, H。et al。SCL/TAL1与Polycomb RYBP-PRC1合作抑制血命运细胞中的替代谱系。Commun Nat。9, 5375-5417(2018)。
Ismailoglu, I., Yeamans, G., Daley, G. Q., Perlingeiro, R. C. R. & Kyba, M. SCL的中胚层模式活动。Exp。内科杂志。36, 1593-1603(2008)。
Org, T。et al。Scl与中胚层启动增强子结合,调节造血和心脏命运分化。EMBO J。34, 759-777(2015)。
Schoenebeck, J. J., Keegan, B. R. & Yelon, D.血管和血液规格高于前中胚层的心脏电位。Dev细胞。13, 254-267(2007)。
范亨德尔,B。et al。Scl在潜在的造血内皮和心内膜抑制心肌发生。细胞150, 590-605(2012)。
张海燕,吴斌,张海燕,张文杰。ATAC-seq:一种检测染色质可达性的方法。咕咕叫。Protoc。摩尔。杂志。109, 21-29(2015)。
Picelli, S。et al。使用Smart-seq2从单细胞获得全长RNA-seq。Protoc Nat。9, 171-181(2014)。
大麦的一种,我。et al。定量差异转录因子活性和基于多组学的分类为激活子和抑制子:diffTF。细胞的代表。29, 3147 - 3159。e12汽油(2019)。
安德烈奇,J。et al。肌细胞分化过程中AP-1转录复合物的组成及功能。生物。化学。277, 16426-16432(2002)。
德洛斯,G。et al。激活蛋白-1 (AP-1)家族成员在cd30阳性淋巴瘤中的作用癌症(巴塞尔)10, 93(2018)。
Obier, N。et al。AP-1与TEAD4的协同结合调节血管平滑肌与造血细胞命运的平衡。发展143, 4324-4340(2016)。
周,J。et al。SWI/SNF染色质重塑复合物调节心肌诱导的平滑肌特异性基因表达。Arterioscler。Thromb。Vasc。医学杂志。29, 921-928(2009)。
Love, m.i, Huber, W. & Anders, S.使用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。基因组医学杂志。15, 550-621(2014)。
Lancrin C。et al。GFI1和GFI1B在造血过程中控制造血内皮内皮细胞内皮特性的丧失。血120, 314-322(2012)。
穆肯斯基,m.l.。et al。功能c-myb基因是正常小鼠胎儿肝造血所必需的。细胞65, 677-689(1991)。
米科拉,香港et al。造血干细胞在缺乏干细胞白血病SCL/tal-1基因的情况下保持长期的再生活性和多能性。自然421, 547-551(2003)。
Goupille, O., Saint Cloment, C., Lopes, M., Montarras, D. & Robert, B. Msx1和Msx2在血管平滑肌细胞亚群中表达。Dev,直流发电机。237, 2187-2194(2008)。
李霞,周娟,黄坤。抑制lncRNA Mirt1通过抑制NF-κB活化减轻急性心肌梗死。细胞杂志。物化学。42, 1153-1164(2017)。
刁旸,王霞,吴哲。SOCS1、SOCS3和PIAS1通过抑制白血病抑制因子诱导的JAK1/STAT1/STAT3通路促进肌源性分化。摩尔。细胞。医学杂志。29, 5084-5093(2009)。
苏莱曼尼,v。D。et al。蜗牛调节MyoD结合位点的占用,以指导增强子开关和分化特异性转录在肌发生。摩尔。细胞47, 457-468(2012)。
Solaimani Kartalaei, P。et al。对内皮细胞向造血干细胞转变的全转录组分析显示,在造血干细胞生成过程中需要Gpr56。实验,医学。212, 93-106(2015)。
Scialdone,。et al。通过单细胞表达分析解决早期中胚层多样化。自然535, 289-293(2016)。
甄,F。et al。造血内皮规范和造血干细胞维持采用不同的Scl异构体。发展140, 3977-3985(2013)。
Lichtinger, M。et al。RUNX1重塑了造血开始时的表观遗传景观。EMBO J。31, 4318-4333(2012)。
舒赫,a.h.。et al。ETO-2在红细胞和巨核细胞中与SCL结合,并在红细胞生成中发挥抑制作用。摩尔。细胞。医学杂志。25, 10235-10250(2005)。
Wadman, i.a。et al。LIM-only蛋白Lmo2是一个桥接分子,组装一个红系dna结合复合体,其中包括TAL1, E47, GATA-1和Ldb1/NLI蛋白。EMBO J。16, 3145-3157(1997)。
Adamov, A, Serina Secanechia, Y. N. & Lancrin, C.胚胎和成人内皮细胞的单细胞转录组分析可以对出生后内皮的产血潜力进行排序。Sci代表。12, 12177年。https://doi.org/10.1038/s41598-022-16127-0(2022)。
Iacovino, M。et al。诱导盒式交换:一种在胚胎干细胞和原代细胞中使有条件基因表达的快速和有效的系统。干细胞29, 1580-1588(2011)。
Vargel, O。et al。TGFβ通路的激活损害内皮细胞的造血转变。科学。代表。6, 21518(2016)。
奥特利,M。et al。单细胞转录组学鉴定CD44是内皮细胞向造血细胞转变的标志和调节因子。Commun Nat。11, 586-618(2020)。
Afgan E。et al。用于可访问、可复制和协作生物医学分析的银河平台:2018年更新。核酸测定。46, w537-w544(2018)。
多布林,一个。et al。STAR:超快通用RNA-seq校准器。生物信息学29, 15-21(2013)。
金久,M. &后藤,S. KEGG:京都基因和基因组百科全书。核酸测定。28, 27-30(2000)。
亨氏,S。et al。谱系决定转录因子的简单组合是巨噬细胞和B细胞鉴定所需的主要顺式调节元件。摩尔。细胞38, 576-589(2010)。
确认
我们感谢Cora Chadick和Christopher Hall (EMBL罗马FACS设施,意大利)的细胞分类;Vladimir Benes (EMBL,基因组学核心设施,海德堡,德国)的下一代测序;Daria Bunina (EMBL,海德堡,德国)在荷马分析方面提供帮助,Valentina Carlini (EMBL,意大利)和Cristina Policarpi (EMBL,意大利)在CRISPR/CAS9基因编辑方面提供建议;Ana Boskovic (EMBL,意大利),Katharina Koch (EMBL,意大利)对手稿进行批判性阅读;Kim Dale(苏格兰邓迪大学),Jamie Hackett (EMBL,意大利)和Karima Kissa(蒙彼利埃大学,法国)进行了富有成果的科学讨论。欧洲分子生物学实验室支持这项工作。
资金
由Projekt DEAL启动和组织的开放获取资金。
作者信息
作者及隶属关系
贡献
y.n.s.s.,概念化,形式化分析,调查,监督,可视化,写作-初稿,写作-审查和编辑;i.b.,概念化,形式分析,写作评审与编辑,监督;硕士,形式化分析,可视化,写作评论和编辑;C.A,形式化分析,可视化,写作评论和编辑;N.D,形式化分析,可视化,写作评论和编辑;研究、调查、写作、编辑;N.L.-A。,Investigation, Writing—review and editing; K.G., Investigation, Writing—review and editing; C.K., Investigation, Writing—review and editing; L.B., Investigation, Writing—review and editing; A.G., Investigation, Writing—review and editing; A.U., Investigation, Writing—review and editing; A.A., Investigation, Writing—review and editing; J.B.Z., Supervision, Investigation, Writing— review and editing; C.L., Conceptualization, Formal analysis, Supervision, Investigation, Visualization, Methodology, Writing—original draft, Project administration, Writing—review and editing.
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Serina Secanechia, y.n., Bergiers, I., Rogon, M.。et al。确定主调节器的新角色Tal1内皮细胞向造血细胞的转变。Sci代表12, 16974(2022)。https://doi.org/10.1038/s41598-022-20906-0
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-20906-0