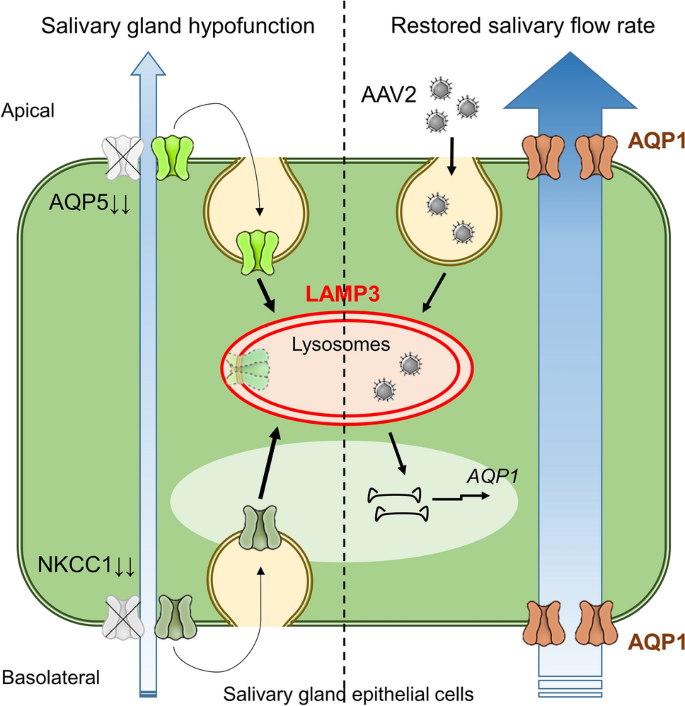
摘要
Sjögren’s病(SjD)是一种慢性自身免疫性涎腺炎,导致唾液腺功能减退并伴有口干症状。先前的研究表明,溶酶体相关膜蛋白3 (LAMP3)过表达参与了与SjD相关的唾液腺功能减退的发展。然而,其分子机制尚不清楚,目前尚无有效的治疗方法来逆转SjD中的腺体功能。对SjD患者唾液腺样本的分析表明,唾液腺功能低下与钠-钾-氯化钠共转运蛋白-1 (NKCC1)和水通道蛋白5 (AQP5)的表达降低有关,这是参与唾液分泌的膜蛋白。进一步的研究表明,LAMP3过表达通过促进内溶酶体降解降低其表达水平。此外,我们发现LAMP3过表达通过促进内溶酶体途径增加腺相关病毒血清型2 (AAV2)的内化,从而增强了基因转移。AAV2载体编码逆行插管AQP1基因(AAV2-AQP1)进入唾液腺诱导AQP1的腺性表达足以恢复lamp3过表达小鼠的唾液腺流量。LAMP3可能通过促进NKCC1和AQP5的内溶酶体降解,在SjD唾液腺功能减退的发展中发挥关键作用。但也可以通过诱导AQP1的表达,增强aav2介导的基因转移,恢复流体运动。这些结果表明AAV2-AQP1基因治疗可逆转SjD患者的唾液腺功能。
唾液通过启动消化过程和控制口腔感染在我们的健康中起着至关重要的作用1.Sjögren’s disease (SjD)是一种慢性疾病,可导致分泌功能减退,伴有口干和/或眼干(sicca)症状,损害患者的口腔和眼睛健康以及生活质量。这种自身免疫性外分泌病的特点是淋巴细胞浸润到受影响的腺体和存在血清自身抗体,如抗ro /SSA和抗la /SSB抗体2.
SjD被认为是一种上皮炎,腺体的上皮功能障碍是其突出特征,最终可导致上皮细胞凋亡3..最近的微阵列和共聚焦免疫荧光研究表明,与健康腺体相比,SjD患者唾液腺上皮细胞凋亡的增加与溶酶体相关膜蛋白3 (LAMP3)表达的增加有关。4,5,6.此外,我们之前的研究表明,LAMP3过表达降低了涎腺上皮细胞中与唾液分泌有关的质膜蛋白的表达,如氯化钠钾共转运蛋白-1 (NKCC1)和水通道蛋白5 (AQP5)6.此外,过表达lamp3的小鼠出现sjd样唾液腺功能减退,唾液流率(SFR)与NKCC1和AQP5表达水平呈强正相关6.尽管在小鼠模型中,NKCC1和AQP5表达的降低被认为是分泌功能减退的关键,但在机制上,LAMP3如何降低这些膜蛋白的表达尚不清楚。
NKCC1是在涎腺上皮细胞基底外侧膜上表达的离子共转运体,在外分泌腺液分泌中起关键作用7,8,9.AQPs是促进水在质膜上运动的水通道家族,具有许多关键功能,包括流体稳态和腺体分泌10,11.aqp中,AQP5在唾液腺上皮细胞的根尖膜上表达,AQP1是一个典型的不受调节的水通道,可以在各种细胞的根尖膜和底外侧膜上表达11.因此,在唾液腺上皮中AQP1的表达为唾液腺中的液体分泌创造了一个新的途径12.
由于SjD患者唾液腺功能减退的病理生理机制尚不清楚,因此只有姑息性治疗可以缓解SjD患者的sicca症状2.阐明lamp3相关唾液腺功能减退的分子细节对于开发一种恢复SjD唾液腺功能的新治疗方法至关重要。
在本研究中,我们发现LAMP3可以通过激活内溶酶体途径促进NKCC1和AQP5的降解,导致唾液腺功能减退。这一发现表明,腺体功能的恢复需要开发一种新的途径,而不是NKCC1和AQP5在唾液腺中启动和转运液体。一种潜在的治疗方法可能涉及通过腺相关病毒(AAV)载体进行基因转移。我们发现LAMP3过表达可以通过上调AAV血清型2 (AAV2)的内吞作用来提高基因转导效率。LAMP3对AAV2转导的影响表明其可以促进AAV2基因的转移和表达。最后,我们观察到aav2介导AQP1基因治疗可恢复过表达lamp3小鼠的SFR。这些发现支持aav2介导的AQP1基因疗法替代降低的NKCC1和AQP5表达作为纠正SjD患者lamp3相关唾液腺功能减退的治疗方法。
结果
NKCC1和AQP5表达降低与SjD患者唾液腺功能减退有关
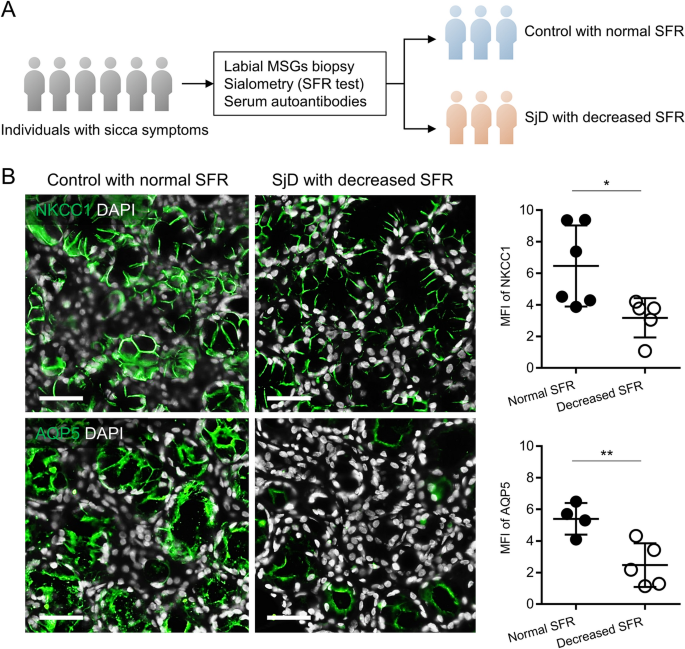
我们之前的研究表明,在过表达lamp3的小鼠中,NKCC1和AQP5表达的降低与唾液腺功能减退有关6.为了检验同样的结果是否适用于SjD患者,我们从11个有sicca症状的个体中获得了唇小唾液腺活检(图2)。1A及补充表1).免疫荧光染色显示SjD患者SFR降低的腺体中NKCC1和AQP5表达水平显著降低(n= 5),与SFR正常的对照组相比(n= 6)(图1B).这些结果表明,NKCC1和AQP5表达降低与SjD患者的唾液腺功能减退有关。
LAMP3通过体外溶酶体途径促进NKCC1和AQP5的降解
细胞膜蛋白如NKCC1和AQP5一般通过内溶酶体途径降解13.我们之前对过表达lamp3的小鼠唾液腺转录组的分析显示,在Slc12a2(编码NKCC1)和Aqp5mRNA表达,尽管NKCC1和AQP5蛋白水平较低,以及核内体和溶酶体相关基因表达增加6.这一转录组分析产生了一个假设,即LAMP3可以通过激活内溶酶体途径在转录后水平促进NKCC1和AQP5的降解。在目前的研究中,我们进一步在体外测试了这一假设。
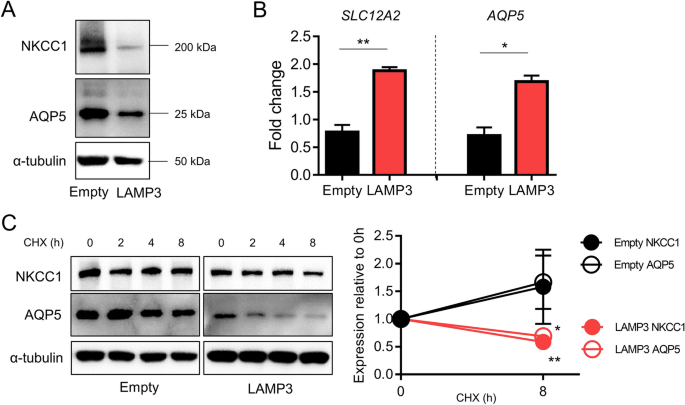
通过Western blotting分析,LAMP3在人唾液腺(HSG)细胞中的过表达降低了NKCC1和AQP5蛋白水平。2A)尽管增加了SLC12A2而且AQP5mRNA水平(图;2此外,我们发现过表达lamp3的HSG细胞经环六甲酰胺(一种蛋白质合成抑制剂)处理后,与空质粒转染细胞相比,NKCC1和AQP5的表达显著降低(图2)。2C).体外过表达LAMP3增加了NKCC1和AQP5的降解,这与我们之前在过表达LAMP3小鼠中的发现一致6.
LAMP3促进NKCC1和AQP5的体外降解。用LAMP3表达或空质粒(3.0 μg / 1 × 10)转染HSG细胞6细胞)。(一个)转染48 h后显示NKCC1、AQP5或α-微管蛋白(内对照)表达的代表性Western印迹。(B)的相对变化SLC12A2而且AQP5mRNA表达ACTB转染48 h后实时定量PCR检测表达量。(C用50 μg/mL环己亚胺(CHX)处理细胞数小时后,得到具有代表性的Western印迹。图中显示了8小时后相对于基线的剩余蛋白表达。所示值为平均值±SEM(所有实验n = 3)。*P< 0.05, **P< 0.01(学生的t测试)。原始的未裁剪斑点显示在补充图中。1.
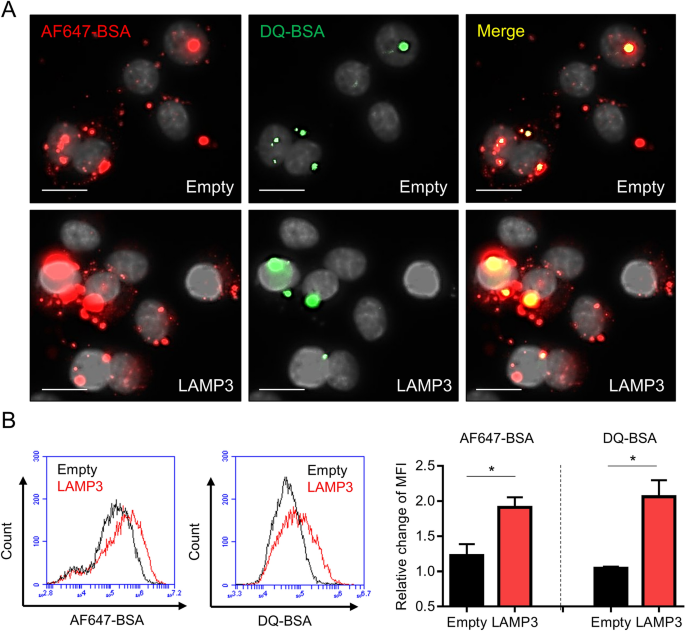
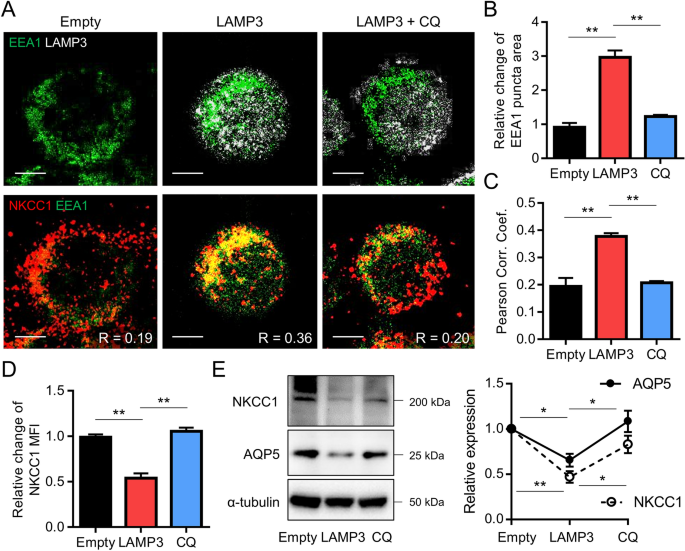
为了研究LAMP3过表达是否会刺激内溶酶体通路,将过表达LAMP3的HSG细胞与Alexa Fluor 647偶联的BSA和DQ-BSA(蛋白酶的荧光底物)孵育,并通过流式细胞术定量信号,并使用荧光显微镜观察。LAMP3过表达显著增加了通过胞吞作用进入细胞的Alexa Fluor 647信号摄取强度,以及DQ-BSA信号在内溶酶体降解时的脱淬强度(图。3.).这些结果表明,LAMP3过表达促进细胞内吞作用和内溶酶体降解。
为了进一步研究LAMP3诱导的膜蛋白内溶酶体降解的增加,我们对过表达LAMP3的HSG细胞进行了早期内溶体抗原1 (EEA1)、NKCC1和LAMP3的联合染色。免疫细胞化学分析显示,LAMP3过表达刺激EEA1蛋白的积累(图。4A,B), EEA1和NKCC1共定位(图。4A,C),提示LAMP3促进NKCC1蛋白的内吞作用。用氯喹(CQ)治疗-一种内溶酶体途径的抑制剂-减少了EEA1的积累(图。4A,B)和EEA1/NKCC1共定位(图。4A,C),导致NKCC1表达增加(图。4A, D)。Western blotting分析显示,LAMP3过表达降低了这些细胞中NKCC1和AQP5蛋白的表达,而CQ处理则逆转了这一情况(图2)。4E).这些结果表明LAMP3过表达通过激活内溶酶体途径促进NKCC1和AQP5的降解。
LAMP3通过促进体外内溶酶体降解增加NKCC1和AQP5的降解。用LAMP3表达或空质粒(3.0 μg / 1 × 10)转染HSG细胞6用25 μM的氯喹(CQ)处理6h (一个) LAMP3(灰色)或NKCC1(红色)和EEA1(绿色)的代表性免疫荧光图像(比例尺= 5µm)。(B- - - - - -D)柱状图显示(B) EEA1点面积的相对变化,(C) EEA1与NKCC1的Pearson相关系数,(D) NKCC1染色平均荧光强度(MFI)的相对变化(n所有实验均为3)。(E)显示NKCC1、AQP5和α-微管蛋白(内控)表达的代表性Western印迹。图表显示NKCC1和AQP5相对于空(n= 3)。所示值为平均值±SEM。**P< 0.01t测试;Bonferroni校正用于校正多次测试)。原始的未裁剪斑点显示在补充图中。1.
LAMP3在体内促进NKCC1和AQP5的内溶酶体降解
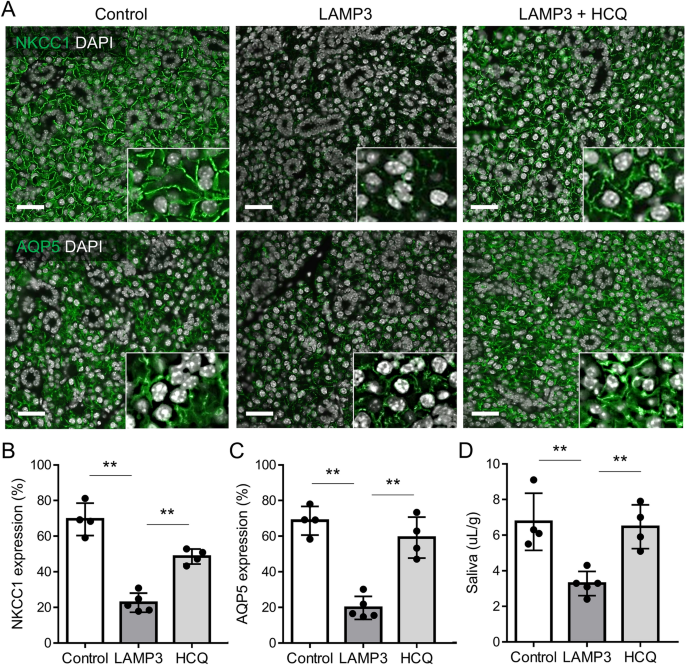
为了研究LAMP3在体内和体外是否通过内溶酶体途径降低NKCC1和AQP5的表达,我们每周腹腔注射羟氯喹(HCQ的衍生物)治疗过表达LAMP3的小鼠。唾液腺组织免疫荧光分析显示,HCQ处理显著提高了过表达lamp3小鼠唾液腺中NKCC1和AQP5的表达(图2)。5a - c)。在过表达lamp3的小鼠中,HCQ处理还诱导毛罗果素刺激的SFR显著增加(图2)。5D),与恢复的NKCC1和AQP5表达一致。综上所述,体内实验结果提示LAMP3过表达通过促进NKCC1和AQP5的内溶酶体降解导致唾液腺功能减退。
LAMP3在体内通过内溶酶体降解NKCC1和AQP5导致唾液腺功能减退。在C57BL/6小鼠颌下腺灌注AAV2-LAMP3或AAV2-GFP(对照)后,每周腹腔注射60 mg/kg的羟氯喹(HCQ),连续4个月。(一个具有代表性的颌下腺免疫荧光图像显示NKCC1或AQP5染色(均为绿色)(比例尺= 20µm)。(B,C)柱状图显示(B) NKCC1及(C)颌下腺标本各核区AQP5的表达。(D)在20分钟内,匹罗卡品刺激的每体重唾液流量。所示值为平均值±标准差(4只对照组,5只lamp3过表达小鼠,4只hcq处理的lamp3过表达小鼠)。**P< 0.01t测试;Bonferroni校正用于校正多次测试)。
LAMP3通过激活内吞作用增加aav2诱导的基因转导
考虑到LAMP3过表达导致唾液腺功能减退的发病机制,替代NKCC1和AQP5表达下降是恢复SjD患者唾液腺功能的一种有前景的方法。基因治疗是一种将遗传物质转移到细胞中以取代功能蛋白质缺失的技术14.AAV是一种具有线性单链DNA基因组的小型非包膜病毒,由于其可用性和将基因转移到各种细胞类型的能力,是研究最活跃的基因治疗载体之一15.AAV转导依赖于适当的细胞内运输,通过内溶酶体途径到达细胞核并表达编码的基因16.由于我们观察到LAMP3激活了内溶酶体蛋白降解,我们研究了LAMP3在AAV转导中的作用。
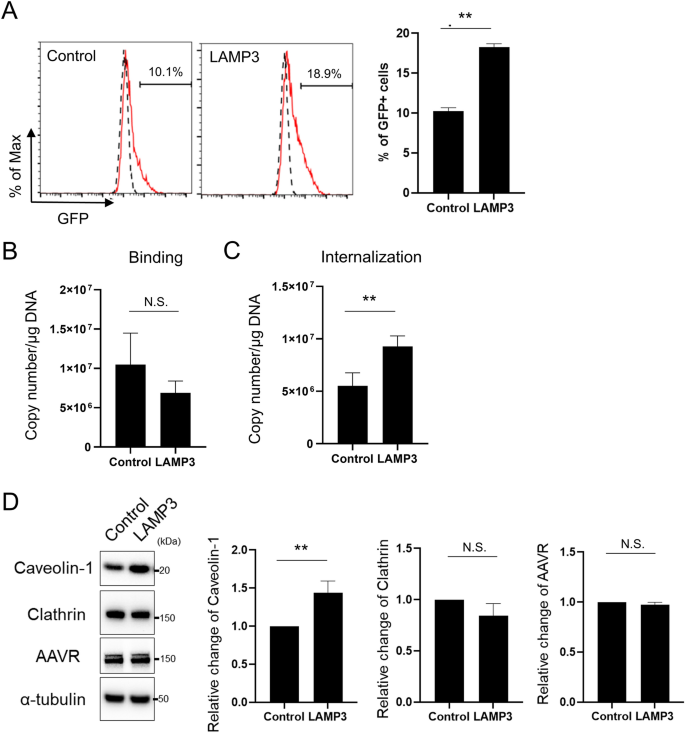
比较过表达lamp3与对照HSG细胞AAV转导效率。与AAV2-GFP颗粒孵育后,过表达lamp3的细胞培养物中gfp阳性细胞的数量显著高于对照细胞培养物(图2)。6A),提示LAMP3增强AAV转导。
LAMP3促进腺相关病毒的内化和体外基因转导。(一个- - - - - -C稳定过表达lamp3和对照的HSG细胞与AAV2-GFP颗粒(感染数量:50,000)孵育1小时(一个48 h后流式细胞术定量细胞内GFP信号。病毒拷贝数(B)结合在细胞膜上和(C),每1 μg DNA内化为细胞。(D)在稳定过表达lamp3和对照的HSG细胞中,有代表性的Western印迹显示了caveolin-1、网格蛋白、KIAA0319L (AAVR)和α-微管蛋白(内控)的表达。柱状图显示指示蛋白的相对表达。所示值为平均值±SEM (n所有实验均为3)。**P< 0.01, N.S. =不显著(学生的t测试)。原始的未裁剪斑点显示在补充图中。1.
为了更好地理解AAV转导与LAMP3相关的机制,我们对AAV转导过程中的初始步骤进行了研究。虽然LAMP3过表达不影响AAV2-GFP颗粒与细胞膜的结合(图。6B),它确实显著增加病毒载体的内化(图。6C).这些结果表明LAMP3可以通过增强内化来辅助AAV转导。
为了阐明lamp3增强AAV内化的分子细节,我们评估了过表达lamp3的细胞内吞相关蛋白的表达。Western blotting分析显示,LAMP3过表达显著增加了caveolin-1的表达,但没有增加网格蛋白的表达(图2)。6D)。与结合试验的结果一致,LAMP3过表达不会改变诵读困难相关蛋白kiaa0319样蛋白(KIAA0319L,也称为AAV受体)的表达,该蛋白与AAV2结合相关(图。6D)。
AAV2-AQP1基因治疗可恢复过表达lamp3小鼠的唾液流量
上述数据表明,通过AAV载体进行基因治疗可能是一种恢复腺体功能的方法。鉴于LAMP3可能通过下调与唾液分泌有关的多种蛋白质来诱导唾液腺功能减退,这似乎是创建一种新的途径来启动唾液腺中的液体运动的最佳方法。最近的临床和临床前研究表明AQP1基因治疗可以为放射引起的唾液腺功能减退患者创造新的液体运动途径17.
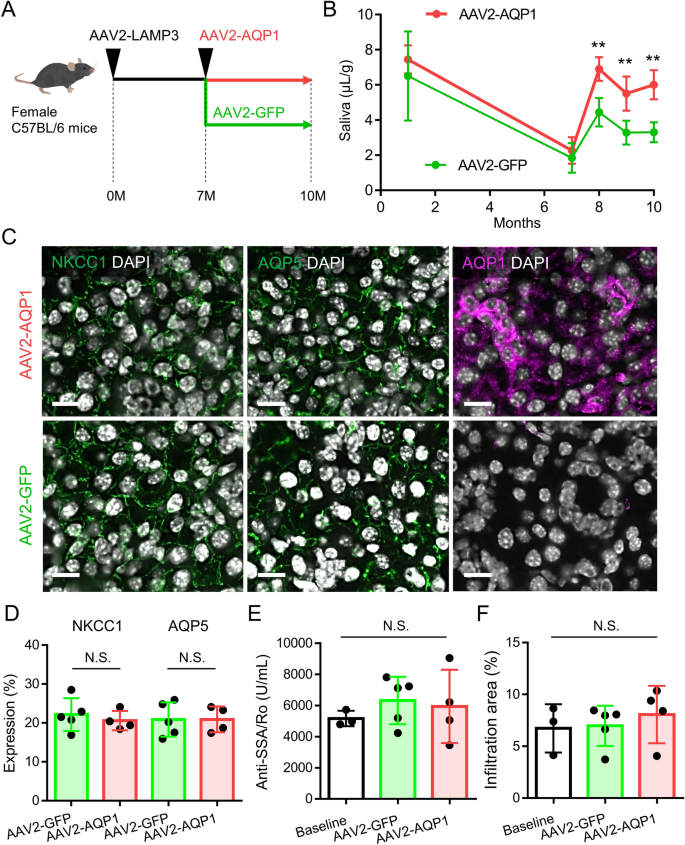
为了测试aav介导的基因治疗是否对治疗lamp3相关的唾液腺功能减退有效,我们在过表达lamp3的小鼠中研究了AAV2-AQP1基因治疗的效果,这些小鼠出现sjd样表型,进行性唾液腺功能减退,抗ro /SSA抗体产生,淋巴细胞浸润6.AAV2-LAMP3逆行导管灌注7个月后,AAV2-AQP1或对照AAV2-GFP也通过逆行插管传递到C57BL/6小鼠的颌下腺(图。7一个)。
AAV2-AQP1基因治疗可恢复过表达lamp3小鼠的唾液流量。(一个)通过逆行插管AAV2-LAMP3实现C57BL/6小鼠颌下腺的过表达。7个月后,通过逆行插管将AAV2-AQP1或AAV2-GFP(对照)递送到过表达lamp3的小鼠颌下腺。(B)匹罗卡品刺激小鼠20分钟内每体重的唾液流量。(C)下颌腺NKCC1(绿色)、AQP5(绿色)或AQP1(品红)的代表性免疫荧光图像(比例尺= 10µm)。(D)腺体中NKCC1和AQP5的表达区。(E)血清抗ssa /Ro抗体水平。(F)腺体内淋巴细胞浸润面积大小。所示值为平均值±标准差(3只基线小鼠,5只aav2 - gfp处理小鼠,4只aav2 - aqp1处理小鼠)。**P< 0.01, N.S. =不显著,学生t测试;Bonferroni校正用于校正多次测试)。
与对照治疗(AAV2-GFP)相比,AAV2-AQP1治疗显著恢复毛罗果素刺激的SFR,这在1个月后可见,并持续至少3个月(图2- aqp1)。7B)。与对照组相比,AAV2-AQP1处理诱导AAV2-AQP1处理小鼠腺状AQP1蛋白表达,但不影响NKCC1和AQP5的表达(图2-AQP1)。7C, D)。AQP1的表达主要集中在唾液腺上皮细胞(图。7C),与AAV2向性一致18,19.与对照治疗(AAV2-GFP)和基线相比,AAV2-AQP1治疗没有显著改变血清抗ro /SSA抗体水平,也没有改变腺体中淋巴细胞浸润区域的大小(图。7E、F)。这些结果如图所示。8.
讨论
在本研究中,我们发现LAMP3过表达激活唾液腺上皮细胞的内溶酶体通路是一种新的作用机制。此外,我们证实LAMP3通过促进NKCC1和AQP5的内溶酶体降解,在SjD相关的唾液腺功能减退的发展中发挥重要的病理生理作用。这些发现导致了一种假设,即我们需要引入一种新的机制来启动腺体腔内的液体运动,以恢复lamp3相关的唾液腺功能减退。在本研究中,我们通过将水通道AQP1引入唾液腺上皮细胞来验证这一假设。有趣的是,LAMP3过表达通过促进的内溶酶体途径增加了AAV感染及其基因转导效率。我们的研究结果表明,在aav介导后,有可能增加该模型中的流体运动AQP1基因转移。
虽然SjD被认为是一种全身性疾病,但患者的主要抱怨是严重的sicca症状(表明分泌功能丧失)以及这些症状对日常生活的许多方面的影响2.为了满足患者的需求,针对特定局部特征的治疗已经被研究。可溶性CTLA4IgG融合蛋白和白介素-17通路调节剂等分子基因传递到SjD小鼠模型的唾液腺已显示出前景20.,21,22.基因治疗到唾液腺的一个优点是,通过基因转移的局部免疫调节剂的传递导致更高的局部浓度和可比的治疗效果,同时最大限度地减少与系统传递相同药物分子相关的副作用。
在过去的10年里,基因治疗领域从概念发展到临床阶段和药物批准。例如,在一期临床试验中,腺病毒介导AQP1基因转移成功地恢复了接受电离放疗治疗头颈部癌症的慢性口干症患者的唾液腺功能17.在这项试验中,将腺病毒载体注射到腮腺中,但尚不清楚这是否是基因转移到唾液腺的最佳载体。另一项使用aav2介导的临床试验AQP1目前正在对同一患者群体的唾液腺进行转移(NCT02446249)。其结果有望提供更多关于AAV2载体剂量的信息,并可能支持该治疗在SjD中的应用。
AQPs是一种新的药物靶点,因为除SjD外,其功能障碍还涉及许多病理,如肿瘤、缺血性疾病和创伤性损伤23.例如,AQP4在血脑屏障和血脊髓屏障中的表达与中风或脊髓损伤后的脑或脊髓水肿有关24,25.然而,目前还没有aqp靶向药物被批准用于临床26.目前的研究表明aav2介导的基因转移是一种靶向AQP功能的替代方法。先前的研究表明,影响转导途径关键步骤的疾病过程可以阻断AAV转导15.但是,SjD患者唾液腺中的LAMP3错表达可能有利于AAV2介导的基因转移,因为我们发现LAMP3通过激活内溶酶体途径增强AAV2的转导。
骨形态发生蛋白6 (Bone morphogenetic protein 6, BMP6)是SjD患者唾液腺中另一种上调的蛋白,与病理生理有关27.此前,我们报道了涎腺上皮LAMP3表达通过细胞外释放HSP70和激活toll样受体4刺激单核细胞产生BMP628.BMP6减少AQP5转录水平的表达27,28,29.当将这些数据与我们发现的LAMP3介导的AQP5转录后降解结合起来时,我们可以认为LAMP3和BMP6在转录和转录后水平共同下调AQP5的表达,导致唾液腺功能减退。在bmp6过表达小鼠中,aav2介导的AQP1表达也能恢复SFR30..
病毒感染及随后的免疫反应,特别是干扰素的诱导,与SjD自身免疫的发展密切相关31,32.因此,使用病毒载体的基因治疗可能会造成SjD自身免疫恶化的潜在风险。AAV是一种非致病性病毒,在人体中引起非常轻微的免疫反应33.与基线相比,我们观察到AAV2-AQP1治疗后SjD小鼠模型中抗Ro/SSA的血清自身抗体或腺淋巴细胞浸润没有显著增加。
总之,我们发现SjD患者唾液腺功能低下与唾液腺上皮细胞中NKCC1和AQP5表达减少有关,其中LAMP3的表达激活了内溶酶体途径并促进了这些蛋白质的降解。此外,我们发现LAMP3激活的内溶酶体途径增加了AAV转导,并证明AAV2-AQP1基因治疗改善了SjD小鼠模型中LAMP3相关的唾液腺功能减退。我们的研究结果表明,AAV2-AQP1基因治疗可能有助于SjD患者唾液腺功能减退的管理。
方法
病人
研究参与者是在日本札幌的北海道大学医院招募的。根据《赫尔辛基宣言》原则采集唇小唾液腺、唾液和血清等临床样本。所有方案均由北海道大学医院伦理委员会批准(批准号:014-0466)。获得所有参与者的知情同意。参与者的临床情况汇总在补充表中1.
动物
用编码lamp3基因的AAV2载体生成过表达小鼠LAMP3(AAV2-LAMP3)使用逆行插管6 - 8周龄雌性C57BL/6小鼠的双颌下腺(Charles River Laboratories, USA),如前所述6.对照组改用含有绿色荧光蛋白基因(AAV2- gfp)的AAV2载体。如前所述,lamp3过表达小鼠每周腹腔注射60 mg/kg体重的羟氯喹(HCQ, Plaquenil®片剂,PBS, Sanofi, USA),持续4个月34.另一组过表达lamp3的小鼠接受AAV2载体编码的基因AQP1(AAV2-AQP1)或AAV2-GFP (1011颗粒/小鼠在100 μl)通过逆行插管双下颌下腺,如前所述30..治疗组被盲目分配到每一笼小鼠,但没有进行随机分配。对所有小鼠进行分析,没有任何纳入和排除标准。结果由盲法研究人员进行评估。本研究未对混杂因素进行控制。
如前所述,在插管后的几个时间点测定了20分钟内匹罗笛酚刺激的SFR6.在研究结束时,收集血清和整个颌下腺。根据制造商说明书,使用固相ELISA (#5710, Alpha Diagnostic International)检测血清抗ro /SSA抗体的存在。
所有涉及活体动物的程序都是按照美国国立卫生研究院《实验动物护理和使用指南》的机构准则和标准操作程序进行的。所有的方案都得到了国家牙科和颅面研究所兽医资源核心伦理委员会的批准(批准号:18-863)。所有方法均按照reach指南进行报告(https://arriveguidelines.org),以汇报动物实验。
Immunofluorescent染色
福尔马林固定,石蜡包埋的唾液腺切片安装在玻片上,脱蜡,再水化,并进行柠檬酸微波抗原提取。用2% BSA (Sigma-Aldrich)在PBS中室温封闭玻片30分钟,4℃下用以下一种一抗孵育过夜:10 μg/mL兔抗nkcc1(人4828号,小鼠85,403号,Cell Signaling Technology,美国)、兔抗aqp5 (#AQP-005, Alomone labs,以色列)或兔抗aqp1 (#ab168387, Abcam,美国)。
取10 μg/mL Alexa Fluor 488或Alexa Fluor 594 AffiniPure驴抗兔IgG (H + L)(均来自Jackson Immuno Research)室温孵育1 H,然后用DAPI安装介质(Abcam)复染。
为了数据采集和分析,每个样品用荧光显微镜采集3至5张图像(尼康,日本)。蛋白表达水平通过对照兔IgG染色信号的减法测定(Jackson ImmunoResearch),并使用ImageJ软件(公共领域来源:美国国立卫生研究院)通过DAPI强度归一化。
细胞
HSG细胞由Indu Ambudkar博士(国家牙科和颅面研究所)提供,在DMEM(美国赛默飞世尔科学公司)中培养,添加10% FBS,并在37°C和5% CO中培养2.如前所述,瞬时转染编码lamp3的质粒,建立稳定过表达lamp3的HSG细胞5.
所有实验均使用30传代内的HSG细胞在70-80%汇合(加倍时间:24 h)。在实验前使用MycoAlert支原体检测试剂盒(Lonza, Switzerland)检查支原体污染。
免疫细胞化学
将HSG细胞用4%多聚甲醛固定15分钟,用0.1% Triton-X-100 (Sigma-Aldrich)渗透10分钟,然后用2% BSA封闭30分钟,均在室温下进行。细胞在4℃下用10 μg/ml一抗培养过夜:Alexa Fluor 488直接标记的抗lamp3抗体(#12,632-1-AP, Proteintech), Alexa Fluor 594直接标记的抗eea1抗体(#PA1-063A, Thermo Fisher Scientific)和Alexa Fluor 647直接标记的抗nkcc1抗体(#4828,Cell Signaling Technology)。抗体使用Lightning-Link快速标记试剂盒(Novus biicals, USA)进行标记。切片用DAPI安装介质(Abcam)反染色。所有图像均使用共聚焦荧光显微镜(Nikon, Japan)采集,并使用ImageJ软件进行分析。
定量实时逆转录PCR
使用RNeasy Mini Kit (QIAGEN,美国)提取HSG细胞的总RNA,用RNase-Free DNase Set (QIAGEN)处理,并使用SuperScript VILO cDNA Synthesis Kit (Thermo Fisher Scientific)逆转录成cDNA。实时定量PCR反应采用TaqMan基因表达测定(赛默飞世尔科学公司)和以下TaqMan探针:SLC12A2(Hs00169032_m1),AQP5(Hs00387048_m1),ACTB(Hs01060665_g1)。基因表达相对ACTB采用ΔΔCt方法计算。在Quantstudio3 Real-Time PCR系统(Life Technologies, USA)上进行PCR循环,条件如下:50℃2 min, 95℃10 min, 95℃15 s, 60℃1 min,循环50次。
西方墨点法
将HSG细胞在RIPA裂解和提取缓冲液中裂解,并加入额外的蛋白酶和磷酸酶抑制剂(均来自赛默飞世尔科学公司),并在4°C下17,000 g离心25分钟清除。上清液在97°C下NuPAGE LDS样品缓冲液中加热10分钟,通过SDS-PAGE分离,然后电泳转移到聚偏二氟乙烯膜(赛默飞世尔科学公司)。用2%的脱脂奶粉在25℃下阻断细胞膜1小时,然后在4℃下用以下一种主要抗体之一培养过夜:抗nkcc1(#4828,细胞信号技术),抗aqp5 (#AQP-005, Alomone实验室),抗穴蛋白-1(#3267,细胞信号技术),抗格网蛋白重链(#4796,细胞信号技术),抗kiaa0319l /AAVR (#21,016-1-AP, Proteintech),或抗α-微管蛋白(#T6199, Sigma-Aldrich)。清洗三次后,将膜与兔或小鼠IgG山根过氧化物酶链接全抗体(Sigma-Aldrich)在25℃下孵育1小时。使用Super Signal West Pico PLUS化学发光衬底(Thermo Fisher Scientific)观察信号。
流式细胞术
为了进行内吞和溶酶体降解实验,将HSG细胞与10 μg/mL Alexa Fluor 647偶联BSA (Thermo Fisher Scientific)和DQ-BSA (Thermo Fisher Scientific)在添加10%胎牛血清的DMEM中孵育,在37℃和5% CO下孵育24小时。
对于AAV2-GFP感染试验,将HSG细胞在含有AAV2-GFP颗粒的1ml培养基中以5万个感染倍数(MOI)培养1小时,48小时后用7-AAD (Biololegend, USA)染色。
使用BD Accuri C6流式细胞仪(BD Biosciences, USA)和FlowJo软件(BD Biosciences)检测信号。
AAV2-GFP结合和内化检测
对于AAV2-GFP结合实验,HSG细胞在4℃预孵育1 h,与AAV2-GFP颗粒(MOI: 50,000)在4℃孵育1 h,在冰冷的DMEM中洗涤一次,在冰冷的PBS中洗涤两次,然后用刮刀收集。
为了进行AAV2-GFP内化试验,将HSG细胞与AAV2-GFP颗粒(MOI: 50,000)一起在预热的DMEM中37°C孵育1小时,在冰上胰酶化收集15分钟3537℃胰蛋白酶化5 min,清除膜表面病毒,然后用DMEM冰水清洗1次,PBS冰水清洗2次。
根据制造商的说明,使用DNeasy血液和组织试剂盒(QIAGEN)从收集的细胞中分离DNA。使用以下引物和探针来检测每1 μg DNA的拷贝数,这些引物用于扩增CMV启动子区域的一部分:正向引物,5 ' - CAT CTA CGT ATT AGT CAT CGC TAT TAC CAT -3 ';反向引物,5 ' - TGG AAA TCC CCG TGA GTC A -3 ';探针,5 ' -/56-FAM/ACA TCA ATG GGC GTG GAT AGC GGT /36-TAMSp/ -3 '(均来自美国Integrated DNA Technologies, Inc.)。条件如下:50℃2 min, 95℃10 min, 95℃循环50次,每次15 s, 60℃1 min。
统计分析
数据以均数±标准差(SD)或均数的标准误差(SEM)表示。定量变量比较使用双尾学生t-test和Pearson相关系数。在适当的时候,Bonferroni校正被用来校正多个假设检验。分类变量比较采用卡方检验。P值< 0.05为有统计学意义。所有分析均使用GraphPad Prism 8.0软件进行。
伦理批准
国家牙科和颅面研究所伦理委员会。
数据可用性
所有相关资料都包含在文章中。
参考文献
Pedersen, a.m., Bardow, A., Jensen, s.b. & Nauntofte, B.唾液和味觉、咀嚼、吞咽和消化的胃肠功能。口头说。8, 117-129(2002)。
Odani, T. & Chiorini, J. A.针对主要的Sjögren综合征。国防部,Rheumatol。29, 70-86(2019)。
Manganelli, P. & Fietta, P.细胞凋亡和Sjögren综合征。Semin。Arthrit。感冒。33, 49-65(2003)。
田中,T。et al。LAMP3诱导Sjögren’s综合征患者细胞凋亡和自身抗原释放。科学。代表。10, 15169(2020)。
田中,T。et al。LAMP3抑制自噬,并通过溶酶体膜渗透作用促进细胞死亡。自噬18, 1629-1647(2022)。
中村,H。et al。小鼠唾液腺中溶酶体相关膜蛋白3的错表达诱导Sjögren综合征样表型。安。感冒。说。80, 1031-1039(2021)。
梅尔文,J. E.,莫兰,A. &特纳,r.j . HCO3-和Na+/H+交换在大鼠腮腺腺泡细胞对毒蕈碱刺激反应中的作用。生物。化学。263, 19564-19569(1988)。
Koumangoye, R., Bastarache, L. & Delpire, E. NKCC1:新发现的人类致病离子转运体。函数2, zqaa028(2021)。
李明光,杨德昌,李文杰,李文杰,杨德昌,李文杰,李文杰,李文杰,杨德昌,李文杰,李文杰3.分泌。杂志牧师。92, 39-74(2012)。
Markou,。et al。调控水通道蛋白再定位的分子机制。Biochim。Biophys。Acta Biomembr。1864, 183853(2022)。
瓦格纳,K. & Unger, L.调控人类健康和疾病中不同水通道蛋白功能的信号机制和药理学调节剂。Int。理学。23, 1388(2022)。
Delporte C。et al。腺病毒介导的水通道蛋白-1 cDNA转移到辐照大鼠唾液腺后液体分泌增加。Proc。国家的。学会科学。美国94, 3268-3273(1997)。
Sardana, R. & Emr, S. D.溶酶体系统中的膜蛋白质量控制机制。细胞生物学趋势。31, 269-283(2021)。
鲍姆,b.j.。et al。唾液疾病的基因治疗。方法分子生物学。1537, 107-123(2017)。
吉玛罗,M. C., Afione, S. A., Tanaka, T. & Chiorini, J. A.通过shRNA共转染拯救腺相关病毒生产。嗡嗡声。其他的基因。31, 1068-1073(2020)。
杜格尔,B. P.,贝利,C. G.和拉斯科,J. E. J.通往细胞中心的旅程:追踪AAV转导的路径。趋势、医学。27, 172-184(2021)。
鲍姆,b.j.。et al。腺病毒介导的水通道蛋白-1 cDNA转移对辐射诱导的涎腺功能减退的早期反应。Proc。国家的。学会科学。美国109, 19403-19407(2012)。
王淑娟,王晓明,王晓明,王晓明。腺相关病毒介导的功能性水通道在唾液上皮细胞中的体外和体内转移。嗡嗡声。其他的基因。9, 2777-2785(1998)。
Voutetakis,。et al。再造唾液腺是系统基因治疗的稳定内源性生物反应器。Proc。国家的。学会科学。美国101, 3053-3058(2004)。
阴,H。et al。局部递送AAV2-CTLA4IgG可减少涎腺炎并改善C57BL/6中的腺体功能。Sjögren综合征NOD-Aec1Aec2小鼠模型。Arthrit。研究》。14, r40(2012)。
Nguyen C. Q., Yin H., Lee B. H., Chiorini, J. A. & Peck, A. B. IL17:腺病毒介导的基因转移在Sjögren综合征中的潜在治疗靶点。实验室投资。91, 54-62(2011)。
Lee, B. H., Carcamo, W. C., Chiorini, J. A., Peck, A. B. & Nguyen, C. Q.使用IL-27的基因治疗可以改善Sjögren的综合征样自身免疫性外分泌病。Arthrit。研究》。14, r172(2012)。
Abir-Awan, M. & Kitchen, P.哺乳动物水通道抑制剂。Int。理学。20., 1589(2019)。
厨房,P。et al。靶向水通道蛋白-4亚细胞定位治疗中枢神经系统水肿。细胞181, 784 - 99。e19(2020)。
西尔万,新泽西州et al。光栓形成小鼠模型观察三氟拉嗪对脑卒中急性期脑水肿、水通道蛋白-4表达及代谢标志物的影响Biochim。Biophys。Acta Biomembr。1863, 183573(2021)。
萨尔曼,M. M.,厨房,P., Yool, A. J.和比尔,R. M.最近的突破和未来的方向在药物水通道蛋白。趋势杂志。科学。43, 30-42(2022)。
阴,H。et al。骨形态发生蛋白6与Sjögren综合征患者和小鼠外分泌腺功能障碍的关系。Arthrit。感冒。65, 3228-3238(2013)。
莫,杨强。et al。在Sjögren综合征中,HSP70的溶酶体胞吐刺激单核细胞BMP6的表达。j .中国。投资。132, e152780(2022)。
阴,H。et al。抑制骨形态发生蛋白6受体可改善小鼠Sjögren综合征。科学。代表。10, 2967(2020)。
赖,Z。et al。水通道蛋白基因治疗纠正Sjögren的小鼠综合征表型。Proc。国家的。学会科学。美国113, 5694-699(2016)。
韦勒,m.l.。et al。在Sjögren综合征患者的唾液腺中检测到丁型肝炎病毒,并在体内总结了Sjögren综合征样表型。Pathog。Immun。1, 12-40(2016)。
Fleck, M., Kern, E. R., Zhou, T., Lang, B. & Mountz, J. D.小鼠巨细胞病毒在C57Bl/6-lpr/lpr小鼠中诱导Sjögren综合征样疾病。Arthrit。感冒。41, 2175-84(1998)。
Ronzitti, G, Gross, D. A. & Mingozzi, F.腺相关病毒(AAV)载体的人体免疫反应。前面。Immunol。11, 670(2020)。
鲁伊斯,一个。et al。羟氯喹在小鼠子宫内膜异位症模型中的作用及自噬特征。细胞死亡。7, e2059(2016)。
Dejarnac, O。et al。TIM-1泛素化介导登革病毒进入。细胞的代表。23, 1789 - 1793(2018)。
确认
该项目由国家牙科和颅面研究成像核心研究所(ZIC DE000750-01)和兽医资源核心(ZIC DE000740-05)提供协助。获得了武田科学基金会研究奖学金和NIH日本生物医学和行为研究人员JSPS研究奖学金的资助。
资金
由美国国立卫生研究院(NIH)提供的开放获取资金。这项工作由NIH/NIDCR部门的校内研究奖(1ZIADE000695)资助(给JAC)。
作者信息
作者及隶属关系
贡献
h.n., t.t., b.m.w., m.n., T.A.和J.A.C.参与了实验的构想和设计。h.n., t.t., C.Z.和S.A.A.进行了实验和数据分析。h.n., T.T.和J.A.C.撰写了手稿,由所有作者修改。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
中村浩,田中涛,郑志刚,郑志刚。et al。水通道蛋白基因治疗lamp3相关性唾液腺功能减退。Sci代表12, 18570(2022)。https://doi.org/10.1038/s41598-022-21374-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-21374-2