摘要
机器人辅助部分肾切除术(RAPN)后阳性手术切缘(PSM)的肿瘤学影响仍在争论中。我们比较了PSM和阴性手术切缘(NSM)在RAPN后的无复发生存期(RFS)、无转移生存期(MFS)和总生存期(OS),并确定了PSM的预测因素。使用UroCCR数据库的多机构研究,前瞻性纳入了2010年4月至2021年2月期间的2166例RAPN (CNIL DR 2013-206;NCT03293563)。回顾性比较两组:PSM和NSM。单因素比较后采用Kaplan-Meyer曲线加log-Rank检验、cox风险比例风险模型和logistic回归评估预后因素。PSM 136例(6.3%),NSM 2030例(93.7%)。在RAPN后中位随访19(9-36)个月期间,报告了160例(7.4%)复发。Kaplan-Meier曲线和分析表明,RFS、MFS和OS不受PSM (p= 0.68;0.71;分别为0.88)。在多变量分析中,PSM的预测因子是肾评分较低(p= 0.001),较长的热缺血时间(p= 0.003)和憎色性肾细胞癌(p= 0.043)。本研究未发现PSM对RFS、MFS或OS有影响,PSM的预测因子为肾评分、WIT和chrRCC。
介绍
由于常规的横断面成像,手术切除的肿瘤比20年前的病例显示出更低的TNM阶段1,2。自2010年至今,只要可能,部分肾切除术(PN)是参考治疗3.,4。机器人手术平台的激增导致接受机器人辅助部分肾切除术(RAPN)的患者数量呈指数级增长。5。
这种保留肾脏的手术(NSS)的目的是在保持整体肾功能的同时实现最佳的肿瘤控制,无任何术后并发症。然而,其主要缺陷仍然是手术切缘阳性的可能性,发生率为0.1-10.7%6。
欧洲指南建议在PSM发生后加强随访,但对特定策略没有共识,PSM与复发之间的关系仍在争论中3.,7。迄今为止报道的大多数研究表明,手术切缘阳性与较高的转移风险或降低的癌症特异性生存(CSS)无关。8,9。另一方面,大型回顾性研究表明PSM是复发的独立预测因子10,11。缺少PSM,例如在三12成绩,也显示出对RAPN后长期结果的预测作用13。
本研究的目的是根据手术切缘状况比较接受RAPN的RCC患者的肿瘤预后,并确定与PSM相关的因素。
患者及方法
研究设计
在机构审查委员会批准后,在UroCCR项目(NCT03293563)的框架内进行了边际研究。所有患者都被告知关于UroCCR项目的目的和方法的口头和书面信息,提供书面和知情同意的患者的数据被前瞻性地纳入UroCCR数据库。所有实验方案均经国家信息与自由委员会伦理委员会批准(CNIL授权号DR-2013-206)。我们回顾了2010年4月至2021年2月期间该数据库中20个法国中心的所有患者的医疗记录。
考虑到回顾性多中心研究设计,手术技术和术前检查没有跨中心标准化,而是欧洲指南3.随访。收集每位患者的以下术前资料:RAPN时的年龄、性别、BMI、ECOG和ASA评分、肿瘤特征,包括临床TNM分期、临床肿瘤大小、肿瘤侧位和放射学肾肾测量评分。所有患者术前均进行CT扫描,包括腹部和盆腔序列以评估肿瘤,大多数时间使用胸部序列以评估肿瘤的延伸。
记录以下手术资料:NSS适应证(择期、必要期、相对期)、手术入路(经腹膜(TP)、后腹膜(RP))、总手术时间、夹紧方式、热缺血时间(WIT)、预估出血量、围手术期并发症及转开腹手术。当肿瘤前路采用RP入路时,手术入路被认为是不一致的,而对于后路采用TP入路的肿瘤则相反。
病理特征包括组织学亚型、pTNM、直径及分级、uss预后分类。根据现行指南记录术后并发症14并根据Clavien-Dindo分类进行分级15。
各中心的随访方案相似。它包括临床访谈、体格检查、血清肌酐、CT扫描以评估局部复发和转移进展。中位随访计算为手术至最后一次会诊之间的中位时间。
关注的结果
主要终点是PSM,定义为H&E染色组织报告的手术标本边缘存在癌细胞。
统计分析
报告了连续变量的均值和标准差,报告了名义变量的比例。比较名义变量采用精确Fisher检验,比较有序变量采用Kruskal-Wallis检验,比较定量连续变量采用Student检验。非参数检验用于小样本量。采用Kaplan-Meier方法估计OS、RFS和MFS的概率。采用多变量Cox回归分析寻求OS、RFS和MFS的预测因子。只有带a的变量p-value < 0.25的单因素分析纳入多因素模型。在初始模型中纳入共线性,最终模型的建立受限于现有文献报道的因素(较大尺寸或肾评分、pT2、III-IV级、总手术时间、出血量)。采用R统计软件进行统计分析16。所有检验均为双侧检验,显著性水平为p< 0.05。所有方法均按照相关指南和规定进行。
涉及人类受试者、其数据或生物材料及知情同意的研究
所有患者都获得了关于UroCCR项目目标和方法学的口头和书面信息,提供书面同意的患者的数据被前瞻性地纳入UroCCR数据库(CNIL授权号DR-2013-206;NCT03293563)。本研究中使用和分析的数据集可应通讯作者的合理要求提供。
结果
病人的特点
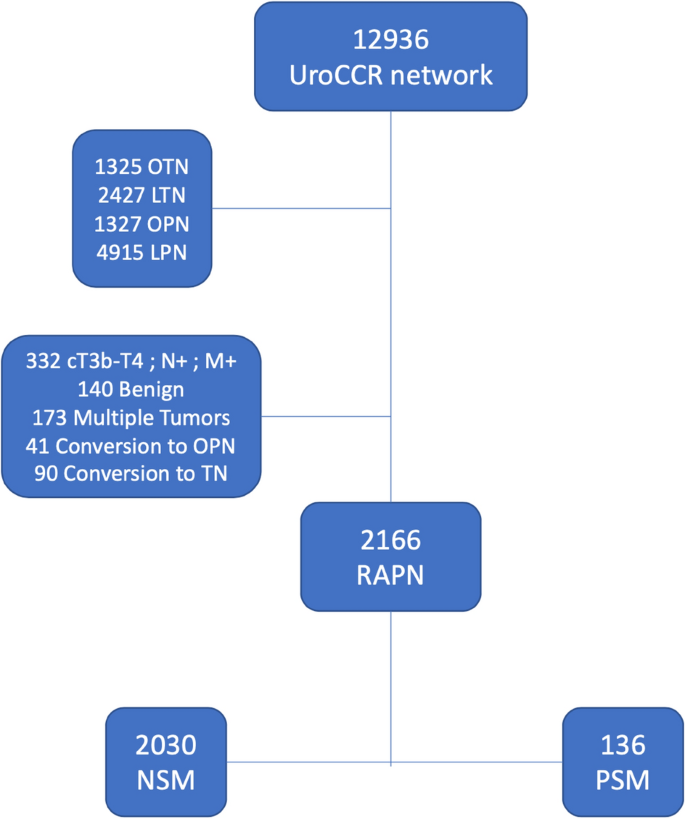
我们回顾了UroCCR网络中12936例患者的医疗记录,包括基线时已知的遗传综合征,排除既往有肾细胞癌病史的患者。首先,我们排除了开放性部分或根治性肾切除术患者(OPN n = 1327, ORN n = 1345),然后是腹腔镜部分或根治性肾切除术患者(LPN n = 4915, LRN n = 2427)。在研究期间接受RAPN的2922例患者中,2166例符合纳入标准。排除标准为cT3b-4、cN +或cM + (n = 332),转化为OPN (n = 41),转化为根治性肾切除术(n = 90),良性肿瘤(n = 140)或多发肿瘤(n = 173)。(无花果。1).
纳入的2166例患者中,136例为PSM(6.3%), 2030例为NSM(93.7%)。患者特征总结见表1。平均手术年龄(PSM: 60.2 vs. NSM: 59.9);p= 0.094);p= 0.4), cTNM (p= 0.987),两组差异无统计学意义。PSM组肾脏评分较低(PSM: 6比NSM: 7);p= 0.05)。总中位随访时间为199,36个月;报告了160例(7.4%)复发(88例局部转移,72例转移):PSM组9例(6.6%),NSM组151例(7.4%)。
围手术期结果
PSM与较长的平均WIT相关(PSM: 20.4±10.3 min vs. NSM: 17.8±8.5 min);p= 0.001)。手术并发症(PSM: 6.7% vs. NSM: 3.9%;p= 0.168),腹膜后入路(n = 168) (PSM: 10.9% vs. NSM: 7.8%,p= 0.279),不一致的方法(PSM: 41.2% vs. NSM: 42.8%;p= 0.845)和钳上手术(PSM: 91% vs. NSM: 86.8%;p= 0.198)与PSM无关。术中数据见表2。
病理结果
chrRCC (PSM: 19.9% vs. NSM: 8.5%)p< 0.001)与PSM显著相关,而ccRCC的组织学类型(PSM: 56.6% vs. NSM: 70.3%;p= 0.001)与PSM的可能性较低相关。
结果如表所示3.。
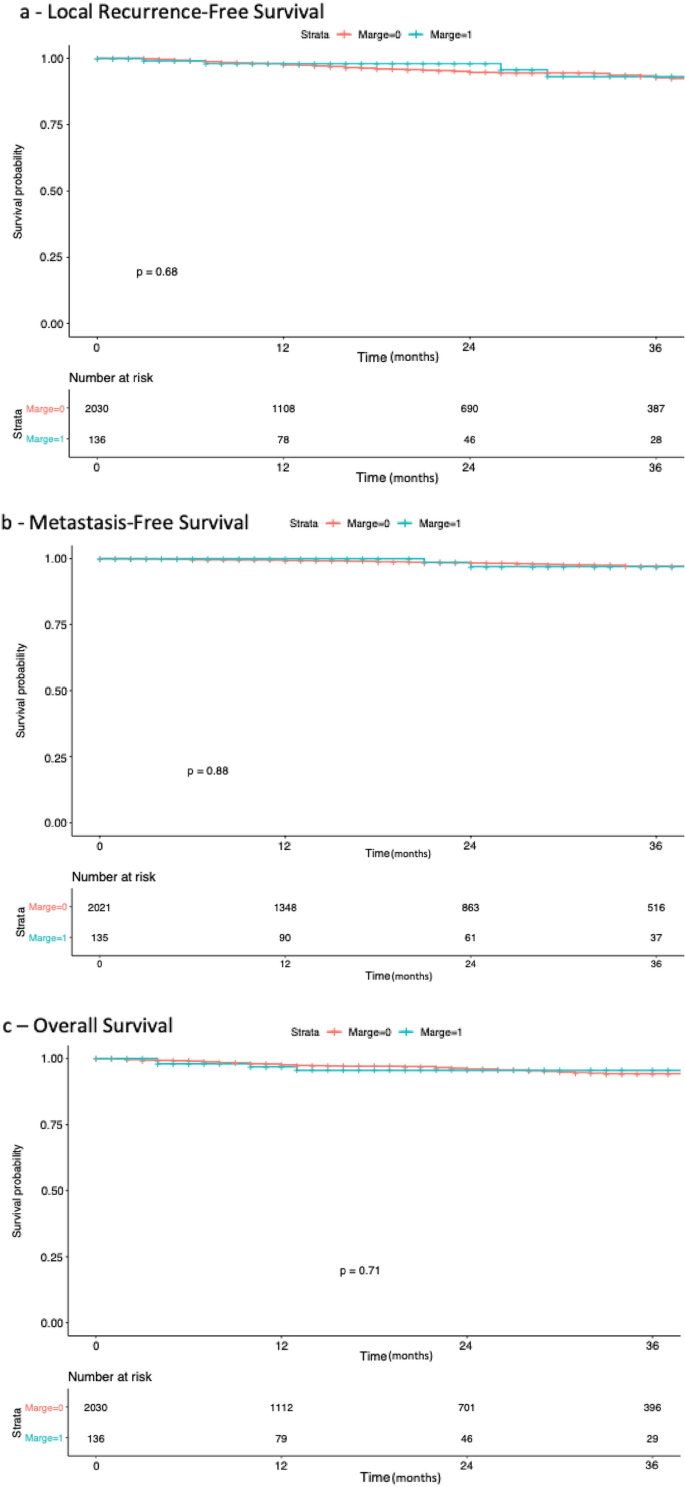
PSM的中位随访时间为21.5个月[9-37],而NSM为19个月[9-36]。p= 0.662)。生存分析未显示各组间RFS有任何差异(图2)。2a)、MFS或OS(图2)。2b, c)(分别p= 0.68;0.71;0.88)。
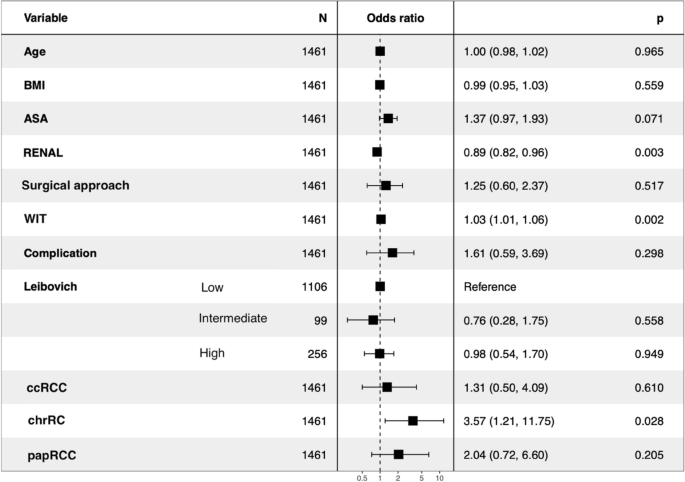
多变量分析(图2)3.)显示肾脏评分(p= 0.001),较长的热缺血时间(WIT) (p= 0.003)和chrRCC组织学(p= 0.043)为PSM的预测因子。
讨论
早期诊断的肾细胞癌和诊断小肾肿块导致了手术方法的演变。自2010年至今,对于cT1-T2肾肿块,在可行的情况下,建议先行PN,然后再行RAPN,而不是OPN3.,4,17。因此,这对作者多年来的临床实践没有影响。为了实现其节省肾脏的潜力,RAPN必须满足三个主要挑战:WIT < 25 min以防止肾功能衰竭,肿瘤控制,目前评估为NSM,无围手术期并发症。
虽然PSM可视为残留在肾脏中的癌细胞,但止血可引起这些细胞缺血和坏死。此外,手术标本中的肿瘤细胞可能与边缘切向接触,对应于PSM,但在切除床上没有癌细胞残留。对于NSM,肿瘤切除时的冰冻切片分析导致5%的NSM假阴性18,而NSM并不能保证不会再发生7。综上所述,PSM在RAPN后的预后价值仍是一个有争议的问题。
我们发现了6.3%的PSM,这与文献报道的0.1-10.7%一致6,但局部复发的PSM患者只有5.9% (N = 8)。我们的中位随访时间为19个月,相当于Takagi等人的中位PN术后复发时间(19个月)。19。在文献中,对于手术切缘与复发率或特定生存率之间是否存在统计学相关性尚无共识。一方面,Petros等人。显示PSM与PN后疾病进展密切相关20.在2297名PN患者中,有1863例(81%)RCC和34例(1.48%)PSM。34例PSM患者与100例NSM患者在肿瘤大小、肾评分、分级和病理分期方面进行1:3匹配。他们发现PSM对OS (NSM为0.99 vs PSM为0.97)、局部RFS (0.98 vs 0.77)和MFS (0.95 vs 0.84)的5年生存率有影响。此外,在另一项分析中,Wood等人。21显示PN时PSM与中位时间23个月后局部肿瘤床复发之间有很强的相关性:复发组PSM为15.9%,对照组为3%。Khalifeh等。22评估947例恶性肿瘤RAPN中21例PSM的肿瘤预后,中位随访时间为13个月。在947例手术后,有9例复发和4例转移。PSM与复发密切相关,调整后的HR为18.4。PSM组3年无复发率和无转移生存率低于NSM组(分别为47% vs. 98.3%和63% vs. 99.5%)。Shah等人对1240例RCC患者进行了回顾性研究,其中97例PSM导致67例复发。23表明PSM是复发的独立危险因素。在他们的亚组分析中,发现PSM是高危肿瘤(pT2-3a或III-IV级)复发的危险因素,而不是低危肿瘤(pT1或I-II级)复发的危险因素。此外,Bernhard等人。24通过27个月的随访评估809例NSS手术同侧复发的预测因素。他们报告了26例局部复发和15.4%的PSM。多因素分析显示PSM与局部复发相关,HR为11.5 (p< 0.01)。
相反,Bensallah等人。8进行了一项配对研究,包括101例PSM和102例NSM,根据手术适应证、肿瘤大小和肿瘤分级进行匹配。PSM对5年RFS、5年癌症特异性生存(CSS)和5年OS无影响。Yossepowitch等人。25研究了1390例PN患者中77例PSM,中位随访40.8个月,发现PSM与较差的RFS或MFS无关。此外,Rothberg等人。26比较了797名NSM患者和42名经RAPN治疗的PSM患者,并报道在中位随访18.8个月后,PSM患者的肿瘤预后并不比NSM患者差。我们的研究结果与Rothberg的研究结果一致,我们没有发现PSM与RFS, MFS或OS之间的统计学关联。
多变量分析显示,较高的肾评分与NSM相关。这种矛盾的发现可能是因为肾实质内较小的肿块可能更难发现,并且外科医生在进行这种PN手术时可能会过于自信,理论上,考虑到肿瘤的小尺寸,在技术上应该更容易。这一假设得到了Schiavana等人的支持。27他发现肿瘤cT1a比cT2小,腹腔镜技术比开放和容积中心< 60 RAPN/年是PSM的危险因素。另一种假设是,更简单的手术可能留给了年轻的外科医生,因为研究中的大多数中心都是学术性的。
对于更复杂的肿瘤,外科医生可能会更深入地切除健康的实质,以降低PSM的风险。不管原因是什么,在考虑肿瘤大小、总手术时间、出血量和组织学等因素后,即使在多变量分析中,这一结果也是稳健的。
像Takagi等人一样。28我们发现RP入路(n = 168)不是PSM的危险因素。他们专门比较了RP和TP,尽管样本量较小(48 RP vs 290 TP),但发现两组之间PSM没有显着差异。阿罗拉等人。29还比较了99 RP-RAPN和394 TP-RAPN,发现两臂间的切缘状态没有差异。这两项研究都有同样的局限性:回顾性设计样本量小,缺乏关于外科医生经验和肿瘤切除术手术技术的精确数据。
正如预期的那样,较长的WIT也是PSM的一个风险因素。如Larcher等人所述,WIT是手术经验的代表,在学习曲线的早期急剧下降。30.。较长的WIT也反映了手术过程中出现的手术困难。
纤维间质肿瘤反应和肿瘤纤维囊的存在、大小和密度根据组织学亚型而变化。这些元素在chrrcc中的减少性质可能解释了该亚型中psm的较高频率31。
最后,我们开始在这个大型、前瞻性、多中心的患者队列中确定边缘对肿瘤预后的影响。为此目的,正在进行进一步的分析,并将在适当时候发表。
我们的研究有几个应该承认的局限性。首先,我们故意排除晚期肿瘤(cT3b-4、cN +、cM +)、良性或多发性肿瘤和转移性疾病,以建立RAPN的同质模型。其次,随访时间较短。其他系列随访时间较长,尤以Yossepowitch等人的随访时间较长。(40.8月)25。然而,根据部分文献,RAPN术后复发的中位时间为13.1 ~ 20个月19,26,32,33从肾部分切除术到发现局部床肿瘤复发的中位时间为23个月21。经验也是一个重要的考虑因素。在UroCCR中记录的第一次手术时已经进行的RAPN的数量并不是所有外科医生都可以获得的,也不是所有实习生的参与。因此,不可能评估经验对PSM的影响。然而,Larcher等人。30.强调尽管外科医生经验与较短的热缺血时间(WIT)和较低的Clavien-Dindo并发症(CD)≥2的概率相关,但与较低的PSM发生率无关。我们认为这个队列显示了大学中心的常规实践,在那里,大三学生在高年级学生的监督下给病人做手术,所以EXP是一个肤浅的概念。最后,像许多关于RAPN的研究一样,我们缺乏关于边缘长度、肿瘤切除技术和附着性肾周脂肪(APF)存在的数据,但这最后两个因素在文献中似乎并不能预测PSM34,35,36。我们也缺乏复发治疗的数据,这种治疗可能通过改变MFS和OS的结果而产生选择偏倚。然而,Brassier等人。37经皮消融或手术切除治疗PN术后局部复发的患者中,有40%的患者在中位随访23个月后出现疾病复发,这也意味着只有60%的患者在再治疗后病情得到控制。
结论
基于这项大型的法国多中心回顾性研究,RAPN后PSM发生率仍然很低,对短期肿瘤预后没有影响。PSM与较长的WIT、chrRCC相关,令人惊讶的是与较低的肾评分相关。
参考文献
Ferlay, J。et al。欧洲癌症发病率和死亡率模式:2012年40个国家的估计数。欧元。j .癌症49(6), 1374-1403(2013)。
加藤,M。et al。小肾细胞癌的自然史:生长速率、组织学分级、细胞增殖和凋亡的评价。j . Urol。172(3), 863-866(2004)。
永贝里,B。et al。欧洲泌尿外科协会肾细胞癌指南:2019年更新。欧元。Urol。75(5), 799-810(2019)。
永贝里,B。et al。肾细胞癌EAU指南:2010年更新欧元。Urol。58(3), 398-406(2010)。
帕特尔博士。et al。肾脏手术的趋势:机器人技术与部分肾切除术的使用增加有关。j . Urol。189(4), 1229-1235(2013)。
Laganosky, D. D., Filson, C. P.和Master, V. A.肾细胞癌保留肾组织手术的手术边缘。咕咕叫。Urol。代表。18(1), 8(2017)。
Antic, T. & Taxy, J. B.肾肿瘤部分切除:边缘状态与局部复发缺乏相关性。点。j .中国。病理学研究。143(5), 645-651(2015)。
Bensalah, K。et al。手术切缘阳性对保留肾单元手术治疗的肾细胞癌存活率的影响可以忽略不计。欧元。Urol。57(3), 466-473(2010)。
López-Costea, M. Á。,Bonet, X., Pérez-Reggeti, J., Etcheverry, B. & Vigués, F. Oncological outcomes and prognostic factors after nephron-sparing surgery in renal cell carcinoma.Int。Urol。Nephrol。48(5), 681-686(2016)。
Tellini, R。et al。阳性手术切缘预测肾细胞癌保留肾细胞手术后无进展生存:来自459例至少随访5年的单中心队列的结果。中国。Genitourin。癌症17(1), e26-31(2019)。
卡瓦略,j.a.m.。et al。部分肾切除术后手术切缘阳性的影响。欧元。Urol。开放的科学。21, 41-46(2020)。
Brassetti, A., Anceschi, U., Bertolo, R., Ferriero, M., Tuderti, G. & Capitanio, U.。等。手术质量,癌症控制和功能保存:介绍机器人辅助部分肾切除术的新三合一。密涅瓦Urol。Nefrol(互联网)。[2022年10月9日];72(1)、(2020)一次性担保:https://www.minervamedica.it/index2.php?show=R19Y2020N01A0082
布拉塞蒂,A.,安切斯基,U.,贝托洛,R.,费里耶罗,M.,图蒂蒂,G.和康斯坦蒂尼,M.。等。机器人辅助肾细胞癌部分切除后预后的综合长期评估:ROMe的成就及其预测图。密涅瓦Urol。Nefrol。(互联网)。[2022年10月9日];72(4)、(2020)一次性担保:https://www.minervamedica.it/index2.php?show=R19Y2020N04A0482
航海图等,D。et al。欧洲泌尿外科指南协会特设小组对泌尿外科Clavien-Dindo分级系统的验证。欧元。Urol。焦点4(4), 608-613(2018)。
Dindo, D., Demartines, N.和Clavien, P. A.手术并发症的分类。安。杂志。240(2), 205-213(2004)。
R开发核心团队。R软件(R Foundation for Statistical Computing, 2008)。
Peyronnet B。et al。1800例机器人与开放式肾部分切除术治疗肾肿瘤的比较。安。Surg.杂志。23(13), 4277-83(2016)。
Gordetsky, J。et al。冷冻切片在部分肾切除术:它能预测阳性边缘吗?北大Int。116(6), 868-872(2015)。
高木涉,T。et al。临床T1期肾细胞癌部分切除后复发的预测因素:对1227例患者的回顾性研究。Int。j .中国。肿瘤防治杂志。25(5), 892-898(2020)。
f·G·彼得斯。et al。部分肾切除术后切缘阳性患者的肿瘤预后:一项25年的单一机构经验。世界J.乌罗尔。36(7), 1093-1101(2018)。
伍德,e。L。et al。小肾肿块部分切除后局部肿瘤床复发。j . Urol。199(2), 393-400(2018)。
Khalifeh,。et al。机器人辅助部分肾切除术的阳性手术切缘:肿瘤结果的多机构分析(不留下肿瘤)。j . Urol。190(5), 1674-1679(2013)。
Shah, p.h.。et al。阳性切缘增加高危肾肿瘤部分切除后复发的风险。j . Urol。196(2), 327-334(2016)。
伯恩哈德,j.c.。et al。肾细胞癌保留肾单元手术后同侧复发的预测因素。欧元。Urol。57(6), 1080-1086(2010)。
Yossepowitch, O。et al。部分肾切除术切缘阳性后的预测因素和肿瘤预后。j . Urol。179(6), 2158-2163(2008)。
罗斯伯格,文学硕士。et al。多机构分析机器人辅助部分肾切除术后手术切缘阳性对肿瘤预后的影响。j . Endourol。34(3), 304-311(2020)。
Schiavina, R。et al。预测部分肾切除术的阳性手术切缘:一项前瞻性多中心观察性研究(RECORd 2项目)。欧元。J.外科医生。46(7), 1353-1359(2020)。
高木涉,T。et al。机器人辅助腹腔镜部分肾切除术中经腹膜入路与后腹膜入路手术效果的比较:倾向评分匹配的比较分析。j .机器人。杂志。15(1), 99-104(2021)。
Arora, S。et al。后腹膜与经腹膜机器人辅助部分肾切除术:多机构背景下的比较。泌尿外科120, 131-137(2018)。
落叶松,。et al。机器人辅助部分肾切除术的学习曲线:手术经验对围手术期结果的影响。欧元。Urol。75(2), 253-256(2019)。
马科,J, Craig, R.,阮,A., Udager, A. M.和Wolfman, D. J.肾细胞癌的放射病理相关性。射线照相41(5), 1408-1419(2021)。
Shah, p.h.。et al。对于临床分期T1至病理分期T3a的肾细胞癌,部分肾切除术与根治性肾切除术相比复发风险更高。j . Urol。198(2), 289-296(2017)。
Mouracade, P。et al。肾肿瘤部分切除后复发的模式和预测因素。j . Urol。197(6), 1403-1409(2017)。
Minervini, A., Campi, R., Sessa, F., Derweesh, I., Kaouk, j.h.和Mari, A.。等。恶性肾肿瘤单纯去核和标准部分肾切除术后手术切缘阳性和局部复发:文献的系统回顾和患病率的荟萃分析密涅瓦Urol。Nephrol。(互联网)。[2022年10月9日];69(6)、(2017)一次性担保:https://www.minervamedica.it/index2.php?show=R19Y2017N06A0523
Minoda, R., Takagi, T., Yoshida, K., Kondo, T.和Tanabe, K.通过1:1倾向评分匹配分析比较机器人辅助的完全内生肾肿瘤部分切除与标准切除的手术结果。j . Endourol。(互联网)https://doi.org/10.1089/end.2021.0213(2021)。
Khene, z。et al。附着性肾周脂肪影响肾部分切除术后围手术期预后:一项系统回顾和荟萃分析。Int。j .中国。肿瘤防治杂志。26(4), 636-646(2021)。
刺耳的,M。et al。肾细胞癌部分切除后局部复发的经皮消融与手术切除:倾向评分分析(REPART研究:UroCCR 71)。欧元。Urol。焦点79, 765(2021)。
作者信息
作者及单位
贡献
a.m.:项目开发、数据收集与管理、数据分析、稿件撰写i.b.:项目开发、数据分析、稿件编辑j.c.b.:数据收集与管理k.b.:数据收集与管理c.c.:数据收集与管理f.b.:数据收集与管理n.d.:数据收集与管理o.j.:数据收集与管理f.a.:数据收集与管理b.p.:数据收集与管理m.b.:数据收集与管理j.a.l.:数据收集与管理F.X.N:数据收集与管理n.b.:数据收集与管理h.l.:数据收集与管理t.c.:数据收集与管理e.x.:数据收集与管理t.w.:数据收集与管理f.g.:数据收集与管理r.b.:数据收集与管理b.r.:数据收集与管理a.s.:数据收集与管理d.c.:项目开发d.a.:稿件编辑m.d.:项目开发,数据收集和管理,稿件编辑。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益冲突。
额外的信息
出版商的注意
b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。
关于本文
引用本文
Morrone, A., Bentellis, I., Bernhard, JC。et al。阳性手术切缘对机器人辅助部分肾切除术后短期肿瘤预后的影响(边缘研究:UroCCR no . 96)。Sci代表12, 18342(2022)。https://doi.org/10.1038/s41598-022-23146-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-23146-4