摘要
膜性肾病(MN)是一种以免疫球蛋白G (IgG)和补充成分沉积在肾小球毛细血管壁上皮为特征的自身免疫性疾病。巨噬细胞迁移抑制因子(MIF)是巨噬细胞释放的一种炎症介质。MIF在免疫介导性肾小球肾炎的发病机制中起着关键的调节作用。本研究旨在探讨MIF水平是否与MN活性相关。收集了57例MN患者和20例健康对照的血浆和尿液样本。采用酶联免疫吸附试验(ELISA)检测血浆和尿液中的MIF水平。采用免疫组化(IHC)检测5例MN患者肾脏标本中MIF的表达。分析血浆和尿液MIF水平及肾小球MIF表达与临床和病理特征的相关性。结果显示,随着MN患者血浆和尿液中MIF水平的升高,其肾脏病理损伤的严重程度逐渐加重。相关分析显示,血浆MIF水平与血小板(PLT)计数呈正相关(r = 0.302,P= 0.022),与凝血酶原时间(PT)呈负相关(r =−0.292,P= 0.028)。血浆MIF水平与c反应蛋白(CRP)水平、红细胞沉降率(ESR)呈正相关(r = 0.651,P< 0.0001;r = 0.669,P< 0.0001)。尿MIF水平与ESR呈正相关(r = 0.562,P< 0.0001)。免疫组化提示MIF在肾小球基底膜和小管间质区表达。血浆和尿液中MIF水平可反映MN的严重程度,血浆和尿液中MIF水平与MN患者静脉血栓形成和感染并发症有关。肾小球MIF的表达可反映锰的活性。
简介
膜性肾病(MN)是一种肾小球疾病,其中免疫球蛋白G (IgG)和补体成分的免疫沉积主要或专门发生在肾小球毛细血管壁上皮下的足细胞下1.MN发生在所有地区和所有种族,北美的年发病率为10-12 / 100万,欧洲为2-17 / 100万,是成人肾病综合征(NS)的主要原因2.随着足细胞抗原及相关自身抗体的探索,根据抗原特异性可将MN分为三类。m型磷脂酶A2受体(PLA2R)和含血栓反应素1型结构域7A (THSD7A)被认为是MN中的靶足细胞抗原3.,4.当目标抗原未知,且MN与任何其他已知的全身性疾病或继发性病因无关时,诊断为特发性MN。如果肾脏损害与其他全身性疾病有关,如感染、自身免疫性疾病、恶性肿瘤等,则诊断为继发性MN。MN的发病机制复杂,如果不及时治疗,它表现为一个独特的临床过程,如先前报道的那样,三分之一的患者获得完全缓解,三分之一的患者部分缓解,其余的患者进展到终末期肾病(ESRD)。5.
巨噬细胞迁移抑制因子(MIF)是一种由115个氨基酸组成的蛋白质,在多种器官和细胞类型中表达,如巨噬细胞、单核细胞、上皮细胞和血小板6,7.MIF与其细胞膜受体CD74的结合导致细胞表面糖蛋白CD44的募集8,9.此外,CD74与CD44偶联,启动信号级联,导致促炎细胞因子的后续表达。MIF与CXC趋化因子受体2型、4型和7型结合,吸引巨噬细胞并将B淋巴细胞引导到炎症部位,MIF还通过抑制糖皮质激素作用间接增强免疫反应10.
迄今为止,大量实验研究发现MIF是免疫系统中必不可少的信号细胞因子,其与分子靶点的结合在炎症过程中起着关键作用11.MIF可以吸引巨噬细胞和T淋巴细胞在炎症中浸润和聚集,增强其吞噬功能,抑制其迁移,促进某些细胞因子的增殖、激活和分泌,从而介导肾脏疾病。之前的一项研究发现,一种MIF的小分子抑制剂可以保护有狼疮倾向的小鼠免受肾脏疾病的影响12.MIF通过多种机制介导肾损伤,抑制巨噬细胞向其他部位移动,并促进一些细胞因子的增殖、激活和分泌。此外,MIF可刺激肾足细胞分泌促炎因子,加速肾小球硬化,最终导致肾脏不可逆损伤。此前有研究发现,抗mif治疗可减少巨噬细胞在肾组织中的聚集,改善肾衰竭,并导致肾功能降低的延迟13.
然而,MIF水平与MN活性之间没有关联的报道。本研究旨在探讨MIF水平是否与MN活性相关。
方法
患者和样本
本研究共纳入2019年11月至2020年10月内蒙古医科大学附属医院确诊的MN患者57例。在开始激素和免疫抑制治疗前收集这些患者的血浆和尿液样本。此外,我们分别收集了20名健康献血者的血浆和尿液样本作为正常对照。本研究排除了严重感染(特别是尿路感染)、肾活检结果合并其他类型肾小球肾炎(如狼疮性肾炎、LN、IgA肾病)、其他自身免疫性疾病(如Graves病、类风湿性关节炎等)、感染、自身免疫性疾病、恶性肿瘤、药物或损伤暴露因素等全身性疾病所致MN的患者。在肾穿刺前,每位患者抽取静脉血5ml,用EDTA抗凝管收集。上清液在3000转,5分钟的离心下分离,并保存在−80°C下供后续使用。所有患者和健康献血者的尿液样本在−80°C冰箱中10分钟内直接冷冻在ep管中。避免了反复的冻结/解冻循环。57例MN患者中有5例采集肾脏组织标本。6个肾组织取自切除肾(因肾癌)正常部分,作为正常对照;用光镜、免疫荧光和电子显微镜检查结果均为正常。 Written informed consent was obtained from each participant. We collected baseline patient data including age, gender, kidney history, positive signs, disease complications etc.Before renal puncture, registration (Urine protein quantification/24 h, UTP/24 h), Creatinine (Cr), serum albumin (ALB), PLA2R-Ab, C-reactive protein (CRP), Blood Down (ESR), fibrinogen (FIB), Prothrombin Time (PT), activated partial prothrombin time (APTT), thrombin time (TT), fibrin (primary) degradation products (FDP), D-dimer, triglyceride (TG), total cholesterol (TCH), low-density lipoprotein (LDL-C), as well as high-density lipoprotein (HDL-C) and other clinical indicators. All patients provided their informed written consent. All the methods were performed in accordance with relevant guidelines and regulations. All methods were approved by the Helsinki Declaration of Inner Mongolia Medical University Ethics committee.
酶联免疫吸附试验(ELISA)检测MIF
采用商业试剂盒(Bioss Biotechnology Co, Beijing, China),根据制造商说明书,并与标准曲线进行比较,ELISA分析血浆和尿液MIF浓度。
肾组织学
根据Ehrenreich-Churg标准评估MN患者的肾组织学14.肾小球病变的存在,包括肾小球硬化、月牙形、节段硬化,以活检中肾小球总数的百分比计算。根据小管间质室受影响的百分比对管状病变和间质病变进行半定量评分:管状萎缩(“−”表示0%,“+”表示0% - 50%,“++”表示> 50%),间质纤维化(“−”表示0%,“+”表示0% - 50%,“++”表示> 50%)和间质浸润(“−”表示0%,“+”表示0% - 20%,“++”表示20% - 50%,“+++”表示> 50%)。
免疫组化法检测肾脏MIF的表达
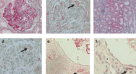
染色前对标本进行脱蜡处理。然后在二甲苯中进一步脱蜡,并通过分级乙醇再水化。抗原提取通过将载玻片在200 W的微波炉中柠檬酸缓冲液(pH值6.0)中加热40分钟进行。然后将载玻片冷却至室温,并在磷酸盐缓冲盐水(PBS)中洗涤。内源性过氧化物酶活性用3%双氧水在室温下淬灭10分钟。用3%牛血清白蛋白(BSA)在PBS中37℃孵育30分钟,阻断非特异性染色。去除BSA后不洗涤,加入一抗(抗人MIF, Abcam, Cambridge, UK),然后在4℃孵育过夜。二抗(MXB, Fu zhou, China)与标本在37°C孵育10分钟。然后,标本在链霉菌抗生物素蛋白过氧化物酶中孵育37°C 10分钟。最后,标本用苏木精孵育,然后用梯度酒精和二甲苯脱水。在光学显微镜下观察各MIF的表达。我们使用Image-Pro Plus分析软件(6.0版本;Media Cybernetics, Dallas, TX, USA)评估MIF的肾染色。阳性信号被量化为平均光密度(综合选项密度/面积)。盲观察× 400切片内所有肾小球,作为肾免疫组化染色的半定量评价。
统计分析
所有数据采用SPSS22.0进行统计分析。定量数据用均数±标准差(对于正态分布的数据)或中位数和极差(对于非正态分布的数据)表示。两组符合正态分布的计数资料采用独立t检验进行比较。如果任何组不匹配,则使用非参数秩和检验。对于两个参数变量,采用Pearson相关法对两个连续变量进行相关分析。对于两个非参数变量或一个非参数变量与一个参数变量,采用Spearman秩相关法对两个连续变量进行相关分析。如果P< 0.05,差异有统计学意义。
结果
MN患者的临床资料
57例MN患者中男性34例(59.65%),女性23例(40.35%),诊断时平均年龄46.96±14.07岁。pla2r - ab阳性35例;-22例pla2r - ab阴性。血清肌酐(Cr)水平范围为44 ~ 232 μmol/L。24小时尿蛋白检测(UTP)范围为1.13 ~ 15.8 g/24 h。21例患者出现眼睑和面部水肿,49例患者出现肢体水肿,8例患者无明显症状。
与MN组比较,对照组白细胞(WBC)计数、纤维蛋白原(FIB)、红细胞沉降率(ESR)、甘油三酯(TG)、总胆固醇(TCH)、低密度脂蛋白-胆固醇(LDL-C)水平显著升高;然而,白蛋白(ALB和HDL-C)水平显著降低。MN组与对照组年龄、性别差异无统计学意义。患者一般临床资料及诊断指标见表1而且2,分别。
MIF水平可反映MN的严重程度,与PLA2R-Ab表达无相关性
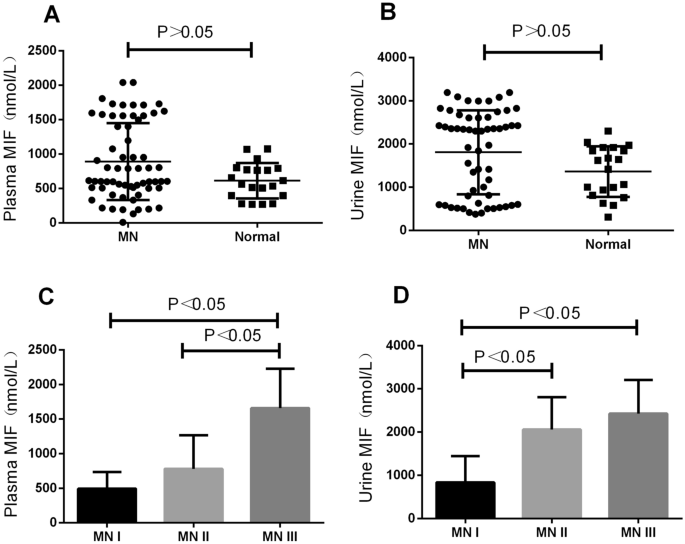
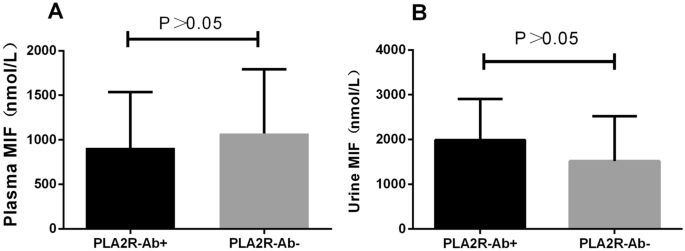
从57名MN患者和20名健康献血者中收集血浆和尿液样本,使用商业酶联免疫吸附试验(ELISA)试剂盒检测血浆和尿液中的MIF水平。结果发现MN组与对照组血浆和尿液中MIF水平无统计学差异(P> 0.05)(图1A、B)。
为了比较不同病理分期MN患者血浆和尿液中MIF水平的差异,我们将所有MN患者病理分为MN- i组(n = 17)、MN- ii组(n = 22)、MN- iii组(n = 18)。进一步比较不同病理分期MN患者血浆和尿液中MIF水平的差异,发现随着肾脏病理程度的加重,血浆中MIF水平逐渐升高,MN- iii组血浆中MIF水平高于MN- ii组(P< 0.05);MN-III组血浆MIF水平高于MN-I组(P< 0.05),差异有统计学意义(图;1C)。此外,我们发现,随着肾脏病理程度的加重,尿中MIF水平逐渐升高,MN-III组尿中MIF水平高于MN-I组(P< 0.05);MN-II组尿MIF水平明显高于MN-I组(P< 0.05),差异有统计学意义(图;1D)。
pla2r - ab阳性组(n = 35)与pla2r - ab阴性组(n = 22)比较,血浆MIF水平无显著性差异(P> 0.05)(图2A)。pla2r - ab阳性组(n = 35)与pla2r - ab阴性组(n = 22)比较,尿MIF水平无明显差异(P> 0.05)(图2B)。
MIF水平与感染和静脉血栓形成的关系
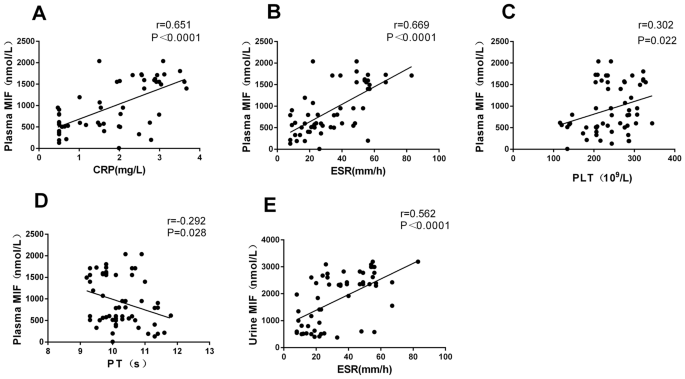
分析MN患者血浆MIF水平与炎性凝血的关系。结果显示,血浆MIF水平与CRP、ESR指标呈正相关(r = 0.651,P< 0.0001;r = 0.669,P< 0.0001)(图3.A, B),血浆MIF水平与PLT呈正相关(r = 0.302,P= 0.022),与PT负相关(r =−0.292,P= 0.028)(图3.C, D),而MIF水平与APTT, TT, FDP, FIB和D-二聚体无相关性。上述结果提示MN患者血浆MIF水平可能与静脉血栓感染及并发症有关。
尿MIF水平也与MN患者的炎症凝血指数进行了比较。结果发现,尿MIF水平与ESR呈正相关(r = 0.562,P< 0.0001)(图3.E),而尿MIF水平与PLT、PT、TT、FIB、FDP和D-dimer无相关性。这些结果提示MN患者尿MIF浓度可能与感染并发症有关。
MIF在MN患者肾组织中显著表达,并与24小时UTP相关
57例患者中,收集了5例MN患者的肾组织,其中MN- i组3例,MN- ii组2例,这5例MN患者pla2r - ab阴性。在这5例患者中,男性3例(60%),女性2例(40%),MN患者的一般病理情况见表3..
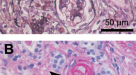
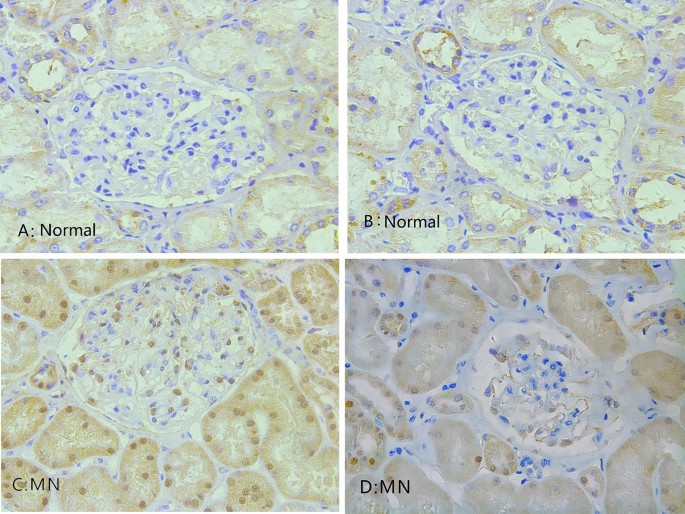
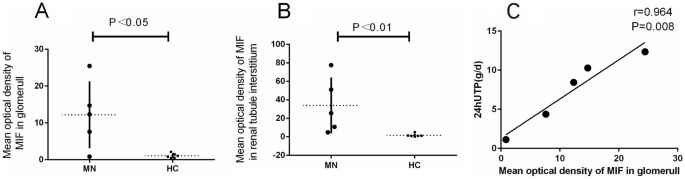
对MN患者的肾组织病理学也进行了研究。在MN患者的肾标本中,免疫组化染色显示MIF在肾小球基底膜和肾间质中显著表达(图2)。4).与对照组相比,MN患者肾小球MIF平均光密度显著升高(12.19±9.11 vs. 1.05±0.66,P= 0.015)4).MN组管状基质MIF平均光密度与对照组比较(P= 0.009)均有统计学意义(图;5A, B)。在MN患者中,相关分析显示mif -阳性的平均光密度与24小时UTP水平相关(P= 0.008)(图5C)。
讨论
MIF是一种炎症细胞因子,具有启动宿主免疫反应的趋化因子特性15.MIF可能是许多免疫相关疾病如哮喘的治疗靶点16类风湿性关节炎17溃疡性结肠炎18系统性硬化症19红斑狼疮20..总的来说,MIF调节细胞因子的表达,促进炎症细胞的募集,并触发和放大其他促炎细胞因子的作用,以及它的糖皮质激素对抗作用21,22.血管紧张素II可促进肾小管上皮细胞中MIF的合成和分泌,从而介导肾损伤23.不少学者发现增殖性肾小球肾炎尿MIF浓度明显升高,月相GN尿MIF水平反映了MIF在肾内的表达,尤其在疾病加重时24.此外,既往研究表明MIF排泄量仅可作为增殖性肾小球肾炎的预后标志物,其值越高,预后越差25.根据免疫组化染色和尿MIF浓度的测量,受损肾脏局部产生和分泌MIF的增加可能与增生性肾小球肾炎中MIF的进行性增加有关。但在非增殖性肾小球肾炎组中未发现同样有统计学意义的相关性,这可能与这些疾病中MIF排泄率较低有关。这与我们的研究结果一致,MN组与对照组血浆和尿MIF水平的差异无统计学意义,我们分析了两组Cr校正后MIF水平的差异。此外,我们发现MN患者血浆和尿MIF水平随着肾脏病理损害程度的升高而逐渐升高。
MN发病机制复杂,近年来MN发病率高,肾活检是其诊断的金标准。然而,由于肾活检有许多并发症,一些患者拒绝接受肾活检,一些学者希望利用生物标志物找到风险更低的MN诊断方法。Beck等首次报道m型磷脂酶A2受体(PLA2R)为主要膜性肾病靶抗原,并对70-80%原发性MN患者血清抗PLA2R抗体检测呈阳性3..在本研究中,我们分析了PLA2R-Ab阳性和阴性两组MN患者血浆和尿液中的MIF水平,我们没有发现PLA2R-Ab表达与MIF水平的一致性。
MIF的表达通常与感染或致病性炎症有关26.例如,细菌感染,包括最严重的内毒素休克病例,与免疫细胞介导的细菌清除过程中巨噬细胞产生的高MIF浓度有关27.因此,我们假设MN患者感染的发生与MIF水平相关,并分析MN患者血浆和尿液MIF水平与感染相关临床指标的相关性。MIF的主要受体是CD74,它可以与CD44结合形成受体复合物,介导MIF信号转导,而CD74也可以与CXCR2、CXCR4形成复合物,将MIF信号传递给炎症细胞中的整合素28,29,30..在引发炎症后,由于基质细胞因子的不受控制的启动,高MIF浓度可能是致命的。因此,通过删除MIF或应用抗MIF抗体来拯救小鼠的致命内毒素血症并不有利。即使在感染开始后应用抗mif治疗,也能获得抗mif治疗的有益效果31.因此,MIF由于其诱导炎症的活性,主要在炎症级联中发挥上游作用。
MN患者并发血栓栓塞的风险极高,这是最常见和最严重的并发症32,33.体外和体内实验研究发现,MIF与CXCR7的相互作用可调节血小板存活和血栓形成潜力34.本研究分析了MN患者血浆和尿MIF水平与凝血异常相关预后指标的相关性,发现MIF水平与MN患者的高凝状态相关。据报道,人类血小板不仅含有大量的MIF蛋白,而且能够在特定的血栓形成刺激下分泌MIF35.Tadamichi等发现MIF在损伤部位与凝血酶合作促进伤口愈合,凝血酶诱导内皮细胞中MIF mRNA的表达,这种表达可被凝血酶特异性抑制剂水蛭素特异性阻断36.
由于MIF在肾脏中的排泄率较低,许多学者试图探索MIF在肾脏组织中的表达。既往研究结果显示,IgA肾病患者肾穿刺病理组织中小管上皮MIF表达明显上调,增生系膜细胞也表达MIF37.在实验性大鼠肾小球肾炎中,肾脏MIF蛋白表达显著上调,这与大鼠病变肾小球抗Thy1肾炎MIF阳性足细胞数量的增加有关38.有学者证实MIF蛋白在人增殖性肾小球肾炎肾组织中表达,并与白细胞浸润、组织学损伤、肾功能损害相关39.此外,Vincenzo等人。40应用基质辅助激光解吸/电离质谱成像(MALDI-MSI)分析两组肾活检证实为MN-II期的均匀患者,然后观察并随访他们的反应。他们最终发现MIF可以作为一种生物标志物来区分哪些患者对免疫抑制治疗有顺从反应。这一发现验证了MIF在MN患者的预后和标准治疗反应方面的假定预测作用,也支持了MN患者的预后评估。目前的研究不仅证实了MIF在MN患者的肾组织中表达,而且发现这种表达与24小时UTP相关(补充信息).
综上所述,血浆和尿MIF水平可反映MN的严重程度,并可能与MN患者静脉血栓形成和感染并发症有关。MIF在MN患者肾组织中表达明显,肾小球MIF表达可作为疾病活动性的指标。
数据可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
参考文献
高,年代,崔,z和赵,m . h .补充C3a和C3a受体激活介导足细胞损伤机制的主要膜性肾病。j。Soc。Nephrol。33, 1742-1756(2022)。
朗科,下午。et al。膜性肾病。Nat. Rev. Dis.引物。7, 1(2021)。
贝克,l。H。et al。m型磷脂酶A2受体作为特发性膜性肾病的靶抗原。心血管病。j .地中海。361, 11-21(2009)。
托马斯,n。M。et al。特发性膜性肾病中含有血栓反应蛋白1型结构域的7A。心血管病。j .地中海。371, 2277-2287(2014)。
徐志峰,陈亮,向海林,张成,熊杰。特发性膜性肾病发病机制研究进展。肾脏说。6, 1-16(2022)。
布鲁奇菲尔德,温特,M. &米勒,E. J.巨噬细胞迁移抑制因子在临床肾脏病。前面。Immunol。7, 8(2016)。
Strussmann, T。et al。血小板是一种以前未被认识到的MIF来源。j . Thromb。Haemost。110中国农业科学,1004-1013(2013)。
Lang, T., Foote, A. & Lee, J. P. W. MIF:在系统性红斑狼疮病理病理学中的意义。前面。Immunol。6, 577(2015)。
Joshua, B., Shan, S. & Yousef, a . MIF,一种有争议的细胞因子:药物开发的结构特征、挑战和机遇综述。当今专家。其他。目标20., 1463-1475(2016)。
Stanislava, s.g., Tamara, S, Dorde, M. & Ivana, S. MIF和胰岛素:从共同起源到共同发病机制的终生伴侣。细胞因子125, 154792(2020)。
Angelina, O., Deng C. & Frank, J. D.巨噬细胞迁移抑制因子(MIF)介导的信号通路在癌症和炎症中的表观遗传调控。药物。今天26, 1728-1734(2021)。
结缔组织疾病:MIF的小分子抑制剂保护狼疮易发小鼠免于肾脏疾病。风湿醇。7, 70(2011)。
梁俊昌et al。抗巨噬细胞迁移抑制因子可降低实验性IgA肾病转化生长因子-β1的表达。Nephrol。拨号。移植。19, 1976-1985(2004)。
奈赫曼,P. H., Jennette, J. C. & Falk, R. J.膜性肾小球病。在Brenner和Rector的肾第9版(布伦纳,b.m.) 1121-1131(桑德斯,2012)。
艾夫斯,一个。et al。巨噬细胞迁移抑制因子通过CD74促进树突状细胞的迁移,激活Src/PI3K/myosin II通路。美国实验生物学学会联合会J。35, 1(2021)。
如意,L。et al。巨噬细胞迁移抑制因子(MIF)在哮喘气道重塑中的作用。过敏哮喘Immun。13, 88-105(2021)。
圣托斯科伊,a.g.et al。巨噬细胞迁移抑制因子启动子多态性与墨西哥南部类风湿关节炎患者的疾病活动性相关。摩尔,麝猫。染色体组。地中海。8, e1037(2020)。
樱井,N。et al。MIF多态性对溃疡性结肠炎患者CDKN2A CpG岛超甲基化的影响BMC医学,伦理。21, 1-9(2020)。
法比安,B。et al。系统性硬化症患者血清巨噬细胞迁移抑制因子和d -多巴色素互变酶的分析。中国。Transl。Immunol。7, e1042(2018)。
Gamez,新泽西。et al。评估血清巨噬细胞迁移抑制因子(MIF)、脂联素和其他脂肪因子作为狼疮性肾炎蛋白尿和肾功能障碍的潜在标志物:一项横断面研究Biomark。Res。8, 1-12(2020)。
Thierry, C. & Richard, B.巨噬细胞迁移抑制因子(MIF):免疫系统内的糖皮质激素反调节。暴击。启Immunol。37, 359-370(2017)。
同时,R。et al。单分子靶向D-DT和MIF的不同互变酶位点抑制中性粒细胞肺招募。美国实验生物学学会联合会J。28, 4961-4971(2014)。
赖斯,e。K。et al。诱导小管上皮细胞合成和分泌MIF——血管紧张素II的新作用。j。Soc。Nephrol。13, 348a(2002)。
菲奥娜,g.b.。et al。尿巨噬细胞迁移抑制因子反映了人肾小球肾炎肾损伤的严重程度。j。Soc。Nephrol。13, 7-13(2002)。
Zwiech, R.巨噬细胞迁移抑制因子尿排泄- mif是增生性原发性肾小球肾炎患者免疫抑制治疗结果的有效预测因子。BMC Immunol。16, 47(2015)。
Stojanovic, T., Saksida, S. & Stosic, G. β细胞功能:巨噬细胞迁移抑制因子的作用。Immunol。Res。52, 81-88(2012)。
Bernhagen, J。et al。MIF是一种垂体衍生的细胞因子,可增强致死性内毒素血症。自然365, 756-759(1993)。
杨,j.w.。et al。靶向巨噬细胞迁移抑制因子治疗急性胰腺炎和胰腺癌。前面。杂志。12, 638950(2021)。
Akinobu, O。et al。MIF-2/D-DT通过SLPI-和atf4依赖机制促进近端小管细胞再生。点。j .杂志。肾杂志。313, 767-780(2017)。
Subbannayya, T。et al。巨噬细胞迁移抑制因子的综合信号转导网络。J.细胞公社。信号。10, 165-170(2016)。
Roger, T., Glauser, M. P. & Calandra, T.巨噬细胞迁移抑制因子(MIF)调节内毒素和革兰氏阴性细菌诱导的先天免疫反应。内毒素Res。7, 456-460(2001)。
巴伯,s.j.。et al。特发性肾小球肾炎患者静脉血栓栓塞事件的疾病特异性风险增加。肾脏Int。81, 190-195(2012)。
邹培明,李宏,蔡剑锋,陈志军。特发性膜性肾病患者血栓栓塞事件发生率及危险因素的队列研究。下巴。医学科学。J。33, 91-99(2018)。
巨噬细胞迁移抑制因子通过cxcr7依赖的Akt信号通路限制激活诱导的血小板凋亡。中国保监会,Res。115, 939-949(2014)。
Strussmann, T。et al。血小板是一种以前未被认识到的MIF来源。Thromb。Haemost。110中国农业科学,1004-1013(2013)。
Tadamichi, S。et al。内皮细胞中凝血酶和Xa因子诱导巨噬细胞迁移抑制因子。生物。化学。279, 13729-13737(2004)。
Taniguchi, Y., Yorioka, N., Yamashita, K., Masaki, T. & Yamakido, M. IgA肾病中的巨噬细胞迁移抑制因子。肾脏Int。54, 2245-2246(1998)。
泰施,g.h.。et al。大鼠系膜细胞体外和体内表达巨噬细胞迁移抑制因子。j。Soc。Nephrol。9, 417-424(1998)。
兰,H. Y。et al。巨噬细胞迁移抑制因子在人肾小球肾炎中的表达。肾脏Int。57, 499-509(2000)。
L 'Imperio, V。et al。MALDI-MSI中试研究强调,巨噬细胞迁移抑制因子的肾小球沉积可能是膜性肾病对治疗反应的一个指标。Proteom。中国。达成。13, e1800019(2019)。
确认
内蒙古医科大学附属医院;资助详情已列于上文。
资金
5项基金分别为国家自然科学基金项目号(82260146)、内蒙古自然科学基金项目号(2018ms08105,2022shzr0762)、内蒙古自治区卫生健康委员会项目号(202201253)和内蒙古医科大学总项目号(YKD2021MS034)。
作者信息
作者及隶属关系
贡献
N.D.进行了实验,分析了数据,并起草了手稿。P.L.L、k.l.w和w.l.y收集案例并分析数据。参与修改稿件。J.H.构思了这项研究,并参与了修改手稿,并提供最终批准提交文件的版本。所有作者都审阅了手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
丁宁,李,李斌,吴,李志强。et al。巨噬细胞迁移抑制因子水平与膜性肾病的疾病活动性和可能的并发症相关。Sci代表12, 18558(2022)。https://doi.org/10.1038/s41598-022-23440-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-23440-1