摘要
我们报道了利用三次谐波显微镜对丝状真菌菌丝中的脂滴进行无标记活细胞成像Phycomyces blakesleeanus.THG显微镜图像显示,在对照条件下,菌丝细胞质中分散着明亮的球形特征,完全氮饥饿后,明亮特征的数量有短暂的增加。对THG和脂质反染图像进行共定位分析,发现胞质颗粒为脂滴。采用颗粒尺寸分析和图像相关光谱法定量脂滴的数量、密度和大小。两种分析方法均显示从16 × 10增加−3到23 × 10−3脂滴/µm2经过氮饥饿和液滴的平均尺寸减小(范围:0.5-0.8微米直径)。综上所述,THG成像、PSA和ICS可可靠地用于丝状真菌体内脂滴定量,无需标记和/或固定。此外,已证明ICS适用于THG显微镜。
简介
三次谐波(THG)显微镜作为一种无标记非线性成像技术是一个强大的工具,可视化的各种细胞和组织结构1.THG主要应用于动物细胞结构成像1,2,3.,4,5,6,7和组织1,4,6,8,9,10,11,12,13,14,以及细胞过程的动力学(功能成像)1,6,12,15.此外,THG显微镜已用于研究人类和脊椎动物的牙齿化石16,三维工程人体脂肪组织17、小生物(黑腹果蝇、斑马鱼、非洲爪蟾、早期小鼠胚胎8,18,19,20.和秀丽隐杆线虫21,22).除了动物标本,THG显微镜也被应用于植物11,23,24,25,26,27、藻类26,27和酵母2,28.据我们所知,丝状真菌的THG研究很少。
THG现象是由具有特定性质的结构引起的非线性相干散射过程。在THG中,三个光子的联合能量被转换为一个光子。由于THG是一个三阶过程,为了保证足够的信号,需要在光焦点处具有高峰值功率密度的超短激光脉冲。在THG显微镜中,在折射率或三阶非线性磁化率有较大变化的界面上产生对比29,30..由于脂类的折射率较高(在1100-480 nm时,r.i(脂类)= 1.46-1.48)31相对于细胞质(r.i在633 nm处= 1.360-1.390)32时,THG信号在水相和富脂结构的界面处有效产生33,34,35.其中包括细胞膜和脂滴(ld)。
脂滴是一种动态细胞器,在真核细胞的脂质稳态和能量调节中起着关键作用。对真菌中脂滴生理的研究仍处于起步阶段,但其定量与生物医学、农业、工业废物和能源危机等问题有关。如上所述,THG显微镜是一种特别适用于脂滴生理学研究的技术11,35,36.THG显微镜的优点是它是非侵入性的,产生固有的共聚焦图像,不需要固定或外部标记-类似于基于拉曼的37,38,39,40,41,42,差分干涉对比度(DIC)43以及光学薄片显微镜37,并且具有最低限度的光毒性,可用于体内研究。基于拉曼的技术和THG显微镜之间的一个不同点是更简单的激发方案和最小的像差风险。将THG与荧光显微镜相结合有助于识别THG产生的信号的分子来源(即靶向LDs的亲脂性荧光染料)。4,7,36.一旦识别出THG相关结构,就可以使用THG显微镜原位跟踪。
定量包含ld的图像可能具有挑战性。所需参数包括LD数量、密度、尺寸和形态。可用于此目的的图像分析软件和编程语言有ImageJ, Cell Profiler, Imaris, AMIRA, Volocity, MATLAB, D编程,用于这两种荧光图像44,45,46,47和脂滴图像采取无标签11,17,20.技术。脂滴的自动定量使用图像的阈值(基于阈值)或分水岭方法(基于形态学)48,并且通常针对特定的细胞系进行优化。我们希望有一个更通用的图像分析平台,不需要广泛的细胞系特定阈值。在这方面,图像相关光谱(ICS)是一种很有前途的方法,因为它是基于测量空间相关波动。ICS已应用于共聚焦图像,测量荧光强度波动的空间变化,这可能进一步与颗粒密度和聚集状态有关49.另一方面,ICS很少用于非线性技术,仅用于双光子激发荧光(TPEF)。50或者最近的二次谐波成像(SHG)51.
丝状真菌52是普遍存在的生物,对广泛的生态系统过程有深刻的贡献,包括有机碳的分解、碳储存和养分转移。作为碳循环中一个不可见且经常被忽视的部分,丝状真菌(如腐生植物和植物共生体(菌根真菌))为植物有机碳创建了一个汇,并将其分配到地下菌丝生物量53.产油丝状真菌有能力以脂质形式积累大量的碳,超过其生物量的20%54,55在适当的条件下。这些脂质被认为是各种生物技术应用(生物柴油生产、高价值化学品、食品/饲料添加剂和废水的有效生物修复)的宝贵替代资源。56,57在以生物为基础的经济中。此外,脂质积累与真菌对毒素的抵抗力有关58致病真菌的毒力59.此外,经过修饰的完全缺乏脂滴的酵母细胞对各种压力都非常脆弱60这表明LD研究可能会导致新的抗真菌治疗方法。我们选择了众所周知的模式物种进行LDs的THG成像研究Phycomyces blaekseneanus在THG成像中,丝状真菌的LDs尺寸非常小(< 1.5 μm),而在白色脂肪细胞中,LDs尺寸可达100 μm,这是利用THG成像对丝状真菌进行成像的挑战61.我们的目的是表明THG显微镜非常适合于成像活丝状真菌中ld的密度和大小。为此,我们将在基线控制条件下使用丝状真菌,具有零星和小的ld,对应于低脂含量条件62,以及氮饥饿诱导的自噬反应引起的LDs密度更大的真菌63,即分子循环的保守细胞机制64.除了真菌中ld的无标记THG成像外,我们还提出了两种用于ld定量和分析的方法。第一种方法是基于ImageJ/Fiji开源平台的颗粒分析工具,它提供了ld的大小、形状和数量的测量。第二种方法称为图像相关光谱(ICS)65,通过空间自相关分析提供颗粒密度和大小的测量。
我们的目的是证明ICS是一种很好的方法来量化在THG图像中的ld。
材料与方法
丝状真菌菌种及生长条件
合子菌一种产油合子菌的野生型菌株Phycomyces blakesleeanus本研究采用(burgff) [NRRL 1555(-)]作为模型细胞系统。为了菌丝体的最佳生长,孢子浓度为107孢子/ml在21-23°C下镀于100mm的培养皿中。每升培养用最低标准液体(SLM)培养基:20克D(+)-葡萄糖(碳源),2克l -天冬酰胺·H2O(氮源),KH 5克2PO4, 500 mg MgSO4h·72O,微量元素/“微量库存”(28毫克钙2,盐酸硫胺素1 mg,柠檬酸·H 2 mg2O, 1.8 mg Fe(NO3.)3.h·92O, ZnSO 1毫克4h·72O, 300µg MnSO4·H2O, 50µg CuSO4h·52O和50µg Na2MoO4h·22O)。葡萄糖单独蒸压,最终培养基pH为4.5。渗透压约为200 mOsm。
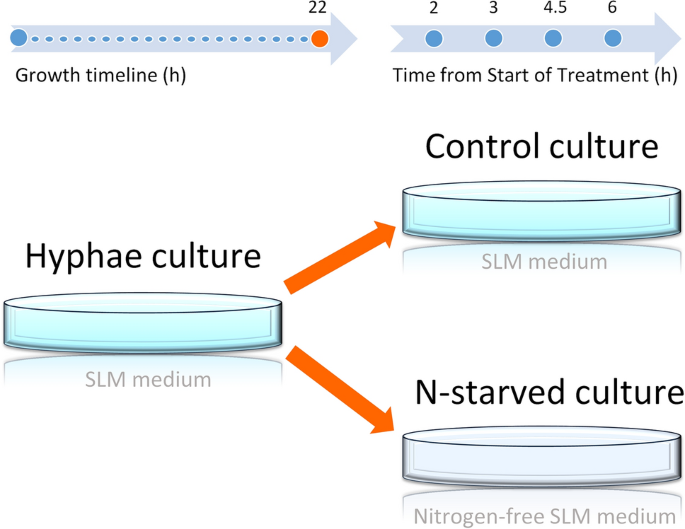
在氮饥饿实验中,真菌首先在SLM培养基中生长,22 h后分为两组。组1为对照组,组2为缺氮组(n -starve)。对照组1的真菌经离心10 min后重悬于SLM培养基中。第2组,真菌细胞离心(10分钟),重悬于无氮培养基(不含l -天冬酰胺的SLM培养基)(图2)。1).在室温下氮饥饿(3、4.5、6 h和> 6 h(至8.5 h))后的不同时间点对年龄匹配的真菌培养进行成像。用于成像的所有真菌培养都处于指数生长期(从播种开始的总时间在24-30.5小时之间)。从6 - 8.5小时的时间点收集的数据汇集在一起,并代表长时间氮饥饿组(图上标记为6小时)。
脂质染色
活真菌细胞染色时不进行化学固定。为了染色真菌细胞,将指数生长期(26 h)的菌丝与40 ng/mL尼罗红染料(Acros Organics)在20℃下孵育10分钟。
非线性激光扫描显微镜(NLSM)实验设置和菌丝成像
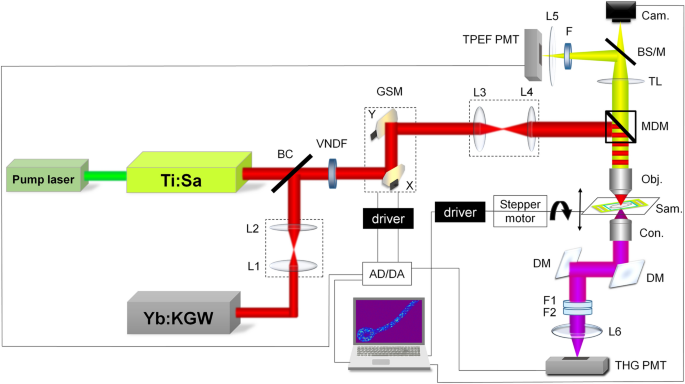
未染色的活真菌细胞的图像是使用定制的非线性激光扫描显微镜获得的,先前在参考文献中描述过66,67,但修改了THG成像(图。2).为了对细菌进行三次谐波(THG)成像,使用了以下基于显著改进的Zeiss Jenaval直立显微镜的实验装置:由SESAM锁模Yb:KGW激光器提供红外飞秒脉冲(Time-Bandwidth Products AG, Time-Bandwidth Yb GLX;瑞士苏黎世,波长1040 nm,脉冲持续时间200 fs,重复频率83 MHz)。激光波长的选择使得波长短3倍(347 nm)的THG信号仍然在常规空气紫外光学的范围内。激光首先通过1:1的准直扩束器(L1和L2)进行发散补偿,然后与用于TPEF成像的Ti: Sa激光束结合(在BC处)。在此之后,两个光束通过电动可变中性密度滤波器(VNDF)进行功率调节和机械快门。使用两个检镜对样品上的光束进行光栅扫描(Cambridge Technologies, 6215H;使用1:3.75的扩束器(L3和L4)填充物镜的后孔径,达到4f。配置。光束通过高数值孔径(NA)油浸物镜(Carl Zeiss, EC Plan-Neofluar 40X, NA 1.3)通过短通主二向色镜(MDM,在700 nm处截止)进一步定向到样品上。 The THG signal was detected in the forward direction (transmission arm), parallel to the direction of laser propagation. First, the signal was collected by high NA aspheric lens (condenser). Then, it was reflected by two dichroic mirrors (DM) that reflect 347 nm but transmit 1040 nm to prevent the laser beam from reaching the detector. Further on, the signal was filtered out from the rest of the laser photons by a bandwidth filter 275–375 nm (Thorlabs FGUV11M) and a Hoya glass UV filter (Newport FSR-U340) with a maximum transmission at 340 nm. The THG signal was detected using a photomultiplier tube (PMT) (Hamamatsu, H7422, Japan), after being focused by a 50 mm focal length lens (L6) onto the entrance window of the PMT.
NLSM设置。用于TPEF成像的Ti: sa激光,用于TPEF和THG成像的Yb: kgw激光,bc光束组合器,L1和l2镜头1:1扩束器用于再准,vndf可变中性密度滤光片,gsm -振镜扫描镜,L3和l4镜头1:3.75扩束器用于成像,mdm -主二向色镜(截光700nm), Obj。显微物镜40 × 1.3, Sam。-样品,锥形非球面聚光镜,dm -二向色镜,反射THG (347 nm),透射Yb激光(1040 nm), F1-Hoya玻璃UV滤光片,峰值透射340 nm, f2 -带通滤光片275-375 nm, l6聚焦透镜,THG pmt -光电倍增管用于THG信号,tl管透镜,BS/ m光束分镜或镜开关,凸轮。-相机,F-VIS滤光片400-700 nm自动荧光或VIS + 570 nm长通用于尼罗红荧光,l5聚焦透镜,TPEF pmt -光电倍增管用于TPEF信号,AD/ da采集卡。该方案是在Microsoft powerpoint 2016中创建的(https://www.microsoft.com/en-us/microsoft-365/powerpoint).
用于(自动)TPEF成像可调(700-900 nm)克尔透镜模式锁定Ti:Sa激光器(Mira 900,相干公司。采用532 nm连续波频率倍Nd:YVO4激光器(VERDI V10, Coherent Inc.)进行泵浦。美国CA)。Ti:Sa激光的波长设置为730 nm用于自动TPEF成像,因为大多数内源性荧光团(NADH,黄素等)可以在此波长激发68一方面,又因为技术上的限制(激光可调范围和二向色镜的切断)。荧光信号由物镜进行后向反射采集,经过MDM、管状透镜(TL),通过VIS (400-700 nm)带通滤波器(佳能,摄于相机EOS50D)滤除,用于检测Ti:Sa激光激发的自荧光。此外,尼罗红荧光采用570 nm长通滤波器(彩色玻璃,未知厂商),由Yb: KGW激光激发,同时由THG信号检测。TPEF信号通过50mm焦距透镜(L5)聚焦到TPEF PMT的入口窗口后检测。
采用国家仪器卡USB-6351采集,采集速率为1.2 M sample/s。这使得在低分辨率下的实时监控具有足够高的帧率,例如每秒3帧,256 × 256像素,平均6帧。对于高分辨率图像,1024 × 1024图像需要30秒,平均为30。40 × 1.3物镜显微镜的横向分辨率估计为300 nm,轴向分辨率估计为1000 nm。
亮场图像由佳能EOS 50D数码相机(日本东京)拍摄,其CMOS传感器放置在管镜头的像平面上。拨码开关BS/M允许使用相机进行亮场或TPEF PMT进行荧光成像。
使用了一个特殊设计的样品夹,使菌丝和生长介质被放置在两个盖片之间,以满足物镜的最佳NA标准,同时也避免了厚玻璃对UV THG信号的损失(补充图。S1而且S2显示所测试的菌丝的不同成像条件,以便找到最佳的)。采用#1.5覆盖层(170 μm厚度)。用20 μl菌丝悬液维持菌丝存活。支架放置在物镜和非球面聚光镜之间的电动工作台上,可沿光束传播方向(z轴)平移0.3 μm步长,用于样品的光学切片和三维成像。
在对照组和缺氮组成像中,时间点依次收集。使用无标签成像技术,如THG,使我们能够在从培养物中提取真菌后,以最小的延迟对样品进行成像。为了获得活菌丝的至少3张THG图像,样品在显微镜下培养的总时间在25 - 37分钟之间。有效地,控制和处理的时间点在一个实验日偏移30-40分钟,在第二天,偏移方向与另一个相反。实验组中所有菌丝生长时间的准确范围(均值和标准差)收集在补充图中。S4.
图像分析
使用ImageJ对脂滴进行二维THG图像分析(W. Rasband,美国马里兰州国家卫生研究所,http://imagej.nih.gov/ij/).使用MATLAB(内部创建代码)和VolView软件编写的算法进行3D和4D图像处理。采用两种图像分析方法,颗粒尺寸分析(PSA)和图像相关光谱(ICS)来量化LDs的数量和大小。有关两项程序的详情载于补充资料。
统计数据
为了进行定量图像分析,分别从6个独立生长的培养物中获得对照条件下(n = 44)和氮饥饿后(n = 17)的单个菌丝图像。GraphPad Prism用于绘图和统计比较。盒状和须状图的盒子由第25和第75百分位的范围包围,线代表中位数;晶须分别向最小值和最大值延伸。每组所有LD直径以0.3µm分仓生成LD数量直方图,每个bin值除以组内菌丝面积之和。LDs个数/菌丝面积直方图误差计算公式为:相对误差(被装箱N/面积)=相对误差(LDs个数/菌丝面积)+相对误差(面积),相对误差(被装箱N/面积)乘以该bin的LDs个数/菌丝面积。采用双因素方差分析(two -way ANOVA)和Holm-Sidac校正(Holm-Sidac correction)和非配对双尾t检验(Welch's correction)对不平等方差进行统计学意义的计算。在适当的情况下,用未配对的双面Mann-Whitney检验代替。统计学显著性置信水平为:0.05(*),0.01(**),0.005(***),0.0001(****)。
结果
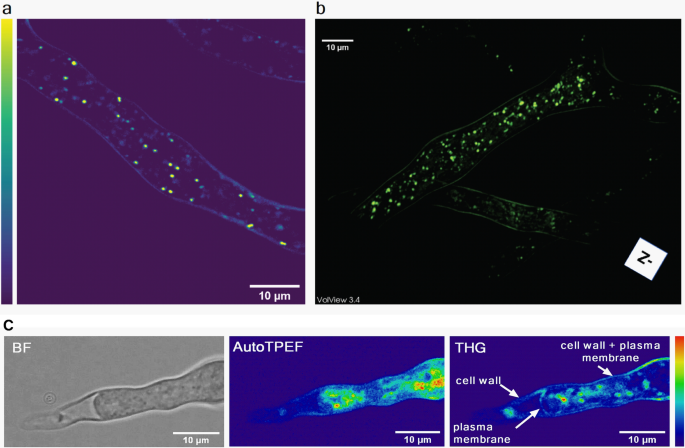
未染色活体THG切片(2D)及三维重建p . blakesleeanus处于指数生长期的菌丝如图所示。3.分别为a, b。细胞周长处的THG信号来源于几丁质细胞壁和质膜,它们遵循细胞壁的形状。在细胞质中,可以看到产生THG信号的各种实体。菌丝置于两个盖层之间的液体培养基中。显微系统的高分辨率(衍射受限),菌丝的厚度(约10微米)和介质的透明性使得整个菌丝可以被光学切片,并可以重建3D模型(图。3.b和补充视频S1参阅补充资料)。可见,在细胞质中的所有实体中,强THG信号特征最为突出。根据文献,这些很可能是脂滴,因为与细胞质的其他部分相比,它们具有较大的折射率。此外,在Supplementary Material中提供了源自ld的THG信号的功率依赖性(图2)。S3).
细胞壁和质膜之间的距离非常小,这在通过衍射有限技术获得的原生菌丝图像中是无法分辨的(分辨率约为250 nm)。为了分别观察细胞壁和质膜,我们将菌丝溶解,使质膜在可分辨的距离上从细胞壁上缩回(图2)。3.c).收缩的细胞质在亮区清晰可见(图。3.c左)和autoTPEF图像(图。3.c中),但只有在THG图像中才能完全分辨出质膜(图。3.C右),因为它的折射率不同于细胞质。
菌丝中AutoTPEF和THG信号无明显重叠
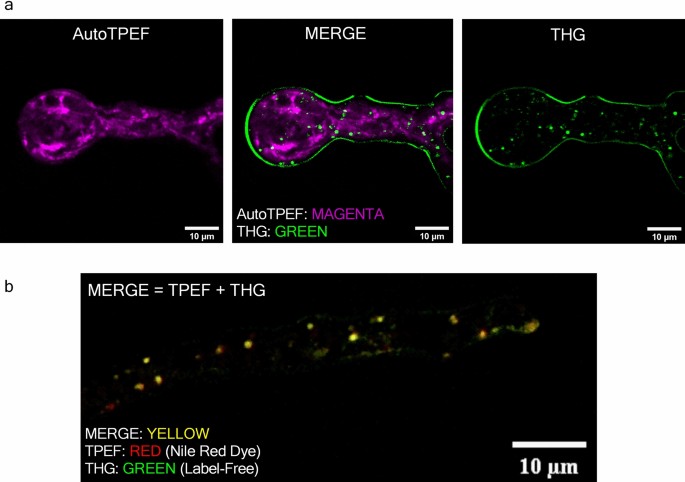
虽然THG成像并不一定是特定于LDs,因为THG信号是由任何折射率变化产生的,但与细胞细胞质中的其他结构相比,LDs仍然产生明显更高的THG信号p . blakesleeanus.这一事实可以用来提取细胞中的ld,在一个广泛的但仍然比其他细胞质实体低得多的信号范围。作为确认高THG信号特征在未标记现场的第一步p . blakesleeanus为LDs,我们通过在730 nm处两次光子激发下检测自动荧光信号对同一菌丝进行成像(图。4左)。为了保证高THG信号实体(图;4a)不是可能由高激光强度损伤引起的伪影,我们合并了两幅图像,THG和autoTPEF(图2)。4(中)显示相同位置的TPEF信号没有明显增加。菌丝处于指数生长期,如图。3..
TPEF和THG成像的脂滴信号共定位
而许多对各种生物样品的无标记成像研究表明,细胞质中强烈的THG对比主要来自于ld11,35,36的情况下Phycomyces blaekseneanusTHG成像从未应用于这类生物。
为了坚定地证明菌丝THG图像中的细胞质点是LDs,我们进行了共定位实验(图2)。4b).菌丝用尼罗红染色,尼罗红染色被认为是脂质的标准69.采用与THG相同的激光激发尼罗红染料的TPEF,通过400-700 nm带通和570 nm长通滤波器收集TPEF信号,有效地将荧光信号隔离在570 - 700 nm光谱区域。激光束用Zeiss Plan Neofluar 40 × 1.3物镜聚焦,同时检测TPEF和THG信号。在测量前,在两个覆盖纸之间加入非常小体积的样品(10 μl真菌悬浮液)。这使得菌丝在成像过程中保持存活,但也可以尽可能地固定在覆盖层附近,从而实现最佳分辨率。
基于Pearson相关系数和图像交叉相关光谱(ICCS)对TPEF和THG图像进行定量比较(共定位分析)。Pearson相关系数在0.74 < R范围内总计< 0.88 (ImageJ,共域阈值插件)。根据ICCS分析,THG检测到的聚类与tpef检测到的聚类相互作用的比例为0.89,表明脂质探针产生的波动与THG信号之间存在高度的空间相关性。在我们的工作中获得的共定位程度与在活体和一些固定样品上的无标签成像所获得的一致或更高7,70.
基于共定位实验(图;4b),结果如图所示。4人们可能会认为THG图像中最圆的明亮特征Phycomyces blaekseneanus就是脂滴。
脂滴THG图像分析与定量
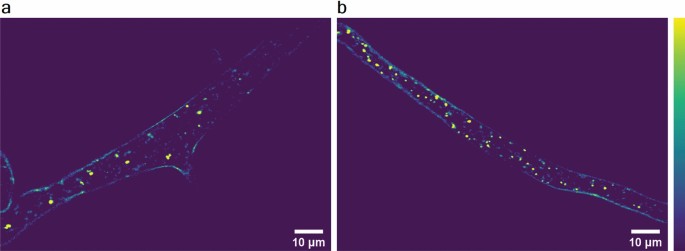
为了量化ld,我们通过粒度分析和图像相关光谱分析了一小组THG图像(均可在ImageJ中获得)。为了测试和比较这两种方法,我们使用在完全无氮培养基中培养的菌丝培养物和在标准培养基中培养的同批次菌丝培养物作为对照。已知氮限制会引起丝状真菌的自噬71,导致脂质代谢的改变和ld数量的增加72,73.我们对指数生长期的菌丝进行THG成像,并在对照组之间交替进行(图2)。5a)和n -饥饿(图。5B)菌丝批次年龄匹配。从无花果。5即使用肉眼也可以明显看出,氮饥饿4.5 h后LD数量显著增加。一旦我们确认我们获得了预期的LD数量增加,我们就继续测试两种量化方法以及THG成像对LD检测的敏感性。
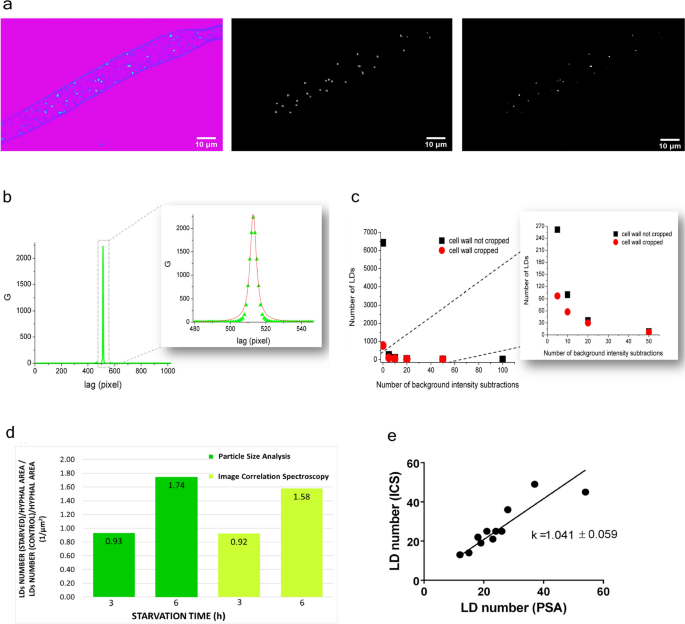
对于PSA方法(可在ImageJ中作为“分析粒子”),原始THG图像(图。6a左)进行阈值,并转换为8位掩码,在此基础上,程序自动统计所分析图像中代表ld的“粒子”的数量(图。6一个中间)。除了粒子的数量,直径和面积也被量化。
THG图像的图像相关光谱(ICS)和颗粒尺寸分析(PSA)。(一个)处理同一THG图像的PSA和ICS分析。左:未处理的THG图像Phycomyces blakesleeanus标准液体培养基中指数生长阶段菌丝;中间:粒度分析得到的8位掩码;右图:用于ICS分析的背景减去图像。左起图像(未处理的THG图像)采用20 ×背景相减处理。两个图像都显示在全动态范围(8位)。采用蔡司40 × 1.3物镜拍摄THG图像,样品面平均激光功率为27 mW。(bICS分析:自相关函数(G曲线)作为活菌丝和未标记菌丝经过强度中心的THG图像相关图。自相关曲线拟合一个洛伦兹函数来提取FWHM值,如方法部分所述。(c) ICS分析,去除细胞壁的效果:对于手动裁剪细胞壁的THG图像(红色圆圈)和在背景减去之前未裁剪细胞壁的同一THG图像(黑色方块),在每次背景减去后从G曲线中获得的LDs的数量。(d)比较从同一组缺氮培养3 h和6 h的THG图像中获得的ICS和psa衍生数据及其年龄匹配的对照组(每组n = 3)。n -饥饿菌丝中每单位菌丝面积上的LDs数量与年龄匹配对照中每单位菌丝面积上的LDs数量之比。(e) ICS与PSA的LD数定量结果一致。对于每张图像,将ics获得的LD编号与psa获得的LD编号进行绘制。两幅图的数据均来自无标记THG图像,其分析见表1.
由于图像的阈值和有限的分辨率(像素大小),PSA可能对非常小或微弱的信号实体不敏感。因此,一些新出现的ld可能会被省略,并没有在最终结果中显示出来。为了解决这一问题,我们执行了ICS,该ICS根据图像中信号强度的空间波动提取颗粒属性信息(数量和大小)。ICS也适用于漫反射图像。
由于菌丝的形态,在应用ICS分析之前,有必要对THG图像进行预处理。菌丝的细胞壁被从图像中移除,因为它阻碍了相关分析(在G曲线上产生了座),因为菌丝周围的强度沿整个圆周呈明显的不连续。我们对背景进行多次减法(菌丝外ROI的平均像素强度),直到墙壁消失74.后一个过程如图所示。6很明显,来自大多数ld的THG信号比来自墙壁的信号强得多(大约> 10x)。
去除细胞壁后,在图像j中进行图像相关处理,得到空间自相关图像,通过图像中心取强度剖面,提取G曲线。G曲线的一个例子如图所示。6b. ld数量计算公式如下:
其中N照片像素大小是2吗n×2n图像(其中n为整数),r为作为G曲线FWHM一半的LDs的平均半径,G(0)为G曲线的最大值。r和G(0)是从G曲线的Lorentzian拟合中提取出来的(图。6b插入)。应该注意的是,ld的形态与通常用ICS分析检查的聚类的形态有很大的不同。因此,在我们的例子中,背景的多次减法并没有像预期的那样导致曲线G与减法次数的变平74.参考文献74中所示的G曲线的扁平化被用作应用ICS之前背景必须减去多少次的标准。我们对背景减法数量的标准是:(a)在每次后续减法后,ld数量的显著减少停止。6c,黑色方块),(b)每个菌丝的LDs数量与PSA的近似匹配,(c)经验(从肉眼观察到的图像中消失细胞壁)。在检查了几十张对照和处理过的菌丝图像后,我们得出结论,平均而言(取决于初始图像质量),连续20次减法足以进行可靠的ICS分析。
为了检查额外的去除细胞壁是否会产生不同数量的ld,我们只进行人工去除细胞壁。它是通过在多重背景减法之前的圈定和裁剪完成的。在连续20个背景减除后,与未手动裁剪细胞壁的图像相比,该方法在ld数量上没有显着差异(如图所示)。6c)。
用PSA和ICS分析LDs
ICS和PSA得到的LD数量和大小的比较见表1.平均每个菌丝面积上的LDs数量大致相同,但ICS得到的平均直径略低。这种差异可能是因为这两种方法中使用的对象大小定义不同。
为了估计处理过的菌丝中LD数量的变化,我们计算了处理过的菌丝中LD数量与对照菌丝中每面积LD数量的比值(图2)。6d).饥饿3 h后LDs总数无明显变化。饥饿时间越长,ld的数量增加50%以上。
通过ICS分析,计数的特征数为目测LD数(n = 12)的80±12%,与PSA得到的数据密切相关。当通过这两种方法获得的ld的数量为每个单独的图像作为一个单独的点绘制(图。6e),回归线斜率接近于1,证实ICS在检测和计数ld方面与PSA方法同样可靠。回归R的系数2大约是0.8。
氮饥饿诱导脂滴数量和大小的变化,从THG图像定量
为了充分利用THG成像(1024 × 1024像素图像的曝光时间最长为30秒,平均为30),并将随后的分析作为LD分析,我们对在缺氮和对照条件下生长的丝状真菌培养物进行了一组跨时间的成像和测量。真菌培养物在处理开始(氮饥饿或对照)后至少2小时后进行成像,这是预防措施,以避免在开始处理准备期间的操作(例如离心)可能产生的影响。
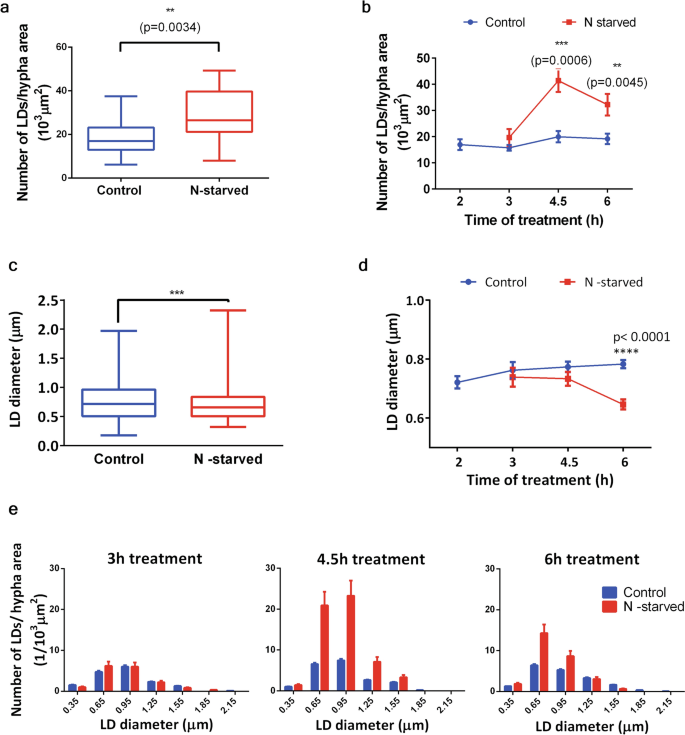
在贫氮培养基(缺氮)中培养的真菌菌丝中,所有成像菌丝中每单位细胞面积的LDs数量(LDs数量/菌丝面积)明显大于对照组菌丝培养的整个组(对照)(图2)。7a).为了阐明观察到的LD数量诱导增加的时间过程,将对照组和缺氮组分别分解为从治疗开始到持续时间的组,并绘制出LD数量/菌丝面积的值随时间的变化(图2)。7b).对照组的LDs数量/菌丝面积在观察时间内基本保持不变,向后期生长时间点有轻微而不显著的增加趋势(图。7b).仅在处理时间点3 h时,n饥饿组的LDs/菌丝面积与相应对照组相似。处理4.5 h后,与对照相比,LDs数量/菌丝面积增加了两倍。与对照菌丝相比,n饥饿菌丝中LDs数量/菌丝面积显著增加,且持续时间较长(图2)。7b)。
从THG图像中定量的lddsPhycomyces blaekseneanus菌丝。处理开始后,菌丝在无氮或标准液体培养基中培养2-6小时(或更长至8小时)。得到的ld THG图像采用PA分析。N = 6个独立的培养物。(一个) n -饥饿增加了单位面积上ld的数量。从单个菌丝获得的LD数归一化为菌丝面积(在103.µm2).对照组(n = 44),缺氮组(n = 17)。盒状和晶须图,由第25和第75百分位范围包围,晶须从最小值扩展到最大值的中位数线。韦尔奇修正的未配对t检验,双尾,p= 0.0038。(b) LD数/单位面积的时间变化,表明饥馑对LD数的增加在4.5 h时显著(p=p= 0.0006)及以后的时间(p= 0.0045),与相应的对照组相比。双向方差分析,带Holm-Sidac校正。均值±SE, n(控制)= 8;7;11;21为时间点(单位h),分别为:2;3;4.5;6.n(N-starved)= 6;3;7表示时间点(单位h),分别为:3;4.5;6.(c) n -饥饿会降低ld的直径。对照组(n = 1205)和缺氮组(n = 431)的LD直径。盒状和晶须图,由第25和第75百分位范围包围,晶须从最小值扩展到最大值的中位数线。Mann-Whitney (p= 0.0008),双尾。(d) LD直径的时间进程变化,说明n饥饿对LD直径的降低只有在较长的饥饿时间才显著。双向方差分析,霍尔姆-西达克校正(p< 0.0001),与相应的对照组相比。均值±SE, n(控制)= 176;124;302;571表示时间点(单位h),分别为:2;3;4.5;6.n(N-starved)= 100;118;214表示时间点(单位h),分别为:3;4.5;6.(e) n饥饿4.5 h和6 h后LDs数量增加的差异分布。最大的ld在最长的饥饿时间内丢失。对照组和缺氮组LD直径分布直方图,0.3 μ m分仓。直方图中每个bin中的ld数量除以相应组的菌丝面积之和。误差的计算方法请参见方法部分。x轴上的数字表示箱子的上限。
与对照组相比,在缺氮培养中,当不考虑处理时间的整个组进行比较时,LDs的平均直径显著减小(图2)。7c).从时间过程图可以看出(图。7d),从处理时间2 h到最长处理时间,对照组的平均LD直径基本相同。在n饥饿3 h和4.5 h菌丝及相应对照中也相同。n饥饿对平均LD大小的影响只有在处理6小时或更长时间后才会显现出来。7d)。
LD直径直方图,以LD数量/菌丝面积(图;7e)在处理时间为4.5 h和6 h的组中,发现在4.5 h时间点n饥饿组中小于1.6 μ m的ld数量多于相应的对照组,而在6 h时,仅小于1 μ m的ld数量增加。LD平均直径在4.5和6小时n饥饿组之间的变化似乎是由于在n饥饿条件下长时间生长期间,大于0.6 μ m的LD种群显著损失的结果。综上所述,在无氮条件下生长过程中,LDs的总体变化是在3 - 4.5 h时间点之间LDs数量增加,随后在长时间饥饿期间,大于平均水平的LDs种群数量减少。
讨论
脂滴曾经被认为是被动的脂质储存团块,现在被认为是动态的细胞器,在真核细胞中作为无处不在的能量和脂质稳态的中心枢纽75.真菌中脂滴生理学的研究,虽然仍然很少76,有望为许多重要问题提供新的解决方案:减轻和调节真菌对杀菌剂和压力的耐药性,确保食品安全,更好地理解如何将真菌作为可持续有机废物再利用和转化为能源的重要组成部分,等等。Phycomyces blakesleeanus,本研究中使用的模式菌属Mucormycota,能形成丛枝菌根和其他互利共生的真菌的系统发育类群77陆生植物78.在真菌与植物相互作用的过程中,真菌将氮运送到植物,并接收植物合成的高达30%的有机C化合物78作为回报。众所周知,从植物输送到真菌的有机分子是脂类79,80并且脂滴在与植物接触区域相邻的菌丝中大量形成81.类似于Phycomyces,丛枝菌根真菌能够以脂滴的形式积累大量获得性有机碳82.本文所述的LDs的THG成像是一种可以直接应用于与之相关的活菌根真菌的方法Phycomyces,无需对方案进行任何修改,也无需进行其他染色。
在我们的研究中使用的真菌培养条件导致了相当适度的脂滴积累,正如预期的那样62.THG成像分析使我们能够从这种低密度/直径基线观察和量化完全去除氮所带来的脂滴数量变化。正如预期的那样,完全不含氮只会引起脂滴数量的短暂增加,随后是脂质周转83.THG成像分析发现生长后期脂质储备明显下降。总而言之,这表明THG成像方法对于更广泛地探索各种生活条件下丝状真菌中的LD是有用的。
光学成像技术通常用于研究体内脂滴,但脂滴通常需要用各种染料进行标记。另一方面,使用荧光染料的长时间成像对细胞有光毒性,并可能扰乱代谢过程,包括脂质代谢。因此,无标记成像方法有利于活细胞的研究84,85,86.
THG成像是一种无标记的方法,我们已应用于产油真菌的活菌丝Phycomices blakesleeanus,生成的图像具有脂滴高THG信号强度的特征斑点,是正常和应激细胞生理的产物。有几行证据支持这一归因。首先,根据文献,脂滴界面与细胞质其余部分之间的脂质折射率的急剧变化产生了高强度的THG信号11.其次,为了排除可能产生高THG信号的激光损伤点,我们对未染色的菌丝进行了TPEF成像,结果显示,在同一菌丝的THG图像上,autoTPEF图像没有任何突出的斑点。第三,我们进行了共定位实验,用脂质特异性染料对菌丝进行染色,并用TPEF和THG法进行成像。这两幅图像上的斑点大部分是重叠的,这证实了这些斑点中含有脂质。此外,按照折射率急剧变化的相同逻辑,我们已经证明了用THG方法可以对无标记菌丝中的细胞壁和细胞膜进行成像和区分。
关于脂质斑点的成像,有许多需要讨论的注意事项。由于同时检测两种信号(TPEF和THG),可以使用有限数量的染料进行实时成像。在本研究中,固定不是一种选择,因为它改变了ld的结构87.这项研究中使用的染料尼罗河红可能对ld没有特异性,它可以与细胞中的其他物体和结构结合88.来自非ld结构的信号会渗入检测波段,最终影响共域度。此外,来自细胞壁的强THG信号进一步恶化了共定位程度。与TPEF成像相比,THG成像需要更高的激光功率。正因为如此,当同时检测两个信号时,人们必须在应用激光功率方面做出权衡。这种折衷的代价是THG图像中某些结构的损失(例如,小的ld,否则在较高的激光功率下可见),以及失焦ld产生微弱、模糊的TPEF信号(否则在较低的激光功率下不可见)。
为了从THG图像中提取定量数据,采用了颗粒尺寸分析(PSA)和图像相关光谱(ICS)两种图像分析方法。这两种方法都可以量化脂滴的数量及其平均大小(直径)。由于ICS主要用于荧光图像和聚类分析,据我们所知,到目前为止它还没有用于THG图像,我们通过将结果与PSA进行比较来测试它。试验对菌丝在正常和应激(氮饥饿)条件下的图像进行。已知氮饥饿会导致脂滴数量增加72,73两种方法得到的数值吻合较好。
总的来说,所提出的成像方法(THG)和图像分析方法(ICS)被证明适合于产油真菌脂滴的无标记体内研究。将THG方法应用于真菌脂滴动力学的未来研究,有助于促进对真菌细胞生理学的基本认识,进而有助于对自然界碳循环过程的基本认识。
数据可用性
向通讯作者提出合理要求后可获得的数据。
参考文献
魏格林,B.,巴克,G. J. &弗里德,P.细胞和组织组织的三次谐波显微镜。细胞科学。129, 245-255(2016)。
叶林,李志强,杨志强。激光扫描三次谐波显微镜在生物学中的应用。选择快递。5(8), 169-175(1999)。
Barzda, V。et al。心肌细胞中线粒体的可视化。选择快递。13, 8263(2005)。
威特,S。et al。用三次谐波显微镜进行无标签活体脑成像和靶向修补。Proc。国家的。学会科学。美国。108, 5970-5975(2011)。
蔡,C.-K。et al。三次谐波显微镜下白细胞的成像粒度。生物医学。选择快递。3., 2234(2012)。
韦格林,B.,巴克,G.-J。黑素瘤细胞集体侵袭的活体三次谐波发生显微镜。活体的1, 32-43(2012)。
Gavgiotaki E。et al。三次谐波显微镜作为一种可靠的诊断工具,用于评估细胞激活期间脂体修饰:BV-2小胶质细胞的例子。j . Struct。医学杂志。189, 105-113(2015)。
或者,D。et al。三次谐波显微镜深度分辨结构成像。j . Struct。医学杂志。147, 3-11(2004)。
太阳,C.-K。et al。皮肤多谐波代活检。选择列托人。28, 2488(2003)。
Aptel F。et al。人眼角膜的多模态非线性成像。Investig。角膜切削。粘度科学。51, 2459-2465(2010)。
Debarre D。et al。用三次谐波显微镜成像细胞和组织中的脂质体。Nat方法。3., 47-53(2006)。
Farrar, M. J., Wise, F. W., Fetcho, J. R. & Schaffer, C. B.在脊椎动物中枢神经系统髓磷脂的体内成像使用第三谐波发生显微镜。Biophys。J。One hundred., 1362-1371(2011)。
Genthial, R。et al。使用三次谐波显微镜对骨多尺度孔隙度和界面进行无标签成像。科学。代表。7, 1-16(2017)。
Gavgiotaki E。et al。三次谐波显微镜在人乳腺组织活检中区分恶性细胞级别。科学。代表。10, 1-13(2020)。
Canioni, L。et al。Ca成像2 +用三次谐波显微镜观察细胞内动态。选择列托人。26, 515-517(2001)。
陈,研究。et al。三次谐波显微镜揭示了古代化石的牙齿解剖结构。选择列托人。40, 1354(2015)。
常,T。et al。使用无标签多光子显微镜对3D工程人类脂肪组织中的细胞代谢和脂质生成进行无创监测。生物材料34, 8607-8616(2013)。
Debarre D。et al。速度测量三次谐波显微镜:微米级量化形态发生运动在未染色的胚胎。选择列托人。29, 2881(2004)。
孙,c。K。et al。发育生物学的高谐波发生显微镜。j . Struct。医学杂志。147, 19-30(2004)。
渡边,T。et al。使用自适应谐波产生显微镜描述早期小鼠胚胎中脂滴的动态行为。BMC细胞生物学。11(1), 1 - 11(2010)。
Tserevelakis, g.j.。et al。用三次谐波显微镜成像秀丽隐杆线虫胚胎发生。微米41, 444-447(2010)。
Aviles-Espinosa, R。et al。用第三次谐波显微镜成像秀丽隐杆线虫的细胞分裂阶段。在生物医学光学与三维成像(2010),论文BTuD78(光学学会,华盛顿,2013)。
于敏敏。et al。微光谱原位分析揭示了月桂李叶片角质层中三萜化合物的组成模式。足底227, 823-834(2008)。
购物,N。et al。非线性显微镜在生物系统结构和动力学研究中的应用。光子达成。非线性光学。纳米光子学。光子学5971, 597106(2005)。
Tokarz D。et al。用偏振依赖的二次和三次谐波显微镜测定了胡萝卜中结晶β-胡萝卜素的分子结构。期刊。化学。B118, 3814-3822(2014)。
Cisek, R。et al。光合作用中的光学显微镜。Photosynth。Res。102, 111-141(2009)。
Barzda, V。光学显微镜的非线性对比机制35-54(施普林格,Dordrecht, 2008)。
Segawa H。et al。CARS、SHG、THG和TSFG(相干反斯托克斯拉曼散射、二次谐波、三次谐波和三阶和频产生)活细胞无标签四模态分子成像。选择快递。20., 9551(2012)。
巴拉德,Y.,艾森伯格,H.,霍洛维茨,M.和西尔伯伯格,Y.非线性扫描激光显微镜的三次谐波。达成。理论物理。列托人。70, 922-924(1997)。
博伊德,r.w.。非线性光学(学术出版社,纽约,2008)。
Iy, Y., En, L. & Vv, T.在宽光谱和温度范围内测量脂肪组织和脂滴的折射率。达成。选择。57, 4839(2018)。
刘培友,et al。细胞生物学和疾病诊断的细胞折射率:过去,现在和未来。芯片实验室16, 634-644(2016)。
陈,研究。,Hsu, H.-C., Lee, C.-M. & Sun, C.-K. Third-harmonic generation susceptibility spectroscopy in free fatty acids.j .生物医学。选择。20., 095013(2015)。
小,d。M。et al。使用三次谐波显微镜对动脉粥样硬化斑块进行无标记成像。生物医学。选择快递。9, 214(2018)。
包蒂斯塔,G。et al。偏振显微镜可以识别哺乳动物细胞中成分不同的脂滴。Biophys。J。107, 2230-2236(2014)。
Tserevelakis, g.j.。et al。使用三次谐波显微镜对秀丽隐杆线虫的脂质沉积进行无标记成像。《公共科学图书馆•综合》9(1), e84431(2014)。
Siddhanta, S., Paidi, s.k, Bushley, K., Prasad, R. & Barman, I.用无标签光片显微镜和拉曼光谱探索真菌生长的形态和生化联系。ChemPhysChem18, 72-78(2017)。
张超,李建军,兰良,郑建新。通过受激拉曼散射成像测量的脂滴动态,定量活细胞中的脂代谢。肛交。化学。89, 4502-4507(2017)。
Brackmann C。et al。酵母脂质储存的CARS显微镜:营养状态和遗传背景的影响。拉曼光谱学。40, 748-756(2009)。
张,C. & Boppart, s.a .脂滴动态特征作为量化细胞代谢变化的新标记。肛交。化学。92, 15943-15952(2020)。
董培泰。et al。极化敏感受激拉曼散射成像解决假丝酵母菌膜两性霉素B取向。科学。睡觉。7, 1-11(2021)。
安田,M. Takeshita, N. & Shigeto, S.利用多元曲线分辨率交替最小二乘拉曼高光谱成像揭示真菌细胞中不均匀分子分布和细胞色素类型和氧化还原状态。肛交。化学。91, 12501-12508(2019)。
库里安,s.m.,彼得罗,a。Di。镰孢镰刀菌菌落形成过程中分生吻合管融合的活细胞成像。《公共科学图书馆•综合》13, e0195634(2018)。
Adomshick, V., Pu, Y. & vega - lopez, A.脂肪细胞表型分析的自动脂滴定量系统使用细胞Profiler。Toxicol。动力机械。方法30., 378-387(2020)。
Jüngst, C., Klein, M. & Zumbusch, A.脂肪细胞中脂滴融合动力学的长期活细胞显微镜研究。脂质Res;54, 3419-3429(2013)。
报告》,T。et al。基于迭代图像处理的脂滴定量研究。脂质Res;60, 1333-1344(2019)。
Rambold, A. S., Cohen, S. & lippintt - schwartz, J.饥饿细胞中的脂肪酸运输:脂滴脂解,自噬和线粒体融合动力学的调节[发育细胞32(2015)678-692]。Dev细胞。32, 678-692(2015)。
Dejgaard, S. Y. & Presley, J. F.用于脂滴分割和定量的新自动化单细胞技术。j . Histochem。Cytochem。62, 889-901(2014)。
Nohe, A. & Petersen, N. O.图像相关光谱。科学。抽烟可以2007,(2007)。
怀斯曼,P. W.,斯奎尔,J. A.,埃利斯曼,M. H. &威尔逊,K. R.双照片图像相关光谱和图像互相关光谱。j . Microsc。200, 14-25(2000)。
苗条,E。et al。在悬浮和细胞中产生二次谐波的纳米颗粒的图像相关光谱。期刊。化学。列托人。9, 6112-6118(2018)。
Bahram, M. & Netherway, T.真菌作为连接生物体和生态系统的介质。《。牧师。46, 1-16(2022)。
帕里哈,M。et al。丛枝菌根真菌在C循环中的潜力综述。拱门。Microbiol。202, 1581-1596(2020)。
产油微生物中脂质积累的调节。物化学。Soc。反式。30., a101-a101(2002)。
Cerdá-Olmeda, E. & Avalos, J.产油真菌:富含胡萝卜素的Phycomyces。掠夺。脂质物。33, 185-192(1994)。
酵母和丝状真菌的脂质及其对生物技术的重要性。Biotechnol。酵母,丝状真菌https://doi.org/10.1007/978-3-319-58829-2_6(2017)。
Mhlongo, s.i。et al。从丝状真菌中提取的单细胞油作为生物柴油生产的替代原料的潜力。前面。Microbiol。12, 57(2021)。
常,W。et al。将毒素困在脂滴中是真菌的一种抗性机制。科学。代表。51(5), 1-11(2015)。
刘,N。et al。由FgNem1/Spo7-FgPah1磷酸酶级联调控的脂滴生物发生在小麦赤霉病菌的真菌发育和毒力中起关键作用。新植醇。223, 412-429(2019)。
Petschnigg, J。et al。良好的脂肪,必需的细胞要求三酰甘油合成,以维持细胞膜内的稳态。生物。化学。284, 30981-30993(2009)。
铃木,M., Shinohara, Y., Ohsaki, Y. &藤本,T.脂滴:大小很重要。J.电子显微;60, s101-s116(2011)。
Nand, K. & Mohrotra, B. S.印度真菌学脂肪生产。2氢离子浓度对脂肪合成的影响。Sydowia24, 144-152(1971)。
波拉克,J. K.哈里斯,S. D. & Marten, M. R.丝状真菌的自噬。真菌麝猫。医学杂志。46, 1-8(2009)。
Jaishy, B. & Abel, E. D.脂质,溶酶体和自噬。脂质Res;57, 1619-1635(2016)。
彼得森,N. O., Höddelius, P. L., Wiseman, P. W., Seger, O. & Magnusson, K. E.用图像相关光谱定量膜受体分布:概念和应用。Biophys。J。65, 1135-1146(1993)。
Bukara, K。et al。使用双光子激发荧光显微镜在红细胞和红鬼中绘制血红蛋白。j .生物医学。选择。22, 026003(2017)。
despotovic, s.z。et al。离恶性肿瘤10厘米和20厘米处未受累者结肠黏膜胶原纤维组织改变。科学。代表。101(10), 1-11(2020)。
黄,S. Heikal, A. A. & Webb, W. W. NAD (P) H和黄蛋白的双光子荧光光谱和显微镜。Biophys。J。82(5), 2811-2825(2002)。
格林斯潘,梅尔,E. P.和福勒,S. D.尼罗红:细胞内脂滴的选择性荧光染色剂。J.细胞生物学。One hundred., 965(1985)。
咦,中州。et al。相干反斯托克斯拉曼散射显微镜观察了两个秀丽隐杆线虫脂肪突变体的脂滴形态和非滴状结构。j .生物医学。选择。19, 011011(2013)。
陈,Y。et al。氮饥饿在罗氏绿僵菌中引发三酰甘油的细胞积累。真菌生物。122, 410-419(2018)。
翁,l.c.。et al。氮剥夺诱导脂滴积累,改变白斑Aiptasia pulchella共生鞭毛藻脂肪酸代谢。科学。代表。4, 1-8(2014)。
阿吉拉尔,l.r。et al。真菌致病菌黑穗病菌(Ustilago maydis)在氮饥饿条件下脂滴积累及其他生化变化。拱门。Microbiol。199, 1195-1209(2017)。
罗彻罗,J. V.怀斯曼,P. W. &彼得森,n.o.。在多种群图像相关光谱系统中使用强度减法的明亮聚集波动的隔离。Biophys。J。84, 4011-4022(2003)。
Olzmann, J. A. & Carvalho, P.(2018)脂滴动力学和功能。细胞生物学。203(20), 137-155(2018)。
Yu Y。et al。脂滴在高寒被孢霉衰老中的作用通过亚细胞和全细胞蛋白质组综合分析揭示。科学。代表。71(7), 1-12(2017)。
Bonfante, P. & Venice, F. Mucoromycota:去植物相互作用真菌的根。真菌生物。牧师。34, 100-113(2020)。
史密斯,S. &里德,D.。菌根共生(学术出版社,纽约,2008)。
卢金布尔,l.h.。et al。丛枝菌根真菌中的脂肪酸是由宿主植物合成的。科学356, 1175-1178(2017)。
江,Y。et al。植物转移脂质以维持互惠菌根和寄生真菌的定植。科学356, 1172-1173(2017)。
Keymer,。et al。脂质从植物向丛枝菌根真菌的转移。Elife6, e29107(2017)。
Deka, D., Sonowal, S., Chikkaputtaiah, C. & Velmurugan, N.共生关联:决定产油微生物生理和脂质积累的关键因素。前面。Microbiol。11, 555312(2020)。
Athenaki, M。et al。来自酵母和真菌的脂质:生理学,生产和分析考虑。j:。Microbiol。124, 336-367(2018)。
藤田,K. &史密斯,n.i.活细胞的无标签分子成像。Mol. Cells OS530 - 535(2008)。
Knaus, H., Blab, g.a., van Jerre Veluw, G., Gerritsen, h.c. & Wösten, H. A. B.真菌中的无标签荧光显微镜。真菌生物。牧师。27, 60-66(2013)。
Borile, G., Sandrin, D., Filippi, A., Anderson, K. I. & Romanato, F.无标签多光子显微镜:远不止花哨的图像。Int。理学。22, 2657(2021)。
马丁斯,A. S.,马丁斯,I. C. &桑托斯,N. C.黄病毒科感染中脂滴生物物理特征的方法。前面。Microbiol。9, 1951(2018)。
尼罗红。可以在:https://www.thermofisher.com/order/catalog/product/N1142.
确认
我们感谢Dunja stefanoviic对一些文化种植的宝贵帮助,以及Marina stannik对尼罗河红染色的帮助和许多有用的讨论。同时,我们也要感谢米兰米尼克在技术上的帮助和支持。
资金
这项工作得到塞尔维亚共和国教育、科学和技术发展部的支持[合同编号:451-03-68/2022-14/200178和451-03-68/2022-14/200007];塞尔维亚共和国科学基金PROMIS项目HEMMAGINERO[资助号6066079];和贝尔格莱德物理研究所,通过塞尔维亚共和国教育、科学和技术发展部的拨款。
作者信息
作者及隶属关系
贡献
所有的实验都由T.P.进行,图像处理,样品制备。N.T.设计了实验方案,并监督了样品的制备和处理。m .Ž。监督研究的生物部分。S.N.设计了采集并改进了成像软件。mr设计了光学装置,监督成像实验和图像分析。交流监督图像处理,特别是LD量化。A.K.设计了这项研究,设计了光学装置,并监督了实验。所有作者都参与了稿件的准备和修改。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
补充视频S1。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
帕吉克,T.,托多罗维奇,n.v., Živić, M.;et al。活丝状真菌中脂滴的无标签三次谐波成像和定量。Sci代表12, 18760(2022)。https://doi.org/10.1038/s41598-022-23502-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-23502-4