摘要
预测CAR -T细胞疗法对弥漫性大b细胞淋巴瘤(DLBCL)的疗效是至关重要的。虽然已经确定了耐药和/或早期复发的几种肿瘤内在危险因素,但决定CAR-T细胞潜在活性的临床有用标记物尚未得到充分研究。白细胞分离时t细胞的性质可以作为这样一个标记。因此,我们评估了CD3的临床影响+白细胞抽取时外周血细胞计数对CAR-T细胞治疗临床结果的影响。共有44例复发或难治性(r/r)弥漫大bcl患者在京都大学医院接受组织皂苷水平化疗。根据CD3+细胞计数,患者被分为CD3类低和CD3高各组的阈值为553/μL。CD3组1年无进展生存期明显高于对照组高组优于CD3低组(68.3% vs. 17.3%;调整后的风险比[aHR], 0.37;p = 0.042)。CD3组的总生存率也高于对照组高集团(aHR, 0.24;p = 0.043)。此外,更高的CD3+CAR-T细胞输注后第7天,外周血淋巴细胞计数与外周血淋巴细胞计数显著升高相关(中位数为860 vs. 420/μL, P = 0.021),提示在体内输注CAR-T细胞的增殖更为广泛。总之,我们证明了CD3+白细胞抽取时的细胞计数可以预测CAR-T细胞输注后的扩增和CAR-T细胞治疗的结果,有助于在白细胞抽取时制定综合治疗策略。
介绍
弥漫大B细胞淋巴瘤(弥漫大B细胞淋巴瘤,DLBCL)可以通过标准的蒽环类化疗方案治愈,但复发或难治性(r/r) DLBCL患者即使加强化疗和自体或异体干细胞移植,预后仍然很差1.cd19靶向嵌合抗原受体(CAR)-T细胞治疗显著改善了r/r DLBCL患者的预后2.CAR-T细胞治疗有应答者预后良好,应答不完全者预后较差。此外,即使在曾经对cd19靶向CAR-T治疗有反应的患者中,据报道约20%的患者后来会复发3.,4,5.因此,需要基于早期识别CAR-T细胞治疗耐药或复发高危患者的风险分层方法来优化CAR-T细胞治疗。
最近,CAR-T细胞治疗的几个预后临床因素,主要集中在患者特征或疾病状态,已被报道。例如,输注时肿瘤体积大与CAR-T细胞治疗的疗效下降有关,这表明CAR-T细胞治疗前的疾病控制对更好的疗效很重要6,7.某些基因改变,如TP53突变,已被报道为肿瘤固有的生物标志物,提示不良反应8.肿瘤侧的这些参数已迅速确定。然而,CAR-T细胞治疗的疗效不仅取决于肿瘤的内在因素,还取决于CAR-T细胞侧的参数,而后者尚未得到充分的分析9.此外,由于CAR-T细胞治疗的候选者通常有高度难治性、进行性的疾病,以及频繁的并发症,因此,尽早预测CAR-T细胞治疗的疗效(即在白细胞去除时),并优化治疗前后的治疗策略以最大化其效果是至关重要的。
因此,在本研究中,我们关注CD3的预后价值+外周血白细胞计数对CAR-T细胞治疗结果的影响。我们的发现提供了一种新的生物标记物,使我们能够预测早在白细胞抽取时的反应。这个标记应该有助于改善CAR-T符合条件的r/r DLBCL患者的预后。
患者和方法
研究群体
这项研究是通过分析2019年12月至2021年10月期间在日本京都大学医院接受组织抗原水平化疗的所有r/r弥漫大bcl连续患者进行的。随访时间确定在2021年12月。DLBCL的诊断基于WHO对造血和淋巴组织肿瘤的分类(修订版第四版)10.所有患者均复发或对两种或两种以上的治疗方案无效。本研究经京都大学伦理委员会批准,并按照《赫尔辛基宣言》的原则进行。所有患者均获得知情同意。
端点和变量
本研究的主要终点是无进展生存期(PFS)。总生存率(OS)作为次要终点进行评估。PFS定义为CAR-T输注至记录疾病进展、复发、死亡或最后随访日期的时间。OS从CAR-T输注日到最后一次随访或死亡日计算。使用恶性淋巴瘤修正反应标准评估白血病抽取时、输注时和输注后的疾病状态11.根据疾病活动的形态学和临床证据来确定复发的进展。表格和图表中显示的所有变量都是从患者记录中回顾性获得的。为了简化风险分层,我们将患者分为两个风险组(CD3低和CD3高组),采用CD3的受试者工作特征(ROC)曲线+1年无进展生存(PFS)白细胞抽取时的细胞计数。
统计分析
连续变量用中位数和范围进行汇总,分类变量用计数和百分比进行汇总。组间比较,患者和疾病特征比较采用Mann‐Whitney U检验(连续变量)和Fisher确切检验(分类变量)。CD3之间的相关性+取白细胞时的细胞计数和输注后的淋巴细胞计数采用Pearson相关性分析。PFS和OS的概率采用Kaplan‐Meier方法估计,组间比较采用log - rank检验。在多变量分析中,Cox比例风险模型用于评估CD3的影响+外周血细胞计数与PFS和OS结合其他临床相关变量,包括既往化疗在白细胞分离时(0-3或> 3)和白细胞分离时的疾病状态(完全缓解[CR]/部分缓解[PR]或稳定疾病[SD]/进展疾病[PD])。p < 0.05为差异有统计学意义。所有的统计分析使用R(版本3.1.1;R发展核心团队)和EZR(日本埼玉芝医科大学埼玉医学中心)12.
结果
病人的特点
本研究共纳入44例患者1).研究队列包括23名女性和21名男性,中位年龄为60岁(范围为20-73岁)。中位数CD3+外周血白细胞计数为687个/μL(范围60-2234)。根据CD3的ROC曲线+1年PFS细胞数的截止值为553/μL。然后,我们定义CD3患者+细胞计数≤553/μL为CD3低对照组(20例),CD3水平较高组(20例)+细胞计数为CD3高组(24例)。两组在输注时年龄差异无统计学意义。在DLBCL的特征方面,两组生发中心b细胞样(GCB) DLBCL、双表达淋巴瘤(DEL)、转化滤泡性淋巴瘤(tFL)患者的比例具有可比性(P分别为0.545、0.475和0.734)。各组间在化疗前化疗线、化疗时疾病状态或输注时无显著差异。CD3从诊断到白细胞清除的时间明显更长高与CD3组比较低组(P = 0.036)。淋巴细胞消耗方案由氟达拉滨+环磷酰胺(Flu/Cy, n = 37)和苯达莫司汀为基础的方案(n = 5)组成,2例淋巴细胞计数异常低的患者未使用该方案。各组CAR-T细胞产物的特征见补充表1.各组细胞因子释放综合征(CRS)的发生情况或级别及托珠单抗的使用情况见补充表2.如果患者持续高热对保守治疗无效或出现2级CRS,我们使用托珠单抗。
OS和PFS根据CD3+白细胞抽取时的细胞计数
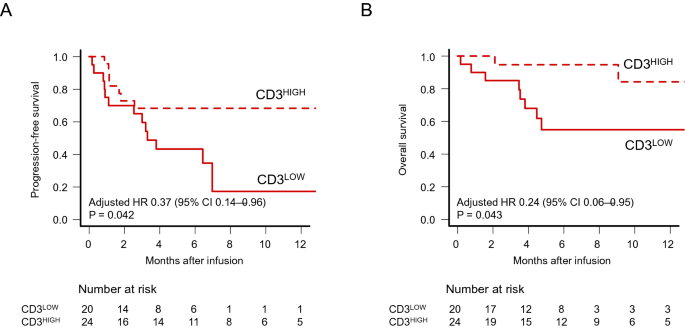
我们比较了CD3的作用+CAR-T细胞输注后白细胞计数对存活的影响,发现CD3的1年PFS明显较低低对照组(17.3%,95%CI 1.50 ~ 48.3%)高于CD3组高组(68.3%,95%CI 44.8-83.5%;p = 0.032)(图。1A).在调整白细胞分离时的先验线(0-3或> 3)和白细胞分离时的疾病状态(CR/PR或SD/PD)作为协变量后,CD3的PFS的调整风险比(aHR)为0.37 (95% CI: 0.14-0.96, p = 0.042)高组比较CD3低组(表2).当CD3+细胞数作为连续变量处理,每增加100/μL, aHR为0.90 (95% CI: 0.81-1.00, p = 0.052)。
单因素分析显示,CD3的1年OS有恶化的趋势低对照组(54.9%,95% CI 29.2 ~ 74.7%)与CD3比较高组(84.2%,95% CI 47.0 ~ 96.2%;p = 0.054)(图。1B).多因素分析显示CD3较低+细胞计数显著降低OS(表2).aHR用于CD3中的OS高组和CD3的对比低0.24例(95% CI 0.06-0.95, p = 0.043)2).当CD3+细胞数作为连续变量处理,每增加100/μL, aHR为0.88 (95% CI 0.75-1.03, p = 0.102)。
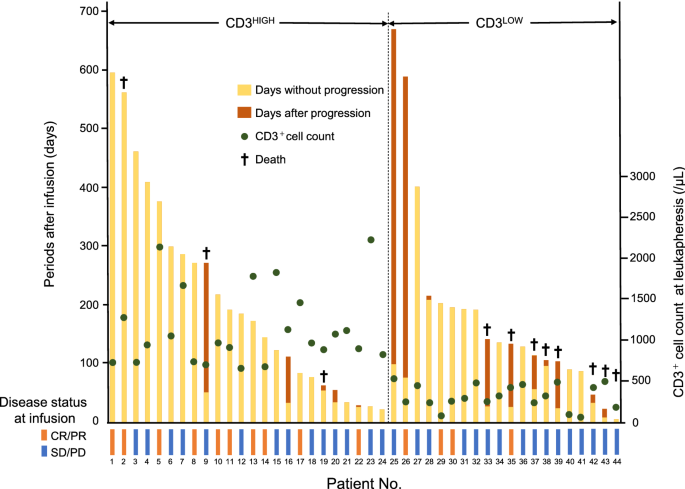
所有患者的临床病程总结见图。2和详细的疾病状况在无药治疗和CAR-T输注,以及无药治疗和淋巴细胞耗尽治疗后见补充表3..死亡原因主要为疾病复发,除骨髓增生异常综合征2例(2例)和严重细胞因子释放综合征2例(44例)外。在CD3高CAR-T细胞输注组中CR/PR组10例中仅有1例(10.0%)复发,SD/PD组5例中4例(80.0%)复发。在CD3低CR/PR组和SD/PD组患者输注后病情进展的比例相似[CR/PR组4例患者中2例(50.0%);7 / 16的SD/PD(43.8%)]。有趣的是,关于Hans细胞起源分类,在28例输注时SD/PD的患者中,gcb表型的患者比非gcb表型的患者反应更好[14例患者中有10例(76.9%)vs. 14例患者中有3例(23.1%),P = 0.021]。在输注时接受CR/PR治疗的患者中,没有观察到这种分类上的差异。
CD3的影响+CAR-T细胞输注后淋巴细胞扩张的白细胞计数
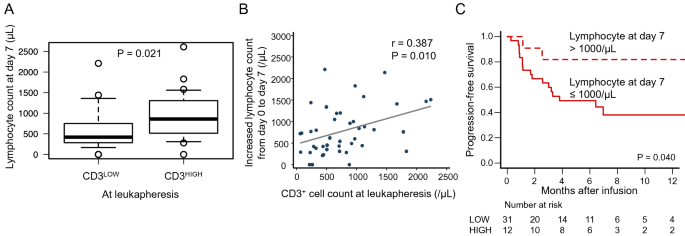
因为CD3+外周血白细胞计数可能反映CAR-T细胞的功能,我们试图分析CD3的影响+CAR-T细胞输注后淋巴细胞扩张的白细胞计数。第7天CD3组外周血淋巴细胞计数明显升高高组(中位860/μL,范围0-2610 /μL)较CD3明显增加低组(中位数420/μL,范围0-2210 /μL;P = 0.021;无花果。3.A),尽管第0天的淋巴细胞计数和CAR-T细胞注入数在两组间具有可比性。此外,CD3+外周血白细胞计数与输注后0 ~ 7天淋巴细胞计数显著正相关(P = 0.010)(图1)。3.B).各组CAR-T细胞输注后其他血计数数据见补充表4.
了解CD3之间的关系+取白细胞时淋巴细胞计数和输注后淋巴细胞增加,下一步分析第7天淋巴细胞计数对PFS的影响。淋巴细胞计数在第7天为1000/μL的患者的1年PFS (81.8%, 95% CI 44.7-95.1%)显著高于第7天计数≤1000/μL的患者(38.0%,95% CI 19.1-56.8%, P = 0.040)(图4)。3.C).在调整CAR-T细胞输注时的疾病状态后,观察到在第7天淋巴细胞计数为> 1000/μL的患者中PFS的优势仍然存在,但无统计学意义(P = 0.094)。这些结果表明CAR-T细胞在输注后的增殖是由较高的CD3所预测的+白细胞采集的细胞计数也可以作为CAR-T细胞治疗后的预后标记。
讨论
本研究评估了CD3的预后影响+接受CAR-T细胞治疗的r/r DLBCL患者外周血白细胞计数。关于CD3有两个主要发现+外周血白细胞计数:(1)CD3增多+细胞数量导致PFS和OS更好,(2)CD3更高+白细胞清除时的细胞计数与第7天显著升高的淋巴细胞计数相关,提示CAR-T细胞在输注后扩增。我们的结果表明CD3+外周血白细胞计数对于预测预后和设计风险适应策略(包括CAR-T细胞治疗)非常有用。这项研究的新奇之处在于,它揭示了CAR-T细胞侧的参数对CAR-T细胞治疗结果的贡献,而不依赖于肿瘤内在因素。
CD3的正相关+白细胞抽取时的细胞计数和CAR-T细胞治疗的疗效可能由至少三个因素驱动,包括T细胞的质量、CAR-T细胞制造过程的疗效和体内环境13.首先,减少CD3+外周血中的细胞计数,即“T细胞数量低”,可以作为CAR-T细胞来源“T细胞质量低”的替代标记。在r/r型DLBCL患者中,T细胞的质量可能受到各种因素的损害,如化疗方案增多导致T细胞功能长期紊乱14,15,16.在本研究中,CD3低组患者化疗系数高于CD3高虽然差异无统计学意义(表1).
第二,虽然收集了足够数量的CD3+即使在低CD3的患者中,也可以通过优化白细胞抽取来获得细胞+细胞计数17在低CD3的患者中,随后CAR-T细胞的体外制造过程(T细胞被激活,与CAR转导,然后扩展)可能会变得复杂+白细胞提取的细胞计数。实际上,在我们的队列中,CAR的转导效率明显较低(P = 0.02), CAR在CD3中的表达趋于较低(P = 0.085)低与CD3组相比高集团(补充表1).我们的研究结果支持了之前的研究,即如果白细胞清除产物中含有增殖能力较差的T细胞,则CAR的整合效率和表达水平较低18.
第三,低CD3的患者+白细胞清除时的细胞计数,通常有较长的化疗史和更多难治性淋巴瘤,可能对注入CAR-T细胞的生长和疗效有潜在的不利的体内环境。高肿瘤负荷是环境退化的因素之一,导致更高的免疫失调,增加血清炎症细胞因子和肿瘤干扰素信号,从而导致CAR-T细胞膨胀不良19,20..
因此,CD3+白细胞计数可作为T细胞质量、CAR-T细胞生产效果和体内环境的替代标记物。除此之外,我们首次发现CD3+细胞计数可以预测输注后第7天的淋巴细胞数量,提示CAR-T细胞的扩张程度。在以往的研究中,CAR-T细胞输注后在体内的扩张被报道为CAR-T细胞功能的一个重要标志3.,21,22,23淋巴细胞计数的早期增加有助于估计治疗反应。然而,目前还没有确定的方法来评估T细胞产生CAR-T介导的抗肿瘤反应的能力,并预测CAR-T细胞在体内的扩张,因此我们发现CD3+白细胞分离时的细胞计数预测以后的扩增将有助于制定治疗策略,包括CAR-T细胞治疗。
基于这些结果,为了使CAR-T细胞的治疗效果最大化,需要在整个CAR-T细胞治疗过程中采取综合治疗策略。因为减少CD3+外周血中的细胞计数通常是由于反复大量暴露于化疗药物引起的,是CAR-T细胞来源质量退化的标志,T细胞应该以一种完全保持其功能的方式收集。在日本,CAR-T疗法被批准用于对两种以上化疗方案都不耐受的患者。然而,t细胞收集是考虑在开始密集的挽救性化疗之前,而不是在化疗中或化疗后充分的洗脱期之后。特别是对于那些未来复发或对传统疗法产生耐药性的高危患者,即使没有严格满足CAR-T细胞治疗的适应症,也可以在T细胞耗尽之前,提前采集和储存高质量的T细胞。诊断早期患者的T细胞比r/r病患者的T细胞产生更大的CAR-T细胞扩增24.这些策略可以增强CAR-T细胞功能,不依赖于肿瘤的内在因素,提高整体治疗效率。
这项研究有几个局限性。首先,这是一项单中心回顾性分析,由于CAR-T细胞治疗的新颖性,患者数量较少,随访时间短,尽管我们的中心比日本大多数机构进行更多的CAR-T细胞治疗,CAR-T细胞治疗的资格是相当一致的。在本研究中,在评估CD3影响的多变量分析中,仔细调整了疾病状态和既往白细胞抽取化疗路线的影响+白细胞抽取时细胞计数对存活的影响;然而,考虑到从诊断到CD3白细胞清除的时间较长,与肿瘤内在因素相关的因素对生存的潜在影响还需要在更大的队列中进一步研究高与CD3组比较低组,不同效果的乳糜泻3 +在输注时疾病状态为SD或PD时,T细胞数量根据细胞来源(数据未显示)和gcb表型患者比非gcb表型患者观察到的更高的应答率。其次,我们没有评估CAR-T细胞本身的扩张或CD3的详细表型+而CAR-T细胞输注后最初几周的大多数循环淋巴细胞本身就是CAR-T细胞22,23.此外,大量无CAR的T细胞也被建议在CAR-T输注后被激活25.因此,我们认为评价乳糜泻3 +细胞,包括CAR-T细胞和非CAR-T细胞,是评估CAR-T治疗的整体效果的合理方法。乳糜泻之间的表型差异3 +细胞是促进CAR-T细胞增殖和CAR-T治疗效果的重要因素。我们发现单采时CD4/CD8比值与第7天淋巴细胞计数增加呈正相关,特别是CD3低分组(数据未显示)。此外,先前的研究表明,由naïve/stem记忆T细胞生成的CAR - T细胞产物,与未选择的T细胞相比,具有更好的抗肿瘤活性和增加膨胀率26,27.然而,由于在临床环境中很难评估这些表型,我们使用外周血中的淋巴细胞计数作为反映CAR-T细胞增殖的简单生物标志物28,29.未进行详细的细胞因子或趋化因子测定。
总之,我们证明了CD3+白细胞计数预测CAR-T细胞输注后的扩增和CAR-T细胞治疗的总体结果。应考虑在白细胞抽取时优化CAR-T细胞治疗,特别是高危患者,以获得良好的CAR-T细胞反应。
数据可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
参考文献
嘎吱声,M。et al。难治性弥漫性大b细胞淋巴瘤的预后:来自国际SCHOLAR-1研究的结果。血130(16), 1800 - 1808(2017)。
Sermer D。et al。与替代疗法相比,商业CAR - T细胞治疗DLBCL患者的结果。血供订购。4(19), 4669 - 4678(2020)。
Neelapu, S。et al。Axicabtagene ciloleucel CAR - t细胞治疗难治性大b细胞淋巴瘤。心血管病。j .地中海。377(26), 2531 - 2544(2017)。
Pasquini, m . C。et al。儿童急性淋巴母细胞白血病和非霍奇金淋巴瘤的真实世界证据。血供订购。4(21), 5414 - 5424(2020)。
舒斯特尔,美国J。et al。白细胞在成人复发或难治性弥漫性大b细胞淋巴瘤中的应用。心血管病。j .地中海。380(1) 45-56(2019)。
院长,大肠。et al。在大b细胞淋巴瘤中,高代谢肿瘤体积与axicabtagene ciloleucel疗效降低相关。血供订购。4(14), 3268 - 3276(2020)。
Vercellino, L。et al。复发/难治性弥漫大b细胞淋巴瘤CAR - t细胞治疗后早期进展的预测因素血供订购。4(22), 5607 - 5615(2020)。
Shouval, R。et al。cd19嵌合抗原受体t细胞治疗大b细胞淋巴瘤中TP53基因组改变的影响j .中国。肿瘤防治杂志。40(4), 369 - 381(2022)。
Green, m.r. & Neelapu, s.s. Not so FASt:肿瘤细胞抵抗死亡驱动CAR - t细胞功能障碍。癌症。10(4), 492 - 494(2020)。
斯维尔德洛,S.H.C.E,和哈里斯,N.L.等.(Ed)。造血和淋巴组织肿瘤的WHO分类.修改后的第四版。(国际癌症研究机构,2017)。
Cheson, b D。et al。修正的恶性淋巴瘤反应标准。j .中国。肿瘤防治杂志。25(5), 579 - 586(2007)。
调查免费提供的易于使用的医学统计软件“EZR”。骨髓移植。48(3), 452 - 458(2013)。
梅塔,p . H。et al。T细胞适应度和自体CAR - T细胞在恶性血液病中的治疗。前面。Immunol。12780442(2021)。
库克,r E。et al。多发性骨髓瘤的常规治疗导致T细胞过早老化表型和代谢功能障碍。前面。Immunol。112153(2020)。
斋藤,H。et al。复发或难治性惰性b细胞和套细胞淋巴瘤患者经苯达莫司汀治疗后淋巴细胞减少延长。血癌J。5e362(2015)。
孙,H。et al。多发性骨髓瘤引起克隆性t细胞免疫衰老:识别促进肿瘤免疫的潜在新靶点和检查点封锁的意义白血病30.(8), 1716 - 1724(2016)。
乔,T。et al。白细胞去除用于CD19 CAR-T细胞治疗的临床经验Rinsho Ketsueki62(3), 163 - 169(2021)。
Riviere, I., Gallardo, H. F, Hagani, A. B. & Sadelain, M.逆转录病毒介导的小鼠和人t淋巴细胞的基因转移。生物科技摩尔。》。15(2), 133 - 142(2000)。
耆那教徒,m D。et al。肿瘤干扰素信号和抑制性髓样细胞与大b细胞淋巴瘤CAR - t细胞衰竭相关。血137(19), 2621 - 2633(2021)。
CAR-T失败:抗原丢失和T细胞之外。血137(19), 2567 - 2568(2021)。
班萨尔,r.g.。et al。CAR-T治疗后淋巴细胞绝对计数峰值与侵袭性淋巴瘤的临床反应和生存结局相关。血138(增刊1),3856(2021)。
Faude, S。et al。CAR - t细胞输注冲击反应和复发后淋巴细胞绝对计数增殖动力学。血供订购。5(8), 2128 - 2136(2021)。
穆勒,k . T。et al。复发/难治性b细胞急性淋巴细胞白血病和慢性淋巴细胞白血病中CTL019的细胞动力学血130(21), 2317 - 2325(2017)。
Garfall, a . L。et al。诱导后与复发性多发性骨髓瘤的有效CAR - t细胞治疗相关的t细胞表型血供订购。3.(19), 2812 - 2815(2019)。
陈,p . H。et al。CAR - T细胞治疗后肿瘤微环境中CAR - T细胞和非CAR - T细胞的激活。江森自控的洞察力512(2020)。
Arcangeli, S。et al。从原始/干记忆T淋巴细胞制造CAR - T细胞增强抗肿瘤反应,同时减少细胞因子释放综合征。j .中国。投资。132(12), 3(2022)。
Biasco, L。et al。T记忆干细胞的克隆扩增决定了患者早期抗白血病反应和长期CAR - T细胞持久性。Nat。癌症。2(6), 629 - 642(2021)。
邓,Q。et al。抗cd19 CAR - T细胞输注产品在大B细胞淋巴瘤患者中的疗效和毒性Nat,地中海。26(12), 1878 - 1887(2020)。
罗西,J。et al。输注前多功能抗cd19嵌合抗原受体T细胞与NHL的临床结果相关。血132(8), 804 - 814(2018)。
确认
作者感谢京都大学医院和相关医院的临床医学工程师、护士、临床技术人员和所有临床医生,以及对这项研究做出贡献的患者。这项工作得到了乐天财团的部分研究经费和日本文部科学省(MEXT)授予Y.A.的“下一代具有全球洞察力的顶尖科学家培养计划”(L-INSIGHT)的支持
作者信息
作者和联系
贡献
研究的概念和设计:f.w., t.j., Y.A., t.k., c.m., j.k., k.y., m.n., A.T.-K。起草或修改手稿:f.w., t.j., y.a., c.m., j.k., t.k., k.y., m.n., a.t.k.。所有作者都认可了最终的文章。
相应的作者
道德声明
相互竞争的利益
作者声明没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于这篇文章
引用这篇文章
和田、F、乔、T、新井、Y。et al。外周血淋巴细胞计数预测CAR-T细胞治疗后的反应。Sci代表1218696(2022)。https://doi.org/10.1038/s41598-022-23589-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-23589-9