摘要
狼疮性肾炎(LN)是自身免疫性疾病系统性红斑狼疮最严重和最常见的器官表现之一。铁下垂是一种新型的程序性细胞死亡,到目前为止,它在LN中的作用仍不确定。在本研究中,我们探讨了铁下垂在LN中的作用及其与免疫反应的关系。GSE112943 LN数据集从Gene Expression Omnibus数据库中下载。从公共ferdb数据库中检索到驱动、抑制或标记铁下垂的铁下垂相关基因(FRGs)。用R中的“limma”包分析GSE112943数据集的基因表达矩阵,获得LN与健康样本之间的差异表达基因(DEGs)。随后,DEGs和FRGs之间的交叉基因被鉴定为差异表达铁坠铁相关基因(DE-FRGs)。利用STRING和Cytoscape进行了蛋白-蛋白相互作用(PPI)网络分析、可视化和轮心性狼疮肾炎铁脱铁相关基因(LN-FRGs)的鉴定,而它们的基因本体论(GO)和京都基因和基因组百科全书(KEGG)通路则使用clusterProfiler包确定。用CIBERSORT计算免疫细胞浸润。用Pearson相关法确定LN中轮毂LN- frgs与免疫浸润细胞之间的关系。 A total of 96 DE-FRGs and 8 hub LN-FRGs (Kras, pik3ca, egfr, mapk14, src, mapk3, vegfa而且自动取款机)。GO和KEGG功能分类显示这些基因在凋亡过程、程序性细胞死亡、自噬-动物、FoxO信号通路、松弛素信号通路和VEGF信号通路中富集。免疫细胞浸润基质分析显示LN肾组织中有丰富的单核细胞和M0/M1/M2巨噬细胞。相关分析显示,LN中有8个轮毂LN- frgs与免疫浸润细胞相关。总之,ROS的过量产生和免疫细胞的异常浸润可能与铁下垂引起的LN有关。本研究发现了8个轮毂狼疮性肾炎上铁症相关基因(LN- frgs),这些基因可能是狼疮性肾炎上铁症的良好生物标志物。这些发现表明,免疫应答通过中枢LN- frgs与免疫浸润细胞之间的相互调节在铁下垂引起的LN中发挥重要作用。
简介
狼疮性肾炎(LN)是自身免疫性疾病系统性红斑狼疮(SLE)最严重和最常见的器官表现之一,也是肾小球肾炎的一种形式1.在过去的几十年里,人们对LN的发病机制和特征有了很大的了解。然而,LN仍然是SLE患者发病和死亡的主要原因,尽管有了更多的了解和更有针对性的治疗方案2,3..LN通常用免疫抑制药物治疗,如糖皮质激素和环磷酰胺或霉酚酸酯(MMF)。遗憾的是,常规免疫抑制疗法并非对所有患者都有效,而且药物的毒副作用也不容小觑4,5,6.因此,早期准确的诊断和靶向治疗靶点的确定对LN至关重要。
细胞死亡被认为是LN发病机制的一个关键因素7.越来越多的证据表明,包括细胞凋亡、NETosis和自噬在内的程序性细胞死亡会加重LN的进展8,9,10.近年来,铁下垂病作为一种新型的程序性细胞死亡,开始受到越来越多的研究。铁坠症是由致命的脂质过氧化(细胞代谢和氧化还原稳态失衡的结果)驱动的,除了越来越多的证据表明铁坠症在肿瘤抑制和免疫方面的潜在生理作用外,还可以通过直接阻断脂质过氧化或铁的消耗来抑制11.细胞研究表明两者都有DPEP1而且CHMP1A单一途径(铁下垂)的重要调节因子是否通过改变细胞铁运输而促进肾脏疾病的发展12.一项研究发现,GPX4在急性肾损伤(AKI)过程中,功能障碍降低了小鼠对急性肾小管坏死(ATN)的敏感性,而Nec-1f。是一种固体抑制剂RIPK1也是一种弱的铁下垂抑制剂13.Zhang等人发现铁下垂有助于常染色体显性多囊肾病(ADPKD)的进展,铁下垂抑制剂可能是治疗ADPKD的一种新策略14.线粒体自噬是一种关键的细胞稳态机制,在AKI过程中被早期激活,并且在线粒体自噬和铁脱落之间存在重要联系15.然而,到目前为止,铁下垂在LN中的作用似乎从未被提及。
为了研究铁下垂是否参与LN的进展,我们从LN患者和健康个体的GEO数据库中收集了肾脏组织的微阵列数据。随后,我们通过生物信息学方法筛选与铁下垂相关的LN差异表达基因(DEGs)和hub基因,并进行免疫浸润分析,分析其相关性。综上所述,有96个差异表达上铁症相关基因(DE-FRGs)和8个中枢狼疮性肾炎上铁症相关基因(LN- frgs)被鉴定为LN潜在的下铁症相关靶生物标志物。
材料与方法
数据收集与获取
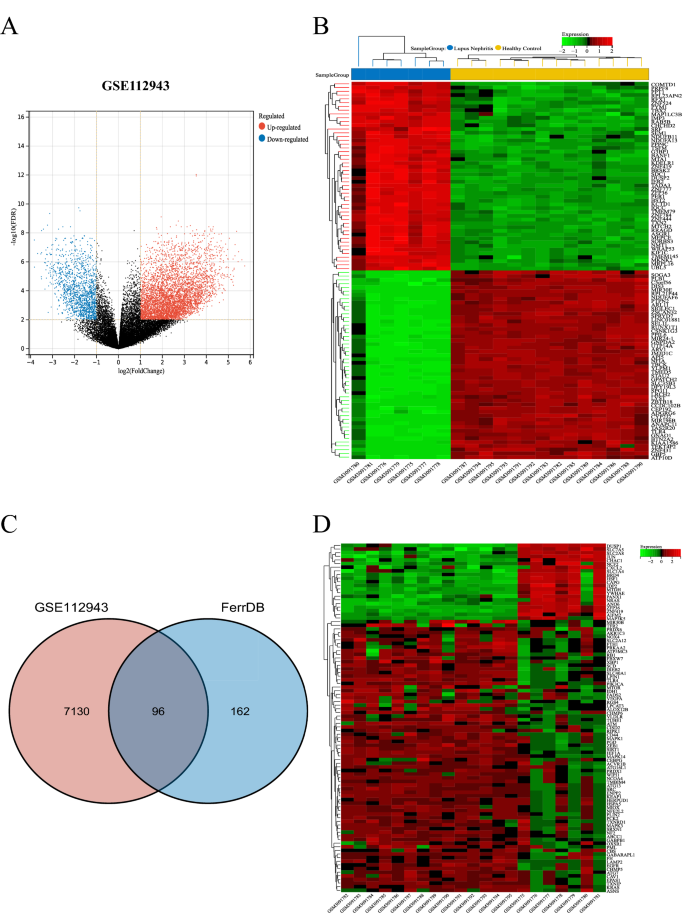
基因表达综合(GEO;www.ncbi.nlm.nih.gov /地理/)16利用数据库检索LN肾样本的基因芯片数据。的GSE11294317数据集,包括7个健康(对照组)和14个LN(实验组)肾组织样本。探针按照GPL10558平台(Illumina HumanHT-12 V4.0 expression beadchip)转换成基因符号。驱动、抑制或标记铁坠病的铁坠病相关基因(FRGs)从公共FerrDb数据库(http://www.zhounan.org/ferrdb18.去除重复基因后获得的最后258个frg用于后续分析。
差异表达铁坠病相关基因(DE-FRGs)的鉴定
用R中的“limma”包分析GSE112943数据集的基因表达矩阵,得到LN与健康样本之间的差异。简单地说,|log2 fold change (FC)|> 1和P以< 0.05为筛选标准。随后,DEGs和FRGs之间的交叉基因被鉴定为差异表达铁坠铁相关基因(DE-FRGs)。
蛋白质-蛋白质相互作用(PPI)网络构建及模块分析
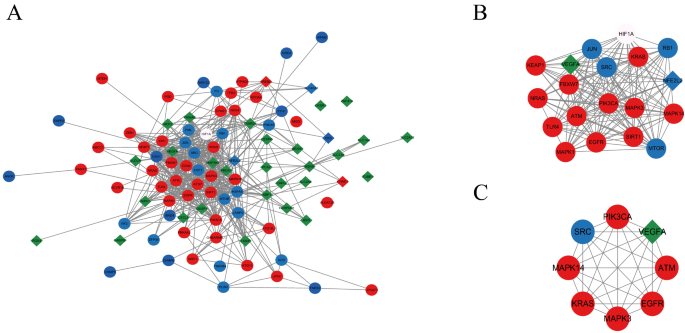
使用STRING数据库分析不同de - frg之间的相互作用(http://string-db.org/19.使用Cytoscape 3.9.1软件构建PPI网络并进行可视化。(http://cytoscape.org/.20.最重要的模块是通过Cytoscape插件分子复杂检测(MCODE)(2.0版本)确定的,该模块用于通过基于拓扑对给定网络进行聚类来识别密集连接的区域21.使用cytoHubba插件,基于MCC、最大邻域分量(MNC)、DNMC、close、Degree和edge percolated component (EPC)算法的前20个基因的重叠被确定为轮毂狼疮性肾炎铁脱铁相关基因(LN-FRGs)。
DE-FRGs和hub LN-FRGs的功能富集
使用R中的clusterProfiler包来识别基因本体(GO)和京都基因和基因组百科全书(KEGG)22,23,24以DE-FRGs和hub LN-FRGs为特征的信号通路,并探索其潜在的生物学过程、细胞成分、分子功能和重要的信号通路。选择最小5个基因集,最大5000个基因集。P< 0.05、误检率< 0.1为有统计学意义。
免疫浸润细胞亚型分布的评价
基于反褶积算法,CIBERSORT将规范化的基因表达矩阵转换为22种免疫细胞类型的组成25.本研究采用CIBERSORT计算LN和健康样本中免疫细胞的组成。该算法采用LM22签名和1000个排列。鉴于P< 0.05, 14 LN和7个健康样本进行进一步分析。
免疫浸润细胞的相关性和差异分析
为了评估不同免疫细胞之间的相关性,从CIBERSORT筛选的样本数据中获得Pearson相关系数,P< 0.05。LN组与对照组比较采用秩和检验。
轮毂LN- frgs与LN免疫浸润细胞的相关性
对CIBERSORT分析的GSE112943免疫浸润细胞谱和本数据集的基因表达谱进行Pearson相关矩阵分析。轮毂LN-FRGs与免疫浸润细胞之间的相关性使用Pearson相关系数(r) > 0.6和P< 0.05。
结果
LN中DE-FRGs的鉴定
GSE112943数据集包含7个健康和14个LN肾活检组织样本的基因表达谱,是从GEO数据库中检索的。经芯片结果标准化,共鉴定出7226个deg;其中包括5671个上调基因和1555个下调基因。1A、B)。为了探索在LN中差异表达的FRGs,从ferdb数据库中检索了258个FRGs,这是一个涉及铁下垂的调控因子、标记物和疾病的数据库。将DEGs与FRGs进行杂交后,共鉴定出96个FRGs为DE-FRGs(图2)。1C).数据集GSE112943中96个de - frg的表达如图所示。1D。
PPI网络构建,模块分析,枢纽LN-FRGs识别
DE-FRGs的PPI分析基于STRING数据库,结果使用Cytoscape进行可视化(图2)。2A). MCODE插件识别出PPI网络中连接最密集的区域(19个节点和146条边)(图。2B).利用Cytoscape插件cytoHubba的6种算法,我们计算出前20个基因(表1)。选取基于MCC、DNMC、MNC、Degree、proximity和EPC算法分析的前8个交叉基因作为轮毂LN-FRGs,其中包括Kras, pik3ca, egfr, mapk14, src, mapk3, vegfa而且自动取款机(无花果。2C).值得注意的是,LN患者中所有这些中枢LN- frgs均上调。关于8个轮毂ln - frg的详细信息见表2.
DE-FRGs和hub LN-FRGs的功能富集
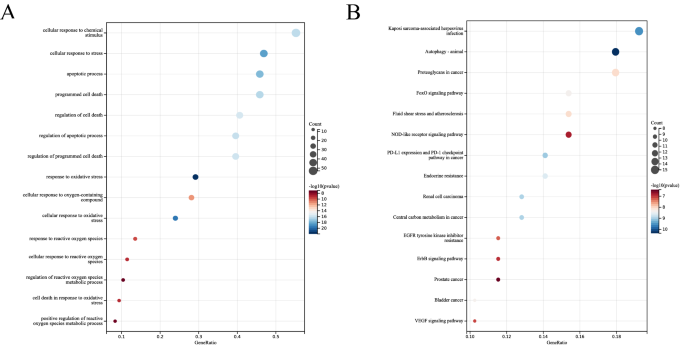
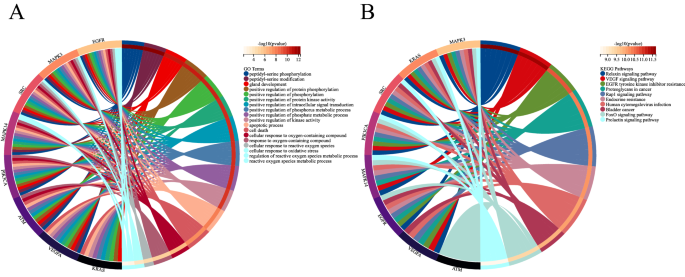
为了预测DE-FRGs的生物学功能,我们进行了功能富集分析。GO分析显示,DE-FRGs主要富集于细胞对化学刺激的反应、凋亡过程、程序性细胞死亡、氧化应激反应和活性氧(ROS)反应(图。3.一个);而KEGG通路分析显示,DE-FRGs在Autophagy-animal、cancer蛋白多糖、FoxO信号通路、nod样受体信号通路中均显著富集(图5)。3.B). GO分析表明,hub LN-FRGs在肽酰丝氨酸磷酸化、凋亡过程、细胞死亡、细胞对活性氧的反应和活性氧代谢过程的调控中显著富集(图。4一个);而KEGG通路分析显示,hub LN-FRGs在松弛素信号通路、VEGF信号通路和EGFR酪氨酸激酶抑制剂耐药性方面显著富集(图2)。4A或B的功能富集分析结果表明,这些LN基因与程序性细胞死亡或ROS相关。
免疫浸润细胞的分布
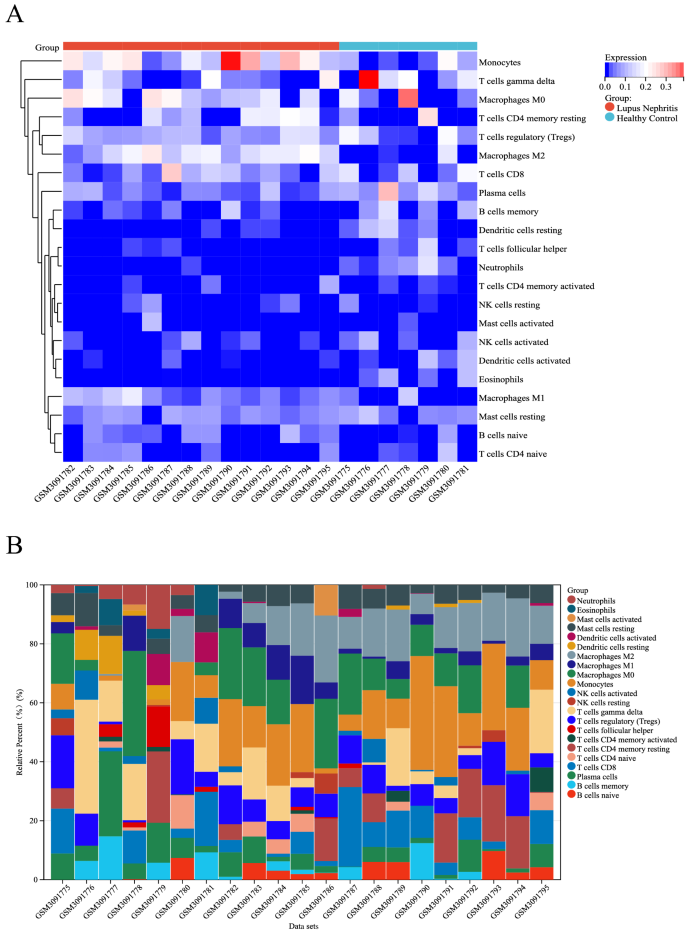
采用CIBERSORT逆卷积方法对微阵列进行筛选P结果热图上有7组健康肾组织和14组LN肾组织。LN患者肾组织中单核细胞、M0巨噬细胞、M1巨噬细胞和M2巨噬细胞的表达均高于健康对照组,而T细胞滤泡辅助细胞、树突状细胞静息、嗜酸性粒细胞和中性粒细胞在LN患者肾组织中的表达均低于健康对照组(图2)。5一)。5B详细描述了每个样本中22个免疫细胞的分布。
免疫浸润细胞的相关性和差异分析
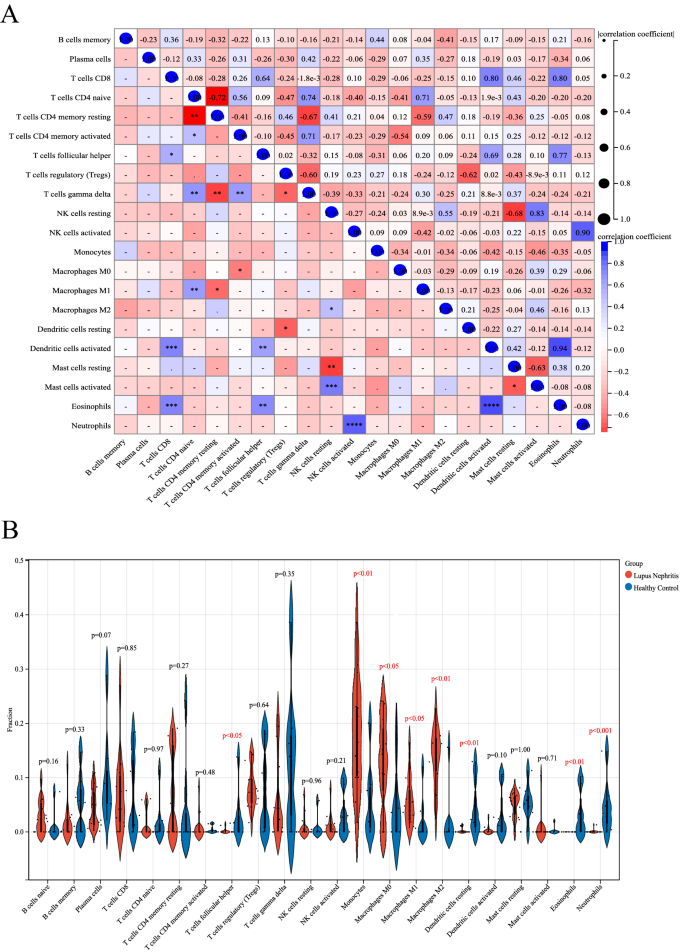
CD8 T细胞与活化的树突状细胞(r = 0.80)、CD8 T细胞与嗜酸性粒细胞(r = 0.80)、CD4初代T细胞与γδ T细胞(r = 0.74)、M1巨噬细胞与CD4初代T细胞(r = 0.71)以及嗜酸性粒细胞与活化的树突状细胞(r = 0.94)呈正相关(图4)。6相反,在CD4幼稚T细胞和CD4记忆静止T细胞(r =−0.72)、CD4记忆静止T细胞和γδ T细胞(r =−0.67)、NK细胞静止和肥大细胞静止(r =−0.68)、T细胞调节器(Tregs)和γδ T细胞(r =−0.60)以及肥大细胞静止和肥大细胞活化(r =−0.63)之间检测到负相关(图1)。6一个)。
用小提琴图显示健康和LN患者肾组织免疫浸润细胞的差异,差异有统计学意义P< 0.05。LN患者肾组织中单核细胞、M1巨噬细胞和M2巨噬细胞均有差异性升高,而T细胞滤泡辅助细胞、树突状细胞静止状态、嗜酸性粒细胞和中性粒细胞(图2)。6B)。
轮毂LN- frgs与LN免疫浸润细胞的相关性
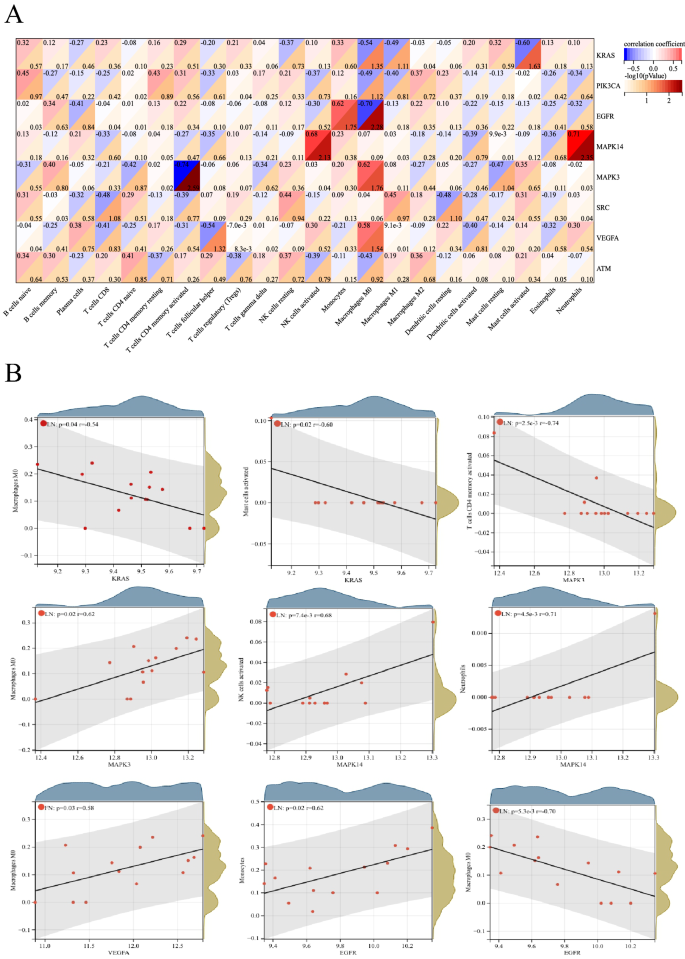
轮毂LN- frgs与LN中免疫浸润细胞之间的关系,在LN与对照样品之间存在差异,通过Pearson相关评估(图2)。7)。与肥大细胞激活呈负相关喀斯特(r =−0.60)。与单核细胞呈正相关表皮生长因子受体(r = 0.62)。与M0巨噬细胞呈负相关表皮生长因子受体(r =−0.70)。与NK细胞活化呈正相关MAPK14(r = 0.68)。与中性粒细胞呈正相关MAPK14(r = 0.71)。与CD4记忆激活T细胞呈负相关MAPK3(r =−0.74)。M0巨噬细胞与MAPK3(r = 0.62)。M0巨噬细胞与VEGFA(r = 0.58)。因此,这些基因与LN中的免疫浸润细胞有很强的相关性。
讨论
LN的发病机制是一种肾小球肾炎,是环境因素、遗传因素等多种因素共同作用的结果1.本研究共发现96个DE-FRGs在LN肾脏中显著表达,8个hub LN- frgs也被鉴定出来,但它们在LN发病中的参与程度有待进一步研究。GO术语的功能富集分析表明,DE-FRGs主要富集于凋亡过程、程序性细胞死亡和ROS。KEGG通路分析表明,DE-FRGs主要富集于自噬动物。在DE-FRGs的PPI网络中,8 (Kras, pik3ca, egfr, mapk14, src, mapk3, vegfa而且自动取款机)的96个基因在cytoHubba的6种算法中得分较高。GO术语分析显示,这8个基因在凋亡过程、细胞死亡和ROS中高度富集,KEGG为松弛素信号通路和VEGF信号通路。遗传关联研究已经确定了狼疮性肾炎发病的多种机制,包括与程序性细胞死亡改变相关的遗传变异和程序性细胞死亡碎片的免疫清除缺陷26.虽然LN的发病机制尚未完全阐明,但异常的程序性细胞死亡(如凋亡过程)在其发病机制中起着重要作用27.自噬在维持肾细胞代谢和细胞器稳态中至关重要,上调自噬活性可能在狼疮性肾炎中发挥保护和限制肾损伤的作用28.由于在慢性肾脏疾病的实验模型中,松弛素具有抗纤维化作用,假设松弛素可能能够改善LN的进展29,30..VEGF已被证明是SLE和LN疾病活动性的标志31.这些GO术语和KEGG通路的结果表明,本研究中发现的DE-FRGs或hub LN- frgs可能通过上述方法参与LN的进展。
已经证实LN中活性氧(ROS)的过量产生,抑制ROS的产生可以减少炎症反应并减少肾脏损伤32,33.ROS的过量产生和抗氧化系统成分的下调也容易导致铁下垂34.p66shc属于SRC同源性与A型胶原蛋白(ShcA)家族,一种与ROS生成相关并能诱导细胞内ROS生成的蛋白质35.因此,SRC可能通过引起抗氧化系统的失衡或ROS的过量产生而影响铁下垂的过程,进而参与LN的发病。已经证明PIK3CA,一种抑制PI3Kα,阻止铁下垂细胞死亡36但其在LN中的作用尚未见报道,尚需进一步研究。一些基因的体细胞突变,包括喀斯特,可能有助于SLE的顽固性37的体细胞突变喀斯特引起小儿Rosai-Dorfman综合征和SLE38.但是,作为铁下垂的驱动因素,其作用喀斯特其在LN中的作用尚不清楚,是否通过铁下垂参与LN尚需进一步研究。研究表明,一种与DNA损伤修复相关的基因丝氨酸/苏氨酸激酶自动取款机,在SLE中明显低表达39.自动取款机抑制通过增加铁的储存和输出的铁调节因子的表达来拯救铁下垂,而不是典型的DNA损伤途径40.然而,还需要进一步的研究来调查自动取款机在LN中通过调节铁下垂起作用。
LN的一个特征是免疫细胞浸润。研究表明,铁坠瘤催化的氧化物也可以增强蛋白质和自身抗体诱导的炎症转录因子,导致基质、细胞因子/趋化因子产生增加,免疫细胞浸润增加,导致随后肾小球通透性增加,小管间质炎症和肾衰竭相互作用41.树突状细胞和巨噬细胞对死亡细胞的无效清除可能导致耐受性的破坏并导致LN,部分原因是它们提供的自身抗原成为肾脏中沉积的免疫复合物的组成部分42.血管内皮生长因子A (VEGFA),是铁下垂的标志43在LN患者的肾脏和尿液中高表达44,这表明VEGFA可能通过铁下垂参与LN的发病机制。此外,在本研究中,VEGFA与巨噬细胞M0呈正相关,推测VEGFA降低巨噬细胞清除铁坠病细胞的效率,这可能导致免疫耐受的破坏并导致LN。在早期的研究中,免疫组化提示增加表皮生长因子受体约35%的LN患者表达45.细胞外区域的自身抗体表皮生长因子受体在SLE患者中有哪些特征46.的参与表皮生长因子受体在LN的发病机制中已得到证实47.在本研究中,LN患者肾组织中单核细胞浸润水平明显高于健康对照组。与此同时,表皮生长因子受体在本研究中与单核细胞呈正相关,推测表皮生长因子受体可能通过增加单核细胞浸润参与LN的发病机制,但单核细胞是否参与铁上坠症引起的LN的发病机制尚不清楚。此外,表皮生长因子受体在本研究中与巨噬细胞M0呈负相关,这可能是表皮生长因子受体导致巨噬细胞减少,影响它们清除铁坠病细胞的能力,最终加剧LN。
一些研究证实了MAPK通路激活在LN发病机制中的作用48,49.Zhang等人发现骨髓来源的抑制细胞被激活p38(即MAPK14)MAPK狼疮性肾炎中通过增加活性氧产生的信号,最终诱导足细胞损伤50.因此有可能MAPK14可能通过增加ROS的产生来影响铁下垂,从而与LN的发病有关。Zhai等发现,细菌中的脂多糖(LPS)可引起LN肾小球明显的中性粒细胞浸润,尤其是肾小球膜区周围,而Pyrrolidine dithiocarbamate (PDTC)通过抑制NF-κB和p38 MAPK活性,减少中性粒细胞浸润,减轻肾损伤的严重程度51.在本研究中,MAPK14(p38)与中性粒细胞呈正相关,因此假设MAPK14可能通过中性粒细胞浸润共同促进LN的发生。研究发现α2AP通过诱导巨噬细胞产生促炎细胞因子ERK1(即MAPK3)/2通路52,并与二者正相关MAPK3和巨噬细胞M0,因此假设MAPK3可通过巨噬细胞激活诱导炎症,从而导致LN进展。然而,目前还不确定是如何做到的MAPK3或MAPK14通过这些免疫浸润细胞介导铁下垂导致LN。使用这些LN-FRGs进行特异性条件免疫细胞敲除的实验可能有助于揭示潜在的机制。
目前的研究也存在一些局限性。首先,它基于GEO数据库,这是以前发表的数据集的二次挖掘和分析数据库。因此,实验结果可能与以往实验的结论存在差异,这很可能是由于样本量小导致的数据分析存在偏差。其次,CIBERSORT反褶积算法基于有限的遗传数据,由于疾病易发因素的不同和疾病表型的可塑性,可能导致结果不准确。尽管如此,我们的研究仍可能为进一步研究铁下垂中已识别的免疫浸润细胞或免疫相关基因在LN治疗和诊断中的潜力提供令人信服的证据。
结论
总之,ROS的过量产生和免疫细胞的异常浸润可能与铁下垂引起的LN有关。本研究鉴定了8个轮毂狼疮性肾炎上铁症相关基因(LN- frgs),这些基因可能是狼疮性肾炎上铁症的良好生物标志物;它们包括Kras, pik3ca, egfr, mapk14, src, mapk3, vegfa,自动取款机.这些发现表明,免疫应答通过中枢LN- frgs与免疫浸润细胞之间的相互调节在铁下垂引起的LN中发挥重要作用。
数据可用性
在本研究期间产生及/或分析的数据集可在[GEO]资料库,[https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE112943].
参考文献
安德斯,H. J。et al。狼疮肾炎.Nat. Rev. Dis.引物6(1), 7(2020)。
Croca, s.c., Rodrigues, T. & Isenberg, d.a.狼疮性肾炎30年队列评估。风湿病学(牛津)50(8), 1424-1430(2011)。
Bernatsky, S。et al。系统性红斑狼疮的死亡率。关节炎感冒。54(8), 2550-2557(2006)。
梅加-维莱特,j.m.。et al。狼疮性肾炎治疗复兴。肾脏Int。101(2), 242-255(2022)。
Kostopoulou, M., Pitsigavdaki, S. & Bertsias, G.狼疮肾炎:改善治疗方案。药物82(7), 735-748(2022)。
康德,S。et al。免疫介导肾病的发病机制和治疗进展:综述。点。J.肾病。79(4), 582-600(2022)。
杨,F。et al。系统性红斑狼疮发病机制中的程序性细胞死亡途径。j . Immunol。Res。2019, 3638562(2019)。
古普塔,S. &卡普兰,M. J.中性粒细胞和NETosis在自身免疫和肾脏疾病中的作用。Nat. Rev. Nephrol。12(7), 402-413(2016)。
郭,C。et al。狼疮性肾炎的发病机制:RIP3依赖性坏死和NLRP3炎性小体激活。j . Autoimmun。103, 102286(2019)。
傅,R。et al。足细胞激活NLRP3炎性小体有助于狼疮性肾炎蛋白尿的发展。关节炎Rheumatol。69(8), 1636-1646(2017)。
蒋晓霞,刘志刚,刘志刚。铁下垂病的病理机制、生物学研究。Nat. Rev. Mol. Cell。医学杂志。22(4), 266-282(2021)。
关,Y。et al。一个单一的基因位点控制着DPEP1/CHMP1A的表达和通过铁下垂引起的肾脏疾病的发展。Commun Nat。12(1), 5078(2021)。
Tonnus, W。et al。关键的铁脱落监测系统功能障碍使小鼠在急性肾损伤时对小管坏死过敏。Commun Nat。12(1), 4402(2021)。
张X。et al。铁下垂促进常染色体显性多囊肾病小鼠模型的囊肿生长。j。Soc。Nephrol。32(11), 2759-2776(2021)。
苏,L。et al。急性肾损伤中的线粒体ROS和线粒体自噬。自噬,1-14(2022)。
Edgar, R., Domrachev, M. & Lash, A. E.基因表达综合:NCBI基因表达和杂交阵列数据存储库。核酸测定。30.(1), 207-210(2002)。
柯,w。C。et al。皮肤中的基因表达谱揭示了亚急性和慢性皮肤狼疮与狼疮性肾炎不同的强烈相似性。投资皮肤科。141(12), 2808-2819(2021)。
周宁和鲍杰。ferdb:铁上坠症和铁上坠症疾病关联的调节因子和标记物的手动策划资源.数据库(牛津),2020(2020)。
Franceschini,。et al。STRING v9.1:蛋白质-蛋白质相互作用网络,增加了覆盖率和集成度。核酸测定。41, d808-d815(2013)。
斯穆特,m.e。et al。Cytoscape 2.8:数据集成和网络可视化的新特性。生物信息学27(3), 431-432(2011)。
班德提尼,W. P。et al。多重增强延迟增强(MCODE)提高了晚期钆增强心血管磁共振对心内膜下心肌梗死的检测:一项临床验证研究。j . Cardiovasc。粉剂。的原因。14, 83(2012)。
金久,M. &后藤,S. KEGG:京都基因和基因组百科全书。核酸测定。28(1), 27-30(2000)。
为了解细胞生物的起源和进化。蛋白质科学。28(11), 1947-1951(2019)。
Kanehisa, M。et al。KEGG:整合病毒和细胞生物。核酸测定。49(d1), d545-d551(2021)。
纽曼。et al。从组织表达谱中稳健地枚举细胞亚群。Nat方法。12(5), 453-457(2015)。
芒罗,m.e.和詹姆斯,j.a.狼疮性肾炎的遗传学:临床意义。Semin。Nephrol。35(5), 396-409(2015)。
穆尼奥斯,l.e.。et al。凋亡细胞清除缺陷在全身自身免疫中的作用。风湿醇。6(5), 280-289(2010)。
Podesta, m.a., Faravelli, I. & Ponticelli, C.狼疮性肾炎中的自噬:调节与疾病之间的微妙平衡。Autoimmun。牧师。21(8), 103132(2022)。
Hewitson, T. D., Ho, W. Y. & Samuel, C. S.弛豫素的抗纤维化特性:实验肾小管间质纤维化的体内作用机制。内分泌学151(10), 4938-4948(2010)。
沃尔夫,V. L.。et al。在雌性SLE小鼠模型中,人重组松弛素-2不能减轻高血压或肾损伤,但会加重血管功能障碍。点。j .杂志。心脏循环。物理。317(2), h234-h242(2019)。
Adhya, Z。et al。可溶性TNF-R1, VEGF和其他细胞因子作为系统性红斑狼疮和狼疮性肾炎疾病活动性的标志物。红斑狼疮28(6), 713-721(2019)。
蒙蒂思,a.j.。et al。在系统性红斑狼疮中,溶酶体成熟缺陷促进先天传感器的激活。Proc。国家的。学会科学。美国113(15), e2142-e2151(2016)。
Sule, G。,et al。内质网应激传感器ire1促进红斑狼疮中性粒细胞亢进。j .中国。投资.,131(7)(2021)。
严,H. F。et al。铁下垂:与疾病的机制和联系。钙信号。其他目标。6(1), 49(2021)。
曹,W。et al。Src同源性和A胶原蛋白(collagen A, ShcA)接头蛋白可能参与了膜性狼疮性肾炎的发病机制。红斑狼疮27(13), 2014-2019(2018)。
Kang Y。et al。使用Flt3和PI3Kalpha抑制剂的细胞保护证明了氧化谷氨酸毒性的多种机制。Commun Nat。5, 3672(2014)。
劳,s.m.。et al。一例伴有单核细胞增多症的难治性系统性红斑狼疮,表现出体细胞KRAS突变。Inflamm。回复。42(1), 10(2022)。
拉戈特,r.j.。et al。考虑自身免疫的单基因原因的重要性:KRAS的体细胞突变导致小儿Rosai-Dorfman综合征和系统性红斑狼疮。中国。Immunol。175, 143-146(2017)。
苏利欧提斯,v.l.。et al。静止期系统性红斑狼疮患者DNA修复和染色质组织缺陷。关节炎。研究》。18(1), 182(2016)。
陈鹏辉。et al。铁下垂的Kinome筛选揭示了ATM在铁代谢调节中的新作用。细胞死亡不同27(3), 1008-1022(2020)。
Wlazlo E。et al。铁代谢:狼疮性肾炎肾病理的一个未被研究的驱动因素。前面。地中海(洛桑)。8, 643686(2021)。
蔡,F., Perlman, H. & Cuda, C. M.先天性免疫细胞程序性细胞死亡机制对狼疮性肾炎的贡献。中国。Immunol。185, 74-85(2017)。
狄克逊,s.j.。et al。药物抑制胱氨酸-谷氨酸交换可引起内质网应激和铁下垂。Elife3., e02523(2014)。
Torres-Salido, M.T,等,尿神经蛋白酶-1:狼疮性肾炎肾结局的预测生物标志物.Int。理学。,20.(18),(2019)。
Nakopoulou, L。et al。不同类型肾损伤中表皮生长因子受体(EGFR)的免疫组化研究。Nephrol。拨打Transpl。9(7), 764-769(1994)。
Planque年代。et al。系统性硬化症、狼疮和自身免疫性小鼠表皮生长因子受体的自身抗体。美国实验生物学学会联合会J。17(2), 136-143(2003)。
Ma, t.k., McAdoo, s.p.和Tam, f.w.靶向酪氨酸激酶信号通路治疗免疫介导的肾炎:从实验到临床和超越。Nephrol。表盘移植。,32(suppl_1): i129-i138(2017)。
Yung, S. & Chan, T. M. Anti-dsDNA抗体和驻留肾细胞——它们在狼疮性肾炎肾损害发病机制中的假定作用。中国。Immunol。185, 40-50(2017)。
狼疮性肾炎系膜细胞的研究。咕咕叫。Rheumatol。代表。23(12), 83(2022)。
张,D。et al。髓源性抑制细胞通过增加红斑狼疮肾炎中的活性氧诱导足细胞损伤。前面。Immunol。9, 1443(2018)。
翟俊霞,李建新。et al。PDTC减轻系统性红斑狼疮倾向MRL/lpr小鼠lps诱导的肾损伤。摩尔。杂志。代表。39(6), 6763-6771(2012)。
菅野,Y。et al。alpha2AP通过调节纤溶酶抑制和炎症反应与狼疮性肾炎的发展相关。Immun。Inflamm。说。8(3), 267-278(2020)。
确认
我们要感谢Editage (www.editage.cn)进行英文编辑。
资金
本研究得到了泉州市科技计划项目(No.2019C071R)和福建省自然科学基金项目(No.2020J01231)的资助。
作者信息
作者及隶属关系
贡献
WH参与了研究的设计,实施了研究,进行了统计分析,并起草了手稿。XC对稿件进行了审阅和编辑。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
胡玮,陈霞。应用生物信息学方法鉴定红斑狼疮性肾炎中中枢铁倒铁相关基因及免疫浸润。Sci代表12, 18826(2022)。https://doi.org/10.1038/s41598-022-23730-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-23730-8