摘要
全基因组关联研究(GWAS)已经剖析了屈光不正(RE)(如近视)的许多遗传因素。尽管在理解RE的遗传结构方面有重要的见解,但很少有研究验证和探索这些位点内候选基因的功能作用。为了对GWAS进行功能性随访,并描述候选基因在RE发展中的潜在作用,我们优先考虑了9个基因(TJP2,PDE11A,SHISA6,LAMA2,LRRC4C,KCNQ5,GNB3,RBFOX1,GRIA4)以生物学和统计学证据为依据;并使用CRISPR/cas9产生了斑马鱼突变体。在幼鱼(2月龄)和成鱼(4月龄)发育阶段,用光谱域光学相干层析成像技术(spectral-domain optical coherence tomography)检测突变体的轴长异常,用偏心光折射率检测突变体的折光状态异常。我们发现,在我们研究的三个突变体中,眼轴长度显著增加,屈光状态发生近视偏移,这表明人类矫形医师可能参与其中(LAMA2,LRRC4C,KCNQ5)来发展近视。此外,原位杂交研究表明,这三种基因在斑马鱼的视网膜中都有表达。我们的斑马鱼模型提供了这三个基因在屈光不正发展中的功能作用的证据,并提供了阐明视网膜-巩膜信号级联导致近视的途径的机会。
简介
屈光不正(RE)是最常见的眼部疾病,当眼睛的光学与眼睛的生物特征不匹配时就会出现。尤其是近视眼,在过去的几十年里发病率迅速上升。这种RE与眼部疾病有关,如近视性黄斑变性、青光眼、白内障和视网膜脱离,因此正成为日益常见的致盲原因1,2,3..
在过去十年中,全基因组关联研究(GWASs)一直专注于剖析RE背后的遗传因素。2018年,Tedja等人在一项大型(160,420名参与者)GWASs元分析中确定了161个与RE相关的位点4.通过Hysi等人的GWASs元分析,该列表在2020年扩展到449个位点,包括来自英国生物银行、GERA、23andMe和CREAM财团等各种研究的542,934名混合祖先参与者5.研究人员将可能参与视网膜-巩膜信号级联通路的候选基因标记到已识别的位点,并提出了(cat)离子转运、神经传递、神经元发育、细胞-细胞粘附和细胞外基质重塑等疾病机制4,5,6.然而,探索这些候选基因的功能作用并因此验证GWAS发现的研究仍然很少。这项功能研究的目的是评估候选RE基因在控制屈光不正方面的潜力,以斑马鱼为模型。我们之前已经证明斑马鱼是研究RE的有效模型7,8,与传统上使用的鸟类或哺乳动物模型相比,这种方法在时间和成本上都有显著改善。用斑马鱼,我们之前已经证明了消耗GJD2(位于全基因组顶部相关信号之一)导致RE的发展8.
在这项研究中,我们研究了另外9个GWAS候选基因(TJP2,PDE11A,SHISA6,LAMA2,LRRC4C,KCNQ5,GNB3,RBFOX1,GRIA4),根据统计学(例如,GWAS研究中相关单核苷酸多态性(SNPs)的效应量)和生物学(例如,眼功能和表达)证据对其在RE发育中的功能作用进行了优先排序。在这里,我们展示了这些候选基因中的三个在决定眼睛大小方面具有潜在的作用。
结果
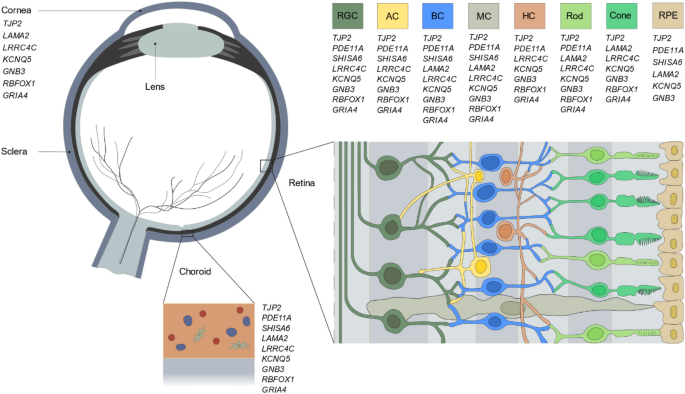
基因的优先级
我们从最近的GWAS荟萃分析中对相关位点中的候选基因进行了优先排序4,5.优先级是基于统计和生物学证据,即(1)效应量(大)和P-value (low)对应的snp;(2)眼组织表达;(3)参与文献中描述的途径;(4)存在一种斑马鱼同类;此外,(5)通过评估locuszoom图(即关联信号相对于候选基因的基因组位置以及基因在该区域的位置)对位点进行区域可视化9).最终的选择包括9个顶级候选基因;TJP2,PDE11A,SHISA6,LAMA2,LRRC4C,KCNQ5,GNB3,RBFOX1,GRIA4(详见补充数据)S1).9个候选基因的细胞特异性表达是从已发表的数据集中检索的10,11,12,13,请参见方法部分。基因的眼部分布的总结可以在图中找到。1及补充资料S1.根据检索到的数据,所有9个基因都在神经视网膜中表达10,11,12,13While表达式TJP2,PDE11A,SHISA6,LAMA2,KCNQ5,GNB3也存在于RPE细胞中11,14.此外,所有候选基因都在脉络膜的细胞中表达,包括:内皮细胞(TJP2,PDE11A,LAMA2,LRRC4C,GNB3);周(TJP2,LAMA2,GNB3,GRIA4);黑色素细胞(TJP2,KCNQ5,RBFOX1);成纤维细胞(TJP2,PDE11A,SHISA6,LAMA2,LRRC4C,GNB3,RBFOX1,GRIA4);免疫细胞(TJP2,PDE11A,LAMA2,RBFOX1)11,14.TJP2,LAMA2,LRRC4C,KCNQ5,GNB3,RBFOX1,GRIA4在角膜中也有表达15.
斑马鱼眼睛中候选基因的表达及突变斑马鱼的产生
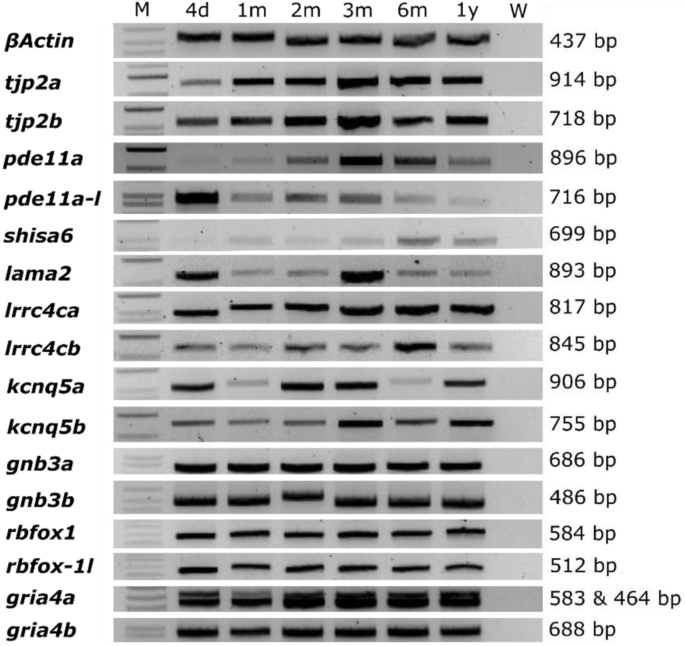
因为硬骨鱼的部分基因组复制16, 9个候选基因中有7个由两个斑马鱼同源基因代表;只有SHISA6而且LAMA2在斑马鱼中有一个同源基因。为了确认基因在斑马鱼眼组织中的表达,在以下发育阶段对斑马鱼整个眼睛进行逆转录酶PCR (RT-PCR):受精后4天(dpf);受精后1、2、3、6个月(mpf);1年。所有研究的基因都被发现在斑马鱼的眼睛中表达(图2)。2、补充数据S2).使用CRISPR-cas9系统为9种(人类)候选基因的每种鱼产生突变斑马鱼株系(补充数据)S3).根据斑马鱼信息网络(ZFIN)命名法来命名所生成的鱼系。对于每一行,诱导的移码突变都会导致一个过早的停止密码子,预计会导致一个被截断的蛋白质。用一种斑马鱼同源基因(即shisa6而且lama2):shisa6re15而且lama2re16.一代的gria4a而且gria4b由于无法引入突变并对目标区域进行基因分型,导致系失败。对斑马鱼中剩下的6个基因产生了双突变体,其中有两个同源体:tjp2ab1367tjp2bb1368, pde11are13pde11a-likere14, lrrc4care17lrrc4cbre18, kcnq5are19kcnq5bre20, gnb3are21gnb3bre22, rbfox1re23rbfox1-likere24(详见补充数据)S3有关诱导突变的详细资料)。的gnb3are21gnb3bre22而且rbfox1re23rbfox1-likere24突变体在14 dpf后无法存活。因此,六个候选基因(Shisa6, lama2, tjp2, pde11a, lrrc4c, kcnq15)进行进一步表征。数字3.显示成功生成的突变体、突变和预测的截断蛋白的图形概述。
候选基因的同源物在斑马鱼的眼睛中表达。琼脂糖凝胶装载了从受精后4天至1年的斑马鱼眼睛中提取的分离RNA的RT-PCR产物。人类近视候选基因的同源基因在时间上呈连续表达。b -肌动蛋白作为阳性对照。参见补充数据S2有关底漆和预期产品尺寸的更多信息。该图描述了为每个基因运行的单独凝胶的分组。完整的琼脂糖凝胶见补充信息文件2。M: marker (1kb +梯子),W:控水,d:天,M:月,y:年。
诱导突变及其对蛋白质的预测效应概述。CRISPR-cas9在六个成功生成的突变系中诱导的缺失和/或插入的结构表示。每个基因面板,虚线指向突变相对于基因的位置。缺失(红色)显示在WT序列中,插入(绿色)显示在突变序列中。预测的WT蛋白(灰色)和截断的突变蛋白(红色)的示意图表示在箭头的右侧。预计在WT和突变蛋白之间保守的区域被描绘在WT蛋白中(细红线)。对于具有两个同源基因的基因,由单个突变体交叉产生的双突变体如图右下所示。WT:野生型,INX:交叉型。参见补充数据S3有关更详细的信息。
SD-OCT检测显示3个突变株系轴长增加
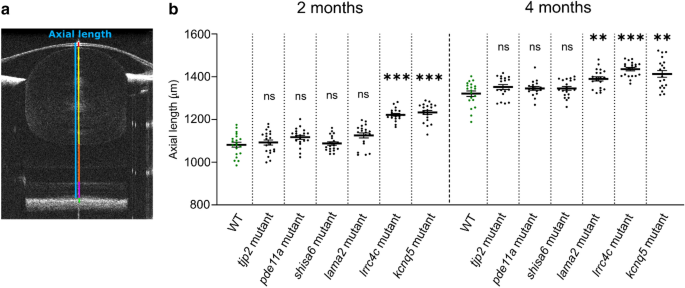
我们使用光谱域光学相干层析成像(SD-OCT)测量了所有6个突变系的轴向长度。为了将生物特征的眼内变化与产生的突变引起的潜在眼外变化隔离,我们研究了与WT鱼相同体长(最大变异< 1%)的突变鱼(n = 20只眼)(补充图)。S1).
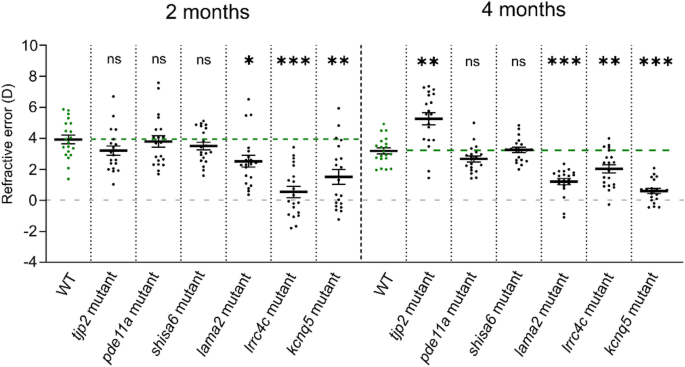
2 mpf时,2个突变株系轴长显著增加:lrrc4care17lrrc4cbre18(效应量= 140.0µm,p< 0.0001)和kcnq5are19kcnq5bre20(效应量= 151.0µm,p< 0,0001),相对于WT对照(图。4、补充数据S4).在4强积金时,收入亦有相对增加lama2re16(效应尺寸= 69.00µm,p= 0.0083)突变体;较大的轴长持续了lrrc4care17lrrc4cbre18(效应量= 114.0µm,p< 0.0001)和kcnq5are19kcnq5bre20(效应尺寸= 92.00µm,p= 0.0044)突变体(图;4、补充数据S4).轴长无明显变化shisa6re15,tjp2ab1367tjp2bb1368,pde11are13pde11a-likere14任一时期的突变体。
的lama2re16,lrrc4care17lrrc4cbre18,kcnq5are19kcnq5bre20突变体轴长增加。(一个)一个典型的4强WT斑马鱼眼睛的单张b扫描图像。轴向长度(蓝色)横跨从角膜上皮的顶端部分到RPE的前边界。利用球形斑马鱼透镜的梯度折射率作为校正因子来获得这幅图像(见“方法”)。单独的隔室:角膜和前房(红色),晶状体(黄色),玻璃体(橙色),神经视网膜(品红)和RPE(绿色)。(b)用光谱域光学相干层析法测量尺寸匹配的2和4mpf斑马鱼的轴长。在2mpf时,发现轴长增加lrrc4c突变体(效应大小= 140.0 μm,p< 0.0001)和kcnq5突变体(效应大小= 151.0 μm,p< 0,0001)相对于WT鱼。在4强积金时,薪金相对增加lama2突变体(效应大小= 69.00 μm,p= 0.0083),lrrc4c突变体(效应尺寸= 114.0 μm,p< 0.0001),和kcnq5突变体(效应大小= 92.00 μm, p = 0.0044)。参见补充数据S4对于所有数据。误差条:SEM。显著性:ns =不显著,*p< 0.05, **p< 0.01, ***p< 0.001。Mpf:受精后数月,RPE:视网膜色素上皮,WT:野生型,tjp2基因突变:tjp2ab1367tjp2bb1368,pde11a基因突变:pde11are13pde11a-likere14,shisa6基因突变:shisa6re15,lama2基因突变:lama2re16, lrrc4c基因突变:lrrc4care17lrrc4cbre18,kcnq5基因突变:kcnq5are19kcnq5bre20, SEM:均值的标准误差。
突变斑马鱼线的屈光状态
为了探索轴向长度的变化是否会导致屈光状态的改变,我们使用了一个自定义的偏心光折射率装置,如前所述7,8.WT对照组的鱼(n = 20只眼睛)显示出正的基线屈光状态(图2)。5、补充数据S5).在以前的研究中也发现了这一点,主要归因于小眼视网膜镜的伪影7,8,17,18,19.与我们的生物特征数据一致,屈光状态在2强时发生近视转移lrrc4care17lrrc4cbre18(效应大小=−3.4D,p< 0.0001)和forkcnq5are19kcnq5bre20(效应大小=−2.4D,p= 0.003)。5、补充数据S5).的lama2re16突变体在2mpf时也表现出明显的近视折射(效应量=−1.4D,p= 0.018)。同样,在4强时也检测到近视转移lrrc4care17lrrc4cbre18 - / -(效应大小=−1.2D,p= 0.003),kcnq5are19kcnq5bre20(效应大小=−2.6D,p< 0.0001)和lama2re16(效应大小=−2.0D,p< 0.0001)(图5、补充数据S5).
轴长增加的突变体在屈光状态上表现为近视转移。由偏心光折变测量的折射状态。的lama2,lrrc4c,kcnq5突变体在2mpf屈光状态发生近视转移(lama2突变体:效应大小=−1.4D,p= 0.018;lrrc4c突变体:效应大小=−3.4D,p< 0.0001;kcnq5突变体:effect size =−2.4D,p= 0.003)及4mpf (lama2突变体:效应大小=−2.0D,p< 0.0001;lrrc4c突变体:效应大小=−1.2D,p= 0.003;kcnq5突变体:效应大小=−2.6D,p< 0.0001),相对于WT(每个时间点n = 20只眼睛)。tjp2突变体在4mpf处出现远视偏移(效应值= + 2.1D,p= 0.001)。参见补充数据S5对于所有数据。误差条:SEM。显著性:ns =不显著,*p< 0.05, **p< 0.01, ***p< 0.001。Mpf:受精后数月,WT:野生型,tjp2基因突变:tjp2ab1367tjp2bb1368,pde11a基因突变:pde11are13pde11a-likere14,shisa6基因突变:shisa6re15,lama2基因突变:lama2re16,lrrc4c基因突变:lrrc4care17lrrc4cbre18,kcnq5基因突变:kcnq5are19kcnq5bre20, SEM:均值的标准误差。
在2和4强时,未发现屈光状态的变化pde11are13pde11a-likere14而且shisa6re15突变体。然而,tjp2ab1367tjp2bb1368突变体表现出屈光状态的远视偏移(效应值= + 2.1D,p= 0.001)。5、补充数据S5).与三个近视突变体相比,tjp2ab1367tjp2bb1368突变体轴长无明显变化。然而,在OCT数据中,我们观察到晶状体直径的增加tjp2ab1367tjp2bb1368相对WT透镜的4mpf (Δ增加= 26.70µm,p= 0.035)(补充数据S4).我们假设突变体的远视屈光变化是由于晶状体形状的改变,从而导致晶状体曲率减小。为了验证这一假设,我们比较了4个离体晶状体(每组n = 10条鱼,n = 20个晶状体),发现突变体和WT晶状体的圆度均为1,这表明突变体和WT晶状体的晶状体直径和体积均有增加tjp2ab1367tjp2bb1368突变体(见补充图)S2a, b和方法)。接下来,我们使用4强SD-OCT数据测量前透镜半球曲率的变化。在这里,我们发现晶状体的弧度明显下降tjp2ab1367tjp2bb1368突变体(补充图。S2c).曲率的减小可能导致焦距的增加和屈光不正中检测到的远视移位。
所选基因导致屈光不正表型的地形概况
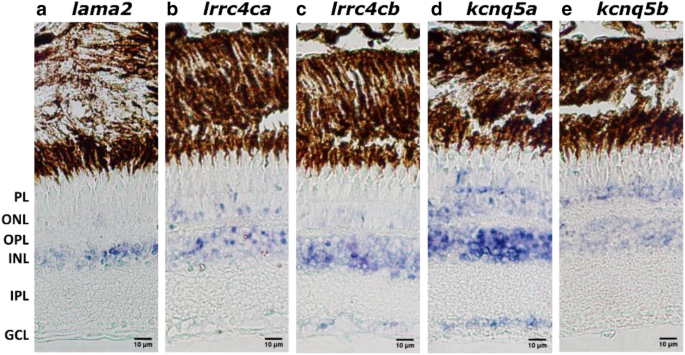
视网膜作用的特征lama2,lrrc4ca,lrrc4cb,kcnq5a,kcnq5b,我们用原位杂交技术研究了1岁WT鱼的表达和地形分布。的表达lama2主要出现在内核层(INL),而在外核层(ONL)则较少(图2)。6a).两者的表达lrrc4ca而且lrrc4cb在ONL和INL中观察到。6b, c)。lrrc4ca在光感受器层(PL)中也被适度检测到,而lrrc4cb神经节细胞层(GCL)中也有。kcnq5a在GCL、INL、ONL和PL中表达(图2)。6d)和kcnq5b局限于INL和ONL(图;6e). ISH显示这些近视候选基因均在斑马鱼视网膜中表达。
眼部分布喇嘛,lrrc4ca/lrrc4cb而且kcnq5a/kcnq5b在斑马鱼。原位杂交显示的分布lama2, lrrc4ca,lrrc4cb,kcnq5a而且kcnq5b在1岁大的WT斑马鱼视网膜上用紫色的NBT/BCIP来显示探针。Lama2主要在INL中表达,在ONL中也有少量表达(一个).Lrrc4ca而且lrrc4cb在ONL和INL中均有表达(b- - - - - -c),而lrrc4ca在PL中也检测到表达(b),lrrc4cb协cl的表达(c).Kcnq5aPL、ONL、INL和GCL均有表达(d),而kcnq5b仅在ONL和INL中发现表达(e).比例尺:10 μm。WT:野生型,PL:感光层,ONL:外核层,OPL:外丛层,INL:内核层,IPL:内丛层,GCL:神经节细胞层。
讨论
尽管GWASs已经成功地提供了对诸如屈光不正等复杂性状的遗传结构的洞察,但GWASs并没有提供关于因果变异或其功能作用的信息。在本研究中,我们提出了一种候选基因方法研究,目的是使用突变斑马鱼模型验证和探索re候选基因在眼睛中的功能作用。我们优先选择了在之前的RE GWASs中发现的9个候选基因,并使用CRISPR/cas9技术生成突变斑马鱼。在6个突变系中可以进行眼部屈光不正筛查,在其中3个突变系中,我们观察到近视表型:lama2re16,lrrc4care17lrrc4cbre18,而且kcnq5are19kcnq5bre20.在我们的ISH研究中我们证明了这一点lama2,Lrrc4ca, lrrc4cb, kcnq5a和kcnq5b根据我们在已发表的scRNA-seq数据库中的搜索结果,斑马鱼视网膜中都有表达,并支持了先前的观点,即视网膜(及其复杂的信号级联)作为一个整体参与了正视和屈光不正的发展。我们的研究提供了新的体内模型,将有助于解剖导致RE发展的途径。
该突变体rs12193446,位于人类的内含子58LAMA2基因(NM_000426.4)与RE的相关性最强P-value of = 9.87 × 10−328在最大的GWAS元分析中4,5.目前尚不清楚这种深内含子变异是否真正具有因果关系,因为其潜在的功能影响尚未阐明。然而,在我们的候选基因方法中,我们发现在4mpf处轴长增加lama2re16突变,而屈光不正在2和4强时均被检测到近视转移。SD-OCT和光折光在可检测变化的发生上的差异可能是由于这两种方法之间的敏感性和方法上的差异。在我们的原位杂交研究中,我们观察到斑马鱼lama2主要在INL中表达。先前对鸟类和啮齿动物组织的研究也报道了视网膜神经节细胞(RGC)的表达。20.和脉管系统21,22.
在之前的斑马鱼研究中,突变lama2导致严重肌营养不良表型和8 - 15 DPF之间的生长异常23,24,25.与这些先前产生的突变系相比,我们的lama2re16突变体没有表现出游泳异常,宏观上可见的生长缺陷或早期死亡,然而,需要对肌肉纤维组成进行更全面的研究,以排除肌肉组织的退化。的lama2re16本研究中使用的突变体包含移码突变,并预测早期外显子的停止增益(#3),预计将导致无意义介导的衰变或至少是早期终止和Lama2蛋白的严重截断。而之前报道的lama2模型携带高度保守的氨基酸残基突变,映射到lama2的球状结构域,已知会导致人类肌肉萎缩。值得注意的是,没有严重的早发性肌营养不良的表型lama2re16,创造了关注突变的眼内后果的可能性,即RE发育。在人类中,基因突变LAMA2以及两个相关基因的突变:DAG1而且ITGA7这两种基因都编码LAMA2受体,已知会导致肌肉萎缩22,26,27,28,29.在之前的GWAS荟萃分析中,这三个基因都与RE显著相关5.常见变体之间的关系LAMA2,DAG1而且ITGA7与近视有关的基因突变导致肌肉营养不良的基因突变尚不清楚。研究表明了层蛋白的作用,包括层蛋白α -2和视网膜血管基底膜的完整性。此外,已知双等位基因致病性变异的患者LAMA1(引起Poretti-Boltshauser综合征,OMIM #615960)发展为高度近视的症状之一。耗竭后的近视表型lama2在斑马鱼中,以及来自GWAS研究的有力证据支持了人类LAMA2导致近视。
Rs11602008,一个内含子变体LRRC4C基因(NM_001258419.2),在多个GWAS荟萃分析中一直与RE相关4,5,30..该变体已被注释为LRRC4C编码netrin-G1配体(NGL-1)的基因。NGL-1是一种跨膜蛋白,已知与其突触前配体Netrin-G1一起促进发育中的丘脑神经元的神经突生长31,32.此外,Lrrc4c/NGL-1缺失抑制雄性小鼠海马兴奋性突触的发育和功能33.虽然视网膜的功能LRRC4C/NGL-1尚未被描述,我们在检索到的scRNA-seq数据库和我们的ISH研究中观察到人类LRRC4C和斑马鱼lrrc4c基因都在神经视网膜中表达。因此,的潜在作用LRRC4C在视网膜中,类似于丘脑,也可以在发育过程中寻找轴突引导的方向,在控制视网膜布线中发挥作用。在斑马鱼中,我们发现了潜在的损失lrrc4c导致眼轴伸长和屈光状态的近视转移。斑马鱼缺失引起的视网膜信号缺陷lrrc4c/Ngl-1和发育中的突变斑马鱼的视网膜线路可能会干扰emomtropization过程。视网膜-巩膜信号级联的确切机制,由于潜在的缺乏lrrc4c,可能导致轴向伸长仍有待阐明。探索下游转录组变化的研究lrrc4c将为这个过程提供更多的见解。
的内含子1中的rs7744813 SNPKCNQ5(NM_019842.4)与近视相关的多项独立GWAS荟萃分析4,5,30..此外,rs7744813和其他四个KCNQ5基因多态性也与高度近视有关34.在这项研究中,我们描述了人类KCNQ5和斑马鱼kcnq5a / kcnq5b广泛地表达在整个视网膜和潜在的损失kcnq5导致斑马鱼近视。KCNQ5编码名为Kv7.5的电压门控钾通道。已经证明KCNQ5/kv7.5在大脑中调节m型电流35,36视网膜色素上皮(RPE)和神经视网膜37,38.Yang et al. 2021显示了两者之间的潜在关系KCNQ5以及缺乏形态的豚鼠近视的发展。作者报告说,视网膜KCNQ5明显下调,并提出这是由于增加钾浓度或减少m型钾电流密度的RPE细胞形态剥夺豚鼠眼睛39.然而,在我们的研究中,眼轴伸长和相应的屈光不正(近视)偏移被观察到是由于潜在的缺乏kcnq5在斑马鱼。因此,在豚鼠模型中,事件发生的顺序可能是:形体剥夺型近视;其次是m型钾电流的下调和损伤;导致眼轴性生长。另一项研究提出,表达模式或功能的改变KCNQ5影响视网膜双极细胞信号产生的时间响应光感受器的光诱发反应40.这些改变的双极细胞反应可能会增加近视的易感性。我们在斑马鱼中的发现支持了在其他动物模型中报道的发现,这些模型显示了两者之间关系的证据kcnq5和近视。未来研究KCNQ5(Kv7.5)选择性钾通道开启器或抑制剂可能会导致新的近视治疗方法的发现。
除了观察到的近视表型lama2re16,lrrc4care17lrrc4cbre18,而且kcnq5are19kcnq5bre20变种人,我们发现tjp2ab1367tjp2bb1368突变体在4mpf时表现出屈光状态的远视转移,然而,轴向伸长没有相应的减少。这可能是晶状体组织中紧密连接的潜在损失的直接影响tjp2a而且tjp2b似乎在斑马鱼幼虫的晶状体中有适度表达41,42.斑马鱼不能适应由于前庭牵开迟缓43,44,45此外,斑马鱼的角膜对水中的光功率没有贡献46,47,48.因此,屈光不正很可能是由焦距的增加引起的,即透镜直径的增加和曲率/球度的减小。为了评估我们的假设,我们研究了WT和tjp2ab1367tjp2bb1368突变镜头;这带来了局限性,因为我们没有执行光功率的绝对计算。理想情况下,镜头的正面和背面都应该被测量,然而在SD-OCT扫描中,镜头的背面由于镜头效应而变形,导致图像变形。尽管如此,由于我们在体外测量的完美球形,我们假设透镜的前面和后面是相同形状的。我们的晶状体评估的最后一个局限性是,我们只考虑了外层皮层区域和上皮细胞的变化,而没有考虑深层皮层和核层光学特性的潜在变化。在本研究中,我们发现了一种潜在的透镜功能tjp2a而且tjp2b然而,未来的研究需要对分子和光学的变化进行深入的描述tjp2ab1367tjp2bb1368突变镜头。
在我们的筛选中,我们没有观察到眼显型pde11are13pde11a-likere14而且shisa6re15突变体。然而,本研究的一个局限性是缺乏所研究的斑马鱼蛋白质的特异性抗体,这限制了我们在蛋白质水平上通过western blot或免疫组化来确认所产生的突变等位基因的作用。因此,基于这些结果,我们不能排除这些基因可能参与调节眼睛大小。
解释GWAS的发现是具有挑战性的,不仅需要识别因果变异,还需要识别变异的分子效应,相关基因的作用,以及相关的细胞类型和途径。在本研究中,我们提出了一种候选基因方法,以应对缺乏探索候选基因在屈光不正发展中的潜在作用的功能性研究。我们对9个候选基因进行了优先排序,筛选了6个突变斑马鱼模型,并在3个突变系中发现了近视表型(lama2re16,lrrc4care17lrrc4cb/ re18−−,kcnq5are19kcnq5bre20).近视的表型特征是眼轴长度的增加和屈光状态的负移。这些发现表明,从GWAS中选择的个体强相关候选基因的缺失可以诱导近视屈光不正。考虑到复杂近视是由SNPs和基因的互加引起的共识,这些单一候选基因在耗尽时导致屈光状态的显著变化是有趣的。我们的研究结果表明,当这三个候选基因被耗尽时,它们独立地决定了轴长。近视的lama2re16,lrrc4care17lrrc4cbre18 - / -,kcnq5are19kcnq5bre20突变体可用于进一步研究近视眼轴长和近视干预措施发展背后的信号级联。
方法
在已发表的转录组数据集中查找候选基因
候选基因的视网膜表达通过三个独立发表的成人视网膜单细胞RNA测序(scRNA-seq)数据集进行评估10,11,12以及人类蛋白质图谱13.在神经视网膜外,我们从视网膜色素上皮(RPE)和脉络膜中检索了scRNA-seq数据14、角膜15.人类巩膜和晶状体组织的单细胞表达研究尚未发表;因此,这些组织在本次评估中未被考虑。
鱼线和鱼壳
利用WT-AB斑马鱼的CRIPSR-cas9生成突变系。设计单导rna (sgRNA)(补充数据S3)并根据CRISPRscan协议合成(http://www.crisprscan.org)49.sgRNA合成的寡核苷酸分别包括:5’T7启动子序列(aattaatacgactcactata)、靶位点序列和环序列(gttttagagctagaaatagc)。该寡核苷酸与一个互补环寡核苷酸(aaaagcaccgactcggtgccactttttcaagttgataacggactagcctttttttttaacttgctattttctagctctaaaac)结合,其中包括用于Cas9识别的RNA环。进行PCR生成DNA引导寡核苷酸,然后用T7 megascript试剂盒(ThermoFisher)转录sgrna。结合sgRNAs和Cas9蛋白,在WT AB卵单细胞期注射1 nl(终浓度1500 pg/nl)49,50,51.该协议的更多细节可以在Vejnar等人2017中找到。通过Sanger测序验证诱导突变,并将建立子杂交产生纯合子敲除鱼。对斑马鱼中具有多个同源基因的基因进行双敲除(补充数据)S3).的tjp2ab1367而且tjp2bb1368线条之前在俄勒冈大学生成50.这些行被交叉以生成tjp2ab1367tjp2bb1368本研究中使用的线条。鱼线在鱼缸中饲养,数量大小相匹配。对于光谱域光学相干断层扫描(SD-OCT)和光折射,使用0.016%三卡因甲烷磺酸溶液(MS222, Sigma Aldrich)麻醉斑马鱼,缓冲至pH = 7。所有动物的治疗均符合荷兰动物福利立法和荷兰鹿特丹Erasmus医疗中心实验动物卫生保健中心(EDC: Experimenteel Dier Centrum)的指导方针,并符合欧盟委员会理事会指令2010/63/EU (CCD批准,许可证AVD 1010020186907)。在这项研究中,我们遵循了在arrival指南中描述的报告建议。所有斑马鱼都暴露在28.5°C的14小时光照:10小时黑暗循环中。
斑马鱼眼睛RNA的分离及表达分析
从4条dpf (n = 20头)、1条mpf (n = 8眼)、2条mpf (n = 6眼)、3条mpf (n = 5眼)和12条mpf (n = 4眼)中采集去核眼。在立体显微镜(徕卡m80)下取出镜片,收集组织并在液氮中冷冻。使用500 μ l Trizol试剂(Ambion)提取RNA,然后使用手持均质器(Pro 200, Pro scientific Inc.)均质2 × 5秒。匀浆在室温(RT)下放置5分钟,加入200µl氯仿(Sigma Aldrich,≥99%)。样品在RT下孵育15分钟,在4°C下以最大转速离心15分钟。接下来,收集上部部分,并使用RNeasy Mini Kit (Qiagen)提取RNA。使用Nanodrop (DS-11系列分光光度计/荧光计,DeNovix)对提取的RNA进行定量,并使用iScript cDNA Synthesis kit (BioRad)合成cDNA。cDNA转录物通过PCR和琼脂糖凝胶电泳确认,使用的引物集见补充数据S2.
光谱域光学相干断层扫描(SD-OCT)
按照Quint等人先前的描述进行SD-OCT测量和分析。8.在2和4强时分别测定各基因型鱼10条(20眼)。研究中包括的突变鱼相对于WT鱼的体长变化均小于1%(补充图)。S1),排除了由于身体大小的显著变化而引起的眼部指标的变化。采用900 nm SD-OCT Ganymede系统(Thorlabs)。视场设置为1.7 × 1.7 × 2.2 mm, z方向像素深度为2µm。如前所述,使用定制的MATLAB软件分析眼部指标8,并利用各眼成分的特定折射率校正眼成分的尺寸;角膜1.3346,47,48,透镜(梯度折射率)1.446,47,48,52,53,54前腔和玻璃体腔1.34,视网膜1.3848,55,56.
古怪的光反射照相
斑马鱼眼睛的屈光状态是由偏心红外光折射率确定的。该协议的更多细节可以在其他地方找到8.分析是用自定义的c++软件完成的。在2和4 mpf下测定突变株和对照株。亮度梯度的斜率由100个独立的测量结果确定并平均。这一数值通过眼科镜片校正转换为屈光度的屈光误差8.
透镜球度和曲率测量
对体外分离的4强WT和晶状体进行晶状体生物测定tjp2ab1367tjp2bb1368突变鱼(n = 10条鱼,n = 20个透镜)。我们假设测量的远视屈光变化tjp2ab1367tjp2bb1368突变是由于晶状体形状的改变,其结果是晶状体曲率减小。这一假设是基于以下事实:(1)由于退化的牵开透镜,刚性晶状体不能适应43,44,45(2)由于角膜在水中的贡献可以忽略不计(折射率:1.33),所有的光功率都来自球面透镜。46,47,48(3)我们观察到晶状体直径增加tjp2ab1367tjp2bb1368突变体。但由于虹膜色素对红外光的阻挡,不能直接从SD-OCT数据判断球度的变化。为了克服这一限制,我们通过比较4个离体晶状体间接评估了晶状体的球度。镜头放置在光学显微镜(Olympus DP72)下,并从3个不同角度拍摄(Olympus U-TV0.63XC)。我们使用大圆(中平面)的圆度,从三个不同的角度测量,作为每个透镜的圆度的代理(圆度是在斐济测量的(ImageJ))。我们观察到,突变体和WT透镜的所有三个位置的圆度都等于1(补充图。S2b).这种圆度/球度守恒意味着透镜直径的增加tjp2ab1367tjp2bb1368突变体在各轴向分布均匀。这种透镜直径和体积的均匀增加,即当球度保持与WT透镜相同时,导致透镜曲率的减小。为了证实这一发现,我们还在4强WT和4强SD-OCT数据中直接测量了前透镜半球曲率的变化tjp2ab1367tjp2bb1368突变体(n = 10条鱼,n = 20个透镜)。分析是在斐济(ImageJ)使用Kappa插件进行曲率测量。
原位杂交
一岁大的WT斑马鱼解剖眼睛在4%多聚甲醛(PFA)中保存两天,使用EFTP组织处理器(Intelsint)固定,切片前用石蜡包埋。使用切片机(Microm HM 335 E)按照标准协议对嵌入的眼睛进行切片。将石蜡切片(6µm)转移到Superfrost载玻片(VWR)中,并在37°C下干燥。部分在二甲苯deparaffinized 5分钟和10分钟,100%乙醇为5分钟,10分钟的70%乙醇,PBST(1×磷酸缓冲盐0.1% Tween-20) 5分钟。部分固定在4% PFA的20分钟,洗PBST pre-hybridization前5分钟的预热HYB +缓冲(50%的甲酰胺,5×SSC(柠檬酸Saline-sodium), 50µg / ml肝素,500µg / ml tRNA, Tween-20 0.1%,和aqua dest)在68°C的1 h。感觉和反义调查(见补充数据S2)在HYB +中稀释,在95°C下加热2分钟,并在冰上冷却至所需。切片与探针在68°C的潮湿室中杂交过夜。切片在68℃的预热洗涤缓冲液(50/50 HYB-(50%甲酰胺,5 × SSC, 0.1% Tween-20, aqua dest)/0.2 × SSC)中洗涤15分钟,在68℃的预热0.2 × SSC中洗涤2次30分钟。50%;25%;将切片用阻断液(2%羊血清,2 mg/ml牛血清白蛋白(Sigma Aldrich)在PBST中)在RT下阻断1小时,然后用抗digg - ap抗体(Anti-Digoxigenin-AP, Fab片段,1:2000,Roche)稀释在阻断液中孵育(过夜,4°C)。切片在PBST中洗涤3次15分钟,在染色缓冲液NTMT (1 M Tris (pH 9.5), 1 M MgCl2, 5 M NaCl, 10% ten -20)中洗涤2次5分钟。染色溶液(12 μ l NBT/BCIP (Roche) / 1 ml染色缓冲液)涂在切片上,并在暗处rt孵育。孵育时间因探针组而异,从1小时到2天不等。切片分别在PBST中洗涤3次,15分钟,蒸馏水中漂洗,分别在95%和100%乙醇中水化1分钟,最后暴露于二甲苯中2次,2分钟。载玻片用Entellan (Sigma Aldrich)安装,37°C干燥一夜。在Olympus DX40显微镜和Olympus DP73相机上进行成像。图像处理采用Olympus cellSens软件。
统计分析和样本量估计
我们通过拟合GraphPad Prism 8.0中实现的混合模型来分析SD-OCT和光折射率。该混合模型采用复合对称协方差矩阵,并采用限制极大似然(REML)进行拟合。在这个模型中,同一条鱼的两只眼睛都被视为重复测量。Grubbs检验检测异常值(p< 0.01),排除在分析之外。体长测量用Welch 's ANOVA分析,也在GraphPad Prism 8.0中。
为了估计SD-OCT和光折变评估的样本量,我们使用了GLIMMPSE软件57重复测量。估计的效应大小(即轴长约4%的变化和光折射率约6%的变化)是基于先前的研究8, alpha-error设置为0.05,power设置为0.95。根据这些参数,每组最少需要20只眼(10条鱼)(幂= 0.953)。
数据可用性
在本研究过程中产生或分析的所有数据都包含在本文及其补充信息文件中。任何额外的(原始)数据可根据要求从通讯作者处获得。
参考文献
哈曼,a.e.g.et al。近视并发症:综述和荟萃分析。投资。角膜切削。粘度科学。61, 49(2020)。
视网膜、光学和环境因素在近视病因学中的复杂相互作用。掠夺。Retin。眼睛Res。31, 622-660(2012)。
霍顿,b.a。et al。2000年至2050年近视和高度近视的全球患病率及时间趋势。眼科学123, 1036-1042(2016)。
Tedja, m.s。et al。全基因组关联荟萃分析强调光诱导信号是屈光不正的驱动因素。Nat,麝猫。50, 834-848(2018)。
海西,p.g.et al。对542,934名欧洲血统受试者的荟萃分析确定了导致屈光不正和近视的新基因和机制。Nat,麝猫。52, 401-407(2020)。
基弗,a.k.。et al。全基因组分析指出在近视中细胞外基质重塑、视觉周期和神经元发育的作用。公共科学图书馆麝猫。9, e1003299(2013)。
昆特,w。H。et al。斑马鱼:研究眼部表型的体内筛选模型。Transl。粘度科学。抛光工艺。11, 17(2022)。
昆特,w。H。et al。Gap Junction Delta-2 (GJD2)基因的缺失导致斑马鱼屈光不正。Commun。医学杂志。4, 1-14(2021)。
普鲁姆,r.j.。et al。LocusZoom:全基因组关联扫描结果的区域可视化。生物信息学26, 2336-2337(2010)。
卢科斯基,s.w.。et al。成人视网膜的单细胞转录组图谱。EMBO J。38, e100811(2019)。
考恩,c.s.。et al。单细胞分辨率下人类视网膜及其类器官的细胞类型。细胞182, 1623 - 1640。e34(2020)。
福格特,资深作家。et al。用单细胞RNA测序研究人视网膜中央凹与周围的分子特征。Exp. Eye Res。184, 234-242(2019)。
图尔,P. J。et al。人类蛋白质组的亚细胞图。科学356, 6340 eaal3321(2017)。
沃伊特,et al。健康和黄斑变性中人类视网膜色素上皮细胞和脉络膜的单细胞转录组学。Proc。国家的。学会科学。美国。116, 24100-24107(2019)。
科林,J。et al。人类角膜单细胞图谱,定义其发展,角膜缘祖细胞及其与免疫细胞的相互作用。Ocul。冲浪。21, 279-298(2021)。
波斯特思韦特,J.,阿莫雷斯,A.,克雷斯科,W.,辛格,A. &严,Y.-L.。子功能划分,硬骨骨辐射和人类基因组的注释。趋势麝猫。20., 481-490(2004)。
帕杜,m.t。et al。具有视网膜通路缺陷的小鼠模型对实验性近视的高度易感性。投资。角膜切削。粘度科学。49, 706-712(2008)。
Glickstein, M. & Millodot, M.视网膜镜检查和眼睛大小。科学168, 605-606(1970)。
Schmucker, C. & Schaeffel, F.生长中的C57BL/6小鼠近轴示意眼模型。视觉Res。44, 1857-1867(2004)。
Morissette, N. & Carbonetto, S.层粘连蛋白α 2链(M链)在鸟类和小鼠视网膜投射通路中被发现。j . >。15, 8067-8082(1995)。
利比,r.t.。et al。层粘连蛋白在成人和发育中的视网膜中的表达:两种新的中枢神经层粘连蛋白的证据。j . >。20., 6517-6528(2000)。
Toti, P。et al。人视网膜中层粘连蛋白链的定位:与α - 2链层粘连蛋白缺乏相关的先天性肌营养不良的可能意义。Neuromuscul。Disord。7, 21-25(1997)。
古普塔,v.a.。et al。层粘连蛋白-α2的剪接位点突变导致斑马鱼严重的肌肉萎缩和生长异常。《公共科学图书馆•综合》7, e43794(2012)。
Sztal, T. E., Sonntag, C., Hall, T. E. & Currie, P. D.营养不良斑马鱼肌肉层蛋白受体相互作用的上位解剖。嗡嗡声。摩尔,麝猫。21, 4718-4731(2012)。
Fabian, L. & Dowling, J. J.斑马鱼lama2相关的先天性肌肉营养不良(MDC1A)模型。前面。摩尔。>。13, 122(2020)。
Colognato, H。et al。鉴定营养不良糖作为少突胶质细胞中的第二层粘连蛋白受体,在髓鞘形成中起作用。发展134, 1723-1736(2007)。
柏金,D. J. &考夫曼,S. J. α7β1整合素在肌肉发育和疾病。细胞组织测定。296, 183-190(1999)。
奥利维拉,J。et al。26例先天性肌肉萎缩症患者的LAMA2基因分析。中国。麝猫。74, 502-512(2008)。
Sarkozy, A., Foley, A. R., Zambon, A. A., Bönnemann, C. G. & Muntoni, F. lama2相关营养不良:临床表型、疾病生物标志物和临床试验准备。前面。摩尔。>。13, 123(2020)。
范霍芬,V. J. M。et al。多血统队列的全基因组荟萃分析确定了屈光不正和近视的多个新的易感位点。Nat,麝猫。45, 314-318(2013)。
林俊昌,何伟华。,Gurney, A. & Rosenthal, A. The netrin-G1 ligand NGL-1 promotes the outgrowth of thalamocortical axons.Nat。>。6, 1270-1276(2003)。
Barallobre, m.j, Pascual, M, Del Río, J. A. & Soriano, E. Netrin家族的引导因子:强调Netrin-1信号。Brain Res. Brain Res. Rev49, 22-47(2005)。
崔Y。et al。NGL-1/LRRC4C缺失以输入无关的方式适度抑制海马兴奋性突触的发育和功能。前面。摩尔。>。12, 119(2019)。
廖,X。et al。KCNQ5多态性与高度近视的遗传关联研究。Biomed Res. Int。2017, 3024156(2017)。
施罗德,B. C., Hechenberger, M., Weinreich, F., Kubisch, C. & Jentsch, T. J. KCNQ5,一种广泛表达于大脑的新型钾通道,介导M型电流。生物。化学。275, 24089-24095(2000)。
雷曼兄弟。et al。KCNQ5的功能丧失和功能获得突变可导致智力残疾或癫痫性脑病。点。j .的嗡嗡声。麝猫。101, 65-74(2017)。
李志刚,张志刚,张志刚。KCNQ通道调节剂对灵长类动物视网膜色素上皮细胞m型钾电流的影响。点。j .杂志。细胞杂志。302, c821-c833(2012)。
张晓霞,杨德华,张晓霞。KCNQ5/K(v)7.5钾通道在灵长类动物视网膜色素上皮和神经视网膜中的表达及亚细胞定位。点。j .杂志。细胞杂志。301, c1017-c1026(2011)。
杨问。et al。近视眼豚鼠视网膜KCNQ5表达及钾微环境的变化前面。杂志。12, 790580(2021)。
徐震,姜旭,哈蒙,程杰,马罗,O. A. R., Hysi, P. G.近视风险变异与视网膜电生理参数的关系:KCNQ5在近视发展中的作用。投资。角膜切削。粘度科学。62, 2282-2282(2021)。
法恩斯沃斯,桑德斯,L. M. &米勒,a.c.斑马鱼发育的单细胞转录组图谱。Dev,杂志。459, 100-108(2020)。
法恩斯沃思。UCSC Cell Browser。在斑马鱼发育的单细胞转录组图谱https://zebrafish-dev.cells.ucsc.edu(2019)。
Collery, r.f., Veth, K. N, Dubis, a.m., Carroll, J. & Link, B. A.使用SD-OCT快速、准确和非侵入性地测量斑马鱼轴长和其他眼睛尺寸,可以对近视和对眼化进行纵向分析。《公共科学图书馆•综合》9, e110699(2014)。
格斯特里,G., Link, B. A. & Neuhauss, S. C. F.斑马鱼的视觉系统及其用于模拟人类眼部疾病。Dev。一般人。72, 302-327(2012)。
格雷,M. P.,史密斯,R. S.,索勒斯,K. A.,约翰,S. W. M.和林克,B. A.斑马鱼的房水流出途径。投资。角膜切削。粘度科学。50, 1515-1521(2009)。
老鼠和斑马鱼眼睛中的透明晶状体和角膜。Semin。细胞发育生物学。19, 94-99(2008)。
Verma, Y., Divakar Rao, K. & Gupta, P. K.成年斑马鱼的体内成像使用光学相干断层扫描。在第一届坎特伯雷光学相干层析成像和自适应光学研讨会有,2008)。https://doi.org/10.1117/12.814914.
饶,D, Verma, Y., Patel, H. & Gupta, P.成年斑马鱼眼睛非侵入性成像使用光学相干断层扫描。咕咕叫。科学。90,(2006)。
Vejnar, c.e., Moreno-Mateos, m.a., Cifuentes, D., Bazzini, a.a. & Giraldez, a.j.优化的CRISPR-Cas9系统用于斑马鱼基因组编辑。冷泉港。Protoc。(2016)。
马什,米歇尔,J. C.,阿德克,A. P.,赫克曼,E. L. &米勒,A. C.脊椎动物电突触细胞内支架的不对称性。咕咕叫。医学杂志。273561 - 3567. - e4。https://doi.org/10.1016/j.cub.2017.10.011(2017)。
Shah, A. N, Moens, C. B. & Miller, A. C.使用CRISPR/Cas9技术进行靶向候选基因筛选。方法细胞生物学。135, 89-106(2016)。
星野,M。et al。用x射线Talbot干涉测量法测量原位眼透镜的光学特性:生长过程的一种新测量方法。《公共科学图书馆•综合》6, e25140(2011)。
魏玛,饶k . D.,苏雷什,M. K.,帕特尔,H. S. & Gupta, P. K.利用光学相干层析成像测量鱼眼晶体透镜的梯度折射率剖面。达成。理论物理。B87, 607-610(2007)。
Young, L. K., Jarrin, M., Saunter, C. D., Quinlan, R. A. & Girkin, J. M.使用SPIM对胚胎眼晶状体发育光学特性和分级指数的无创体内量化。生物医学。选择快递。9, 2176-2188(2018)。
光学相干层析成像技术与应用。在2013年欧洲激光与光电国际量子电子学会议CLEO Europe / iec(IEEE 2013)。https://doi.org/10.1109/cleoe-iqec.2013.6802013.
哈里里,S。et al。在1060 nm波长范围内对人和啮齿动物视网膜进行体内成像的OCT轴向分辨率的限制因素。选择快递。17, 24304-24316(2009)。
克雷德勒,s.m。et al。GLIMMPSE:有和没有基线协变量的线性模型的在线功率计算。J.统计。54, 10(2013)。
确认
我们要感谢Beerend Winkelman和Frank Schaeffel的技术支持。这项工作的资金由欧洲研究委员会(ERC)在欧盟地平线2020研究和创新计划(赠款648268)和荷兰科学研究组织(NWO,赠款91815655和VidW.1154.18.046), UitZicht(项目2018-29)和Henkes Stichting教授博士支持。
作者信息
作者及隶属关系
贡献
W.H.Q, m.m.s., r.w., C.C.W.K.和A.I.I对研究的设计做出了贡献。W.H.Q, N.C.C.J.K和kc.d.t进行了实验并筛选了突变体。r.w., C.C.W.K.和A.I.I监督了这项研究。whq和ai起草了这份手稿。C.C.W.K、a.m.、m.m.s.和r.w.对手稿进行了批判性的审阅。所有的作者都阅读了手稿的最终稿,并达成了一致意见。作者声明没有利益冲突。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
昆特,w.h.,塔德马,K.C.D,科克,n.c.j.et al。突变斑马鱼模型屈光不正候选基因的gwas后筛选。Sci代表13, 2017(2023)。https://doi.org/10.1038/s41598-023-28944-y
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-023-28944-y