摘要
β细胞的再生能力有限,容易导致糖尿病。这里,我们展示了MYC家族成员,Mycl在胰腺内分泌细胞增殖中起关键作用。遗传消融Mycl导致新生小鼠胰腺内分泌细胞增殖减少。相比之下,的表达Mycl在成年小鼠体内刺激β和α细胞增殖,并在细胞消退后持续存在Mycl表达式。一个子集的扩大α细胞产生胰岛素生产细胞后,这种退出。瞬态Mycl体内表达足以使糖尿病小鼠的高血糖恢复正常。体外表达Mycl类似地,激发胰岛细胞的活跃复制,即使是来自老年小鼠的胰岛细胞。最后,我们证明了这一点MYCL刺激成人尸体胰岛细胞的分裂。我们的结果表明,诱导Mycl单独增加功能β细胞的数量,这可能为β细胞的再生提供了策略。
这是订阅内容的预览,通过你所在的机构访问
访问选项
订阅《自然》+
立即在线访问《自然》和其他55种《自然》杂志
29.99美元
每月
订阅期刊
获得1年的完整期刊访问权限
99.00美元
每期只要8.25美元
所有价格均为净价格。
增值税稍后将在结帐时添加。
税务计算将在结账时完成。
买条
在ReadCube上获得时间限制或全文访问。
32.00美元
所有价格均为净价格。
参考文献
胰腺发育生物学。发展121, 1569-1580(1995)。
多纳特,M. Y. & Halban, P. A.糖尿病β细胞质量减少:意义,机制和治疗意义。Diabetologia47, 581-589(2004)。
Cnop, M.等。通过脂褐素积累的数学模型估计人类胰岛β细胞的长寿命和低周转率。Diabetologia53, 321-330(2010)。
Teta, M., Long, s.y ., Wartschow, L. M., Rankin, M. M. & Kushner, J. A.老年成年小鼠β细胞的非常缓慢的周转。糖尿病54, 2557-2567(2005)。
Bonner-Weir, S., Trent, d.f. & Weir, G. C.大鼠部分胰腺切除术和随后葡萄糖诱导胰岛素释放的缺陷。j .中国。投资。71, 1544-1553(1983)。
Aguayo-Mazzucato, C. & Bonner-Weir, S.胰腺β细胞再生作为糖尿病的一种可能疗法。细胞金属底座。27, 57-67(2018)。
van der Meulen, T.等。原始β细胞在胰岛内的新生生态位中持续存在一生。细胞金属底座。25, 911-926 e916(2017)。
王,D.等。来自常驻Procr(+)祖细胞的胰岛类器官长期扩张。细胞180, 1198-1211 e1119(2020)。
周强和梅尔顿,d。自然557, 351-358(2018)。
王,P.等。糖尿病——人类β细胞增殖的进展与挑战。内分泌。11, 201-212(2015)。
Laybutt, d.r.等。转基因小鼠β细胞c-Myc过表达导致细胞增殖和凋亡,胰岛素基因表达下调,引发糖尿病。糖尿病51, 1793-1804(2002)。
Rosselot, C.等人。Myc在胰腺β细胞中的许多生命。生物。化学。https://doi.org/10.1074/jbc.REV120.011149(2020)。
Pelengaris, S., Khan, M. & Evan, g.i.抑制Myc诱导的β细胞凋亡暴露Myc的多种致癌特性并引发致癌进展。细胞109, 321-334(2002)。
王,P.等。高通量化学筛选显示,harmy介导的抑制DYRK1A增加人胰腺β细胞复制。Nat,地中海。21, 383-388(2015)。
Puri, S.等。复制导致β细胞不成熟。Commun Nat。9485(2018)。
Collombat, P.等人。Pax4在小鼠胰腺中的异位表达将祖细胞转化为α细胞,随后转化为β细胞。细胞138, 449-462(2009)。
考特尼等人。Arx在胰腺α细胞中的失活触发了它们的新生并转化为功能性β样细胞。公共科学图书馆麝猫。9, e1003934(2013)。
本-奥斯曼,N.等人。长期服用GABA可诱导α细胞介导的β样细胞新生。细胞168, 73-85 e11(2017)。
李,J.等。青蒿素靶向GABAA受体信号转导,损害α细胞识别。细胞168, 86-100 e115(2017)。
van der Meulen, T.等。蒿甲醚不能将α细胞转化为β细胞。细胞金属底座。27, 218-225 e214(2018)。
Ackermann, a.m., Moss, N. G. & Kaestner, K. H. GABA和青蒿琥酯在体内不诱导胰腺α - β细胞转分化。细胞金属底座。28, 787-792 e783(2018)。
伯恩斯,L. E.等。单细胞分辨率下小鼠胰腺发育的谱系动力学。Commun Nat。9, 3922(2018)。
邱伟林等。在单细胞水平上破译胰岛β细胞和α细胞的成熟途径和特征。细胞金属底座。25, 1194-1205 e1194(2017)。
于,x.x等。染色质标记的动态和JMJD3在胰腺内分泌细胞命运承诺中的作用。发展145,https://doi.org/10.1242/dev.163162(2018)。
Lu, T. T.等。多梳依赖的表观基因组控制β细胞功能障碍、去分化和糖尿病。细胞金属底座。27, 1294-1308 e1297(2018)。
哈顿,K. S.等。L-Myc在正常小鼠发育中的表达和活性。摩尔。细胞。医学杂志。16, 1794-1804(1996)。
Beard, C., Hochedlinger, K., Plath, K., Wutz, A. & Jaenisch, R.在胚胎干细胞中通过位点特异性整合产生单拷贝转基因小鼠的有效方法。《创世纪》44, 23-28(2006)。
Ohnishi, K.等。体内重编程的过早终止通过改变表观遗传调控导致癌症的发展。细胞156, 663-677(2014)。
Rane, S. G.等。Cdk4表达缺失导致胰岛素缺乏性糖尿病,Cdk4激活导致β -胰岛细胞增生。Nat,麝猫。22, 44-52(1999)。
Muzumdar, m.d, Tasic, B., Miyamichi, K., Li L., Luo L.一种全球双荧光Cre报告小鼠。《创世纪》45, 593-605(2007)。
索伦斯等人。Ins1(Cre)敲入小鼠进行β细胞特异性基因重组。Diabetologia58, 558-565(2015)。
金,S. J.,年,C., Doudet, D. J. & McIntosh, C. H.西格列汀(MK0431)抑制二肽基肽酶IV延长链脲佐菌素诱导的糖尿病小鼠胰岛移植存活。糖尿病57, 1331-1339(2008)。
Zhang N.等。胰岛血管内皮生长因子的产生提高了胰岛移植物的血管化。糖尿病53, 963-970(2004)。
Alvarez-Dominguez, J. R.等。昼夜夹带触发人离体胰岛成熟。细胞干细胞26, 108-122 e110(2020)。
索雷尔等人。成人胰腺β细胞在极度损失后转化为β细胞。自然464, 1149-1154(2010)。
古山,K.等。通过葡萄糖感应胰岛素分泌的人类α细胞缓解小鼠糖尿病。自然567, 43-48(2019)。
肖,x等。由病毒基因疗法诱导的内源性α细胞重编程为β细胞,可逆转自身免疫性糖尿病。细胞干细胞22, 78-90 e74(2018)。
Birrer, m.j.等人。L-myc与ras合作转化原代大鼠胚胎成纤维细胞。摩尔。细胞。医学杂志。8, 2668-2673(1988)。
中川,M.,泷泽,N.,成田,M.,一坂,T. &山中,S.促进转化缺陷Myc的直接重编程。国家科学院学报美国107, 14152-14157(2010)。
金,D. W.等。小细胞肺癌小鼠模型中Mycl的遗传需求和RNA Pol I抑制的有效性。Dev的基因。30., 1289-1299(2016)。
MyoD家族和肌生成:冗余、网络和阈值。细胞75, 1241-1244(1993)。
亚迪斯,R. C. &爱泼斯坦,J. A.诱导再生——心脏修复直接重编程的进展和前景。Nat,地中海。19, 829-836(2013)。
郭,Z.等。在脑损伤和阿尔茨海默病模型中,活性神经胶质细胞在体内直接重编程为功能神经元。细胞干细胞14, 188-202(2014)。
周,Q., Brown, J., Kanarek, A., Rajagopal, J. & Melton, D.在体内重编程成人胰腺外分泌细胞到β细胞。自然455, 627-632(2008)。
Talchai, C., Xuan, S., Kitamura, T., DePinho, R. A. & Accili, D.通过Foxo1消融在肠道中产生功能性胰岛素生产细胞。Nat,麝猫。44, 406-412(2012)。
Luo, C.等。成纤维细胞向神经元直接重编程过程中的全局DNA甲基化重塑。eLife8,https://doi.org/10.7554/eLife.40197(2019)。
赫林,B. J.等。人胰岛移植治疗1型糖尿病合并严重低血糖的三期临床研究糖尿病护理39, 1230-1240(2016)。
八木,等人。维持配子衍生DNA甲基化的基态女性胚胎干细胞的衍生。自然548, 224-227(2017)。
Kaneko, T.,佐久间,T.,山本,T. & Mashimo, T.通过电穿孔工程内切酶进入完整大鼠胚胎的简单敲除。科学。代表。4, 6382(2014)。
波拉特等人。葡萄糖代谢对胰腺细胞再生的控制。细胞金属底座。13, 440-449(2011)。
日银,s.f.等。人和小鼠导管胰腺癌的类器官模型。细胞160, 324-338(2015)。
Dobin, A.等人。STAR:超快通用RNA-seq对准器。生物信息学29, 15-21(2013)。
Martin, M. Cutadapt从高通量测序读取中移除适配器序列。EMBnet J。https://doi.org/10.14806/ej.17.1.200(2011)。
Anders, S, Pyl, P. T. & Huber, W. htseq -一个用于处理高通量测序数据的Python框架。生物信息学31, 166-169(2015)。
Love, m.i, Huber, W. & Anders, S.使用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。基因组医学杂志。15, 550(2014)。
Butler, A, Hoffman, P, Smibert, P, Papalexi, E. & Satija, R.整合不同条件、技术和物种的单细胞转录组数据。生物科技Nat。》。36, 411-420(2018)。
泰鲁什,我,等人。通过单细胞RNA-seq分析转移性黑色素瘤的多细胞生态系统。科学352, 189-196(2016)。
曹,J.等。哺乳动物器官发生的单细胞转录景观。自然566, 496-502(2019)。
确认
我们感谢Yagi M.和Ito K.对手稿的批判性阅读。我们感谢山田Y.,坂本R.,菊地M.和巴巴M.的技术援助。Yasuhiro Y.和T.Y.由AMED-CREST资助。21gm1110004h9905),日本医学研究开发机构(AMED)。Yasuhiro Y.也得到了P-CREATE、AMED的部分支持。21cm0106203h0006)和JSPS kakeni(批准号18H04026, 20H05384)。人类生物学高级研究研究所(ASHBi)由日本MEXT世界顶级国际研究中心计划(WPI)支持。我们感谢ASHBi中的单细胞基因组信息分析核心(SignAC)进行RNA序列分析。
作者信息
作者及隶属关系
贡献
M.H.和Yasuhiro Y.设计并构思了这项研究,并撰写了论文。m.h., y.s., n.s., j.t., Yosuke Y., T.U.和M.O.制造小鼠,进行实验,并生成RNA-seq和scRNA-seq文库。H.S.进行了透射电镜分析。s.t., M. Kato和J.N.提供了有关糖尿病实验的技术指导。M. Kabata, S.O.和T.Y.分析了小鼠和人类的RNA-seq和scRNA-seq数据。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
同行评审
同行评审信息
自然的新陈代谢感谢Patrick A Carroll和其他匿名审稿人对这项工作的同行评审所做的贡献。伊莎贝拉·萨缪尔森是主要处理编辑。
额外的信息
出版商的注意施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
扩展数据
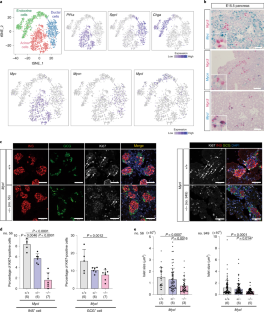
图1小鼠胰腺发育过程中MYC家族基因的表达。
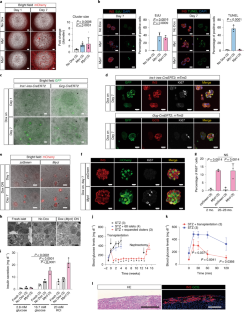
a. E14.5胰腺上皮细胞的scRNA-seq。scRNA-seq数据来自GSE101099.b。Mycl在不同时间点的胚胎胰腺内分泌细胞scRNA-seq分析中的表达。红色条表示平均表达水平。scRNA-seq数据来自GSE115931.c。MyclscRNA-seq分析β-和α-细胞在不同时间点的表达。红色条表示平均表达水平。scRNA-seq数据来自GSE87375.d. ChIP-seq分析胰腺内分泌细胞中H3K27ac。H3K27ac的富集Mycl基因座仅在E17.5位点可见Ins1+细胞。的Chga轨迹显示为对照。ChIP-seq数据来自GSE84324而且GSE110648.e.一代Mycl基因敲除鼠。两个独立的基因畸变Mycl敲除鼠标行(编号56和#949)显示。f.的原位检测Mycl记录。淋巴细胞的Mycl敲除小鼠(没有。949)显示没有检测到Mycl表达式。比例尺:100 μm。g.在P0产生激素的细胞中定量Ki67+细胞比例Mycl敲除小鼠(没有。949)。数据以均数±s.d表示。括号内的数字为所分析小鼠的数量。分析细胞总数为:+/+小鼠INS+细胞963个,GCG+细胞295个;+/-小鼠INS+细胞1028个,GCG+细胞418个;-/-小鼠中INS+细胞769个,GCG+细胞374个。单向方差分析,然后是Tukey-Kramer事后检验。h. IPGTTMycl敲除小鼠(没有。949)在4周大的时候。数据以均数±s.d表示。括号内的数字为所分析小鼠的数量。附注:不显著;双向方差分析,然后是Tukey-Kramer事后检验。
扩展数据图2MYC小鼠的家族基因。
a.具有诱导等位基因的ESCsMYC家族的基因。Dox治疗后ESCs可检测到mCherry信号。比例尺:300 μm。b. qRT-PCR分析MYC家族基因和ESCs中的mCherry。MYCDox处理诱导家族基因和mCherry。数据以三次生物学重复的平均值±标准差表示。将Dox ON细胞的平均表达量设为1。未配对双尾t检验。c.系统性诱导Myc小鼠的表达。Dox在饮用水中给药3天后(2 mg/mL,含蔗糖),mCherry在大多数器官中均有表达。比例尺:1毫米。
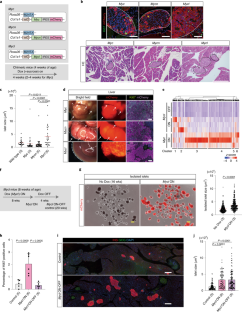
扩展数据图3全身诱导后肿瘤发展MYC小鼠的家族基因。
a.肿瘤在Myc- - -Mycn全身的老鼠。4周大的嵌合小鼠用Dox治疗4周。虚线表示肝脏肿瘤区域。箭头表示肠道肿瘤。Mycl-诱导小鼠的肝脏、肠道、胃、肺或脾脏均未出现肿瘤。比例尺:500 μm,除肠道(200 μm)外。b.诱导小鼠肝脏肿瘤和肠道发育不良的发生率MYC家族基因表达。括号中的数字是被分析的小鼠数量。一些Myc-诱导小鼠在实验结束前被处死,因为其表型高度病态。c.各器官Ki67染色Mycl小鼠(图;2 f).八周大的小鼠服用Dox 8周。mCherry表达式表示Mycl表达的细胞。标尺:100 μm(肺、肝、肾),200 μm(肠)。d.各器官Ki67+细胞比例的定量Mycl在老鼠身上。每个图像的量化显示。数据以均数±s.d表示。括号内的数字为所分析小鼠的数量。被分析的细胞总数为:4,683 (No Dox)和3,881 (MyclON)在肾脏;3,182个(非阿克斯)及2,228个(MyclON)在肝脏;1,966 (No Dox)及1,390 (Mycl在肺里。e.每日腹腔注射Dox (0.2 ml/day;1.0 mg/mL)。f.图中所示聚类的基因本体(GO)术语富集情况。2 e.GO项和p值(费雪精确检验)显示。使用DAVID Bioinformatics Resources (v6.8)进行分析。左图:任意一种诱导后肝组织的RNA-seq分析Mycl或Myc48小时。热图显示了基因表达水平的变化Mycl或Myc诱导(折叠变化>2,P<0.05 [fdr调整Wald检验])。右图:GO术语浓缩指示集群。GO项和p值(费雪精确检验)显示。
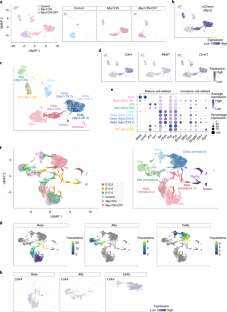
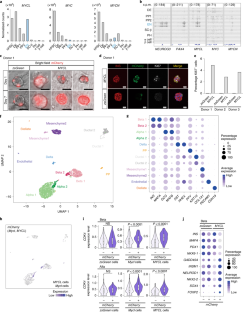
图4小鼠胰岛细胞诱导后的scRNA-seq分析Mycl表达式。
a.成人对照胰腺组织学,Mycl在和Mycl开关老鼠。组织学上均见肿大的胰岛Mycl在和Mycl开关老鼠。b.成人对照组胰岛激素阳性区域比例,Mycl在和Mycl开关老鼠。每只老鼠的量化结果如图所示。数据以均数±s.d表示。括号内的数字为所分析小鼠的数量。经分析的胰岛总数为:52(对照),60 (MyclON), 41 (MyclON-OFF)用于INS和SST表达;48(对照组),58(对照组)MyclON)和55 (MyclON-OFF)用于GCG和PP表达。c.图中UMAP图中各细胞类型代表性标记基因的表达水平和分布。3 c.d.胰岛细胞中细胞周期相关基因表达的点状图。e. RT-qPCR检测术后表达水平改变的代表性基因MyclscRNA-seq分析诱导。从对照中分离出胰岛(无Dox)和Mycl在此分析中使用ON小鼠。数据以三次生物学重复的平均值±标准差表示。括号中的数字是被分析的小鼠数量。的平均表达水平Mycl,Stmn1,到在Mycl在小岛上Mafa对照组胰岛分别设为1。未配对双尾t检验。f.未成熟胰岛细胞相关基因的表达水平和分布。g.常见胰腺祖细胞相关基因的表达水平和分布。
图6小鼠胰岛细胞诱导后的scRNA-seq分析Mycl表达式。
胰岛分离出来的胰岛Mycl-诱导嵌合小鼠(n=2,雄性;阿Dox治疗8周;16周龄)(图;2 f)在三重溶液中分离成单细胞悬浮液。ESCs包含Rosa26-M2rtTA;Col1a1: tetO-Mycl-ires-mCherry与一个Gcg报告细胞被用来生成用于scRNA-seq分析的嵌合小鼠。嵌合小鼠的胰岛含有这两种物质mCherry+Mycl-诱导细胞和非诱导细胞。a. 7001个小鼠胰岛细胞的UMAP可视化Mycl在嵌合小鼠上。一个假定的双态簇被移除。N =4,307个复制1细胞,2,694个复制2细胞。UMAP可视化是彩色的簇识别,并在标记基因表达的基础上进行注释。表达水平和分布mCherry(Mycl)以及每种细胞类型的代表性标记基因。b.左:表达水平及分布Mki67而且到.右图:显示胰岛细胞中细胞周期相关基因表达的点状图。c.各簇中成熟细胞相关基因的表达水平。d.未成熟细胞相关基因在胰岛细胞中的表达点图。
图7诱导后胰岛细胞谱系示踪分析Mycl表达式。
a.结构示意图Gcg靶向等位基因的产生Gcg-CreERT2ESCs。的mTmG含有记者的ESCs被用于定位。b.包含的基因组结构示意图Mycl-诱导等位基因和报告等位基因用于小鼠。c. 7周龄小鼠连续3天注射他莫昔芬(200 mg/kg),并在8周龄时分析报告基因表达。报告者标记细胞只表达INS或GCGIns1-CreERT2;mTmG老鼠和Gcg-CreERT2;mTmG老鼠,分别。α细胞示踪采用注射法获得嵌合小鼠Gcg-CreERT2;mTmG胚胎干细胞进入囊胚。比例尺:20 μm。每个报告者检查4只小鼠。d.期间谱系追踪分析的实验方案示意图Mycl-诱导成年小鼠胰岛细胞的扩张。嵌合小鼠α细胞示踪。e.图中每只小鼠中含有mGFP+细胞的胰岛比例。4 b.数据以均数±s.d表示。括号内的数字为所分析小鼠的数量。f.成熟β细胞谱系示踪分析Mycl在和MyclON-OFF胰岛用于SST和PP表达。比例尺:比例尺:20 μm。g.成熟α-细胞谱系示踪分析Mycl在和MyclON-OFF胰岛用于SST和PP表达。所有α细胞示踪实验均采用嵌合小鼠。比例尺:比例尺:20 μm。h. mGFP+细胞中sst阳性(左)和pp阳性(右)细胞的定量。每只老鼠的量化结果如图所示。数据以均数±s.d表示。括号内的数字为所分析小鼠的数量。mGFP+细胞总数为:208(对照),254(对照)MyclON)和433 (MyclON-OFF)Ins1SST表达报告;205(对照),248 (MyclON)和429 (MyclON-OFF)Ins1PP表达报告;176(对照),891 (MyclON),及1,105 (MyclON-OFF)GcgSST表达报告;203(对照),855 (MyclON),以及1,274 (MyclON-OFF)GcgPP表达报告。
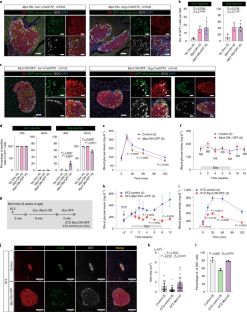
图8诱导后成人胰岛细胞的体外扩增Mcyl表达式。
a.成熟α-细胞的谱系追踪分析Mycl开关小岛。一组α细胞报告者标记细胞不表达GCG或SST。比例尺:大板50 μm,小板20 μm。b.左:表达水平及分布Arx在UMAP图上。右:表达水平Arx在α肽。白框中的黑条表示中位表达水平。白色条形和线条分别表示IQR和上下相邻值(±1.5 IQR)。Wilcoxon秩和检验。c.诱导期间及诱导后小鼠体重Mycl表达式。数据以均数±s.d表示。括号内的数字表示所分析的小鼠数量。附注:不显著;单向方差分析和Holm-Sidak事后检验。d.诱导后的胰岛细胞群Myc或Mycl表达式。第7天mCherry+集群扩展。没有阿霉素:Mycl-诱导胰岛不经Dox治疗。比例尺:50 μm。N =10只小鼠接受检查。e.两种诱导后7天,INS+细胞中Ki67+和裂解的caspase 3+细胞Myc或Mycl开始。没有阿霉素:Mycl-诱导胰岛不经Dox治疗。比例尺:20 μm。每只小鼠中Ki67+和cleaved caspase 3+细胞比例相对于INS+细胞数量的定量显示。数据以均数±s.d表示。括号内的数字为所分析小鼠的数量。被分析的INS+细胞总数为:1185 (No Dox), 1001 (No Dox)Myc-诱导),以及1566 (Mycl-诱导)用于Ki67分析;1,176 (No Dox), 1,246 (Myc-诱导),以及1168 (Mycl-诱导)用于cleaved caspase 3分析。单向方差分析,然后是Tukey-Kramer事后检验。f.左:结构示意图Ins1针对等位基因的生成Ins1-ires-CreERT2等位基因。右图:β细胞标记Ins1-ires-CreERT2;mTmG嵌合体小鼠。注意,mGFP+细胞只表达INS。比例尺:20 μm。N =4只小鼠进行检查。g.体外谱系追踪分析方案的示意图。嵌合小鼠用于体外谱系追踪分析。h.成熟β-和α-细胞的谱系追踪分析。mGFP+细胞在诱导后只表达原激素Mycl体外。比例尺:20 μm。每次示踪分析检查4只小鼠。
图9功能胰岛细胞体外扩增。
a.成熟α-细胞移植到肾脏后7天的谱系追踪分析Mycl-诱导胰岛细胞簇扩增7天。N =4只实验小鼠。b.体外反复传代胰岛簇细胞。扩展的胰岛簇在分离后呈小簇传代,并在第二次传代后继续扩张,但在第4次传代后扩张不明显。比例尺:50 μm。N =3只实验小鼠。c.诱导后的胰岛细胞群MyclRPMI 1640 (D-glucose;2.0 g/L),加入10% FBS。即使在低葡萄糖培养基中也能观察到mCherry+细胞的扩增。比例尺:300 μm。N =4只实验小鼠。d.含有a的慢病毒的基因组结构示意图Mycl诱导系统。e.慢病毒介导的诱导的实验方案示意图Mycl离体老年小鼠胰岛细胞的表达。f.评估胰岛素分泌的实验方案示意图。g.切除肾脏的组织学。移植细胞包括INS+和SST+细胞。比例尺:300 μm。N =3只实验小鼠。
图10人胰岛细胞诱导后的scRNA-seq分析MYCL表达式。
a.慢病毒介导的诱导的实验方案示意图MYCL在人尸体胰岛细胞体外。b. mCherry (MYCL)+供体2和3的胰岛细胞,显示Ki67染色。比例尺:20 μm。分析细胞数如图所示。6 e.c.诱导后人体尸体胰岛细胞的UMAP可视化MYCL,Mycl,或zsGreenDR表达式。一个假定的双态簇被移除。n = 816MYCL诱导细胞,1110Mycl-诱导细胞和962zsGreenDR全身的细胞。d.的表达水平和分布mCherry每一个转基因。e.胰腺细胞类型代表性标记基因的表达水平及分布。
补充信息
图1 .源数据扩展数据
扩展数据图1e中未裁剪的凝胶扫描图。
权利和权限
关于本文
引用本文
平野,M, So, Y, Tsunekawa, S。et al。MYCL-介导的重编程扩大胰腺胰岛素生产细胞。Nat金属底座4, 254-268(2022)。https://doi.org/10.1038/s42255-022-00530-y
收到了:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s42255-022-00530-y
