摘要gydF4y2Ba
细胞表面表达的接触蛋白1和神经束蛋白155控制神经系统的布线,并在细胞间相互作用,形成和维持副神经节髓鞘-轴突连接。接触蛋白1 -神经束蛋白155粘连复合物形成的分子机制尚不清楚。这里展示的复杂和个体接触蛋白1和神经束蛋白155结合区域的晶体结构提供了一个丰富的画面,展示了竞争和互补界面、翻译后糖基化、剪接差异和结构可塑性是如何形成不同的粘附位点的。结构、生物物理和细胞聚类分析揭示了保守的Ig1-2界面如何形成竞争性的异亲性接触蛋白1-神经束蛋白155和亲同性神经束蛋白155复合物,而接触蛋白1如何通过Ig3-6界面形成低亲和簇。这些结构解释了接触蛋白1-神经束蛋白155复合体中的异亲性Ig1-Ig4马蹄形结构域如何定义7.4 nm的旁神经间隙,以及其余六个结构域如何实现不同细胞间距离的桥接。gydF4y2Ba
介绍gydF4y2Ba
免疫球蛋白样细胞粘附分子(IgCAM)家族通过提供细胞识别、机械支持和促进细胞间粘附位点的膜微域组装,对多细胞结构进行功能调控gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba。两个IgCAM亚家族,接触蛋白和L1,在组织的发育和功能中起作用gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba尤其是神经系统gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba通过控制神经突延伸、轴突引导、突触形成、髓鞘形成和轴胶质结构域组装的过程gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba。许多这些过程的基础是接触蛋白和L1家族蛋白之间和内部的低聚物和复合物的形成gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba。接触蛋白1和神经束蛋白155是这两个亚类的例证,它们一起在髓鞘-轴突旁极形成嗜异性的粘附复合物gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba还有神经元突触gydF4y2Ba15gydF4y2Ba。接触蛋白和L1亚家族的功能障碍与学习和记忆调节缺陷、广泛的神经精神诊断、神经发育障碍、癌症、神经退行性疾病和神经病变有关gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba。接触蛋白1和神经束蛋白在各种脱髓鞘性神经病变、神经退行性疾病(包括阿尔茨海默氏症和帕金森病)和癌症的病因学中发挥着重要作用gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba。gydF4y2Ba
Contactin 1(糖蛋白gp135,鸡F11,小鼠F3)和其他5个类似蛋白(Contactin 2-6)构成IgCAM家族的脊椎动物接触蛋白亚家族gydF4y2Ba20.gydF4y2Ba。定义亚家族的特征是细胞外6个n端免疫球蛋白样结构域(Ig), 4个纤维连接蛋白III型结构域(FnIII)和翻译后修饰,即多个位点的n糖基化和c端糖磷脂酰肌醇(GPI)膜锚定。一到四个含域接触片段的晶体结构表明,前四个域形成一个具有多功能结合能力的马蹄形超模gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2BaIg5-FnIII2结构域以扩展的头尾构象排列,FnIII2-3连接是弯曲的gydF4y2Ba25gydF4y2Ba。膜锚定或可溶性形式的接触在组织中表达,在神经系统中表达最强gydF4y2Ba3.gydF4y2Ba。接触蛋白对神经元发育和体内平衡至关重要gydF4y2Ba16gydF4y2Ba通过无处不在的相互作用发挥作用,可以是同性的,也可以是异性恋的gydF4y2Ba独联体gydF4y2Ba或gydF4y2Ba反式gydF4y2Ba8gydF4y2Ba。来自接触蛋白相关蛋白(caspr)、受体酪氨酸磷酸酶(PTPR)、β淀粉样蛋白前体蛋白(APP)、notch和L1信号蛋白家族的蛋白质与接触蛋白相互作用gydF4y2Ba8gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba26gydF4y2Ba。接触蛋白1 -神经束蛋白155gydF4y2Ba反式gydF4y2Ba相互作用是正确的副阳极形成和维持所必需的,是记录最好的相互作用之一,具有强大的细胞水平数据,支持这些分子在这种情况下的伴随作用gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba。gydF4y2Ba
神经束蛋白和其他三个类似物(L1、CHL1和NrCam)构成了igcam的脊椎动物L1亚家族gydF4y2Ba7gydF4y2Ba它在神经系统发育和体内平衡中起着重要作用gydF4y2Ba6gydF4y2Ba。所有四个成员都是I型跨膜蛋白,具有6个细胞外n端Ig样结构域,3到5个FnIII结构域,各种预测的n糖基化位点,单个跨膜跨越螺旋和agydF4y2Ba∼gydF4y2Ba120细胞质区域具有高度保守的锚蛋白结合序列gydF4y2Ba4gydF4y2Ba。该亚家族唯一可用的结构是神经束蛋白Ig1-Ig4,它显示出与接触相似的特征,具有位于Ig1-Ig2上的保守同源二聚化界面的马蹄形超模gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba。神经束蛋白由50多种可能的剪接变体组成gydF4y2Ba32gydF4y2Ba在细胞外和细胞质位点,具有与其选择性生物学功能密切相关的严格调控的表达模式gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba。两种亚型,神经束蛋白155和神经束蛋白186,主要在成熟的神经系统中表达。通常被称为“胶质”和“轴突”亚型,由于它们的细胞类型特异性表达,它们都在髓鞘形成中起关键作用gydF4y2Ba11gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba。gydF4y2Ba
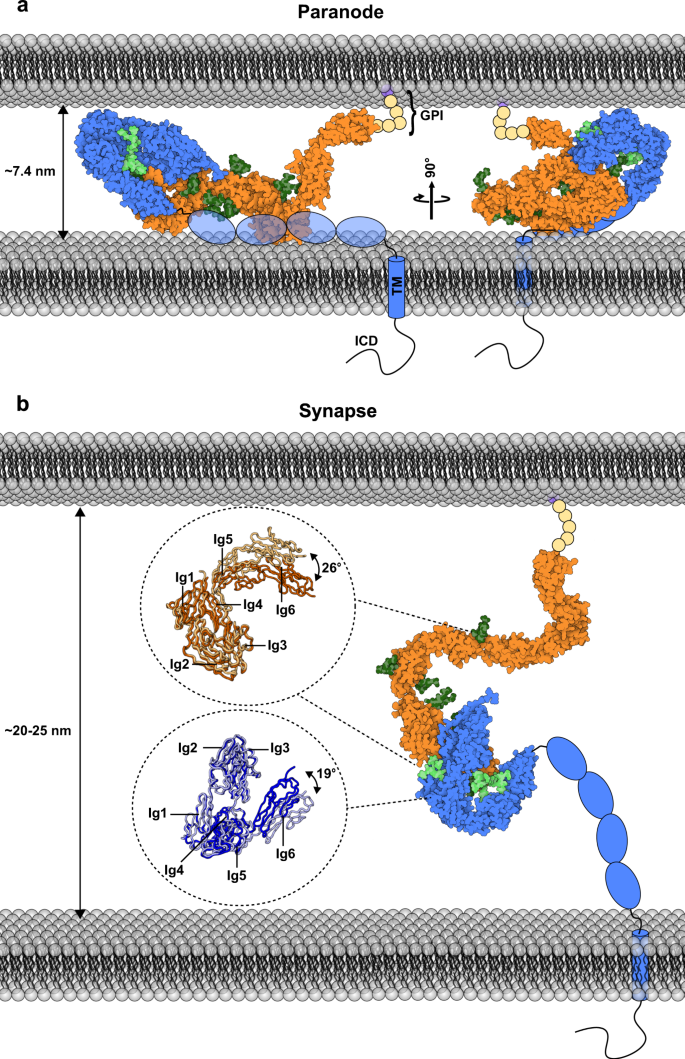
偏执狂位于Ranvier淋巴结两侧,由远端未紧致的髓磷脂环形成,这些髓磷脂环在7.4 nm的紧密连接处与轴突接触gydF4y2Ba37gydF4y2Ba。接触蛋白1 -神经束蛋白155gydF4y2Ba反式gydF4y2Ba复合体和caspr1是这些结构形成和维持所必需的,它们作为分子尺子维持相当窄的细胞间距gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba。这种三元复合物在轴突周围形成一个更大的螺旋结构,作为膜扩散屏障,这表明在失去这三种成分中的任何一种时,观察到的副神经节附着和轴突区隔的丧失gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba。最近的研究强调了这种屏障的重要性,因为它作为正确动作电位传播的不完全导电密封gydF4y2Ba38gydF4y2Ba在学习过程中,它所创造的边界会随着时间的推移而动态地改变,从而显著地显示出可塑性gydF4y2Ba39gydF4y2Ba。有趣的是,接触蛋白1和神经束蛋白155也在突触上相互作用gydF4y2Ba15gydF4y2Ba细胞间距离大得多,约为20 - 25nmgydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba。gydF4y2Ba
而接触蛋白1 -神经束蛋白155gydF4y2Ba反式gydF4y2Ba许多接触蛋白和L1家族成员在淋巴结、旁淋巴结旁和沿有髓鞘轴突建立邻近分子结构域的节间区域定位并密切相互作用gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba。在这种情况下,这些同源分子如何保持相互作用的特异性是非常有趣的,因为它们之间具有高度同一性。似乎这个问题的一部分可以通过同工异构体和糖异构体的作用来回答,它们似乎调节相互作用的强度。对于接触蛋白1 -神经束蛋白的相互作用,接触蛋白1的n -链糖基化gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba神经束蛋白的剪接gydF4y2Ba14gydF4y2Ba据报道可以调节两个分子之间的相互作用。在缺乏接触蛋白1 -神经束蛋白155复合物的结构信息的情况下,其相互作用模式、粘附机制、决定特异性的参数以及同种异构体和糖基化的作用仍未得到解决。此外,虽然碎片接触gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba和L1亚族gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba蛋白质已经了解了其功能的结构基础,但亲异性复合物如何形成及其可能的化学计量尚未阐明。gydF4y2Ba
为了解决这些问题,我们对接触蛋白1和神经束蛋白155的相互作用区域,即Ig1-Ig6进行了结构表征,单独和复杂。我们发现这两种蛋白都具有Ig1-Ig4特有的马蹄形褶皱,并且与接触蛋白1和神经束蛋白155相比,Ig5与Ig4有明显的联系。两个分子上Ig1-2的保守表面在复合物形成中起重要作用。几种n -链聚糖参与复合物的分子间相互作用,它们在神经束蛋白155上的组成影响相互作用的亲和力。由于相互作用位点重叠,神经束蛋白155同二聚体的形成和接触蛋白1 -神经束蛋白155异络合物的形成是相互排斥的。基于结构的见解通过阻止接触蛋白1 -神经束蛋白155介导的细胞聚集的突变得到验证。接触蛋白1在晶体中形成一个更大的拉链,在溶液中也形成,神经束蛋白155的结合位点暴露在这个低聚物中。SAXS分析表明,接触1全外畴(fe)被拉长,具有一定的柔韧性。总之,我们的数据表明,接触1 -神经束蛋白155中的Ig1-Ig4相互作用的马蹄形决定了旁神经间隙,并且更长的Ig5-FnIII-4尾巴可以用来跨越神经元突触中遇到的更大的细胞间隙。gydF4y2Ba
结果gydF4y2Ba
Contactin 1gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2BaIg1-Ig2结构域介导的复合物gydF4y2Ba
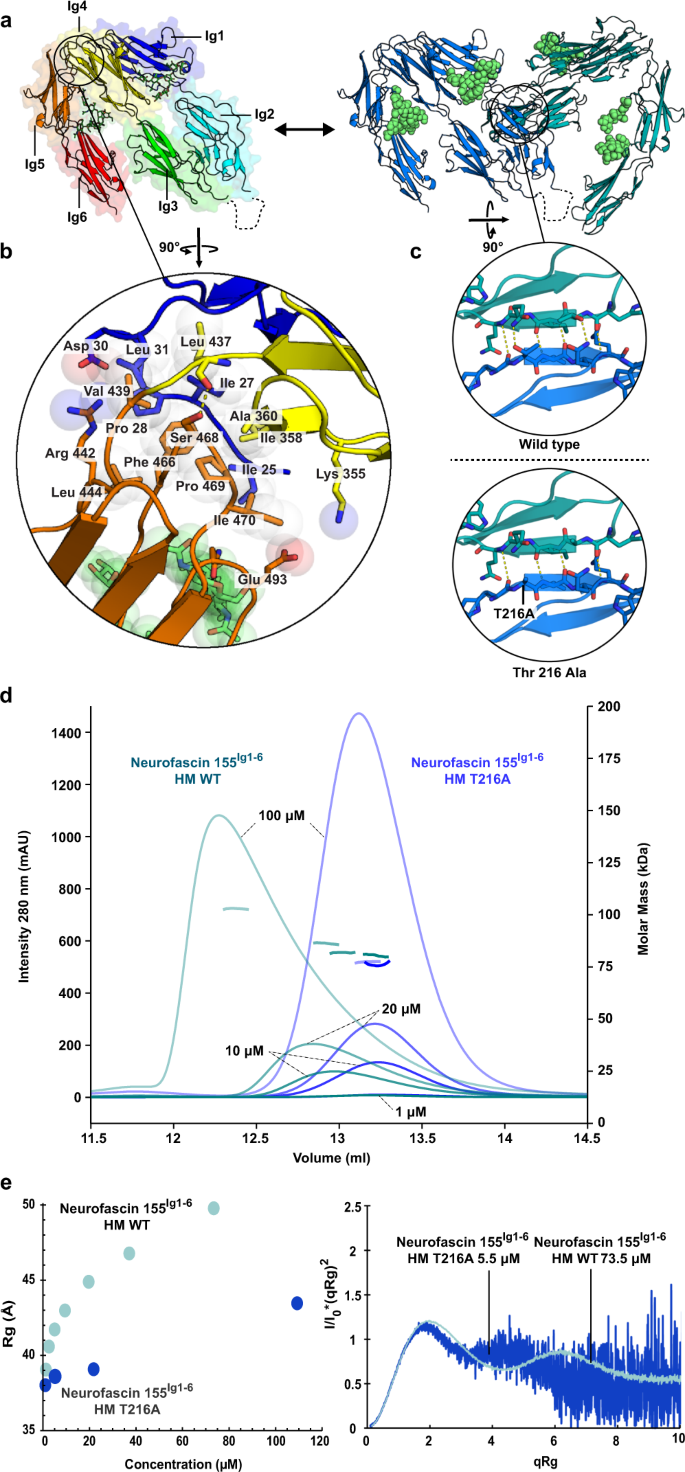
功能分析已经确定了接触蛋白1和神经束蛋白155的六个ig结构域作为介导反式相互作用的细胞外区域gydF4y2Ba14gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba。我们确定了接触1的直接相互作用gydF4y2BaIg1-6gydF4y2Ba用神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba与一个gydF4y2BaKgydF4y2BaDgydF4y2Ba0.22µM(图2)gydF4y2Ba1 a, bgydF4y2Ba及补充图gydF4y2Ba1gydF4y2Ba)。接下来,我们确定了糖基化接触蛋白1的结构gydF4y2BaIg1-6gydF4y2Ba与神经束蛋白结合gydF4y2BaIg1-6gydF4y2Ba从各向异性衍射到8-4.8 Å的晶体(PDB:7OL4)(图2)。gydF4y2Ba1、汉英gydF4y2Ba和表gydF4y2Ba1gydF4y2Ba)。低分辨率配合物的结构确定由非配位接触的结构辅助gydF4y2BaIg1-6gydF4y2Ba(PDB:7OL2)和神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba(PDB:7OK5),我们确定的分辨率分别为3.9和3.0 Å。接触1的Ig1-Ig4马蹄形gydF4y2BaIg1-6gydF4y2Ba神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba在一个接近正交的方向上相互作用,每个使用Ig2结构域侧的大部分进行相互作用(图2)。gydF4y2Ba1汉英gydF4y2Ba,补充图gydF4y2Ba2gydF4y2Ba,以及辅助电影gydF4y2Ba1gydF4y2Ba)。在异质络合物的中心,分子间的“超级”β-片是由位于两个分子的Ig2 GFC β-片上的外部G β-链的反平行氢键形成的。gydF4y2Ba2gydF4y2Ba)。在“底部”,超级β片形成一个凹的半桶状,由两个分子的Ig2 CD环封闭,其特点是在核心处有广泛的疏水接触(图2)。gydF4y2Ba1 egydF4y2Ba及补充图gydF4y2Ba2gydF4y2Ba)。在“上方”,分子间的相互作用不太突出。在这里,两个分子的Ig1 AB环接触由Ig2 n端和G β-链形成的相反的Ig2结构域的边缘。gydF4y2Ba2gydF4y2Ba)。在超级β片的两侧形成了分子内盐桥。总的来说,接触蛋白1 -神经束蛋白155复合物埋葬了~2089 ÅgydF4y2Ba2gydF4y2Ba溶剂可及面积gydF4y2Ba47gydF4y2Ba界面为混合疏水亲水性,具有互补的静电相互作用(图2)。gydF4y2Ba1 egydF4y2Ba)。gydF4y2Ba
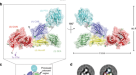
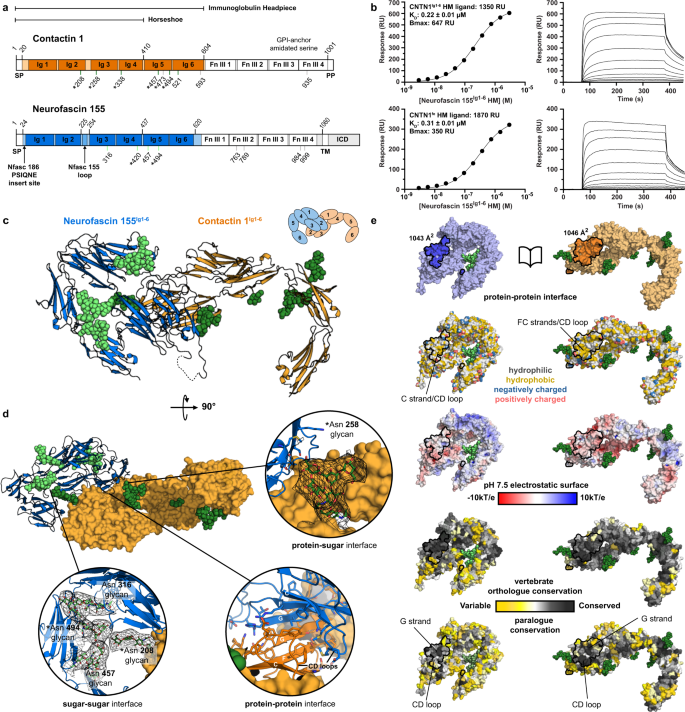
一个gydF4y2Ba接触蛋白1和神经束蛋白155的序列示意图。免疫球蛋白样结构域(Ig)和纤维连接蛋白III型结构域(FnIII)用结构域边界(顶线)表示,结晶的Ig片段用颜色表示。n -糖基化位点(底线)由结构(绿色)确认,预测(灰色),并在同源保守分析中高度保守(*)。信号肽(SP)、前肽(PP)、跨膜结构域(TM)、糖磷脂酰肌醇(GPI)锚点和细胞内结构域(ICD)也被指出。Neurofascin (Nfasc)。gydF4y2BabgydF4y2Ba神经束蛋白表面等离子体共振成像相互作用数据[j]gydF4y2BaIg1-6gydF4y2Ba含有高甘露糖聚糖(HM)与接触蛋白1gydF4y2BaIg1-6gydF4y2BaHM(上)或contact 1gydF4y2Ba菲gydF4y2BaHM(底部)配体。平衡结合数据与分析物浓度的关系,左图为1:1 Langmuir结合模型,右图为相关SPR传感器图。神经束蛋白的亲和力gydF4y2BaIg1-6gydF4y2Ba到联系人1gydF4y2BaIg1-6gydF4y2Ba(上)和接触1gydF4y2Ba菲gydF4y2Ba(下)是相似的。连接蛋白1 (CNTN1),结构域Ig1至Ig6 (Ig1 - 6),全外结构域(fe),最大分析物结合(gydF4y2BaBgydF4y2Ba马克斯gydF4y2Ba)、响应单位(RU)。gydF4y2BacgydF4y2Ba接触的卡通表示1gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba复杂的结构,具有聚糖残基(球体),缺失的环段(虚线)和表示组成的示意图。界面位于两种分子的Ig1和2结构域上。gydF4y2BadgydF4y2Ba联系人的旋转视图1gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba具有接触的复杂结构gydF4y2BaIg1-6gydF4y2Ba在表面表示中。插图显示了聚糖密度(2mF)的不同界面gydF4y2Ba奥林匹克广播服务公司gydF4y2BadfgydF4y2BacalcgydF4y2Ba)在1σ处,如黑色网格所示。gydF4y2BaegydF4y2Ba打开书本表示接触1gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba复杂的表面表示,根据不同的属性着色,并与交互表面概述。界面是相对保守的,表明在粘附中起作用。源数据作为源数据文件提供。gydF4y2Ba
接触蛋白1 -神经束蛋白155的相互作用模式在马蹄铁介导的粘附机制中是保守的gydF4y2Ba
Ig1-Ig2介导的接触蛋白1和神经束蛋白155的相互作用模式类似于先前报道的平行接触蛋白2gydF4y2Ba22gydF4y2Ba和L1gydF4y2Ba22gydF4y2Ba,gydF4y2Ba30.gydF4y2Bag-马蹄形同源二聚化模式。这表明二聚化和亲异络合物形成之间可能存在进化关系,并且这些分子亚群中可能存在粘附的保守机制(图2)。gydF4y2Ba1 egydF4y2Ba及补充图gydF4y2Ba2gydF4y2Ba)。接触蛋白1 -神经筋膜蛋白155相互作用界面在脊椎动物同源物中是保守的,这表明我们在复杂结构中发现的界面特征可能对接触蛋白1 -神经筋膜蛋白155介导的相互作用至关重要。gydF4y2Ba1 egydF4y2Ba)。特别是,在同源物中观察到的β-链G和C、CD环残基和特定n -糖基化位点的高度保守性表明,这些特征与异亲性相互作用有关。为了剖析接触蛋白和L1蛋白成员的更大子集共同的相互作用的共同特征,我们还研究了旁系间的保护。绘制L1指定的旁系,即L1、CHL1、NrCAM和神经束蛋白在神经束蛋白155上的守恒图gydF4y2BaIg1-6gydF4y2Ba我们发现G β-链残基非常保守,但C β-链和CD环残基的保守性较低(图2)。gydF4y2Ba1 egydF4y2Ba)。对于接触蛋白,我们绘制了与接触蛋白1和接触蛋白2的相似的保守性,因为对整个家族的初步保守性分析发现了可能与接触蛋白家族结合受体酪氨酸磷酸酶的功能有关的保守热点gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba。该分析显示,在界面区域外整体守恒性降低的背景下,FC链和CD环残基守恒性较低,G链残基守恒性较低(图2)。gydF4y2Ba1 egydF4y2Ba)。综上所述,在接触中残基的直同源和旁同源之间的守恒gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba界面提示该位点可能在这些家族的粘附机制中起作用。gydF4y2Ba
神经束蛋白上富含甘露糖的聚糖gydF4y2BaIg1-6gydF4y2Ba稳定与联系人1的交互gydF4y2Ba
接触蛋白1的n -糖基化已被证明可调节与神经束蛋白的结合gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,含有富含甘露糖聚糖的接触蛋白1可能是旁腺粘连的相关形式gydF4y2Ba48gydF4y2Ba。为了确定结构,我们制作了富含甘露糖的n链聚糖版本,并在结合实验中对富含甘露糖和复杂聚糖的蛋白质进行了探测(图2)。gydF4y2Ba1 bgydF4y2Ba及补充图gydF4y2Ba1gydF4y2Ba)。在联系人1gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba在Ig2上的Asn 208和Ig3上的Asn258的保守的接触蛋白1糖基化位点上,一个复杂的富含甘露糖的聚糖支撑了主要的蛋白质-蛋白质界面,并可能分别形成分子间聚糖-聚糖和聚糖-蛋白质界面(图2)。gydF4y2Ba1 dgydF4y2Ba)。接触蛋白1 Asn208上的聚糖靠近神经束蛋白155的Ig2,而接触蛋白Asn258上的聚糖延伸到神经束蛋白155的Ig5上的Asn457和Asn494上的聚糖附近。这些额外的聚糖介导的界面可以扩展或更重要的是,在空间上阻碍蛋白质-蛋白质界面,这取决于聚糖的组成(图2)。gydF4y2Ba1 dgydF4y2Ba及辅助电影gydF4y2Ba1gydF4y2Ba)。我们没有观察到神经束蛋白155的明显差异gydF4y2BaIg1-6gydF4y2Ba与接触蛋白1免疫球蛋白或含有富含甘露糖聚糖的全外结构域(fe)段的相互作用亲和力(图2)。gydF4y2Ba1 bgydF4y2Ba及补充图gydF4y2Ba1模拟gydF4y2Ba)。接触蛋白1与神经束蛋白的相互作用gydF4y2BaIg1-6gydF4y2Ba含有甘露糖的多糖比神经束蛋白155更强gydF4y2BaIg1-6gydF4y2Ba含有复合聚糖,尽管我们还没有量化结合亲和力的差异(补充图2)。gydF4y2Ba1比gydF4y2Ba)。可能神经束蛋白155的Ig5上的聚糖(其中Asn494是保守的)以及与接触蛋白1的Asn258上的聚糖的界面在调节亲和力方面发挥了作用(图2)。gydF4y2Ba1 dgydF4y2Ba)。gydF4y2Ba
Neurofascin 155gydF4y2BaIg1-6gydF4y2Ba有一个独特的由n端稳定的锄形结构吗gydF4y2Ba
非配体神经束蛋白6个Ig结构域的构象[j]gydF4y2BaIg1-6gydF4y2Ba,确定到最大分辨率为3 Å (PDB:7OK5)(图2)。gydF4y2Ba2gydF4y2Ba和表gydF4y2Ba1gydF4y2Ba),与神经束蛋白155相似gydF4y2BaIg1-6gydF4y2Ba绑定联系人1gydF4y2BaIg1-6gydF4y2Ba。神经束蛋白的前四个域gydF4y2BaIg1-6gydF4y2Ba显示一个特征的马蹄形排列,其中Ig1接触Ig4, Ig2以反平行方式接触Ig3,通过在Ig2 - Ig3单元连接环路中180°转弯实现。正如预期的那样,Ig1-Ig4的这种马蹄形排列与报道的神经束蛋白186的排列几乎相同gydF4y2BaIg1-4gydF4y2Ba(PDB: 3 p3y)gydF4y2Ba30.gydF4y2BaCα rr = 0.83 Å。在神经束蛋白155中,存在于Ig2-Ig3单元结构域之间的18个残基剪接插入,但在神经束蛋白186中不存在,由于这种扩展环的灵活性,在神经束蛋白155中,这在很大程度上是未解决的。gydF4y2Ba1gydF4y2Ba和gydF4y2Ba2gydF4y2Ba)。结构域Ig5和Ig6首尾相连相互作用,并与Ig3-Ig4一起形成v型转弯,使分子具有独特的花园锄状结构。在这里,马蹄铁回想起工具的刀片,Ig5-Ig6是手柄(图5)。gydF4y2Ba2 a, bgydF4y2Ba及辅助电影gydF4y2Ba2gydF4y2Ba)。在V-turn的Ig4-Ig5尖端,神经束蛋白155 n端残基23-31楔入这些结构域之间,并与两者密切相互作用(图2)。gydF4y2Ba2 a, bgydF4y2Ba及补充图gydF4y2Ba3gydF4y2Ba)。Ig4 - Ig5介导的V-turn被广泛的疏水相互作用所稳定,其中Ig5的中心Phe466被n端的Ile25、Ile27、Pro28和Leu31, Ig4的Ile358和Leu437以及Ig5的Val439、Leu444和Ile 470所包围(图4)。gydF4y2Ba2 a, bgydF4y2Ba及补充图gydF4y2Ba3gydF4y2Ba)。此外,Asp30与Arg442的侧链和Lys355与Glu493的侧链形成了夹在界面上的两个盐桥。参与n端、Ig4和Ig5相互作用的残基的守恒表明,Ig4和Ig5的V-turn结构是L1家族成员的共同特征。gydF4y2Ba3gydF4y2Ba)。有趣的是,L1和神经束蛋白186分别插入5个和6个残基的n端,可能会潜在地影响整体结构(补充图2)。gydF4y2Ba3gydF4y2Ba)。gydF4y2Ba
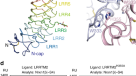
一个gydF4y2BaNeurofascin 155gydF4y2BaIg1-6gydF4y2Ba单体(区域彩虹色)和神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba二聚体(由链着色)与聚糖显示为球体(石灰)。单体呈锄头状,其中Ig1-Ig4的马蹄形代表“叶片”,Ig5和Ig6结构域相对于Ig3-Ig4呈v型旋转,代表“手柄”。Neurofascin 155gydF4y2BaIg1-6gydF4y2Ba使用与接触1中类似的接口进行二聚gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba复杂。gydF4y2BabgydF4y2Ba神经束蛋白155 n端和Ig 1、4和5的界面相互作用是特征结构的基础。n端位于Ig结构域4和5之间。gydF4y2BacgydF4y2BaNeurofascin 155gydF4y2BaIg1-6gydF4y2Ba二聚化位点与wt和模型Thr279Ala突变体相同。gydF4y2BadgydF4y2BaNeurofascin 155gydF4y2BaIg1-6gydF4y2BaSEC-MALS分析显示,该突变体破坏了二聚化(另见补充表)gydF4y2Ba1gydF4y2Ba)。显示注射时的蛋白质浓度。gydF4y2BaegydF4y2BaNeurofascin 155gydF4y2BaIg1-6gydF4y2Bawt和Thr279Ala突变体批次SAXS分析,Rg变化由浓度(左)和特征Kratky图(右)绘制。SAXS数据显示神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba是一种包含柔性区域的多结构域蛋白。Thr279Ala突变破坏了神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba二聚化由Rg与浓度决定(另见补充表)gydF4y2Ba2gydF4y2Ba)。结构域Ig1至Ig6 (Ig1 - 6)、全外结构域(fe)、高甘露糖聚糖(HM)、复合聚糖(CG)、野生型(WT)、Thr216Ala突变体(T216A)、毫吸收单位(mAU)。源数据作为源数据文件提供。gydF4y2Ba
神经束蛋白155的同二聚化界面与接触蛋白1结合位点重叠gydF4y2Ba
在非配体形式下,神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba形成同二聚体(图2)。gydF4y2Ba2gydF4y2Ba及辅助电影gydF4y2Ba2gydF4y2Ba)。二聚化界面与接触蛋白1的结合位点重叠,提示神经束蛋白155二聚化与接触蛋白1结合之间可能存在竞争。gydF4y2Ba2gydF4y2Ba)。神经束蛋白的组织gydF4y2BaIg1-6gydF4y2Ba同型二聚体与接触体1相似gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba复杂的除了一个神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba同型二聚体分子被一个接触1取代gydF4y2BaIg1-6gydF4y2Ba分子(补充图)gydF4y2Ba2gydF4y2Ba)。此外,神经束蛋白为155gydF4y2BaIg1-6gydF4y2Ba二聚体与先前描述的神经束蛋白186几乎相同gydF4y2BaIg1-4gydF4y2Ba二聚体gydF4y2Ba30.gydF4y2Ba,仅在Ig1 EF和AB环的构象上略有不同,这些环扩展了相对分子之间的接触(补充图)。gydF4y2Ba2gydF4y2Ba)。在神经束蛋白155同二聚化界面的中心,由Ig2结构域和较少的Ig1贡献建立,通过连接两个Ig2结构域的G β-链形成一个超级β片。在神经束蛋白155中,超级β片“底部”的疏水界面更小gydF4y2BaIg1-6gydF4y2Ba同型二聚体与亲异性络合物相比,由于在接触上有更大的疏水区域1(补充图1)。gydF4y2Ba2gydF4y2Ba)。神经束蛋白的同二聚化界面gydF4y2BaIg1-6gydF4y2Babury ~1700 ÅgydF4y2Ba2gydF4y2Ba溶剂的可及面积,略小于2089 ÅgydF4y2Ba2gydF4y2Ba埋藏在触点1中gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba复杂。Neurofascin 155gydF4y2BaIg1-6gydF4y2Ba在多角度光散射(SEC-MALS)的粒径排除色谱中,通过浓度依赖的峰移和分子量增加来评估溶液中的二聚体,在SAXS分析中,随着浓度的增加,粒径也在增加(图6)。gydF4y2Ba2 d, egydF4y2Ba及补充表格gydF4y2Ba1gydF4y2Ba和gydF4y2Ba2gydF4y2Ba)。与晶体学观察一致,n -糖基化的类型不影响这一过程(补充图2)。gydF4y2Ba3 dgydF4y2Ba)。Neurofascin 155gydF4y2BaIg1-6gydF4y2Ba据报道,一种破坏神经束蛋白186的Thr216Ala突变大大减少了二聚化gydF4y2BaIg1-4gydF4y2Ba二聚gydF4y2Ba30.gydF4y2Ba通过阻止Ig2的G β-链中的两个分子间氢键形成(图2)。gydF4y2Ba2摄氏度gydF4y2Ba)。在SEC-MALS分析中,Thr216Ala突变体没有发生浓度依赖的峰移,也没有分子量的增加(图2)。gydF4y2Ba二维gydF4y2Ba及补充表gydF4y2Ba1gydF4y2Ba)表明二聚化被破坏。旋转半径随浓度的增加(gydF4y2BaRgydF4y2Bag)在SAXS中被Thr216Ala突变减少,尽管没有完全消除(图2)。gydF4y2Ba2 egydF4y2Ba及补充表gydF4y2Ba2gydF4y2Ba)。野生型神经束蛋白155的浓度依赖性二聚化现象gydF4y2BaIg1-6gydF4y2Ba在SEC-MALS和SAXSgydF4y2BaRgydF4y2Ba在5 μM以下,以单体蛋白为主,表明agydF4y2BaKgydF4y2BaDgydF4y2Ba~5 ~ 30µM范围内二聚化的影响(图2)gydF4y2Ba2 d, egydF4y2Ba),比接触弱得多gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba亲和力为0.22µM(图2)。gydF4y2Ba1 bgydF4y2Ba及补充图gydF4y2Ba1 a, bgydF4y2Ba)。gydF4y2Ba
Neurofascin 155gydF4y2BaIg1-6gydF4y2Ba具有构象可塑性gydF4y2Ba
4个独立神经束蛋白155的存在gydF4y2BaIg1-6gydF4y2Ba分子,两个在接触1中gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba晶体和两个神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba晶体,允许比较构象(补充图2)。gydF4y2Ba3 bgydF4y2Ba)。这表明神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba具有Ig2-Ig3单元和Ig5-Ig6片段的构象可塑性,可以用两种铰接运动来描述。Ig2-Ig3单元组合通过17°旋转与Ig1 - Ig4连接,使Ig1 - Ig4的马蹄形平面弯曲。尽管n端具有稳定作用,Ig5-Ig6组合通过Ig4-Ig5连接处的19°铰链平行于Ig1-Ig4的马蹄形摆动。n -链聚糖可能在神经束蛋白的结构可塑性中起结构作用gydF4y2BaIg1-6gydF4y2Ba。Asn残基316,457和494的聚糖并列在Ig1-Ig4马蹄形和Ig5-Ig6组合之间的空间中。gydF4y2Ba3 cgydF4y2Ba),并可根据聚糖组成限制Ig4-Ig5之间的屈曲。此外,Ig4的Asn420上的聚糖与Ig1上的残基相互作用并扩展Ig1 - Ig4界面gydF4y2Ba30.gydF4y2Ba(补充图。gydF4y2Ba3 cgydF4y2Ba)。神经束蛋白的可塑性观察[j]gydF4y2BaIg1-6gydF4y2Ba晶体结构,与SAXS测量结果一致,其中二聚体和单体神经束蛋白的归一化Kratky图155gydF4y2BaIg1-6gydF4y2Ba具有双峰和非锥形的形状,这是包含柔性区域的多结构域蛋白所期望的(图2)。gydF4y2Ba二维gydF4y2Ba)。结构可塑性似乎与两种神经束蛋白都没有关联gydF4y2BaIg1-6gydF4y2Ba二聚化或与接触gydF4y2BaIg1-6gydF4y2Ba复杂构象是指没有构象在结构上相互阻碍。最有可能的是,可塑性是神经束蛋白155的内在特性,是其作为粘附蛋白的功能所必需的。gydF4y2Ba
Contactin 1gydF4y2BaIg1-6gydF4y2Ba有一个独特的镰刀状结构,在Ig4-Ig5连接处铰链gydF4y2Ba
在无配体接触的结构中gydF4y2BaIg1-6gydF4y2Ba,最大分辨率为3.9 Å (PDB:7OL2),前4个Ig结构域采用典型的马蹄形构象(图2)。gydF4y2Ba3gydF4y2Ba)。Ig5-Ig6的组合方向远离,但与Ig1-Ig4的马蹄形呈弧形结构,使分子呈镰刀状,Ig1-Ig4形成“柄”,Ig5-Ig6形成弧形“刃”。gydF4y2Ba3gydF4y2Ba及辅助电影gydF4y2Ba3.gydF4y2Ba)。总的来说,接触的域取向1gydF4y2BaIg1-6gydF4y2Ba数据集中的链之间非常相似,然而,两种非配体接触的比较1gydF4y2BaIg1-6gydF4y2Ba结构与两个神经束蛋白155gydF4y2BaIg1-6gydF4y2Babound显示Ig4-Ig5连接中有一个26°铰链(补充图2)。gydF4y2Ba4 bgydF4y2Ba)。gydF4y2Ba
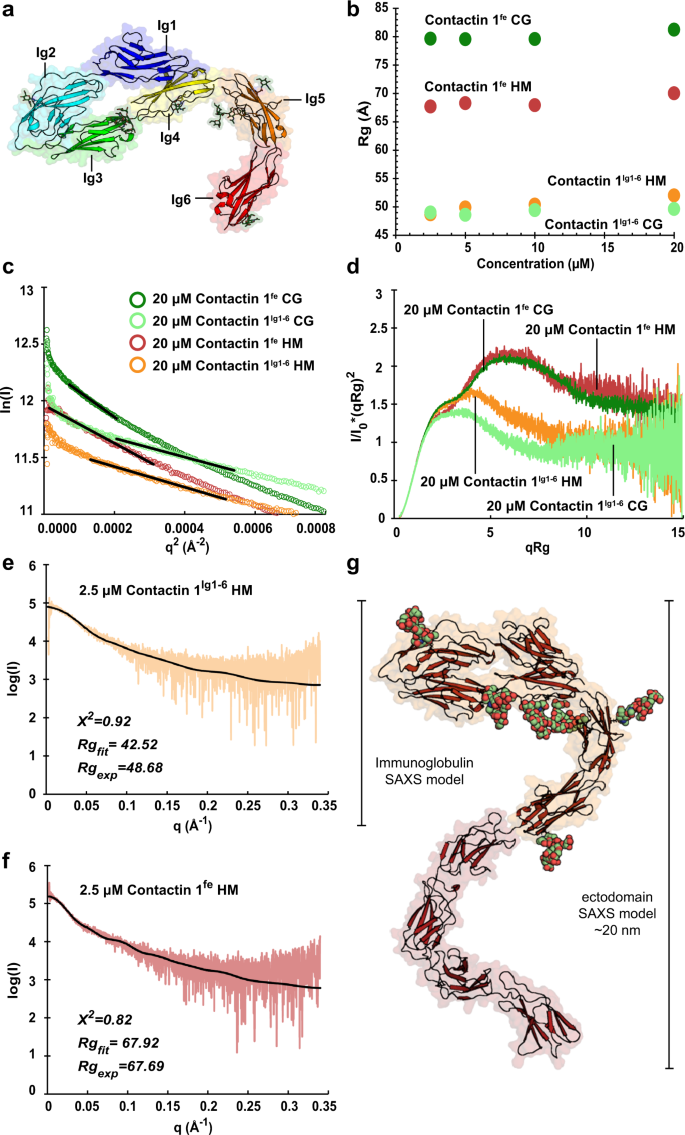
一个gydF4y2Ba域彩虹色接触1gydF4y2BaIg1-6gydF4y2Ba单体。Contactin 1gydF4y2BaIg1-6gydF4y2Ba呈镰刀状,Ig1-Ig4的马蹄形形成“柄”,Ig5-Ig6的组合形成弯曲的“刃”。gydF4y2BabgydF4y2BaContactin 1gydF4y2BaIg1-6gydF4y2Ba接触1gydF4y2Ba菲gydF4y2Ba批量SAXS在测量浓度中显示稳定的Rg。gydF4y2BacgydF4y2Ba批量SAXS吉尼埃图显示在低位的特征上升gydF4y2Ba问gydF4y2Ba指示存在某些低聚物的值。gydF4y2BadgydF4y2BaContactin 1gydF4y2BaIg1-6gydF4y2Ba接触1gydF4y2Ba菲gydF4y2Ba特征克拉特基图表明两个样品都是多结构域蛋白质,包含柔性区域和接触1gydF4y2Ba菲gydF4y2Ba是拉长。gydF4y2BaegydF4y2Ba- - - - - -gydF4y2BaggydF4y2BaHM接触的散射gydF4y2BaIg1-6gydF4y2Ba(gydF4y2BaegydF4y2Ba),联系方式1gydF4y2Ba菲gydF4y2Ba(gydF4y2BafgydF4y2Ba)。接触面散射数据计算gydF4y2BaIg1-6gydF4y2Ba模型n -聚糖的晶体结构(黑色曲线,gydF4y2BaegydF4y2Ba)和联系人1gydF4y2Ba菲gydF4y2Ba模型(gydF4y2BaggydF4y2Ba基于重叠结构和模型n -聚糖的叠加,与实验散射数据(黑色曲线,gydF4y2BafgydF4y2Ba)。结构域Ig1至Ig6 (Ig6),全外结构域(fe),高甘露糖聚糖(HM),复合聚糖(CG)。gydF4y2Ba
接触1 Ig1-Ig4马蹄段类似于先前报道的接触1、2、4和5段。我们的鼠标接触gydF4y2BaIg1-6gydF4y2BaCα与人类接触的r.m.s.d.为0.64 ÅgydF4y2BaIg2-3gydF4y2Ba(PDB: 3 s97)gydF4y2Ba24gydF4y2Ba, 1.25 Å与鸡接触2gydF4y2BaIg1-4gydF4y2Ba(PDB: 1 cs6)gydF4y2Ba21gydF4y2Ba, 1.57 Å与人类接触2gydF4y2BaIg1-4gydF4y2Ba(PDB: 2 om5)gydF4y2Ba22gydF4y2Ba, 1.18 Å, 1.63 Å和2.04 Å到鼠标接触4gydF4y2BaIg1-4gydF4y2Ba链(PDB:3JXA和3KLD)gydF4y2Ba23gydF4y2Ba, 1.14 Å到鼠标接触5gydF4y2BaIg1-4gydF4y2Ba(PDB: 5出价)gydF4y2Ba25gydF4y2Ba。此外,单独排列结构域的rm.s.d.通常低于1 Å,这表明超模的较高偏差可能是由于组装的一些构象自由造成的。同样,Ig5-Ig6的组合接触蛋白1gydF4y2BaIg1-6gydF4y2BaCα与小鼠接触蛋白3gydF4y2BaIg5-FnIII2gydF4y2Ba(PDB: 5 i99)gydF4y2Ba25gydF4y2Ba单个Ig 5和Ig 6结构域分别为1.10 Å和0.98 Cα r.m.s.d。gydF4y2Ba
1 .接触颗粒尺寸稳定gydF4y2BaIg1-6gydF4y2Ba接触1gydF4y2Ba菲gydF4y2Ba在2.5-20µM的浓度范围内,SAXS测量显示主要为单体形式(图2)。gydF4y2Ba3 bgydF4y2Ba及补充表gydF4y2Ba2gydF4y2Ba)。然而,在非常小的角度下,散射数据的向上曲率(图1)。gydF4y2Ba3 cgydF4y2Ba)表明存在少量较大的物种。Kratky图为1号联系人gydF4y2BaIg1-6gydF4y2Ba接触1gydF4y2Ba菲gydF4y2Ba由富含甘露糖或复杂聚糖生产的具有非锥形的形状,对于含有柔性区域的延伸蛋白是预期的。gydF4y2Ba3 dgydF4y2Ba)。富含甘露糖和复杂聚糖的Kratky图的相似性表明,总体分子结构不受聚糖组成的影响。Contactin 1gydF4y2Ba菲gydF4y2Ba与接触图1相比,Kratky图具有更明显的双峰形状gydF4y2BaIg1-6gydF4y2Ba指示1号接触点gydF4y2Ba菲gydF4y2Ba更拉长,更灵活。由于少量较大物种的存在减少,因此使用较低浓度的SAXS数据进行接触免疫球蛋白和外畴段的溶液状态建模。我们找到了联系gydF4y2BaIg1-6gydF4y2Ba高甘露糖SAXS散射与接触1计算的散射吻合较好gydF4y2BaIg1-6gydF4y2Ba晶体结构以完整的甘露糖树为模型,带有gydF4y2BaχgydF4y2Ba2gydF4y2Ba的0.92(图2)gydF4y2Ba3 e, ggydF4y2Ba及补充表gydF4y2Ba2gydF4y2Ba)。一个简单的接触模型gydF4y2Ba菲gydF4y2Ba产生了重叠晶体结构的接触1gydF4y2BaIg1-6gydF4y2Ba,用小鼠同源模型进行接触1gydF4y2BaFnIII1-3gydF4y2Ba,联系人1gydF4y2BaIg5-FnIII2gydF4y2Ba接触1gydF4y2BaFnIII4gydF4y2Ba生成与gydF4y2BaPhyre2gydF4y2Ba49gydF4y2Ba根据联系人1gydF4y2BaFnIII1-3gydF4y2Ba(PDB: 5 e53)gydF4y2Ba25gydF4y2Ba接触3gydF4y2BaIg5-FnIII2gydF4y2Ba(PDB: 5 i99)gydF4y2Ba25gydF4y2Ba。该模型以甘露糖树为模型,以确定糖基化位点,预测接触的散射1gydF4y2Ba菲gydF4y2Ba高甘露糖SAXS数据好,具有gydF4y2BaχgydF4y2Ba2gydF4y2Ba0.82(图2)gydF4y2Ba3 f, ggydF4y2Ba及补充表gydF4y2Ba2gydF4y2Ba)。总的来说,解决方案状态建模建议接触1gydF4y2Ba菲gydF4y2Ba具有扩展的蛇形结构。gydF4y2Ba
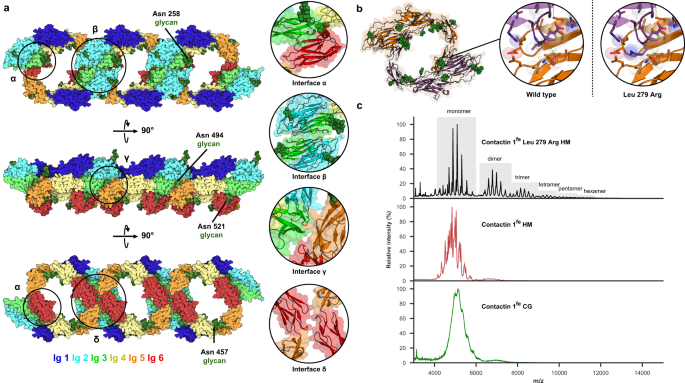
接触点1晶体包装中的一维拉链gydF4y2BaIg1-6gydF4y2Ba
Contactin 1gydF4y2BaIg1-6gydF4y2Ba沿着晶体学的a轴形成一个连续的一维阵列,由Ig3、Ig4、Ig5和Ig6介导的相互作用拉紧,导致所有分子的c端指向同一侧,表明agydF4y2Ba独联体gydF4y2Ba型相互作用(图1)gydF4y2Ba4gydF4y2Ba)。拉链排列出现在四个界面,表示为α到δ(图1)。gydF4y2Ba4gydF4y2Ba),捕获构成链的四种单独的二聚体排列(补充图2)。gydF4y2Ba4gydF4y2Ba)。埋表面积最大的二聚体埋2980 ÅgydF4y2Ba2gydF4y2Ba并使用两倍的界面α,其中一个分子上的Ig3-Ig4与另一个分子的Ig6接触(图6)。gydF4y2Ba4 a、bgydF4y2Ba)。第二种二聚体排列涉及界面β埋埋1190 ÅgydF4y2Ba2gydF4y2Ba通过A链和对称相关链B之间的Ig3-Ig3相互作用(图2)。gydF4y2Ba4gydF4y2Ba)。第三和第四种排列是通过界面γ和δ埋埋更小的区域,420 ÅgydF4y2Ba2gydF4y2Ba340 ÅgydF4y2Ba2gydF4y2Ba,分别为(图2)。gydF4y2Ba4gydF4y2Ba)。在界面γ中,链A的Ig3与对称相关的等效分子Ig5-Ig6接触,而界面δ是由链B与对称相关的链A之间的Ig6-Ig6相互作用形成的。在界面α形成的二聚体中加入一个接触蛋白1分子形成三聚体,增加了两个额外的相互作用界面,例如β和γ。gydF4y2Ba4gydF4y2Ba)。而加入到三聚体中形成四聚体的第四个分子增加了四个额外的界面,即两个α,一个γ和一个δ(补充图1)。gydF4y2Ba4gydF4y2Ba)。在界面附近有几个n -链聚糖。特别是Ig3的Asn258和Ig6的Asn521上的聚糖位于分子间相互作用位点附近,可能根据它们的组成影响相互作用(图2)。gydF4y2Ba4gydF4y2Ba)。在放置saxs衍生的接触1时,没有明显的空间冲突gydF4y2Ba菲gydF4y2Ba模型导入拉链组织(补充图2)。gydF4y2Ba4摄氏度gydF4y2Ba),表明拉链组织与外域架构兼容。gydF4y2Ba
一个gydF4y2Ba结晶学接触gydF4y2BaIg1-6gydF4y2Ba拉链与彩虹色域。将分子结合在一起的界面被标注为(α-δ),并附有插图说明这些接触。在潜在界面附近的聚糖被注释。gydF4y2BabgydF4y2BaContactin 1gydF4y2BaIg1-6gydF4y2Ba二聚体从拉链中通过两个α界面埋没大部分表面积。插图显示了界面的细节和模拟的Leu279Arg突变,该突变增加了高阶物种的丰度。gydF4y2BacgydF4y2Ba接触1的原生质谱gydF4y2Ba菲gydF4y2Ba变体揭示了聚糖诱导的异质性和弱寡聚倾向于复杂聚糖(绿色)和高甘露糖(红色)变体。低聚化倾向被Leu279Arg突变(黑色)增强。全外畴(fe),高甘露糖聚糖(HM),复合聚糖(CG)。源数据作为源数据文件提供。gydF4y2Ba
Contactin 1gydF4y2BaIg1-6gydF4y2Ba接触1gydF4y2Ba菲gydF4y2Ba形成低聚物的倾向较弱gydF4y2Ba
在溶液中测量时,细胞表面的相互作用可能很弱,但在生理环境中,由于膜附着提供的稳定特性,细胞表面的相互作用是相关的gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba。接触的SAXS分析gydF4y2BaIg1-6gydF4y2Ba或者联系1gydF4y2Ba菲gydF4y2Ba在溶液中,无论是作为富含甘露糖的聚糖形式还是作为复合聚糖形式,在10µM时,Rg没有浓度依赖性的增加,仅在20µM时略有增加(图2)。gydF4y2Ba3 bgydF4y2Ba),但在20µM处,散射数据的向上曲率非常小(图1)。gydF4y2Ba3 bgydF4y2Ba)可能表明接触寡聚物或聚集体的存在。为了更好地确定低聚物的存在,我们对两种浓度的接触样品进行了沉降速度分析超离心(SV-AUC)实验gydF4y2Ba2gydF4y2Ba及补充图gydF4y2Ba5gydF4y2Ba)。这里的c(s)分布分析表明,在低浓度(5或9µM)和高浓度(22或36µM)富含甘露糖的糖基化接触蛋白1gydF4y2Ba菲gydF4y2Ba接触1gydF4y2BaIg1-6gydF4y2Ba主要是单体(补充图。gydF4y2Ba5gydF4y2Ba),部分二聚体存在~0.1 ~ 11.7%,三聚体存在~0.3 ~ 1.8%(表2)gydF4y2Ba2gydF4y2Ba及补充图gydF4y2Ba5gydF4y2Ba)。在这些样品的亚群中,高阶物种以微量~0.6%的量存在。Contactin 1gydF4y2Ba菲gydF4y2Ba与富含甘露糖的形式相比,含有复杂聚糖的形式具有略高的二聚体、三聚体和高阶物种丰度(表1)gydF4y2Ba2gydF4y2Ba及补充图gydF4y2Ba5gydF4y2Ba)。令人惊讶的是,二聚体和低聚体的存在似乎不依赖于浓度。为了测试溶液中的低聚物是否代表晶体中观察到的拉链,我们制作了一个Leu279Arg接触1gydF4y2Ba菲gydF4y2Ba我们预测的突变体将通过引入空间约束盐桥来稳定α界面,从而增加寡聚物的丰度(图2)。gydF4y2Ba4 bgydF4y2Ba)。事实上,Leu279Arg接触1gydF4y2Ba菲gydF4y2Ba在SV-AUC分析中,与wt蛋白相比,用富含甘露糖的聚糖生产的三聚体和高阶物种增加了6.7-8.7%(表1)gydF4y2Ba2gydF4y2Ba及补充图gydF4y2Ba5gydF4y2Ba)。gydF4y2Ba
我们使用原生质谱(MS)来证实在SV-AUC中观察到的寡聚化模式,并确定不同结构的准确质量(图2)。gydF4y2Ba4摄氏度gydF4y2Ba)。原生质谱测量在原生条件下完整蛋白及其复合物的质量,允许非共价相互作用保持完整gydF4y2Ba53gydF4y2Ba。不出所料,接触1的天然质谱gydF4y2Ba菲gydF4y2Ba含复合聚糖的(接触蛋白1gydF4y2Ba菲gydF4y2BaCG),揭示了这种结构是高度异质性的(图2)。gydF4y2Ba4摄氏度gydF4y2Ba)。从这些数据中,我们只能部分地解析电荷态分布(4000
细胞聚类分析,以证实结构的见解gydF4y2Ba
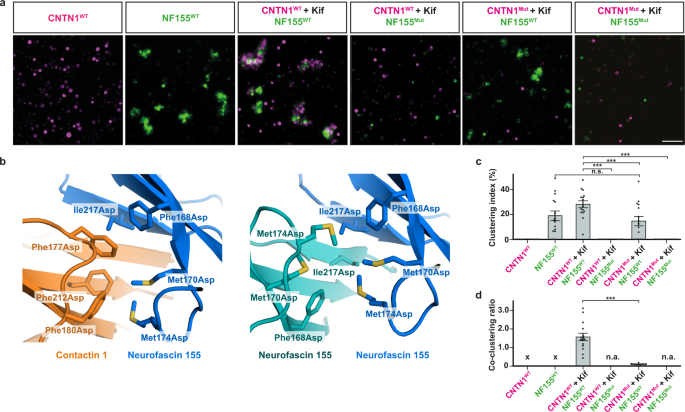
为了进一步验证接触蛋白1和神经束蛋白155粘附的结构,我们建立了一个先前报道的细胞聚类实验来表征粘附复合物的形成gydF4y2Ba21gydF4y2Ba,gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba。先前的报告表明,在细胞环境中,高甘露糖形式的接触蛋白1是神经束蛋白155结合的先决条件gydF4y2Ba44gydF4y2Ba。我们用甘露糖苷酶I抑制剂kifunenine处理表达接触蛋白1的K562细胞,导致高甘露糖型糖基化,证实了这一发现。表达contactn - 1的细胞不会自行聚集,无论是否使用kifunenine处理(图2)。gydF4y2Ba5gydF4y2Ba及补充图gydF4y2Ba6gydF4y2Ba)。这表明接触1不参与亲同性gydF4y2Ba反式gydF4y2Ba相互作用,与我们的发现一致,我们在接触1低聚物中观察到的界面最有可能代表gydF4y2Ba独联体gydF4y2Ba交互。另一方面,表达神经束蛋白155的细胞参与亲同性细胞聚集,支持先前关于神经束蛋白介导的亲同性粘附的报道gydF4y2Ba30.gydF4y2Ba,且这种相互作用不受克夫宁处理的影响(图2)。gydF4y2Ba5gydF4y2Ba及补充图gydF4y2Ba6gydF4y2Ba)。kifunensin处理过的表达contactin - 1的细胞与表达神经束蛋白155的细胞共聚在一起,共聚比表明簇中同时包含了表达contactin - 1和神经束蛋白155的细胞(图2)。gydF4y2Ba5 dgydF4y2Ba)。未经处理的细胞不会形成这种嗜异性的共簇,即簇主要由表达神经束蛋白155的细胞组成(补充图2)。gydF4y2Ba6 c, dgydF4y2Ba)。总的来说,我们证实了之前的报道gydF4y2Ba44gydF4y2Ba高甘露糖聚糖在接触蛋白1上的存在是细胞环境中与神经束蛋白155的异亲性相互作用所必需的。有趣的是,我们还发现,未用kifunenine处理的表达接触蛋白1的细胞(因此含有复杂聚糖)与表达神经束蛋白155的细胞共聚集,只要这些细胞用kifunenine处理。gydF4y2Ba6 dgydF4y2Ba)。当两种细胞类型都用克氏酶处理时,即接触蛋白1和神经束蛋白155都含有高甘露糖聚糖,没有发生共聚(补充图2)。gydF4y2Ba6 dgydF4y2Ba)。这些发现表明,在细胞背景下,接触蛋白1 -神经束蛋白155的相互作用需要特定的糖基化类型和模式。gydF4y2Ba
一个gydF4y2Ba表达接触蛋白1 (mCherry)的K562细胞的代表性细胞聚类图;洋红色;CNTN1)和神经束蛋白155 (GFP;绿色的;NF155)。当接触蛋白1在kifunenine (Kif;10µM)。表达神经束蛋白155但不表达接触蛋白1的细胞表现出亲同性聚集。任何一种蛋白上竞争性界面残基的突变都会消除共聚。每个实验独立重复三次,结果相似。 Scale bar, 100 µm. Contactin 1 Phe177Asp, Phe180Asp and Phe212Asp is CNTN1无足轻重的人gydF4y2Ba神经束蛋白155 Phe168Asp、Met170Asp、Met174Asp和Ile217Asp为NF155gydF4y2Ba无足轻重的人gydF4y2Ba。gydF4y2BabgydF4y2Ba突变的位置。在Ig2超级β-薄片(左图)的“底部”,以棒状表示的Contactin - 1-neurofascin 155界面残基突变为天冬氨酸并阻止异亲性gydF4y2Ba反式gydF4y2Ba交互。相同的神经束蛋白155残基也位于神经束蛋白155同型二聚体界面(右图),将它们突变为天冬氨酸可防止同型性gydF4y2Ba反式gydF4y2Ba交互。gydF4y2BacgydF4y2Ba群集索引;分类为簇的总分割单元面积的比例。gydF4y2BapgydF4y2Ba值为:NF155与CNTN1mut + Kif/NF155的比值为0.9544,CNTN1 + Kif/NF155与CNTN1 + Kif/NF155的比值<0.0001,CNTN1 + Kif/NF155与CNTN1mut + Kif/NF155的比值为0.0003,CNTN1 + Kif/NF155与CNTN1mut + Kif/NF155的比值<0.0001。gydF4y2BadgydF4y2Ba共聚类比确定为每个簇的平均mCherry信号比平均GFP信号。接触蛋白1 (kifunensin处理过的野生型)-神经束蛋白155(野生型)这一比例的增加表明共聚类,而其他条件下的低比例值表明只有神经束蛋白155亲和簇的存在。单数据点gydF4y2BacgydF4y2Ba和gydF4y2BadgydF4y2Ba的平均值gydF4y2BangydF4y2Ba= 15 (gydF4y2BangydF4y2Ba= 14为接触1gydF4y2Ba无足轻重的人gydF4y2Ba-neurofascin 155gydF4y2Ba无足轻重的人gydF4y2Ba)图片来自gydF4y2BaNgydF4y2Ba= 3个独立实验(每个实验5张图像)。误差条表示平均值±SEM。统计显著性通过单因素方差分析和Tukey多重比较检验来确定,结果使用以下惯例表示:n.s.不显著,***gydF4y2BapgydF4y2Ba< 0.001。在没有集群分析的情况下。表示,“X”表示无法计算荧光比的单通道条件。gydF4y2BapgydF4y2BaCNTN1 + Kif/NF155与CNTN1mut + Kif/NF155的比值<0.0001。源数据作为源数据文件提供。gydF4y2Ba
基于接触蛋白1 -神经束蛋白155结构,我们设计了两个界面突变版本,其中Ig2 GFC超级β-片“底部”的疏水残基(图2)。gydF4y2Ba1 dgydF4y2Ba及补充图gydF4y2Ba二维gydF4y2Ba)被改变为带电残基,我们预测这些残基将阻止接触1 -神经束蛋白155的异亲性和神经束蛋白155的同亲性gydF4y2Ba反式gydF4y2Ba交互。表面残基Phe177、Phe180和Phe212在接触1中突变为天冬氨酸gydF4y2Ba无足轻重的人gydF4y2Ba在神经束蛋白155中,表面残基Phe168、Met170、Met174和Ile217突变为天冬氨酸gydF4y2Ba无足轻重的人gydF4y2Ba(无花果。gydF4y2Ba5 bgydF4y2Ba)。正如预期的那样,表达接触蛋白1的细胞gydF4y2Ba无足轻重的人gydF4y2Ba(kifunenine处理)和表达神经束蛋白155的细胞gydF4y2Ba无足轻重的人gydF4y2Ba没有共聚类(图2)。gydF4y2Ba5a, c, dgydF4y2Ba)。另外,联系人1gydF4y2Ba无足轻重的人gydF4y2Ba-表达细胞(用kifunenine处理)不与神经束蛋白155共聚集gydF4y2BaWTgydF4y2Ba-表达细胞,也没有神经束蛋白155gydF4y2Ba无足轻重的人gydF4y2Ba-表达细胞与接触蛋白共簇gydF4y2BaWTgydF4y2Ba-表达细胞(经kifunenine处理)(图2)gydF4y2Ba5a, c, dgydF4y2Ba)。这些实验表明,突变版本独立地消除了共聚类,并表明我们在接触蛋白1和神经束蛋白155 Ig2结构域上发现的疏水表面是异亲性所必需的gydF4y2Ba反式gydF4y2Ba交互。此外,正如预期的那样,神经束蛋白155gydF4y2Ba无足轻重的人gydF4y2Ba表达-的细胞也不会形成嗜同性的细胞团(图2)。gydF4y2Ba5gydF4y2Ba及补充图gydF4y2Ba6gydF4y2Ba),证实了接触蛋白1 -神经束蛋白155的嗜异性粘附位点与神经束蛋白155的嗜同性粘附位点重叠。gydF4y2Ba
综上所述,细胞聚类实验表明接触蛋白1 -神经束蛋白155gydF4y2Ba反式gydF4y2Ba相互作用是通过Ig2介导的,正如在复杂结构中观察到的那样,神经束蛋白155是亲同性的gydF4y2Ba反式gydF4y2Ba相互作用是通过我们在神经束蛋白中观察到的界面介导的gydF4y2BaIg1-6gydF4y2Ba二聚体结构和预期的一样,即接触1不参与亲同性gydF4y2Ba反式gydF4y2Ba交互。gydF4y2Ba
讨论gydF4y2Ba
接触蛋白和L1家族的成员通过功能多样的低聚物和复合物共同作用,以建立神经元组织布线和连接的粘附性gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba。结构和生物物理方法一致认为,在这些科中,第一个Ig1-4结构域具有典型的后折叠马蹄形结构gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba。在许多情况下,免疫球蛋白结构域,特别是马蹄形上模,已被确定为反式粘附的必要和充分条件gydF4y2Ba14gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba。这里我们展示了鼠标接触1gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba复合体,神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba二聚体是通过马蹄形模块之间的Ig1-2相互作用形成的,其模式类似于人类接触2gydF4y2BaIg1-4gydF4y2Ba22gydF4y2Ba神经束蛋白186gydF4y2BaIg1-4gydF4y2Ba30.gydF4y2Ba马蹄为。这种共同的相互作用模式表明,接触蛋白1和神经束蛋白155之间的异亲性相互作用可能来自祖先同源二聚化蛋白的复制gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba。来自祖先同源二聚体的蛋白质家族中出现的异亲性相互作用被认为导致具有不同亲和力的异二聚体物种,这可能被用于微调细胞反应的时空控制gydF4y2Ba64gydF4y2Ba。这一概念在亚细胞水平上得到了接触蛋白1 -神经束蛋白155异亲性相互作用机制的相似性的支持gydF4y2Ba反式gydF4y2Ba在髓鞘副阳极连接形成中起作用的复合体gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba接触2是亲同性的gydF4y2Ba反式gydF4y2Ba髓鞘旁阳极形成所需的复合体gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba(无花果。gydF4y2Ba6gydF4y2Ba)。gydF4y2Ba
接触蛋白1、神经束蛋白155与Caspr 1共同控制神经节旁粘连gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba48gydF4y2Ba保持细胞间距离7.4 nm±0.6 nmgydF4y2Ba37gydF4y2Ba对髓鞘纤维的成熟和体内平衡很重要gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba确保有效的跳跃传导gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba。联系人1gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba配合物的边沿尺寸约为7 nm(图2)。gydF4y2Ba6gydF4y2Ba)表明这两种蛋白质必须平躺在两个细胞表面之间,而马蹄形模块决定了副神经间隙,类似于视网膜中含有马蹄形的伴生蛋白质gydF4y2Ba65gydF4y2Ba。有趣的是,接触蛋白1和神经束蛋白155也被发现gydF4y2Ba66gydF4y2Ba,gydF4y2Ba67gydF4y2Ba并在神经元突触中相互作用gydF4y2Ba15gydF4y2Ba哪个细胞间距离大得多,约20 - 25nmgydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba。1 .接触的大小gydF4y2Ba菲gydF4y2Ba,波长为20 nm,由SAXS测定(图2)。gydF4y2Ba3.gydF4y2Ba),以及我们在接触蛋白1和神经束蛋白155中观察到的Ig4-5连接的可塑性(补充图。gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba),其他FnIII 1-3接触段报告的灵活性gydF4y2Ba25gydF4y2Ba膜附着位点的灵活性可能允许跨越细胞间突触空间(图2)。gydF4y2Ba6gydF4y2Ba),并使这些分子能够在不同的细胞-细胞距离上发挥作用。接触蛋白1和神经束蛋白155的结构可塑性是否以及如何在细胞粘附中发挥作用将需要进一步的功能验证。特定亚型的表达水平gydF4y2Ba11gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,在空间和时间上的定位gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba接触1的翻译后修饰gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba和neurofascingydF4y2Ba14gydF4y2Ba,gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba,gydF4y2Ba70gydF4y2Ba对神经系统发育和功能的影响。神经束蛋白155同二聚化和接触蛋白1 -神经束蛋白155复杂界面重叠,表明这些相互作用相互排斥。接触蛋白1 -神经束蛋白155复合物具有更高的亲和力(0.22µM)。gydF4y2Ba1 bgydF4y2Ba)与神经束蛋白155二聚化(5-30µM)相比,表明异亲性复合物的形成优于同二聚化。这种偏好也解释了为什么在细胞聚类实验中,神经束蛋白155的亲同性相互作用不会阻止接触1 -神经束蛋白155的亲异性相互作用(图2)。gydF4y2Ba5gydF4y2Ba及补充图gydF4y2Ba6gydF4y2Ba)。然而,在生物学背景下,影响组分有效浓度的因素,如表达水平、锚定和运输过程、相对膜上分子之间的距离,以及竞争相互作用是否会发生在细胞中gydF4y2Ba独联体gydF4y2Ba或者在gydF4y2Ba反式gydF4y2Ba设置,可能提供这种偏好的额外调制。此外,神经束蛋白有许多同型gydF4y2Ba33gydF4y2Ba它们的表达水平和位置往往是不同的gydF4y2Ba11gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba。神经束蛋白结构的比较gydF4y2BaIg1-6gydF4y2Ba神经束蛋白186gydF4y2BaIg1-4gydF4y2Ba表明两个分子上的接触蛋白1结合位点非常相似。鉴于同种异构体的剪接差异在Ig1-Ig2区域之外,所有的神经束蛋白同种异构体都可能通过在Ig1-Ig2上报道的界面结合接触蛋白1。与我们的模型一致,接触蛋白1将能够与任何神经束蛋白异构体相互作用,这一发现得到了早期神经束蛋白异构体-接触蛋白1相互作用研究的支持,这些研究显示了不同相对效率的明确结合gydF4y2Ba14gydF4y2Ba。独特的神经束蛋白gydF4y2BaIg1-6gydF4y2Ba锄形结构可以通过在n端剪接来调节(图2)。gydF4y2Ba2 a, bgydF4y2Ba及补充图gydF4y2Ba3.gydF4y2Ba),可能影响接触蛋白1结合位点的呈现,并解释了相互作用中剪接位点依赖性差异gydF4y2Ba14gydF4y2Ba以及在神经束蛋白中Ig5-6结构域缺失后,在细胞环境中缺乏相互作用gydF4y2Ba46gydF4y2Ba。此外,n -链糖基化已被证明在细胞环境下调节接触蛋白1和神经束蛋白155的结合gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba在这种情况下,我们表明高甘露糖聚糖,无论是在接触蛋白1上还是在神经束蛋白155上,但不是在两者上,都能使嗜异性细胞-细胞相互作用。在SPR实验中,我们发现当两种蛋白具有相同的高甘露糖聚糖类型时,接触蛋白1 -神经束蛋白155的相互作用仍然发生(图2)。gydF4y2Ba1 bgydF4y2Ba),这表明聚糖的微异质性、全长分子的立体特性或细胞环境的结构约束可能会额外调节跨细胞相互作用。从接触1gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba结构上,免疫球蛋白片段中保守的糖基化位点似乎可以根据糖基化微异质性延长或立体阻碍相互作用。总之,翻译前和翻译后修饰、定位和蛋白质浓度的平衡是接触蛋白-神经束蛋白相互作用的基础。gydF4y2Ba
而接触蛋白1和神经束蛋白155以类似于神经束蛋白的方式相互作用gydF4y2Ba30.gydF4y2Ba(补充图。gydF4y2Ba2gydF4y2Ba)和接触2gydF4y2Ba22gydF4y2Ba在我们报道的结构中,接触1不会通过Ig1-Ig2界面形成同型二聚体。相反,联系1gydF4y2BaIg1-6gydF4y2Ba使用Ig3, Ig4, Ig5和Ig6结构域形成一个更大的一维拉链,使神经束蛋白155的结合位点可接近。虽然我们不能排除在特定条件下接触蛋白1 - Ig1-Ig2可能发生界面相互作用,但接触蛋白1似乎不会形成homo-gydF4y2Ba反式gydF4y2Ba我们的细胞聚类实验和其他实验表明的相互作用gydF4y2Ba73gydF4y2Ba。然而,接触1可能会形成gydF4y2Ba独联体gydF4y2Ba相互作用,与拉链是兼容的gydF4y2Ba独联体gydF4y2Ba与细胞表面连接的c端相互作用都在同一侧。虽然在溶液中测量的相互作用可能很弱,但它们可能与生理膜相关的设置相关,可以提供额外的稳定性gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba74gydF4y2Ba,gydF4y2Ba75gydF4y2Ba,gydF4y2Ba76gydF4y2Ba接触蛋白1的表达水平在轴突膜中特别高gydF4y2Ba77gydF4y2Ba。有趣的是,接触蛋白1和caspr或神经束蛋白155和caspr的线性排列已经在副阳面和沿轴突被报道gydF4y2Ba48gydF4y2Ba,gydF4y2Ba78gydF4y2Ba,gydF4y2Ba79gydF4y2Ba接触蛋白1 -神经束蛋白155-caspr1的三元复合物被认为在旁阳极形成环绕轴突的分离样连接gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba48gydF4y2Ba。目前尚不清楚我们发现的拉链是否在这种情况下起作用,尽管拉链中有神经束蛋白155的结合位点,但并不是所有的位点都能被神经束蛋白155占据,因为这将导致神经束蛋白155分子之间的空间冲突。最后,分泌接触蛋白1在调节节点钠通道聚集中起作用gydF4y2Ba80gydF4y2Ba接触蛋白1的低聚形式可能在这个功能中起作用,但这还没有得到实验证实。gydF4y2Ba
近年来出现的证据表明,接触蛋白1和神经束蛋白155在许多病理中都起着核心作用。这两种蛋白都与自身免疫性神经病变密切相关gydF4y2Ba81gydF4y2Ba例如多发性硬化症gydF4y2Ba19gydF4y2Ba,gydF4y2Ba82gydF4y2Ba。此外,接触素可能在神经退行性疾病中发挥作用,有报道暗示它与帕金森病有关gydF4y2Ba83gydF4y2Ba和阿尔茨海默病gydF4y2Ba84gydF4y2Ba,gydF4y2Ba85gydF4y2Ba它还会影响癌症的进展和转移gydF4y2Ba86gydF4y2Ba,gydF4y2Ba87gydF4y2Ba。我们在接触蛋白1 -神经束蛋白155复合体和单个蛋白上的工作,为未来针对这些分子的治疗方法的发展提供了一个踏脚石。gydF4y2Ba
方法gydF4y2Ba
构建、生成和诱变gydF4y2Ba
以Image Clone 30099512为基础的Contactin 1 (CNTN1)和GeneArt Thermo Fisher公司获得的基于NCBI转录变体NM_001160316.1的人细胞系表达密码子优化的neurofascin 155 (NF155)为模板,生成Contactin 1gydF4y2BaIg1-6gydF4y2Ba(残留物21-604),神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba(残留物25-633),接触1gydF4y2Ba菲gydF4y2Ba(残留物21-996)和神经束蛋白155gydF4y2Ba菲gydF4y2Ba(残基25-1059)通过聚合酶链反应(PCR)构建(补充表)gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba)。Neurofascin 155gydF4y2BaIg1-6gydF4y2BaThr216Ala,触点1gydF4y2Ba菲gydF4y2BaLeu279Arg,呼叫1号gydF4y2Ba菲gydF4y2BaPhe177Asp, Phe180Asp, Phe212Asp(接触器gydF4y2Ba无足轻重的人gydF4y2Ba)和神经束蛋白155gydF4y2Ba菲gydF4y2Baph168asp, Met170Asp, Met174Asp, Ile217Asp (neurofascingydF4y2Ba无足轻重的人gydF4y2Ba)突变体使用重叠引物创建(补充表)gydF4y2Ba3.gydF4y2Ba)。所有构建体均利用BamHI/NotI位点亚克隆到pUPE107.03(胱抑素分泌信号肽,c -末端His6标签,U-Protein Express)中,除接触蛋白1外gydF4y2Ba无足轻重的人gydF4y2Ba亚克隆到pUPE107.58(胱抑素分泌信号肽,c端跨膜螺旋- mcherry荧光团- his6标签,u蛋白表达)和神经束蛋白155gydF4y2Ba无足轻重的人gydF4y2Ba亚克隆到pUPE107.21(胱抑素分泌信号肽,c端跨膜螺旋- egfp荧光团- his6标签,U-Protein Express)。Contactin 1gydF4y2BaIg1-6gydF4y2Ba接触1gydF4y2Ba菲gydF4y2Ba进一步亚克隆到pUPE107.62(胱抑素分泌信号肽,c端生物素受体肽- his6标签)载体(U-Protein Express)中。Contactin 1gydF4y2Ba菲gydF4y2Ba神经束蛋白155gydF4y2Ba菲gydF4y2Ba分别亚克隆到pUPE107.58和pUPE107.21(称为contactin 1gydF4y2BaWTgydF4y2Ba神经束蛋白155gydF4y2BaWTgydF4y2Ba)。gydF4y2Ba
蛋白表达与纯化gydF4y2Ba
在表达HEK293细胞(HEK293- e) (U-Protein Express)的Epstein-Barr病毒核抗原I (EBNA1)悬浮液中产生复合聚糖(CG)蛋白,而在表达n -乙酰氨基转移酶I缺陷(GnTI−)EBNA1的HEK293细胞(HEK293- es) (U-Protein Express)中产生高甘露糖(HM)蛋白。转染6天后收获培养基,1000倍离心10分钟,将细胞纺丝gydF4y2BaggydF4y2Ba。细胞碎片在4000 ×下从培养基中纺丝15分钟gydF4y2BaggydF4y2Ba。用Ni Sepharose excel (GE Healthcare)亲和层析纯化蛋白质,然后在Superdex200 Hiload 16/60 (GE Healthcare)或Superdex200 10/300 (GE Healthcare)色谱柱上用SEC缓冲液(25 mM HEPES pH 7.5, 150 mM NaCl)平衡,进行大小排除层析(SEC)。对于Leu279Arg接触1样品cOmpletegydF4y2BaTMgydF4y2Ba在SEC缓冲液中加入Mini、不含edta的蛋白酶抑制剂鸡尾酒。然后将蛋白质浓缩至5-10 mg mlgydF4y2Ba−1gydF4y2Ba保存于- 80°C。通过SDS-PAGE和考马斯氏染色评价纯度。gydF4y2Ba
结晶和x射线数据收集gydF4y2Ba
通过将150 nl的蛋白质溶液与150 nl的储层溶液混合,所有结晶试验均采用4°C的坐滴蒸汽扩散。1 .晶体接触gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba(等摩尔比最终混合物6mg mlgydF4y2Ba−1gydF4y2Ba)从2% v/v的Tacsimate条件下生长gydF4y2BaTMgydF4y2BapH 5.0, 0.1 M柠檬酸三碱二水合钠pH 5.6, 16% w/v PEG 3350。神经束蛋白晶体gydF4y2BaIg1-6gydF4y2Ba(8 mg mlgydF4y2Ba−1gydF4y2Ba在20% (w/v) PEG 8000和100 mM HEPES/氢氧化钠pH 7.5的条件下生长。1 .晶体接触gydF4y2BaIg1-6gydF4y2Ba从接触中成长起来的gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba(等摩尔比最终混合物6mg mlgydF4y2Ba−1gydF4y2Ba)与20% w/v PEG 3350和0.2 M六水硝酸镁pH值5.9。在结晶中加入含有30%甘油的储液作为冷冻保护剂,然后将其放入液氮中冷冻。数据集在100 K时在钻石光源光束线I03(见图1)处采集gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba,波长0.9763 Å),金刚石光源光束线I24(接触点1)gydF4y2BaIg1-6gydF4y2Ba,波长为0.9686 Å)。联系人1gydF4y2BaIg1-6gydF4y2Ba采用螺旋收集策略收集数据集。gydF4y2Ba
结构确定和细化gydF4y2Ba
获得神经束蛋白155的综合数据gydF4y2BaIg1-6gydF4y2Ba接触1gydF4y2BaIg1-6gydF4y2Ba数据集,来自霞2表盘的钻石光束线数据自动处理流水线gydF4y2Ba88gydF4y2Ba,并在gydF4y2Ba漫无目的的gydF4y2Ba89gydF4y2Ba。根据半数据集的平均强度相关系数CC1/2确定分辨率极限截止。从霞2表盘金刚石光束线数据自动处理管道中获得未合并和未缩放的数据gydF4y2Ba88gydF4y2Ba对于两个同构接触1gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba从同一晶体连续收集的数据集。这些数据被用来生成一个组合的未合并和未缩放的数据集gydF4y2Ba毫无意义的gydF4y2Ba90gydF4y2Ba。对组合数据集进行各向异性截断、合并和缩放gydF4y2BaSTARANISOgydF4y2Ba91gydF4y2Ba网络服务器。以下是gydF4y2BaSTARANISOgydF4y2Ba91gydF4y2Ba从合并的数据文件中删除了衍射截止表面外的未观测和不可观测反射。所有的结构都用分子置换法求解gydF4y2Ba移相器gydF4y2Ba92gydF4y2Ba。非配体神经束蛋白的初始搜索模型gydF4y2BaIg1-6gydF4y2Ba接触1gydF4y2BaIg1-6gydF4y2Ba结构为(PDB: 3P3Y)gydF4y2Ba30.gydF4y2Ba神经束蛋白Ig1-4残基31-437,(PDB: 2OM5)gydF4y2Ba21gydF4y2Ba接触Ig1-4残基38-410,和gydF4y2BaPHYRE2gydF4y2Ba49gydF4y2Ba神经束蛋白155和接触蛋白1的Ig5和Ig6结构域以>90%的置信度生成模型。联系人:1gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba使用非配体数据集的复杂结构和精细结构作为搜索模型。对未配体数据集进行结构细化gydF4y2Ba凤凰gydF4y2Ba93gydF4y2Ba具有自动加权选项。手工模型构建是在gydF4y2Ba傻瓜gydF4y2Ba94gydF4y2Ba。对无配体结构进行了迭代的人工检测和校正gydF4y2Ba傻瓜gydF4y2Ba94gydF4y2Ba在此期间,会运行自动细化以纠正寄存器错误。在以下部分重新调整残基定位或纠正寄存器:neurofascin 155 Ig 5残基445-449和482-492,neurofascin 155 Ig 6残基564-584,contactin 1 Ig 5残基415-422,contactin 1 Ig 6残基549-566。以尽量减少未配体神经束蛋白的过拟合gydF4y2BaIg1-6gydF4y2Ba,非配体接触1gydF4y2BaIg1-6gydF4y2Ba采用模型、二级结构和NCS约束。无配体神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba考虑到数据集中链之间的域的可移动性,还使用TLS参数进行了细化。触点的结构细化gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba数据集最初使用gydF4y2BaREFMACgydF4y2Ba95gydF4y2Ba中执行的手动模型构建gydF4y2Ba傻瓜gydF4y2Ba94gydF4y2Ba。考虑到接触面的低分辨率和高度各向异性数据gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba复杂的数据集,特别注意在细化,以避免过度参数化。MR放置区域位置首先使用果冻体约束和x射线和几何约束之间的保守加权(0.0002)进行细化。B因子进一步设置为恒定值,仅对结构进行TLS组B因子细化。为了优化多糖的几何结构,在PHENIX中进行最后的优化步骤,使用相同的TLS组,并使用保守的x射线/几何加权(wxc为0.05)和x射线/ADP加权优化,对每个链进行单组b因子的细化。这里还使用了启动模型、NCS和二级结构约束。gydF4y2BaMOLPROBITYgydF4y2Ba96gydF4y2Ba用于结构验证。在gydF4y2Ba凤凰gydF4y2Ba使用“简单”的方法gydF4y2Ba97gydF4y2Ba。gydF4y2Ba
结构分析gydF4y2Ba
使用各种相关程序进行结构分析。测定了界面性能和埋地面积gydF4y2BajsPISAgydF4y2Ba47gydF4y2Ba服务器。采用YRB着色方案获得疏水表面表征着色gydF4y2Ba98gydF4y2Ba。在pH值为7.4时,采用gydF4y2BaPDB2PQRgydF4y2Ba99gydF4y2Ba和gydF4y2BaapbgydF4y2BaOne hundred.gydF4y2Ba网络服务器。保守性分析采用gydF4y2BaCONSURFgydF4y2Ba101gydF4y2Ba从UNIPROT检索脊椎动物同源物的精选序列列表gydF4y2Ba102gydF4y2Ba数据库和从NCBI数据库中选择的对白gydF4y2Ba103gydF4y2Ba。选取人、鼠、鸡、爪蟾和斑马鱼的L1和接触亲缘序列进行亲缘序列保守性分析。图形是用gydF4y2BaPyMolgydF4y2Ba(Schrödinger),以及gydF4y2Ba说明gydF4y2Ba104gydF4y2Ba网络服务器。对L1鼠标旁系高亮结构进行序列比对gydF4y2BaESPriptgydF4y2Ba网络服务器gydF4y2Ba105gydF4y2Ba。gydF4y2Ba
粒径排除色谱和多角度光散射gydF4y2Ba
神经束蛋白155进行SEC分析gydF4y2BaIg1-6gydF4y2BaHM和CG wt,以及Thr216Ala HM样品通过峰移来表征单体二聚体交换。纯化后的样品(1-100 μM)注射到在SEC缓冲液中平衡的Superdex200 10/300 increase (GE Healthcare)柱上,以0.75 ml min的流速分离gydF4y2Ba−1gydF4y2Ba。神经束蛋白155的分子量表征gydF4y2BaIg1-6gydF4y2BaHM和Thr216Ala HM样品,使用miniDAWN TREOS多角度光散射检测器(Wyatt)进行光散射测量,连接用于蛋白质浓度定量的差分折射率监测器(Shimadzu, RID-10A)。收集的色谱图使用Wyatt的ASTRA6软件进行分析和处理,计算出的dn/dc值为0.182 ml ggydF4y2Ba−1gydF4y2Ba(蛋白质和聚糖部分的dn/dc分别为0.188和0.145,通过晶体学证实的糖基化位点估计糖基化率为8%)。通过注射5 mg ml来评估仪器校准gydF4y2Ba−1gydF4y2Ba单体康白蛋白(Sigma-Aldrich),在本例中使用的dn/dc值为0.185 ml ggydF4y2Ba−1gydF4y2Ba。gydF4y2Ba
表面等离子体共振成像gydF4y2Ba
在pUPE107.62中亚克隆的Contactin 1 SPR配体构建体(胱抑素分泌信号肽,c端生物素受体肽- his6标签)与分泌信号次优的大肠杆菌BirA生物素连接酶(在pUPE5.02载体中)共转染,DNA比为9:1(样品:BirA, m/m),在HEK293细胞中进行生物素化。在培养基中添加无菌生物素(每4ml HEK293培养物中添加1mg /ml hepes缓冲生物素100µl)。Contactin 1配体样品采用Ni Sepharose excel (GE Healthcare)亲和层析纯化,通过SDS-PAGE和考马斯色染色评估纯度。使用8 × 6格式的连续流微点仪(CFM, Wasatch microfluics)将c端生物素化蛋白阵列沉积在P-STREP SensEye®(Ssens)芯片上。用0.005% Tween-20的SEC缓冲液作为点斑缓冲液,用SEC缓冲液中的1 mM生物素淬灭斑点芯片表面。配体的c端耦合确保了芯片的原生拓扑结构。表面等离子体共振成像实验在MX96 SPRi仪器(IBIS Technologies)上进行。将SEC缓冲液中的分析物掠过传感器芯片,以0.005% Tween-20的SEC缓冲液作为运行缓冲液,以2m MgCl 25 mM MES pH 5作为再生缓冲液。在测量过程中,温度保持在25°C恒定。数据分析使用gydF4y2BaSPRINTXgydF4y2Ba(IBIS Technologies)和gydF4y2Ba棱镜gydF4y2Ba(Graphpad)。通过使用没有配体沉积的参考区域减去参考信号来校正信号。基于平衡状态下(即300 - 380秒的结合相)平均响应信号的响应单元,根据分析物浓度绘制响应单元,并使用1:1 Langmuir结合模型建模,以计算gydF4y2BaKgydF4y2BaDgydF4y2Ba最大分析物结合(gydF4y2BaBgydF4y2Ba马克斯gydF4y2Ba)。的理论gydF4y2BaBgydF4y2Ba马克斯gydF4y2Ba由沉积在传感器表面的配体量确定,并根据配体和分析物之间的分子量差异进行校正。相互作用实验见补充图。gydF4y2Ba1比gydF4y2Ba没有被量化。gydF4y2Ba
小角度x射线散射gydF4y2Ba
在能量为12.4 keV的DLS光束线B21上进行了批量SAXS实验,样品到探测器(Eiger 4 M, Dectris)的距离为4.01 M。利用纯水散射将强度标定为绝对单位。方法自动执行数据约简gydF4y2Ba黎明gydF4y2Ba106gydF4y2Ba管道。人工检查辐射损伤后取帧平均值,减去SEC缓冲的散射,并按浓度归一化强度。数据分析gydF4y2Ba博智金融gydF4y2Ba107gydF4y2Ba结果被绘制在gydF4y2BaEXCELgydF4y2Ba(微软)。寡聚分析的预期单体分子量是根据序列推导的分子量估计的,对于高甘露糖和复杂聚糖材料,每个晶体学上确认的糖基化位点分别增加1.5 kDa或2 kDa。gydF4y2BaPgydF4y2Ba(gydF4y2BargydF4y2Ba)对低浓度样品进行分析以估计gydF4y2BadgydF4y2Ba马克斯gydF4y2Ba单体。考虑到样品明显的非单分散性,不确定较高浓度样品的值(n.d)。萨克斯模型接触1gydF4y2BaIg1-6gydF4y2Ba单体,神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba利用几何约束在晶体结构中观察到的糖基化位点上对高甘露糖聚糖树(两个GlcNAc和五个甘露糖残基)进行建模,制备了单体和二聚体(所有高甘露糖版本)gydF4y2Ba傻瓜gydF4y2Ba94gydF4y2Ba。Contactin 1gydF4y2Ba菲gydF4y2Ba模型是通过对齐和连接接触1来制作的gydF4y2BaIg1-6gydF4y2Ba与小鼠同源模型接触1gydF4y2BaFnIII1-3gydF4y2Ba,联系人1gydF4y2BaIg5-FnIII2gydF4y2Ba接触1gydF4y2BaFnIII4gydF4y2Ba生成的gydF4y2BaPHYRE2gydF4y2Ba49gydF4y2Ba我有90%的信心。虽然由于缺乏FnIII3-4连接的先验信息,接触1 FnIII4的方向被任意放置以避免冲突,但没有改变结构域的相对方向以提高SAXS模型的拟合。对于神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba使用晶体结构的A链。计算了模型的预测散射、与实验散射数据的拟合以及RggydF4y2Ba绝大部分gydF4y2Ba108gydF4y2Ba网络服务器。gydF4y2Ba
分析超速离心法gydF4y2Ba
SV-AUC实验在Beckman Coulter Proteomelab XL-I分析超离心机上进行,安-60 Ti转子(Beckman),转速为每分钟42,000或50,000转(r.p.m)。Contactin 1gydF4y2BaIg1-6gydF4y2Ba高甘露糖在9/36µM,接触1gydF4y2Ba菲gydF4y2Ba在20°C的SEC缓冲液中测定5/22µM的高甘露糖/复合物聚糖。Contactin 1gydF4y2Ba菲gydF4y2Ba5/22µM的Leu279Arg高甘露糖在添加cOmplete的SEC缓冲液中测定gydF4y2BaTMgydF4y2Ba, Mini,无edta蛋白酶抑制剂鸡尾酒,20°C。使用12 mm(5/9µM样品)或3 mm(22/36µM样品)带蓝宝石窗口的中心件。以缓冲液为参比,在280 nm处测定吸光度。每个细胞共收集了500次扫描,并用gydF4y2BaSEDFITgydF4y2Ba109gydF4y2Ba版本16.1c(2018年10月)。数据拟合为连续的c(s)分布模型,在0 ~ 20 s的沉降系数范围内分辨率为200。摩擦比、基线和大多数配合的半月板在配合中浮动,底部保持固定。由于吸收残余物产生的蛋白酶抑制剂在突变体接触1样品引起峰值接近gydF4y2Ba年代gydF4y2Ba= 0,为了比较高阶物种在样品中的出现情况,根据低聚物物种的峰面积相对于单体峰的归一化面积来确定丰度。gydF4y2Ba
原生质谱法gydF4y2Ba
原生质谱实验在改良的LCT飞行时间仪(Waters)上进行。在4°C下,使用Amicon Ultra离心过滤器,将蛋白质样品缓冲交换到150 mM醋酸铵(pH 7.5),连续六个稀释和浓缩步骤,分子量截止为10 kDa(默克)。使用NanoDrop 1000分光光度计(NanoDrop Technologies)在280 nm处测量吸光度来测定主要原液的浓度。分析前将样品稀释至2.5µM浓度,然后将样品装入包金硼硅酸盐毛细管(自制)中,从静态纳米电喷雾电离源直接输注。数据在MassLynx V4.1 (Waters)中处理。gydF4y2Ba
细胞聚类分析、成像和分析gydF4y2Ba
K562细胞(荷兰癌症研究所Bas van Steensel博士赠送)在rmi -1640培养基(Gibco)中培养,添加10%的牛血清(Gibco)和1%的青霉素/链霉素(Gibco),在37°C和5% CO的振动培养箱中生长gydF4y2Ba2gydF4y2Ba。电穿孔前,从培养瓶中收集K562细胞,300倍离心5mingydF4y2BaggydF4y2Ba。然后用1倍PBS (Gibco)洗涤细胞,300倍离心5分钟gydF4y2BaggydF4y2Ba并在缓冲液R (Gibco)中重悬。每个条件,2 × 10gydF4y2Ba6gydF4y2Ba细胞在室温下与总添加量为15µg的DNA孵育15 min。接触比1gydF4y2BaWTgydF4y2Ba或者神经束蛋白155gydF4y2BaWTgydF4y2Ba质粒与空载体的比例为10:1,接触比为1:1gydF4y2Ba无足轻重的人gydF4y2Ba或者神经束蛋白155gydF4y2Ba无足轻重的人gydF4y2Ba质粒与空载体的比例为1:1。孵育后,K562细胞在DNA混合物存在下,用Neon转染系统(Thermo Fisher Scientific)电穿孔,使用100 μl针尖,设置:1450 V, 10 ms脉冲长度,3个脉冲gydF4y2Ba110gydF4y2Ba。电穿孔后,将细胞直接在6孔板中接种于5ml含有10% FBS和0.1% DMSO (Sigma-Aldrich)或10 μM kifunenine (0.1% DMSO (Kif;Sigma-Aldrich)。细胞在37°C和5% CO的振动培养箱中恢复约20小时gydF4y2Ba2gydF4y2Ba。回收后收集细胞,200 g离心3 min。然后将细胞重悬在实验培养基(rmi -1640中添加10% FBS)中,并在37°C下用DNase I (Invitrogen)处理10分钟。细胞再次离心,在实验培养基中重悬,并通过40 μm细胞过滤器。使用伯爵夫人3 FL (Thermo Fisher Scientific)进行细胞计数,总数为2 × 10gydF4y2Ba5gydF4y2Ba每个聚集条件下的细胞在12孔板中加入1ml检测培养基。细胞在37°C和5% CO的振动培养箱中聚集24小时gydF4y2Ba2gydF4y2Ba和簇在EVOS M5000显微镜上成像,物镜×10 (0.25 NA;EVOS, Thermo Fisher Scientific),使用EVOS LED GFP和RFP立方体(Thermo Fisher Scientific)。为了进行分析,我们将GFP和mCherry通道结合起来,并采用Otsu阈值法。使用Analyze Particles识别大于50像素的感兴趣区域(roi)gydF4y2Ba111gydF4y2Ba。在测量每个ROI的GFP和mCherry通道的面积和平均强度之前,对单个GFP和mCherry通道进行半径为50像素的滚动球背景减法。细胞簇定义为去除最大的10个roi后,由1637个单细胞roi组成的单幅图像中最大的2.5%计算得出的平均大单个细胞大小的三倍。聚类指数为聚类面积之和除以所有roi(聚类+非聚类)面积之和乘以100%。对每幅图像的聚类大小、共聚类比和聚类指数进行平均,并对三个独立实验(每个实验5幅图像,每个条件共15幅图像)的数据进行分析gydF4y2BaPython 3gydF4y2Ba112gydF4y2Ba和gydF4y2BaSeaborngydF4y2Ba113gydF4y2Ba统计数据可视化。gydF4y2Ba
统计分析gydF4y2Ba
对于多组的比较,我们采用单因素方差分析,然后使用GraphPad Prism (GraphPad Software, San Diego, California USA)进行Tukey多重比较检验。条件之间的差异被认为是显著的,当gydF4y2BapgydF4y2Ba< 0.05 (*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001)(补充表gydF4y2Ba5gydF4y2Ba)。在所有的人物传说中,gydF4y2BaNgydF4y2Ba表示独立实验的个数,和gydF4y2BangydF4y2Ba表示分析的图像数量。数据用平均值±SEM表示。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
接触的坐标和结构因子1gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba,神经束蛋白155gydF4y2BaIg1-6gydF4y2Ba,联系人1gydF4y2BaIg1-6gydF4y2Ba已存入蛋白质数据库,并附有编号gydF4y2Ba7 ol4gydF4y2Ba(contactin 1gydF4y2BaIg1-6gydF4y2Ba-neurofascin 155gydF4y2BaIg1-6gydF4y2Ba复杂的),gydF4y2Ba7 ok5gydF4y2Ba(neurofascin 155gydF4y2BaIg1-6gydF4y2Ba),gydF4y2Ba7 ol2gydF4y2Ba(contactin 1gydF4y2BaIg1-6gydF4y2Ba)。所有SAXS数据已存入小角度散射数据库(SASBDB),其加入代码:gydF4y2BaSASDL66gydF4y2Ba(neurofascin 155gydF4y2BaIg1-6gydF4y2BaHm 37.2µm);gydF4y2BaSASDL76gydF4y2Ba(neurofascin 155gydF4y2BaIg1-6gydF4y2BaHm 73.5µm);gydF4y2BaSASDL86gydF4y2Ba(neurofascin 155gydF4y2BaIg1-6gydF4y2BaHm 19.7µm);gydF4y2BaSASDL96gydF4y2Ba(neurofascin 155gydF4y2BaIg1-6gydF4y2BaHm 9.5µm);gydF4y2BaSASDLA6gydF4y2Ba(neurofascin 155gydF4y2BaIg1-6gydF4y2BaHm 5.1µm);gydF4y2BaSASDLB6gydF4y2Ba(neurofascin 155gydF4y2BaIg1-6gydF4y2BaHm 2.7µm);gydF4y2BaSASDLC6gydF4y2Ba(neurofascin 155gydF4y2BaIg1-6gydF4y2BaHm 1.3µm);gydF4y2BaSASDLD6gydF4y2Ba(neurofascin 155gydF4y2BaIg1-6gydF4y2BaThr216Ala HM 109.3µM);gydF4y2BaSASDLE6gydF4y2Ba(neurofascin 155gydF4y2BaIg1-6gydF4y2BaThr216Ala HM 21.9µM);gydF4y2BaSASDLF6gydF4y2Ba(neurofascin 155gydF4y2BaIg1-6gydF4y2BaThr216Ala HM 5.5µM);gydF4y2BaSASDLG6gydF4y2Ba(neurofascin 155gydF4y2BaIg1-6gydF4y2BaThr216Ala HM 1.1µM);gydF4y2BaSASDLH6gydF4y2Ba(contactin 1gydF4y2BaIg1-6gydF4y2BaCG 24.6µm);gydF4y2BaSASDLJ6gydF4y2Ba(contactin 1gydF4y2BaIg1-6gydF4y2BaCG 12.3µm);gydF4y2BaSASDLK6gydF4y2Ba(contactin 1gydF4y2BaIg1-6gydF4y2BaCG 6.2µm);gydF4y2BaSASDLL6gydF4y2Ba(contactin 1gydF4y2BaIg1-6gydF4y2BaCG 3.1µm);gydF4y2BaSASDLM6gydF4y2Ba(contactin 1gydF4y2BaIg1-6gydF4y2BaHm 21.8µm);gydF4y2BaSASDLN6gydF4y2Ba(contactin 1gydF4y2BaIg1-6gydF4y2BaHm 10.9µm);gydF4y2BaSASDLP6gydF4y2Ba(contactin 1gydF4y2BaIg1-6gydF4y2BaHm 5.5µm);gydF4y2BaSASDLQ6gydF4y2Ba(contactin 1gydF4y2BaIg1-6gydF4y2BaHm 2.7µm);gydF4y2BaSASDLR6gydF4y2Ba(contactin 1gydF4y2Ba菲gydF4y2BaCG 20µm);gydF4y2BaSASDLS6gydF4y2Ba(contactin 1gydF4y2Ba菲gydF4y2BaCG 10µm);gydF4y2BaSASDLT6gydF4y2Ba(contactin 1gydF4y2Ba菲gydF4y2BaCG 5µm);gydF4y2BaSASDLU6gydF4y2Ba(contactin 1gydF4y2Ba菲gydF4y2BaCG 2.5µm);gydF4y2BaSASDLV6gydF4y2Ba(contactin 1gydF4y2Ba菲gydF4y2BaHm 20.5µm);gydF4y2BaSASDLW6gydF4y2Ba(contactin 1gydF4y2Ba菲gydF4y2BaHm 11.1µm);gydF4y2BaSASDLX6gydF4y2Ba(contactin 1gydF4y2Ba菲gydF4y2BaHm 5.5µm);gydF4y2BaSASDLY6gydF4y2Ba(contactin 1gydF4y2Ba菲gydF4y2BaHm 2.4µm)。gydF4y2Ba源数据gydF4y2Ba都提供了这篇论文。gydF4y2Ba
参考文献gydF4y2Ba
免疫球蛋白超家族细胞粘附分子:拉链和信号。gydF4y2Ba咕咕叫。当今。细胞生物。gydF4y2Ba19gydF4y2Ba, 543-550(2007)。gydF4y2Ba
Honig, B. & Shapiro, L.粘附蛋白结构、分子亲和力和细胞-细胞识别原理。gydF4y2Ba细胞gydF4y2Ba181gydF4y2Ba中文信息学报,520-535(2020)。gydF4y2Ba
莫里斯,J.等。在英国生物库中探索心理,精神和心脏代谢特征的接触作用。gydF4y2Ba基因gydF4y2Ba11gydF4y2Ba, 1-17(2020)。gydF4y2Ba
Herron, L. R., Hill, M., Davey, F. & Gunn-Moore, F. J.细胞粘附分子L1家族的细胞内相互作用。gydF4y2Ba生物化学J。gydF4y2Ba419gydF4y2Ba, 519-531(2009)。gydF4y2Ba
Mohebiany, A. N., Harroch, S.和Bouyain, S.接触细胞粘附分子在神经发育中的作用的新见解。gydF4y2Ba放置一般。gydF4y2Ba8gydF4y2Ba, 165-194(2014)。gydF4y2Ba
Sytnyk, V., Leshchyns 'ka, I.和Schachner, M.免疫球蛋白超家族的神经细胞粘附分子调节突触的形成、维持和功能。gydF4y2Ba趋势>。gydF4y2Ba40gydF4y2Ba, 295-308(2017)。gydF4y2Ba
L1家族的结构和功能进化:四个粘附分子比一个好吗?gydF4y2BaMol细胞神经科学gydF4y2Ba15gydF4y2Ba, 1-10(2000)。gydF4y2Ba
Shimoda, Y.和Watanabe, K.接触:神经系统发育和功能中新兴的关键角色。gydF4y2Ba细胞Adh Migr。gydF4y2Ba3.gydF4y2Ba, 64-70(2009)。gydF4y2Ba
Lubetzki, C, Sol-Foulon, N.和Desmazieres, A.中枢神经系统发育和修复过程中的Ranvier节点。gydF4y2BaNat, Rev. Neurol。gydF4y2Ba16gydF4y2Ba, 426-439(2020)。gydF4y2Ba
Rasband, M. N. & Peles, E. Ranvier装配节点的机制。gydF4y2BaNat, Rev.神经科学。gydF4y2Ba22gydF4y2Ba, 7-20(2021)。gydF4y2Ba
谢尔曼,d.l.等。神经束素是建立突发性传导轴突结构域所必需的。gydF4y2Ba神经元gydF4y2Ba48gydF4y2Ba, 737-742(2005)。gydF4y2Ba
Boyle, m.e.等。在有髓鞘的周围神经中,接触蛋白协调了旁阳面分离样连接的组装。gydF4y2Ba神经元gydF4y2Ba30.gydF4y2Ba, 385-397(2001)。gydF4y2Ba
查尔斯,P.等。神经束素是一种神经胶质受体,用于在轴胶质交界处的paranodin/ caspr -contact轴突复合体。gydF4y2Ba咕咕叫。医学杂志。gydF4y2Ba12gydF4y2Ba, 217-220(2002)。gydF4y2Ba
Volkmer, H., Zacharias, U., Norenberg, U.和Rathjen, F. G.。神经束蛋白与轴突蛋白-1,F11和腱蛋白- r的复杂分子相互作用的解剖,促进了直肠细胞的附着和神经突的形成。gydF4y2Ba[j]细胞生物学。gydF4y2Ba142gydF4y2Ba, 1083-1093(1998)。gydF4y2Ba
Gonzalez-Lozano, m.a.等。拼接突触:交联质谱法解决突触蛋白相互作用。gydF4y2Ba科学。睡觉。gydF4y2Ba6gydF4y2Ba, 1-14(2020)。gydF4y2Ba
查特吉,M.,席尔德,D.和特尼森,C. E.中枢神经系统中的接触:在健康和疾病中的作用。gydF4y2Ba神经的回复。Res。gydF4y2Ba14gydF4y2Ba, 206-216(2019)。gydF4y2Ba
免疫球蛋白超家族的神经识别分子:轴突引导和神经元迁移的信号转导。gydF4y2BaNat。>。gydF4y2Ba10gydF4y2Ba, 19-26(2007)。gydF4y2Ba
L1-CAM和N-CAM:从粘附蛋白到药理靶点。gydF4y2Ba趋势制药。科学。gydF4y2Ba36gydF4y2Ba, 769-781(2015)。gydF4y2Ba
查特吉,M.等。脑脊液中接触蛋白1和接触蛋白2作为多发性硬化症轴突结构域功能障碍的潜在生物标志物gydF4y2Ba乘。sci。J.翻译;中国。gydF4y2Ba4gydF4y2Ba, 1-10(2018)。gydF4y2Ba
Zuko, A., Bouyain, S., van der Zwaag, B.和Burbach, J. P.接触:与脑部疾病发育功能相关的结构方面。gydF4y2BaAdv.蛋白质化学结构体。医学杂志。gydF4y2Ba84gydF4y2Ba, 143-180(2011)。gydF4y2Ba
Freigang, J.等。轴突蛋白-1/TAG-1配体结合模块的晶体结构提示神经细胞粘附的拉链机制。gydF4y2Ba细胞gydF4y2Ba101gydF4y2Ba, 425-433(2000)。gydF4y2Ba
Mortl, M., Sonderegger, P., Diederichs, K. & Welte, W. .人类TAG-1配体结合模块的晶体结构提示了一种新的亲同性相互作用模式。gydF4y2Ba蛋白质科学。gydF4y2Ba16gydF4y2Ba, 2174-2183(2007)。gydF4y2Ba
蛋白酪氨酸磷酸酶PTPRZ和PTPRG与神经识别分子接触蛋白家族的不同成员结合。gydF4y2Ba自然科学进展。美国gydF4y2Ba107gydF4y2Ba, 2443-2448(2010)。gydF4y2Ba
Thomas, J. L, Bouyain, S. & Harroch, S.接触蛋白-1与酪氨酸磷酸酶PTPRZ之间的复合物控制少突胶质细胞前体细胞的发育。gydF4y2Ba自然科学进展。美国gydF4y2Ba108gydF4y2Ba科学通报,17498-17503(2011)。gydF4y2Ba
Nikolaienko, r.m.等。接触蛋白家族成员与神经组织中G型蛋白酪氨酸磷酸酶受体相互作用的结构基础。gydF4y2Ba生物。化学。gydF4y2Ba291gydF4y2Ba中文信息学报,21335-21349(2016)。gydF4y2Ba
Karuppan, s.j.等。脊椎动物接触蛋白和淀粉样前体蛋白家族的成员通过一个保守的界面相互作用。gydF4y2Ba生物。化学。gydF4y2Ba298gydF4y2Ba, 101541-101557(2022)。gydF4y2Ba
詹纳提安,M.等。两个粘附系统协同调节中枢神经系统的轴突鞘鞘和髓鞘生长。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 1-15(2019)。gydF4y2Ba
伊拉撒等人。结间和旁结的协调粘附控制少突胶质细胞精确的髓鞘形成。gydF4y2Ba[j]细胞生物学。gydF4y2Ba218gydF4y2Ba中文信息学报,2887-2895(2019)。gydF4y2Ba
Klingseisen, A.等。少突胶质细胞神经束蛋白在中枢神经系统中独立调节髓鞘靶向和鞘生长。gydF4y2BaDev细胞。gydF4y2Ba51gydF4y2Ba, 730-744(2019)。gydF4y2Ba
刘海,Focia, P. J., He, X.神经细胞粘附分子L1家族成员神经束蛋白的嗜同性粘附机制。gydF4y2Ba生物。化学。gydF4y2Ba286gydF4y2Ba; 797-805(2011)。gydF4y2Ba
He, Y., Jensen, G. J. & Bjorkman, P. J.神经细胞黏附分子L1介导的嗜同性黏附的低温电子断层扫描。gydF4y2Ba结构gydF4y2Ba17gydF4y2Ba, 460-471(2009)。gydF4y2Ba
Hassel, B., Rathjen, F. G.和Volkmer, H.神经束蛋白基因的组织和发育调控的选择性剪接分析。gydF4y2Ba生物。化学。gydF4y2Ba272gydF4y2Ba, 28742-28749(1997)。gydF4y2Ba
Kriebel, M., Wuchter, J., Trinks, S.和Volkmer, H.神经束蛋白:神经元可塑性和稳定性之间的切换。gydF4y2BaInt。学生物化学j。细胞生物。gydF4y2Ba44gydF4y2Ba, 694-697(2012)。gydF4y2Ba
Pruss, T., Kranz, e.u., Niere, M. & Volkmer, H.小鸡神经束蛋白同种异构体的调节开关调节配体识别和神经突延伸。gydF4y2BaMol细胞神经科学gydF4y2Ba31gydF4y2Ba, 354-365(2006)。gydF4y2Ba
Zonta, B.等。神经束蛋白的胶质和神经元同种异构体在中枢神经系统兰维耶淋巴结的组装中具有不同的作用。gydF4y2Ba[j]细胞生物学。gydF4y2Ba181gydF4y2Ba, 1169-1177(2008)。gydF4y2Ba
皮莱,a.m.等。小鼠髓鞘胶质特异性神经束蛋白(Nfasc NF155)的时空消融揭示了副神经轴胶质连接的逐渐丧失和伴随的轴突结构域的紊乱。gydF4y2Baj . >。Res。gydF4y2Ba87gydF4y2Ba, 1773-1793(2009)。gydF4y2Ba
Nans, A., Einheber, S., Salzer, J. L.和Stokes, D. L.中枢神经系统旁神经分离样连接和相关轴突和胶质细胞骨架的电子断层扫描。gydF4y2Baj . >。Res。gydF4y2Ba89gydF4y2Ba, 310-319(2011)。gydF4y2Ba
科恩,c.c.h.等。沿有髓鞘轴突的跳跃传导涉及轴突周围的纳米电路。gydF4y2Ba细胞gydF4y2Ba180gydF4y2Ba中文信息学报,311-322(2020)。gydF4y2Ba
卡伦,c.l.等。轴周和节的可塑性调节成年小鼠脑的动作电位传导。gydF4y2Ba细胞的代表。gydF4y2Ba34gydF4y2Ba, 1-15(2021)。gydF4y2Ba
Lucic, V., Yang, T., Schweikert, G., Forster, F. & Baumeister, W.突触间隙中分子复合物的形态学表征。gydF4y2Ba结构gydF4y2Ba13gydF4y2Ba, 423-434(2005)。gydF4y2Ba
Zuber, B., Nikonenko, I., Klauser, P., Muller, D.和Dubochet, J. .哺乳动物中枢神经突触间隙包含高密度的周期性组织复合体。gydF4y2Ba自然科学进展。美国gydF4y2Ba102gydF4y2Ba, 192 - 197(2005)。gydF4y2Ba
陶志林等。兴奋性和抑制性突触的分化和特征的冷冻电子断层扫描和相关显微镜。gydF4y2Baj . >。gydF4y2Ba38gydF4y2Ba, 1493-1510(2018)。gydF4y2Ba
Gollan, L., Salomon, D., Salzer, J. L.和Peles, E. Caspr调节接触蛋白的加工并抑制其与神经束蛋白的结合。gydF4y2Ba[j]细胞生物学。gydF4y2Ba163gydF4y2Ba, 1213-1218(2003)。gydF4y2Ba
Bonnon, C.等。PGY重复序列和n-聚糖控制paranodin的运输及其与接触蛋白和神经束蛋白的选择性关联155。gydF4y2Ba摩尔。杂志。细胞gydF4y2Ba18gydF4y2Ba, 229-241(2007)。gydF4y2Ba
Labasque, M.等。特异性接触n -聚糖与周围神经病的神经束蛋白结合和自身免疫靶向有关。gydF4y2Ba生物。化学。gydF4y2Ba289gydF4y2Ba, 7907-7918(2014)。gydF4y2Ba
Thaxton, C.等。神经束蛋白(Nfasc)免疫球蛋白结构域5和6的体内缺失揭示了髓鞘轴突的结构域特异性需求。gydF4y2Baj . >。gydF4y2Ba30.gydF4y2Ba科学通报,4868-4876(2010)。gydF4y2Ba
基于股票的jsPISA蛋白寡聚物状态检测。gydF4y2Ba核酸类。gydF4y2Ba43gydF4y2Ba, 314-319(2015)。gydF4y2Ba
里奥斯,j.c.等。接触蛋白相关蛋白(Caspr)和接触蛋白形成一种复合物,在髓鞘形成过程中靶向副神经结。gydF4y2Baj . >。gydF4y2Ba20.gydF4y2Ba, 8354-8364(2000)。gydF4y2Ba
Kelley, L. A, Mezulis, S., Yates, C. M., Wass, M. N. & Sternberg, M. J.蛋白质建模、预测和分析的Phyre2门户网站。gydF4y2BaProtoc Nat。gydF4y2Ba10gydF4y2Ba, 845-858(2015)。gydF4y2Ba
生物系统中的信号起始:瞬态细胞外蛋白相互作用的性质和检测。gydF4y2Ba摩尔。Biosyst。gydF4y2Ba5gydF4y2Ba, 1405-1412(2009)。gydF4y2Ba
chatigner, L. M. P, Leloup, N. & Janssen, B. J. C.细胞外识别和几种i型跨膜受体构象变化的结构观点。gydF4y2Ba前面。摩尔。Biosci。gydF4y2Ba7gydF4y2Ba, 1-13(2020)。gydF4y2Ba
M. F.等人。髓鞘相关糖蛋白粘附和信号传导的结构基础。gydF4y2BaCommun Nat。gydF4y2Ba7gydF4y2Ba, 1-13(2016)。gydF4y2Ba
莱尼,a.c.和赫克,a.j. r.s Native质谱法:名字里有什么?gydF4y2Baj。Soc。质量范围。gydF4y2Ba28gydF4y2Ba, 5-13(2017)。gydF4y2Ba
Yamagata, M. & Sanes, J. R.扩展视网膜层特异性的Ig超家族代码:接触的表达和作用。gydF4y2Baj . >。gydF4y2Ba32gydF4y2Ba, 14402-14414(2012)。gydF4y2Ba
彭玉仁等。Satb1调节接触蛋白5形成哺乳动物视网膜神经节细胞的树突。gydF4y2Ba神经元gydF4y2Ba95gydF4y2Ba, 869-883(2017)。gydF4y2Ba
Mikulska-Ruminska, K.等。用单分子AFM和SMD研究多结构域神经元细胞粘附蛋白接触的纳米力学。gydF4y2Ba科学。代表。gydF4y2Ba7gydF4y2Ba, 1-11(2017)。gydF4y2Ba
雷德,C.等。轴突蛋白-1结构域排列的意义来源于其NgCAM结合位点的定位。gydF4y2BaEMBO J。gydF4y2Ba15gydF4y2Ba(1996年)。gydF4y2Ba
De Angelis, E.等。神经细胞粘附分子L1的病理性错义突变影响嗜同性和嗜异性的结合活性。gydF4y2BaEMBO J。gydF4y2Ba18gydF4y2Ba, 4744-4753(1999)。gydF4y2Ba
哈斯佩尔,J.等。L1/Ng-CAM促进神经突生长的关键和最佳Ig结构域。gydF4y2Baj .一般。gydF4y2Ba42gydF4y2Ba, 287-302(2000)。gydF4y2Ba
De Angelis, E, Watkins, A, Schafer, M, brummenendorf, T. & Kenwrick, S. L1 CAM疾病相关突变干扰配体相互作用和细胞表面表达。gydF4y2Ba嗡嗡声。摩尔,麝猫。gydF4y2Ba11gydF4y2Ba, 1-12(2002)。gydF4y2Ba
Kunz, B.等。轴突蛋白-1/TAG-1通过顺式辅助的反式相互作用介导细胞-细胞粘附。gydF4y2Ba生物。化学。gydF4y2Ba277gydF4y2Ba[j], 2002。gydF4y2Ba
Pavlou, O.等人。粘附分子TAG-1及其结构域与其他免疫球蛋白超家族成员的相互作用分析。gydF4y2BaMol细胞神经科学gydF4y2Ba20.gydF4y2Ba, 367-381(2002)。gydF4y2Ba
Gouveia, R. M, Gomes, C. M, Sousa, M., Alves, P. M. & Costa, J. L1亲和相互作用的动力学分析:前四个免疫球蛋白结构域的作用及其结合机制的意义。gydF4y2Ba生物。化学。gydF4y2Ba283gydF4y2Ba, 28038-28047(2008)。gydF4y2Ba
Ispolatov, I., Yuryev, A., Mazo, I.和Maslov, S.蛋白质相互作用网络中同型二聚体的结合特性和进化。gydF4y2Ba核酸类。gydF4y2Ba33gydF4y2Ba, 3629-3635(2005)。gydF4y2Ba
Tang, H.等。由侧链介导的细胞-细胞粘附结构。gydF4y2Ba自然科学进展。美国gydF4y2Ba115gydF4y2Ba, 9246-9251(2018)。gydF4y2Ba
Pourhoseini, S., Goswami-Sewell, D.和Zuniga-Sanchez, E.神经束蛋白是外视网膜杆状光感受器突触的一个新组成部分。gydF4y2Ba前面。神经回路gydF4y2Ba15gydF4y2Ba, 1-13(2021)。gydF4y2Ba
favre - sarrailh, C, Gennarini, G, Goridis, C. & Rougon, G.发育中的小鼠小脑中F3/F11细胞表面分子的表达在突触位点和颗粒细胞内是极化的。gydF4y2Baj . >。gydF4y2Ba12gydF4y2Ba, 257-267(1992)。gydF4y2Ba
Ren, Q. & Bennett, V.在细胞粘附分子L1家族中高度保守的跨膜区域的神经束蛋白棕榈酰化。gydF4y2Baj . Neurochem。gydF4y2Ba70gydF4y2Ba, 1839-1849(1998)。gydF4y2Ba
Pacharra, S, Hanisch, F. G. & Breloy, I.神经束蛋白186在粘蛋白结构域内外被o -甘露糖基化。gydF4y2BaJ.蛋白质组学。gydF4y2Ba11gydF4y2Ba, 3955-3964(2012)。gydF4y2Ba
Tuvia, S., Garver, T. D.和Bennett, V.神经束蛋白FIGQY酪氨酸的磷酸化状态决定了锚蛋白结合活性和细胞分离模式。gydF4y2Ba自然科学进展。美国gydF4y2Ba94gydF4y2Ba, 12957-12962(1997)。gydF4y2Ba
张,A.等。神经束蛋白140是一种胚胎神经束蛋白异构体,可促进朗维耶结的组装。gydF4y2Baj . >。gydF4y2Ba35gydF4y2Ba, 2246-2254(2015)。gydF4y2Ba
弗雷尔,A.等。轴突初始段的反馈驱动组装。gydF4y2Ba神经元gydF4y2Ba104gydF4y2Ba, 305-321(2019)。gydF4y2Ba
favre - sarrailh, C, Falk, J., Pollerberg, E., Schachner, M.和Rougon, G. NrCAM,神经元粘附分子F3的小脑颗粒细胞受体,在生长锥中显示出动作蛋白依赖的移动性。gydF4y2BaJ.细胞科学。gydF4y2Ba112gydF4y2Ba, 3015-3027(1999)。gydF4y2Ba
Wu, Y., Vendome, J., Shapiro, L., Ben-Shaul, A.和Honig, B.结合亲和力从三维到二维的转化与钙粘蛋白聚类的应用。gydF4y2Ba自然gydF4y2Ba475gydF4y2Ba, 510-513(2011)。gydF4y2Ba
Chen, C. P, Posy, S., Ben-Shaul, A., Shapiro, L.和Honig, B. H.细胞-细胞粘附的特异性:通过β -链交换的低亲和二聚化的关键作用。gydF4y2Ba自然科学进展。美国gydF4y2Ba102gydF4y2Ba, 8531-8536(2005)。gydF4y2Ba
Katsamba, P.等。钙粘蛋白介导的黏附中的分子亲和力和细胞特异性。gydF4y2Ba自然科学进展。美国gydF4y2Ba106gydF4y2Ba, 11594-11599(2009)。gydF4y2Ba
佩莱斯,E.等。鉴定一种新的与蛋白-蛋白相互作用相关的多结构域的接触相关跨膜受体。gydF4y2BaEMBO J。gydF4y2Ba16gydF4y2Ba, 978-988(1997)。gydF4y2Ba
布朗,a.a.等人。自发性糖尿病BB-Wistar大鼠淋巴结区分子结构未发生改变。gydF4y2Baj . >。Res。gydF4y2Ba65gydF4y2Ba, 139-149(2001)。gydF4y2Ba
D 'Este, E., Kamin, D., Balzarotti, F.和Hell, S. W.周围神经系统Ranvier淋巴结的显微结构解剖。gydF4y2Ba自然科学进展。美国gydF4y2Ba114gydF4y2Ba, 191-199(2017)。gydF4y2Ba
杜贝西,a.l.等。少突胶质细胞分泌的Contactin多分子复合物在中枢神经系统结蛋白聚集中的作用。gydF4y2Ba神经胶质gydF4y2Ba67gydF4y2Ba中文信息学报,2248-2263(2019)。gydF4y2Ba
Stathopoulos, P., Alexopoulos, H. & Dalakas, M. C.脱髓鞘疾病中Ranvier淋巴结的自身免疫抗原靶点。gydF4y2BaNat, Rev. Neurol。gydF4y2Ba11gydF4y2Ba, 143-156(2015)。gydF4y2Ba
豪厄尔,o.w.等。神经束蛋白定位的破坏揭示了多发性硬化症脱髓鞘和再髓鞘形成之前的早期变化。gydF4y2Ba大脑gydF4y2Ba129gydF4y2Ba中文信息学报,373 - 385 (2006)gydF4y2Ba
查特吉,M.等。接触蛋白-1在帕金森病患者脑脊液中减少,并存在于路易体中。gydF4y2Ba生物分子gydF4y2Ba10gydF4y2Ba, 1-14(2020)。gydF4y2Ba
班福德,r.a.等。接触蛋白与淀粉样前体蛋白的相互作用及其在阿尔茨海默病中的作用。gydF4y2Ba神经科学gydF4y2Ba424gydF4y2Ba, 184-202(2020)。gydF4y2Ba
Chatterjee, M. & Teunissen, C.接触与阿尔茨海默病:突触蛋白、接触可能与阿尔茨海默病的病理有关。gydF4y2Ba神经科学gydF4y2Ba424gydF4y2Ba, 182-183(2020)。gydF4y2Ba
顾旸,李涛,Kapoor, A., Major, P., Tang, D.一种重要的促进肿瘤进展和转移的致癌蛋白。gydF4y2Ba基因gydF4y2Ba11gydF4y2Ba, 1-22(2020)。gydF4y2Ba
梁勇,马,昌,李,富,聂,国,张辉,接触蛋白1在癌症中的作用:迄今为止我们所知道的。gydF4y2Ba前面。肿瘤防治杂志。gydF4y2Ba10gydF4y2Ba, 1-7(2020)。gydF4y2Ba
温特,G.等。DIALS:新集成包的实现和评估。gydF4y2BaActa Crystallogr。d结构。医学杂志。gydF4y2Ba74gydF4y2Ba, 85-97(2018)。gydF4y2Ba
我的数据有多好?分辨率是多少?gydF4y2BaActa Crystallogr。d杂志。Crystallogr。gydF4y2Ba69gydF4y2Ba中文信息学报,2013年第4期。gydF4y2Ba
埃文斯,p.r.介绍数据缩减:空间群的确定,尺度和强度统计。gydF4y2BaActa Crystallogr。d杂志。Crystallogr。gydF4y2Ba67gydF4y2Ba, 282-292(2011)。gydF4y2Ba
Tickle, I. J.等。STARANISO(编辑剑桥UKGPL, 2018)。gydF4y2Bahttp://staraniso.globalphasing.org/cgi-bin/staraniso.cgigydF4y2Ba。gydF4y2Ba
McCoy, A. J.等。相位晶体软件。gydF4y2Baj:。Crystallogr。gydF4y2Ba40gydF4y2Ba, 658-674(2007)。gydF4y2Ba
Afonine, P. V.等。用phenix.refine实现晶体结构的自动细化。gydF4y2BaActa Crystallogr。d杂志。Crystallogr。gydF4y2Ba68gydF4y2Ba, 352-367(2012)。gydF4y2Ba
Emsley, P. & Cowtan, K. Coot:分子图形的模型构建工具。gydF4y2BaActa Crystallogr。d杂志。Crystallogr。gydF4y2Ba60gydF4y2Ba, 2126-2132 (2004)gydF4y2Ba
Murshudov, g.n.等。REFMAC5用于大分子晶体结构的细化。gydF4y2BaActa Crystallogr。d杂志。Crystallogr。gydF4y2Ba67gydF4y2Ba, 355-367(2011)。gydF4y2Ba
威廉姆斯,c.j.等人。MolProbity:为改进全原子结构验证提供更多更好的参考数据。gydF4y2Ba蛋白质科学。gydF4y2Ba27gydF4y2Ba中文信息学报,293-315(2018)。gydF4y2Ba
Afonine, P. V.等。FEM:特征增强地图。gydF4y2BaActa Crystallogr。d杂志。Crystallogr。gydF4y2Ba71gydF4y2Ba, 646-666(2015)。gydF4y2Ba
Hagemans, D., van Belzen, I. A., Moran Luengo, T.和Rudiger, S. G.一个突出蛋白质表面的疏水性和电荷的脚本。gydF4y2Ba前面。摩尔。Biosci。gydF4y2Ba2gydF4y2Ba, 1-11(2015)。gydF4y2Ba
Dolinsky, t.j., Nielsen, j.e., McCammon, j.a.和Baker, n.a. PDB2PQR:用于泊松-玻尔兹曼静电计算设置的自动管道。gydF4y2Ba核酸类。gydF4y2Ba32gydF4y2Ba, 665-667(2004)。gydF4y2Ba
Baker, n.a., Sept, D, Joseph, S., Holst, m.j.和McCammon, j.a.纳米系统的静电:微管和核糖体的应用。gydF4y2Ba自然科学进展。美国gydF4y2Ba98gydF4y2Ba科学通报,10037-10041(2001)。gydF4y2Ba
Ashkenazy, H.等。ConSurf 2016:一种估计和可视化大分子进化守恒的改进方法。gydF4y2Ba核酸类。gydF4y2Ba44gydF4y2Ba, 344-350(2016)。gydF4y2Ba
UniProt: 2021年的通用蛋白质知识库。gydF4y2Ba核酸类。gydF4y2Ba49gydF4y2Ba, 480-489(2021)。gydF4y2Ba
国家生物技术信息中心的数据库资源。gydF4y2Ba核酸类。gydF4y2Ba46gydF4y2Ba, 8-13(2018)。gydF4y2Ba
Goodsell, D. S, Autin, L. & Olson, A. J.图解:生物分子图解软件。gydF4y2Ba结构gydF4y2Ba27gydF4y2Ba, 1716-1720(2019)。gydF4y2Ba
Robert, X. & Gouet, P.用新的ENDscript服务器解密蛋白质结构的关键特征。gydF4y2Ba核酸类。gydF4y2Ba42gydF4y2Ba, 320-324(2014)。gydF4y2Ba
菲利克,J.等。DAWN 2的二维x射线衍射和小角散射数据处理。gydF4y2Baj:。Crystallogr。gydF4y2Ba50gydF4y2Ba, 959-966(2017)。gydF4y2Ba
Konarev, P. V., Volkov, V. V., Sokolova, a . V., Koch, M. H. J. & Svergun, D. PRIMUS:基于Windows pc的小角度散射数据分析系统。gydF4y2Baj:。Crystallogr。gydF4y2Ba36gydF4y2Ba, 1277-1282(2003)。gydF4y2Ba
Schneidman-Duhovny, D, Hammel, M., Tainer, J. A. & Sali, A. FoXS, FoXSDock和MultiFoXS:基于SAXS谱的蛋白质及其复合物的单态和多态结构建模。gydF4y2Ba核酸类。gydF4y2Ba44gydF4y2Ba, 424-429(2016)。gydF4y2Ba
用沉降速度、超离心和lamm方程模型分析大分子的粒径分布。gydF4y2BaBiophys。J。gydF4y2Ba78gydF4y2Ba, 1606-1619(2000)。gydF4y2Ba
Pederick, d.t.等。相互排斥指导平行海马体网络的精确组装。gydF4y2Ba科学gydF4y2Ba372gydF4y2Ba, 1068-1073(2021)。gydF4y2Ba
Schindelin, J.等。斐济:生物图像分析的开源平台。gydF4y2BaNat方法。gydF4y2Ba9gydF4y2Ba, 676-682(2012)。gydF4y2Ba
范·罗萨姆G,德雷克f·L。gydF4y2BaPython 3参考手册gydF4y2Ba(CreateSpace, 2009)。gydF4y2Ba
统计数据可视化。gydF4y2BaJ.开源软件。gydF4y2Ba6gydF4y2Ba, 1-4(2021)。gydF4y2Ba
致谢gydF4y2Ba
我们感谢DLS光束线I03和I24的工作人员帮助收集x射线衍射数据,以及光束线B21的工作人员帮助收集SAXS数据。L.M.P.C.感谢Nick Pearce, Jitse van der Horn和Gijs van der Schot对晶体学的教学对话。K562细胞是来自荷兰癌症研究所的巴斯·范·斯汀塞尔博士的礼物。该项目已获得欧洲研究委员会(ERC)在欧盟地平线2020研究和创新计划下的资助,资助协议号为677500(给B.J.C.J.)。D.H.M.感谢家长们对KIND基金的支持,该基金由卡夫利纳米科学研究所、代尔夫特生物科学系和世界卫生组织斯宾诺莎奖赞助。M.A.d.B.和A.J.R.H.感谢荷兰科学研究组织(NWO)通过x组学路线图计划(项目184.034.019)资助荷兰蛋白质组学中心的支持。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
B.J.C.J.构思了这个项目。L.M.P.C.用B.J.C.J. B.J.C.J.的输入设计实验,L.M.P.C.和J.C.M.G.克隆了各种结构。L.M.P.C.用B.J.C.J.提供的数据纯化重组蛋白,并进行了结构和生物物理实验(x射线衍射、SAXS、SEC和SPR), B.J.C.J.处理了x射线衍射数据。D.M.E.T.-W。进行SV-AUC实验和数据分析。M.A.d.B.在A.J.R.H. C.G.和C.P.F.的支持下进行了原生质谱实验和数据分析,D.H.M. B.J.C.J.在D.H.M. B.J.C.J.的支持下监督了该项目。L.M.P.C.和B.J.C.J.分析了结构信息并撰写了手稿。所有作者都对手稿作了评论。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益冲突。gydF4y2Ba
同行评审gydF4y2Ba
同行评议信息gydF4y2Ba
自然通讯gydF4y2Ba感谢U. Helena Danielson, Shuya Fukai, Piotr Neumann和其他匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Bab施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接从版权所有者处获得许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
查塔格纳,L.M.P,戈古,C,登波尔,文学硕士gydF4y2Baet al。gydF4y2Ba接触蛋白1 -神经束蛋白155粘连复合体的结构见解。gydF4y2BaNat CommungydF4y2Ba13gydF4y2Ba, 6607(2022)。https://doi.org/10.1038/s41467-022-34302-9gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-022-34302-9gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果你发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba