摘要gydF4y2Ba
RAS-RAF通路是人类癌症中最常见的失调通路之一gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.尽管经过了几十年的研究,对二聚化和激活背后的分子机制的了解gydF4y2Ba4 gydF4y2BaRAF激酶的活性仍然有限。无活性RAF单体的最新结构gydF4y2Ba5gydF4y2Ba和活性RAF二聚体gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7 gydF4y2Ba,gydF4y2Ba8gydF4y2Ba绑定到14-3-3gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba揭示了14-3-3通过特定的磷酸丝氨酸残基稳定两种RAF构象的机制。在RAF二聚化之前,蛋白磷酸酶1催化亚基(PP1C)必须去磷酸化RAF的n端磷酸丝氨酸(NTpS)gydF4y2Ba11gydF4y2Ba尽管分离出来的PP1C缺乏内在的底物选择性。SHOC2是一种重要的支架蛋白,参与PP1C和RAS去磷酸化RAF NTpSgydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba但SHOC2的结构和假定的SHOC2 - pp1c - ras复合物的结构仍然未知。在这里,我们展示了SHOC2 - PP1C - MRAS复合物的冷冻电子显微镜结构,其总体分辨率为3 Å,揭示了一个新月形的SHOC2充当摇篮并将PP1C和MRAS聚集在一起的三元分子结构。我们的工作证明了多种RAS亚型对复合物形成的GTP依赖性,描述了RAS亚型对复合物组装的偏好,并揭示了SHOC2支架和RAS如何共同驱动PP1C对RAF NTpS的特异性。我们的数据表明,疾病相关突变影响复杂的组装,揭示了RAF激活同时需要两个RAS分子,并为发现针对这一途径的新一类抑制剂建立了合理的途径。gydF4y2Ba
主要gydF4y2Ba
RAS超家族在人类中有36个成员gydF4y2Ba2gydF4y2Ba包括三种主要的RAS亚型:HRAS、KRAS和NRAS(以下统称为H/K/NRAS),它们是人类癌症中最常突变的gydF4y2Ba3.gydF4y2Ba,以及相关的MRAS。RAS蛋白是gtp依赖的细胞内分子开关,锚定在质膜上,通过直接结合和膜募集激活RAF激酶,导致RAF二聚化和通路激活gydF4y2Ba4 gydF4y2Ba.致癌突变也发生在RAF中,促进RAF二聚gydF4y2Ba14gydF4y2Ba以及驱动通路激活,既依赖于RAS,也独立于RASgydF4y2Ba15gydF4y2Ba.这促使人们努力将这一途径的药理干预作为一种抗癌治疗策略gydF4y2Ba16gydF4y2Ba.尽管这些努力在临床中显示出了疗效,但已经出现了重新激活RAS-RAF通路的多种耐药机制gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba并加强对通过RAS和RAF信号的分子更深层次理解的重要性。gydF4y2Ba
在通路激活之前,RAF通过与特定的NTpS (BRAF中的pS365)相互作用,被14-3-3困在催化无活性构象中,这是14-3-3依赖性负调控所必需的gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba19gydF4y2Ba磷酸丝氨酸(pS) c端连接RAF激酶结构域gydF4y2Ba5gydF4y2Ba(茶多糖)。在RAS-RAF结合和通路激活后,14-3-3二聚体结合到两个RAF分子的cps上,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba8gydF4y2Ba诱导二聚体和活性激酶构象gydF4y2Ba4 gydF4y2Ba,增加RAF激酶对组成型相关底物MEK的活性gydF4y2Ba7 gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba.无活性RAF向活性RAF转变的关键步骤是通过蛋白磷酸酶PP1C对NTpS残基进行去磷酸化,以防止活性二聚RAF逆转为无活性单体RAFgydF4y2Ba21gydF4y2Ba.PP1C调节细胞内的许多途径,其各种底物的特异性由200多种调节蛋白控制,其中大多数使用氨基酸的线性延伸与PP1C接合gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba.特异性地去磷酸化RAF的NTpSgydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2BaPP1C依赖于与富亮氨酸重复序列(LRR)蛋白SHOC2以及RAS蛋白的结合gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.gydF4y2Ba
而一些报道表明MRAS单独可与SHOC2-PP1C相互作用gydF4y2Ba11gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,其他人则涉及其他RAS亚型gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba.尽管RAS与效应蛋白的结合取决于其GDP或gtp结合状态,但SHOC2-PP1C-RAS复合物中RAS的核苷酸状态尚未明确定义。与调节RAF单体-二聚体转变的作用一致,SHOC2敲低导致RAF二聚体减少gydF4y2Ba27gydF4y2Ba.基因敲除gydF4y2BaShoc2gydF4y2Ba抑制kras突变癌细胞系亚群的生长,并抑制kras驱动的肺癌小鼠模型中的肿瘤生长gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba表明SHOC2功能对RAS-RAF通路的激活至关重要。尽管如此,20多年来,SHOC2和ras驱动的PP1C活性对RAF的增强以及随后的RAF激活背后的结构和分子机制仍然难以捉摸。为了帮助从结构上理解由SHOC2、RAS和PP1C介导的RAF激活机制,我们组装并表征了SHOC2 - PP1C - RAS复合物。gydF4y2Ba
RAS与SHOC2-PP1C的结合依赖于gtpgydF4y2Ba
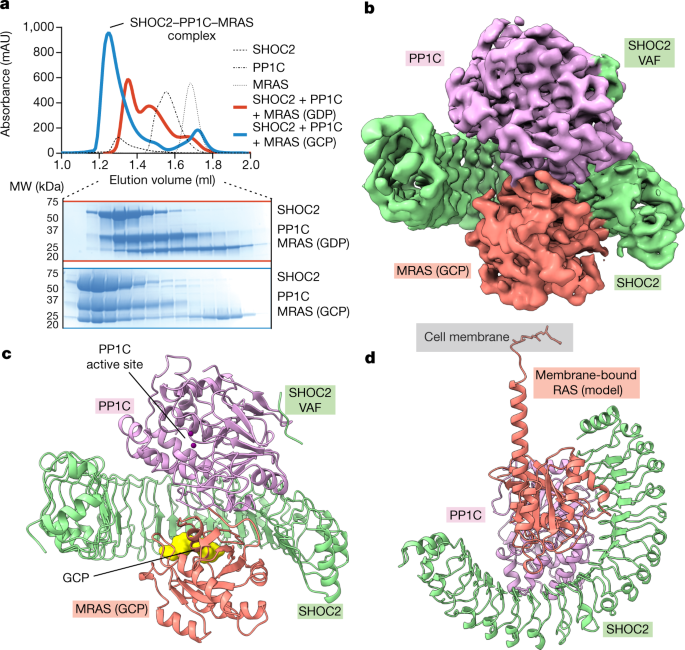
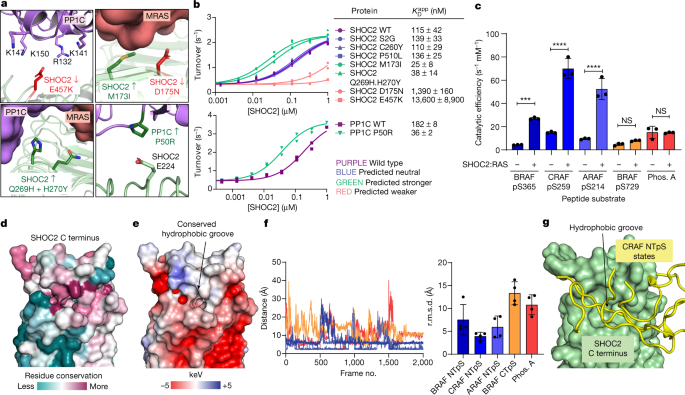
考虑到SHOC2同时参与PP1C和RAS的作用,我们推测有可能在体外产生一个稳定的SHOC2、PP1C和RAS复合物。首先,我们纯化了重组表达的全长SHOC2, PP1C的γ-亚型(PPP1CCγ;在这里称为“PP1C”)和RAS蛋白(HRAS, KRAS, MRAS和NRAS),用GDP或不可水解的GTP类似物GMP-PCP(以下简称GCP)装载每个RAS,并使用质谱法确认完全核苷酸装载(扩展数据图。gydF4y2Ba1gydF4y2Ba).然后,我们用过量的PP1C和RAS培养SHOC2,并通过尺寸排除色谱(SEC)评估复合物的形成,发现SHOC2、PP1C和MRAS(图。gydF4y2Ba1gydF4y2Ba),以及H/K/NRAS(扩展数据图。gydF4y2Ba1 bgydF4y2Ba)在RAS与gcp结合时形成三向复合物,而在RAS与gdp结合时则不形成,这表明三向SHOC2-PP1C-RAS复合物的形成依赖于gtp。表面等离子体共振(SPR)实验进一步证实了gtp结合RAS的选择性(扩展数据图)。gydF4y2Ba2 a - cgydF4y2Ba).PP1C对于三元复合物的形成至关重要,因为gcp结合的RAS无法与SHOC2形成二元复合物(扩展数据图)。gydF4y2Ba二维gydF4y2Ba).在RAS与gdp结合的所有情况下,我们观察到不包括RAS的SHOC2和PP1C二元复合物(图2)。gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba1 bgydF4y2Ba).MRAS(GDP)与H/K/NRAS的不同之处在于其与PP1C形成二元复合物的能力(图1)。gydF4y2Ba1gydF4y2Ba).我们试图通过生物化学和结构研究来了解这种复杂形成的分子基础及其对gcp结合RAS的明显依赖。gydF4y2Ba
一个gydF4y2Ba, SEC痕迹显示存在MRAS(GCP)时SHOC2-PP1C-MRAS复合物的三向形成,而不存在MRAS(GDP)时(上),SEC组分的SDS-PAGE分析(下)。两个独立实验的结果具有代表性。gydF4y2BabgydF4y2Ba, SHOC2(绿色)PP1C(紫色)MRAS(鲑鱼)复合物的Cryo-EM密度图,未细化。gydF4y2BacgydF4y2Ba, SHOC2-PP1C-MRAS复合物的结构显示GCP(黄色)和暴露于溶剂中用于底物结合的PP1C活性位点。gydF4y2BadgydF4y2Ba,通过RAS烯酰化C端锚定在膜上的SHOC2-PP1C-RAS复合物模型(鲑鱼显示用法尼酰化KRAS的C端螺旋模拟的MRAS(GCP);蛋白质数据库(PDB) ID: 5TAR)。gydF4y2Ba
为了确认我们已经组装了一个功能相关的SHOC2-PP1C-RAS复合物,我们测量了有和没有SHOC2-RAS (GCP)的PP1C对以BRAF NTpS (pS365)为中心的30个残基肽的去磷酸化活性。三元复合物对BRAF含ntps的肽底物表现出比单独PP1C更高的活性(扩展数据图)。gydF4y2Ba2 egydF4y2Ba),表明复合物的形成赋予了SHOC2-PP1C-RAS复合物对BRAF NTpS去磷酸化的特异性。gydF4y2Ba
接下来,我们确定了126 kDa SHOC2-PP1C-MRAS (GCP)复合物的冷冻电子显微镜(cro - em)结构,总体分辨率为3.0 Å。该结构揭示了SHOC2采用月牙形结构,大约50 Å宽,35 Å深,有20个lrr,并作为一个摇篮将PP1C和MRAS聚集在一起,每个蛋白质与其他两个蛋白质接触,形成一个三向复合体(图2)。gydF4y2Ba1 b, cgydF4y2Ba扩展数据图gydF4y2Ba3 fgydF4y2Ba及扩展数据表gydF4y2Ba1gydF4y2Ba).PP1C和MRAS,以及它们所结合的SHOC2 LRRs,在电子密度图中得到了很好的解析(扩展数据图。gydF4y2Ba3 egydF4y2Ba而且gydF4y2Ba4 a、bgydF4y2Ba).与单个晶体结构相比,PP1C在与SHOC2形成复合物时没有发生大规模的构象变化,而MRAS仅在其动态开关I和II区域存在差异(扩展数据图)。gydF4y2Ba4摄氏度gydF4y2Ba).在细胞环境中,由于RAS被戊烯化并与膜结合,我们的结构显示了如何通过RAS(GTP)将SHOC2和PP1C招募到膜上(图2)。gydF4y2Ba1 dgydF4y2Ba).在SHOC2-PP1C-RAS复合物面向膜的一侧没有观察到明显的膜相互作用静电(扩展数据图)。gydF4y2Ba4 dgydF4y2Ba),提示RAS可能是shoc2结合PP1C的膜募集的唯一原因。gydF4y2Ba
为了进一步表征SHOC2,我们确定了它的x射线晶体结构的分辨率为3.2 Å(扩展数据图。gydF4y2Ba4 egydF4y2Ba及扩展数据表gydF4y2Ba2gydF4y2Ba).然而,单独的SHOC2的整体结构与与PP1C-RAS复合物的SHOC2相似,PP1C-RAS结合诱导了SHOC2新月的构象变化。SHOC2经历了一个在lrr中均匀分布的扭曲,导致c端端与n端端相比倾斜了9°(扩展数据图)。gydF4y2Ba4 fgydF4y2Ba).gydF4y2Ba
我们还获得了SHOC2-PP1C-KRAS配合物的低温em数据和2D类平均。优选的粒子取向排除了3D重建,尽管2D类平均表明SHOC2-PP1C-KRAS复合体采用与SHOC2-PP1C-MRAS复合体相同的总体结构(扩展数据图。gydF4y2Ba3 bgydF4y2Ba).基于小角x射线散射(SAXS)实验的分子建模进一步证实了MRAS-和kras -含三元配合物采用相似的结构(扩展数据图)。gydF4y2Ba5中gydF4y2Ba).SHOC2-PP1C-MRAS低温- em数据集中的一小部分颗粒采用了2:2:2的六聚体络合物(SHOC2-PP1C-MRAS异三聚体的二聚体),这与我们的SEC结果一致(图2 - pp1c - mras异三聚体的二聚体)。gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba3 bgydF4y2Ba)和我们的SAXS数据(扩展数据图。gydF4y2Ba5 a, b, fgydF4y2Ba).明显灵活的三聚体-三聚体界面和优选的粒子取向阻碍了这种六聚体shoc2 - ppc1 - mras复合物的高分辨率3D重建。gydF4y2Ba
PP1C与SHOC2相互作用gydF4y2Ba
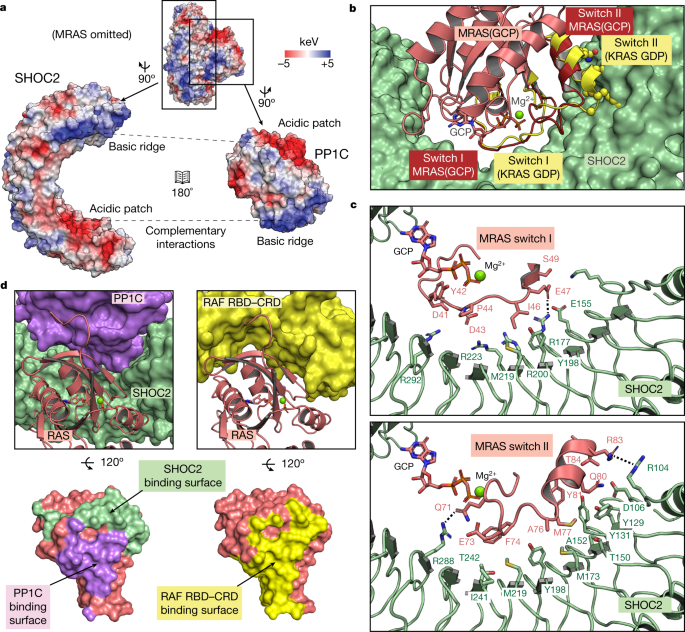
我们的结构揭示了SHOC2和PP1C主要通过两种蛋白质之间的两大块电荷互补相互作用(图。gydF4y2Ba2gydF4y2Ba).对PDB中所有可用的PP1C全酶结构的分析表明,这些带电斑块被SHOC2同时接合代表了已知PP1C全酶复合物中独特的PP1C结合模式。为了评估这些相互作用对复杂装配的重要性,我们测量了表观亲和度(gydF4y2BaKgydF4y2BaDgydF4y2Ba应用程序gydF4y2Ba使用BRAF NTpS的三元配合物的特定去磷酸化活性来形成三元配合物(扩展数据图)。gydF4y2Ba6gydF4y2Ba)作为复杂地层的替代品。在SHOC2上的任何一个补丁上的电荷逆转突变都取消了SHOC2形成三向复合物的能力,而在基本补丁外的电荷逆转的影响要小得多(扩展数据图)。gydF4y2Ba6 bgydF4y2Ba).gydF4y2Ba
一个gydF4y2BaSHOC2和PP1C的静电表面在酸性(红色)和碱性(蓝色)斑块之间创建了互补的结合界面。为了清晰起见,省略了MRAS。gydF4y2BabgydF4y2Ba, MRAS(GCP)(鲑鱼)通过其开关I和II区域(暗红色)与SHOC2(绿色)相互作用。gdp结合KRAS (PDB: 4OBE)的开关I和II区域(黄色)的对齐显示了选定的侧链(球体),揭示了与SHOC2的空间冲突。为了清晰起见,省略了PP1C。gydF4y2BacgydF4y2Ba, MRAS(GCP)开关I(三文鱼,上)和开关II(三文鱼,下)与SHOC2(绿色)相互作用的详细视图,关键氢键和π-堆叠相互作用以虚线表示。gydF4y2BadgydF4y2Ba左图突出显示的是RAS(鲑鱼色)与SHOC2(绿色)和PP1C(紫色)结合界面,它们与RAF RBD-CRD结合表面(黄色,右)有相当大的重叠。gydF4y2Ba
PP1C结合调节蛋白使用特定的小线性基序(slim)与PP1C结合,如RVxF, SILK和KiR,以形成全酶gydF4y2Ba23gydF4y2Ba,gydF4y2Ba31gydF4y2Ba.对所有可用的PP1C结构的分析显示,PP1C使用其表面的两个保守位点与调控亚基相互作用,其中包括无处不在的slim结合位点,以及PP1C完全相反一侧的一个不太突出的相反位点(扩展数据图)。gydF4y2Ba6摄氏度gydF4y2Ba).SHOC2序列中的基序SLVK(残基329-332,SILK型)和KIPF(残基369-372,RVxF型)-先前被认为是与pp1s结合的slimgydF4y2Ba32gydF4y2Ba-位于SHOC2 LRR新月的外表面,不与我们结构中的PP1C相互作用。然而,在我们的结构中,PP1C中的slim结合位点包含了结合的VxF motif的密度,可能来自N端SHOC2残基64-66 (VAF)。来自其他PP1C结合伙伴的该区域的高分辨率x射线晶体结构与该密度很好地叠加(扩展数据图。gydF4y2Ba6 d-fgydF4y2Ba),而shoc2n末端的其余部分(残基1-85)是无序的(扩展数据图。gydF4y2Ba3 egydF4y2Ba而且gydF4y2Ba5 dgydF4y2Ba).因此,除了主要的通过电荷互补的SHOC2 - PP1C相互作用外,我们的结构还揭示了在SHOC2的N端存在一个之前未被识别的典型PP1C结合基序。虽然SEC分析表明n端截断了SHOC2 (SHOC2-ΔN;残基91-582),去除该基序(以及SHOC2中的无序区域),可形成SHOC2- ppc1 - ras复合体,SHOC2-ΔN表现出约40倍的弱gydF4y2BaKgydF4y2BadgydF4y2Ba应用程序gydF4y2Ba比全长SHOC2(扩展数据图。gydF4y2Ba7 a、bgydF4y2Ba),表明SHOC2中的VAF motif在功能上是相关的。我们的结果证实了在基于细胞的下拉实验中,SHOC2的n端区域对于三聚体复合物形成的必要性gydF4y2Ba32gydF4y2Ba.gydF4y2Ba
在SHOC2-PP1C-RAS复合物的背景下,PP1C α, β和γ异构体之间的生物学和结合亲和力差异已被报道,尽管它们具有高度的同源性gydF4y2Ba26gydF4y2Ba.然而,我们的结构表明,在异构体之间的大多数不同的残基不会与SHOC2或MRAS映射到PP1C结合界面,并且这三个不同的残基在异构体之间存在保守差异(扩展数据图)。gydF4y2Ba7 cgydF4y2Ba).我们发现所有的PP1C亚型都能通过SEC形成一个SHOC2-PP1C-MRAS复合物(扩展数据图)。gydF4y2Ba7 dgydF4y2Ba).当SHOC2 - PP1C - ras复合物的一部分出现时,所有PP1C亚型都表现出对BRAF NTpS催化活性的特征增加,而SHOC2也表现出类似的情况gydF4y2BaKgydF4y2BadgydF4y2Ba应用程序gydF4y2Ba所有PP1C异构体在三向复合物形成中的值(扩展数据图。gydF4y2Ba7 e, fgydF4y2Ba).所有PP1C异构体也能与MRAS(GDP)形成二元络合物(扩展数据图)。gydF4y2Ba7 ggydF4y2Ba).总之,这些数据表明,报道的PP1C异构体之间的差异是由其形成SHOC2-PP1C-RAS复合物的固有能力以外的因素引起的,例如相对表达水平或细胞内的定位。gydF4y2Ba
RAS与SHOC2-PP1C或RAF结合,但不能同时结合gydF4y2Ba
RAS蛋白包含两个动态区域,称为开关I和II,在GDP-GTP交换时改变构象gydF4y2Ba33gydF4y2Ba.我们的结构揭示了MRAS主要通过这些区域与SHOC2接触,为我们在生物化学上观察到的复合物形成的GTP依赖性提供了分子基础。已知GTP水解为GDP会导致开关II螺旋向外移动。这将有望与SHOC2产生位阻碰撞,并破坏将损害复合物形成的关键MRAS-SHOC2相互作用(图2)。gydF4y2Ba2 bgydF4y2Ba).在gtp结合状态下,关键的MRAS-SHOC2相互作用包括E47-R177和Q71-R288氢键,以及R83-R104 π-堆叠相互作用。在Q71和Y81之间的开关II上的一段残基形成了与SHOC2的疏水相互作用网络。gydF4y2Ba2摄氏度gydF4y2Ba).gydF4y2Ba
RAS在MAPK信号通路中的主要功能是通过结合RAF的RAS结合域(RBD)和富半胱氨酸结构域(CRD)来激活RAF。我们的SHOC2-PP1C-MRAS结构中的RAS结合表面与CRAF中结合RBD和CRD结构域的RAS结合表面的比较gydF4y2Ba34gydF4y2Ba显示RAS使用相同的表面结合SHOC2-PP1C和RAF(RBD-CRD),这将排除一个RAS分子同时结合RAF(RBD-CRD)和SHOC2-PP1C(图。gydF4y2Ba二维gydF4y2Ba).SEC分析证实BRAF RBD和CRAF RBD都不能与SHOC2-PP1C-KRAS复合物相互作用,但能够结合不属于SHOC2-PP1C-KRAS复合物的游离KRAS(扩展数据图)。gydF4y2Ba8gydF4y2Ba).由于一个RAS分子与SHOC2-PP1C或RAF(RBD-CRD)的结合是互斥的,因此这些结果表明两个独立的RAS分子分别结合SHOC2-PP1C和RAF(RBD-CRD)是必要的。为了在细胞膜上发生RAF NTpS的去磷酸化,一个RAS分子将招募SHOC2-PP1C,另一个RAS分子将招募RAF,使酶(PP1C)和底物(磷酸化的RAF NTpS)共定位,导致RAF激活。gydF4y2Ba
SHOC2-PP1C优先与MRAS结合gydF4y2Ba
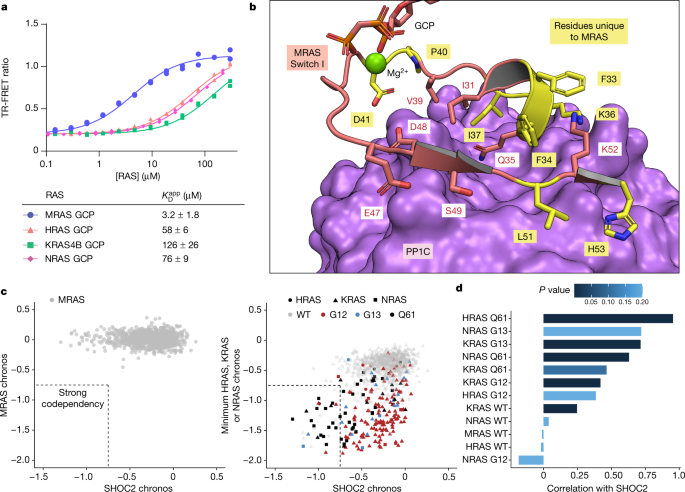
接下来,我们试图解决关于MRAS以外的RAS亚型是否可以与SHOC2-PP1C结合的冲突数据gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba26gydF4y2Ba在我们自己的数据显示H/K/NRAS也可以参与复杂的形成(扩展数据图。gydF4y2Ba2 bgydF4y2Ba).由于SHOC2-PP1C-RAS复合物中的每个蛋白质都与其他两个蛋白质形成直接接触,我们推断其中一个伙伴的结合将协同调节其余对的结合gydF4y2Ba35gydF4y2Ba,与我们的去磷酸化实验结果一致(扩展数据图。gydF4y2Ba8 bgydF4y2Ba).我们测量了不同RAS亚型在三元配合物中增加荧光共振能量转移(FRET)标记的SHOC2和PP1C的关联的能力。MRAS(GCP)能诱导复合物的形成,且具有明显的降低gydF4y2BaKgydF4y2BaDgydF4y2Ba应用程序gydF4y2Ba(即与HRAS(GCP)、KRAS(GCP)、NRAS(GCP)相比,具有更强的表观亲和力(图2)。gydF4y2Ba3gydF4y2Ba),表明MRAS(GCP)是测试的异构体中SHOC2-PP1C-RAS复合物中较强的结合伙伴,其结合倍数为20 - 40倍。H/K/NRAS仍然表现出结合,尽管相对较弱。这些差异也与KRAS和MRAS增加pp1c - shoc2介导的底物肽去磷酸化能力的不同有关(扩展数据图)。gydF4y2Ba8 cgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba, Top,在不同RAS浓度下TR-FRET测量PP1C与SHOC2相关性的代表性结果。数据代表两个时间点(gydF4y2BangydF4y2Ba= 2)。底部,表格汇总gydF4y2BaKgydF4y2BaDgydF4y2Ba应用程序gydF4y2Ba来自两个独立进行的实验(gydF4y2BangydF4y2Ba= 2)。MRAS(GCP)是被测者中与SHOC2-PP1C亲和度最高的结合伙伴。gydF4y2BaKgydF4y2BaDgydF4y2Ba应用程序gydF4y2Ba值(以平均值±s.d表示)是一种相对亲和性的测量,依赖于PP1C和SHOC2浓度。[PP1C] = 2 nM, [SHOC2] = 200 nM。gydF4y2BabgydF4y2Ba, MRAS开关I与PP1C结合的PP1C接触区域(鲑鱼色)(紫色)。MRAS相对于H/K/NRAS的独特残基(黄色)与PP1C有大量接触。为了清晰起见,省略了SHOC2。gydF4y2BacgydF4y2Ba, DepMap chronos评分1061癌细胞系(点)的SHOC2与MRAS(左)或与H/K/NRAS中的最小chronos评分(每个细胞系的三种可能的RAS亚型中的最低评分),其中细胞系由具有最小chronos评分(形状)和该亚型的热点突变状态(颜色)的RAS亚型识别(右)。虚线封装具有强相互依赖性的细胞系(chronos评分< - 0.75)。gydF4y2BadgydF4y2Ba、Pearson相关系数(条)和gydF4y2BaPgydF4y2Ba-value from two-sidedgydF4y2BatgydF4y2Ba-测试(颜色)使用DepMap chronos评分计算SHOC2与HRAS, KRAS, NRAS或MRAS,其中细胞系(gydF4y2BangydF4y2Ba= 1061)按Ras亚型热点突变状态进行分组。gydF4y2Ba
三元配合物中的MRAS-PP1C界面主要由开关I的部分组成,以及开关I的一些残基N-和c端(图1)。gydF4y2Ba3 bgydF4y2Ba).HRAS、KRAS、MRAS和NRAS的序列比较也表明,其中一些残基在所有四种RAS亚型中都是保守的,这与H/K/NRAS也能形成SHOC2-PP1C-RAS复合物的能力一致。然而,MRAS在这些区域有许多独特的残基,我们假设这可能是其对复合物更强的亲和力的原因(扩展数据图)。gydF4y2Ba8 dgydF4y2Ba).除了开关I和开关II区域外,MRAS中的N端和c端段是不同的(扩展数据图。gydF4y2Ba8 dgydF4y2Ba),并且MRAS n端尾部与PP1C的Van der Waals接触可见有限的EM密度(图1)。gydF4y2Ba1 b, cgydF4y2Ba).gydF4y2Ba
我们使用我们的时间分辨FRET (TR-FRET)结合实验来确定这些区域中哪些区域有助于增加MRAS对三元配合物中SHOC2-PP1C的表观亲和力。与野生型MRAS相比,MRAS中开关I PP1C接触残基突变到KRAS中发现的残基显著降低了MRAS的结合亲和力(68µM vs 3µM,gydF4y2BaPgydF4y2Ba= 0.0004)(扩展数据图。gydF4y2Ba8 dgydF4y2Ba),强调了MRAS-PP1C界面在复合物形成中的作用。相比之下,与MRAS N-和/或c -末端片段的KRAS嵌合体与野生型KRAS相比,并没有表现出明显改善的亲和力。总之,这些数据表明开关I和周围的残基是更强的MRAS与SHOC2-PP1C结合的主要决定因素。gydF4y2Ba
依赖于shoc2的肿瘤依赖于H/K/NRASgydF4y2Ba
考虑到H/K/NRAS与SHOC2-PP1C形成生产性复合物的能力(扩展数据图)。gydF4y2Ba1 bgydF4y2Ba)以及它们在癌症中经常发生突变的事实,我们探索了RAS和SHOC2在广泛的肿瘤细胞系面板中对细胞适应性的共同要求。癌症依赖图谱计划(gydF4y2Bahttps://depmap.org/portal/gydF4y2Ba)使用基于CRISPR敲除的功能丧失筛查为癌细胞系提供全基因组依赖性评分gydF4y2Ba36gydF4y2Ba.肿瘤细胞系对特定基因的依赖性由chronos评分量化,该评分量化了与原始肿瘤细胞相比敲除某个基因对细胞适应性的影响。为了评估肿瘤细胞系对SHOC2和RAS的相互依赖性,我们将来自DepMap中所有1061个肿瘤细胞系的SHOC2和MRAS或HRAS、KRAS或NRAS的chronos评分进行了关联。尽管根据我们的生化分析,MRAS是SHOC2- pp1c更强的结合伙伴,但我们发现肿瘤细胞系中的SHOC2和MRAS依赖性之间没有相关性,这表明即使在高度依赖SHOC2的细胞系中,MRAS也是可有可无的(图2)gydF4y2Ba3 c, dgydF4y2Ba).gydF4y2Ba
相比之下,在Q61、G13和g12位点存在热点RAS突变的肿瘤细胞系中,SHOC2 chronos评分与H/K/NRAS chronos评分显著相关。对于对SHOC2和HRAS、KRAS或NRAS中的任何一种具有高度共同依赖性的细胞系(chronos评分< - 0.75),71%的细胞系存在Q61、G13或G12热点突变(34个细胞系中有24个)。gydF4y2Ba3 cgydF4y2Ba扩展数据图gydF4y2Ba8 fgydF4y2Ba及补充表gydF4y2Ba1gydF4y2Ba),表明肿瘤细胞的生长是由突变的HRAS、KRAS或NRAS驱动的,而敲除SHOC2可以使这些细胞系中突变RAS的表型丧失。我们的分析还表明,几乎所有高度依赖于SHOC2的细胞系也依赖于H/K/NRAS的细胞适应度。这说明癌细胞系中SHOC2失活引起的适应度缺陷与H/K/NRAS的致癌活性直接相关,且与MRAS无关。gydF4y2Ba
疾病突变影响复杂的装配gydF4y2Ba
除了SHOC2在肿瘤设置中的作用外,SHOC2、PP1C和MRAS的功能增加和丧失突变已在MAPK信号失调的rasopathy中被确认。在破坏复合物形成的三元复合物中映射到蛋白质-蛋白质界面的突变将被预测在RAF激活中不那么有效,而对于稳定复合物形成的突变将被预测相反。我们表达和纯化了一组已报道的SHOC2突变蛋白,并评估了它们的特异性gydF4y2BaKgydF4y2BaDgydF4y2Ba应用程序gydF4y2Ba诱导SHOC2-PP1C磷酸酶活性增加。界面突变导致MAPK信号缺失(D175N和E457K(映射到一个关键的SHOC2带电斑块)gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba显示较差的复杂关联,而界面突变显示MAPK信号通路的增加gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba(M173I和Q269H/H270Y)表现出较强的复合体关联。一组影响MAPK信号表型的SHOC2突变,但不映射到SHOC2 - pp1c - ras结合接口gydF4y2Ba13gydF4y2Ba,gydF4y2Ba41gydF4y2Ba(S2G、C260Y和P510L)均无影响gydF4y2BaKgydF4y2BaDgydF4y2Ba应用程序gydF4y2Ba,表明这些突变通过影响复合物形成以外的方式发挥作用(图。gydF4y2Ba4 a、bgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba显示功能增益(SHOC2 M173I(右上)、SHOC2(Q269H/H270Y)(左下)和PP1C(P50R)(右下))或功能损失(SHOC2(E457K)(左上)和SHOC2(D175N)(右上))的突变映射到三元配合物中的接口。gydF4y2BabgydF4y2Ba, SHOC2突变体(上)或PP1C突变体(下)的SHOC2滴定代表图gydF4y2BaKgydF4y2BaDgydF4y2Ba应用程序gydF4y2BaSHOC2。[PP1C] = 25 nM, [MRAS(GCP)] = 1µM。数据表示在2分钟和4分钟时间点的肽底物去磷酸化(gydF4y2BangydF4y2Ba= 2)。好的,汇总表显示了SHOC2gydF4y2BaKgydF4y2BaDgydF4y2Ba应用程序gydF4y2Ba从三个独立的实验(gydF4y2BangydF4y2Ba= 3)。WT,野生型。gydF4y2BacgydF4y2Ba, PP1C或SHOC2-PP1C-RAS对肽脱磷酸化的催化效率。当SHOC2-RAS存在时,催化效率提高。数据为均数±标准差。(gydF4y2BangydF4y2Ba= 3)。gydF4y2BaPgydF4y2Ba从Tukey的多重比较检验(单侧)计算的值。***gydF4y2BaPgydF4y2Ba= 0.001, ****gydF4y2BaPgydF4y2Ba≤0.001。NS,不显著。BRAF pS729:gydF4y2BaPgydF4y2Ba= 0.9942,磷酸化酶A pS15 (Phos。一个):gydF4y2BaPgydF4y2Ba> 0.9999。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba, SHOC2的C端,显示残馀守恒(gydF4y2BadgydF4y2Ba)和静电势(gydF4y2BaegydF4y2Ba).gydF4y2BafgydF4y2Ba,在四次GaMD模拟(左)过程中,对pS+13 (BRAF中的pS+12)(肽疏水残基)到Ile669(在SHOC2疏水槽中)距离的定量,从四个独立的模拟中分别获得平均均方根平方偏差(r.m.s.d) (gydF4y2BangydF4y2Ba= 4)(右)。数据为均数±s.e.m。gydF4y2BaggydF4y2Ba,来自PCA峰的CRAF NTpS的四个稳定状态(黄色)(扩展数据图。gydF4y2Ba10gydF4y2Ba),显示肽与SHOC2疏水槽的相互作用。为了清晰起见,省略了PP1C和肽N末端。模型由SHOC2 C端排列,为清晰起见,仅显示一个SHOC2分子。gydF4y2Ba
除了SHOC2, ppc β P49R突变(ppc γ上的P50)也被确定为导致努南综合征(一种RASopathy)样表型gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba.gydF4y2BaKgydF4y2BaDgydF4y2Ba应用程序gydF4y2BaP50R突变比野生型PP1C更强。这在结构上是合理的,因为P50R突变将与邻近的SHOC2 E224引入一种新的稳定离子相互作用(图2)。gydF4y2Ba4 a、bgydF4y2Ba).最后,导致努南综合征的MRAS突变gydF4y2Ba44gydF4y2Ba如G23V(相当于KRAS G13V)和T68I(相当于KRAS T58I)出现在不直接与三元配合物相互作用的区域,但预计会通过增加gtp结合mras的比例来影响复合物的形成——类似于众所周知的致癌KRAS突变。总之,这些结果表明,即使是由其中一些突变引起的相对温和的四到五倍的亲和变化也可以充分调节MAPK信号以引起疾病,而改变的SHOC2-PP1C-RAS复合物关联是大部分已确定的ras病的生化原因。gydF4y2Ba
SHOC2-RAS驱动RAF的PP1C特异性gydF4y2Ba
鉴于RAF NTpS是SHOC2-PP1C-RAS的生物学靶点,我们接下来试图了解SHOC2-PP1C-RAS复合物如何决定其靶点去磷酸化的特异性。作为全长无活性RAF的替代品,我们评估了PP1C单独或SHOC2-PP1C-KRAS复合物去磷酸化一组磷酸化肽的能力,使我们能够确定催化效率(gydF4y2BaVgydF4y2Ba马克斯gydF4y2Ba/gydF4y2BaKgydF4y2Ba米gydF4y2Ba;在哪里gydF4y2BaVgydF4y2Ba马克斯gydF4y2Ba酶催化反应在无限浓度的底物和时的速度是多少gydF4y2BaKgydF4y2Ba米gydF4y2Ba为Michaelis-Menten常数)的PP1C,是衡量底物偏好的指标。来自于SHOC2-PP1C-RAS复合物的生物靶点ARAF、BRAF和CRAF(以下统称为A/B/CRAF)的NTpS被该复合物去磷酸化,其催化效率明显高于PP1C单独去磷酸化(图1)。gydF4y2Ba4摄氏度gydF4y2Ba和扩展数据图。gydF4y2Ba9gydF4y2Ba),表明三元配合物的形成直接促进了PP1C识别RAF NTpS底物的能力。相反,不被认为是复合物的特定生物靶标的肽(BRAF CTpS和不相关的PP1C靶标磷酸化酶A pS15(“非靶标肽”))(图。gydF4y2Ba4摄氏度gydF4y2Ba和扩展数据图。gydF4y2Ba9gydF4y2Ba),以及通用磷酸酶底物pNPP(扩展数据图。gydF4y2Ba9 bgydF4y2Ba)被PP1C以相似的催化效率去磷酸化,无论是否存在SHOC2和RAS,这表明SHOC2 - RAS对RAF NTpS的肽识别是特异性的。gydF4y2Ba
为了测试RAF中NTpS之外的保守区域是否也有助于特异性,我们用SEC测试了BRAF激酶结构域与SHOC2-PP1C-RAS复合物之间的结合,但没有观察到复合物的形成(扩展数据图)。gydF4y2Ba9 cgydF4y2Ba).这个结果,加上我们之前观察到的RAF RBD不与SHOC2-PP1C-RAS复合物结合(扩展数据图。gydF4y2Ba8gydF4y2Ba),表明三元复合物不与RAF的有序结构域结合,特异性的决定因素是围绕RAF NTpS的序列。gydF4y2Ba
在弱底物条件下,更好地理解SHOC2-PP1C-RAS识别RAF区域的结构基础gydF4y2BaKgydF4y2Ba米gydF4y2Ba对于NTpS,我们生成了RAF NTpS与复合物结合的模型,并使用分子动力学模拟对其进行了表征。对来自NTpS区域的多个物种的所有RAF亚型的序列校准显示,A/B/CRAF NTpS肽的c端半部分是保守的,并含有几个疏水残基(扩展数据图)。gydF4y2Ba9 d, egydF4y2Ba).来自NTpS的pS中的磷酸盐必须与SHOC2-PP1C-RAS中的PP1C活性位点相互作用。对不同物种的SHOC2、PP1C和MRAS的表面残留守恒分析显示,在shoc2c末端存在一个保守的疏水槽,以及先前确定的PP1C活性位点旁边的疏水槽gydF4y2Ba23gydF4y2Ba(无花果。gydF4y2Ba4 d, egydF4y2Ba和扩展数据图。gydF4y2Ba9 fgydF4y2Ba).由于这些区域在复合物的结构中彼此相邻,我们假设邻近pS的NTpS c端区域可能与PP1C活性位点附近的疏水斑块结合(扩展数据图)。gydF4y2Ba9 fgydF4y2Ba),随后的残基可与shoc2c末端的疏水槽结合(图2)gydF4y2Ba4 d, egydF4y2Ba).与此模型一致的是,我们的催化数据表明,在PP1C之外,底物肽的特异性主要依赖于SHOC2而不是RAS(扩展数据图)。gydF4y2Ba8 bgydF4y2Ba).单独的SHOC2可以诱导更高水平的PP1C活性,但RAS只能在非常高的浓度(超过100µM)下才能做到这一点(由于增加了总复合物亲和力,两者仍然是协同的)。因此,我们建立了从PP1C活性位点和疏水槽延伸到SHOC2疏水槽的A/B/CRAF NTpS肽模型,以及基于与A/B/CRAF NTpS模型相同的空间位置(仅在肽序列上有所不同)的非靶标肽模型。gydF4y2Ba
为了验证这些模型,我们进行了高斯加速分子动力学gydF4y2Ba45gydF4y2Ba(GaMD)模拟这些复合物,以确定稳定的肽-蛋白质相互作用。在所有情况下,pS残基与PP1C活性位点稳定相互作用,正如预期的那样(补充视频gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba5gydF4y2Ba).每个轨迹的主成分分析(PCA)揭示了每个肽结合复合物的几个稳定状态簇(扩展数据图)。gydF4y2Ba10gydF4y2Ba).对于A/B/CRAF NTpS,来自每个稳定状态的代表结构显示疏水c端P-V /M基序与SHOC2疏水槽相互作用(图2)。gydF4y2Ba4 ggydF4y2Ba),而在非目标肽上的这个位置则不是这样(扩展数据图。gydF4y2Ba10gydF4y2Ba).为了量化这种相互作用,我们从该区域选择了一个具有代表性的残基对(肽残基pS+13和SHOC2 Ile669),并发现在模拟过程中,a /B/CRAF NTpS肽的平均成对距离小于非目标肽(图2)。gydF4y2Ba4 fgydF4y2Ba).总之,这些结果表明A/B/CRAF NTpS的c端部分的疏水残基与SHOC2相互作用,提供了一种SHOC2 - ppc1 - ras底物识别机制。gydF4y2Ba4 ggydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
MRAS是否仅负责SHOC2-PP1C复合物的形成和RAF去磷酸化gydF4y2Ba11gydF4y2Ba,gydF4y2Ba32gydF4y2Ba或者其他RAS亚型是否也与SHOC2-PP1C形成功能复合物gydF4y2Ba13gydF4y2Ba是一个长期存在的问题。同样,RAS的GTP负载是否需要与SHOC2-PP1C复合物产生有效的相互作用还不清楚。这可能源于难以确定gtp负载状态和细胞中每种蛋白质的相对浓度。通过体外重组蛋白重组该系统,我们发现尽管gtp结合的MRAS是对SHOC2-PP1C复合物具有最高亲和力的结合伙伴,但gtp结合的H/K/NRAS也能形成高效的全酶复合物。gydF4y2Ba
正常情况下,MRAS是SHOC2-PP1C的首选结合对象(亲和力高20倍左右),而H/K/NRAS蛋白是RAF的首选结合对象gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba(亲和度高10倍左右)。这表明,与RAS - raf (RBD-CRD)复合物相比,MRAS在形成SHOC2-PP1C-RAS复合物方面比H/K/NRAS具有大约200倍的选择性,尽管每个RAS蛋白的细胞水平和GTP负载状态也会调节这种平衡。我们对DepMap数据的分析表明,MRAS敲除在强烈依赖SHOC2生存的癌细胞系中具有良好的耐受性,这与H/K/NRAS可能在某些情况下替代MRAS的假设一致。与H/K/NRAS敲除的严重后果相比,MRAS敲除小鼠要么没有表型,要么只有轻微缺陷,这也是一致的gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba.gydF4y2Ba
在具有某些H/K/NRAS热点突变(G13/Q61)的癌细胞系中,对SHOC2的依赖尤其明显,这表明与这些突变的RAS亚型形成的SHOC2 - pp1c复合物可能是细胞生长的驱动因素。这些突变导致RAS GTP水解和核苷酸交换速率异常gydF4y2Ba51gydF4y2Ba导致与野生型相比RAS(GTP)升高,可能高到足以与SHOC2-PP1C形成直接复合物。与MRAS是基础条件下首选的SHOC2-PP1C结合伙伴一致,H/K/NRAS - shoc2的相互依赖在没有热点RAS突变的细胞中很少可见,因为当途径不具有构成性活性时,gtp结合的高H/K/NRAS水平可能不会持续。gydF4y2Ba
由于单个RAS分子不能同时结合SHOC2-PP1C和RAF RBD-CRD,生长因子诱导的MAPK通路激活导致RAS(GTP),并将SHOC2-PP1C和RAF招募到不同的蛋白复合物的膜上。我们的数据表明,SHOC2-PP1C-RAS复合物特异性地去磷酸化短线性RAF NTpS肽,但不与有序的RAF结构域结合。因此,要发生有效的NTpS:PP1C相互作用,需要将NTpS从非活性RAF复合体中的保护性14-3-3结合位点暴露出来。这意味着RAS与RAF RBD-CRD结合必须发生在PP1C与SHOC2-RAS结合的NTpS去磷酸化之前。我们的数据还表明,NTpS序列的特异性直接由PP1C和SHOC2决定,RAS在SHOC2 - PP1C - RAS复合物中的功能在于SHOC2和PP1C的膜定位。同时限制RAS-RAF和RAS-SHOC2-PP1C复合物到二维膜环境将允许底物RAF NTpS和磷酸酶PP1C的共定位,以精确的空间和时间激活MAPK信号(扩展数据图)。gydF4y2Ba10 bgydF4y2Ba).gydF4y2Ba
许多癌细胞系与突变的H/K/NRAS和SHOC2表现出很强的相关性或依赖性。成年小鼠可耐受SHOC2基因敲除gydF4y2Ba28gydF4y2Ba然而,敲除MAPK通路的许多其他成分是致命的。此外,对RAS和RAF抑制的抵抗通常通过重新激活MAPK途径发生。这表明SHOC2-PP1C-RAS复合物是一个有吸引力的治疗靶点。我们的数据显示,SHOC2 - PP1C - RAS复合物的功能可以通过多种机制被靶向,包括改变RAS开关II的构象,通过阻断结合界面破坏复合物,或通过靶向从PP1C延伸到SHOC2的扩展底物结合面。通过与现有MAPK通路抑制剂靶点正交的节点(如SHOC2-PP1C-RAS复合物)进一步抑制MAPK通路,可能有助于在相关肿瘤中更有效地下调ERK信号。gydF4y2Ba
方法gydF4y2Ba
SHOC2的表达与纯化gydF4y2Ba
SHOC2构造(gydF4y2Ba智人gydF4y2Ba残基2-582,(除了SHOC2ΔN,残基91-582))表达在gydF4y2BaSpodoptera frugiperdagydF4y2Ba9 (Sf9)细胞。收集细胞并在−80°C保存。细胞球在每1 l球100 ml的SHOC2 SEC缓冲液(10%甘油,20 mM Tris pH 7.5, 500 mM NaCl, 1 mM TCEP)中重新悬浮,补充20 mM咪唑,1片无edta蛋白酶抑制剂片,0.2 mg Benzonase和裂解洗涤剂0.3% Sb3-14和0.03% C7BzO。将溶液均质,并在4°C下与每1 l含ni的MagBeads (Genscript)颗粒1 ml孵育1小时。用SHOC2 SEC缓冲液+ 20 mM咪唑洗涤珠粒,用SHOC2 SEC缓冲液+ 500 mM咪唑洗脱蛋白。用TEV裂解SHOC2,在4°C下透析到SHOC2 SEC缓冲液中过夜,然后重新应用于镍珠。含有SHOC2的流集中在Superdex S200 16/600上,并在SHOC2 SEC缓冲液中运行。将含有纯化的SHOC2的组分混合、浓缩并在液氮上快速冷冻。gydF4y2Ba
PP1C的表达及纯化gydF4y2Ba
PP1C结构(gydF4y2Ba智人gydF4y2Ba残基1-323)表达于gydF4y2Ba大肠杆菌gydF4y2BaBL21(DE3) Tuner细胞在Terrific Broth培养基中添加1mm MnClgydF4y2Ba2gydF4y2Ba.表达在gydF4y2Ba一个gydF4y2Ba600gydF4y2Ba50 μ M IPTG = 1.0,在17℃过夜表达。收集细胞并在−80°C保存。每1升PP1C SEC缓冲液(20 mM Tris pH 7.5, 700 mM NaCl, 1 mM MnCl) 100 ml重悬细胞球gydF4y2Ba2gydF4y2Ba, 1 mM TCEP),添加咪唑20 mM,无edta蛋白酶抑制剂片1片,苄唑酶0.2 mg,裂解洗涤剂0.3% Sb3-14和0.03% C7BzO,溶菌酶20 mg。将溶液均质,并在4°C下与每1 l含ni的MagBeads (Genscript)颗粒2ml孵育1小时。珠粒用PP1C SEC缓冲液+ 20 mM咪唑清洗,蛋白用PP1C SEC缓冲液+ 500 mM咪唑洗脱。对PP1C进行TEV裂解,在4℃下透析到PP1C SEC缓冲液中过夜,并重新应用于镍珠。含有PP1C的流过液被浓缩,并在Superdex S75 16/600上运行在PP1C SEC缓冲液中。将含有纯PP1C的组分混合、浓缩并在液氮上快速冷冻。gydF4y2Ba
RAS基因的表达与纯化gydF4y2Ba
H/K/NRAS结构(gydF4y2BaHgydF4y2Ba.gydF4y2Ba智人gydF4y2Ba残基:HRAS, 2-189;喀斯特,1 - 188;国家管制当局方面,2 - 189;KRASΔHVR, 1-169)表达于gydF4y2Ba大肠杆菌gydF4y2BaBL21(DE3)细胞置于TB自诱导培养基中,17°C, 48h。MRAS结构(gydF4y2BaHgydF4y2Ba.人类残基1-208)和KRAS-MRAS嵌合体在Sf9细胞中表达。收集细胞并在−80°C保存。每1升RAS SEC缓冲液(20 mM Tris pH 7.5, 150 mM NaCl, 1 mM MgCl) 100 ml重悬细胞球gydF4y2Ba2gydF4y2Ba, 1 mM TCEP),添加20 mM咪唑,无edta蛋白酶抑制剂片1片,0.2 mg苄唑酶,0.3 % Sb3-14和0.03% C7BzO裂解洗涤剂和20 mg溶菌酶(用于gydF4y2Ba大肠杆菌gydF4y2Ba表达的蛋白质)。将溶液均质,用每1升含镍磁珠(Genscript)颗粒2ml孵育。珠粒用RAS SEC缓冲液+ 20 mM咪唑洗涤,蛋白用RAS SEC缓冲液+ 500 mM咪唑洗脱。对RAS进行TEV裂解,在4°C下透析成RAS SEC缓冲液+ 10µM GDP过夜,并重新应用于镍珠。含有流经的RAS浓缩在Superdex S75 16/600上,在RAS SEC缓冲液+ 10µM GDP中运行。含有纯GDP负载RAS的馏分被混合、浓缩并在液氮上快速冷冻。gydF4y2Ba
对于GCP负载的RAS构造,将纯化的RAS与50倍摩尔过量的GCP、10 U碱性磷酸酶琼脂糖珠(Sigma)混合,并在37°C下搅拌1小时。蛋白被缓冲交换到25 mM Tris pH 7.5, 100 mM NaCl, 5 mM MgCl中gydF4y2Ba2gydF4y2Ba, 10 μ M GCP,在液氮中快速冷冻。gydF4y2Ba
质谱分析gydF4y2Ba
每个样品50微克缓冲交换成50毫米醋酸铵,pH值为7。样品直接使用TriVersa NanoMate (Advion)注入,并通过5微米喷嘴ESI芯片(Advion)的纳米电喷雾电离在线分析到Thermo Exactive Plus EMR Orbitrap质谱仪(Thermo Fisher Scientific)中。采用UniDec软件对采集的质谱数据进行分析gydF4y2Ba52gydF4y2Ba.gydF4y2Ba
分析美国证券交易委员会gydF4y2Ba
单个蛋白质或配合物在20 mM Tris pH 7.5, 100 mM NaCl, 1 mM TCEP, 0.5 mM MnCl中平衡的排除尺寸柱上运行gydF4y2Ba2gydF4y2Ba, 0.5 mM MgClgydF4y2Ba2gydF4y2Ba.用考马斯蓝染色SDS-PAGE分析各组分。所使用的列为:gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba1 bgydF4y2Ba,gydF4y2Ba二维gydF4y2Ba,gydF4y2Ba7 a, dgydF4y2Ba,gydF4y2Ba8gydF4y2Ba而且gydF4y2Ba9 cgydF4y2Ba: s200 3.2/300;扩展数据图。gydF4y2Ba7 ggydF4y2Ba: s75 3.2/300。gydF4y2Ba
Cryo-EM网格准备和数据收集gydF4y2Ba
将SEC纯SHOC2-PP1C-RAS复合物在RAS SEC缓冲液+ 10µM GCP中稀释至约11 μM,取4 μl GCP涂抹在孔洞金网格上(Ultrafoil R1.2/1.3;Quantifoil),使用Solarus等离子体清洁器(Gatan)发光放电20秒。使用Vitrobot (Thermo Fisher Scientific)将网格吸干3.5 s,设置为4°C和100%相对湿度,并浸入液态乙烷中。gydF4y2Ba
为了制备氧化石墨烯涂层栅格,采用了永久水化法gydF4y2Ba53gydF4y2Ba.多孔金网格(Ultrafoil R1.2/1.3;Quantifoil)使用Solarus等离子体清洗剂(Gatan)放电20秒,4 μl氧化石墨烯薄片(Sigma-Aldrich)新鲜稀释至0.2 mg mlgydF4y2Ba−1gydF4y2Ba在DDI水中施加于EM网格的正面(有孔洞层的一侧)。孵育50秒后,将4µl SEC纯SHOC2-PP1C-RAS复合物(在RAS SEC缓冲液+ 10µM GCP中稀释至约1 μM)涂于EM网格的背面(有网格的一侧)。在没有进一步孵育的情况下,使用Vitrobot (Thermo Fisher Scientific)将网格吸干3.5 s,设置为4°C和100%相对湿度,并浸入液态乙烷中。gydF4y2Ba
数据收集使用Titan Krios (Thermo Fisher Scientific)在300kev下工作,配备BioQuantum能量过滤器(20 eV狭缝宽度)和K3 (Gatan)直接检测摄像机。电影在超分辨率模式下记录,标称放大倍数为105,000×(校准像素大小0.419 Å),每部电影60帧,每帧50 ms,每帧电子通量为1.07 egydF4y2Ba−gydF4y2Ba一个gydF4y2Ba−2gydF4y2Ba(总通量64 egydF4y2Ba−gydF4y2Ba一个gydF4y2Ba−2gydF4y2Ba).使用SerialEM自动收集数据gydF4y2Ba54gydF4y2Ba设置离焦范围0.5 ~ 1.5 μm。gydF4y2Ba
Cryo-EM数据处理和模型构建gydF4y2Ba
冷冻- em数据的初始步骤使用CryoSPARC Live进行处理gydF4y2Ba55gydF4y2Ba.共10780部电影进行了运动校正和CTF校正。CTF拟合度低于7.0 Å的显微照片立即被丢弃,只留下5060张显微照片。使用斑点选取工具选取粒子并进行二维分类。代表蛋白质复合物的2D类被用于重新挑选,结果是一堆3,996,056个颗粒,这些颗粒被导出到CryoSPARC,在那里进行所有进一步的处理。对颗粒进行二维分类,去除垃圾颗粒,剩下1261442个颗粒。用6个3D类进行从头重建,揭示了4类三聚体和1类六聚体SHOC2-PP1C-MRAS体,以及1类低分辨垃圾。包含2个最佳三聚体3D类的共551,091个颗粒被组合并用于非均匀细化gydF4y2Ba56gydF4y2Ba,以最佳从头算3D体积作为起始模型。CTF拟合度低于4.0 Å的显微照片被进一步丢弃,留下3847张显微照片,分离距离小于20 Å的颗粒也被丢弃。剩余的粒子进行进一步的2D分类,分辨率较低的2D分类被丢弃,留下323,910个粒子,使用256像素的盒子大小重新提取。这些粒子进行了最终的非均匀细化,包括细化每个粒子的离焦和每个组的CTF参数(倾斜和三叶)。这导致最终模型的金标准傅里叶壳相关分辨率为2.95 Å。gydF4y2Ba
我们的SHOC2 (PDB: 7DS1)晶体结构,以及现有的MRAS (PDB: 1X1S)和PP1C (PDB: 4MOV)结构最初被ChimeraX放置到密度图中gydF4y2Ba57gydF4y2Ba.改进和构建是用Phenix进行的gydF4y2Ba58gydF4y2Ba真实空间精炼和COOTgydF4y2Ba59gydF4y2Ba分别。使用ChimeraX和PyMol创建分子可视化。gydF4y2Ba
SHOC2晶体结构测定gydF4y2Ba
使用悬滴蒸汽扩散法获得SHOC2晶体,浓度为1 μ l (6.0 mg ml)gydF4y2Ba−1gydF4y2Ba蛋白质在SHOC2 SEC缓冲液与1 μ l母液(100 mM Tris pH 8.5, 200 mM MgClgydF4y2Ba2gydF4y2Ba, 14%(w/v) PEG4000),在16°C的母液库上。x射线衍射数据采集于斯坦福同步辐射光源光束线12-2,x射线波长为0.97946 Å在100 K。数据通过XDS进行集成和缩放gydF4y2Ba60gydF4y2Ba.为了获得相,尝试用各种同源LRR蛋白进行分子置换,其中PDBL 4U06 (gydF4y2Ba钩端螺旋体interrogansgydF4y2BaLRR蛋白LIC10831, 23%序列相同)得到一个溶液。SHOC2链最初放在Phenix Autobuild中,然后迭代地在COOT中构建gydF4y2Ba59gydF4y2Ba并在Phenix中进行了改进gydF4y2Ba58gydF4y2Ba.gydF4y2Ba
在这一过程接近尾声时,SHOC2的预测结构在AlphaFold蛋白质结构数据库中可用gydF4y2Ba61gydF4y2Ba(gydF4y2Bahttps://alphafold.ebi.ac.uk/entry/Q9UQ13gydF4y2Ba),并将预测结构的LRR部分作为分子替代溶液。在建造和改进之后,gydF4y2BaRgydF4y2Ba工作gydF4y2Ba/gydF4y2BaRgydF4y2Ba免费的gydF4y2Ba人工构建的结构显著改善至0.209/0.238,而非0.269/0.300。因此,基于AlphaFold的分子替换溶液,根据我们的实验数据进行人工重建和改进,得到了最终的模型。最终的Ramachandran统计数据为96.1%赞成,3.9%允许,0%异常值。gydF4y2Ba
sec -多角度光散射- saxsgydF4y2Ba
数据收集于ALS光束线12.3.1 LBNL Berkeley, CaliforniagydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Bax射线波长为1.127 Å。所有实验均在20°C下进行,数据处理如前所述gydF4y2Ba64gydF4y2Ba.简而言之,SAXS流池直接与HPLC系统耦合。每个样品的55µl体积通过SEC运行,并在30分钟洗脱期间连续收集3-s x射线曝光。在蛋白洗脱峰之前记录的SAXS帧被用来减去所有其他帧。用旋转半径(gydF4y2BaRgydF4y2BaggydF4y2Ba)由基尼耶近似导出gydF4y2Ba\(我(q) \约(0){{\ rm {e}}} ^ {- {q} ^ {2} {R} _ {{\ rm {g}}} ^ {2} / 3} \)gydF4y2Ba有限制gydF4y2Ba65gydF4y2Ba问gydF4y2BaRgydF4y2BaggydF4y2Ba< 1.5,其中gydF4y2Ba问gydF4y2Ba是散射向量。通过使用程序SCÅTTER比较与背景和Rg相对于记录帧的比值的积分来绘制洗脱峰。最终合并SAXS剖面,通过在洗脱峰处积分多帧得到,用于进一步分析。使用SCÅTTER程序计算gydF4y2BaPgydF4y2Ba(gydF4y2BargydF4y2Ba)函数。gydF4y2Ba
SAXS方案结构建模gydF4y2Ba
基于我们的x射线晶体结构,在modeler中添加了缺失的N端和c端区域,建立了全长SHOC2的模型gydF4y2Ba66gydF4y2Ba.BILBOMDgydF4y2Ba67gydF4y2Ba用于模拟n端区域的构象柔度。然后将SHOC2的实验SAXS剖面与BILBOMD使用FOXS生成的原子模型的理论散射曲线进行比较gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba,然后利用multifox进行多状态模型选择gydF4y2Ba70gydF4y2Ba,gydF4y2Ba71gydF4y2Ba.gydF4y2Ba
基于我们的cryo-EM结构构建了SHOC2-PP1C、SHOC2-PP1C - mras和SHOC2-PP1C - kras的初始原子模型。采用刚体模拟策略BILBOMD对模型中的柔性区域进行了最小分子动力学模拟,以优化SHOC2 n端区域的构象空间。对于SHOC2,多状态模型的选择如上所述。gydF4y2Ba
磷酸酶化验gydF4y2Ba
对于肽去磷酸化实验,将PP1C与不同浓度的BRAF pS365肽、SHOC2和/或RAS按每个图中指定的浓度混合。在2分钟和4分钟的时间点,通过向80µl孔雀石绿溶液中加入20µl的反应混合物来停止反应,并在室温下孵育30分钟以显色。还生成了0-100 μ M无机磷酸盐的标准曲线。在640 nm处读取吸光度,并参考标准曲线计算每个反应的酶转化率。gydF4y2Ba
对于PNPP去磷酸化实验,将10 nM PP1C、1µM SHOC2和1µM KRAS与不同浓度的PNPP混合。在405nm处每隔1分钟读取吸光度。通过NPP消光系数(dephosphorylated PNPP)计算周转率gydF4y2Ba一个gydF4y2Ba405gydF4y2Ba= 18,000米gydF4y2Ba−1gydF4y2Ba厘米gydF4y2Ba−1gydF4y2Ba),并在5、10、15和20分钟时间点取平均值。使用GraphPad Prims8生成图表,用于磷酸酶测定和其他生化测定。gydF4y2Ba
表面等离子体共振gydF4y2Ba
如上所述,表达和纯化avi标记的KRAS。根据制造商的说明,用BirA生物素-蛋白连接酶试剂盒(Avidity)对KRAS进行生物素化。所有SPR步骤均在Biacore S200仪器(Cytiva)上进行,温度为20°C。在PBS中,通过EDC/NHS活化后注入100 μg ml,将C1芯片(Cytiva)与~ 1000 ~ 1200 RU Neutravidin功能化gydF4y2Ba−1gydF4y2BaNeutravidin(用10mm醋酸钠制备,pH 4.6),用1m乙醇胺盖盖。然后用1M NaCl/50 mM NaOH对表面进行处理。将系统注入数据收集缓冲液(50 mM HEPES, pH 7.4, 100 mM NaCl, 500µM TCEP, 0.01% ten -20, 10 mM MgClgydF4y2Ba2gydF4y2Ba, 500 nM GDP或GNP),生物素化的avi标记KRAS预加载GDP或GNP,然后以2 μl min短暂注射10 s捕获到~40 RUgydF4y2Ba−1gydF4y2Ba在100 μl min下,用200 nM生物素阻断剩余的生物素结合位点60 sgydF4y2Ba−1gydF4y2Ba.在多循环动力学模式下,以50 μl min的流速,从低到高依次向KRAS-耦合表面注入2倍稀释倍数gydF4y2Ba−1gydF4y2Ba45秒,监测游离300秒。gydF4y2Ba
所有分析均采用标准双参照后,使用S200评价软件进行。理论gydF4y2BaRgydF4y2Ba马克斯gydF4y2Ba(配体-分析物对相互作用产生的最大可行SPR信号;以反应单位(RU)表示)确定为(蛋白质在溶液中的分子质量)/(固定靶分子质量)×(捕获的固定靶数量),表面活性百分比确定为(实验gydF4y2BaRgydF4y2Ba马克斯gydF4y2Ba) /(理论gydF4y2BaRgydF4y2Ba马克斯gydF4y2Ba).gydF4y2Ba
TR-FRET结合试验gydF4y2Ba
C端snap标记的PP1C和n端snap标记的SHOC2按照上述方法表达和纯化。PP1C使用SNAP-Lumi4-Tb标记试剂(Cisbio)标记,SHOC2使用SNAP-Red标记试剂(Cisbio)标记,按照制造商的方案。每组20 μ l溶液,最终浓度为2 nM Tb-PP1C, 200 nM Red-SHOC2和可变RAS浓度,每个成分都用TR-FRET测定缓冲液(25 mM Tris pH 7.5, 200 mM NaCl, 2 mM MgCl)稀释gydF4y2Ba2gydF4y2Ba, 2 mM MnClgydF4y2Ba2gydF4y2Ba, 1 mM TCEP, 0.2 mg mlgydF4y2Ba−1gydF4y2BaBSA),室温孵育30分钟。TR-FRET的激发波长为340 nm,发射波长为620 nm和665 nm。延迟10分钟后,对每个板进行第二次读取,以确认结合已达到平衡。将每个时间点的665 nm发射量的比值除以620 nm发射量,得到TR-FRET比值。gydF4y2Ba
DepMap数据分析gydF4y2Ba
DepMap发布公共21Q4数据集,包含细胞系信息(sample_info.csv), chronos评分(CRISPR_gene_effect.csv)和突变状态(CCLE_mutations.csv)gydF4y2Bahttps://depmap.org/portal/download/gydF4y2Ba.我们构建了包含1061个细胞系中SHOC2、MRAS、KRAS和NRAS的chronos评分的数据集,并在G12、G13和Q61位置标注了KRAS、NRAS和HRAS的相应热点突变状态。每个细胞系对H/K/NRAS的总体依赖性以H/K/NRAS chronos评分中的最小值计算。皮尔逊相关系数和双面相关系数gydF4y2BatgydF4y2Ba以及gydF4y2BaPgydF4y2Ba使用R中的cor.test函数在1061个细胞系中计算SHOC2与MRAS、HRAS、KRAS或NRAS chronos评分之间的-值,由G12、G13和Q61位置的突变状态确定。数据分析使用R自定义脚本进行。gydF4y2Ba
分子动力学gydF4y2Ba
利用FF19SB力场对蛋白质的复杂结构进行参数化gydF4y2Ba72gydF4y2Ba以及磷酸化氨基酸的参数gydF4y2Ba73gydF4y2Ba,在OPC中完全溶解gydF4y2Ba74gydF4y2Ba水盒从蛋白质边缘延伸12 Å。利用Hartree-Fock/6-31 G*基集和Gaussian09对GCP配体进行参数化,计算出约束静电势电荷,并将计算出的电位与前腔进行拟合,生成力场文件。加入Na+反离子使体系中和。使用SPFP精度模型的Amber 2018的GPU实现gydF4y2Ba75gydF4y2Ba用于分子动力学模拟。首先,在保持溶质和溶剂固定的情况下,对结构进行2000步共轭梯度能量最小化。然后,在温度为310 K的NPT系综下,允许溶剂分子移动。另一个步骤是共轭梯度能量最小化,共2000步,同时消除所有约束。接下来,压力保持在1 atm,温控器温度在500 ps的过程中增加到310 K,而谐波位置限制强度为10 kcal molgydF4y2Ba−1gydF4y2Ba一个gydF4y2Ba−2gydF4y2Ba作用于溶质。然后系统平衡1ns,约束力常数为1千卡摩尔gydF4y2Ba−1gydF4y2Ba一个gydF4y2Ba−2gydF4y2Ba.在生产阶段,所有的限制都被取消了。氢质量重分配被使用,允许一个时间步长gydF4y2Ba76gydF4y2Ba4个fs。10 Å截止半径用于范围有限的相互作用,粒子网格Ewald静电用于远程相互作用。在NPT条件下进行了生产模拟。朗之万动力学gydF4y2Ba77gydF4y2Ba用于将温度维持在310 K,碰撞频率为3psgydF4y2Ba−1gydF4y2Ba.在动态过程中,SHAKE算法gydF4y2Ba78gydF4y2Ba是应用。所有其他模拟参数都使用默认值。常规分子动力学模拟的生产阶段进行了50纳秒。gydF4y2Ba
四次独立的常规分子动力学试验每一次都进行了GaMD模拟gydF4y2Ba45gydF4y2Ba,gydF4y2Ba79gydF4y2Ba该模块包括用于收集电位统计信息的200 ps短cMD模拟,添加升压电位后的2 ns平衡,最后是500 ns的GaMD生产运行。所有的GaMD模拟都在双升压级下运行,将参考能量设置为下界。系统势能的平均值和s.d.以每50,000 (100 ps)为单位计算。升压电位s.d的上限,gydF4y2BaσgydF4y2Ba0gydF4y2Ba设置为6.0千卡摩尔gydF4y2Ba−1gydF4y2Ba对于二面体和总势能项。模拟帧每20ps保存一次用于分析。gydF4y2Ba
CPPTRAJgydF4y2Ba80gydF4y2Ba用于对组合GaMD轨迹的集合进行后处理。通过每个残基内任意两个原子之间的简单距离截断(5 Å)来确定接触。对整个结构的二面角进行主成分分析。每一帧都与第一帧进行rms拟合,以去除全局平移和旋转运动。对组合协方差矩阵进行对角化得到特征向量和特征值,然后将各独立轨迹的坐标沿特征向量投影,得到给定模态的投影值。采用分离出来的数据变化最大的第一主成分Mode1和Mode2,生成二维PCA密度图。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
SHOC2和SHOC2 - pp1c - mras配合物的结构坐标及相关数据已分别存入PDB和EMDB中,并附有PDB登录码gydF4y2Ba7 sd1gydF4y2Ba用于SHOC2和PDB代码gydF4y2Ba7 sd0gydF4y2Ba和EMDB代码gydF4y2Baemd - 25044gydF4y2Ba用于SHOC2-PP1C-MRAS复合物。SAXS数据和原子模型已存入小角度散射生物数据库(SASBDB)gydF4y2BaSASDMB5gydF4y2Ba(SHOC2),gydF4y2BaSASDMC5gydF4y2Ba(SHOC2-PP1C),gydF4y2BaSASDMD5gydF4y2Ba(SHOC2-PP1C-KRAS)和gydF4y2BaSASDME5gydF4y2Ba(SHOC2-PP1C-MRAS)。DepMap发布公共21Q4数据集,包含细胞系信息(sample_info.csv), chronos评分(crispr_gene_effects .csv)和突变状态(CCLE_mutations.csv)gydF4y2Bahttps://depmap.org/portal/download/gydF4y2Ba.gydF4y2Ba
代码的可用性gydF4y2Ba
应要求,将提供用于分析DepMap数据的SHCO2-RAS相关性的代码。gydF4y2Ba
参考文献gydF4y2Ba
Lavoie, H. & Therrien, M. RAF蛋白激酶在ERK信号的调节。gydF4y2Ba细胞生物学。gydF4y2Ba16gydF4y2Ba, 281-298(2015)。gydF4y2Ba
温纳伯格,K,罗斯曼,K. L. & Der, C. J. Ras超家族一瞥。gydF4y2Ba细胞科学。gydF4y2Ba118gydF4y2Ba, 843-846(2005)。gydF4y2Ba
Hobbs, G. A., Der, C. J. & Rossman, K. L. RAS亚型与癌症突变一瞥。gydF4y2Ba细胞科学。gydF4y2Ba129gydF4y2Ba1287-1292(2016)。gydF4y2Ba
Rajakulendran, T., Sahmi, M., Lefrancois, M., Sicheri, F. & Therrien, M.一种二聚化依赖机制驱动RAF催化活化。gydF4y2Ba自然gydF4y2Ba461gydF4y2Ba, 542-u114(2009)。gydF4y2Ba
Park, E.等人。自抑制和活性BRAF-MEK1-14-3-3复合物的结构。gydF4y2Ba自然gydF4y2Ba575gydF4y2Ba, 545-550(2019)。gydF4y2Ba
近藤,Y.等。二聚物B-Raf:14-3-3复合物的冷冻电镜结构揭示了B-Raf激酶活性位点的不对称性。gydF4y2Ba科学gydF4y2Ba366gydF4y2Ba, 109-115(2019)。gydF4y2Ba
Liau, N. P. D.等。c端14-3-3结合诱导的二聚体足以激活BRAF激酶。gydF4y2Ba生物化学gydF4y2Ba59gydF4y2Ba, 3982-3992(2020)。gydF4y2Ba
Liau, N. P. D.等。ATP对RAF激酶活性的负调控被14-3-3-诱导的二聚体克服。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba27gydF4y2Ba, 134-141(2020)。gydF4y2Ba
布里奇斯,D. & Moorhead, G. B. 14-3-3蛋白:一种编号蛋白的若干功能。gydF4y2Ba科学。抽烟可以gydF4y2Ba2005gydF4y2Ba, re10(2005)。gydF4y2Ba
Thorson, J. A. et al. 14-3-3蛋白是维持Raf-1磷酸化和激酶活性所必需的。gydF4y2Ba摩尔。细胞。医学杂志。gydF4y2Ba18gydF4y2Ba, 5229-5238(1998)。gydF4y2Ba
rodrigz - viciana, P., Oses-Prieto, J., Burlingame, A., Fried, M. & McCormick, F.由Shoc2/Sur8和PP1催化亚基组成的磷酸酶全酶作为M-Ras效应子调节Raf活性。gydF4y2Ba摩尔。细胞。gydF4y2Ba22gydF4y2Ba, 217-230(2006)。gydF4y2Ba
李伟,韩敏,关克良。富含亮氨酸的重复蛋白ur -8可增强MAP激酶的活化,并与Ras和Raf形成复合物。gydF4y2BaDev的基因。gydF4y2Ba14gydF4y2Ba, 895-900(2000)。gydF4y2Ba
Sieburth, d.s., Sun, Q. & Han, M. SUR-8,一种具有富亮氨酸重复序列的保守ras结合蛋白,正向调控ras介导的信号通路gydF4y2Ba秀丽隐杆线虫gydF4y2Ba.gydF4y2Ba细胞gydF4y2Ba94gydF4y2Ba, 119-130(1998)。gydF4y2Ba
Poulikakos, p.i.等人。RAF抑制剂耐药是由异常剪接的BRAF(V600E)二聚化介导的。gydF4y2Ba自然gydF4y2Ba480gydF4y2Ba, 387-390(2011)。gydF4y2Ba
塔特,J. G.等。COSMIC:癌症体细胞突变目录。gydF4y2Ba核酸测定。gydF4y2Ba47gydF4y2Ba, d941-d947(2019)。gydF4y2Ba
摩尔,a.r.,罗森博格,s.c.,麦考密克,F. &马雷克,s.s . ras靶向治疗:是不可药物?gydF4y2BaNat. Rev.药物发现gydF4y2Ba19gydF4y2Ba, 533-552(2020)。gydF4y2Ba
Dunnett-Kane, V., Nicola, P., Blackhall, F. & Lindsay, C. KRAS(G12C)抑制剂耐药机制。gydF4y2Ba癌症gydF4y2Ba13gydF4y2Ba, 151(2021)。gydF4y2Ba
Yen, I.等。ARAF突变使黑色素瘤对RAF抑制剂belvarafenib产生耐药性。gydF4y2Ba自然gydF4y2Ba594gydF4y2Ba, 418-423(2021)。gydF4y2Ba
齐维安,罗振杰,Avruch, J.一个二聚体14-3-3蛋白是Raf激酶活性的必要辅因子。gydF4y2Ba自然gydF4y2Ba394gydF4y2Ba, 88-92(1998)。gydF4y2Ba
哈林,J. R.等。BRAF - mek复合物的结构揭示了BRAF在MAPK信号通路中的激酶活性独立作用。gydF4y2Ba癌症细胞gydF4y2Ba26gydF4y2Ba, 402-413(2014)。gydF4y2Ba
莫里森,D. K, Heidecker, G., Rapp, U. R. & Copeland, T. D. Raf-1激酶主要磷酸化位点的鉴定。gydF4y2Ba生物。化学。gydF4y2Ba268gydF4y2Ba, 17309-17316(1993)。gydF4y2Ba
Wakula, P., Beullens, M., Ceulemans, H., Stalmans, W. & Bollen, M.普遍存在的RVXF motif介导与蛋白磷酸酶-1结合的简并性和功能。gydF4y2Ba生物。化学。gydF4y2Ba278gydF4y2Ba, 18817-18823(2003)。gydF4y2Ba
Peti, W., Nairn, a.c . & Page, R.蛋白磷酸酶1调控的结构基础和特异性。gydF4y2Ba2月J。gydF4y2Ba280gydF4y2Ba, 596-611(2013)。gydF4y2Ba
Jeoung, M., Abdelmoti, L., Jang, e.r, Vander Kooi, C. W. & Galperin, E. Shoc2支架保守结构域的功能集成。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba8gydF4y2Ba, e66067(2013)。gydF4y2Ba
莫塔等人。SHOC2亚细胞穿梭需要KEKE基序丰富区域和n端亮氨酸丰富重复结构域,并影响ERK信号。gydF4y2Ba嗡嗡声。摩尔,麝猫。gydF4y2Ba25gydF4y2Ba, 3824-3835(2016)。gydF4y2Ba
杨,L. C.等。MRAS、SHOC2和SCRIB复合物协调ERK通路的激活与极性和致瘤性生长。gydF4y2Ba摩尔。细胞gydF4y2Ba52gydF4y2Ba, 679-692(2013)。gydF4y2Ba
骨头德尔里约热内卢,我等。SHOC2复合物驱动的RAF二聚体选择性地促进了ERK通路动力学。gydF4y2Ba国家科学院学报美国gydF4y2Ba116gydF4y2Ba, 13330-13339(2019)。gydF4y2Ba
琼斯,G. G.等。SHOC2磷酸酶依赖性RAF二聚体介导ras突变癌症对MEK抑制的抗性。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 2532(2019)。gydF4y2Ba
Terai, H.等人。SHOC2是非小细胞肺癌细胞对EGFR-TKIs敏感性的关键调节剂。gydF4y2BaMol. Cancer Res。gydF4y2Ba19gydF4y2Ba, 317-328(2021)。gydF4y2Ba
卡普兰,f.m.等人。在突变的nras介导的RAF抑制剂抗性中,SHOC2和CRAF介导ERK1/2的再激活。gydF4y2Ba生物。化学。gydF4y2Ba287gydF4y2Ba, 41797-41807(2012)。gydF4y2Ba
伯特兰,m.t.等人。ASPP蛋白通过其SH3结构域和PP1 c尾区分PP1催化亚基。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 771(2019)。gydF4y2Ba
杨,L. C.等。SHOC2-MRAS-PP1复合物正调控RAF活性并参与努南综合征的发病机制。gydF4y2Ba国家科学院学报美国gydF4y2Ba115gydF4y2Ba, e10576-e10585(2018)。gydF4y2Ba
目前对KRAS蛋白结构和动力学的理解。gydF4y2Ba第一版。结构体。Biotechnol。JgydF4y2Ba.gydF4y2Ba18gydF4y2Ba, 189-198(2020)。gydF4y2Ba
Tran, t.h.等。KRAS与RAF1 ras结合结构域和富半胱氨酸结构域的相互作用为ras介导的RAF激活提供了见解。gydF4y2BaCommun Nat。gydF4y2Ba12gydF4y2Ba, 1176(2021)。gydF4y2Ba
大分子组装中的协同作用。gydF4y2BaNat,化学。医学杂志。gydF4y2Ba4 gydF4y2Ba, 458-465(2008)。gydF4y2Ba
Tsherniak, A.等。定义癌症依赖图。gydF4y2Ba细胞gydF4y2Ba170gydF4y2Ba, 564-576 e516(2017)。gydF4y2Ba
德沃,D. L., Horvitz, H. R. & Stern, M. J. FGF受体信号通路是生殖成肌细胞正常细胞迁移所必需的gydF4y2Ba秀丽隐杆线虫gydF4y2Ba雌雄同体。gydF4y2Ba细胞gydF4y2Ba83gydF4y2Ba, 611-620(1995)。gydF4y2Ba
Selfors, L. M., Schutzman, J. L., Borland, C. Z. & Stern, M. J. soc-2编码一种富含亮氨酸的重复蛋白,涉及成纤维细胞生长因子受体信号。gydF4y2Ba国家科学院学报美国gydF4y2Ba95gydF4y2Ba, 6903-6908(1998)。gydF4y2Ba
莫塔等人。激活MRAS突变可引起与肥厚性心肌病相关的努南综合征。gydF4y2Ba嗡嗡声。摩尔,麝猫。gydF4y2Ba29gydF4y2Ba1772-1783(2020)。gydF4y2Ba
韩宁,V., Jeoung, M.,张e . R., Phillips, J. A. third & Galperin, E.一种新的SHOC2变体在rasopathy。gydF4y2Ba嗡嗡声。Mutat。gydF4y2Ba35gydF4y2Ba, 1290-1294(2014)。gydF4y2Ba
Cordeddu, V.等人。SHOC2突变促进异常蛋白gydF4y2BaNgydF4y2Ba-肉豆蔻酰化,导致noonan样综合征,毛发疏松。gydF4y2BaNat,麝猫。gydF4y2Ba41gydF4y2Ba, 1022-1026(2009)。gydF4y2Ba
格里普,K. W.等。一种由PPP1CB中反复出现的新生错义突变引起的新型rasopathy与伴有松散毛发的努南综合征非常相似。gydF4y2Ba点。J.医学热内。一个gydF4y2Ba170gydF4y2Ba, 2237-2247(2016)。gydF4y2Ba
Bertola, D.等人。在另外一个努南样综合征个体中复发的PPP1CB突变p.Pro49Arg:扩大临床表型。gydF4y2Ba点。J.医学热内。一个gydF4y2Ba173gydF4y2Ba, 824-828(2017)。gydF4y2Ba
希金斯,e.m.等人。mras介导的伴有心肌肥厚的努南综合征的阐明。gydF4y2Ba江森自控的洞察力gydF4y2Ba2gydF4y2Ba, e91225(2017)。gydF4y2Ba
苗颖,费赫,V. A. & McCammon, J. A.高斯加速分子动力学:无约束增强采样和自由能计算。gydF4y2Baj .化学。理论第一版。gydF4y2Ba11gydF4y2Ba, 3584-3595(2015)。gydF4y2Ba
Ye, M.等。M-Ras的晶体结构揭示了Ras家族小GTPases的gtp结合“off”态构象。gydF4y2Ba生物。化学。gydF4y2Ba280gydF4y2Ba, 31267-31275(2005)。gydF4y2Ba
Nakhaeizadeh ., Amin, E., Nakhaei-Rad, S., Dvorsky, R. & Ahmadian, M. R. ras -效应器界面:效应器结合区域的异构体特异性差异。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba11gydF4y2Ba, e0167145(2016)。gydF4y2Ba
Nunez Rodriguez, N.等人。R-ras3/m-ras缺失小鼠的特征揭示了其在营养因子信号通路中的潜在作用。gydF4y2Ba摩尔。细胞。医学杂志。gydF4y2Ba26gydF4y2Ba, 7145-7154(2006)。gydF4y2Ba
王斌,梁明杰,王志强,王志强。M-Ras基因缺失对小鼠社会行为的调节作用。gydF4y2BaBMC >。gydF4y2Ba16gydF4y2Ba, 68(2015)。gydF4y2Ba
艾哈特,A.等人。Mras缺失的雄性小鼠尿潴留、尿失禁和毒蕈碱受体失调。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba10gydF4y2Ba, e0141493(2015)。gydF4y2Ba
亨特,J. C.等。常见癌症相关KRAS突变的生化和结构分析。gydF4y2BaMol. Cancer Res。gydF4y2Ba13gydF4y2Ba, 1325-1335(2015)。gydF4y2Ba
马蒂,m.t.等人。质量和离子迁移谱的贝叶斯反褶积:从二元相互作用到多分散系综。gydF4y2Ba分析的化学。gydF4y2Ba87gydF4y2Ba, 4370-4376(2015)。gydF4y2Ba
张,M.等。使用“永久水化”的氧化石墨烯薄片改善了样品在低温电子显微镜中的分散性。gydF4y2Baj . Struct。医学杂志。gydF4y2Bas1047 - 8477gydF4y2Ba, 30083-2(2018)。gydF4y2Ba
SerialEM:在Tecnai显微镜上使用预测标本位置自动倾斜系列采集的程序。gydF4y2BaMicrosc。Microanal。gydF4y2Ba9gydF4y2Ba, 1182-1183(2003)。gydF4y2Ba
Punjani, A., Rubinstein, J. L., Fleet, D. J. & Brubaker, M. A. cryoSPARC:快速无监督冷冻em结构确定的算法。gydF4y2BaNat方法。gydF4y2Ba14gydF4y2Ba, 290-296(2017)。gydF4y2Ba
彭贾尼,A.,张,H.和Fleet, D. J.非均匀细化:自适应正则化改进单粒子低温em重建。gydF4y2BaNat方法。gydF4y2Ba17gydF4y2Ba, 1214-1221(2020)。gydF4y2Ba
彼得森,E. F.等人。UCSF ChimeraX:为研究人员、教育工作者和开发人员提供结构可视化。gydF4y2Ba蛋白质科学。gydF4y2Ba30.gydF4y2Ba, 70-82(2021)。gydF4y2Ba
亚当斯,P. D.等。PHENIX:一个全面的基于python的大分子结构解决方案系统。gydF4y2BaActa Crystallogr。DgydF4y2Ba66gydF4y2Ba, 213-221(2010)。gydF4y2Ba
Emsley, P., Lohkamp, B., Scott, W. G. & Cowtan, K.白骨顶的特征与发育。gydF4y2BaActa Crystallogr。DgydF4y2Ba66gydF4y2Ba, 486-501(2010)。gydF4y2Ba
Kabsch, W. Xds。gydF4y2BaActa Crystallogr。DgydF4y2Ba66gydF4y2Ba, 125-132(2010)。gydF4y2Ba
Tunyasuvunakool, K.等。高度精确的蛋白质结构预测人类蛋白质组。gydF4y2Ba自然gydF4y2Ba596gydF4y2Ba, 590-596(2021)。gydF4y2Ba
Dyer, K. N.等。用于溶液中生物分子表征的高通量SAXS:一种实用的方法。gydF4y2Ba方法分子生物学。gydF4y2Ba1091gydF4y2Ba, 245-258(2014)。gydF4y2Ba
克拉森,S.等人。SIBYLS的实现和性能:双端站小角度x射线散射和高级光源大分子晶体束流线。gydF4y2Baj:。Crystallogr。gydF4y2Ba46gydF4y2Ba, 1-13(2013)。gydF4y2Ba
哈梅尔等人。与XRCC1支架蛋白的非典型BRCT-BRCT相互作用将人DNA连接酶IIIα压缩在一个灵活的DNA修复复合体中。gydF4y2Ba核酸测定。gydF4y2Ba49gydF4y2Ba, 306-321(2021)。gydF4y2Ba
Guinier, A. & Fournet, F.;gydF4y2Bax射线的小角度散射gydF4y2Ba(Wiley Interscience, 1955)。gydF4y2Ba
沙利,A. &布伦德尔,T. L.比较蛋白质模型的满足空间限制。gydF4y2BaJ. Mol.生物学。gydF4y2Ba234gydF4y2Ba, 779-815(1993)。gydF4y2Ba
Pelikan, M., Hura, G. L. & Hammel, M.蛋白质的结构和灵活性通过小角度x射线散射识别。gydF4y2Ba杂志。Biophys。gydF4y2Ba28gydF4y2Ba, 174-189(2009)。gydF4y2Ba
Schneidman-Duhovny, D., Hammel, M. & Sali, a . FoXS:用于快速计算和SAXS配置文件拟合的web服务器。gydF4y2Ba核酸测定。gydF4y2Ba38gydF4y2Ba, w540-w544(2010)。gydF4y2Ba
Schneidman-Duhovny, D., Hammel, M., Tainer, J. A. & Sali, A.精确SAXS剖面计算及其对比变异实验评估。gydF4y2BaBiophys。J。gydF4y2Ba105gydF4y2Ba, 962-974(2013)。gydF4y2Ba
Schneidman-Duhovny, D. & Hammel, M.用SAXS剖面建模蛋白质复合物的结构和动力学。gydF4y2Ba方法分子生物学。gydF4y2Ba1764gydF4y2Ba, 449-473(2018)。gydF4y2Ba
Schneidman-Duhovny, D., Hammel, M., Tainer, J. A. & Sali, A. FoXS, FoXSDock和multifox:基于SAXS剖面的蛋白质及其复合物的单态和多态结构建模。gydF4y2Ba核酸测定。gydF4y2Ba44gydF4y2Ba, w424-w429(2016)。gydF4y2Ba
Tian, C. et al. ff19SB:针对溶液中量子力学能量表面训练的氨基酸特异性蛋白骨干参数。gydF4y2Baj .化学。理论第一版。gydF4y2Ba16gydF4y2Ba, 528-552(2020)。gydF4y2Ba
霍梅耶,霍恩,a.h.,兰尼格,H. & Sticht, H. AMBER力场参数磷酸化氨基酸在不同质子化状态:磷酸丝氨酸,磷酸苏氨酸,磷酸酪氨酸和磷酸组氨酸。gydF4y2BaJ. Mol.模型。gydF4y2Ba12gydF4y2Ba, 281-289(2006)。gydF4y2Ba
Izadi, S., Anandakrishnan, R. & Onufriev, a . V.建立水模型:不同的方法。gydF4y2Ba期刊。化学。列托人。gydF4y2Ba5gydF4y2Ba, 3863-3871(2014)。gydF4y2Ba
Le Grand, S., Götz, A. W. & Walker, R. C. SPFP:不妥协的速度——GPU加速分子动力学模拟的混合精度模型。gydF4y2Ba第一版。理论物理。Commun。gydF4y2Ba184gydF4y2Ba, 374-380(2013)。gydF4y2Ba
霍普金斯,C. W.,勒格兰,S.,沃克,R. C.和罗伊伯格,A. E.通过氢质量再分配的长时间步分子动力学。gydF4y2Baj .化学。理论第一版。gydF4y2Ba11gydF4y2Ba, 1864-1874(2015)。gydF4y2Ba
牧师,R. W.,布鲁克斯,B. R. & Szabo, A.朗之万和分子动力学算法的准确性分析。gydF4y2Ba摩尔。物理。gydF4y2Ba65gydF4y2Ba, 1409-1419(1988)。gydF4y2Ba
Ryckaert, j。,Ciccotti, G. & Berendsen, H. J. C. Numerical integration of the cartesian equations of motion of a system with constraints: molecular dynamics ofngydF4y2Ba烷烃。gydF4y2Baj .第一版。理论物理。gydF4y2Ba23gydF4y2Ba, 327-341(1977)。gydF4y2Ba
苗,杨,等。改进的重加权加速分子动力学模拟自由能计算。gydF4y2Baj .化学。理论第一版。gydF4y2Ba10gydF4y2Ba, 2677-2689(2014)。gydF4y2Ba
Roe, d.r. & Cheatham, t.e. PTRAJ和CPPTRAJ:用于处理和分析分子动力学轨迹数据的软件。gydF4y2Baj .化学。理论第一版。gydF4y2Ba9gydF4y2Ba, 3084-3095(2013)。gydF4y2Ba
确认gydF4y2Ba
我们感谢基因泰克生物分子资源(BMR)小组对生产结构物和用于蛋白质生产的BEVS生物质的支持;用于同步加速器接入的斯坦福同步辐射光源(SSRL);用于接入SIBYLS光束线的高级光源(ALS);A. Estevez协助初步电子显微镜筛查;C. Arthur用于低温电子显微镜数据收集;W. Wang用于x射线衍射数据采集;A. Oh和B. Martin关于Ras GTP-GDP装载的建议;F. Shanahan和I. Yen讨论RAS生物学;以及2021年CCP4/APS大分子晶体学学校的培训。使用斯坦福同步辐射光源,SLAC国家加速器实验室由美国能源部,科学办公室,基础能源科学办公室支持。 DE-AC02-76SF00515. The SSRL Structural Molecular Biology Program is supported by the DOE Office of Biological and Environmental Research, and by the National Institutes of Health, National Institute of General Medical Sciences (P41GM103393). The contents of this publication are solely the responsibility of the authors and do not necessarily represent the official views of NIGMS or NIH. Funding for the SIBYLS beamline at the Advanced Light Source was provided in part by the Offices of Science and Biological and Environmental Research, U.S. Department of Energy, under Contract DE-AC02-05BH11231 and NIGMS grant P30 GM124169-01, ALS-ENABLE.
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
j。s。和s。g。监督项目的各个方面的执行。N.P.D.L.进行了所有的蛋白质生物化学和生物化学分析(活性和TR-FRET),并解决了晶体和冷冻em结构。m.c.j进行低温网格样品制备,收集低温电磁数据并协助低温电磁数据处理。S.I.进行了分子动力学模拟并分析了数据。L.G.对来自DepMap的肿瘤细胞系数据进行了生物信息学分析。M.H.进行并分析了SAXS实验。J.M.B.执行并分析了SPR数据。T.J.W.设计了蛋白质结构,并开发了TR-FRET试验。W.P.进行了所有的质谱实验。N.P.D.L, S.G.H.和J.S.根据所有作者的意见撰写了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
受到打击还得追溯到L.G N.P.D.L M.J。,。,J.M.B, T.J.W,工作压力和J.S.二是基因泰克公司的所有员工。gydF4y2Ba
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢Poulikos Poulikakos和其他匿名审稿人对这项工作的同行评审所做的贡献。可以获得同行评审报告。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
扩展数据图1 SHOC2:PP1C复合物与RAS亚型形成。gydF4y2Ba
一个gydF4y2Ba,对装载核苷酸的RAS样品进行质谱分析,发现每个样品都装载了完全的GDP或GCP。gydF4y2BabgydF4y2Ba, SEC痕迹显示KRASΔHVR(左上),HRAS(左下),NRAS(右上)和KRAS4B(右下)之间的三向复杂形成,存在GCP负载RAS(蓝色),但不存在GDP负载RAS(红色),以及相关的SEC分数SDS-PAGE分析。代表两个独立实验的结果。gydF4y2Ba
扩展数据图2 SHOC2:PP1C:RAS复合物功能验证。gydF4y2Ba
一个gydF4y2Ba, SPR数据显示KRAS(GNP)与SHOC2:PP1C相关,但与KRAS(GDP)无关。gydF4y2BabgydF4y2Ba核苷酸结合的KRAS不单独与PP1C结合gydF4y2BacgydF4y2Ba, SHOC2单独,表明结合gydF4y2Ba一个gydF4y2Ba是由于RAS结合SHOC2:PP1C复合物。gydF4y2BadgydF4y2Ba在没有PP1C的情况下,SEC示踪(上)显示SHOC2与KRAS(GCP)(绿色)或MRAS(GCP)(橙色)不相关,SEC分数的相关SDS-PAGE分析(下)。结果代表两个独立的实验。gydF4y2BaegydF4y2Ba, 10 nM PP1C或10 nM PP1C + 1µM SHOC2 + 10µM KRAS(GCP)对BRAF NTpS磷酸肽去磷酸化的代表性图。数据点显示2和4分钟时间点(n = 2)。gydF4y2Ba
图3 SHOC2:PP1C:MRAS(GCP)的Cryo-EM结构gydF4y2Ba
一个gydF4y2Ba,含有网格的氧化石墨烯上的SHOC2:PP1C:MRAS(GCP)的代表性显微照片(从收集的10,870张)。图像最左侧为金色衬底,中间区域为玻璃状冰,右侧为单层氧化石墨烯吸附蛋白复合物。gydF4y2BabgydF4y2Ba,具有代表性的SHOC2:PP1C:MRAS的2D类平均值(上)显示了较好的三聚体配合物和较差的六聚体配合物,对氧化石墨烯有不同的看法。SHOC2:PP1C:KRAS配合物(左下)仅显示三聚物配合物,但不含氧化石墨烯,呈优先取向。SHOC2:PP1C:KRAS在氧化石墨烯上(右下)显示复合物解离。gydF4y2BacgydF4y2Ba,两个半数据集之间的FSC产生了2.95的分辨率估计Å。gydF4y2BadgydF4y2Ba, SHOC2:PP1C:MRAS重构的Angular分布图。颗粒显示出一个首选的方向,但充分的其他视图获得了使用氧化石墨烯获得三维重建。gydF4y2BaegydF4y2Ba局部分辨率估计图表明了SHOC2 LRR的C端部分的灵活性。gydF4y2BafgydF4y2Ba,低温电镜数据处理方案,方法详细描述。gydF4y2Ba
扩展数据图4 Cryo-EM和x射线结构比较。gydF4y2Ba
一个gydF4y2Ba, SHOC2:PP1C:MRAS复合体未锐化的cryoEM图,等高线为0.15(左)。肖2:PP1C:MRAS复合物的锐化cryoEM图轮廓为0.35(锐化B因子=−110 ÅgydF4y2Ba2gydF4y2Ba)(右)。在这些等高线上,SHOC2 c端密度不可见。gydF4y2BabgydF4y2Ba, MRAS SwII区域实例模型及锐化密度。gydF4y2BacgydF4y2Ba(左)来自cryoEM结构的PP1C(紫色)与PP1C x射线结构(PDB: 4MOV)对齐。右,来自cryoEM结构(salmon)的MRAS(GCP)与MRAS(GNP) x射线结构(PDB: 1X1S)对齐。gydF4y2BadgydF4y2Ba, SHOC2和PP1C的静电视图,显示碱性和酸性区域(蓝色/白色/红色),与烯酰化MRAS模型(基于PDB代码5TAR)(黄色)对齐,从平行于页面表面的膜向下看。gydF4y2BaegydF4y2Ba, SHOC2的x射线晶体结构(左橙色),静电视图显示碱性和酸性区域(蓝/白/红,右)。gydF4y2BafgydF4y2Ba,将SHOC2:PP1C:MRAS cryoEM结构(绿色:紫色:鲑鱼色)与SHOC2 x射线结构(橙色)进行比对,使用n端帽和SHOC2的前四个lrr。相对于1,两个结构之间明显存在9°扭转gydF4y2Ba圣gydF4y2Ba远程雷达。gydF4y2Ba
图5 SAXS分析和shoc2n末端对复合物形成的贡献。gydF4y2Ba
一个gydF4y2Ba、SEC-MALS中SHOC2(灰色)、SHOC2:PP1C(蓝色)、SHOC2:PP1C:KRAS(GCP)(三文鱼)和SHOC2:PP1C:MRAS(GCP)(绿色)的痕迹。SHOC2作为二聚体单独洗脱。SHOC2:PP1C:MRAS(GCP)显示三聚体和六聚体峰。虚线矩形表示用于后续内联SAXS分析的帧。gydF4y2BabgydF4y2Ba, SHOC2和配合物的距离分布函数(P(r))。SHOC2呈马蹄形双峰分布。所有蛋白质在高r值时都显示出延伸的尾巴,表明shoc2n末端未展开。gydF4y2BacgydF4y2Ba、SHOC2:PP1C:MRAS、SHOC2:PP1C:KRAS、SHOC2:PP1C和SHOC2(从上到下)的实验SAXS曲线(黑色),叠加了单态(橙色)和多态模型的理论SAXS曲线(绿色)。每个实验数据的基尼耶图(插图)。gydF4y2BadgydF4y2Ba,分子模型的SHOC2和配合物(彩色带图)覆盖从头算SAXS信封(灰色)。每个分子包络的侧面凸起表示SHOC2的扩展n端,影响包络的计算。SHOC2:PP1C、SHOC2:PP1C:KRAS和SHOC2:PP1C:MRAS表现出相似的总体架构。SHOC2、SHOC2:PP1C和SHOC2:PP1C:KRAS SAXS数据采用MultiFoXS确定的多态模型拟合,以百分比标签表示,而SHOC2:PP1C:MRAS由于复合物形成稳定,可以很好地用单一态解释。在没有RAS的情况下,可以观察到一些SHOC2:PP1C的解离。gydF4y2BaegydF4y2Ba,剩余((I(q))gydF4y2Ba经验值gydF4y2Ba——我(q)gydF4y2Ba模型gydF4y2Ba)/σ(q)))的SAXS模型与数据比较。多状态模型导致较低的ΧgydF4y2Ba2gydF4y2Ba对于SHOC2、SHOC2:PP1C和SHOC2:PP1C:KRAS,单状态模型拟合效果较好,而对于SHOC2:PP1C:MRAS,单状态模型拟合效果较好。gydF4y2BafgydF4y2Ba,为SHOC2:PP1C:MRAS六聚体SAXS曲线计算的SAXS包线(灰色)。两种原子模型SHOC2:PP1C:MRAS冷冻- em结构与SAXS包膜手工叠加,显示存在2:2:2配合物的空间。每个分子的确切相对构象不能从这些数据中确定。gydF4y2Ba
图6 PP1C相互作用位点。gydF4y2Ba
一个gydF4y2Ba肽去磷酸化亲和分析技术原理综述。在一定浓度的肽段下,SHOC2与RAS结合会诱导出更高的PP1C催化活性。数据点来自两个时间点(n = 2)gydF4y2BabgydF4y2Ba,不同SHOC2突变体复合物形成的代表图。[PP1C] = 25 nM, [MRAS(GCP)] = 1µM。数据点来自两个时间点(n = 2)(左)。表汇总KgydF4y2BaDgydF4y2Ba应用程序gydF4y2Ba不同的SHOC2突变体的值从三个独立的实验(n = 3)(右)。SHOC2带电斑块的突变降低了亲和力,超出了检测限度。gydF4y2BacgydF4y2Ba,左,PP1C上的SLiM结合位点(蓝色)(紫色),有几个相互作用的SLiM结构(白色),“对立”位点(黄色)有几个相互作用的蛋白质结构(白色)。gydF4y2BadgydF4y2Ba, SHOC2 N端“VAF”基序(绿色,左)与PP1C结合的详细视图,使用未锐化的cryoEM图(灰色表面)。现有的高分辨率x射线晶体结构包含RVxF基序在该区域(黄色,右边,来自PDB: 5INB)的对齐与cryoEM图(灰色表面)很好地重叠。在PP1C上进行校准。gydF4y2BaegydF4y2Ba, SHOC2:PP1C:MRAS cryoEM结构,SLiM(蓝色)和“相反”(黄色)结合位点突出显示。大多数SHOC2与PP1C的相互作用都远离SLiM结合位点和相反位点。SHOC2“VAF”motif与SLiM结合位点结合。MRAS仅绑定到“对立”站点。gydF4y2BafgydF4y2Ba, SDS22(白色)是另一个与PP1C相互作用的LRR蛋白,尽管利用不同的结合表面与SHOC2结合,连接SLiM和相反的位点。gydF4y2Ba
图7 SHOC2:PP1C:RAS相互作用数据。gydF4y2Ba
一个gydF4y2Ba, SHOC2ΔN、PP1C和KRAS(GCP)(橙色)(上)之间复杂形成的SEC痕迹,以及相关的SDS-PAGE馏分分析(下)。gydF4y2BabgydF4y2Ba,肽去磷酸化显示KgydF4y2BaDgydF4y2Ba应用程序gydF4y2BaSHOC2和SHOC2ΔN。[PP1C] = 25 nM, [MRAS(GCP)] = 1µM。数据点来自两个时间点(n = 2)(左)。表汇总KgydF4y2BaDgydF4y2Ba应用程序gydF4y2Ba三个独立实验的值(n = 3)(右)。SHOC2ΔN与SHOC2 WT相比亲和力受损。gydF4y2BacgydF4y2Ba, SHOC2:PP1C:MRAS结构,在PP1C α,β和γ之间有不相同的残基,以黄色突出显示。位于复杂界面上的三个不相同的残基具有相似的化学性质(箭头)。gydF4y2BadgydF4y2BaSEC示踪和相关SDS-PAGE分析显示,SHOC2、MRAS与PP1C α、β和γ异构体之间形成了复合物。gydF4y2BaegydF4y2Ba左图:具有代表性的PP1C α、β和γ异构体的BRAF NTpS肽去磷酸化实验。数据点来自两个时间点(n = 2)(左)。右图:从三个独立实验(n = 3)中总结平均催化效率+/- SD的柱状图。当与SHOC2:RAS结合时,所有的异构体都表现出催化效率的提高。[PP1C] = 10 nM, [KRAS(GCP)] = 10µM。gydF4y2BafgydF4y2Ba左图:代表性肽去磷酸化实验显示SHOC2 KgydF4y2BaDgydF4y2Ba应用程序gydF4y2BaMRAS:PP1C α, β和γ复合物。数据点来自两个时间点(n = 2)(左)。右:汇总平均SHOC2 K的柱状图gydF4y2BaDgydF4y2Ba应用程序gydF4y2Ba+/- SD来自三个独立的实验(n = 3)。[PP1C] = 25 nM, [MRAS(GCP)] = 1µM。gydF4y2BaggydF4y2Ba, SEC痕迹(上)和相关的SDS-PAGE分析(下)显示MRAS(GDP)可以与PP1C α、β和γ亚型相互作用。所有SEC和SDS-PAGE数据都代表两个独立的实验。gydF4y2Ba
扩展数据图8 RAS绑定交互。gydF4y2Ba
一个gydF4y2BaSEC的SDS-PAGE分析显示,SHOC2:PP1C:KRAS不能与BRAF RBD(绿色)或CRAF RBD(橙色)(上)相互作用(下)。与BRAF RBD相比,CRAF RBD上的FLAG标签会略微增加其质量。代表两个独立实验的结果gydF4y2BabgydF4y2Ba在不同的SHOC2和KRAS浓度下,PP1C对BRAF pS365肽的去磷酸化表现出K的依赖性gydF4y2BadgydF4y2Ba应用程序gydF4y2Ba一个结合点对另一个结合点的影响。数据点来自两个时间点(n = 2)。gydF4y2BacgydF4y2Ba,在不同RAS浓度的存在下,PP1C:SHOC2对BRAF pS365肽(0.2 mM)去磷酸化。数据点来自两个时间点(n = 2)。MRAS的K值较低gydF4y2BaDgydF4y2Ba应用程序gydF4y2Ba与KRAS相比,尽管在较高浓度时也表现出活性下降,可能是因为较高浓度的SHOC2:PP1C:MRAS三聚体促进了可能催化不活跃的SHOC2:PP1C:MRAS六聚体的形成。[PP1C] = 10 nM, [SHOC2] = 100 nM。gydF4y2BadgydF4y2Ba, M, K, H和NRAS N端,开关I和II(上)和C端(下)之间的序列对齐gydF4y2BaegydF4y2Ba,上:TR-FRET测量存在不同GCP结合的MRAS/KRAS嵌合体时PP1C和SHOC2之间的相关性,显示MRAS上有8个与PP1C接触的残基(见(gydF4y2BabgydF4y2Ba)是高结合亲和力的关键。MRAS N端和C端均不能提高KRAS的结合亲和力。与KRAS WT相比,KRAS:MRAS嵌合体表现出适度但统计学上显著的结合亲和力改善(103µM vs 128µM, p = 0.02),但并没有完全再现MRAS WT的强亲和力,这表明MRAS Switch I和II动力学等其他因素在驱动复合物形成中也很重要。数据点来自两个时间点的测量(n = 2)(上)。下:K汇总表gydF4y2BaDgydF4y2Ba应用程序gydF4y2Ba来自三个独立实验的值(n = 3)。[Tb-PP1C] = 2 nM, [Red-SHOC2] = 200 nM。gydF4y2BafgydF4y2Ba, chronos分别绘制了HRAS、KRAS和NRAS与SHOC2的相关性。主图。gydF4y2Ba3 cgydF4y2Ba表示这些图的组合,图中显示了所选每个细胞系的H/K/NRAS chronos得分的最低值gydF4y2Ba3 cgydF4y2Ba.gydF4y2Ba
图9 PP1C底物识别由SHOC2和RAS驱动。gydF4y2Ba
一个gydF4y2Ba代表性的肽去磷酸化实验显示,当与SHOC2和KRAS配合时,PP1C对A/B/CRAF NTpS的催化效率更高,但对非目标肽没有催化效率。数据点来自两个时间点(n = 2)。见图。gydF4y2Ba4 gydF4y2Ba对三个独立实验进行统计总结。[PP1C] = 10 nM, [KRAS(GCP)] = 10µM。gydF4y2BabgydF4y2Ba,多肽去磷酸化实验显示PP1C(绿色)或PP1C:SHOC2:KRAS(栗色)对硝基苯磷酸(PNPP)去磷酸化。误差柱表示四个时间点(n = 4)的平均值+/- SD。[PP1C] = 10 nM, [KRAS(GCP)] = 10µM。两个独立实验的结果具有代表性。gydF4y2BacgydF4y2Ba, SEC分析显示,SHOC2:PP1C:KRAS和BRAF激酶结构域(橙色)(上)之间没有关联,相关的SDS-PAGE分析(下)。代表两个独立实验的结果gydF4y2BadgydF4y2BaA/B/CRAF NTpS (SHOC2:PP1C:RAS的预期生物靶点),CRAF CTpS和磷酸化酶A pS15(非靶肽)的序列比对。NTpS肽含有C末端疏水残基(黄色),NTpS和CTpS都含有关键的14-3-3相互作用残基(蓝色),这些残基可能已经进化为14-3-3识别,而不是SHOC2:PP1C:RAS识别。gydF4y2BaegydF4y2Ba,序列标志,显示A/B/CRAF NTpS在18个代表性物种中的保护情况gydF4y2Ba秀丽隐杆线虫gydF4y2Ba来gydF4y2Ba智人gydF4y2Ba(如果有等效的RAF异构体)(上),或跨物种分离RAF NTpS(下三)。gydF4y2BafgydF4y2Ba, SHOC2:PP1C:MRAS结构,PP1C衬底结合槽突出显示(红色椭圆)。gydF4y2Ba
图10 SHOC2:PP1C:RAS与多肽相互作用的分子动力学模拟。gydF4y2Ba
一个gydF4y2Ba,每个肽的主成分分析(PCA):蛋白质模拟,显示每个模拟中的稳定状态集群。代表性结构是从人口最多的州内选择的,如所示(黑线)。根据SHOC2的最终LRR和c端旋盖螺旋对典型结构进行对齐,将SHOC2疏水槽置于共同视图上。为了清晰,只有一个SHOC2:PP1C:MRAS复合物显示出来。RAF NTpS肽在大多数模拟中与SHOC2疏水槽相互作用,但对非目标肽没有作用。疏水相互作用可能包含相当大的熵部分,阻碍了对这些模型的结合自由能的精确计算。gydF4y2BabgydF4y2Ba, RAS结合模型。正常情况下,H/K/NRAS是RAF的首选结合伙伴,而MRAS是SHOC2:PP1C的首选结合伙伴。RAF和SHOC2:PP1C:RAS在底物去磷酸化之前在膜上共定位。gydF4y2Ba
补充信息gydF4y2Ba
补充表1gydF4y2Ba
高度依赖于SHOC2和HRAS, KRAS或NRAS的癌细胞系列表。gydF4y2Ba
BRAF NTpS肽与SHOC2:PP1C:MRAS复合物相互作用的分子动力学模拟gydF4y2Ba
BRAF NTpS(序列QRDRSS[pS]APNVHINTIEPVNID)结合到SHOC2:PP1C:MRAS复合物的分子模型如手稿中所述。该视频是5个独立运行的组合,并显示BRAF NTpS的C端区域与SHOC2 C端保守区域稳定地相互作用,表明SHOC2可以识别底物。gydF4y2Ba
CRAF NTpS肽与SHOC2:PP1C:MRAS复合物相互作用的分子动力学模拟gydF4y2Ba
本文建立了与SHOC2:PP1C:MRAS复合物结合的CRAF NTpS(序列QRQRST[pS]TPNVHMVSTTLPVDSR)的分子模型。该视频是5个独立运行的组合,并显示了CRAF NTpS的C端区域与SHOC2 C端保守区域稳定地相互作用,表明SHOC2识别了底物。gydF4y2Ba
ARAF NTpS肽与SHOC2:PP1C:MRAS复合物相互作用的分子动力学模拟gydF4y2Ba
本文建立了与SHOC2:PP1C:MRAS复合物结合的ARAF NTpS(序列QRIRST[pS]TPNVHMVSTTAPMDSN)的分子模型。该视频是5个独立运行的组合,并显示ARAF NTpS的C端区域与SHOC2 C端保守区域稳定地相互作用,表明SHOC2可以识别底物。gydF4y2Ba
BRAF cps肽与SHOC2:PP1C:MRAS复合物相互作用的分子动力学模拟gydF4y2Ba
BRAF cps(序列KIHRSA[pS]EPSLNRAGFQTEDFS)结合到SHOC2:PP1C:MRAS复合物的分子模型如手稿中所述。该视频是5个独立运行的合成,并显示BRAF cps的C端区域与SHOC2 C端保守区域不稳定地相互作用,这表明BRAF cps可能不是SHOC2介导的去磷酸化的底物。gydF4y2Ba
磷酸化酶A pS肽与SHOC2:PP1C:MRAS复合物相互作用的分子动力学模拟。gydF4y2Ba
磷酸化酶-A pS肽(序列EKRKQI[pS]VRGLAGVENVTELKK)结合到SHOC2:PP1C:MRAS复合物的分子模型如手稿所述。该视频是5个独立运行的合成,显示磷酸化酶- a pS肽的C端区域与SHOC2 C端保守区域不稳定相互作用,这表明磷酸化酶- a pS可能不是SHOC2介导的去磷酸化的底物。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Liau, N.P.D, Johnson, m.c., Izadi, S。gydF4y2Baet al。gydF4y2BaSHOC2调控RAS信号的结构基础。gydF4y2Ba自然gydF4y2Ba609gydF4y2Ba, 400-407(2022)。https://doi.org/10.1038/s41586-022-04838-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-04838-3gydF4y2Ba
这篇文章被引用gydF4y2Ba
震惊英国皇家空军gydF4y2Ba
结构与分子生物学gydF4y2Ba(2022)gydF4y2Ba
结构钥匙解锁RAS-MAPK细胞信号通路gydF4y2Ba
自然gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba