摘要gydF4y2Ba
RAS-MAPK信号是细胞增殖的基础,在大多数人类癌症中发生改变gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.然而,我们对RAS如何通过RAF发出信号的机制理解仍然不完整。虽然研究显示自抑制和活性RAF-MEK1-14-3-3复合物的快照gydF4y2Ba4gydF4y2Ba在美国,导致RAF激活的中间步骤尚不清楚。MRAS-SHOC2-PP1C全磷酸酶在丝氨酸259处去磷酸化RAF,导致14-3-3和RAF - ras关联的部分移位gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.MRAS、SHOC2和PP1C在MAPK通路异常激活引起的rasopathy - developmental syndrome中发生突变gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba而且SHOC2本身已经成为受体酪氨酸激酶(RTK) ras驱动肿瘤的潜在靶点gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.尽管它很重要,但人们对SHOC2全磷酸酶的结构还缺乏了解。在这里,我们使用x射线晶体学确定了MRAS-SHOC2-PP1C复合物的结构。SHOC2通过其凹面连接PP1C和MRAS,并使所有三个亚基之间的相互作用成为可能。生物物理特征表明,由MRAS gtp结合活性状态驱动的合作组装,这一观察结果可扩展到其他RAS亚型。我们的发现支持ras驱动的RAF激活多分子模型的概念,其中单个RAS-GTP分子招募RAF - 14-3-3和SHOC2-PP1C产生下游通路激活。重要的是,我们发现rasopathy和cancer突变存在于全磷酸酶内的蛋白质-蛋白质界面,导致亲和性和功能增强。总的来说,我们的发现揭示了RAS生物学的基本机制以及临床观察到的RAS - mapk信号增强的机制,因此为治疗干预提供了结构基础。gydF4y2Ba
主要gydF4y2Ba
RAS蛋白家族由高度同源的膜相关的小gtp酶组成,在RTK刺激后,或在疾病环境中通过激活突变,切换到活跃的gtp结合状态,导致构象变化,从而与各种效应蛋白相互作用gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba.RAF蛋白可以说是最重要的RAS效应物,一旦被激活,就会启动丝裂原活化蛋白激酶(MAPK)信号级联,以驱动细胞增殖和生存gydF4y2Ba3.gydF4y2Ba.鉴于基本的细胞过程被控制,RAS-MAPK通路经常通过激活癌细胞中的突变被劫持gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,但也在临床相关的发育综合征称为rasopathiesgydF4y2Ba19gydF4y2Ba.在正常情况下,信号在不同水平上被严格控制,通过与14-3-3二聚体和两个调节RAF磷酸化残基的相互作用,使RAF激酶保持自抑制构象。MRAS-SHOC2-PP1C全磷酸酶去磷酸化CRAF的Ser259 (BRAF的Ser365和ARAF的Ser214)被认为导致14-3-3的部分解离,使RAF-RAS结合,这是MAPK信号起始的关键步骤gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba.尽管我们可以了解raf -抑制和raf -激活复合物的结构组成和构象gydF4y2Ba4gydF4y2Ba目前缺乏MRAS-SHOC2-PP1C复合物参与RAF激活的结构解析。SHOC2是一种结构不明的富含亮氨酸重复序列(LRR)结构域的支架蛋白,被认为可以将蛋白磷酸酶1催化亚基(PP1C)定位到膜上,并可能为这种杂乱的酶提供底物选择性。SHOC2-PP1C被MRAS招募到细胞膜上,尽管一些报告显示与其他RAS亚型结合。关于SHOC2是否在GDP或gtp结合状态下与RAS结合,也存在相互矛盾的理论gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.这种复合物的生理重要性通过激活MRAS突变而得到强调gydF4y2Ba7gydF4y2Ba, SHOC2gydF4y2Ba8gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba, PP1CgydF4y2Ba9gydF4y2Ba,gydF4y2Ba14gydF4y2Ba以及CRAF(聚集在Ser259附近)gydF4y2Ba11gydF4y2Ba见于努南样综合征,这是一种rasopathy。此外,SHOC2耗尽-单独或与MEK抑制剂联合使用-最近已被提出作为某些ras驱动的癌症的治疗方法gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba.为了获得MRAS-SHOC2-PP1C全磷酸酶的结构理解,并解释影响其成分的临床相关突变,我们旨在描述亚单位关联并确定复合物的结构。我们的结果揭示了一个高度合作的组装,依赖于MRAS的核苷酸负载状态,与作为RAS效应子的SHOC2一致。SHOC2、MRAS和PP1C的Rasopathy突变映射到亚基界面,并增强复合物的形成,驱动RAF二聚体和MAPK通量。值得注意的是,依赖于gtp的SHOC2募集可以扩展到典型的RAS异构体,与MRAS相比,RAS异构体形成的三元复合物具有较低的协同性,但在体外具有相似的活性。有趣的是,我们发现在表达具有gtp激活突变的致癌RAS的癌细胞中,SHOC2和典型RAS蛋白具有显著的共同依赖性,但在这种情况下,对MRAS没有共同依赖性。综上所述,这些见解表明MRAS作为SHOC2-RAS-PP1C全磷酸酶的首选组分,但其他RAS亚型可以替代(特别是当携带gtp锁定突变时)。gydF4y2Ba
MRAS-SHOC2-PP1C协同组装gydF4y2Ba
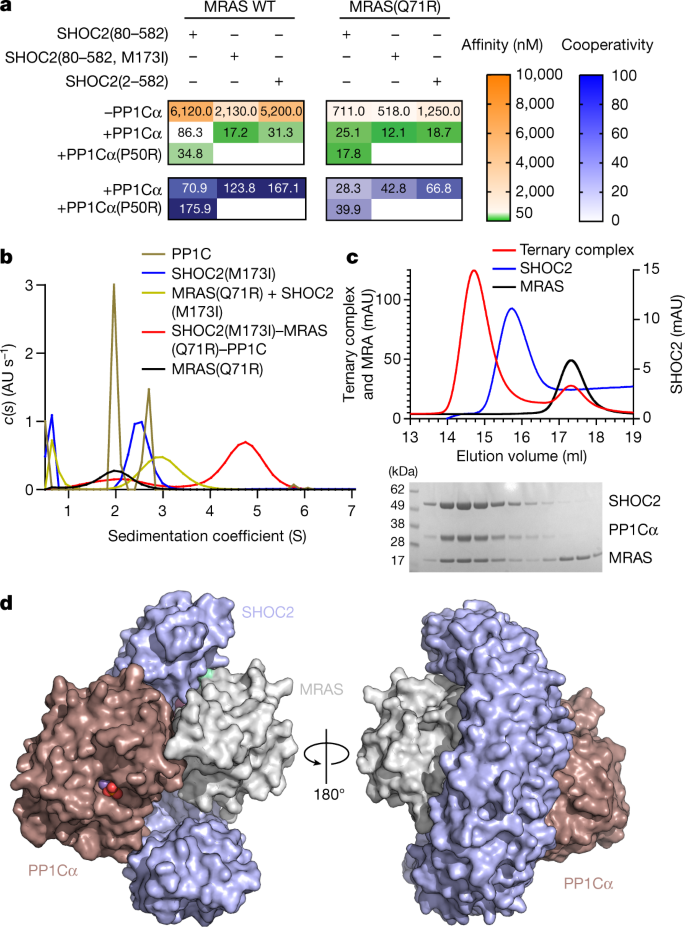
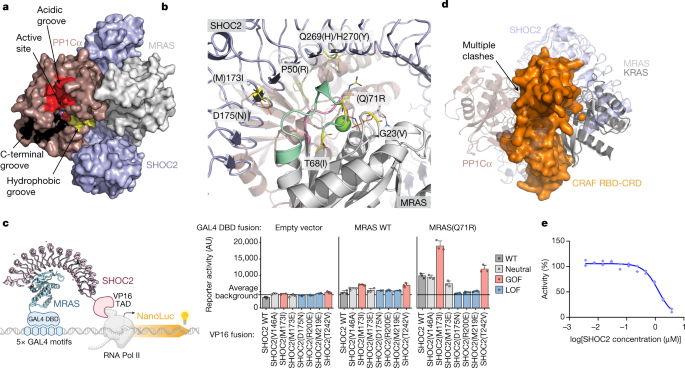
作为结构分析的前奏,我们从组成组分的角度研究了三元SHOC2配合物的组装。我们分别表达和纯化了重组体SHOC2(残基80-582,对应保守的LRR结构域)、MRAS(残基1-178)和PP1Cα(残基7-300),并利用表面等离子体共振(SPR)研究了它们之间的相互作用。为了评估其成对相互作用,我们固定化MRAS(装载GDP或不可水解GTP类似物GppNHp),并使用SHOC2或PP1Cα作为分析物进行SPR分析。尽管SHOC2以浓度和核苷酸依赖的方式与MRAS结合,PP1Cα却没有,即使在高微摩尔浓度(SHOC2,解离常数(gydF4y2BaKgydF4y2BaDgydF4y2Ba) = 6.12µm;PP1Cα,gydF4y2BaKgydF4y2BaDgydF4y2Ba,无约束力;无花果。gydF4y2Ba1gydF4y2Ba和扩展数据图。gydF4y2Ba1 a, bgydF4y2Ba).我们也无法检测到PP1Cα与固定的SHOC2的结合(扩展数据图。gydF4y2Ba1 cgydF4y2Ba),表明在这些条件下,PP1Cα不会与MRAS或SHOC2形成单独的二元配合物。值得注意的是,在过量PP1Cα的存在下,SHOC2对固定化MRAS的亲和力增加了70倍。这些发现表明PP1Cα需要MRAS和SHOC2同时存在才能参与三元配合物,而SHOC2和MRAS可以形成较弱的、独立的二元配合物。在PP1Cα存在的情况下,SHOC2 - MRAS结合具有较强的正协同作用,这表明三元配合物涉及组分蛋白之间的相互作用,而不是由SHOC2独立支撑MRAS和PP1C。gydF4y2Ba
一个gydF4y2Ba,亲和度(gydF4y2BaKgydF4y2BaDgydF4y2Ba)和相关的协作性(gydF4y2BaαgydF4y2Ba)由表面固定化MRAS-GppNHp (WT或Q71R)和指示分析物的SPR传感器图得出的值。协同性定义为二元与三元之比gydF4y2BaKgydF4y2BaDgydF4y2Ba值,gydF4y2BaαgydF4y2Ba=gydF4y2BaKgydF4y2BaDgydF4y2BaSHOC2gydF4y2Ba/gydF4y2BaKgydF4y2BaDgydF4y2BaSHOC2-PP1CgydF4y2Ba.反应单位(RU)信号的增加与两种蛋白的MRAS饱和度一致gydF4y2BaRgydF4y2Ba马克斯gydF4y2Ba,震动2,~800 - 1000 ru;gydF4y2BaRgydF4y2Ba马克斯gydF4y2Ba, shoc2 / pp1cα, ~ 1,250-1,500 ru)。gydF4y2BabgydF4y2Ba、沉积系数分布gydF4y2BacgydF4y2Ba(gydF4y2Ba年代gydF4y2Ba)由MRAS(Q71R)沉积速度剖面(黑色)得出;PP1Cα(青铜);SHOC2(80-582, M173I)(蓝色);MRAS(Q71R)和SHOC2(80-582, M173)的混合物(金);SHOC2(80-582, M173I), MRAS(Q71R)和PP1Cα(红色)的混合物。原始沉降信号是在转子转速为42,000 rpm、温度为20°C的情况下,在280 nm处通过吸收获得的。所有蛋白在10 μM的等摩尔浓度下沉积。数据代表两个独立的实验。gydF4y2BacgydF4y2Ba,半制备SEC在280 nm处的紫外光吸光度(上)。三元复迹相对应的单个组分SDS-PAGE分析(下)。SEC实验独立地重复了三次,得到了相似的结果。gydF4y2BadgydF4y2Ba、SHOC2(淡蓝色)、MRAS(灰色)和PP1Cα(栗色)三元配合物的表面表示。结合在活性位点的磷酸基显示为红色球体,而MngydF4y2Ba2 +gydF4y2Ba显示为紫色。gydF4y2Ba
我们推断,在SHOC2和/或MRAS中,rasopathy-associated gain of function (GOF)突变可能稳定三元复合物,从而促进结构分析。带有M173I取代的SHOC2,在一些具有努南综合征特征的个体中发现gydF4y2Ba8gydF4y2Ba(2.5×/5×二元/三元;无花果。gydF4y2Ba1gydF4y2Ba).类似地,MRAS中ras病相关的Q71R突变也导致了对野生型(WT) SHOC2 LRR结构域(8×/3×二元/三元;无花果。gydF4y2Ba1gydF4y2Ba).PP1Cα P50R突变是PP1Cβ GOF P49R突变的替代品,同样提高了三元配合物的亲和力。结合MRAS(Q71R)和SHOC2(M173I)进一步稳定了二元和三元配合物(12×/7×二元/三元;无花果。gydF4y2Ba1gydF4y2Ba).为了测试非结构的SHOC2 N端是否有助于复杂组装,我们纯化了全长的SHOC2(残基2-582)。尽管与MRAS的二元相互作用相当于或略低于SHOC2(80-582),三元络合物的形成得到了改善,这与PP1Cα与SHOC2 N端直接相互作用的可能性一致。分析超离心和半制备尺寸排除色谱(SEC)均证实,等摩尔比的MRAS(Q71R)、SHOC2(80-582, M173I)和PP1Cα可以有效地形成稳定的配合物(图。gydF4y2Ba1 b, cgydF4y2Ba).一个由SHOC2 LRR结构域的M173I rasopathy突变体(80-582)、GTPase-deficient MRAS(Q71R)和WT PP1Cα组成的复合物被分离并结晶,衍射至1.95 Å (gydF4y2BaRgydF4y2Ba结晶的gydF4y2Ba= 0.1838;gydF4y2BaRgydF4y2Ba免费的gydF4y2Ba= 0.2209;无花果。gydF4y2Ba1 dgydF4y2Ba,gydF4y2Ba方法gydF4y2Ba及扩展数据表gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
MRAS-SHOC2-PP1C全磷酸酶结构gydF4y2Ba
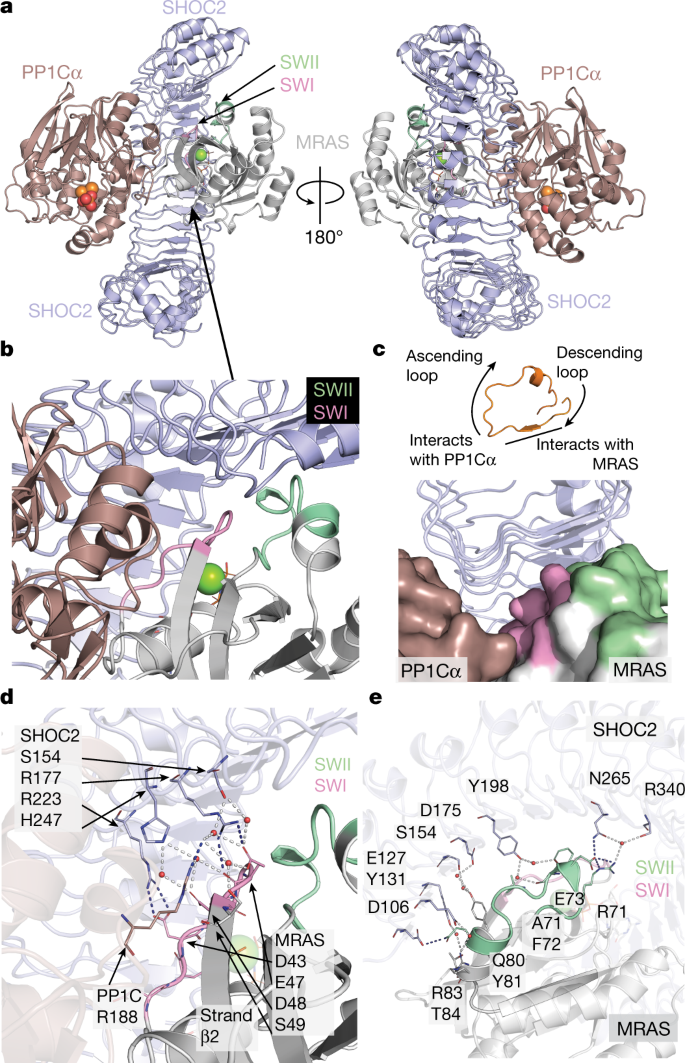
全酶表现出一个紧凑的结构,其中c形的SHOC2包裹着MRAS和PP1Cα,使所有三个亚基之间的相互作用(图1)。gydF4y2Ba2gydF4y2Ba).SHOC2表现出预期的LRR折叠;20次重复的SHOC2线圈形成一个沿其内凹表面延伸β-片的螺线管。gppnhp结合的MRAS和PP1Cα都以球状结构域的形式存在,这与已发表的载脂蛋白结构一致gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba.在SHOC2的凹面上高度保守的残基与MRAS和PP1Cα接合(扩展数据图。gydF4y2Ba1 d, egydF4y2Ba).MRAS主要由LRR结构域2-10的下降环和β链参与,而PP1Cα则由每个LRR β链的c端上升环协调,几乎跨越整个SHOC2螺线管(图2)。gydF4y2Ba2 b, cgydF4y2Ba).我们还在1.9 Å分辨率下确定了SHOC2的孤立LRR结构域(残基80-582)(扩展数据图)。gydF4y2Ba2gydF4y2Ba).无配位域采用了类似的整体结构,但与三元配合物中的SHOC2相比,其总体曲率变化不大(扩展数据图)。gydF4y2Ba2 bgydF4y2Ba).这种程度的灵活性在许多LRR蛋白中都可以看到。在载波结构和三元配合物中,SHOC2 β-链在9和10链之间被破坏,桥接水分子插入到平行β-链之间规则的氢键模式中(扩展数据图)。gydF4y2Ba2摄氏度gydF4y2Ba).这似乎是SHOC2的一个保守特征,因为Alphafold准确地预测了它gydF4y2Ba25gydF4y2Ba.gydF4y2Ba
一个gydF4y2Ba, SHOC2(淡蓝色),MRAS(灰色)和PP1Cα(栗色)复合物的卡通视图,说明了由SHOC2凹面介导的相互作用。MRAS的SWI和SWII分别以粉红色和绿色突出显示;GppNHp以球和棒的形式呈现;和毫克gydF4y2Ba2 +gydF4y2Ba表示为一个绿色球体。结合到PP1C活性位点的磷酸盐用红色表示,而MngydF4y2Ba2 +gydF4y2Ba金属用橙色球体表示。这种配色方案贯穿于所有的人物。gydF4y2BabgydF4y2Ba, MRAS的SWI(淡绿色)和SWII(粉红色)介导的SHOC2、PP1Cα与MRAS的协同界面。gydF4y2BacgydF4y2BaSHOC2利用其β-sheet表面和多个LRRs的下行环招募MRAS,同时通过多个LRRs的上行环与PP1Cα结合。一个具有代表性的LRR(橙色)所示。MRAS和PP1Cα以表面表示。gydF4y2BadgydF4y2Ba合作界面上的直接和水介导的相互作用突出了MRAS SWI与pp1 α螺旋g的Arg188的相互作用。所示侧链用亚基进行颜色编码,其中代表的水分子用红色球体表示,键合网络用折线标出。mras结合的镁离子显示为绿色球体。gydF4y2BaegydF4y2Ba,在合作界面上直接和水介导的相互作用gydF4y2BadgydF4y2Ba,但强调MRAS SWI和SWII与SHOC2的交互作用。gydF4y2Ba
MRAS GTPase采用活性构象,在结合的GTP类似物的结构中观察到清晰的密度。MRAS开关I (SWI)和开关II (SWII)循环在GTP与gdp绑定状态下重新排列,是该复合物的核心。在目前的结构中,MRAS的SWI和SWII都与SHOC2有广泛的相互作用(图2)。gydF4y2Ba两个罪犯gydF4y2Ba),而SWI与MRAS螺旋α1及其邻近区域同时参与PP1Cα。SWI和SWII介导了大部分的相互作用,将SHOC2的n端LRR结构域招募到MRAS。静电和疏水的相互作用都有助于界面,其中还包含16个协调的水。值得注意的是,结合MRAS(Q71R)位于一种特别“封闭”、活跃的GppNHp构象中,与未结合的GppNHp - MRAS和NRAS有很大不同gydF4y2Ba22gydF4y2Ba,gydF4y2Ba26gydF4y2Ba(蛋白质数据库(PDB):gydF4y2Ba1 x1gydF4y2Ba,gydF4y2Ba1 x1rgydF4y2Ba,gydF4y2Ba5特高压gydF4y2Ba;扩展数据图。gydF4y2Ba3 a, bgydF4y2Ba).重要的是,MRAS SWII的重新排列可以与SHOC2进行额外的交互。这种构象移位使SWII残基能够介导直接相互作用,并在界面处形成协调的溶剂网络。由MRAS残基Gln80和Glu73以及SHOC2残基Asp106和Asn265所强调的直接相互作用,是由SWII主链和SHOC2 β-片之间的大量水介导的相互作用所支持的。gydF4y2Ba2 egydF4y2Ba).gydF4y2Ba
未结合的GppNHp-MRAS的SWI基序也采用开放的非活性构象,但我们发现结合的MRAS SWI反映了活跃的标准RAS异构体(扩展数据图)。gydF4y2Ba3 a, bgydF4y2Ba).这种活性构象对于SWI残基在SHOC2界面上的正确取向是必需的,同时支持PP1Cα通过SWI残基Glu47和Asp48结合。这些MRAS SWI和邻近残基与活性位点对面小螺旋结构域螺旋G周围的PP1Cα残基相互作用。SWI残基与周围溶剂的相互作用网络直接延伸到SHOC2界面(图2)。gydF4y2Ba二维gydF4y2Ba和扩展数据图。gydF4y2Ba3 cgydF4y2Ba)强调了MRAS构象位移(相对于载波MRAS),这对SHOC2和PP1Cα结合都至关重要。gydF4y2Ba
PP1Cα结合到由SHOC2和MRAS形成的广泛的复合表面(扩展数据图。gydF4y2Ba4 a、bgydF4y2Ba),并定向使其活性位点暴露,并完全可用于底物在全酶复合物中的结合(图。gydF4y2Ba3gydF4y2Ba).PP1C作为多种PP1磷酸酶复合物的催化亚基,在整个系统发育中高度保守。与SHOC2和MRAS接触的PP1C残基在高等真核生物中表达的三种亚型(α, β和γ)中几乎相同地保守(扩展数据图)。gydF4y2Ba4摄氏度gydF4y2Ba).因此,我们期望三种异构体中的任何一种都可以组装形成SHOC2全酶。PP1活性是通过它与许多调节蛋白的相互作用来控制的,这些蛋白将磷酸酶靶向到特定的细胞位置并确定底物的特异性gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba.通常,这些调节因子通过在蛋白质内在无序区域内发现的4-8个氨基酸的短线性基序与PP1Cα结合。许多这些调控伙伴的共同结合位点已被映射到PP1C表面,远于酸性、疏水和c端底物结合槽。在SHOC2全酶中,所有这些底物结合槽都可在PP1C上访问(图。gydF4y2Ba3gydF4y2Ba).SHOC2的绑定模式更类似于SDS22的绑定模式gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba这是一种从酵母到人类保守的调控伙伴,并通过其LRR结构域的广泛相互作用与PP1C结合。尽管它们的结合位点部分重叠,但在SHOC2和SDS22与PP1C的结合中没有直接的结构对应。SHOC2和PP1Cα之间的相互作用主要是极性的,三个亚基之间的结合界面都含有大量的有序溶剂。尽管如此,广泛的亚单位之间的相互作用共埋葬了大约4966 ÅgydF4y2Ba2gydF4y2Ba溶剂可接触表面。其中只有1762个ÅgydF4y2Ba2gydF4y2Ba埋在SHOC2和PP1Cα之间(约881 ÅgydF4y2Ba2gydF4y2Ba表面上)。在缺乏MRAS的情况下,shoc2 - pp1 α界面的高度极性和溶剂化性质决定了它们相互作用的极低亲和力。gydF4y2Ba
一个gydF4y2Ba, SHOC2-PP1Cα-MRAS全酶的表面表达,突出显示了PP1Cα的活性位点和可接近的酸性(红色)、c端(黑色)和疏水(黄色)底物结合槽。在SHOC2(80-582) -MRAS (Q71R, 1-178) -PP1Ca(7-300)三元配合物中没有占据RVXF和PP1Cα的其他调控面。gydF4y2BabgydF4y2Ba, GOF rasopathy突变定位于PPI界面。指示的GOF和LOF rasopathy突变分别显示为黄色和橙色突出的棒状;SHOC2和MRAS用灰色表示,SWI和SWII表示。Ile173 (WT SHOC2中的Met173)填充了由SWI, SWII和SHOC2 LRR结构域产生的疏水空间。SHOC2 Gln269/His270位于这三个亚基的界面上,而SHOC2 Asp175将一个水坐标到MRAS Tyr81。PP1Cα Pro50位于PPI界面,但由于侧链的限制,不能进行大量的相互作用。gydF4y2BacgydF4y2Ba, M2H系统示意图(左)。WT及突变型GAL4(DBD) -MRAS与SHOC2-VP16 (TAD)同时表达并相互作用产生的Nluc报告信号(右)。数据为均数±s.e.m。gydF4y2BangydF4y2Ba= 3个独立的生物重复。该图是用gydF4y2BaBioRender.comgydF4y2Ba.gydF4y2BadgydF4y2Ba, MRAS-SHOC2-PP1C三元全磷酸酶结构与crf RBD-CRD结构域结合的KRAS结构的对齐(PDB:gydF4y2Ba6 xhagydF4y2Ba).注意,对齐(使用RAS作为关键对象)会导致RBD-CRD和PP1C-SHOC2之间的多次冲突。gydF4y2BaegydF4y2Ba如TR-FRET试验评估的那样,Untagged全长SHOC2破坏了MRAS(Q71R) -GppNHp和RBD的相互作用(ICgydF4y2Ba50gydF4y2Ba913nM),表明SHOC2和RBD与RAS的结合是不相容的。技术复制显示为单个数据点;展示了三个独立实验中的一个。集成电路的竞争gydF4y2Ba50gydF4y2Ba扩展数据表中提供了其他测试组合的值gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
总的来说,我们的mras - shoc2 - pp1 α全磷酸酶的高分辨率x射线结构揭示了合作复合物组装,并能够详细解剖三种组分之间的相互作用氨基酸。gydF4y2Ba
Rasopathy突变定位于PPIsgydF4y2Ba
在SHOC2、MRAS和ppc β上已报道了引起rasopathy的GOF突变gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba.此外,一些与rasopathy无关的SHOC2功能丧失(LOF)突变体通过基因筛选被识别出来,这些基因筛选废除了rtk - ras激活的表型gydF4y2Ba秀丽隐杆线虫gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba.我们将这些不同突变体的位置映射到我们的结构上。值得注意的是,几乎所有报道的GOF突变都定位于SHOC2 - mras - PP1Cα结构中的PPI接口,其中大多数共同定位于SWI/ swii介导的与SHOC2和PP1Cα的合作接口(图1)。gydF4y2Ba3 bgydF4y2Ba).rasopathy相关突变SHOC2(M173I)和Q269_H270delinsHY (Q269H/H270Y);MRAS G23V、T68I和Q71R;PP1Cα P50R(对应PP1Cβ P49R);而非rasopathy SHOC2 LOF突变D175N和E457K均映射到相互作用位点。这些观察结果支持这样的结论,即GOF rasopathy突变可以通过调节驱动复杂关联的表面来增加MAPK信号。gydF4y2Ba
在我们的SPR和细胞双杂交实验(下面讨论)中,SHOC2(M173I)对WT MRAS的亲和力有轻微增加,它在我们的结构中被分解,位于由SHOC2 Thr150、Asp175和Thr196以及SWII MRAS残基Ala76和Met77形成的关键疏水贴片的表面。此外,通过SPR测量,SHOC2(M173I) -MRAS (Q71R) -PP1Cα (WT)配合物的亲和力明显高于SHOC2(WT) -MRAS (WT) -PP1Cα (WT)配合物(图)。gydF4y2Ba1gydF4y2Ba).为了从结构的角度解释后一种亲和性差异,我们对突变体结构和相应的WT三元配合物进行了分子动力学模拟。对于WT复合物,我们将结构上的SHOC2 Ile173和MRAS Arg71反向突变到相应的WT残基上(SHOC2 Met173和MRAS Gln71)。虽然从我们突变体结构的分子动力学模拟中获得的构象系综与晶体态非常相似,但WT配合物的模拟显示MRAS-SHOC2界面的三种不同状态(扩展数据图)。gydF4y2Ba5gydF4y2Ba).WT模拟的主要状态(67%的集合)显示了MRAS和SHOC2之间在Met173附近的直接蛋白-蛋白氢键,而较少流行的状态(33%的集合)在该区域周围显示了水介导的氢键。MRAS WT和SHOC2 WT之间的这种局部“紧密性”损失可能会导致界面处水的增加而导致熵成本,这为在SPR分析中观察到的相对于SHOC2(M173I) -MRAS (Q71R) -PP1Cα (WT)复合物的较低亲和力提供了支持。接下来,我们研究了GOF和LOF突变对细胞中SHOC2-MRAS相互作用的影响。我们开发了一种哺乳动物双杂交(M2H)试验,其中GAL4 dna结合域融合到MRAS WT或MRAS(Q71R),我们监测荧光素酶活性与SHOC2-VP16 /TAD结合成比例(图2)。gydF4y2Ba3 cgydF4y2Ba).考虑到细胞中大量WT MRAS处于GDP状态,我们使用MRAS(Q71R)突变来锁定gtp诱导的RAS构象变化,我们发现这对于检测与SHOC2的强相互作用是必要的。我们通过突变从x射线三元结构推断的关键SHOC2-MRAS相互作用残基来研究我们的M2H测定的有效性。我们发现,从PPIs (V146A)突变的SHOC2不会改变SHOC2 - ras相互作用。相比之下,MRAS SWI-SWII接口的SHOC2突变(R200E或M219E)导致SHOC2 - MRAS结合缺失,而T242V产生了显著的亲和力增强。接下来,我们发现rasopathology衍生的SHOC2 GOF突变体M173I导致MRAS募集增加两倍,当异亮氨酸被谷氨酸取代时,MRAS募集恢复。在同一热点PPI区域,LOF突变D175N取消了SHOC2与MRAS的结合(图。gydF4y2Ba3 cgydF4y2Ba).考虑到该检测信号中蛋白质的非原生(核)定位,我们使用正交SHOC2-eGFP二部系统,与mCherry表达对照相比,该系统能够定量评估SHOC2-eGFP丰度。我们发现突变不会改变SHOC2的丰度或导致细胞中的聚集(在细胞隔间中的精确分布没有被分析)(扩展数据图。gydF4y2Ba6 a、bgydF4y2Ba).gydF4y2Ba
总的来说,我们在这里的发现验证了结构观察,并揭示了与疾病相关的突变,如在rasopathy中发现的突变,定位于PPIs并调节复合物组装以影响所产生复合物的功能。gydF4y2Ba
SHOC2和RAF RBD竞争RAS结合gydF4y2Ba
位于SHOC2-PP1Cα界面核心的MRAS SWI残基也负责将RAF的ras结合和富半胱氨酸结构域(RBD-CRD)募集到质膜。我们注意到SWI延伸到β2链的c端残基对RBD和PP1Cα界面都至关重要。磷酸酶三元复合物中的MRAS与先前解决的KRAS - raf的KRAS对齐gydF4y2BaRBD-CRDgydF4y2Ba共结构与该MRAS亚基的SWI募集RAF到单个全酶复合体不相容(PDB:gydF4y2Ba6 xhagydF4y2Ba;无花果。gydF4y2Ba3 dgydF4y2Ba),表明RAS不能同时接合SHOC2-PP1Cα和RAF激酶。为了在实验上证实这一点,我们首先通过SPR测量了MRAS与分离的cRAF1 RBD(以下简称RBD)的亲和力,并证实了MRAS WT和Q71R突变体之间的亲和力相似,并且与典型的NRAS(Q61R)变体相当(扩展数据表)gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
为了证实RBD结合与SHOC2介导的复合物形成不相容,我们在RBD和gppnhp负载的MRAS(Q71R)之间建立了时间分辨荧光能量转移(TR-FRET)试验,并评估了未标记的全长SHOC2(残基2-582)破坏这种相互作用的能力。与RBD结合RAS的竞争预期一致,我们在本试验中获得了半最大抑制浓度(IC)的完全抑制gydF4y2Ba50gydF4y2Ba)的913 nM(图;gydF4y2Ba3 egydF4y2Ba),与SHOC2对MRAS的亲和性(Q71R)一致。为了确认并进一步扩展这一初步结果,我们想评估这一观察结果是否可转移到其他RAS蛋白,并与MRAS WT和NRAS(Q61R)建立了类似的竞争分析,并包括GOF突变体SHOC2(M173I)(扩展数据表)gydF4y2Ba3.gydF4y2Ba).与MRAS(Q71R) -RBD设置一样,全长SHOC2也取代了含有IC的MRAS WT中的RBDgydF4y2Ba50gydF4y2Ba值与SPR数据一致。在TR-FRET系统中,SHOC2(M173I)对MRAS具有较高的亲和力(如在SPR中观察到的那样),显示出较低的ICgydF4y2Ba50gydF4y2Ba有趣的是,SHOC2也表现出与NRAS(Q61R) -RBD非常相似的竞争,这表明SHOC2也与标准RAS蛋白相互作用(扩展数据表gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
NRAS和KRAS形成功能性全磷酸酶gydF4y2Ba
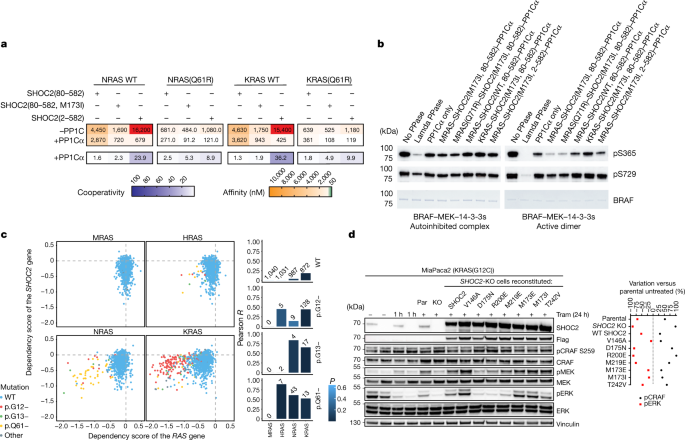
与SHOC2相互作用的MRAS残基在非典型MRAS和RRAS以及典型RAS蛋白中在整个系统发育中高度保守(扩展数据图)。gydF4y2Ba7一个gydF4y2Ba).相比之下,与PP1C接触的MRAS残基子集在RRAS1、RRAS2或典型RAS蛋白中并不保守。这些独特的相互作用可能支持活性MRAS在全磷酸酶复合物中的优先组装。为了从机制上研究标准RAS异构体是否可以结合到SHOC2并形成三元配合物,我们使用结合到SPR芯片表面的NRAS和KRAS进行了SPR分析(图2)。gydF4y2Ba4gydF4y2Ba).我们发现,gppnhp负载的NRAS和KRAS能够与SHOC2的二元相互作用水平与MRAS相当(图2)。gydF4y2Ba1gydF4y2Ba),与与SHOC2结合的序列高度保守相一致。值得注意的是,虽然我们可以观察到加入PP1C后三元配合物的清晰形成,但相互作用的协同性几乎完全丧失。我们发现,这些含有NRAS-和kras的三元配合物与MRAS对应物相比,整体亲和力低4倍至33倍。我们进一步观察到,与装载gppnhp的WT蛋白相比,gtp锁定Q61R突变对含有NRAS-和kras的复合物有积极的影响。这表明,像在MRAS中一样,Q61R突变可以添加一个残基,不仅可以刚性活性构象,而且还可以积极参与RAS-SHOC2 PPI。尽管这些突变显著提高了复合物的整体亲和力,但这并不能完全恢复到含有WT MRAS的复合物水平的结合。为了直接测试MRAS在全磷酸酶结合方面是否比其他RAS异构体更有竞争力,我们将重组KRAS和MRAS与SHOC2和PP1Cα各相当于一个,并用SEC纯化该复合物。我们发现含有KRAS的复合物很容易分离(扩展数据图)。gydF4y2Ba7 bgydF4y2Ba),但在等摩尔条件下,MRAS完全优于KRAS。这表明gtp结合的MRAS是全磷酸酶内优化的RAS亚型,而其他RAS亚型可以在MRAS缺失的情况下替代。gydF4y2Ba
一个gydF4y2Baspr衍生的亲和力和协同作用固定化NRAS - gppnhp, NRAS(Q61R) -GTP, KRAS - gppnhp或KRAS(Q61R) -GTP与指定的分析物。gydF4y2BaαgydF4y2Ba=gydF4y2BaKgydF4y2BaDgydF4y2BaSHOC2gydF4y2Ba/gydF4y2BaKgydF4y2BaDgydF4y2BaSHOC2-PP1CgydF4y2Ba.超过10,000 nM的亲和值用红色突出显示。gydF4y2BabgydF4y2BaSHOC2全磷酸酶体外去磷酸化自抑制和活性BRAF-MEK1-14-3-3复合物。将自抑制状态(左)或活性二聚体状态(右)纯化的全长BRAF复合物与lambda磷酸酶(PPase)、pp1 α或三元SHOC2复合物孵育,并用Ser365和Ser729位点磷酸化的BRAF磷酸化特异性抗体进行印迹。考马斯染色显示BRAF配合物的等效负荷。磷酸化的Ser365相对于活性二聚体中的Ser729选择性地去磷酸化,而两者都在自抑制(14-3-3- binding)状态下受到相对保护。实验进行了两次,得到了相似的结果。gydF4y2BacgydF4y2Ba,打倒之间的关系gydF4y2BaSHOC2gydF4y2Ba而且gydF4y2BamragydF4y2Ba,gydF4y2Ba极品gydF4y2Ba,gydF4y2Ba国家管制当局方面gydF4y2Ba而且gydF4y2Ba喀斯特gydF4y2Ba.每个依赖项的得分gydF4y2Ba拉gydF4y2Ba基因和gydF4y2BaSHOC2gydF4y2Ba都显示在gydF4y2BaxgydF4y2Ba而且gydF4y2BaygydF4y2Ba轴,分别。虚线表示依赖分数为零。高度负依赖性得分意味着给定的细胞系高度依赖该基因。同时依赖于SHOC2和RAS的细胞系显示在左下角。对,计算出的Pearson相关系数(gydF4y2BaygydF4y2Ba轴)应用于每个突变组(包含相关突变的细胞系组)。阳性值越高,正相关关系越强:SHOC2基因的依赖得分与RAS基因的依赖得分呈同一直线下降/上升趋势。的gydF4y2BangydF4y2Ba每个柱状图上方的值表示每个突变组中的细胞系数量。gydF4y2BadgydF4y2Ba, MiaPaca2亲本细胞(Par)免疫印迹分析;gydF4y2BaSHOC2 -gydF4y2Ba10 nM trametinib (Tram)处理1 h或24 h(+)后,KO (KO)和稳定细胞系用SHOC2突变体重组。将未处理的MiaPaca2亲本细胞归一化,通过免疫印迹分析得到pCRAF/CRAF和pERK/ERK水平的密度定量(百分比变化)。样品来源于同一实验,印迹并行处理。这些图像代表了两个独立的实验。gydF4y2Ba
为了测试我们纯化的复合物是否对RAF Ser259磷酸化位点具有活性和特异性,我们纯化了含有MRAS、PP1Cα和WT或GOF SHOC2(M173I)突变体的复合物。我们发现所有全磷酸酶复合物都能在活性的二聚态下对重组BRAF进行位点特异性去磷酸化。组装的复合物在体外特异性地去磷酸化BRAF Ser365(相当于CRAF Ser259),而对BRAF的c端14-3-3结合位点Ser729(相当于CRAF Ser621)没有活性。rasopathy GOF SHOC2(M173I)突变增强了这种活性(图。gydF4y2Ba4 bgydF4y2Ba).此外,我们还发现含有PP1Cα、SHOC2(M173I)和KRAS而不是MRAS的复合物仍然能够选择性地去磷酸化,这表明,一旦形成,全磷酸酶活性不依赖于RAS亚型。gydF4y2Ba
我们的数据表明,有利于gtp锁定状态的RAS突变可以促进复杂的形成,并且独立地,RAS标准异构体可以替代MRAS。值得注意的是,在癌症中,典型的RAS蛋白(而不是MRAS)经常受到激活突变的影响,从而驱动癌细胞的生存和增殖。对DepMap提供的大型癌症功能筛选数据集(超过1,000个细胞系)的分析(gydF4y2Bahttps://depmap.org/portal/gydF4y2Ba)表明SHOC2对于在典型RAS蛋白中携带gtp激活突变的细胞模型的生存是必要的,潜在的功能相互作用。有趣的是,在SHOC2起重要作用的模型中,MRAS耗竭对细胞适应度没有影响(图)。gydF4y2Ba4摄氏度gydF4y2Ba).SHOC2和RAF1 (CRAF)依赖配置文件在所有细胞模型中都有良好的相关性,突出了它们的基本功能交互作用,这与给定的RAS伙伴无关(扩展数据图。gydF4y2Ba7 cgydF4y2Ba).gydF4y2Ba
为了验证这些发现,我们在KRAS中进行了实验gydF4y2BaG12CgydF4y2Ba-突变的MiaPaca2细胞存在MEK抑制剂曲美替尼。SHOC2已显示出合成致死率gydF4y2Ba喀斯特gydF4y2Ba-突变癌系,如MEK抑制剂处理的MiaPaca2细胞,在初始通路抑制后,引起通路反弹并增加RAS GTP负载gydF4y2Ba18gydF4y2Ba.与这些报道一致,我们发现敲除(KO)的内源性gydF4y2BaSHOC2gydF4y2Ba阻止MAPK通路的再激活(24小时曲美tinib治疗),导致磷酸化的CRAF Ser259(抑制RAF)增加,磷酸化的ERK和磷酸化的MEK减少,这测量了MAPK通路下游的活性(图。gydF4y2Ba4 dgydF4y2Ba).在相同条件下,击倒gydF4y2BamragydF4y2Ba表达未对CRAF Ser259的磷酸化及下游标记物产生任何显著变化(扩展数据图)。gydF4y2Ba7 dgydF4y2Ba;比较车道1-2gydF4y2BamragydF4y2Ba在3-4车道击倒gydF4y2BaSHOC2gydF4y2BaKO)。这些和先前的结果与来自癌症功能筛查的数据一致,并表明在RAS - gtp锁定条件下,例如由致癌基因突变导致的条件下,典型RAS蛋白可以替代SHOC2-PP1C复合体中的MRAS。gydF4y2Ba
最后,我们使用了MiaPaca2的上下文gydF4y2BaSHOC2 -gydF4y2Ba以KO模型研究其功能效应gydF4y2BaSHOC2gydF4y2BaMAPK激活标记的突变(图;gydF4y2Ba4 dgydF4y2Ba).虽然用WT SHOC2和中性或GOF突变重组后pCRAF (Ser259)、pMEK和pERK水平恢复到亲本细胞系的水平,但SHOC2 LOF突变如D175N与KO相当,这表明SHOC2全磷酸酶关联影响MAPK通路的活性。结合之前M2H中给出的相互作用数据(图。gydF4y2Ba3 cgydF4y2Ba),在MRAS-SHOC2 PPI上的合理诱变使我们能够指导这些成分在细胞中的亲和力和活性,确认了我们结构中这些相互作用表面的保真度。gydF4y2Ba
讨论gydF4y2Ba
在这里,我们描述了SHOC2-MRAS-PP1Cα全酶的组装和结构,这被认为是调节RAF磷酸化状态和MAPK通路活性的关键。使用单独纯化的亚基,我们证明了这些成分具有高度的协同性,在pp1 α存在的情况下,SHOC2的LRR结构域对gppnhp负载的MRAS的亲和力增加了70倍。此外,我们能够证明只有在全酶的第三个成员存在的情况下,PP1Cα与SHOC2或MRAS与PP1Cα之间才存在稳定的相互作用。我们的结构解释了观察到的协同作用,即SHOC2 LRR作为关键节点通过广泛的凹面招募MRAS和PP1Cα,同时创建一个相互依赖的蛋白质-蛋白质和水介导的相互作用网络,同时涉及所有三个亚基。gppnhp负载的MRAS是复合物的核心,而SHOC2作为RAS效应分子,与SWI和SWII的活性构象相互作用,使SWI与pp1 α相互作用。SWI在界面上的核心作用,介导与SHOC2和PP1Cα的相互作用,我们的对齐和竞争实验数据与我们复合物中发现的RAS原聚体直接招募RBD-CRD和RAF的下游Ser259磷酸化位点不一致。我们对含有完整N端全长SHOC2的招募研究显示,只有在磷酸酶存在的情况下,才会增加对MRAS的亲和力(图2)。gydF4y2Ba1gydF4y2Ba),提示SHOC2的N端与PP1Cα直接相互作用。PP1Cα经常通过短的线性相互作用基序出现在与多个调控因子的复合物中,当本文正在审查时,发表了一篇预印本,其中包含全长SHOC2的全酶晶体结构,显示了SHOC2的RVXF基序与PP1Cα的RVXF结合口袋之间的直接相互作用gydF4y2Ba38gydF4y2Ba.在SHOC2领域存在的一个冲突是,SHOC2是否只与MRAS相互作用,还是与多种RAS亚型混杂。原始细胞免疫沉淀研究发现,SHOC2和PP1C是MRAS特有的效应因子。然而,最近的研究显示,SHOC2衰竭与MEK抑制剂在合成的致命相互作用,而不是MRASgydF4y2Ba喀斯特gydF4y2Ba-突变的胰腺癌或肺癌细胞株gydF4y2Ba18gydF4y2Ba.我们的招募研究表明,所研究的所有RAS亚型都以相似的亲和力招募SHOC2,并显示出在其他RAS效应子相互作用中发现的相同的gtp负载依赖性。然而,不同的RAS-PP1C界面似乎有利于MRAS作为该配合物的首选组分,这从含NRAS或KRAS的三元配合物相对较低的亲和力和协同性得到证明gydF4y2Ba18gydF4y2Ba.DepMap分析和我们的细胞实验与MRAS的可有可无性一致,这表明在某些细胞环境下,MRAS可以被取代为全磷酸酶复合体中的优势RAS物种,例如存在显著改变这些RAS蛋白的gtp负载状态的致癌突变gydF4y2Ba39gydF4y2Ba.每个RAS亚型在全酶中的确切贡献和潜在的生物学背景仍然是一个悬而未决的问题。值得注意的是,MRAS的SHOC2和SWI的凹表面介导的广泛界面与其他含有脚手架亚基的PP1或PP2A全酶类似(Huntingtin,伸长因子3,蛋白磷酸酶2A,酵母激酶TOR1)或LRR重复序列。PP1Cα和活性位点金属离子的三个底物槽远离复合物的核心,而PP1Cα和MRAS的界面延伸了磷酸酶的疏水槽,通向活性位点。疏水结合槽的延伸被认为是含有支架和调节亚基的类似PP2A全酶的底物募集机制。RAS可能有类似的在Ser259位点磷酸化的RAF招募机制。无论如何,我们证明了组装的全磷酸酶体外对RAF Ser259具有更高的活性和特异性(图2)。gydF4y2Ba4 bgydF4y2Ba),提示在去磷酸化之前直接识别。gydF4y2Ba
总之,RAS gtp结合的特异性以及RAS与SHOC2-PP1C或RAF的互斥相互作用允许推测存在具有不同复合物的多分子RAS信号体模型,其中至少两个单独的RAS分子在激活后同时招募RAF - 14-3-3和全磷酸酶以激活RAF。这种协调机制是否需要两种不同复合物之间的直接相互作用,例如,通过RAS单元,或简单的共定位在细胞质膜上,仍有待建立。最后,我们为这种活跃的RAS-SHOC2-PP1C全磷酸酶复合物在rasopathy和癌症环境中的相关性提供了见解。我们对SHOC2、MRAS和PP1C中与疾病相关的rasopathy突变进行了结构定位,以及对特定SHOC2 GOF和LOF变体的结构-功能研究,为其功能建立了机制基础。也就是说,在全磷酸酶复合体中,蛋白-蛋白相互作用亲和力的调节分别转化为增强PPIs时途径激活的增强和减弱PPIs时途径激活的降低。总的来说,这些结果为RAS生物学的重要方面提供了分子见解,并为可能的治疗干预提供了资源。gydF4y2Ba
方法gydF4y2Ba
重组表达载体gydF4y2Ba
用于重组表达的载体是使用传统的克隆方法和定制的合成插入(Genewiz)制备的。gydF4y2Ba
重组蛋白生产gydF4y2Ba
MRAS,生物素化/ avii标记的MRAS和RAS亚型gydF4y2Ba
所有重组RAS亚型的表达和纯化基本相同。RAS向量(pET15b-6×His-HRV3C-MRAS(1-178))转化为BL21星(DE3)胜任gydF4y2Ba大肠杆菌gydF4y2Ba细胞(赛默飞世尔科学公司)接种到添加100 μg ml的结核肉汤中gydF4y2Ba−1gydF4y2Ba卡本西林在37°C过夜。将发酵剂稀释到装有1升TB肉汤的烧瓶中,并选择抗生素,在37°C下摇晃生长,直到光密度为600 nm (OD)gydF4y2Ba600gydF4y2Ba),大约1.0。温度降至17°C,冷却约45分钟,然后用0.5 mM终浓度IPTG诱导培养过夜(18小时),然后收集并快速冷冻细菌球。gydF4y2Ba
所有步骤都在4°C下进行。细菌球在裂解缓冲液(50 mM HEPES pH 7.5, 500 mM NaCl, 5 mM咪唑,1 mM TCEP, 1 mM MgCl)中解冻并重悬gydF4y2Ba2gydF4y2Ba)补充蛋白酶抑制剂片(Millipore Sigma, 11697498001, 1片/ 40 ml), DNase (10 μg mlgydF4y2Ba−1gydF4y2Ba),以及100毫米GTP或GDP。均匀再悬浮的裂解物在微流态器(microfluics M110L)中以约15,000 p.s.i的温度中断。在JLA 16.250转子(贝克曼)中以16000转/分澄清1小时。制备Ni-NTA树脂(Qiagen, 30450,每升表达1 ml树脂床)的预平衡柱(裂解缓冲液),澄清的裂解液分批结合1 - 2小时,然后用重力排水。用裂解缓冲液彻底清洗珠子,用30ml洗脱缓冲液(裂解缓冲液中添加400 mM咪唑)洗脱。洗脱蛋白用His HRV3C蛋白酶(自定义制备,1:50摩尔比)裂解过夜。通过液相色谱-质谱(LC-MS)确认解理,溶液通过另一个与裂解缓冲液预平衡的Ni-NTA柱,收集流经。在SEC Buffer (20 mM HEPES pH 7.5, 150 mM NaCl, 40 μM GDP, 5 mM MgCl)中,对流过液进行池化和浓缩,然后加载到Superdex 75 HiLoad 26/600尺寸排除柱(Cytiva)中gydF4y2Ba2gydF4y2Ba).用SDS-PAGE和LC-MS对洗脱蛋白进行评价,并在20 mg ml左右冷冻gydF4y2Ba−1gydF4y2Ba.gydF4y2Ba
avii标记版本通过RAS共同转化制备(pET15b-6×His-HRV3C-RAS-Avi;将MRAS 1-178、NRAS/KRAS 1-168)和BirA (pACYC184-BirA)按RAS表达方案转染BL21 star (DE3)感受质细胞,添加34 μg mlgydF4y2Ba−1gydF4y2Ba氯霉素对BirA培养基进行筛选。体外生物素化通过在细胞颗粒重悬浮过程中加入生物素(最终浓度为100 mM)和ATP(最终浓度为1 mM)进行,保留上述所有步骤。gydF4y2Ba
RAS核苷酸交换gydF4y2Ba
gppnhp结合的RAS异构体是通过将上述纯化的GTP结合版本与不可水解的GTP类似物交换而生成的。简单地说,将EDTA(终浓度25 mM)和24倍摩尔过量GppNHp (Jena Biosciences, 100 mM溶液,0.1 M Tris pH 8)加入0.5-1 μmol纯化的RAS中,得到终体积为2.5 ml,在室温下孵育1 h。PD-10尺寸排除重力柱(Cytiva)用核苷酸交换缓冲液(40 mM Tris pH 8,200 mM (NHgydF4y2Ba4gydF4y2Ba)gydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba, 0.1 mM ZnClgydF4y2Ba2gydF4y2Ba)根据制造商的说明。将RAS样品加载到色谱柱上,用3.5 ml核苷酸交换缓冲液洗脱。加入新鲜24倍的GppNHp,并加入50 μl虾碱性磷酸酶(rSAP, NEB, M0371S)。溶液在4°C下孵育1小时。用210 μl 1 M MgCl淬火gydF4y2Ba2gydF4y2Ba加入最终浓度为30 mM。然后用SEC缓冲液(20 mM HEPES pH 7.5, 150 mM NaCl, 10 μM GppNHp, 5 mM MgCl)稀释溶液gydF4y2Ba2gydF4y2Ba)至约10毫升,然后在Superdex 75 HiLoad 26/600排除尺寸柱上进行最终纯化。将纯组分混合,浓缩并冷冻在10-20 mg mlgydF4y2Ba−1gydF4y2Ba.gydF4y2Ba
SHOC2gydF4y2Ba
SHOC2和M173I点突变体制备方法相同。gydF4y2BaSHOC2gydF4y2Ba将载体pFastBac-10xHis-SHOC2转化为DH10α基因gydF4y2Ba大肠杆菌gydF4y2Ba根据bacto - bac杆状病毒表达系统(Gibco)分离细胞和bacmid DNA。根据用户指南将Bacmid DNA转染到SF9昆虫细胞培养物中,并如所述生产高滴度P2病毒原液。在SF21昆虫细胞培养中加入10 ml l进行蛋白表达gydF4y2Ba−1gydF4y2BaP2病毒溶液对对数相SF21细胞悬浮。3天后,收集细胞并快速冷冻。SF9和SF21细胞来源于表达系统,未进行支原体检测。gydF4y2Ba
所有纯化步骤均在4°C下进行。将冷冻细胞膏体解冻并重悬于裂解缓冲液(50 mM Tris pH 8, 300 mM NaCl, 10%甘油,20 mM咪唑,1 mM TCEP)中,补充蛋白酶片,2 mM MgClgydF4y2Ba2gydF4y2Ba200 μg mlgydF4y2Ba−1gydF4y2BaDNase。均匀重悬的细胞在微流态器中以15,000 p.i.的温度裂解两次。裂解液在JLA 16.250转子中以16000转/分澄清1小时。制备预平衡的Ni-NTA树脂柱(Qiagen, 30450,每升表达1 ml树脂床),澄清的裂解液分批结合1 - 2小时,然后用重力排水。用裂解液彻底清洗珠子,用30ml洗脱液(裂解液中加入300 mM咪唑)洗脱。洗脱蛋白用HRV3C蛋白酶(1:50摩尔比)裂解过夜,同时透析到透析缓冲液(50 mM Tris pH 8, 300 mM NaCl, 10%甘油,1 mM TCEP)。LC-MS确认裂解后,用稀释缓冲液将溶液稀释至50 mM NaCl (50 mM Tris pH 8, 10%甘油,1 mM TCEP),并使用样品泵应用于预平衡的5 ml HiTrap SP阳离子交换柱。蛋白质通过50 mM到1 M NaCl之间的20柱体积梯度洗脱,SDS-PAGE评估并池化。将样品浓缩至约12 ml,注入Superdex 75 HiLoad 26/600中,在SEC缓冲液(50 mM Tris pH 7, 150 mM NaCl, 1 mM TCEP)中进行最终SEC纯化。通过SDS-PAGE鉴定,混合、浓缩并在5-15 mg ml速冻gydF4y2Ba−1gydF4y2Ba.gydF4y2Ba
PP1CαgydF4y2Ba
PP1Cα(7-300)是根据先前发表的方案生产的gydF4y2Ba27gydF4y2Ba,gydF4y2Ba40gydF4y2Ba.简而言之,PP1Cα (pET15b-6×His-PP1Cα)与编码GroEL/GroES的pGRO7质粒共同转化(Takara Bio)。转化产物在100 μg ml的LB发酵剂中培养gydF4y2Ba−1gydF4y2Ba卡本西林34 μg mlgydF4y2Ba−1gydF4y2Ba氯霉素和1mmmnclgydF4y2Ba2gydF4y2Ba.用同样的补剂接种更大的1l培养物,并培养至ODgydF4y2Ba600gydF4y2Ba~ 0.5。此时,阿拉伯糖(2 g lgydF4y2Ba−1gydF4y2Ba最终浓度),以诱导伴侣产物的产生,培养直到ODgydF4y2Ba600gydF4y2Ba加入0.1 mM最终IPTG以诱导蛋白质生成(在10°C下过夜)。培养物独立离心收集颗粒,重悬于200 μg ml新鲜LB中gydF4y2Ba−1gydF4y2Ba氯霉素(防止进一步核糖体合成)和1mm MnClgydF4y2Ba2gydF4y2Ba.这些重悬液在10°C下摇晃2小时,以便在体内重新折叠,然后通过离心和速冻收集细胞颗粒。gydF4y2Ba
所有纯化步骤均在4°C下进行。将冷冻细胞膏体解冻并重悬于裂解缓冲液(25 mM Tris pH 7,700 mM NaCl, 5 mM咪唑,1 mM MnCl)中gydF4y2Ba2gydF4y2Ba, 0.1% Triton X-100)新鲜补充蛋白酶片。均匀重悬的细胞在微流态器中以15,000 p.i.的温度裂解两次。裂解液在JLA 16.250转子中以16000转/分澄清1小时。制备Ni-NTA树脂裂解缓冲预平衡柱(Qiagen, 30450,每升表达1 ml树脂床),澄清的裂解液分批结合1 - 2小时,然后用重力排水。用连续的PP1Cα缓冲液A (25 mM Tris pH 7,700 mM NaCl, 5 mM咪唑,1 mM MnCl)彻底清洗珠子gydF4y2Ba2gydF4y2Ba)和PP1Cα洗涤缓冲液(25 mM Tris pH 7,700 mM NaCl, 15 mM咪唑,1 mM MnClgydF4y2Ba2gydF4y2Ba),用15 ml洗脱缓冲液(25 mM Tris pH 7, 700 mM NaCl, 250 mM咪唑,1 mM MnClgydF4y2Ba2gydF4y2Ba).洗脱液直接应用于预平衡的Superdex 75 HiLoad 26/600,在PP1Cα缓冲液a中进行初始纯化。通过SDS-PAGE对PP1Cα进行评估,并将His-TEV蛋白酶添加到裂解纯化标签(1:20摩尔比,自制)中过夜。在这一步中我们持续观察到沉淀,这并不妨碍我们获得纯净的最终产品。通过LC-MS确认裂解溶液,然后将其应用到新的缓冲a平衡的Ni-NTA柱上,从中收集流经。将流过液浓缩至15ml,再次注入预平衡的Superdex 75 HiLoad 26/600中,最终纯化到SEC缓冲液(50 mM Bis-Tris pH 6.5, 500 mM NaCl, 1 mM TCEP)或直接纯化到SPR运行缓冲液(20 mM Bis-Tris pH 6.5, 200 mM NaCl, 2.5%甘油,1 mM TCEP, 0.5 mM MgCl中gydF4y2Ba2gydF4y2Ba, 5 μM GppNHp, 0.005%吐温-20)。这些组分被汇集、浓缩并用于下游结合研究和三元络合物的形成。gydF4y2Ba
cRaf1 RBD带和不带n端His标签gydF4y2Ba
的gydF4y2Ba大肠杆菌gydF4y2Ba本研究中使用的表达结构基于pET系统,并使用标准的分子克隆技术生成。编码cRAF RBD(全长蛋白的51-131氨基酸)的DNA在可切割的n端六氨基组氨酸标记后插入。该插入物由GeneArt(赛默飞世尔科学公司)对密码子进行优化和合成。最终的表达结构通过Sanger测序进行验证。gydF4y2Ba
两升培养基接种预培养gydF4y2Ba大肠杆菌gydF4y2Ba用表达质粒新鲜转化BL21(DE3),用1 mM IPTG (Sigma-Aldrich)在18℃诱导蛋白表达16 h。gydF4y2Ba
通过离心收集细菌细胞,并将颗粒冷冻在干冰上。然后将细胞球重新悬浮在缓冲液A (50 mM HEPES, 300 mM NaCl, 20 mM咪唑,1 mM TCEP, pH 7.8)中,补充Turbonuclease (Merck)和完全蛋白酶抑制剂片(Roche)。细胞在约1000bar的均质器(Avestin)中经过三次裂解,裂解液在40000下离心澄清gydF4y2BaggydF4y2Ba40分钟。gydF4y2Ba
裂解物装载到HiFliQ 5 ml Ni Advance色谱柱(ProteinArk)上,安装在ÄKTA Pure 25色谱系统(Cytiva)上。用缓冲液A洗去污染蛋白,结合蛋白以线性梯度洗脱到缓冲液B(缓冲液A添加400 mM咪唑)。gydF4y2Ba
不含n -末端His标记的结构物通过HRV 3C蛋白酶在对缓冲液a透析过夜时裂解而获得。蛋白溶液重新装载到Ni Advance色谱柱上,收集含有目标蛋白的流动物。gydF4y2Ba
然后在HiLoad 26/600 Superdex 75 pg的色谱柱(Cytiva)上进一步纯化标记蛋白,并预先平衡存储缓冲液(50 mM HEPES, 300 mM NaCl, 1 mM TCEP, 10%甘油,pH 7.4)。gydF4y2Ba
采用反相高效液相色谱法测定了蛋白的纯度和浓度,并采用LC-MS对其进行了鉴别。gydF4y2Ba
SPR结合研究gydF4y2Ba
二元MRAS-SHOC2和三元配合物SPRgydF4y2Ba
三元配合物结合研究在Biacore 8K SPR仪(Cytiva)上进行,在25°C下使用改性缓冲液进行PP1Cα稳定性(20 mM Bis-Tris pH 6.5, 200 mM NaCl, 2.5%甘油,0.5 mM MgClgydF4y2Ba2gydF4y2Ba, 1 mM TCEP, 5 μM GppNHp或GTP, 0.005%吐温-20)。生物素化的MRAS-avi、NRAS-avi、KRAS-avi或SHOC2-avi蛋白以5 μl min的流速固定在SA系列链霉亲和素芯片上gydF4y2Ba−1gydF4y2Ba表面密度达到500ru。采用平行动力学方法,在20 μl min流速下,结合时间90 s、解离时间600 s,同时测定7点剂量-反应曲线gydF4y2Ba−1gydF4y2Ba.没有观察到PP1Cα与MRAS或SHOC2独立相互作用,并保持在恒定的过量分析物剂量-反应曲线。使用Biacore评估软件对数据进行稳态亲和分析。gydF4y2Ba
MRAS核苷酸负载状态结合实验(扩展数据图。gydF4y2Ba1gydF4y2Ba)在Biacore T200 SPR仪(Cytiva)上进行,温度为25°C,使用标准运行缓冲液(20 mM HEPES pH 7.5, 150 mM NaCl, 0.5 mM MgClgydF4y2Ba2gydF4y2Ba, 1 mM TCEP, 5 μM GppNHp或GDP, 0.005%吐温20)。生物素化MRAS (500 RU)固定在系列S SA芯片上。在60 s的结合时间和1200 s的分离时间下进行多循环运行。gydF4y2Ba
二进制RAS-RBD SPRgydF4y2Ba
在25°C下,在Biacore 8K SPR仪器(Cytiva)上进行了结合研究。将生物素化WT和突变体MRAS-avi蛋白稀释至0.04 μg mlgydF4y2Ba−1gydF4y2Ba在实验缓冲液中(50 mM HEPES pH 7.5, 150 mM NaCl, 1 mM MgClgydF4y2Ba2gydF4y2Ba, 10 μM GppNHp, 0.1% Tween-20),以5 μl min的流速固定在SA链霉亲和素芯片上gydF4y2Ba−1gydF4y2Ba表面密度约为100 RUs。Raf1 RBD(残基51 ~ 131)以50 μl min的流速连续多次注入,注入量为4 μMgydF4y2Ba−1gydF4y2Ba对所有流细胞有90秒的结合和100秒的分离时间。数据使用Biacore评价软件进行分析,采用1:1结合模型。gydF4y2Ba
沉降速度分析超离心gydF4y2Ba
在Beckman-Coulter Optima AUC分析超离心机上进行了沉降速度实验。样品被透析到分析超离心缓冲液(20mm Bis-Tris pH 6.5, 500 mM NaCl, 0.5 mM MgClgydF4y2Ba2gydF4y2Ba, 1 mM TCEP, 5 μM GppNHp),装入配有1.2 cm中心件和蓝宝石窗的双扇区离心室。细胞被装入一台an -50 Ti转子中,在以42,000 rpm的速度开始高速沉降之前,将细胞平衡到20°C 2小时。在280 nm处收集数据,并使用gydF4y2BacgydF4y2Ba(gydF4y2Ba年代gydF4y2Ba)分析gydF4y2Ba41gydF4y2Ba(SEDFIT v.5.01b)。结果的形式gydF4y2BacgydF4y2Ba(gydF4y2Ba年代gydF4y2Ba)图用Gussi可视化gydF4y2Ba42gydF4y2Ba.gydF4y2Ba
半准备SEC和MRAS/KRAS竞赛gydF4y2Ba
三元配合物形成并在Superdex 200 10/300 GL色谱柱(Cytiva)上使用SEC进行评估。MRAS(1-178) -GppNHp、SHOC2(M173I, 80-582)和PP1Cα(7-300)在30-50 μM的终浓度下同时合成~500 μl的反应。为了避免SHOC2或PP1Cα单体(它们不能从三元配合物中完全分离),MRAS使用1.2倍摩尔比。10分钟后,用SEC缓冲液(20 mM HEPES pH 7.5, 150 mM NaCl, 1 mM MgCl)对混合物进行透析gydF4y2Ba2gydF4y2Ba, 1 mM TCEP)在4°C下放置2-4小时。将透析液应用于Superdex 200 10/300色谱柱,观察到一个强三元配合物(和弱单体RAS)峰。通过SDS-PAGE对三元配合物进行鉴定,并将其浓缩至~6.5 mg mlgydF4y2Ba−1gydF4y2Ba用于结晶试验。gydF4y2Ba
在MRAS和KRAS的竞争SEC实验中,SHOC2、PP1Cα、MRAS(1-178)和KRAS(1-169)以1:1:1.2:1.2摩尔比组合。为了避免添加顺序的问题,MRAS-GppNHp和KRAS-GppNHp首先结合在一起,然后再加入到SHOC2(M173I, 80-582)和PP1Cα(7-300)的混合物中。在4°C孵育约2小时后,将混合物应用于Superdex 200 10/300 GL色谱柱(Cytiva),该色谱柱已与SEC缓冲液(20 mM HEPES pH 7.5, 150 mM NaCl, 1 mM MgCl)平衡gydF4y2Ba2gydF4y2Ba, 1 mM TCEP, 5 μ M GppNHp)。以同样的方法制备了SHOC2-KRAS-PP1Cα三元配合物,但不含MRAS。通过SDS-PAGE和考马斯色染色分析洗脱谱上的部分。gydF4y2Ba
结晶gydF4y2Ba
采用静滴蒸汽扩散法将SHOC2(80-582)载波和SHOC2(80-582)与MRAS(1-178)和PP1Cα(7-300)配合物结晶。ApoSHOC2用1:1体积的蛋白质和孔溶液(0.1 M Tris-Cl, pH 8.0, 0.2 M MgCl)结晶gydF4y2Ba2gydF4y2Ba, 11% PEG 4000, 2.5% 1,5-二氨基戊烷)。在结晶液中加入20%的甘油进行冷冻保护,然后直接在液氮中快速冷冻。三元配合物使用1:1体积的蛋白质和良好的溶液(0.1 M NaH)共结晶gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2BapH 6.5, 12% PEG 8000)。在结晶液中加入20%的甘油进行冷冻保护,然后直接在液氮中快速冷冻。gydF4y2Ba
结构测定gydF4y2Ba
apoSHOC2和三元配合物的衍射数据都是在阿贡国家实验室先进光子源的Dectris Pilatus 6M探测器的光束线17ID (IMCA-CAT)上收集的。数据从一个保持在100 K的单晶中测量,暴露在波长为1 Å的环境中,并用XDS对反射进行索引、集成和缩放gydF4y2Ba35gydF4y2Ba.apoSHOC2的空间基团为C121,不对称单元为2个分子。用相位仪进行分子置换,确定了结构gydF4y2Ba43gydF4y2Ba,使用gydF4y2Ba钩端螺旋体interrogansgydF4y2BaLRR蛋白LIC12234 (PDB:gydF4y2Ba4 tzhgydF4y2Ba)作为搜寻模式。最终的模型是在白骨顶分子图形应用程序中建立的gydF4y2Ba44gydF4y2Ba并在Phenix中进行了改进gydF4y2Ba45gydF4y2Ba.三元配合物的空间群为P1211,不对称单元中有两个配合物。采用分子置换法测定蛋白磷酸酶1 (PP1) T320E突变体(PDB:gydF4y2Ba6 zk6gydF4y2Ba), MRAS与GppNHp (PDB:gydF4y2Ba1 x1gydF4y2Ba)和载波SHOC2作为去除所有溶剂分子的搜索模型。最终的模型是在白骨顶分子图形应用程序中建立的,并使用Buster进行改进gydF4y2Ba46gydF4y2Ba和凤凰。最终模型的几何形状在可接受的范围内(扩展数据表gydF4y2Ba1gydF4y2Ba), Ramchandran禁用区残留0.05%。数据收集和细化统计信息显示在gydF4y2Ba补充表1gydF4y2Ba.gydF4y2Ba
分子动力学模拟与建模gydF4y2Ba
分子动力学模拟gydF4y2Ba
建模工作的起始结构是gppnhp结合的MRAS(Q71R)、SHOC2(M173I)和PP1Cα与Mn、磷酸离子在PP1Cα活性位点上的三元配合物。除去其他辅助因子,保留高占用率的晶体水用于薛定谔的后续处理gydF4y2Ba47gydF4y2Ba通过蛋白质制备的特点,然后手动管理旋转和质子化状态的一致性的氢键网络。游离端用中性ACE残基和NME残基覆盖。为了模拟MRAS和SHOC2的WT状态,将MRAS第71位和SHOC2第173位的残基突变回相应的WT对应物。对于三元配合物的突变体和WT版本,使用3D-RISM放置补充水gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba.使用AMBER ff19SB蛋白力场对蛋白质进行建模gydF4y2Ba50gydF4y2Ba, GppNHp通过parm@Frosst力场参数化gydF4y2Ba51gydF4y2Ba水被模拟为TIP3PgydF4y2Ba52gydF4y2Ba.gydF4y2Ba
分子动力学模拟使用AMBER 16进行gydF4y2Ba53gydF4y2Ba和PMEMD CUDAgydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba从突变体和WT(建模)结构开始。每个系统首先最小化(保持溶质分子固定),从10,000步最陡的下降开始,然后使用等体积周期边界进行10,000步共轭梯度最小化。使用朗之万动力学在2500步(5秒)中将系统加热到100 KgydF4y2Ba57gydF4y2Ba体积恒定。在恒定压力下,系统在100 ps的时间内从100 K加热到303 K,使用2 fs的时间步长。最小化和加热步骤使用固定的溶质分子,使用力常数为5.0千卡摩尔gydF4y2Ba−1gydF4y2Ba一个gydF4y2Ba2gydF4y2Ba.接下来,系统在303 K下运行100 ps,其中所有Cα原子,GppNHp, Mg, Mn,磷酸盐离子都受到10.0 kcal mol的力常数的约束gydF4y2Ba−1gydF4y2Ba一个gydF4y2Ba2gydF4y2Ba.在恒定的压力和温度(NPT)下进行三次1µs的最终生产运行。gydF4y2Ba
聚类模拟数据gydF4y2Ba
从每个轨迹中删除前1000帧(50 ns),以最大限度地减少分析中不充分平衡的帧。剩下的19,000帧分别来自三个轨迹重复,并使用CPPTRAJ进行聚类gydF4y2Ba58gydF4y2Ba基于SHOC2和MRAS之间关于MRAS残基71和SHOC2残基173的界面残基。集群是使用gydF4y2BakgydF4y2Ba-means算法和最优聚类数,gydF4y2BangydF4y2Ba= 6,采用肘关节法测定。使用CPPTRAJ生成每个复制的平均结构,并为每个集群提取代表,作为WT和突变体模拟的关键构象示例。使用CPPTRAJ脚本和getcontacts软件包组合进行蛋白质-蛋白质和蛋白质-水相互作用的分析gydF4y2Ba59gydF4y2Ba.gydF4y2Ba
TR-FRET试验评估Ras/cRaf1-RBD结合的竞争性gydF4y2Ba
建立了一个TR-FRET分析小组,对不同Ras结构(NRAS结构为氨基酸1-168,MRAS结构为氨基酸1-178)与cRaf1 RBD(氨基酸51-131,RBD)的相互作用进行评分。实验的最终浓度为25 nM c -末端avid标记和生物素化RAS, 6.25 nM cy5 -链霉亲和素(VWR), 50 nM RBD和1 nM anti-6×His Europium (LANCE Eu-W1024 Anti-6×His, Perkin Elmer)在实验缓冲液(50 mM Tris pH 7.5, 100 mM NaCl, 1 mM MgCl)中gydF4y2Ba2gydF4y2Ba, 50 μM GppNHp, 0.5 mM DTT, 0.005% Tween-20)。gydF4y2Ba
将RAS构建物与2.2倍终浓度的Cy5-streptavidin (VWR)在测定缓冲液中预孵育30分钟。同时,His-RBD(51-131)与anti-6×His Europium以2.2倍终浓度预孵育30 min。在RAS/ cy5 -链霉亲和素混合物中加入两倍连续稀释的未标记蛋白竞争对手,孵育30分钟,然后加入RBD/anti-His Europium混合物。gydF4y2Ba
在室温下再孵育1小时后,在PHERAstar FSX平板阅读器(BMG Labtech)上测量平板,激发波长为320 nm,发射波长为620 nm和665 nm。TR-FRET比值通过665 nm计数除以620 nm计数再乘以100来计算。数据归一化为活动百分比,并在GraphPad Prism (v.9.2.0, GraphPad;gydF4y2Bawww.graphpad.comgydF4y2Ba).使用非线性回归方程拟合曲线,log[抑制剂]与响应,变量斜率(四个参数),将下平台固定为0。gydF4y2Ba
M2H化验gydF4y2Ba
纳米荧光素酶报告细胞系(HEK293A-M2H-NLuc,支原体污染检测阴性)是通过自定义载体(pNGX_LV_017_GAL4_NLuc)慢病毒转导产生的,该载体在最小启动子上游和纳米荧光素酶开放阅读框(ORF)上含有5× GAL4基序。将GAL4-DBD或VP16-TAD orf克隆到定制的慢病毒载体(命名为pXP1510和pXP1512)gydF4y2BaEF1agydF4y2Ba启动子,并在ccdb盒两侧的IIS型酶,使金门克隆gydF4y2BaSHOC2gydF4y2Ba或gydF4y2BamragydF4y2BacDNA(通过基因合成获得)。突变体通过定点诱变(Agilent QuickChange Lightning试剂盒)获得。HEK293A-M2H-Nluc细胞在DMEM (Gibco)中添加10% FBS (Gibco)。细胞按1.25 × 10镀膜gydF4y2Ba4gydF4y2Ba第二天,用X-tremeGENE 9 (Roche)以1:3的比例(DNA:转染试剂)将GAL4-MRAS和VP16-SHOC2组合物转染。转染72 h后加入Nano-Glo细胞试剂(Promega),使用Synergy HT reader (BioTek)测量发光。图中所示的图形。gydF4y2Ba3 cgydF4y2Ba说明使用Biorender生成M2H测定的设置(gydF4y2Bawww.biorender.comgydF4y2Ba).gydF4y2Ba
SHOC2-eGFP流式细胞术及成像gydF4y2Ba
所有SHOC2-eGFP实验均在DMEM (Gibco)中添加10% FBS (Gibco)的HEK293T细胞中进行,证实支原体污染阴性。SHOC2-eGFP-chy-mCherry结构物自定义合成(Vectorbuilder);双电子SHOC2-eGFP-chy-mCherry卡带通过a表达gydF4y2BahPGK1gydF4y2Ba启动子,以及在SHOC2-eGFP和mCherry之间的自裂解chysel (chy)肽序列使两者蛋白的1:1表达,并能够在eGFP/mCherry比值测量的基础上监测SHOC2-eGFP的周转gydF4y2Ba60gydF4y2Ba使用流式细胞仪或成像技术进行SHOC2定位研究。对于这两种方法,16000个HEK293T细胞在播种后1天使用FuGene6 (Promega)标准方案以96孔格式转染120ng质粒。转染48 h后,从96孔标准组织培养板制备细胞进行流式细胞术,数据采用CytoFLEX S仪(Beckman Coulter)采集,并使用FlowJo v.10.7.1软件进行分析。在96孔细胞培养处理过的黑壁室(Ibidi)中,使用InCell分析仪6500 (GE Healthcare)进行了SHOC2定位成像研究,使用尼康40×/0.95 Plan Apo, Corr Collar 0.11-0.23, CFI/60 lambda目标和以下条件和滤波器组(绿色:Exc 488/10, Emi 524/48, 0.2 s曝光,2 × 2 binning;橙色:Exc 561/1, Emi 605/51, 0.2 s曝光,2 × 2装箱)。gydF4y2Ba
MiaPaca2细胞系的产生gydF4y2Ba
所有MiaPaca2细胞系在添加10% FCS (Bioconcept)、1%丙酮酸钠(Bioconcept)和1%谷氨酰胺(Bioconcept)的DMEM (Gibco)中培养。MiaPaca22gydF4y2BaSHOC2gydF4y2Ba在稳定表达的MiaPaca2细胞中生成-KO细胞gydF4y2BaCas9gydF4y2Ba(MiaPaca2gydF4y2BaCas9gydF4y2Ba)由表达sp的自定义载体慢病毒转导产生gydF4y2BaCas9gydF4y2Ba下一个gydF4y2BaEF1AgydF4y2Ba启动子(名为pNGX_LV_c028)。MiaPaca2支原体污染检测呈阴性。总之,3万个MiaPaca2 CAS9细胞被播种在6孔板中,第二天,根据制造商的说明书,使用6µl Dharmafect (Dharmacon)转染2µM SHOC2 sgRNA (5 ' -TAGTTATACGATTAAAGCGA-3 '(18))。转染后6天,从转染池中制备细胞进行克隆选择。用抗SHOC2抗体(Cell Signaling Technology, 53600)通过western blotting筛选克隆的SHOC2水平,并通过测序验证成功的KO克隆,其中一个已验证gydF4y2BaSHOC2 -gydF4y2BaKO克隆(MiaPaca2gydF4y2BaSHOC2 -gydF4y2BaKO)随后用于各种SHOC2突变体的慢病毒转导重表达。对于慢病毒生产,HEK293FT细胞在T175细胞培养瓶中接种,并用12µg ppr - gag - pol、4.8µg pMD2-VSV-G和1µg定制的表达各种SHOC2突变体(pXP1510-SHOC2突变体)的慢病毒载体pXP1510转染,使用Mirus TransIT (Mirus, MIR2700)。收集含病毒的上清液,48小时后使用0.45 μ m注射器过滤器过滤,随后用于MiaPaCa-2gydF4y2BaSHOC2gydF4y2Bako转导。感染24 h后,用新霉素(1mg mlgydF4y2Ba−1gydF4y2Ba,赛默飞世尔科学公司,10131027)。gydF4y2Ba
西方墨点法gydF4y2Ba
全细胞裂解物在RIPA缓冲液(Thermo Fisher Scientific, 89901)中制备,补充蛋白酶和磷酸酶抑制剂鸡尾酒(Sigma-Aldrich, PPC1010),并使用BCA蛋白测定试剂盒(Thermo Fisher Scientific, 23225)进行定量。样品被装载在4-12%的Bis-Tris凝胶(Invitrogen, WG1403A)上,并使用Trans-Blot Turbo系统(Bio-Rad, 1704150)转移到硝化纤维膜(Bio-Rad, 1704159)上。用5%牛血清白蛋白(Sigma-Aldrich, A2153-100G)阻断所有膜,并与一抗孵育过夜。使用FUSION FX7成像系统(Vilber)对免疫印迹进行成像,并使用其集成定量软件进行密度分析。gydF4y2Ba
依赖关系图数据分析gydF4y2Ba
我们使用Bioconductor上提供的DepMap包(v.1.8)和实验中心包(v.2.2)来访问Broad研究所DepMap癌症依赖性研究的数据集gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba.使用了2021年第四季度发布的数据集,具体来说,CRISPR-Cas9基因KO筛查量化了1052个癌细胞系的遗传依赖性(数据集ID EH7290在实验中心)。使用了包中与元数据和突变调用相关的其他可用数据集(实验集线器id分别为EH7294和EH7293)。细胞系中基因的依赖得分是主要的兴趣特征。这可以解释为特定基因对特定癌细胞系的重要性。例如,高度负的依赖得分来自基因KO后癌细胞种群的巨大负对数转换折叠变化,这意味着给定的细胞系高度依赖该基因。gydF4y2Ba
考察打倒a之间的关系gydF4y2Ba拉gydF4y2Ba基因和gydF4y2BaSHOC2gydF4y2Ba,我们使用统计库核心R包计算依赖关系分数的Pearson相关性gydF4y2Ba63gydF4y2Ba.具体来说,我们计算了依赖得分之间的Pearson相关gydF4y2BaSHOC2gydF4y2Ba以及每个人的依赖得分gydF4y2Ba拉gydF4y2Ba基因(gydF4y2BamragydF4y2Ba,gydF4y2Ba喀斯特gydF4y2Ba,gydF4y2Ba国家管制当局方面gydF4y2Ba,gydF4y2Ba极品gydF4y2Ba)在每组包含感兴趣突变的细胞系(p.G12-, p.G13-, p.Q61-, other, WT)中进行。我们没有区分氨基酸变成了什么,例如p.G12C, p.G12V)。这使我们能够研究每个突变组中两个基因的线性关系。评估各组间相关性的显著性。一个gydF4y2BaPgydF4y2Ba的值。gydF4y2BatgydF4y2Ba计算每个相关的-检验(检验总体相关显著大于0的替代假设)。所有分析均使用R v.4.1.1进行。gydF4y2Ba
重组BRAF去磷酸化试验gydF4y2Ba
如前所述,制备纯化的自抑制和活性BRAF-MEK1-14-3-3复合物gydF4y2Ba4gydF4y2Ba.BRAF复合物(浓度为500 nM BRAF)与WT或突变体MRAS-SHOC2-PP1Cα复合物、KRAS-SHOC2-PP1Cα复合物、PP1Cα单独或lambda磷酸酶在30°C下,在含有100 mM HEPES (pH 7.4)、150 mM NaCl、2mm MnCl、1 mM TCEP和0.02% Brij 35的缓冲液中孵卵90分钟。用蛋白印迹法分析反应产物,抗体为Ser365位点磷酸化(Cell Signaling Technology, 9421S)或Ser729位点磷酸化(Abcam, ab124794)的BRAF特异性抗体。每个反应的等分在考马斯染SDS-PAGE凝胶上进行分析,以提供BRAF配合物的负载控制。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
支持本研究结果的数据可根据合理要求从相应作者处获得。结构因素和坐标已根据登录代码存入PDBgydF4y2Ba7双柄陶制大酒杯gydF4y2Ba对于SHOC2(80-582)载波结构和gydF4y2Ba7 txhgydF4y2Ba对于SHOC2(M173I, 80-582) -MRAS (Q71R, 1-178) -PP1Cα(7-300)三元配合物结构。gydF4y2Ba
参考文献gydF4y2Ba
Simanshu, D. K., Nissley, D. V. & McCormick, F.人类疾病中的RAS蛋白及其调控因子。gydF4y2Ba细胞gydF4y2Ba170gydF4y2Ba, 17-33(2017)。gydF4y2Ba
Hobbs, G. A., Der, C. J. & Rossman, K. L. RAS亚型与癌症突变一瞥。gydF4y2Ba细胞科学。gydF4y2Ba129gydF4y2Ba1287-1292(2016)。gydF4y2Ba
Lavoie, H. & Therrien, M. RAF蛋白激酶在ERK信号的调节。gydF4y2Ba细胞生物学。gydF4y2Ba16gydF4y2Ba, 281-298(2015)。gydF4y2Ba
Park, E.等人。自抑制和活性BRAF-MEK1-14-3-3复合物的结构。gydF4y2Ba自然gydF4y2Ba575gydF4y2Ba, 545-550(2019)。gydF4y2Ba
Rodriguez-Viciana, P.等人。由Shoc2/Sur8和PP1催化亚基组成的磷酸酶全酶作为M-Ras效应子调节Raf活性。gydF4y2Ba摩尔。细胞gydF4y2Ba22gydF4y2Ba, 217-230(2006)。gydF4y2Ba
杨,L. C.等。SHOC2-MRAS-PP1复合物正调控RAF活性并参与努南综合征的发病机制。gydF4y2Ba国家科学院学报美国gydF4y2Ba115gydF4y2Ba, e10576(2018)。gydF4y2Ba
铃木,H.等。与种系Q71R MRAS变体相关的严重努南综合征表型:各种癌症中RAS同源物的复发性替代。gydF4y2Ba点。J.医学热内。一个gydF4y2Ba179gydF4y2Ba, 1628-1630(2019)。gydF4y2Ba
汉尼格,V.等。rasopathy中的一种新的SHOC2变体。gydF4y2Ba嗡嗡声。Mutat。gydF4y2Ba35gydF4y2Ba, 1290-1294(2014)。gydF4y2Ba
格里普,K. W.等。一种由PPP1CB中反复出现的新生错义突变引起的新型rasopathy与伴有松散毛发的努南综合征非常相似。gydF4y2Ba点。J.医学热内。一个gydF4y2Ba170gydF4y2Ba, 2237-2247(2016)。gydF4y2Ba
Cordeddu, V.等人。SHOC2突变促进异常蛋白gydF4y2BaNgydF4y2Ba-肉豆蔻酰化,导致noonan样综合征,毛发疏松。gydF4y2BaNat,麝猫。gydF4y2Ba41gydF4y2Ba, 1022-1026(2009)。gydF4y2Ba
小林,T.等人。RAF1在努南综合征及相关疾病中的分子和临床分析:丝氨酸259去磷酸化是突变体激活的基本机制。gydF4y2Ba嗡嗡声。Mutat。gydF4y2Ba31gydF4y2Ba, 284-294(2010)。gydF4y2Ba
Kwon Jason, J. & Hahn William, C.富含亮氨酸的重复蛋白提供了RAS电路中的SHOC2:结构功能视角。gydF4y2Ba摩尔。细胞。医学杂志。gydF4y2Ba41gydF4y2Ba, e00627-20(2021)。gydF4y2Ba
莫塔等人。一种与产前肥厚性心肌病相关的新型ras病引起的SHOC2突变的临床和功能特征。gydF4y2Ba嗡嗡声。Mutat。gydF4y2Ba40gydF4y2Ba, 1046-1056(2019)。gydF4y2Ba
Ma, L.等人。PPP1CB基因的新生错义变异与智力残疾和先天性心脏病有关。gydF4y2Ba嗡嗡声。麝猫。gydF4y2Ba135gydF4y2Ba, 1399-1409(2016)。gydF4y2Ba
王,T.等。基因本质分析揭示了基因网络和与致癌Ras的合成致命相互作用。gydF4y2Ba细胞gydF4y2Ba168gydF4y2Ba, 890-903(2017)。gydF4y2Ba
Behan, F. M.等人。利用CRISPR-Cas9筛选癌症治疗靶点的优先排序。gydF4y2Ba自然gydF4y2Ba568gydF4y2Ba, 511-516(2019)。gydF4y2Ba
琼斯,G. G.等。SHOC2磷酸酶依赖性RAF二聚体介导ras突变癌症对MEK抑制的抗性。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 2532(2019)。gydF4y2Ba
Sulahian, R.等人。ras驱动癌症中SHOC2耗尽与MEK抑制的合成致命相互作用gydF4y2Ba细胞的代表。gydF4y2Ba29gydF4y2Ba, 118-134(2019)。gydF4y2Ba
Riller, Q. & Rieux-Laucat, F. RASopathies:从生殖系突变到体细胞和多基因疾病。gydF4y2Ba生物医学。J。gydF4y2Ba44gydF4y2Ba, 422-432(2021)。gydF4y2Ba
Sieburth, d.s., Sun, Q. & Han, M. SUR-8,一种具有富亮氨酸重复序列的保守ras结合蛋白,正向调控ras介导的信号通路gydF4y2Ba秀丽隐杆线虫gydF4y2Ba.gydF4y2Ba细胞gydF4y2Ba94gydF4y2Ba, 119-130(1998)。gydF4y2Ba
李伟,韩敏,关克良。富含亮氨酸的重复蛋白ur -8可增强MAP激酶的活化,并与Ras和Raf形成复合物。gydF4y2BaDev的基因。gydF4y2Ba14gydF4y2Ba, 895-900(2000)。gydF4y2Ba
Ye, M.等。M-Ras的晶体结构揭示了Ras家族小GTPases的gtp结合“off”态构象。gydF4y2Ba生物。化学。gydF4y2Ba280gydF4y2Ba, 31267-31275(2005)。gydF4y2Ba
奥康奈尔等人。核NIPP1底物特异性的分子基础:PP1全酶。gydF4y2Ba结构gydF4y2Ba20.gydF4y2Ba, 1746-1756(2012)。gydF4y2Ba
Bollen等人。扩展的PP1工具包:旨在创建专一性。gydF4y2Ba学生物化学的发展趋势。科学。gydF4y2Ba35gydF4y2Ba, 450-458(2010)。gydF4y2Ba
Jumper, J.等。高度准确的蛋白质结构预测AlphaFold。gydF4y2Ba自然gydF4y2Ba596gydF4y2Ba, 583-589(2021)。gydF4y2Ba
约翰逊,c.w.等人。小的gtpase K-Ras, N-Ras和H-Ras具有由变构效应决定的独特生化性质。gydF4y2Ba生物。化学。gydF4y2Ba292gydF4y2Ba, 12981-12993(2017)。gydF4y2Ba
Choy, m.s.等。通过了解PNUTS对视网膜母细胞瘤蛋白去磷酸化的拮抗作用,可以深入了解PP1调控代码。gydF4y2Ba国家科学院学报美国gydF4y2Ba111gydF4y2Ba, 4097-4102(2014)。gydF4y2Ba
萨尔维,F.等。目的探讨蛋白磷酸酶-1 c端磷酸化抑制蛋白磷酸酶-1的机制。gydF4y2BaChemBioChemgydF4y2Ba22gydF4y2Ba, 834-838(2021)。gydF4y2Ba
Peti, W., Nairn, a.c . & Page, R.蛋白磷酸酶1调控的结构基础和特异性。gydF4y2Ba2月J。gydF4y2Ba280gydF4y2Ba, 596-611(2013)。gydF4y2Ba
拉古萨,M. J.等。亲旋素通过阻断底物结合位点来指导蛋白磷酸酶1的特异性。gydF4y2BaNat。结构。摩尔。杂志。gydF4y2Ba17gydF4y2Ba, 459-464(2010)。gydF4y2Ba
Choy, m.s.等。SDS22选择性地识别和捕获缺乏金属活性的PP1。gydF4y2Ba国家科学院学报美国gydF4y2Ba116gydF4y2Ba, 20472(2019)。gydF4y2Ba
曹晓霞,李丽娟,李志强,等。蛋白质磷酸酶1的生命过程调控研究。gydF4y2Ba2月J。gydF4y2Ba289gydF4y2Ba, 3072-3085(2021)。gydF4y2Ba
Fedoryshchak, R. O.等。Phactr1/PP1磷酸酶全酶底物特异性的分子基础。gydF4y2BaeLifegydF4y2Ba9gydF4y2Ba, e61509(2020)。gydF4y2Ba
莫塔等人。激活MRAS突变可引起与肥厚性心肌病相关的努南综合征。gydF4y2Ba嗡嗡声。摩尔,麝猫。gydF4y2Ba29gydF4y2Ba1772-1783(2020)。gydF4y2Ba
Kabsch, W. Xds。gydF4y2BaActa Crystallogr。DgydF4y2Ba66gydF4y2Ba, 125-132(2010)。gydF4y2Ba
塞尔福斯,L. M.等。gydF4y2Basoc-2gydF4y2Ba编码一种与成纤维细胞生长因子受体信号有关的富含亮氨酸的重复蛋白。gydF4y2Ba国家科学院学报美国gydF4y2Ba95gydF4y2Ba, 6903-6908(1998)。gydF4y2Ba
德沃,D. L., Horvitz, H. R. & Stern, M. J. FGF受体信号通路是生殖成肌细胞正常细胞迁移所必需的gydF4y2Ba秀丽隐杆线虫gydF4y2Ba雌雄同体。gydF4y2Ba细胞gydF4y2Ba83gydF4y2Ba, 611-620(1995)。gydF4y2Ba
Bonsor, d.a.等人。SHOC2-MRAS-PP1C复合物的结构为RAF激活和努南综合征提供了见解。预印在gydF4y2BabioRxivgydF4y2Bahttps://doi.org/10.1101/2022.05.10.491335gydF4y2Ba(2022)。gydF4y2Ba
Nunez Rodriguez, N.等人。R-Ras3/M-Ras缺失小鼠的特征揭示了其在营养因子信号通路中的潜在作用。gydF4y2Ba摩尔。细胞。医学杂志。gydF4y2Ba26gydF4y2Ba, 7145-7154(2006)。gydF4y2Ba
Choy, m.s.等。PP1:互变菌素复合物揭示了开发PP1特异性抑制剂的途径。gydF4y2Baj。化学。Soc。gydF4y2Ba139gydF4y2Ba, 17703-17706(2017)。gydF4y2Ba
Lebowitz, J., Lewis, M. S. & Schuck, P.蛋白质科学中的现代分析超离心:教程回顾。gydF4y2Ba蛋白质科学。gydF4y2Ba11gydF4y2Ba, 2067-2079(2002)。gydF4y2Ba
分析超离心数据的计算和出版质量插图。gydF4y2BaEnzymol方法。gydF4y2Ba562gydF4y2Ba, 109-133(2015)。gydF4y2Ba
麦考伊,A. J.等人。相位晶体学软件。gydF4y2Baj:。Crystallogr。gydF4y2Ba40gydF4y2Ba, 658-674(2007)。gydF4y2Ba
埃姆斯利等人。白骨顶的特征与发展。gydF4y2BaActa Crystallogr。DgydF4y2Ba66gydF4y2Ba, 486-501(2010)。gydF4y2Ba
Liebschner, D.等人。使用x射线、中子和电子测定大分子结构:Phenix的最新进展。gydF4y2BaActa Crystallogr。DgydF4y2Ba75gydF4y2Ba, 861-877(2019)。gydF4y2Ba
聪明,o.s.等人。优化中的结构相似性开发:BUSTER中的自动NCS和目标结构约束。gydF4y2BaActa Crystallogr。DgydF4y2Ba68gydF4y2Ba, 368-380(2012)。gydF4y2Ba
薛定谔发布2021-2:大师(薛定谔,2021)。gydF4y2Ba
Sindhikara, d.j., Yoshida, N. & Hirata, F. Placevent:一种用于预测显式溶剂原子分布的算法-应用于HIV-1蛋白酶和F-ATP合酶。gydF4y2Baj .第一版。化学。gydF4y2Ba33gydF4y2Ba, 1536-1543(2012)。gydF4y2Ba
陈志伟,陈志伟,陈志伟,等。生物分子溶剂化位点的3D-RISM分析。gydF4y2Ba期刊。化学。BgydF4y2Ba117gydF4y2Ba, 6718-6723(2013)。gydF4y2Ba
Tian, C. et al. ff19SB:针对溶液中量子力学能量表面训练的氨基酸特异性蛋白骨干参数。gydF4y2Baj .化学。理论第一版。gydF4y2Ba16gydF4y2Ba, 528-552(2020)。gydF4y2Ba
贝利,C.麦凯,D. & Truchon, J.-F。非正式的AMBER小分子力场:parm@Frosst。gydF4y2Ba创新领导力。网gydF4y2Bahttp://www.ccl.net/cca/data/parm_at_Frosst/gydF4y2Ba(2015)。gydF4y2Ba
乔根森,W. L. C. J. D.马杜拉,Impey, R. W. & Klein, M. L.模拟液态水的简单势函数的比较。gydF4y2Baj .化学。理论物理。gydF4y2Ba79gydF4y2Ba, 926-935(1983)。gydF4y2Ba
Case, d.a.等。AMBER 2016(加州大学旧金山分校,2016)。gydF4y2Ba
Le Grand, S., Götz, A. W. & Walker, R. C. SPFP:不妥协的速度- GPU加速分子动力学模拟的混合精度模型。gydF4y2Ba第一版。理论物理。Commun。gydF4y2Ba184gydF4y2Ba, 374-380(2013)。gydF4y2Ba
所罗门-费雷尔,R.等人。在gpu上使用AMBER进行常规微秒分子动力学模拟。2.显式溶剂粒子网格。gydF4y2Baj .化学。理论第一版。gydF4y2Ba9gydF4y2Ba, 3878-3888(2013)。gydF4y2Ba
戈茨,a.w.等人。在gpu上使用AMBER进行常规微秒分子动力学模拟。1.广义诞生了。gydF4y2Baj .化学。理论第一版。gydF4y2Ba8gydF4y2Ba, 1542-1555(2012)。gydF4y2Ba
牧师,R. W.,布鲁克斯,B. R. & Szabo, A.朗之万和分子动力学算法的准确性分析。gydF4y2Ba摩尔。物理。gydF4y2Ba65gydF4y2Ba, 1409-1419(1988)。gydF4y2Ba
Roe, d.r. & Cheatham, t.e. PTRAJ和CPPTRAJ:用于处理和分析分子动力学轨迹数据的软件。gydF4y2Baj .化学。理论第一版。gydF4y2Ba9gydF4y2Ba, 3084-3095(2013)。gydF4y2Ba
GetContacts。gydF4y2BaGithub库gydF4y2Bahttps://getcontacts.github.io/gydF4y2Ba(GitHub)。gydF4y2Ba
舒克,L.等人。利用CRISPR/Cas9筛选鉴定HECT E3连接酶UBR5作为MYC降解的调节因子。gydF4y2Ba科学。代表。gydF4y2Ba10gydF4y2Ba, 20044(2020)。gydF4y2Ba
Gatto, L. & Killian, T. DepMap:癌症依赖性地图数据包。R包版本为1.10.0。gydF4y2BadepmapportalgydF4y2Bahttps://depmap.org/portal/gydF4y2Ba(2022)。gydF4y2Ba
广泛的研究所。DepMap 22Q1 Public。gydF4y2BafigsharegydF4y2Bahttps://doi.org/10.6084/m9.figshare.19139906.v1gydF4y2Ba(2022)。gydF4y2Ba
R核心团队。gydF4y2BaR:统计计算的语言和环境gydF4y2Ba(R统计计算基础,2021)。gydF4y2Ba
确认gydF4y2Ba
我们感谢我们的扩展团队成员和j - r。Marchand, S. Gleim, J. Koschwanez, T. Schmelzle, J. Tallarico和S. Malek的支持和科学投入;NIBR创新博士后项目,为Z.J.H.提供支持;B. Yang进行MS分析;以及M. Meyerhofer, C. Zimmermann, P. Fontana, C. Premand, W. A. Rahman和D. Erdmann对蛋白质生产的支持。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
z.j.h., d.a.k., C.R.T.和L.T.策划了这项研究,设计了实验并分析了结果。m.f., Z.J.H.和D.A.K.在K.C.和A.D.的支持下解决了结构问题;Z.J.H.和D.A.K.在L.T.和C.R.T.的帮助下完成了手稿;A.D.和J.V.支持Z.J.H.进行的生物物理学研究;D.E.在H.G.和S.M.的支持下进行细胞体外研究;F.M.进行了shock - gfp研究。G.K.进行了DepMap分析。M.B.进行M2H测定。S.K.表演TR-FRET。E.P.进行了体外活性测定,D.M.J.进行了SEC竞争实验,两者都得到了M.J.E.的支持; K.A.P. and C.V.-V. performed the molecular dynamics simulations. K.S.B., G.G.G., S.-M.M., T.S. and M.J.E. provided intellectual input.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
公元Z.J.H,,丰富多彩,丧,M.B, S.K, K.A.P, F.M, H.G。G.K。S.M C.V.-V。,K.S.B., G.G.G., S.-M.M., T.S., K.C., L.T., C.R.T. and D.A.K. are employees and shareholders of Novartis Pharma. M.F. is a former employee of Novartis. M.J.E. receives funding from Novartis Pharma.
同行评审gydF4y2Ba
同行评审信息gydF4y2Ba
自然gydF4y2Ba感谢匿名审稿人对本工作的同行评议所作的贡献。gydF4y2Ba同行评审报告gydF4y2Ba是可用的。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
SHOC2通过高度保守的凹面结合MRAS和PP1。gydF4y2Ba
一个gydF4y2Ba.重组MRAS装载GDP或非水解GTP类似物GppNHp固定在链霉亲和素(SA)芯片上,重组SHOC2 80-582在剂量反应中流动。代表性的传感器图显示,只有活跃的GppNHp加载的MRAS可以绑定到SHOC2。gydF4y2BabgydF4y2Ba.携带非水解GTP类似物GppNHp的重组MRAS被固定在链霉亲和素(SA)芯片上,重组PP1Cα、SHOC2 80-582或FL SHOC2在过量PP1Cα存在的剂量反应中流动。代表性的传感器图显示,只有在SHOC2 80-582存在时,pp1cα才能结合到活性GppNHp负载的MRAS上。gydF4y2BacgydF4y2Ba.重组SHOC2 80-582固定在链霉亲和素(SA)芯片上,重组pp1cα在剂量反应中流动。gydF4y2BadgydF4y2Ba.PP1C和MRAS结合在SHOC2上高度保守的表面。三元SHOC2/MRAS/PP1C复合物的正面和背面视图。请注意,SHOC2在其凹面上以高度保守的区域接合PP1C和MRAS。相比之下,SHOC2的外凸表面保守性很差。根据CONSURF服务器(PMID: 27166375)的分析,SHOC2的表面根据保守性从品红色(最保守)到蓝绿色(最可变)进行了着色。gydF4y2BaegydF4y2Ba.SHOC2序列比对。人类、青蛙、苍蝇和蠕虫的SHOC2氨基酸序列对齐,相同保守的残基为红色阴影。目前结构中M173I突变的位置为黄色阴影。SHOC2的二级结构元件显示在对齐上方。排列上方的符号表示全酶复合体中位于与pp1 α(绿色点)或MRAS(黄色星)界面的残基。gydF4y2Ba
图2 SHOC2 80-582的晶体结构。gydF4y2Ba
一个gydF4y2Ba.重组SHOC2 80-582的晶体结构显示了一个由20个富亮氨酸重复序列组成的折叠域,与结构预测非常吻合。N端和C端盖帽图案都被分解,没有密度为非结构的N端保留的部分。LRR重复被编号。gydF4y2BabgydF4y2Ba.SHOC2载波结构(灰色)和三元复合结构(浅绿色)的对齐。SHOC2的整体折叠是相同的,螺线管的曲率只显示出微小的变化,以适应其他复杂成员的结合。gydF4y2BacgydF4y2Ba.穿过凹面的beta薄片的氢键网络特征在LRR 9和10之间被破坏,这是SHOC2中范围重复中轻度非典型LRR折叠的组成部分。gydF4y2Ba
扩展数据图3 MRAS SWI/SWII环采用封闭构象。gydF4y2Ba
一个gydF4y2Ba.MRAS在三元配合物中向封闭构象转变。放大与载脂蛋白MRAS-GppNHp(蓝绿色pdb: 1x1s)对齐的绑定MRAS-GppNHp的SWI和SWII区域(灰色)。图示SWII F74从未绑定的开界(蓝绿色)到闭界(浅绿色)的运动。绑定MRAS的SWI为粉红色。gydF4y2BabgydF4y2Ba.结合MRAS SWI(粉红色)表现出与活性NRAS(紫色,pdb: 5uhv)相似的封闭构象。MRAS SWII(淡绿色)相对于NRAS-GppNHp也发生了构象移位。SWII F74从NRAS对应物Y64移动显示。MRAS-GppNHp以灰色显示。gydF4y2BacgydF4y2Ba.关键残基介导的水网络切割视图:PP1C R188和MRAS SWI E47, D48和S49介导了一个连接复合物所有亚基的协调网络。gydF4y2Ba
图4 PP1C与SHOC2和MRAS效应面进行了扩展的相互作用。gydF4y2Ba
一个gydF4y2Ba.PP1Cα与SHOC2相互作用通过一个延伸的残基弧,定位到SHOC2 lrr的上升环。这些相互作用主要是亲水的,并且在n端SHOC2 lrr附近变得更加网络化。选择具有盐桥和氢键相互作用的残基进行标记。gydF4y2BabgydF4y2Ba.PP1的螺旋G(紫色)和SWI(粉红色)/Strand beta 2(灰色)是MRAS/PP1 α PPI的主要相互作用表面。关键相互作用残基被标记。gydF4y2BacgydF4y2Ba.PP1C序列比对。人类PP1Cα、PP1Cβ和PP1Cγ的氨基酸序列与青蛙、苍蝇和蠕虫的PP1C序列一致。同守恒残基用红色表示。PP1C的二级结构元件显示在对线上方。排列上方的符号表示全酶复合物中与SHOC2(绿点)或MRAS(蓝菱形)界面上的残基。gydF4y2Ba
图5 M173I突变对SHOC2-RAS-PP1C界面的影响gydF4y2Ba
从SHOC2 M173I/MRAS Q71R/PP1Cα的晶体结构出发,提出了三个1 μs的轨迹,作为晶体配合物的验证手段。为了研究SHOC2和MRAS突变的影响,通过将SHOC2和MRAS残基(I173, R71)突变为它们的野生型残基(M173, Q71)并提交三个额外的1 us轨迹来模拟WT复合体。来自三个轨迹中的每一个的帧都被汇集和聚类。将聚类中心作为代表性结构进行检查,揭示了MRAS WT和SHOC2 WT接口的三种不同状态。聚类种群近似于每个状态被观察到的频率,显示状态1大约出现67%的时间,其次是状态2的29%,状态3的4%。在晶体络合物和突变轨迹中,Y198最常通过与A76和E73主链原子的氢键与MRAS相互作用。在WT运行1和3中,Y198、A76和E73触点是保守的。相反,在WT运行2中,MRAS WT/SHOC WT界面的状态2和3最常被抽样,Y198和MRAS开关II的位移导致氢键网络改变,其中Y198界面MRAS主要通过水介导的相互作用到D43, P44, T45或Q71。gydF4y2Ba一个gydF4y2Ba.模拟的SHOC2 WT/MRAS WT/PP1Cα WT三元配合物的SHOC2-MRAS界面的代表性结构。从聚集的MRAS WT/SHOC2 WT/PP1Cα WT轨迹观察到MRAS(深蓝色)- SHOC2(紫色)界面的三种不同状态,并与三元SHOC2 M173I(浅绿色),MRAS Q71R(灰色),PP1Cα(未显示)配合物的晶体结构对齐。(1)在状态1中,SHOC2 M173将MRAS M77侧链推离接口,而SHOC2 Y198不受扰动。(2)在状态2中,M173被埋没,导致Y198位移,氢键网络相对于晶体结构发生改变。(3)状态3,M173直接将MRAS开关II环推离SHOC2接口。gydF4y2BabgydF4y2Ba.在重复MD模拟中观测到的与SHOC2 Y198接触的频率。E73和A76之间的Y198氢键在第二个SHOC2 WT/MRAS WT/PP1Cα WT轨道中丢失。Y198和MRAS残基之间的置换接触主要是水介导的(用“wat”表示)。gydF4y2Ba
图6 SHOC2突变不影响蛋白质在细胞中的稳定性或定位。gydF4y2Ba
一个gydF4y2Ba.流式细胞术分析转染293T细胞的SHOC2-EGFP-chy- mcherry,比较细胞中不同GOF和LOF变体之间的SHOC2-EGFP丰度/稳定性。(i)流式细胞仪检测SHOC2-EGFP vs mCherry点图,SHOC WT与未转染对照叠加,显示mCherry+门。(ii)选取mCherry+细胞,提取每个细胞中EGFP与mCherry信号的比值,对于这两个信号,分别将未转染细胞(灰色群体)的中位数EGFP或mCherry信号减去背景(BG) (EGFP-BG)/(mCherry-BG),并绘制成归一化到模式的直方图,以考虑WT和R200E转染细胞之间的不同细胞数量。(iii)表示rel的柱状图。归一化到SHOC2 WT的指示突变体的SHOC2- egfp丰度,数据表示ii中从N = 4个独立转染中提取的中位数(EGFP-BG)/(mCherry- bg)值的平均值+/−SD(柱状图中每次重复的单个值表示1636 < mCherry+细胞< 40098,平均20460个细胞的中位数)。gydF4y2BabgydF4y2Ba.用WT和相应的SHOC2突变体转染293T细胞的SHOC2- egfp -chy- mcherry的代表性免疫荧光图像。显示了mCherry和EGFP通道的叠加图像(左)和SHOC2变体的仅EGFP通道图像(右),所有图像的尺寸条对应于15µm。结果代表了每种条件下的三次独立转染。gydF4y2Ba
扩展数据图7 RAS-PP1C接口有利于MRAS,而N/KRAS弥补了MRAS损失。gydF4y2Ba
一个gydF4y2Ba.RAS及RAS相关蛋白序列比对。人ras相关蛋白MRAS Q71R, RRAS, RRAS2的氨基酸序列,并与KRAS, NRAS和HRAS对齐。同守恒残基用红色表示。本结构中Q71R突变位点为黄色阴影。MRAS的二级结构元件显示在校准上方。排列上方的符号表示全酶复合物中位于与SHOC2(黄色星星)或PP1Cα(蓝色钻石)界面的残基。gydF4y2BabgydF4y2Ba.将SHOC2、PP1Cα和KRAS (GppNHp)以1:1:1.2摩尔比混合,并使用Superdex 200 Increase 10/300 GL色谱柱进行尺寸排除色谱。在MRAS缺失的情况下,与KRAS形成三元配合物(左)。在SEC分析之前,将SHOC2、PP1Cα、MRAS和KRAS分别以1:1:1.2:1.2的摩尔比组合(右)。在与SHOC2和PP1C结合之前,MRAS和KRAS都被非水解GTP类似物GppNHp带电。由此产生的UV280吸光度痕迹显示在顶部面板中,相应馏分的考马斯染色SDS-PAGE凝胶显示在下部面板中。注意三元配合物与MRAS组装,而KRAS和多余的MRAS如预期的那样洗脱未结合的GTPases。这些数据代表了两个独立的实验。gydF4y2BacgydF4y2Ba.x轴为RAF1依赖分数,y轴为SHOC2依赖分数的散点图。虚线表示依赖分数为零(无依赖)。高度负依赖性得分意味着给定的细胞系高度依赖该基因。依赖于SHOC2和RAF1的细胞系显示在散点图的左下角。gydF4y2BadgydF4y2Ba.Western Blot分析MiaPaca2亲本细胞或SHOC2 KO细胞,分别用曲美替尼(10 nM)处理24小时和siRNA靶向MRAS (100 nM) 48小时。Western Blot分析中pCRAF(S259)/CRAF和pERK/ERK水平的密度定量归一化至曲美替尼处理的亲本细胞。样品来源于相同的实验,印迹并行处理。所显示的代表性图像来自两个独立的实验。gydF4y2Ba
补充信息gydF4y2Ba
补充图1gydF4y2Ba
原始电泳图像。四个显示页面,每页有多个图像。显示未裁剪和未处理的western blot和SDS-PAGE图像,并提供有关主图和扩展数据图中位置的信息。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
豪斯曼,Z.J.,福多,M.,登比,A.。gydF4y2Baet al。gydF4y2BaMRAS-SHOC2-PP1C磷酸酶复合物的结构。gydF4y2Ba自然gydF4y2Ba609gydF4y2Ba, 416-423(2022)。https://doi.org/10.1038/s41586-022-05086-1gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-022-05086-1gydF4y2Ba
这篇文章被引用gydF4y2Ba
震惊英国皇家空军gydF4y2Ba
结构与分子生物学gydF4y2Ba(2022)gydF4y2Ba
结构钥匙解锁RAS-MAPK细胞信号通路gydF4y2Ba
自然gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba