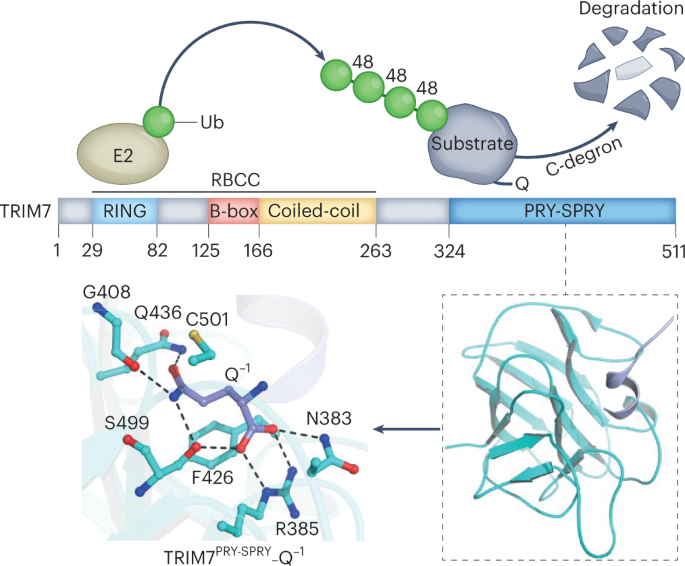
结合结构和生化分析表明,TRIM7 E3连接酶通过其PRY-SPRY结构域识别病毒蛋白的c端谷氨酰胺(C-Gln),从而靶向降解病毒蛋白,为C-degron途径提供了机制见解。
蛋白质泛素化涉及E1-E2-E3酶级联反应,在广泛的细胞事件中发挥重要作用,包括蛋白质周转,先天免疫反应,基因转录和细胞周期1。蛋白质可能含有各种降解信号(degrons),这些信号足以使它们成为E3连接酶或其复合物的靶标,随后通过泛素-蛋白酶体系统(UPS)进行蛋白质降解。2。具体来说,N或C末端的degron分别通过N-degron和C-degron途径招募E3连接酶诱导泛素依赖性消除2。与发现所有20种天然氨基酸都是N-degron通路的不稳定信号相比,直到最近发现了几种C-degron通路,包括Arg/C-degron和Gly/C-degron,才发现C-degron3.,4。是否其他C-degron通路控制蛋白质周转仍有待研究。在本期的自然化学生物学, Liang等。5揭示了trim7介导的Gln/C-degron通路及其在抗病毒功能中的重要作用。
Tripartite-motif-containing family (TRIM)蛋白属于一个RING-type E3连接酶家族,其大部分成员具有n端RING/B-box/coil -coil (RBCC)结构域和一个变异的c -末端区域(图2)。1).TRIM蛋白的表达在干扰素(ifn)的作用下上调,它们在各种先天免疫相关途径中起着关键作用6。最近,据报道,TRIM7通过激发赖氨酸48 (K48)连接的泛素化和病毒2BC蛋白的降解来抑制肠道病毒的复制7。此外,TRIM7被发现通过k63链催化RACO-1的多泛素化来稳定RACO-18。这样,TRIM7通过在不同底物上安装不同连锁类型的泛素链,显示出显著的泛素化可塑性。其他研究表明,TRIM7被劫持以促进病毒的复制9。尽管TRIM7在蛋白质周转和病毒感染中起着复杂的作用,但该蛋白如何识别其底物并使其泛素化在很大程度上是未知的。
为了揭示TRIM7的识别机制,Liang等。5首先采用等温滴定量热法(ITC)测定TRIM7的c端PRY-SPRY结构域(TRIM7)PRY-SPRY也被称为B30.2结构域)特异性识别病毒2C蛋白的c端片段(图2)。1)5。他们进一步解决了TRIM7的2c结合结构,其中肽的c端谷氨酰胺(C-Gln)紧密地安装在TRIM7的带正电的口袋中PRY-SPRY。C-Gln(位置-1)与TRIM7相互作用PRY-SPRY通过谷氨酰胺特异性氢键和疏水相互作用。此外,C- gln的主链羰基与TRIM7残基形成了几个氢键,使得C端不耐受额外的基团。C-Gln上游的肽残基(位置-2和-3)与TRIM7形成额外的氢键和疏水相互作用PRY-SPRY这表明TRIM7优先结合在分别在-1和-2位置上含有Gln和大块疏水残基的底物上5。与结构分析一致,他们发现SARS-CoV-2蛋白和RWDD2B从蛋白质-蛋白质相互作用(PPI)数据库中鉴定出来10以C-Gln/降解依赖的方式被TRIM7消除,这表明它们是TRIM7的潜在底物。通过求解一组TRIM7的结构PRY-SPRY结构域与含C-Gln/degron的肽结合,揭示了保守的C-Gln/degron识别模式,并通过诱变和结合实验验证了这一模式。进一步的体内实验表明,过表达TRIM7和敲除TRIM7分别导致底物降解增加和减少5。综上所述,这些结果揭示了由TRIM7介导的Gln/ c -degron依赖性蛋白转换(图7)。1).
在本研究之前,已知的c -degron是Cullin-RING E3泛素连接酶(CRL)复合物中底物受体靶向的c -degron3.,4。这项工作表明,E3连接酶也可以作为靶C-degron的受体,并且C-degron途径在防御病毒方面具有关键作用。人类基因组编码超过60个假定的TRIM家族成员,其中近一半包含一个PRY-SPRY结构域。了解其他PRY-SPRY结构域是否也作为底物结合模块将是一件有趣的事情。进一步的工作需要了解TRIM7如何泛素化不同连锁类型的底物,并检查其他TRIM蛋白是否也在底物泛素化中表现出连锁可塑性。与PROTACs类似,degrons具有靶向特定E3连接酶或复合物以降解非天然蛋白质底物的潜力。因此,新的degron通路的发现以及新发现的机制,也将有助于在不久的将来合理地设计PROTACs的分子。
参考文献
Hershko, A., cihanover, A.和Varshavsky, A.。Nat,地中海。6, 1073-1081(2000)。
Varshavsky,。自然科学进展。美国116, 358-366(2019)。
韩,I.等。细胞173, 1622-1635(2018)。
林,H.等。摩尔。细胞70中文信息,602-613(2018)。
Liang, X.等。Nat,化学。医学杂志。https://doi.org/10.1038/s41589-022-01128-x(2022)。
Ozato, K, Shin, D.-M。Chang, t.h。莫尔斯,H. C.。Nat, Rev. immuno1。8, 849-860(2008)。
Fan, W.等。细胞184, 3410-3425(2021)。
Chakraborty, A., Diefenbacher, m.e., Mylona, A., Kassel, O. & Behrens, A.。Commun Nat。6, 6782(2015)。
吉拉尔多,m.i.等。自然585中文信息学报,414-419(2020)。
运气,k,等等。自然580中文信息学报,402-408(2020)。
作者信息
作者及单位
相应的作者
道德声明
相互竞争的利益
作者声明没有利益冲突。
权利和权限
关于本文
引用本文
郭强,陈晓,徐超。基于Gln/C-degrons的TRIM-away。化学与生物18科学通报,1168-1169(2022)。https://doi.org/10.1038/s41589-022-01164-7
发表:
发行日期:
DOI:https://doi.org/10.1038/s41589-022-01164-7