摘要
b细胞淋巴瘤6 (BCL6)蛋白通过招募辅阻遏蛋白抑制基因转录,控制b细胞生发中心形成和维持所需的转录网络。由于BCL6失调控与弥漫性大b细胞淋巴瘤的发展有关,我们试图发现新的小分子抑制剂,破坏BCL6辅助抑制蛋白-蛋白相互作用(PPI)。在这里,我们报告了我们的发现和化合物优化策略,这些策略为用小分子抑制剂解决这一具有挑战性的PPI所需的多方面正交方法提供了深入的见解。使用1536孔板荧光偏振高通量屏幕,我们识别了多个命中序列,随后使用热位移分析、表面等离子体共振和配体观察核磁共振进行了命中确认。我们确定了BCL6与9个不同系列化合物结合的x射线结构,使基于结构的药物设计方法能够改善其弱生化效力。我们开发了一种时间分辨荧光能量转移生化测定方法和一种纳米生物发光共振能量转移细胞测定方法,以监测化合物优化过程中的细胞活性。这一工作流程导致了具有各自生化和细胞效力的新型抑制剂的发现(IC50年代)在亚微磨牙和低微磨牙范围内。
简介
b细胞淋巴瘤6 (BCL6)蛋白是Broad-Complex、Tramtrack和Bric-à-brac (BTB) /痘病毒和锌指(POZ)家族转录因子的成员,在b细胞生发中心的形成和维持中起关键作用1.在正常的体液免疫反应中,BCL6上调以产生高亲和力抗体。它的功能随后被其下调和BCL6转录复合物的破坏而终止。然而,在弥漫性大b细胞淋巴瘤(DLBCL)中,BCL6表达的异常持久性(例如,由于染色体易位和/或点突变)在淋巴瘤的发生中起着关键作用2,3.,4,5,6.
BCL6有一个N -末端BTB结构域,负责专性同二聚;一个与MTA3/NuRD复合物相互作用的长而非结构的中心区域;和六个C-末端c2h2型锌指参与DNA结合7,8.为了抑制其靶基因的转录,BCL6与各种蛋白复合物相互作用6并招募辅助抑制蛋白,如BCOR, NCOR或SMRT(也称为NCOR2)到其N -终端BTB域二聚体以互斥的方式9.NCOR和SMRT形成类似的去乙酰化组蛋白的染色质修饰复合物10,11,而BCOR形成一个变体Polycomb PRC1复合物,对染色质产生多种不同的影响12.中断SMRT或BCOR辅阻遏因子与BCL6 BTB结构域的相互作用足以抑制DLBCL细胞的生长9,13.因此,我们和其他研究人员试图发现破坏这些相互作用的小分子抑制剂,旨在确定BCL6驱动的淋巴瘤的新治疗方法,目前已经报道了多种用于BCL6的小分子抑制剂14,15,16,17,18,19,20.,21,22,23,24.
在这里,我们报告了BCL6的发现、验证和优化活动,以提供解决小分子抑制剂具有挑战性的蛋白质-蛋白质相互作用(PPI)所需的多方面和正交方法的见解,特别是在过程开始时缺乏经过验证的工具分子时。使用高通量筛选(HTS)中的荧光偏振(FP)测定法进行命中鉴定,以及多种正交生物物理技术,包括热位移测定(TSA)、表面等离子体共振(SPR)和配体观察核磁共振(LO-NMR)进行命中验证,我们鉴定出了9种新的、化学上不同的BCL6 btb -辅阻遏物相互作用的抑制剂系列。我们建立了一个坚固的,可浸泡的,高分辨率的BCL6 BTB结构域晶体系统,使我们能够阐明所有9个击中系列的结合模式,并绘制与辅抑制肽结合相关的结合位点热点。为了优化命中率,开发了一种时间分辨荧光共振能量转移(TR-FRET),以提供一种具有更高灵敏度的测定方法,用于测定显著低于原始FP试验的紧密结合极限的抑制剂效力。为了确定改进抑制剂的细胞活性,我们建立了两个测定方法;BCL6 InCell Hunter™检测(DiscoverX/Eurofins),以确认目标参与,以及纳米生物发光共振能量转移(NanoBRET, Promega UK Ltd)25证明并量化细胞中BCL6/SMRT蛋白-蛋白相互作用的全长抑制。通过这种综合的分析级联,结合基于结构的药物设计方法,我们改善了初级打击的弱效力,并生成了基于苯并咪唑酮的亚微摩尔生化IC抑制剂50年代,转化为低微摩尔IC50年代在NanoBRET细胞分析中。
结果与讨论
高通量屏幕
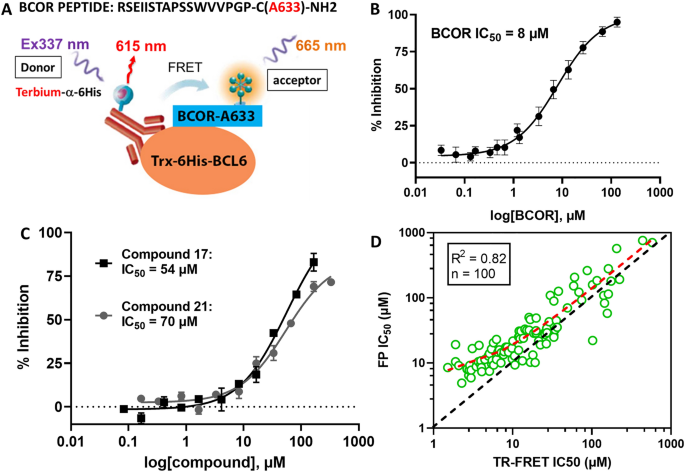
对于HTS,我们使用FP竞争检测,监测BCL6 BTB结构域与荧光标记的bor肽相互作用的中断9.之所以选择这种技术,是因为它易于安装,并且易于小型化为1536孔板格式。关键因素是能够生产大量稳定的重组BCL6 BTB结构域(每升细胞培养获得20-35毫克纯蛋白质)和高质量稳定的17氨基酸Alexa Fluor 633共轭bor肽探针,具有FP KD1.7±0.3µM(图S1A).在筛选时,只有一种弱小分子抑制剂79-6被报道17.因此,未标记的BCOR和SMRT肽在FP试验中作为阳性对照的适用性进行了测试。BCOR和SMRT肽具有平均的FP IC50分别为13±1µM和16±6µM(图;S1B).由于BCOR肽是这两种肽中最稳定的,因此选择它作为阳性对照肽。
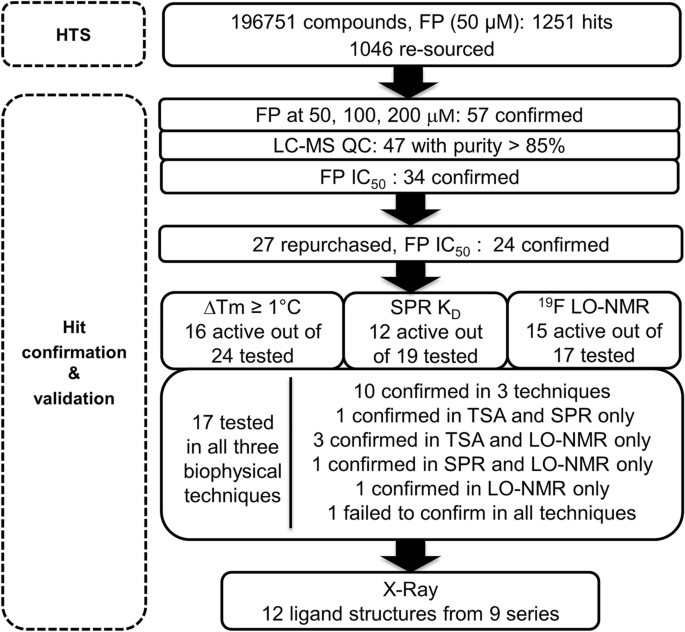
使用FP法,我们筛选了最终浓度为50µM的196751种化合物的内部HTS库。检测窗口在80 - 90mp之间,Z '值在0.6 - 0.8之间变化。如果化合物表现出超过16%的抑制作用,即与平均值-2.9%有两个标准差,则认为它们命中。略负的平均值表明在整个HTS期间记录的总FP mP值呈不均匀的高斯分布,这是由于不溶性化合物产生的偏光散射造成的。选择这个低临界值来识别我们所期望的弱活性化合物,以实现这一具有挑战性的PPI目标。该屏幕产生了1251个主要命中,对应的命中率为0.6%。其中,100种化合物显示出的总荧光强度大于DMSO对照的110%,因此被标记为荧光干扰物,并从打击名单中删除26.我们还去除了89种化学上难以处理的化合物和16种不再可用的化合物,留下1046种化合物进行确认筛选(图2)。1).
在确认FP筛选中,以50、100和200 μ M的浓度对主要命中进行测试,以确认其活性,并研究其是否依赖于浓度。得到57个确认的命中,其中47个通过了LC-MS QC分析(纯度大于85%),并用于IC50的决心。除去一种荧光干扰剂和12种化合物的浓度响应曲线斜率大于2,15种化合物在最大浓度为200 μ M时表现出25-48%的抑制作用,19种化合物产生IC50值在23到197µM之间。
根据我们的经验,使用不同批次的固体材料再次确认化合物活性是至关重要的。有7种主要成分没有上市,但我们重新购买了16种IC可测量的化合物50值和坡度在0.5 ~ 2之间,以及11种弱活性化合物与活性较强的化合物结构相关。我们假设,在更高的浓度(> 200µM)下重新测试这些结构相关的化合物可以解开一些初始的结构活性关系。我们在FP试验中重新测试了27个重新购买的结果,在最高2 mM的可变浓度下。我们再次确认了24个化合物,其中23个含有IC50值范围为70 ~ 700 μ M,一个弱活性,在1 mM抑制34%(图。1和表S1).
在生物物理分析中命中验证
为了进一步验证我们的结果是真正的BCL6抑制剂,我们同时使用了三种正交生物物理技术,每种技术对干扰的敏感性和敏感性都不同:TSA、SPR和LO-NMR。此外,通过核磁共振或高效液相色谱测定命中的动力学溶解度15,揭示了复合溶解度范围从高(≥500 μ M)到低(< 30 μ M)的水溶液缓冲液(表S1).某些命中物的低溶解度意味着并非所有命中物都能在每种技术中得到验证,这尤其影响了SPR和LO-NMR实验。
运输安全管理局
用BCL6热位移法研究了回购化合物的结合27.apo-BCL6 BTB结构域给出了一个熔化温度(T米)为56.7±0.1°C,而正ΔT米在200µM的BCOR控制肽存在时,观察到6.5°C。我们测试了在200和400µM的FP试验中再次确认的24个命中,并确定了16个具有阳性ΔT的化合物米在+ 1和+ 3.5°C之间(图;1和表S1)和8个没有或非常小的位移(ΔT米= 0.0±0.5°c)。
SPR
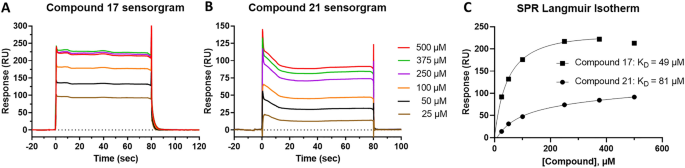
使用SPR,可以测量平衡结合常数(KD),即使是结合弱的小分子和碎片20.,28,我们测试了24个再次确认的命中中的19个直接绑定到BCL6 BTB域。其中四种因其溶解度低(< 30µM)而未检测,一种因其FP活性低而未检测。在19次测试中,有7次没有给出可测量的K值D由于不饱和结合曲线,质量差的传感器图,或与1:1结合模型不一致的结合化学计量(实验/理论R马克斯我们确认了12个化合物与K的结合D数值范围从49毫米到1毫米(图。1和表S1).两种最强的粘合剂是化合物17而且21分别用KDs49 μ M和81 μ M(图;2和表S1).
LO-NMR
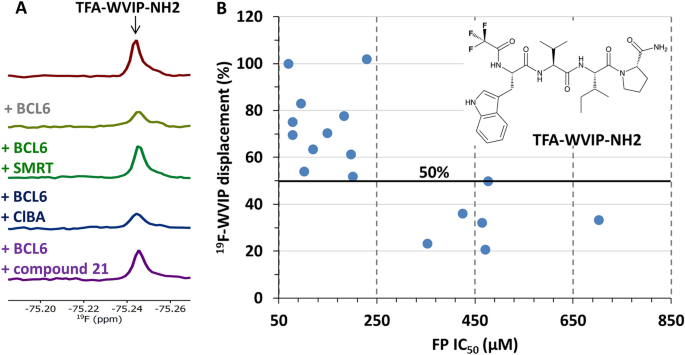
根据我们和其他研究小组的经验,如果将LO-NMR实验设置为具有紧密结合控制化合物或弱结合报告分子的竞争形式,则最具信息量29.为了进一步验证再次确认的HTS命中,我们试图鉴定一种对BCL6 BTB结构域具有低亲和力的小肽,可以用作LO-NMR位移分析中的报告探针。我们测试了基于bor或SMRT BCL6结合域的序列的4到8个氨基酸的小肽的结合9,30.使用1核磁共振(图S2A).基于BCOR肽序列,我们鉴定了四肽WVVP为保留BCL6 BTB结构域结合亲和力的最小肽片段1核磁共振(无花果。S2A、C)。然后,我们测试了一组基于WVVP肽的短肽,结果表明,BCL6 BTB结构域存在时,混合bor /SMRT WVIP肽的峰值降低最高。S2B, D)。此外,1在17残基BCOR肽的存在下,WVVP和WVIP肽的H-NMR信号被恢复(图2)。S2C,D),证实两种四肽的结合位点与BCOR辅抑制子结合位点重叠。WVIP肽被选为我们的NMR位移分析的报告探针,因为它结合了最小的序列和最大的峰还原(图。S2B, D)。
防止信号重叠1H-NMR实验中,我们合成了一种含氟WVIP肽(三氟乙酸,TFA)N -终点站,并在C终点站(TFA-WVIP-NH2,无花果。3.解析:选B2放松的编辑19F-NMR实验。如图所示。3.A, TFA-WVIP-NH的峰值2四肽在与BCL6 BTB结构域结合时减少,但在与SMRT控制肽和化合物竞争时恢复21,我们的一个样本击中了,但不是在阴性对照4-氯苯甲酸存在的情况下。我们测试了24个已确认的HTS中的17个19F-NMR报告法。其余7个化合物由于其低溶解度(< 30 μ M)、低信噪比或同一系列的代表性化合物被测定而未被表征。11种最强的化合物19F-NMR位移对应于最高效力的命中(IC50< 250µM)(图;3.B),而6种药效较低的化合物(IC50> 350µM)的位移最弱(≤50%)。这种相关性增加了我们对11个最有力的打击的信心。
总之,在FP试验中确认的24个主要结果中,17个通过所有三种生物物理技术进行了测试,16个在一个或多个正交试验中得到了验证(图2)。1和表S1).经验证的命中集中在5个化学类别(三唑嘧啶、氰-三氟甲基吡啶、噻唑、嘧啶-苯并咪唑酮和吡唑啉-嘧啶酮)和4个额外的单例(表2)S1).总的来说,通过多种生物物理方法对HTS命中物进行评估,使我们对已验证的命中物列表有了很高的信心,并鼓励我们尝试通过x射线晶体学来阐明它们的结合模式。
x射线晶体学的结合模式测定
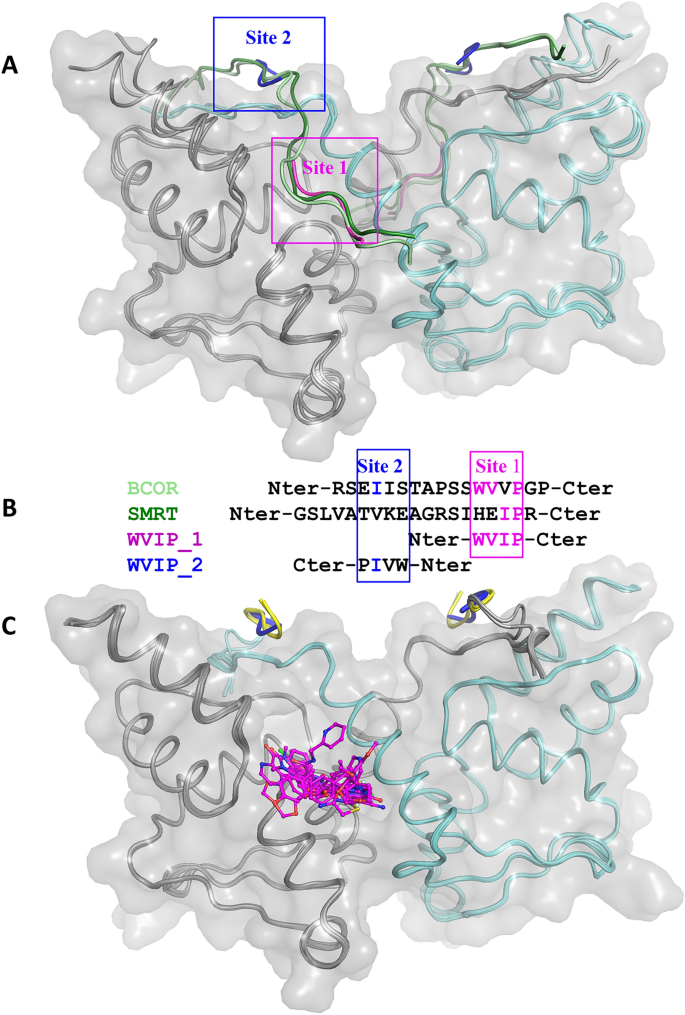
我们第一次尝试获得可浸泡BCL6 BTB结构域晶体体系只产生弱衍射晶体。然而,当我们在通过low - nmr鉴定的WVIP四肽存在的情况下结晶BCL6 BTB结构域时,我们获得了强衍射晶体,并在2.05 Å分辨率下确定了WVIP结合的BCL6 BTB晶体结构(表2S2).WVIP四肽结合在BCL6 BTB肽结合槽的两个位置。主要WVIP结合位点(图中site 1)。4)与BCOR和SMRT肽段中的相应残基重叠9,30.,其结合模式类似于这些较长的多肽(图。S3).BCL6与WVIP肽的相互作用主要由极性相互作用驱动。其中包括BCL6中Met51的羰基与肽色氨酸残基侧链nh基之间的h键,BCL6中Arg24和Arg28的侧链与肽主链上的两个羰基之间的h键,以及BCL6中Asn21的侧链与WVIP肽主链上的一个羰基和一个nh基之间的h键。S3C).疏水相互作用进一步稳定肽。这包括肽的色氨酸残基侧链和BCL6残基53-55主链之间的相互作用,以及肽异氨酸侧链嵌入在BCL6的Tyr58和Asn21之间的一个小疏水囊中(图5)。S3C)。在第二个位点,WVIP肽结合方向与辅抑制子相反(图2中的位点2)。4A、B)。由于这第二个WVIP分子与邻近的BCL6分子有广泛的晶体接触,稳定了晶体包装,这种结合事件很可能是结晶人工产物。
天然辅抑制因子,WVIP肽和HTS命中结合到BCL6 BTB结构域二聚体表面的相同区域。(一个BCL6 BTB结构域二聚体与SMRT辅抑制肽(深绿色,PDB ID 1R2B)、BCL6辅抑制肽(浅绿色,PDB ID 3BIM)和WVIP肽结合在位点1(洋红色)和位点2(蓝色)的重叠。BCL6二聚体以带状表示,两个单体分别用灰色和青色表示,灰色半透明表面叠加。(B)序列比对反映了WVIP肽的两个分子和辅抑制子分别结合在位点1和位点2上的结构重叠。(C)覆盖的BCL6 BTB结构域二聚体结合到12个结构确认的HTS命中(洋红色)。BCL6二聚体的配色方案和表面表现形式与面板(一个).HTS命中显示为洋红色的球和棒。的N出现在Flag-TEV-BCL6结构中的-末端未裂解TEV序列,用于一些bcl6抑制剂结构,并在第二个WVIP结合位点(site 2)结合,显示为黄色带状。
与FP实验中观察到的低亲和力一致(在980 μ M, n = 4时,抑制率为16%,图;S3D),结合在位点1上的WVIP肽在HTS命中浸泡实验中容易被置换。基于生物物理撞击确认实验的结果,我们选择了13个经过验证的撞击,代表了5个不同的化学系列和3个单体,使用x射线晶体学进行结构表征。我们解决了BCL6 BTB域的晶体结构,绑定到9个不同的命中,分辨率在1.38到1.85之间Å(表S2,无花果。4C和S4),相当于69%的成功率。
根据武田制药的出版物23,31我们实现了第二个BCL6 BTB结构域晶体系统,该系统不需要添加肽来结晶。在这些晶体中,一个未分裂的N-terminal Flag-TEV标签取代了结合在位点2上的WVIP肽,稳定了晶体填料,但保留了位点1(图2)。4C).使用该晶体系统,我们解决了BCL6 BTB域的晶体结构与3个额外的命中绑定,将验证的HTS命中的结构表征的成功率提高到92%(表S2,无花果。4C和S4).
正如预期的那样,在所有12个配体结合的BCL6结构中,化合物结合在位点1(图1)。4C),这与在LO-NMR和FP测定中与肽基探针的竞争一致。尽管它们的化学相似性较低,但不同的化合物都通过类似的相互作用与BCL6结合,绝大多数模仿BCL6与其辅抑制子SMRT和BCOR的相互作用(图2)。S3,S4).重要的是,所有化合物,除了氰三氟甲基吡啶11而且13在BCL6中,NH基与Met51的主链羰基之间通过h键相互作用,类似于BCOR和SMRT辅抑制肽中Trp509和His1426侧链形成的相互作用9,30..此外,所有化合物都插在Tyr58和Asn21的侧链之间,如SMRT中的Ile1428和BCOR中的Val511所观察到的那样。此外,除了11有一个取代基堆叠在BCL6残基的主链53-55上,模拟了SMRT和BCOR肽中His1426和Trp509侧链的相互作用。一些化合物与BCL6残基形成了额外的h键,进一步模拟了在BCL6辅阻遏物结构中观察到的相互作用。例如,苯并咪唑酮部分17而且18,噻唑酰胺在14,并将蝶啶酮放入22与Glu115和/或His116的主链原子形成直接和/或水介导的h键,就像bor肽中Ser508侧链的相互作用一样。此外,17,2,11,14而且15它们都通过与以下一个或多个BCL6残基Asn21、Arg24或Arg28形成h键网络(直接或水介导)来模拟与两个辅抑制子的主链原子的相互作用。我们在HTS中观察到的几种BCL6配体相互作用,如Tyr58和Asn21之间的插层,与Met51的关键h键,与Glu115的h键,以及与Arg24和Arg28的相互作用,也出现在报道的BCL6抑制剂中,不同的化学支架结合在同一个热点17,18,20.,21,22,23,24,32,33这并不奇怪,因为它们都模仿与SMRT和BCOR协阻子观察到的相互作用。
总之,结构表征揭示了我们的HTS命中的关键BCL6结合相互作用,这对于使基于结构的药物设计方法能够产生更有效的具有药物类物理化学性质的抑制剂,以便进行细胞活性分析至关重要。
TR-FRET化验
我们的优化工作集中在通过合并氰基氯吡啶获得的抑制剂上21苯并咪唑酮部分1715,因为这些都是最有效的HTS命中化学处理支架(图。2而且5C,表S1).这一策略导致了我们化合物的生化效力的显著改善。然而,在命中优化过程中,FP检测的灵敏度明显受到探针对BCL6 BTB结构域的弱亲和力的限制(图5)。S1A)和大量的蛋白质(3µM),以产生强大的FP信号。在FP实验中,可分解抑制剂的作用范围受到荧光配体亲和力的限制34,我们开发了一种基于硫氧还蛋白- 6his标记的BCL6 BTB变体和荧光标记的BCOR-A633 FP探针的半直接TR-FRET检测方法。5A).在fp试验中,KD硫氧还蛋白- 6his标记的BCL6 BTB蛋白与BCOR-A633肽的相互作用被测量为1.74µM,非常类似于KD未标记的BCL6 BTB结构域(图;S1A).在新的TR-FRET试验中,Z '值在0.7到0.9之间,检测窗口高达2.5,只需1 nM的蛋白质即可常规获得,从而实现了非常可靠和敏感的试验格式。蛋白探针相互作用可以被未标记的BCOR肽中断(图。5B,集成电路50= 8.0±0.8µM)和化合物17而且21(无花果。5C,各IC5054和70 μ M)。HTS命中及其类似物在FP和TR-FRET分析格式之间显示出良好的相关性(图2)。5D R2= 0.82, n = 100,1 μ M < TR-FRET IC50< 600µm)。然而,在命中优化阶段的后期,当复合效价达到低微摩尔范围(TR-FRET IC50< 5,图。5D),预测FP试验的紧密结合限,TR-FRET IC50值变得具有歧视性,并允许使用亚微摩尔生化IC对BCL6抑制剂进行稳健的表征50年代(表1)15.
TR-FRET试验的发展及其与FP试验的相关性。(一个通过TR-FRET试验格式测量BCL6 BTB - BCOR肽相互作用的示意图。(B)在TR-FRET反应中,未标记的BCOR肽与Alexa-633共轭BCOR肽与IC竞争508±0.8 μ M, n = 20。(C)两种最有效的HTS组合17而且21显示各自的IC50TR-FRET试验的值为54和70µM。(D)苯并咪唑酮系列BCL6抑制剂的TR-FRET (x轴)和FP (y轴)测定之间的相关性。在FP实验中BCL6 BTB浓度为3 μ M, TR-FRET实验中BCL6 BTB浓度为10 nM。两种生化检测结果均与R2为0.82,但大多数化合物在TR-FRET试验中表现出比FP试验更高的药效(红色虚线高于黑色虚线统一线)。当复合效力接近FP试验的紧密结合极限时(IC50< 5µM)时,两种测定方法的相关性降低。
细胞分析
我们开发了基于细胞的检测方法,以测试我们最先进的化合物系列的改进生化效力转化为细胞活性。我们建立了两种基于细胞的分析方法:InCELL Hunter™靶点接合分析(eurofin - discoverx)和NanoBRET分析(Promega UK Ltd)技术。
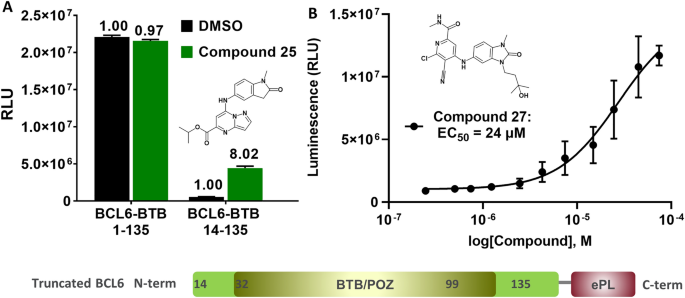
InCELL Hunter™检测方法是基于对细胞中感兴趣蛋白的增强ProLabel (ePL)标记版本的化合物介导稳定的测量35,36,37,38.成功的先决条件是确定一种已知与BCL6-BTB二聚体结合的对照化合物,其性质与细胞渗透性相称。为了建立并验证测定方法,我们合成了基于奥辛多尔的抑制剂化合物25(无花果。6A),类似于已发表的BCL6基于奥辛多尔的抑制剂20..复合25有TR-FRET IC50值为2.1±0.1 μ M (n = 2),被动细胞渗透率为110.106在平行人工膜透性试验(PAMPA)中,Caco-2的流出比为0.72。
使用包含完整BCL6 BTB结构域(氨基酸1-135)的BCL6结构被证明是不成功的,但我们使用an获得了一个可接受的检测窗口N-末端截断的BCL6 BTB结构域(氨基酸14-135)融合成aC-terminal ePL标记。该结构使我们能够确认化合物BCL6的靶点接合25HEK293T细胞(图;6A).随后,我们用EC演示了我们苯并咪唑系列中10个化合物的BCL6靶点接合50值范围为5 ~ 75 μ M(表2 - 3)S3),以化合物为例2714(无花果。6B)。
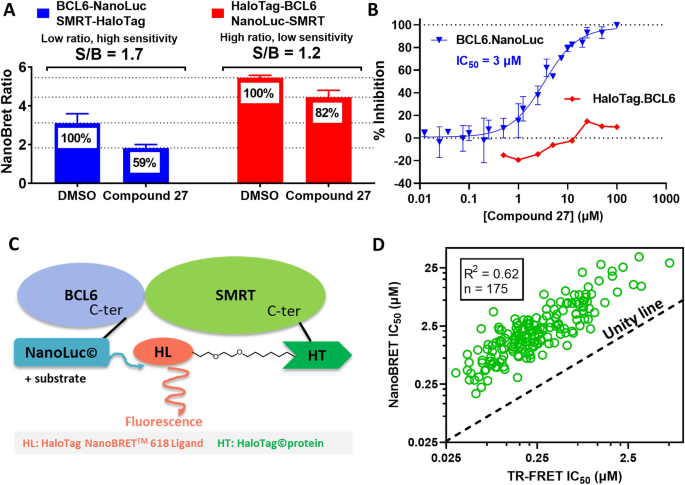
受我们苯并咪唑酮化合物的细胞BCL6靶点参与的鼓舞,我们开发了一种NanoBRET检测方法(Promega UK Ltd),测量HEK293T细胞中全长BCL6/SMRT蛋白-蛋白相互作用的抑制作用,作为跟踪化合物结构-活性关系(SAR)的更敏感的读表。NanoBRET检测基于相互作用蛋白质的标记版本,其中一个带有NanoLuciferase供体(NanoLuc),另一个带有受体荧光染料(HaloTag + 618配体),当两个蛋白质彼此靠近时,会产生生物发光共振能量转移(BRET)信号25,39.因为供体和受体都可以融合到N-或上C- BCL6和SMRT的末端,测试了8种可能的BCL6/SMRT BRET配置(图2)。S5a - c)。为了表征复合抑制,我们选择了两种具有高BRET比率和供体信号的配置,一种是BCL6N-一端与HaloTag (HaloTag.BCL6/NanoLuc.SMRT)融合,另一端与BCL6融合C-最终融合到NanoLuc (BCL6.NanoLuc/SMRT。HaloTag,无花果。7A和S5)。使用haltag . bcl6 /NanoLuc。SMRT组合,我们观察到我们的抑制剂只有非常弱的抑制作用,例如化合物27(无花果。7A、B)。然而,使用BCL6.NanoLuc/SMRT。HaloTag配置(图。7C),我们检测到可测量IC的复合抑制50年代,化合物也证明了这一点27(无花果。7A、B)。
NanoBRET测定苯并咪唑酮类化合物的灵敏度和活性。(一个NanoBRET结构对HEK293T细胞复合抑制检测敏感性的影响。蓝色直方图显示的是C-最终NanoLuc标记BCL6和HaloTag标记SMRT,使用或不使用BCL6抑制剂27.红色直方图显示的是N-最终HaloTag标记BCL6和NanoLuc标记SMRT与不27.我们选择前者是因为其在25µM处理6 h后对复合抑制的敏感性较高27.(B)浓度反应27在两种NanoBRET配置中。一个集成电路50价值可以用C-最终NanoLuc标记了BCL6(蓝色三角形),但当BCL6被标记时没有N-最后是光环标签(红钻)。(C)对复合抑制的最大敏感性的最佳NanoBRET配置示意图。(D)显示相关性的图表(R2= 0.62, n = 175)之间的生化(TR-FRET IC .50在x轴上)和细胞(NanoBRET IC50y轴上)苯并咪唑酮系列抑制剂的活性。数据点高于统一线(黑色),表明细胞活动平均比生化效力低一个数量级。
表格1综述了三种苯并咪唑酮类抑制剂的细胞活性和生化活性14,15在早期的优化阶段。在进一步优化后,我们观察到与TR-FRET生化活性相关的细胞效力逐渐增加,证实了该试验的适用性(R2= 0.62, n = 175,图7D)优化细胞效力。与它们的细胞活性一致,大多数苯并咪唑酮表现出较高的细胞通透性(75%与PAMPA细胞通透性> 20 × 10)6cm/sec, pH 7.4)和溶解度(67%,核磁共振动力学溶解度> 150µM)。总之,这些结果证明了分析级联的稳健性和我们化学系列的质量。结合获得高分辨率抑制剂结合BCL6-BTB结构的能力,这使我们能够有效地推进我们的药物发现计划。
结论
我们使用FP试验成功地进行了一项HTS活动,发现了能够破坏BCL6 BTB/ bor肽相互作用的小分子。尽管确认率很低,但通过三种正交生物物理技术(TSA、SPR和LO-NMR),不同化学支架的多个主要命中物被识别、重新购买并验证。例如,通过使用low - nmr筛选较小肽的结合,绘制出BCL6 BTB结构域上的长辅抑制因子结合槽,从而鉴定出WVIP肽及其氟化版本TFA-WVIP。后者成功地用于LO-NMR竞争实验,验证了HTS命中的结合,显示出与FP测定的良好相关性。
使用x射线晶体学确认WVIP肽的结合提供了进一步的证据,在LO-NMR中显示与WVIP竞争的化合物可能结合在协抑制因子结合槽中。此外,WVIP BCL6-BTB共晶体提供了可靠的高分辨率晶体系统,用于所有命中系列样品和选定单例的详细绑定模式表征。配体结合的BCL6结构表明,我们的化学多样性命中系列有效地模拟了天然辅抑制物bor和SMRT和BCL6之间的关键相互作用。此外,WVIP BCL6- btb共晶系统和额外的FLAG-TEV-BCL6晶体系统,使我们能够及时确定与改进的BCL6抑制剂结合的BCL6- btb结构域的高分辨率结构,实现了高效的基于结构的药物设计方法,并极大地促进了SAR的解释。
改进我们BCL6抑制剂的另一个重要步骤是开发InCELL Hunter和NanoBRET靶点细胞接合测定法,以牢固地确认其细胞活性并能够监测细胞SAR。在这两个测定法中,我们证明了探索不同配置以最大限度地提高化合物结合和/或抑制的测定灵敏度的重要性。InCELL Hunter试验使我们能够在早期阶段证明我们的抑制剂能够与细胞中的BCL6结合。然而,该检测方法使用了截断的BCL6 BTB结构域变体,并且本身不测量细胞活性。先前报道的BCL6细胞检测是基于AlphaLisa或哺乳动物酵母-两种混合形式的多肽或截断蛋白变体18,23,或使用基于荧光素酶的报告器22.这些分析格式都没有测量全长BCL6与其全长SMRT辅阻遏物之间相互作用的抑制作用。相比之下,我们的NanoBRET分析报告了在细胞环境中两个全长蛋白之间相互作用的中断。此外,该方法的通量足以测量BCL6药物发现项目优化阶段产生的数百种抑制剂(> 800)的细胞效力。我们观察到苯并咪唑酮系列的生化(TR-FRET)和细胞(NanoBRET)效力之间有良好的相关性,验证了我们的实验级联和苯并咪唑酮是bcl6 -辅阻遏因子相互作用的真正抑制剂。
综上所述,从HTS中识别针对PPI目标的初始命中物质,例如bcl6 -协抑制因子相互作用,可能非常具有挑战性,因为命中率通常很低,假阳性的比例可能很高。此外,真阳性结果的弱效力使得很难将其与假阳性结果区分开来。通过结合使用生物化学和生物物理分析,然后使用x射线晶体学进行结构确认,我们能够克服每种撞击验证方法各自的局限性,并有效地对撞击化合物进行分类,识别出几种经过验证和结构表征的撞击系列和单体。体外TR-FRET试验被证明有助于优化生化效力,InCell Hunter和NanoBRET试验在评估化合物的细胞活性方面至关重要,因此有助于发现一系列基于苯并咪唑酮和喹诺酮的BCL6抑制剂,在BCL6依赖的淋巴瘤细胞系OCI-LY1和SU-DH-L4中显示亚微摩尔细胞活性和抗增殖作用15,40.
方法
BCL6结构用于分析和结晶学
将人BCL6 BTB结构域5-129残基编码序列亚克隆到pET48b载体中,得到了BCL6 BTB结构域的第一个结构体,我们将其命名为Trx-6His-HRV3C-BCL6N-末端硫氧还蛋白和6-组氨酸标记,随后是HRV-3C蛋白酶裂解位点。在TR-FRET实验中,使用Trx-6His-HRV3C-BCL6蛋白结构,但没有切割标签,因为需要6His与抗6His-铽抗体结合。用于其他生物化学和生物物理分析,以及WVIP肽和化合物的结晶学2,7,11,13,15,17,19,21而且22,经HRV-3C蛋白酶处理去除标记,生成更简单的BCL6 5-129产物。
用于化合物的结晶学10,14而且18,对上述结构进行了修改,在HRV3C和BCL6序列之间引入了一个Flag Tag和一个TEV裂解位点。这个构造称为Flag-TEV-BCL6。
BCL6的表达和纯化
对于上述两种质粒结构,转化BL21-AI大肠杆菌细胞在添加50 mg/L卡那霉素的LB培养基中37℃培养至OD600海里达到0.6。添加0.2 mM IPTG和0.2% (w/v)阿拉伯糖诱导蛋白表达。18°C表达18 h。离心(5500 g, 4°C 30 min)收集细胞,-80°C保存。
将细胞重新悬浮在由20 mM Tris pH 8, 250 mM NaCl, 1 mM MgCl组成的缓冲液中2, 0.5 mM TCEP和5% (v/v)甘油,1 ×完全ULTRA蛋白酶抑制剂和12.5 U/ml苯并酶。超声裂解细胞,然后在21,000 g下离心45分钟,温度为4℃。上清液装入HisTrap FF色谱柱,加入2 mg HRV-3C蛋白酶,对Trx-6His-HRV3C标签进行柱上裂解。裂解的BCL6 5-129,或Flag-TEV-BCL6 5-129,然后用ResourceQ(仅用于Flag-TEV-BCL6结构)进一步洗脱和纯化,并使用HiLoad 26/60 Superdex75柱在含有20 mM HEPES pH 7.5, 250 mM NaCl, 1 mM TCEP和5% (v/v)甘油的缓冲液中凝胶过滤。通过SDS-PAGE和高分辨率质谱分别评估最终蛋白的纯度和摩尔质量。
对于未裂解的Trx-6His-HRV3C-BCL6蛋白构建物,该蛋白直接从hisstrap FF柱洗脱,无需HRV-3C处理,并按照上述方法进行Superdex75凝胶过滤。
荧光偏振
一种修饰过的bor肽,含有AC-末端半胱氨酸,用Alexa Fluor (AF)633 C5马来酰亚胺标记(RSEIISTAPSSWVVPGP-Cys(AF633)-酰胺)从剑桥生化研究公司获得。为了进行高通量筛选,将检测方法从Perkin Elmer 384孔黑色Proxi Plus板中的10µL缩小到Labcyte 1536孔黑色低死容量LP-0410板中的4µL。每个完整的反应(从9,17)含有20 mM Hepes/NaOH pH 8.0, 150 mM NaCl, 0.5 mM三(2-羧乙基)膦(TCEP), 0.05% (v/v) Tween 20, 10 nM BCOR-AF633肽,3µM BCL6 BTB和1-2% (v/v) DMSO。在这个蛋白浓度下,我们记录了一个80 - 90mp的FP信号,对应于约55%的BCOR-AF633结合到BCL6 BTB结构域。化合物和对照bor肽使用Echo550声学分配器(Beckman Coulter)分配器。使用Multidrop combi (Thermo Scientific)或Tempest v2 (Formulatrix)添加蛋白质和肽试剂。在室温下孵育2小时后,在激发波长和发射波长分别为620 nm和688 nm的Envision平板阅读器(Perkin Elmer)或带有FP滤波器模块590-50/675-50/675-50 /675-50的Pherastar FSX (BMG Labtech)上读取板。为了使用Dotmatics或Prism (GraphPad Software, La Jolla, CA)确定原始mP值的抑制率,将测试井正化为含有DMSO或100 μ M未标记BCOR竞争对手肽的控制井。作为低信号控制,我们在HTS运动中使用了bor的最大抑制,或者在IC没有BCL6的情况下从探针获得的信号50的决心。集成电路50数值计算采用s型剂量-响应(变斜率)四参数方程。除了FP测量外,还记录总荧光强度(TFI),以便识别干扰化合物(TFI > 110%对照)。26.
TR-FRET
在384孔黑色proplate (Perkin Elmer)中,每个15µL TR-FRET反应含有1或10 nM Trx-6His-BCL6 BTB, 300 nM BCOR-A633和0.5或1 nM anti-6His-Terbium cryptate (Perkin Elmer),在FP测定缓冲液(25 mM Hepes pH 8, 100 mM NaCl, 0.05% (v/v) Tween20, 0.5 mM TCEP)中,补充0.05% (w/v)牛血清白蛋白。使用Echo 550声学分配器将DMSO或DMSO中的测试化合物添加到孔中,在0.7% v/v DMSO终液中给出适当的测试浓度。在室温下孵育2小时后,在Envision平板阅读器或Pherastar FSX平板阅读器上使用337 nm激光激发,第一个发射滤波器在665 nm,第二个发射滤波器在615或620 nm。数据归一化和IC50按上述方法测定。
热位移测定
热位移分析在4titude FrameStar (Part No. 4ti-0385) 384孔的PCR板中进行:每孔含有10µL pH为6的醋酸钠缓冲液,100 mM NaCl, 0.5 mM TCEP, 10µM BCL6 BTB和20 × Sypro橙色染料(Life Technologies),以4% (v/v)的DMSO最终浓度添加或不添加抑制剂化合物(100 - 400µM)。在Biorad CFX384实时热循环器上加热,温度梯度从10°C到95°C,增加0.5°C, 0.15 s/循环。使用Vortex (Dotmatics)处理数据:BCL6 BTB熔化温度的位移(ΔT米) + 1°C或以上被归类为BCL6化合物结合的指示。
溶解度测定
定量溶解度测量1如前所述,进行H-NMR或HPLC方法15.
表面等离子体共振
所有表面等离子体共振(SPR)实验都在Biacore T200 (Cytiva)上进行,胺偶联化学被用于在研究级CM5传感器芯片上固定蛋白质。运行缓冲液由100mm醋酸钠、100mm氯化钠和1mm TCEP组成,pH值为6.0。使用100 mM n -羟基琥珀酰亚胺和400 mM 1-乙基-3-(3-二甲氨基丙基)-碳二亚胺1:1的混合物激活芯片表面10分钟。将BCL6 BTB蛋白以100µg/mL的浓度注入10 mM醋酸钠缓冲液(pH 5.5)中20分钟。最后,通过注射pH为8.5的1 M乙醇胺7分钟来阻塞表面。在所有上述步骤中,流速保持在10µL/min,并在芯片上固定约10,000个响应单位(RU)的BCL6。流单元1不作修改,作为参考表面。
蛋白固定化后,运行缓冲液改为100 mM醋酸钠、100 mM氯化钠、1 mM TCEP、0.05% Tween20 (v/v)、5% DMSO, pH值为6.0。
所有化合物处理都在ECHO 550声学液体分配器上进行,化合物被添加到384孔聚丙烯v底板(Greiner)中,该板成为SPR的样品板。KD每一种化合物取0.8µL,再加入79.2µL 4% DMSO运行缓冲液,即可得到6 - 8点浓度范围(25-500µM)。流速为30µL/min,样品进样时间为60 s,解离时间为60 s。样品注入之间表面没有再生。KD使用Biacore软件版本2 (Cytiva)中的1:1结合模型计算平衡条件下的Langmuir图值。
Ligand-observed核磁共振
我们开发了一种间接检测配体与BCL6结合的方法:室内合成氟化肽CF3.CO-WVIP-NH2(TFA-WVIP-NH2)作为观察到的配体中的报告探针19F-NMR41.每个180µL19F-NMR肽置换试验含有20 mM HEPES缓冲液pH为8,100 mM NaCl, 0.5 mM TCEP, 10% D2O, 200µM报告器TFA-WVIP-NH2,含或不含200µM化合物(4% D6-DMSO final)和6µM BCL6 BTB。每个180µL的样品反应在96孔板中制备,170µL转移到3mm核磁共振管中(Bruker, Part No. 1)。Z112272)使用吉尔森液体处理器GX-281。核磁共振数据在配备5毫米BBFO探头的Bruker AVANCEIII 500 MHz光谱仪上收集。数据采集和处理使用Bruker Topsin 2.1。复合物加入后报告核磁共振信号的恢复表明与TFA-WVIP-NH在同一位点竞争性结合2蛋白质上的四肽。我们量化了核磁共振信号在报告位移百分比中的恢复程度42:
用化合物观察到的每个报告位移都归一化到分别对应于TFA-WVIP-NH的DMSO高和低对照样品2肽信号中检测到6 μ M BCL6 BTB蛋白的存在和不存在。
各实验均以SMRT肽(氨基酸序列EGLVATVKEAGRSIHEIPR)为阳性对照,4-氯苯甲酸为阴性对照。
BCL6结晶
纯化的BCL6 BTB结构域(氨基酸序列5-129)在含有Ac-WVIP-NH的四肽存在下结晶2序列。在100% DMSO中加入100 mM的WVIP肽原液,加入2 mg/mL的纯化BCL6 BTB溶液,最终浓度为1 mM。然后使用分子量截断为10 KDa的离心浓缩器将混合物浓缩至最终蛋白浓度为4 mg/mL。在由2 μL BCL6-BTB/WVIP复合物和1 μL 1m K结晶液组成的悬液中,在18℃下生长晶体2HPO4, 0.7 M NaH2阿宝4, 75 mM醋酸钠缓冲液pH 4.5和2% (v/v) DMSO,与350 μL结晶液平衡。结晶一般在2天内生长,将相应化合物加入0.5 μL化合物浸泡结晶,在DMSO中溶解至最终浓度为10 - 200 mM,直接形成结晶滴,然后孵育10 - 120 min。晶体在结晶试剂中加入30% (v/v)乙二醇的溶液中冷冻保护,并在液氮中冷冻冷却。
纯化的Flag-TEV- bcl6 BTB 5-129结晶时不含四肽,因为该结构物的Flag-TEV标签取代了晶体包装中的WVIP肽。使用分离分子量为10 KDa的离心浓缩器将蛋白浓缩至最终蛋白浓度为10 mg/mL。在18°C下,在由1.5 μL的旗子- tev - bcl6 BTB配合物和1.5 μL由0.1 M Tris pH 7.5和0.80 M Na/K酒石酸盐组成的结晶液组成的悬滴中生长晶体,该结晶液与300 μL结晶液平衡。晶体通常在2天内生长,化合物按照另一种结构的描述浸泡。晶体在结晶试剂中加入30% (v/v)乙二醇的溶液中冷冻保护,并在液氮中冷冻冷却。
结晶学数据的收集、处理和改进
x射线数据收集于Rigaku FRX-AFC11-VariMax铜- vhf - pilatus300k(英国伦敦癌症研究所),钻石光源(英国牛津郡哈维尔校区)I03和I04-1光束线,以及ESRF(法国格勒诺布尔)ID30A-1光束线。从这两种BCL6结构物中生长出来的晶体都属于空间群p612和衍射到1.38和2.05之间的分辨率Å。数据集与XDS集成43或拨打44并与漫无目的合并45.用相位器进行分子置换来求解结构46,47采用公开可用的BCL6结构(PDB代码3BIM)9用除去配体和水分子作为搜索模型。所有蛋白质/配体结构都在COOT中人工校正和重建48与BUSTER一起精炼49在迭代循环中。用GRADE生成配体约束50和大亨51.用MOLPROBITY评价结构质量52,53.数据收集和细化统计在表中显示S2.
InCELL猎人™
BCL6细胞靶点接合测定使用discovery - eurofin公司的InCELL Hunter™靶点接合试剂盒。在实验中,表达的蛋白包括NBCL6 BTB结构域(HDSD51质粒构建编码氨基酸14-135)的-末端截断区域融合到aC-terminal ePL标签(增强的ProLabel, DiscoverX)。用Lipofectamine 3000 (ThermoFisher Scientific)和2.5 × 10转染HEK293T细胞24小时以上5转染的细胞/ well在无酚红的OptiMEM培养基(ThermoFisher Scientific)中被重新镀在384个检测板中,然后用化合物处理6小时。为了完成检测,按照制造商的说明,细胞在室温下用InCell Hunter检测试剂混合物孵育30分钟,然后在Envision (Perkin Elmer)平板阅读器上读取化学发光信号。
NanoBRET™
对于细胞NanoBRET检测(Promega UK Ltd, NanoBRET Nano-Glo检测系统,目录号N1662),编码全长BCL6和SMRT的DNA被插入到pFC32K NanoLuc和pFC14K HaloTag载体(Promega Ltd)中,以产生各自的C末端标记的融合蛋白BCL6-nanoLuc和SMRT-HaloTag。HEK293T细胞被镀(5 × 10548小时后用Fugene 6 (Promega目录编号E2691)试剂和18µg编码BCL6-nanoLuc供体和SMRT-HaloTag受体的总DNA质粒进行批量转染,供体:受体DNA比例为1:25。转染24小时后,收集HEK293T细胞,并将其保存在液氮中,分别置于90% (v/v) FBS (PAN Biotech UK)和10% (v/v) DMSO中。在检测时,化合物(100nL/孔)和NanoBRET 618配体(10nL,每孔1 mg/ml的原液)被分配在384孔NUNC白色检测板(ThermoScientific NUNC cat。#10080681)使用Echo550声学点胶(贝克曼库尔特)。将冷冻转染的HEK293T细胞解冻,离心,用无酚红的OptiMEM + 4% (v/v) FBS (ThermoFisher- Gibco optimi - mem™I Reduced Serum medium, No酚红)取代冷冻培养基。细胞密度调整为3 × 105细胞/ml和20µL细胞(约6000个细胞)分别镀于含有测试化合物(0.0125-50µM)的DMSO或DMSO单独和0.5µg/ml NanoBRET 618荧光配体的孔中,最终浓度为0.55% (v/v) DMSO。细胞在37°C/5% CO下孵育6 h2然后加入NanoBRET呋喃嗪底物(Promega Ltd)至最终浓度为10µM。在短暂离心后,在配备LUM/D600双镜、LUM 450 nm/40带通和D605 nm长通滤波器的Envision (Perkin Elmer)平板阅读器上读取平板,或在配备LUM模块610 nm- lp和450 nm/80带通的Pherastar FSX (BMG Labtech)平板阅读器上读取。通过将BRET受体:供体比例归一化到适当的高、低对照,计算每种测试浓度下的抑制率%。复合IC50使用Graphpad Prism 6.0或Dotmatics软件将归一化数据拟合到sigmoidal四参数logistic拟合方程中确定值。
南美大草原
采用平行人工膜渗透试验(PAMPA)测定被动扩散渗透率。该测定使用了含有2% (v/v)磷脂酰胆碱的十二烷人工膜(Sigma Aldrich, Dorset, UK)。供体板为MultiScreen- ip板,带有0.45 μ m疏水性Immobilon-P膜(Millipore,英国),受体板为MultiScreen 96孔传输接收板(Millipore,英国)。在30°C孵育16小时后,在含1% (w/v)牛血清白蛋白(Sigma Aldrich, Dorset, UK)的缓冲液中测量测试化合物(10µM)的渗透性,pH值为7.4。转移和离心后,样品上清液被稀释并使用Waters (Milford, MA, US) TQ-S LC-MS/MS系统进行分析。渗透率值(cm/s)由下式计算,其中VD和V一个分别为供体和受体的体积,面积为膜的表面积×孔隙率:
肽和化合物
未标记肽BCOR、SMRT和WVIP来自Pepceuticals Ltd;Alexa Fluor®结合的bor肽来自Cambridge Research Biochemicals。TFA-WVIP-NH2多肽购自法国Genecust。
筛查活动是在合并的HTS图书馆进行的,这些图书馆来自癌症研究所(ICR, Sutton)和治疗发现实验室(TDL, Cambridge)。
化合物的制备,除了下面以奥辛多尔为基础的化合物,已经在前面描述过14,15.
7-((1-甲基-2-oxoindolin-5-基)氨基)吡唑啉[1,5-a]嘧啶-5-羧酸酯(化合物)的制备25)
在氩气作用下,在5-氨基-1-甲基林-2- 1 (21 mg, 0.13 mmol)和7-氯吡唑啉[1,5-a]嘧啶-5-羧酸乙酯(29 mg, 0.129 mmol)的混合物中加入2-丙醇(1 mL),然后加入37%的HCl水溶液(3滴)。所得混合物在100°C搅拌24小时,然后冷却至rt,用乙酸乙酯(10 mL)稀释,减压浓缩。用闪柱层析(80-100%乙酸乙酯环己烷)纯化得到化合物25(15.9 mg, 0.044 mmol,收率33.6%)为黄色固体。HRMS (ESI + ve): m/z发现C为366.1549,期望为366.156119H20.N5O3.+[m + h]+.δH(500 MHz,, CDCl3.δ 8.17 (d,J= 2.4 Hz, 1H), 8.13 (s, 1H), 7.36 (dd,J= 8.3, 2.3赫兹,1 h), 7.33(年代,1 h), 6.96 - 6.90 (m, 2 h), 6.84 (d,J= 2.3 Hz, 1H), 5.36 - 5.24(七tet,J= 6.4赫兹,1 h), 3.63 (s, 2 h), 3.29(年代,3 h), 1.44 (d,J= 6.4 Hz, 6H)。
加入代码
BCL6 BTB结构域与WVIP肽或化合物配合物晶体结构的原子坐标和结构因子2,7,10,11,13,14,15,17,18,19,21而且22可分别使用PDB代码7ZWN, 7ZWO, 7ZWP, 7ZWQ, 7ZWR, 7ZWS, 7ZWT, 7ZWU, 7ZWV, 7ZWW, 7ZWX, 7ZWY和7ZWZ访问。作者将在文章发表时公布原子坐标和实验数据。
参考文献
黄春霞,黄春霞,梅尔nick, A. BCL6在生发中心B细胞发育中的作用机制。科学。中国人寿58, 1226 - 1232。https://doi.org/10.1007/s11427-015-4919-z(2015)。
Polo, J. M., Ci, W. M., Licht, J. D. & Melnick, A. CD40信号通路在正常和恶性B细胞中BCL6抑制复合物的可逆破坏。血112, 644 - 651。https://doi.org/10.1182/blood-2008-01-131813(2008)。
卡德纳斯,m.g.。et al。BCL6癌蛋白作为癌症治疗靶点的扩展作用。中国。癌症Res。23, 885 - 893。https://doi.org/10.1158/1078-0432.Ccr-16-2071(2017)。
拉纳科洛,s.m.。et al。Bcl-6通过dna损伤传感器ATR的转录抑制介导生发中心B细胞表型和淋巴瘤发生。Immunol Nat。8, 705 - 714。https://doi.org/10.1038/ni1478(2007)。
斋藤,M。et al。B细胞淋巴瘤中BCL6基因的改变阻断了生发中心B细胞中BCL6下调的信号通路。癌症细胞12, 280 - 292。https://doi.org/10.1016/j.ccr.2007.08.011(2007)。
b细胞淋巴瘤6与弥漫性大b细胞淋巴瘤的分子发病机制。咕咕叫。当今。内科杂志。15, 381 - 390。https://doi.org/10.1097/MOH.0b013e328302c7df(2008)。
parkh, S., Prive, G.和Melnick, A. BCL6癌基因靶向治疗弥漫性大b细胞淋巴瘤。Leuk。淋巴瘤49, 874 - 882。https://doi.org/10.1080/10428190801895345(2008)。
藤田,N。et al。MTA3和Mi-2/NuRD复合物在B淋巴细胞分化过程中调节细胞命运。细胞119, 75 - 86。https://doi.org/10.1016/j.cell.2004.09.014(2004)。
贫民窟,a。F。et al。BCL6 BTB结构域二聚体与bor辅抑制肽复合物的结构。摩尔。细胞29, 384 - 391。https://doi.org/10.1016/j.molcel.2007.12.026(2008)。
冈瑟,m.g.。et al。一种核心SMRT辅抑制复合体,包含HDAC3和TBL1,一种与耳聋相关的wd40重复蛋白。基因的开发。14, 1048-1057(2000)。
李俊伟。et al。辅助抑制蛋白SMRT和N-CoR都存在于含有HDAC3的大型蛋白复合物中。Embo。J。19, 4342 - 4350。https://doi.org/10.1093/emboj/19.16.4342(2000)。
Gearhart, m.d., Corcoran, c.m, Wamstad, J. a . & Bardwell, V. J. Polycomb组和SCF泛素连接酶在一种新的bor复合体中被发现,该复合体被招募到BCL6靶点。细胞生物学。26, 6880 - 6889。https://doi.org/10.1128/Mcb.00630-06(2006)。
波罗,j.m.。et al。特异性肽干扰揭示BCL6在b细胞淋巴瘤细胞中的转录和致癌机制。Nat,地中海。10, 1329 - 1335。https://doi.org/10.1038/nm1134(2004)。
贝伦尼,b.r.。et al。苯并咪唑酮衍生的Bcl6抑制剂。PCT帕特。应用。WO2018215801。(2018)。
贝伦尼,b.r.。et al。通过发现和优化苯并咪唑酮BCL6降解物,实现体内靶标消耗。医学。化学。63, 4047 - 4068。https://doi.org/10.1021/acs.jmedchem.9b02076(2020)。
卡德纳斯,m.g.。et al。合理设计BCL6抑制剂靶向活化的B细胞弥漫性大B细胞淋巴瘤。j .中国。投资126, 3351 - 3362。https://doi.org/10.1172/Jci85795(2016)。
瑟基耶蒂,l.c.。et al。BCL6的小分子抑制剂在体外和体内杀死DLBCL细胞。癌症细胞17, 400 - 411。https://doi.org/10.1016/j.ccr.2009.12.050(2010).
郑慧敏et al。通过基于nmr的片段筛选和计算机辅助药物设计鉴定b细胞淋巴瘤6 BTB结构域的硫脲类抑制剂医学。化学。61, 7573 - 7588。https://doi.org/10.1021/acs.jmedchem.8b00040(2018)。
郭伟凯,et al。n -苯基-4-嘧啶胺衍生物b细胞淋巴瘤6抑制剂的合成及生物学评价医学。化学。63, 676 - 695。https://doi.org/10.1021/acs.jmedchem.9b01618(2020)。
Kamada Y。et al。通过生物物理学驱动的基于片段的方法发现b细胞淋巴瘤6蛋白-蛋白相互作用抑制剂。医学。化学。60, 4358 - 4368。https://doi.org/10.1021/acs.jmedchem.7b00313(2017)。
克尔,N。et al。致癌转录因子BCL6的化学诱导降解。细胞的代表。20., 2860 - 2875。https://doi.org/10.1016/j.celrep.2017.08.081(2017)。
McCoull, W。et al。pyrazolo[1,5-a]嘧啶b细胞淋巴瘤6 (BCL6)结合物的发现及高亲和力大环抑制剂的优化医学。化学。60, 4386 - 4402。https://doi.org/10.1021/acs.jmedchem.7b00359(2017)。
Yasui, T。et al。利用基于结构的药物设计,发现了一种新型b细胞淋巴瘤6 (BCL6)-辅抑制因子相互作用抑制剂。Bioorgan。地中海,化学。25, 4876 - 4886。https://doi.org/10.1016/j.bmc.2017.07.037(2017)。
皮尔斯,a.c.。et al。GSK137是一种有效的小分子BCL6抑制剂,具有体内活性,可抑制小鼠的抗体反应。生物。化学。https://doi.org/10.1016/j.jbc.2021.100928(2021)。
Machleidt, T。et al。一种用于分析蛋白质-蛋白质相互作用的新型BRET平台。ACS化学。医学杂志。10, 1797 - 1804。https://doi.org/10.1021/acschembio.5b00143(2015)。
Turconi, S。et al。uHTS的实际应用经验:基于1536口井荧光各向异性的井级质量uHTS筛管原型及控制程序的应用j . Biomol。屏幕6, 275 - 290。https://doi.org/10.1177/108705710100600502(2001)。
Lo, m.c.。et al。基于荧光的热位移分析在药物发现中打击鉴定中的评价。肛交。物化学。332, 153 - 159。https://doi.org/10.1016/j.ab.2004.04.031(2004)。
一种利用高分辨率SPR表征复合目标相互作用改进二次筛选和先导优化的新策略。认识。18, 273 - 281。https://doi.org/10.1002/jmr.744(2005)。
Almeida, t.b., Panova, S. & Walser, R.核磁共振报告分析用于弱亲和受体-配体相互作用的量化。sla。26, 1020 - 1028。https://doi.org/10.1177/24725552211009782(2021)。
艾哈迈德,k.f.。et al。BCL6 BTB结构域招募SMRT辅阻遏因子的机制摩尔。细胞12, 1551 - 1564。https://doi.org/10.1016/s1097 - 2765 (03) 00454 - 4(2003)。
坂本,K。et al。高亲和bcl6结合肽的发现及其构效关系。物化学。Bioph。Commun >,482, 310 - 316。https://doi.org/10.1016/j.bbrc.2016.11.060(2017)。
埃文斯,s.e.。et al。安沙霉素抗生素利福霉素SV可抑制BCL6的转录抑制,并与BCL6- btb /POZ结构域形成复合物。Plos One。https://doi.org/10.1371/journal.pone.0090889(2014)。
McCoull, W。et al。新型b细胞淋巴瘤6 (BCL6) PROTAC的开发为BCL6的小分子靶向提供了见解。ACS化学。医学杂志。13, 3131 - 3141。https://doi.org/10.1021/acschembio.8b00698(2018)。
黄晓燕。荧光偏振竞争法:可溶解抑制剂效价的范围受荧光配体亲和力的限制。j . Biomol。屏幕8,品种马非常。https://doi.org/10.1177/1087057102239666(2003)。
麦克纳尔蒂,d。et al。一种高通量剂量反应细胞热位移试验,用于快速筛选活细胞中的药物靶点,例如使用SMYD3和IDO1。sla。23, 34-46。https://doi.org/10.1177/2472555217732014(2018)。
Schulze, J。et al。用于检测小分子抑制剂和BRD4之间相互作用的基于细胞的蛋白质稳定分析。j . Biomol。屏幕20., 180 - 189。https://doi.org/10.1177/1087057114552398(2015)。
卡尼斯坎,h.w.et al。蛋白精氨酸甲基转移酶3 (PRMT3)的一种有效的、选择性的和细胞活性的变构抑制剂。Angew。化学。Int。艾德,心血管病。54, 5166 - 5170。https://doi.org/10.1002/anie.201412154(2015)。
Auld, d.s., Davis, C. A, Jimenez, M, Knight, S. & Orme, J. P.用MEK1激酶抑制剂检测细胞中基于配体的蛋白质稳定性。试验药物。Dev,抛光工艺。13, 266 - 276。https://doi.org/10.1089/adt.2014.614(2015)。
Cho, E. J. & Dalby, K. N.基于发光能转移的化学生物学和药物发现筛选和靶标接合方法。sla。26, 984 - 994。https://doi.org/10.1177/24725552211036056(2021)。
戴维斯,O. A。et al。优化形状互补使有效的三环BCL6抑制剂的发现成为可能。医学。化学。65, 8169 - 8190。https://doi.org/10.1021/acs.jmedchem.1c02174(2022)。
陈,H., Viel, S., Ziarelli, F.和彭,L. F-19核磁共振:研究生物事件的宝贵工具。化学。Soc。牧师。42, 7971 - 7982。https://doi.org/10.1039/c3cs60129c(2013)。
梁毅强et al。2-羟戊二酸加氧酶抑制剂报告配体核磁共振筛选方法。医学。化学。56, 547 - 555。https://doi.org/10.1021/jm301583m(2013)。
Kabsch, W. XDS。Acta Crystallogr。D杂志。Crystallogr。66, 125 - 132。https://doi.org/10.1107/S0907444909047337(2010).
冬天,G。et al。DIALS:实现和评估一个新的集成包。Acta Crystallogr。D组结构。医学杂志。74, 85 - 97。https://doi.org/10.1107/S2059798317017235(2018)。
数据质量的缩放和评估。Acta Crystallogr。D组结构。医学杂志。62, 72 - 82。https://doi.org/10.1107/S0907444905036693(2006)。
麦考伊,a.j.。et al。相位晶体学软件。j:。Crystallogr。40, 658 - 674。https://doi.org/10.1107/S0021889807021206(2007)。
Winn, m.d。et al。CCP4套件和当前开发的概述。Acta Crystallogr。D组结构。医学杂志。67, 235 - 242。https://doi.org/10.1107/S0907444910045749(2011)。
埃姆斯利,P. &考坦,K.库特:分子图形模型构建工具。Acta Crystallogr。D杂志。Crystallogr。60, 2126 - 2132。https://doi.org/10.1107/S0907444904019158(2004)。
Bricogne G。et al。BUSTER,版本2.10.2。全球相位有限公司,剑桥,英国(2015)。
聪明,o.s。et al。等级,版本1.2.9。环球相位有限公司,剑桥,英国(2014)。
布鲁诺,i。J。et al。IsoStar:一个关于非键相互作用的信息库。j .第一版。援助。摩尔,Des。11, 525 - 537。https://doi.org/10.1023/A:1007934413448(1997)。
陈,V. B。et al。MolProbity:大分子结晶学的全原子结构验证。Acta Crystallogr。D组结构。医学杂志。66, 12-21。https://doi.org/10.1107/S0907444909042073(2010).
戴维斯,i。W。et al。MolProbity:蛋白质和核酸的全原子接触和结构验证。核酸测定。35, W375-W383。https://doi.org/10.1093/nar/gkm216(2007)。
确认
作者要感谢结构化学团队的Meirion Richards和Amin Mirza的专业知识和帮助。我们也感谢Stephen Hearnshaw博士和钻石光源和欧洲同步辐射设施的工作人员在数据收集期间的支持。
资金
这项工作得到了CRUK(资助号C309/A11566)、CRT先锋基金和Sixth Element Capital的支持,我们感谢他们的慷慨资助。
作者信息
作者及隶属关系
贡献
b.r.b., k.m j.c., l.d., p.i., h.w., o.a.d., m.g.l., A.V.和R.H.设计并进行了合成化学实验。M.G.R和N.Y.设计并进行了SPR实验。P.C.M.生产和纯化重组蛋白。O.A.P.和M.L.设计并进行了核磁共振实验。O.A.P.开展了HTS运动,R.B.分析了筛查数据。o.a.p., m.s., e.s., r.t., l.p., C.B.设计并执行生化和细胞活性测定。F.B.和M.C.在硅化学实验中设计和执行。D.G.和A.H.设计并执行了PAMPA实验。k.s., g.w.c., M.J.R, E.A.G.和y - v.l.b设计并进行了晶体学实验。F.I.R, s.w., O.W.R, s.h., r.b., y.v l.b.和R.L.M.v.M.设计实验并监督研究。 O.A.P., Y.-V.L.B., R.B. and R.L.M.v.M wrote the manuscript. Y.-V.L.B. made the Figures and Tables related to the protein X-ray crystallography experiments. All authors have given approval to the final version of the manuscript.
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Pierrat, O.A, Liu, M, Collie, G.W.et al。发现细胞活性BCL6抑制剂:有效地将生化HTS与多种生物物理技术、x射线晶体学和基于细胞的分析相结合。Sci代表12, 18633(2022)。https://doi.org/10.1038/s41598-022-23264-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-23264-z