摘要
骨髓增生异常综合征(MDS)是一组伴有骨髓造血细胞发育不良伴细胞减少的血液肿瘤。发现异常增生在MDS的诊断中很重要,但它需要相当多的时间和精力。此外,由于不典型增生的评估是主观的,难以量化,因此需要一种更有效的工具来进行骨髓抽吸涂片解释的质量控制和标准化。在这项研究中,我们开发并评估了一种算法,利用深度学习技术自动区分造血细胞谱系,并在骨髓抽吸涂片中检测异常发育细胞。我们从34例MDS患者和24例正常骨髓切片中获取骨髓抽吸图像。总共有8065个细胞被分为8类:正常红细胞、正常粒细胞、正常巨核细胞、发育不良的红细胞、发育不良的粒细胞、发育不良的巨核细胞、母细胞和其他。该算法对发育不良细胞的分类效果良好,AUC为0.945-0.996,准确率为0.912-0.993。本研究开发的算法可作为诊断MDS患者的辅助工具,有望为缩短MDS骨髓抽吸诊断时间和规范目视读数做出贡献。
简介
骨髓增生异常综合征(MDS)是一组伴有骨髓造血细胞发育不良伴细胞减少的血液肿瘤。MDS发育不良分为红细胞发育不良、颗粒发育不良和巨核细胞发育不良。发育不良的特征是细胞大小、成核、分割和造粒异常1,2,3..诊断MDS伴单系异常增生或MDS伴多系异常增生仅当异常增生满足每个谱系中10%或以上细胞的标准时才有可能。尽管异常增生的检测在MDS的诊断中起着关键作用4,它需要血液科医生花费大量的时间和精力来阅读。此外,由于不典型增生的评估是主观的,难以量化,因此需要一种更有效的工具来进行骨髓抽吸涂片解释的质量控制和标准化5.
最近,深度学习技术在各个医疗领域被用于提高诊断的准确性。利用人工智能(AI)对骨髓标本图像的研究主要集中在各种类型白血病母细胞的检测和正常骨髓细胞的分化6,7,8,9,10,11.对于骨髓抽吸标本,由于标本本身的局限性,包括可变载玻片、外周血稀释、干抽等,迄今为止尚未积极开展研究12.虽然MDS中的AI可以提高异常发育细胞的阅读和量化的准确性和速度,但该领域的研究仍然缺乏。
到目前为止,在对MDS使用深度学习的研究中,Mori等人使用卷积神经网络(CNN)方法分析了“颗粒减少”,颗粒生成中的一种发育不良。13.在另一项研究中,Kimura等人使用CNN开发了一种自动图像分析系统,可以在外周血中区分MDS和再生障碍性贫血(AA)14.在以往的研究中,仅针对与颗粒减少相关的发育不良作为研究对象。大多数研究使用外周血或活检,只有少数研究使用骨髓抽吸。由于以往的研究没有考虑作为诊断标准的骨髓抽吸涂片中的各种细胞类型,因此需要进一步的研究。在这项研究中,我们开发并评估了一种算法,该算法使用深度学习技术自动区分造血细胞谱系,并在MDS患者的骨髓抽吸涂片中检测异常发育细胞。
结果
人口学和临床特征
MDS患者与正常切片患者的特点见表1.MDS患者中位年龄为71.5岁,正常组中位年龄为66.5岁。两组患者的中位年龄和性别差异无统计学意义。其中,EB -2型MDS占12例(35.5%),MLD型MDS占11例(32.4%),EB-1型MDS占6例(17.6%)。MDS伴单系发育不良、环状铁母细胞- mld、治疗相关-MDS和MDS-不可分类患者分别为1例、2例、1例和1例。在细胞遗传学特征方面,15例(44.1%)患者核型正常,10例(29.4%)患者染色体增加和/或丢失,4例(11.8%)患者染色体模式复杂。在发育异常的特征方面,31例(91.2%)有造血功能障碍,15例(44.1%)有颗粒发育障碍,21例(61.8%)有巨核发育障碍(表2)2).在造血功能障碍的病例中,5例患者出现核萌芽,9例患者出现巨幼细胞改变,12例患者出现多核。在颗粒生成异常的情况下,分别有6例、10例和3例患者观察到颗粒减少、核分割不良和异常大。在巨核发育不良的病例中,13例患者观察到微巨核细胞,8例患者观察到核低发育,10例患者观察到多核发育。
骨髓抽吸玻片细胞的检测
用于评估的补丁图像总数为11000张。使用946个细胞对有核细胞进行手工标记。共有756个(80%)细胞被用作训练集,190个细胞(20%)被用于验证。使用U-net进行训练的Dice系数得分为74.7%,验证的Dice系数得分为71.1%。在相同的架构下,交叉优于联合的训练和验证性能分别为62.3%和58.0%。利用标记和分割结果,识别细胞的位置,并进行细胞特异性裁剪,获得555,052张细胞图像。我们将8065个细胞分为8种类型[正常红细胞(EN),正常粒细胞(GN),正常巨核细胞(MN),发育不良红细胞(ED),发育不良粒细胞(GD),发育不良巨核细胞(MD),母细胞和其他]。表中列出了数据集中每个分类单元的图像数量2.我们将8065个细胞随机分为训练集(80%)、验证集(10%)和测试集(10%)。
正常与发育不良骨髓细胞的鉴别性能
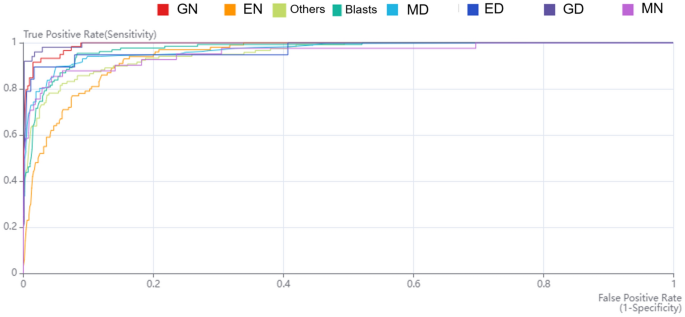
表格3.介绍本研究的表现,包括敏感性、特异性、准确性、阳性预测值(PPV)、阴性预测值(NPV)、受试者工作特征曲线下面积(AUC)、F1评分和8种细胞类型的平均精密度。GD的AUC为0.996,敏感性为90.0%,特异性为99.9%。ED和MD的敏感性分别为79.0%和89.9%。ED的特异性为99.2%,MD的特异性为94.8%。与发育异常的细胞相比,正常模式的细胞的敏感性和特异性降低。EN、GN和MN的敏感性分别为64.0%、79.7%和70.7%,敏感性分别为95.0%、99.3%和98.8%。数字1给出每种单元类型的接收器工作特性曲线。图中还显示了GN(0.993)、ED(0.972)、MD(0.971)、MN(0.955)和EN(0.945)的可靠结果3.,无花果。1).
真假分析
表中列出了标记细胞的混淆矩阵和细胞的预测4.在异常发育细胞中,该算法漏检的细胞比例最高的是同一谱系的正常细胞,其中24%的ED(24/100)被预测为EN, 9.2%的GD(12/130)被预测为GN, 5.3%的MD(1/19)被预测为MN。在ED患者中,9个(9%)细胞被错误预测为GD, 7个(5.4%)细胞被错误预测为GD。在MD病例中,ED、GD和其他病例中错误预测的细胞数量各为一个。正常细胞中,巨核细胞均被解读为巨核谱系细胞,5例(10.0%)MN被预测为MD。在粒细胞和红细胞的情况下,17例(5.9%)GN被错误预测为GD, 16例(13.4%)EN被错误预测为ED。补充图。1展示了使用深度学习(DL)算法正确检测和错误预测的细胞示例。
讨论
在本研究中,我们开发并验证了一种基于dl的MDS患者骨髓抽吸异常发育细胞分类算法。该算法在按照红细胞生成、颗粒生成和巨核细胞生成三种细胞系对异常发育细胞和正常细胞进行分类时表现出良好的性能。AUC总体表现为0.945 ~ 0.996。
由于样本本身的局限性,包括整个幻灯片的可变性,骨髓抽吸中自动细胞检测和分类的相关研究不容易应用于人工智能。此外,与其他领域相比,相关的人工智能研究还没有积极开展12.Mori等人分析了一种基于dl的发育不良评估,专门用于MDS患者发育不良特征之一的颗粒减少检测系统,并报告了AUC为0.944,准确性为97.2%13.本研究是首次利用骨髓涂片标本进行MDS细胞鉴别分析。我们的研究扩展了之前的研究,包括造血功能障碍、巨核功能障碍和颗粒功能障碍。此外,还包括了各种类型的异常粒级生成,如核低分割和GD以外的异常大尺寸,可以开发改进的算法。此外,与Mori等人的研究相似,GD在三种发育不良细胞系中表现最好。GD的敏感性、特异性、AUC、准确性、PPV、NPV和F1评分最高。在大多数患者的骨髓中,大部分有核细胞为粒细胞生成异常,在诊断MDS时比粒细胞生成异常更具特异性15.从这个角度来看,GD可以作为开发应用dl的MDS诊断算法的关键因素。
本研究特异性、AUC、准确率较高,敏感性、F1评分、AP值较低,未达到专家的阅读能力。本研究是一个多分类不平衡模型;因此,在性能评价工具中,定义为精密度和召回率值调和平均值的F1分数可能适合解释。在F1得分方面,本研究的表现在0.643 - 0.938之间。应用梯度加权类激活映射(Grad-CAM)热图生成技术来推断假阳性或阴性的几个原因16.该技术突出显示了CNN中骨髓核细胞的感兴趣区域,并可以聚焦图像中用于预测的重要区域,有助于算法的解释。通过Grad-CAM,我们发现ED以细胞核为中心的图像能够正确预测,这是检测dyserythropoesis的关键。Grad-CAM热图显示GD和MD被正确预测,在细胞核和细胞质中也被正确检测,因此适用于发育不良特征。相反,在ED被错误地预测为EN的情况下,细胞质而不是细胞核被聚焦。在ED的巨幼细胞改变的情况下,它很难阅读,因为它被预测为EN。颗粒减少的GD由于细胞质低颗粒,有时被解读为EN或ED,当低颗粒严重时,也被解读为其他。在GD的情况下,与伪pelger - huet异常形状和/或颗粒减少相比,核低分割显示难以与红系细胞分化。
尽管基于dl的异常发育细胞检测还没有表现出可以取代血液学家的性能,但它作为基于骨髓的诊断的辅助工具是重要的。到目前为止,大多数血细胞的鉴别研究都是在外周血或骨髓活检中进行的10,14,17,18.然而,近年来,一种正常骨髓细胞分化的算法被开发并发表,对发育不良的研究也开始了,为利用AI检测MDS提供了基础9,11,19.由于骨髓抽吸载玻片含有许多有核细胞,而且读取的区域很广,因此在引入DL的初级分类时,它有几个优点。例如,可以减少测试报告的周转时间并计算更多的细胞,从而提高计算有核细胞百分比的准确性。此外,不典型增生的诊断不再依靠专家的主观判断,而是可以通过AI实现更多的标准化。最近,一篇关于整张幻灯片图像检测的论文已经发表,预计DL阅读和数字图像的访问将会增加20..除了鉴定总体正常骨髓细胞外,还需要更多的研究来接近每种疾病的DL。MDS具有独特的细胞形态和性质4.有必要根据各种发育不良建立包含细胞图像和基因组数据的数据库,并开发一种新的疾病分类和预测预后的方法。在这项研究中,使用了常用的深度学习网络InceptionV3架构,并可能在未来的各种研究中进行扩展。这项研究的后续研究,如在每个患者的疾病水平上研究全自动诊断方法,以及应用于发育不良细胞的病理。
本研究的局限性是无法单独训练每个细胞系发育不良的详细形态表现。然而,可以推断,通过确保足够数量的正常细胞,有效的分化是可能的。如果今后根据其详细特征对发育不良进行分类,则有望取得更高的成绩。其次,每个类的单元格数量的比例不能统一。与其他世系相比,颗粒发生细胞数量相对较多;因此,有可能获得更好的性能。因此,在本研究的解释中,每个细胞的谱系性能应考虑数值差异来确定。最后,本研究仅分析了基于细胞的性能,还需要开发更多的疾病诊断性能以用于实际的临床应用。通过后续研究,我们打算开发一种算法,该算法将分析骨髓中所有有核细胞的每个谱系中发育不良细胞的百分比,并作为诊断MDS的有用工具。
在本研究中,我们开发了一种分类算法,可以区分MDS患者骨髓抽吸涂片中三种谱系的正常和发育不良细胞。本研究开发的算法可作为诊断MDS患者的辅助工具,有望为缩短MDS骨髓抽吸诊断时间和规范目视读数做出贡献。
方法
临床标本及全玻片扫描
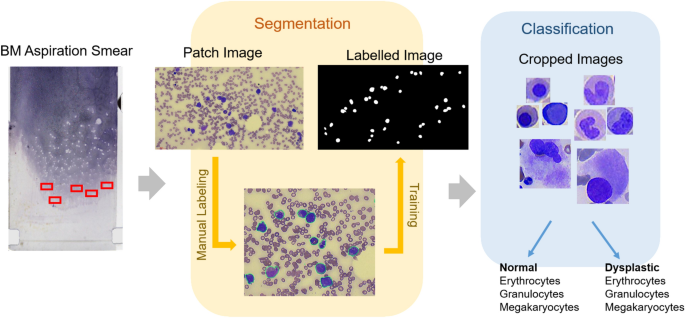
数据集准备和深度学习构建的流程如图所示。2.本研究根据《赫尔辛基宣言》的指导方针进行,并得到江南圣心医院机构审查委员会(IRB)的批准。HKS 2021-07-023),由于该研究的匿名性,该研究放弃了知情同意的需要。研究中使用的数据是公开的。根据WHO 2016年MDS诊断标准,采集34例MDS患者骨髓抽吸图像21,取24张正常骨髓玻片进行骨髓检查。正常骨髓来自于接受初始淋巴瘤常规分期的患者,没有恶性血液肿瘤和/或反应性骨髓的迹象。骨髓涂片用Wright-Giemsa染色。骨髓抽吸玻片全程扫描使用Motic Digital slide Assistant软件版本1.0.7.61 (Motic中国集团有限公司,厦门,中国)。
骨髓抽吸玻片中有核细胞的自动鉴定
包含有核细胞的理想细胞分布区域的图像被手动捕获为补丁图像。修补的映像总数为11,000个。对946个细胞进行人工标记有核细胞,并对修补图像的细胞检测算法进行分割(图。3.).这种分割任务,包括骨髓细胞的检测和描绘,是使用U-Net进行的。U-Net描绘了有核细胞的边界,并从背景微环境中分割出感兴趣的细胞区域。
基于CNN的细胞识别算法的开发
细胞分为8种类型(EN, GN, MN, ED, GD, MD,原细胞和其他)。正常和发育不良的细胞被分配到包括并合并MDS患者和正常骨髓标本的有核细胞。所有细胞图像均由两名分别具有6年和23年实验室医学经验的血液学家根据已发表的标准指南进行回顾性和独立审查。每个图像都由两名血液学家复查,他们之间的分歧通过共识解决。我们使用6453个细胞图像(80.0%)进行训练,806个细胞图像(10.0%)用于验证,806个图像(10.0%)用于测试。我们使用了DEEP:PHI(医疗人工智能软件:DEEPNOID,首尔,韩国)中的度量模块,这是一个帮助DL模型研究的开放平台。使用DEEP:PHI平台进行统计分析。我们使用著名的对象检测DL框架InceptionV3架构对骨髓细胞进行逐图像分类22.采用梯度cam技术对DL输出进行解释和评价16.采用自适应矩估计优化器进行超参数设置,学习率为0.0001。批大小为32,epoch数为200。
统计和数据分析
利用度量相似度的统计工具骰子系数评分来评价U-net的分割效果。评估细胞分类的AUC、敏感性、特异性、PPV、NPV、准确度、F1评分和平均精密度。曲线上的值表示绩效程度:无歧视(AUC < 0.5)、可接受(0.5≤AUC < 0.7)、优秀(0.7≤AUC < 0.9)、优秀(0.9≤AUC)23.
数据可用性
本研究中描述的所有相关数据库已存放在哈佛Dataverse网站上(Lee, Nuri, 2022,“骨髓增生异常综合征患者骨髓吸入细胞鉴别的深度学习应用数据集,”https://doi.org/10.7910/DVN/VIRPNT, Harvard Dataverse, V1)。本研究中使用的代码可在网上获得(https://github.com/Nurilee822/MDS_dysplastic_classification).
参考文献
Invernizzi, R., Quaglia, F. & Porta, m.g.经典形态学在骨髓增生异常综合征诊断中的重要性。Mediterr。j .内科杂志。感染。说。7, e2015035。https://doi.org/10.4084/mjhid.2015.035(2015)。
有关,我。et al。后基因组时代的骨髓增生异常综合征和精准医学的未来展望。癌症(巴塞尔)。https://doi.org/10.3390/cancers13133296(2021)。
骨髓增生异常综合征的诊断和预测。安。实验室。地中海。37, 465 - 474。https://doi.org/10.3343/alm.2017.37.6.465(2017)。
高危骨髓增生异常综合征诊断中的组织病理学。j .中国。Exp Hematopathol。JCEH58, 51-60。https://doi.org/10.3960/jslrt.18009(2018)。
高士根,j.e.。et al。髓系肿瘤巨核发育不良评估的质量控制措施:评估发育不良的困难。Leuk。Res。45, 75 - 81。https://doi.org/10.1016/j.leukres.2016.04.009(2016)。
拉赫曼,。et al。基于深度学习的急性淋巴细胞白血病分类。Microsc。研究技术。81, 1310 - 1317。https://doi.org/10.1002/jemt.23139(2018)。
Ahmed, N., Yigit, A., Isik, Z. & Alpkocak, A.使用卷积神经网络从显微图像中识别白血病亚型。诊断(瑞士巴塞尔)https://doi.org/10.3390/diagnostics9030104(2019)。
Pansombut, T, Wikaisuksakul, S, Khongkraphan, K. & Phon-On, A.用于淋巴细胞图像识别的卷积神经网络。第一版。智能。>。2019, 7519603。https://doi.org/10.1155/2019/7519603(2019)。
黄,F。et al。基于骨髓细胞形态结合卷积神经网络的AML、ALL和CML分类诊断:一项符合标准的诊断研究医学99, e23154。https://doi.org/10.1097/md.0000000000023154(2020)。
Sirinukunwattana, K。et al。基于人工智能的巨核细胞形态指纹:评估MPN患者疾病的新工具。血供订购。4, 3284 - 3294。https://doi.org/10.1182/bloodadvances.2020002230(2020)。
吴亦云。et al。用于评估骨髓涂片中单个核球形态的血液学家级深度学习算法(BMSNet):算法开发。JMIR医院,通知。8, e15963。https://doi.org/10.2196/15963(2020)。
以人工智能为驱动的恶性血液病病理评估。血癌发现。2, 195 - 197。https://doi.org/10.1158/2643-3230.bcd-21-0048(2021)。
森J。et al。基于卷积神经网络的骨髓涂片发育不良评估。科学。代表。10, 14734年。https://doi.org/10.1038/s41598-020-71752-x(2020)。
木村,K。et al。一种利用深度卷积神经网络的新型自动图像分析系统可以帮助区分MDS和AA。科学。代表。9, 13385年。https://doi.org/10.1038/s41598-019-49942-z(2019)。
高士根,j.e.。et al。骨髓增生异常综合征和其他髓系肿瘤诊断中的造血异常:问题领域。Br。j . Haematol。182, 526 - 533。https://doi.org/10.1111/bjh.15435(2018)。
赵娟,张敏,周志军,褚建军,曹峰。基于卷积神经网络的白细胞自动检测与分类。地中海,杂志。Eng。第一版。55, 1287 - 1301。https://doi.org/10.1007/s11517-016-1590-x(2017)。
Kutlu, H., Avci, E. & Özyurt, F.基于区域卷积神经网络的白细胞检测和分类。地中海。假设135, 109472年。https://doi.org/10.1016/j.mehy.2019.109472(2020)。
Brück, o.e。et al。骨髓组织病理学的机器学习确定MDS患者的遗传和临床决定因素。血癌发现。2, 238 - 249。https://doi.org/10.1158/2643-3230.BCD-20-0162(2021)。
金,H。et al。开发和初步验证骨髓涂片的自动细胞分类系统:试点研究。医学系统。44, 184年。https://doi.org/10.1007/s10916-020-01654-y(2020)。
王,C.-W。et al。全玻片图像骨髓细胞检测与分类的深度学习。医学影像肛门。75, 102270年。https://doi.org/10.1016/j.media.2021.102270(2022)。
阿伯,d。et al。2016年世界卫生组织对髓系肿瘤和急性白血病分类的修订。血127, 2391 - 2405。https://doi.org/10.1182/blood-2016-03-643544%JBlood(2016)。
塞格迪,C.,范豪克,V.,约菲,S.,史伦斯,J. & Wojna, Z. In .IEEE计算机视觉与模式识别会议论文集。2818 - 2826。
Kim J. & Hwang i.c.在准备手稿时绘制接受者工作特性曲线的指导方针。韩国医学科学。35, e171。https://doi.org/10.3346/jkms.2020.35.e171(2020)。
确认
我们感谢DEEPNOID公司提供的技术支持和帮助。
资金
本研究由大韩民国大韩血液学会(批准号:ICKSH-2021-03)的ICKSH研究项目资助。资助者在研究设计、数据收集和分析、发表决定或手稿准备中没有任何作用。
作者信息
作者及隶属关系
贡献
N.L, s.j., w.s., M.P.设计了这项研究。N.L., S.J.收集数据,进行数据分析并撰写手稿。N.L, M.J.标记图像,M.J, W.S提供了材料制备的思路。所有作者都审阅了手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
李N,郑S,朴,MJ。et al。骨髓增生异常综合征患者骨髓抽吸细胞鉴别的深度学习应用。Sci代表12, 18677(2022)。https://doi.org/10.1038/s41598-022-21887-w
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-022-21887-w