图片来源:奥利·温沃德
丹尼·本杰明的四个儿子(14岁至20岁)都参加了COVID-19疫苗的临床试验。其中两人是美国第一批接种疫苗的儿童。北卡罗来纳州达勒姆市杜克大学的儿科医生本杰明说:“他们对这样做非常兴奋。”“他们已经把照片发到自己的Instagram账户上了。”
但本杰明还担任国家儿童健康与人类发展研究所儿科试验网络的主席,他认为,在儿童身上测试COVID-19疫苗花了太长时间。他认为,所有针对儿童的临床试验都应该在2021年5月前完成,届时一些国家已经向成年人群注射了数百万剂疫苗。相反,在儿童身上的试验直到当年3月才开始,有些甚至还没有结束。他说:“如果我们在开发新冠疫苗的过程中保持道德和荣誉,我们就应该在5月份之前完成所有儿童的研究,而不是让孩子们再受苦一年。”

自然展望的一部分:儿童健康
儿科临床数据短缺不仅限于COVID-19。尽管近年来在儿童身上进行的试验数量有所增加,但缺乏数据仍然拖延了药物的儿科标签,并使医生几乎没有关于药物对儿童是否有效或安全的信息。
一个分析12008年瑞典医院的约1.1万份儿童处方中发现,近一半的药物未被标签标注,这意味着这些药物尚未被欧洲药品管理局(EMA)批准用于儿科。在样本中,年龄最小的儿童服用超说明书药物的比例最高。“我们没有更好的选择,”瑞典哥德堡大学的儿科临床药理学家Jenny Kindblom说。
加州洛杉矶Cedars-Sinai医院的儿科胃肠病学家大卫·齐林(David Ziring)说,这种方法的问题在于,儿童并不是小大人。“这些药物对儿童身体的作用非常不同,”他说。他说,如果没有试验来确定一种药物应该如何用于儿童,“我们就只能使用30至40年前就不那么有效的药物,或者试图使用最近批准的药物,并试图向保险公司证明,尽管这种药物没有美国食品和药物管理局(FDA)的儿科标签,但我们认为它是安全有效的。”
Ziring说,成人批准的药物通常需要至少七年的时间才能被批准用于儿童。多年来,他一直倡导加快批准药物用于儿科,但收效甚微。“我们进展甚微,”他说。“我所在的儿科专科社区已经变得非常沮丧。”
Ziring说,在很长一段时间里,制药公司几乎没有动力迫切地追求儿科标签。儿科试验通常比成人试验更慢、更昂贵,因为它更难招募参与者,道德标准更高,能赚的钱也更少。
但在2002年,美国国会通过了《儿童最佳药物法案》(Best Pharmaceuticals for Children Act)。根据该法案,自愿对美国食品和药物管理局(fda)确定为优先考虑的药物进行儿科试验的公司,将获得进一步的营销专有权,以此作为激励。同样,2007年,欧盟出台了旨在改善儿童药品获取、提高产品信息透明度和增加儿科研究数量的规定。
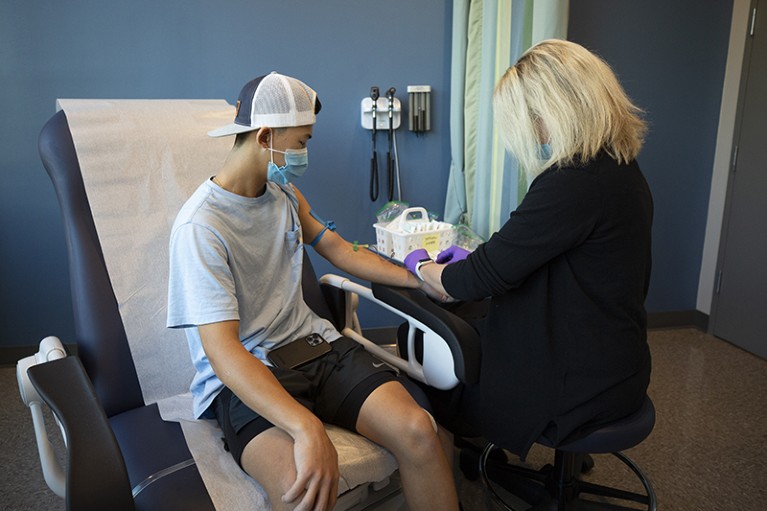
今年10月,丹尼·本杰明(Danny Benjamin)的儿子斯科特(Scotty)在北卡罗来纳州达勒姆的杜克健康公司(Duke Health)参加了辉瑞公司的COVID-19疫苗试验。图源:杜克健康摄影
虽然在儿童身上进行的临床试验仍然很少,但数据表明,这种试验正在增加。2021年的研究2发现在2008年至2010年期间,只有7000多个儿科试验在美国临床试验注册网站ClinicalTrials.gov上注册。但在2017年至2019年期间,这一数字已增加到1.17万左右。然而,这些试验大多是小规模的、单点的,没有得到美国国立卫生研究院或工业界的资助。Ziring认为,制药公司和FDA需要制定新的立法,以便尽早批准儿科药物。“儿科医生能做的只有这么多。”
但也有一些进步的迹象。2020年,湿疹药物dupilumab成为首个被批准用于6岁及以上儿童的生物药物,距离该药物获批用于成人仅3年。今年6月,这种由法国跨国制药公司赛诺菲和美国生物技术公司Regeneron共同研发的疗法被推广到6个月大的儿童身上。“不知怎的,他们能够最有效地招收一大批孩子,”齐林说。“向他们脱帽致敬。”他补充说,这一批准表明,早期儿科药物标签是可能的。“如果制药公司做出承诺,并与FDA密切合作,”他说,“这是非常可行的。”
成功的障碍
药品制造商缺乏在儿童身上试验治疗方法的动力,并不是儿科试验很少的唯一原因。即使对积极的研究人员来说,儿科试验的启动也是困难的。
首先,儿童试验更难获得伦理批准。澳大利亚悉尼大学的儿科专家Patrina Caldwell说,为了使一项试验被认为是道德的,儿童参与的风险必须不大于他们在日常生活中经历的风险。这导致一些公司将试验转移到低收入国家,那里的儿童被认为每天都面临更大的风险,因此标准被设定得更低。考德威尔说:“有时候,制药公司去发展中国家是为了跳过道德的桎梏。”但她认为,把贫困儿童的生命看得不那么有价值是不道德的。此外,她补充说,低收入国家的试验通常被认为审查不那么严格,实施不那么有力,因此结果可能不会被高收入国家的监管机构接受。
Caldwell说,儿童试验的更高道德标准意味着,即使是简单的测试和监测进展的程序也可能更加复杂。她说:“在成人试验中,你可以很容易地进行血液测试,但在儿科试验中,你必须证明你为什么需要这样做。”因为这种测试被认为对儿童更具侵入性和痛苦。
即使试验获得批准,也很难找到志愿者。儿童疾病比成人疾病更罕见,因此可供选择的人群更少。为了招募足够多的儿童,试验通常必须在几个地点同时进行。考德威尔说:“进行多中心研究是很复杂的,因为它涉及不同的监管体系、研究中心、不同的规章制度以及不同的政府。”“这本身就是一场噩梦。”
考德威尔说,提供金钱奖励来鼓励孩子参与试验是增加成人试验人数的一种常见方法,但在儿童试验中存在争议,因为在某些情况下,父母让孩子参加试验只是为了获得物质利益,这一过程很容易被滥用。在包括澳大利亚在内的许多国家,伦理委员会不允许付钱让儿童参加试验。
考德威尔说,另一个问题是,父母经常担心实验性药物可能产生的长期副作用。她回忆起父母问她:“如果有一天这种药物被证明会导致癌症,当他们60岁的时候他们得了癌症,他们会因为我年轻时让他们参与的一些事情而责怪我怎么办?”

更多信息来自《自然展望》
然而,考德威尔说,一旦她解释说,与成人试验不同,儿童试验通常没有安慰剂组,她通常就不难说服父母。相反,在儿童身上的试验通常使用所谓的临床平衡——测试两种治疗方法,以确定哪种更有效。考德威尔说:“为了在儿童身上进行道德试验,需要保持平衡。”她说,解释这一点传达了不确定性,同时给了父母做决定所需的自主权。当孩子患有危及生命的疾病时,父母会更放心,因为他们知道他们的孩子将接受至少一种可能有效的治疗,而不是安慰剂。
虽然研究总体上缺乏儿童参与者,但一旦能够参与的孩子的父母被说服,那么儿童的入学率确实会高于成人试验。考德威尔指出,白血病儿童的存活率已经显著上升3..成年人的健康结果远没有那么高。“这基本上表明了审判的力量,”她说。
更重要的是,研究表明,试验的参与者——无论他们在哪个研究部门——比那些没有参与任何试验的人有更好的健康结果4.这一概念被称为霍桑效应,它表明,当人们知道自己被监视时,他们的行为会有所不同,因此参与者比非参与者更有可能过上健康的生活方式。
进行试验的人需要仔细解释风险和好处,并且必须自己确定参与对个人来说是正确的。考德威尔说:“招募参加试验的人必须真正相信试验。
最终,她认为政府可能需要直接干预,为更多的儿科研究提供资金。“孩子们没有自己的研究数据,这是不公平的,因为如果不赚钱,人们就不会这么做。”

 促进儿童健康
促进儿童健康 儿童健康:研究要点
儿童健康:研究要点 疫苗接种率正在下降,人们拒绝接种的不仅仅是COVID-19疫苗
疫苗接种率正在下降,人们拒绝接种的不仅仅是COVID-19疫苗 社交媒体的使用对儿童来说并不总是一个问题
社交媒体的使用对儿童来说并不总是一个问题 世界上第一个疟疾疫苗的缓慢推出
世界上第一个疟疾疫苗的缓慢推出 car - t细胞疗法能给癌症儿童带来希望吗?
car - t细胞疗法能给癌症儿童带来希望吗? 如何帮助受战争创伤的儿童
如何帮助受战争创伤的儿童 照顾阿片类药物危机中的人们和他们的孩子
照顾阿片类药物危机中的人们和他们的孩子